一种基于声致穿孔的单细胞基因转染方法
文献发布时间:2023-06-19 11:03:41
技术领域
本发明属于基因转染技术领域,涉及一种基于声致穿孔的单细胞基因转染方法。
背景技术
单细胞的基因治疗在当今细胞学和生物医学领域占据着越来越重要的位置,如组织工程、基因工程和分子生物医学,尤其是癌症治疗的发展,都离不开靶向递送和基因转染。为了提高转染的有效性、安全性,研究者们开发了多种基因运载系统。例如,基于阳离子脂质体或靶细胞受体介导的基因转移,通过脂质体包裹或受体修饰使得基因药物能够与细胞结合,通过细胞内吞的方式摄取促进基因转染,但是由于DNA及载体在体内的清除和降解,生物膜屏障的阻隔等,影响内吞摄取效率,加之此类方法制备工艺复杂,化学载体物质本身的副作用,实际应用效果不明确。为了打开细胞膜屏障的阻隔作用,研究人员们探索了一些利用物理方法,如显微注射法、电穿孔法,利用玻璃针或电脉冲将DNA直接导入培养细胞,显微注射法针对单个细胞注射、技术和设备要求高,电脉冲法对活体插入电极、有痛有创操作,故这两种物理方法应用较为局限。
超声已广泛应用于临床疾病的诊断,具有经济、便携,操作安全、穿透性好等特点。研究发现,超声联合微泡的声空化效应,可造成细胞膜的可逆性穿孔,通过控制声空化剂量,细胞膜穿孔增加药物的渗透的同时,不影响细胞的活性。利用细胞膜一过性穿孔到膜修复这个时间窗口,基因转染药物通过穿孔处进入细胞内部,从而促进基因转染。目前认为,将声空化应用于单细胞水平的基因转染,在未来细胞治疗、精准医疗的发展中有望成为新型的运载工具。同时,超声无损地穿透皮肤聚焦于人体深部组织的特定部位,介导药物释放于特定部位,能够减少全身的副作用,在未来临床治疗中有着广阔的应用前景。基于声致穿孔的单细胞基因转染方法有望实现体外安全可靠的细胞基因转染,为后续细胞水平治疗的应用提供有效工具。
如中国专利ZL200510105551.5公开了一种声化学基因转染方法,其包括以下步骤:(1)确定目的基因和靶细胞,培养靶细胞或选择靶组织;(2)选择声敏剂;(3)将声敏剂和目的基因、靶细胞或靶组织放入一起,使声敏剂和目的基因通过吞噬作用以内吞体方式进入靶细胞或靶组织内的靶细胞,使声敏剂能选择性定位于靶细胞或靶组织细胞内的溶酶体;(4)用超声波照射靶细胞或靶组织,使定位于溶酶体内的声敏剂在超声波作用下发生声化学反应生成活性氧物质;(5)活性氧物质破坏溶酶体,使目的基因从溶酶体内逃逸,促进目的基因迅速向胞质内释放,提高其转染率及表达水平。该专利中,目的基因通过细胞内吞进入靶细胞的溶酶体内,由于细胞膜的屏障阻隔作用,进入的总量有限,且对细胞损伤无法控制,处理时间也比较长,安全性低等。
发明内容
本发明的目的就是为了提供一种基于声致穿孔的单细胞基因转染方法,解决现有技术中在单细胞水平上难以实现快速精准的靶向基因转染的问题,对生物环境无毒,生物安全性高,基于超声空化作用的基因转染方法有较好的临床应用前景。
本发明的目的可以通过以下技术方案来实现:
一种基于声致穿孔的单细胞基因转染方法,包括以下步骤:
(1)制备脂质体溶液,充入C
(2)确定靶细胞及基因转染试剂,加入细胞缓冲液稀释后的阳离子磷脂微泡共孵育,使得阳离子磷脂微泡贴合于靶细胞膜表面,之后加入混有基因转染试剂的细胞缓冲液;
(3)装载超声换能器,设定超声作用条件在安全范围内,确保靶细胞在超声换能器的有效超声作用范围内,发射单脉冲超声作用于阳离子磷脂微泡,发生声空化作用,促使靶细胞的细胞膜发生可逆性穿孔,使得基因转染试剂从穿孔处进入靶细胞内,完成转染。
进一步的,步骤(1)中,所述的脂质体溶液由三种磷脂DSPC、DSPE-PEG2000与DOTAP按照摩尔比18:1:1混合后,旋蒸制膜,再加入PBS溶液后,经过超声水合作用制备而成。
进一步的,步骤(1)中,细胞缓冲液为HBSS溶液。
进一步的,步骤(1)中,稀释后的阳离子磷脂微泡的体积浓度为0.6%。在此浓度下,还同时控制后续加入靶细胞后,阳离子磷脂微泡与靶细胞细胞的数量比例约为1-2:1。
进一步的,步骤(2)中,靶细胞与阳离子磷脂微泡共孵育的时间为15min。
进一步的,步骤(3)中,利用三维平移台装载超声换能器,确保超声换能器精准发射超声波至靶细胞。
进一步的,步骤(3)中,超声换能器还依次连接功率放大器和信号发生器,利用信号发生器设定超声作用条件为:主频1.5MHz,电压1Vpp,脉冲重复频率1Hz,占空比0.002%,超声作用时间13.33μs,经由功率放大器加载于超声换能器,施加于靶细胞区域。
进一步的,步骤(3)中,超声换能器发射超声脉冲的方向与水平面呈45°夹角。
进一步的,步骤(3)中,超声换能器表面与靶细胞的距离为8mm。
本发明采用三种磷脂DSPC、DSPE-PEG2000、DOTAP配方制备阳离子磷脂微泡,利用磷脂与细胞膜磷脂双分子层的亲脂相容性以及阳离子微泡与带负电的细胞膜的电荷吸引力,使得微泡贴合于细胞膜表面,微泡与细胞的比例约为1-2:1。超声换能器主频为1.5MHz,设定电压为1Vpp,脉冲重复频率1Hz,占空比0.002%,超声作用时间13.33μs,经由功率放大器加载于超声换能器,施加于靶细胞区域,在此条件下,靶细胞区域声场的声压约为0.7MPa。微泡在此声压下,发生瞬态空化,产生射流、冲击波作用于细胞膜表面,引发细胞膜发生可逆性、短暂的穿孔,细胞活性不受影响,基因转染试剂通过细胞膜穿孔处进入到细胞内,促进基因转染。这种基于声空化效应诱发细胞膜穿孔的声学操控基因转染的方法,简便灵活,能同时保持细胞活性,可有效提高基因转染效率。整个系统可以控制声空化剂量,在单细胞实现安全、可控性强的靶向基因转染。
与现有技术相比,本发明具有以下优点:
(1)基于声致穿孔的单细胞基因转染,通过超声介导微泡发生声空化,引发细胞膜穿孔,并能调节超声换能器精准作用于靶细胞,通过设定超声空化剂量,安全性高、适用性广。
(2)利用超声这一物理手段对基因转染试剂进行递送,无需使用脂质体、病毒等药物传输载体,降低了制备难度和包裹颗粒的毒性,提高了生物安全性和未来的实用性。
(3)基于声致穿孔的单细胞基因转染,能诱发细胞穿孔促进基因转染,在单细胞水平上递送速率快、靶向性好,为后续细胞内基因表达、基因治疗效果提供良好的细胞内环境基础。
(4)基于声空化的基因转染技术,可以应用于体外培养细胞水平,在细胞学研究、基因工程等领域上可作为有利的工具。同时,由于超声无损地穿透皮肤聚焦于人体组织的特定部位,也有着广阔的临床应用前景。
附图说明
图1为实施例1中自制阳离子微泡的20倍倒置显微镜图片;
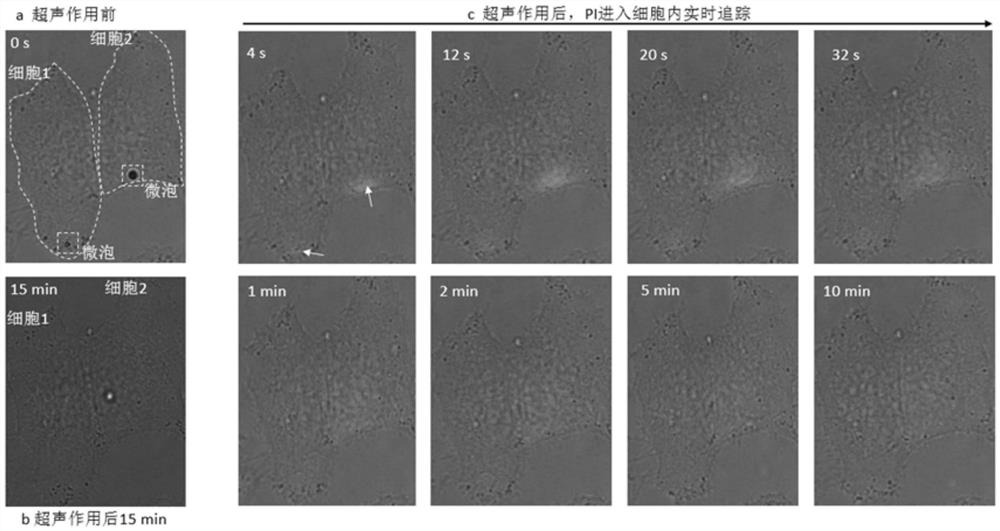
图2为实施例1中贴壁培养的人宫颈癌细胞(HeLa细胞),利用碘化丙啶(PI)模拟基因转染药物的转染前后图片;
图3为实施例1中目标视野中的细胞1、细胞2内模拟基因转染药物PI相对荧光强度变化率随时间的实时变化曲线;
图4为实施例2中贴壁培养的人宫颈癌细胞(HeLa细胞),利用碘化丙啶(PI)模拟基因转染药物的转染前后图片;
图5为实施例2中目标视野中的细胞3、细胞4内模拟基因转染药物PI相对荧光强度变化率随时间的实时变化曲线。
具体实施方式
下面结合附图和具体实施例对本发明进行详细说明。本实施例以本发明技术方案为前提进行实施,给出了详细的实施方式和具体的操作过程,但本发明的保护范围不限于下述的实施例。
以下实施例中,如无特别说明的原料试剂或处理技术,则表明其均为本领域的常规市售产品或常规处理技术。
实施例1:
本实施例提供一种基于声致穿孔的单细胞基因转染方法,具体步骤如下:
S1、HeLa细胞(CCL-2;ATCC,Manassas,VA,USA)培养在具有10%胎牛血清(Gibco10099;Invitrogen,Carlsbad,CA,USA)的DMEM(Hyclone,Thermo Scientific Waltham,MA,USA)培养基中,并置于温度为37℃,CO
S2、制备阳离子磷脂微泡:先将DSPC、DSPE-PEG2000、DOTAP(Li-poid,Ludwigshafen,Germany)三种磷脂按照摩尔比18:1:1混合后,旋蒸成膜,再加入PBS后,超声水合60min,制备得到脂质体溶液,取300μl,充入C
S3、将培养皿中的培养基移除,用HBSS溶液轻柔洗涤2次贴壁培养的HeLa细胞,将1ml稀释后的微泡溶液加入细胞培养皿中,将盖玻片置于细胞培养皿的凹槽中,培养皿倒置,微泡在浮力作用下漂浮于培养皿的底部,与贴壁培养的细胞相接触,在共孵育15min后微泡贴合于细胞膜表面,再将培养皿正置,取出盖玻片,此时,微泡与细胞的比例约为1-2:1。之后,培养皿中加入5ml碘化丙啶(PI)溶液(P3566;Invitrogen),,该溶液由PI溶于HBSS中配制,浓度为60μM,利用PI模拟基因转染药物。
S4、在孵育微泡期间,利用三维平移台,装载超声换能器,设置其发射角度为45°,超声换能器表面与HeLa细胞距离为8mm。利用信号发生器设定超声作用条件:主频1.5MHz,电压1Vpp,脉冲重复频率1Hz,占空比0.002%,超声作用时间为13.33μs,经由功率放大器加载于超声换能器。
S5、将细胞培养皿置于共聚焦显微镜的载物台上,确保超声换能器完全浸入培养皿的PI溶液中,选取微泡与细胞比例为1-2:1的目标视野,连接信号发生器、功率放大器、超声换能器,发射超声脉冲。
S6、设置共聚焦成像像素1024×1024,帧频3s,利用561nm及405nm波长的激发分别激发PI和Calcein Blue的荧光。在timelapse功能下设置10min连续实时记录PI在声致穿孔前后进入细胞及在细胞内分布的动态过程,模拟目的基因实时动态进入细胞全过程。连续拍摄10min后,再加入工作浓度为1μM的Calcein Blue溶液(C1429,Invitrogen),静置5min后,探测细胞内的蓝色荧光,胞质内呈蓝色荧光代表细胞存活。
S7、利用尼康NIS软件分析细胞内随时间变化进入PI的荧光强度,用以作后续定量分析。
图1为本实施例所制备的阳离子磷脂微泡的20倍倒置显微镜图片,从图中,可知其直径约为1-7μm。
图2为实施例1中贴壁培养的人宫颈癌细胞(HeLa细胞),利用碘化丙啶(PI)模拟基因转染药物,细胞膜穿孔后,PI通过穿孔处进入细胞内部,与核酸物质结合发出红色荧光,当细胞膜封闭后,PI不再进入细胞内。通过共聚焦成像系统实时探测PI从穿孔处进入到细胞内的全过程,之后探测Calcein Blue的蓝色荧光判断声致穿孔细胞的活性;其中,图a为目标视野下细胞1、细胞2,在发生声致穿孔前,细胞膜表面均有单个微泡贴合,细胞内无PI进入;图b为超声作用后15min,细胞1、细胞2胞质内显示Calcein Blue的蓝色荧光,表明2个细胞仍保持活性,细胞形态未发生明显变化;图c为声空化发生后,细胞膜发生穿孔,PI通过箭头所指微泡位置的穿孔处,进入2个细胞内动态扩散的实时过程。
图3为实施例1中目标视野中的细胞1、细胞2内模拟基因转染药物PI相对荧光强度变化率随时间的实时变化曲线,PI在细胞膜穿孔后进入细胞内,2个细胞内PI的荧光强度在穿孔后明显增加;在2min以内,细胞膜穿孔修复,PI不再进入细胞内部,2个细胞内PI荧光强度基本不再发生变化;细胞2内的PI荧光强度增加量高于细胞1,表明细胞2的穿孔程度大于细胞1,细胞2中进入模拟基因转染药物的总量高于细胞1。
实施例2:
本实施例与实施例1相同,采取相同靶细胞HeLa细胞及培养条件,具体步骤与实施例1一致,提供一种基于声致穿孔的单细胞基因转染方法。
图4为实施例2中贴壁培养的HeLa细胞,利用碘化丙啶(PI)模拟基因转染药物。通过共聚焦成像系统实时探测PI从穿孔处进入到细胞内的全过程,之后探测Calcein Blue的蓝色荧光判断声致穿孔细胞的活性;其中,图a为目标视野下细胞3、细胞4,超声作用前,细胞3表面无微泡贴合,细胞4表面有微泡贴合,在发生声致穿孔前,细胞内无PI进入;图b为超声作用后15min,细胞3、细胞4胞质内显示Calcein Blue的蓝色荧光,表明2个细胞仍保持活性,细胞形态未发生明显变化;图c为声空化发生后,细胞3未发生穿孔,无模拟基因药物PI进入,细胞4发生穿孔,PI通过箭头所指微泡位置的穿孔处,进入细胞内动态扩散的实时过程。
图5为实施例2中目标视野中的细胞3、细胞4内模拟基因转染药物PI相对荧光强度变化率随时间的实时变化曲线。细胞3未发生声致穿孔,模拟基因药物PI未进入,细胞3内的PI荧光强度在10min内未发生变化,细胞3未能进行基因转染;PI从微泡位置的细胞膜穿孔处进入,细胞4内PI的荧光强度在穿孔后明显增加,在2min以内,细胞膜穿孔修复,PI不再进入细胞内部,之后细胞4内的PI荧光强度基本不再发生变化。
本说明书中的具体实施例采用实施中相关的操作方式描述,各部分作具体说明的都是操作中相对重要之处。其余简单操作部分,描述未尽其详。
上述的对实施例的描述是为便于该技术领域的普通技术人员能理解和使用发明。熟悉本领域技术的人员显然可以容易地对这些实施例做出各种修改,并把在此说明的一般原理应用到其他实施例中而不必经过创造性的劳动。因此,本发明不限于上述实施例,本领域技术人员根据本发明的揭示,不脱离本发明范畴所做出的改进和修改都应该在本发明的保护范围之内。
- 一种基于声致穿孔的单细胞基因转染方法
- 同时对单细胞基因组和转录组构库及测序的方法基于单细胞整合基因组学的测序方法及应用
