一种肺癌基因突变位点的检测方法及其试剂盒
文献发布时间:2023-06-19 11:16:08
技术领域
本发明属于生物技术领域,具体涉及一种肺癌基因突变位点的检测方法及其试剂盒。
背景技术
传统的PCR技术手段容易产生非特异性扩增。为了避免非特异性扩增对结果信噪比和特异性的影响,目前PCR体系内扩增重数限制在10重以内。目前临床上需要检测的肿瘤突变位点有近千个,几乎以NGS平台为主。目前基于PCR的肿瘤基因检测产品由于扩增重数的限制,仅覆盖少量位点,而且需要在多个反应体系内(如艾德生物需使用12个反应体系)完成。多个反应体系内完成检测导致了对同一患者临床样本的稀释,最终降低了检测的灵敏度。
因此,有必要提供改进的技术方案以克服现有技术中存在的技术问题。
发明内容
为解决现有技术存在的问题,本发明提供一种肺癌基因突变位点的检测方法及试剂盒,采用数字PCR的技术手段,应用适应肺癌基因突变位点检测的缓冲液和引物,进行选定肺癌基因突变位点的检测。本发明独特的超多重数字PCR技术大幅提高了肿瘤基因检测的信息通量,可以在2个反应体系内扩增多达99重位点,避免了由于样本分管造成的灵敏度降低的问题,同时检测位点数的提升使检测的临床意义大幅提升。
本发明第一方面提供一种肺癌基因突变位点的检测方法,所述检测方法包括:
步骤一、制备得到数字PCR混合液;
其中,所述数字PCR混合液不包含三磷酸胞嘧啶脱氧核苷酸,所述数字PCR使用的引物包含三维结构,所述数字PCR使用的引物包含不少于十三个碱基的核酸序列N;所述数字PCR使用的引物包含如下核酸序列:GGGUUGGGAAGAAACUGUGGCACUUCGGUGCCAGCAACCC;
将所述数字PCR使用的引物进行预处理,所述预处理方法包括:将所述数字PCR使用的引物加入到缓冲液中加热至65~85℃,保温5~10分钟,然后冷却至0~40℃,保温20~30分钟;
步骤二、用数字PCR混合液制作PCR微反应单元,再进行PCR扩增反应,得到PCR扩增反应后的产物;
步骤三、对所述PCR扩增反应后的产物进行信号收集,根据荧光信号的类型判断待测样品中是否含有目标基因的位点突变的DNA模板及其数量和含量。通过上述技术方案,应用适应肺癌基因突变位点检测的引物设计,进行选定肺癌基因突变位点的检测。本发明独特的超多重数字PCR技术大幅提高了肿瘤基因检测的信息通量,可以在2个反应体系内扩增多达99重位点,避免了由于样本分管造成的灵敏度降低的问题,同时检测位点数的提升使检测的临床意义大幅提升。
优选地,在如前所述的检测方法中,所述缓冲液的组分为:300±5mM NaCl,4.5±1mM MgCl
优选地,在如前所述的检测方法中,所述核酸序列N只由碱基A、T和G组成。通过该技术方案,应用适应肺癌基因突变位点检测的缓冲液和引物设计,进行选定肺癌基因突变位点的检测。本发明独特的超多重数字PCR技术大幅提高了肿瘤基因检测的信息通量,可以在2个反应体系内扩增多达99重位点,避免了由于样本分管造成的灵敏度降低的问题,同时检测位点数的提升使检测的临床意义大幅提升。
优选地,在如前所述的检测方法中,步骤二所述数字PCR可在至少2个反应体系中扩增至少99重位点。通过该技术方案,应用适应肺癌基因突变位点检测的缓冲液和引物设计,进行选定肺癌基因突变位点的检测。本发明独特的超多重数字PCR技术大幅提高了肿瘤基因检测的信息通量,可以在2个反应体系内扩增多达99重位点,避免了由于样本分管造成的灵敏度降低的问题,同时检测位点数的提升使检测的临床意义大幅提升。
本发明第二方面提供一种肺癌基因突变位点的检测试剂盒,其特征在于,所述检测试剂盒通过数字PCR完成肺癌基因突变位点的检测,所述检测试剂盒使用的引物包含不少于十三个碱基的特殊核酸序列N,所述特殊核酸序列N只由碱基A、T和G组成。通过上述技术方案,应用适应肺癌基因突变位点检测的引物设计,进行选定肺癌基因突变位点的检测。本发明独特的超多重数字PCR技术大幅提高了肿瘤基因检测的信息通量,可以在2个反应体系内扩增多达99重位点,避免了由于样本分管造成的灵敏度降低的问题,同时检测位点数的提升使检测的临床意义大幅提升。
优选地,在如前所述的检测试剂盒中,所述检测试剂盒使用的反应液不包含三磷酸胞嘧啶脱氧核苷酸组分。通过该技术方案,应用适应肺癌基因突变位点检测的缓冲液和引物设计,进行选定肺癌基因突变位点的检测。本发明独特的超多重数字PCR技术大幅提高了肿瘤基因检测的信息通量,可以在2个反应体系内扩增多达99重位点,避免了由于样本分管造成的灵敏度降低的问题,同时检测位点数的提升使检测的临床意义大幅提升。
优选地,在如前所述的检测试剂盒中,所述检测试剂盒可在至少2个反应体系中使用至少99对引物,同时进行目标序列的检测。
本发明第三方面提供一种所述的检测方法在生物或医药领域的应用。
本发明第四方面提供一种所述的检测试剂盒在生物或医药领域的应用。
本发明创造的有益效果:
本发明提供一种肺癌基因突变位点的检测方法及试剂盒,采用数字PCR的技术手段,应用适应肺癌基因突变位点检测的缓冲液和引物,进行选定肺癌基因突变位点的检测,使用超多重数字PCR技术大幅提高了肿瘤基因检测的信息通量,可以在2个反应体系内扩增多达99重位点,避免了由于样本分管造成的灵敏度降低的问题,同时检测位点数的提升使检测的临床意义大幅提升。
附图说明
为了更清楚地说明本发明的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
图1为本发明检测的目标基因的突变位点;
图2为本发明检测的肺癌基因位点突变位点的聚类分析。
具体实施方式
下列实施例中未注明具体条件的实验方法,通常按照国家标准测定。若没有相应的国家标准,则按照通用的国际标准、常规条件、或按照制造厂商所建议的条件进行。
可对本发明提到的特征或实施例提到的特征进行组合。本说明书所揭示的所有特征可与任何组合物形式并用,说明书中所揭示的各个特征,可以任何可提供相同、均等或相似目的的替代性特征取代。因此除有特别说明,所揭示的特征仅为均等或相似特征的一般性例子。
在本发明中,如果没有特别的说明,本文所提到的所有技术特征以及优选特征可以相互组合形成新的技术方案。
在本发明中,如果没有特别的说明,本文所提到的一种肺癌基因突变位点的检测方法或检测试剂盒,包含SEQ ID NO.397所示序列、SEQ ID NO.398所示序列或SEQ IDNO.399所示序列。
为使本发明实现的技术手段、创作特征、达成目的与功效易于明白了解,下面结合具体实施方式,进一步阐述本发明,但本发明包括但不限于这些实施例。
实施例1.一种肺癌基因突变位点的检测方法及试剂盒
本实施例主要描述了一种肺癌基因突变位点的检测方法及试剂盒,其包括以下检测步骤:
入组病例:发明人对上海中山医院胸外科2017年1月至2017年12月就诊的肺部结节患者进行研究,根据胸部CT及血液肺癌肿瘤指标(包括EGFR、KRAS、BRAF、HER2、MET)检查结果,均无法确定其为肺癌还是肺良性疾病。所有患者均选择接受手术治疗,术前采外周静脉血10ml,根据肿瘤术后病理结果,将样本分为肺癌及肺良性疾病组(肺良性疾病包括炎性假瘤、硬化性血管瘤、肺结核球等)。
研究方法:应用dPCR技术研究两组样本外周血ctDNA突变情况,具体的操作步骤包括:
①从外周静脉血中分离血浆及白细胞;②Agilent的液相芯片对目标区域DNA进行高效富集、建库;③Illumina Hiseq平台上进行高通量、高深度测序;④数据处理、分析。
研究结果:在入组的肺癌病人中,约48.1%发现了EGFR、KRAS、BRAF、HER2、MET基因中的一种或几种突变。在所有检测到EGFR、KRAS、BRAF、HER2、MET基因突变的肺癌病人中,发明人通过卡方检验发现其与肺良性疾病患者有显著的统计学差异。
其中,对于肺癌病人,其EGFR、KRAS、BRAF、HER2、MET突变基因及突变位点,如图1所示,共计在2个反应体系中,通过数字PCR,和本实施例采用的特殊引物和缓冲液,可实现EGFR、KRAS、BRAF、HER2、MET等5个基因99个突变位点的检测。
研究结论:在肺癌患者的外周血ctDNA中发现EGFR、KRAS、BRAF、HER2、MET基因突变,突变基因包含图1所述突变位点。EGFR、KRAS、BRAF、HER2、MET基因的特定位点突变,可为肺癌患者的临床诊断和用药指导提供参考,对于影像学和肿瘤指标难以确诊的肺结节患者,提供更加合理有效的个体化指导。
在上述发现之前,发明人进行了实验可用的特异性引物和探针设计,引物及探针设计步骤:
1、首先在Ensemble数据库中确定包含EGFR、KRAS、BRAF、HER2、MET基因突变位点的cDNA序列;
2、通过BLAST确定该cDNA序列在DNA上所对应的外显子序列;
3、根据所得外显子序列,通过GenomeBrower确定所对应的完整DNA序列(包括外显子和内含子);
其中,EGFR、KRAS、BRAF、HER2、MET的突变位点、突变基因如图1所示;
4、按照引物和探针的设计原则,根据Cosmic数据公布的人类EGFR、KRAS、BRAF、HER2和MET野生型基因序列,以EGFR、KRAS、BRAF、HER2和MET的突变位点为基础,来设计特异性引物和探针,如表1和表2所示。突变型荧光探针5’端连接有荧光报告基团FAM;3’端连接有荧光淬灭基团BHQ1;野生型荧光探针5’端连接的荧光报告基团CY3;3’端连接有荧光淬灭基团BHQ2。荧光报告基团和淬灭基团还可以根据具体的平台进行合理选择。将设计好的引物的一端添加上核苷酸序列“GGGUUGGGAAGAAACUGUGGCACUUCGGUGCCAGCAACCC(SEQ IDNO.397)”,得到扩增用的初始核苷酸序列。
表1.反应管1中肺癌基因突变位点检测引物探针序列
以上是PCR反应管1中用的引物探针序列,以下是PCR反应管2中用的引物探针序列。
表2.反应管2中肺癌基因突变位点检测引物探针序列
将上述针对图1所示目标基因位点的引物和探针设计的扩增用的初始核苷酸序列,送到生工生物工程(上海)股份有限公司合成,合成后的核苷酸需进行预处理,预处理的方法为:将合成的核苷酸序列,加入到缓冲液B中加热至70℃,保温5分钟,然后冷却至30℃,保温25分钟,得到用于检测的核苷酸序列全长;其中,缓冲液B的组分为:300mM NaC1,5mMMgC1
其中,用于检测图1所示位点的上游引物、下游引物和用于检测图1所示位点的突变型荧光探针、野生型荧光探针,以引物探针混合液的形式存在,共同溶解于TE溶液中,制成引物探针混合溶液。上游引物、下游引物、突变型荧光探针、野生型荧光探针在引物探针混合液中的浓度均为10μM。引物探针混合液的配制方法为:将上游引物、下游引物、突变型荧光探针、野生型荧光探针四种成分的干粉分别用TE缓冲液稀释至100μM。
试剂盒还包括反应预混液、阳性质控品和阴性质控品。阳性质控品的制备方法为:图1所示每一基因突变位点野生型和突变型的序列各200bp,合成后,分别装入质粒载体pET-23d(+)(Promega)。使用Qubit 3.0进行定量,计算两种类型质粒的拷贝数浓度,根据拷贝数比例1:3000,1:2000,1:1000,1:500,1:200,1:100,1:50,1:10混合两种质粒,之后通过超声将质粒混合物打断为约180bp的片段,定量到20ng/μL,作为梯度阳性质控品。阴性质控品由上述含有野生型的质粒单独构成,然后采用同样方法打断为约180bp的片段,定量到20ng/μL,作为阴性质控品。
按照表3配制PCR反应体系,其中,PCR Mix购买自NEB,并加入终浓度0.1%的Triton-X-100,1U热稳定焦磷酸酶,5μg/μL的BSA,按照ddH
表3反应体系(总体积20μL)
其中,所述PCR Mix中,不包含三磷酸胞嘧啶脱氧核苷酸组分。
表4 PCR反应条件
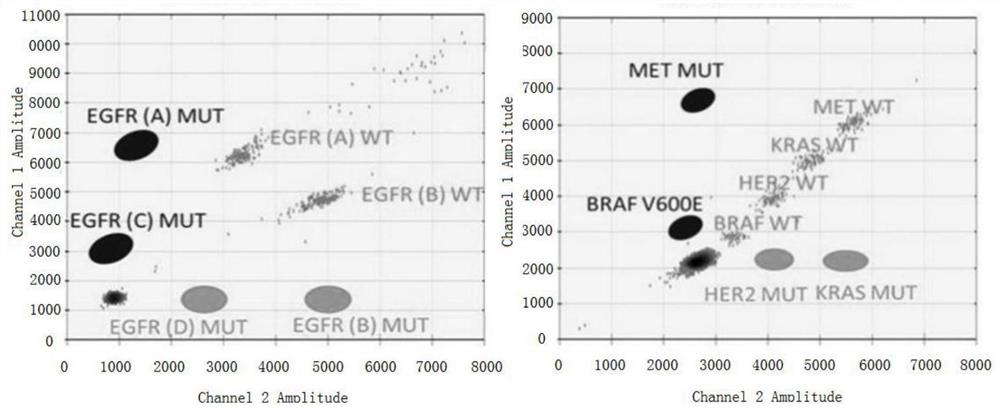
扩增结束后,通过电脑分析,对两个通道的有效荧光阳性点进行判读,并对结果进行分析,如图2所示,图2为临床样本检测结果图(即肺癌基因位点突变位点的聚类分析),纵坐标为FAM荧光通道,横坐标为HEX荧光通道。由实验结果分析可看出,通过聚类分析可以检测出共14个信号,对应图1所示全部99个基因位点。通过将突变信号(MUT)除以对应的野生型信号(WT),可以计算出目标基因群的突变丰度。试剂盒中一个基因群包含了一个或多个位点,这些位点的突变在临床中对应一临床意义和用药指导。
进一步地,将本实施例与现有方法学(NGS)结果的一致性比较结果发现,通过本实施例共完成143例临床血液样本检测(每例都做过NGS检测),其中与NGS结果一致的有133例,不一致的有10例,一致率为93%。
实施例2.一种肺癌基因突变位点的检测方法及试剂盒
本实施例主要描述了一种肺癌基因突变位点的检测方法及试剂盒,与实施例1的不同之处在于,对于表1和表2所示的引物连接核苷酸序列“GGGUUGGGAAGAAACUGUGGCACUUCGGUGCCAGCAACCC(SEQ ID NO.398)”,得到连接后的核苷酸序列,将连接后的核苷酸序列进行预处理,具体方法为:将连接后的核苷酸序列加入到缓冲液B1中加热至65℃,保温10分钟,然后冷却至0℃,保温20分钟,得到用于检测的核苷酸序列全长;其中,缓冲液B1的组分为:295mM NaC1,3.5mM MgC1
在数字PCR扩增结束后,通过电脑分析,对两个通道的有效荧光阳性点进行判读,并对结果进行分析。将本实施例与现有方法学(NGS)结果的一致性比较结果发现,通过本实施例共完成143例临床血液样本检测(每例都做过NGS检测),其中与NGS结果一致的有135例,不一致的有8例,一致率为94%。
实施例3.一种肺癌基因突变位点的检测方法及试剂盒
本实施例主要描述了一种肺癌基因突变位点的检测方法及试剂盒,与实施例1的不同之处在于,对于表1和表2所示的引物连接核苷酸序列“GGGUUGGGAAGAAACUGUGGCACUUCGGUGCCAGCAACCC(SEQ ID NO.399)”,得到连接后的核苷酸序列,将连接后的核苷酸序列进行预处理,具体方法为:将连接后的核苷酸序列加入到缓冲液B1中加热至85℃,保温5分钟,然后冷却至40℃,保温30分钟,得到用于检测的核苷酸序列全长;其中,缓冲液B1的组分为:305mM NaC1,5.5mM MgC1
在数字PCR扩增结束后,通过电脑分析,对两个通道的有效荧光阳性点进行判读,并对结果进行分析。将本实施例与现有方法学(NGS)结果的一致性比较结果发现,通过本实施例共完成143例临床血液样本检测(每例都做过NGS检测),其中与NGS结果一致的有140例,不一致的有3例,一致率为98%。本申请的发明人还对血清、血浆、外周血、胸腔积液、体液或者组织来源的DNA进行图1所示基因位点突变的检测,且重复性良好。通过本实施例所述检测方法及试剂盒,可实现对肺癌基因突变位点的灵敏检测,且无非特异性扩增,特异性好。可以添加多种引物进行检测,可以有效地节省反应过程中的底物。
以上显示和描述了本发明的基本原理和主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。本发明要求保护范围由所附的权利要求书及其等效物界定。
- 一种肺癌基因突变位点的检测方法及其试剂盒
- 肺癌突变位点的突变率的检测方法及试剂盒
