一种沼液微生物DNA的提取试剂盒及提取方法
文献发布时间:2023-06-19 11:16:08
技术领域
本发明属于生物技术领域,具体涉及一种从畜禽粪污沼液样品中提取微生物基因组DNA的试剂盒以及使用该试剂盒提取沼液微生物DNA的方法。
背景技术
沼液是畜禽养殖废弃物经厌氧发酵后的副产物,含有丰富的营养元素,易被作物吸收利用,是一种优质的有机肥料。然而现代养殖业中大量使用抗生素已成为一种习惯,大部分的抗生素未被动物吸收利用随粪便排出,以原形或代谢产物形式残留于沼液中,大量残留于沼液中的抗生素会诱导环境微生物产生抗性基因,造成抗性基因污染日益严重。鉴定沼液中抗生素抗性基因最常用的方法是分子生物学技术,从沼液中提取微生物基因组DNA是进行沼液分子生物学方面研究的先决条件。所提取DNA的产量和纯度直接影响到微生物基因组DNA信息的全面性和客观真实性,高质量的基因组DNA对于后续分子试验完成具有重要意义。
沼液微生物DNA提取的过程大致分成两个阶段:第一阶段通常是去除沼液悬浮物等杂质,常见的方法是纱布过滤方式(陈竞,苏艳,冯蕾,等.羊粪沼液微生物总DNA提取方法优化比较研究[J].新疆农业科学,2013,50(12):2280-2285.),使沼液从浑浊状成为澄清状;第二阶段则是采用不同DNA提取方法对过滤后的沼液进行微生物DNA提取。传统的微生物基因组DNA提取方法主要包括了十二烷基硫酸钠(SDS)法和十六烷基三甲基溴化铵(CTAB)法,目前对于沼液中微生物DNA的提取主要采取SDS结合酚氯仿抽提法。这些方法的缺陷在于步骤繁琐、耗时较长且都使用了苯酚/氯仿/异戊醇等有机试剂来去除蛋白等杂质,这些有机试剂刺激性气味较大,会对人体健康造成一定程度的危害。沼液中悬浮物等杂质的去除有利于沼液微生物的富集,可以提高微生物DNA得率,但文献所述方法中的纱布过滤方式对沼液中悬浮物的滤除效果较差,且无法确定对微生物是否存在拦截作用,难以保证能够最大限度保留沼液中的微生物,不利于后续微生物DNA提取。
因此,在传统的微生物基因组DNA提取方法上进行改进,寻找一种高效的沼液微生物DNA的提取方法,将对后续沼液分子生物学研究开展起到积极的促进作用,也是本发明重点解决的问题。
发明内容
有鉴于此,本发明的目的在于提供一种可用于沼液中微生物基因组DNA提取的试剂盒及提取方法,利用该试剂盒及方法获得的沼液微生物DNA纯度好,得率高,可以避免使用苯酚/氯仿/异戊醇等有机溶剂,不但适用于小规模制备,也适用于大规模生产。
为了实现上述发明目的,本发明提供了以下技术方案:
一种沼液微生物DNA的提取试剂盒,包括裂解缓冲液、副裂解缓冲液、杂质沉淀液、DNA结合液,其特征在于,所述裂解缓冲液包含50~100mmol/L Tris-HCl,50~100mmol/LNaCl,25~50mmol/L EDTA,1%~2%PVP 40,pH 7.0~8.0;所述副裂解缓冲液包含10%~20%SDS;所述杂质沉淀液包含2~2.5mol/LKAC,pH 5.0~6.0;所述DNA结合液包含5~6mol/L异硫氰酸胍和50~100mmol/L Tris-HCl,pH 5.5~6.5。
优选的是,所述提取试剂盒还包括漂洗缓冲液,所述漂洗缓冲液包含10~20mmol/L Tris-HCl,pH 7.0~8.0,80~100mmol/L NaCl,体积浓度70%~80%乙醇。
优选的是,所述提取试剂盒还包括DNA洗脱液,所述DNA洗脱液包含5~10mmol/LTris-HCl,pH 7.5~8.5。
本发明的另一目的在于提供一种沼液微生物DNA的提取方法,包括以下步骤:
利用细胞筛网对沼液进行过滤,富集沼液微生物,再使用上述提取试剂盒提取所述富集沼液微生物的基因组DNA。
优选的是,所述细胞筛网的孔径为100μm。
优选的是,所述使用提取试剂盒提取富集沼液微生物的基因组DNA,包括富集的沼液微生物依次经所述裂解缓冲液和所述副裂解缓冲液处理后离心,所得上清液与所述杂质沉淀液混合沉淀,离心得到的上清液与所述DNA结合液混合,将混合液加入DNA吸附柱中离心吸附,完毕后进行漂洗和洗脱得到沼液微生物DNA。
更优选的是,所述沼液微生物与所述裂解缓冲液混合后,加入RNaseA静置裂解,再加入所述副裂解缓冲液下温育裂解,离心得上清液。
更优选的是,所述杂质沉淀液与裂解离心上清液混合,冰浴沉淀。
更优选的是,所述DNA吸附柱用所述漂洗缓冲液漂洗,将所述DNA洗脱液预热后对漂洗后的DNA吸附柱进行洗脱,离心得到沼液微生物DNA。
更优选的是,所述沼液微生物DNA洗脱进行二次洗脱,将前次富集下来的洗脱液再次吸回到原吸附柱的滤膜中央,再次离心,使前次没有富集下来的DNA再次溶解在洗脱液里。
相对于现有技术,本发明具有如下有益效果:
(1)在沼液预处理步骤中,用细胞筛网取代了传统方法中的纱布过滤方式,筛选的细胞筛网孔径不仅有效去除了沼液悬浮物等杂质,同时又最大限度保留了其中的微生物,为后续微生物DNA高效提取奠定了基础。
(2)在微生物DNA提取过程中,不使用苯酚/氯仿/异戊醇等有毒溶剂,避免了有机溶剂对人体健康的危害;标准化了DNA提取步骤,避免了人员操作熟练程度对DNA提取结果的影响,大规模提取时更可节约操作时间。
(3)提取的沼液微生物DNA相较传统SDS方法,具有完整性好、纯度高和得率优的特点,在满足后续分子生物学下游实验需求时具有更广泛的适用性。
附图说明
图1:沼液中可培养微生物数量分析结果图;
图2:从沼液中提取微生物DNA的琼脂糖凝胶电泳图;
图3:从沼液中提取微生物DNA的PCR产物琼脂糖凝胶电泳图。
具体实施方式
本发明提供了一种沼液微生物DNA的提取试剂盒及提取方法。
本发明沼液微生物DNA的提取试剂盒包括裂解缓冲液、副裂解缓冲液、杂质沉淀液和DNA结合液。优选还包括漂洗缓冲液和DNA洗脱液。
本发明裂解液包含50~100mmol/L Tris-HCl,50~100mmol/L NaCl,25~50mmol/L EDTA,1%~2%PVP 40,pH 7.0~8.0;优选60~80mmol/L Tris-HCl,60~80mmol/LNaCl,30~40mmol/L EDTA,1%~2%PVP 40,pH 7.0~8.0。裂解缓冲液中加入的少量金属离子螯合剂EDTA有利于对DNA酶活性的抑制,防止基因组DNA的生物降解;加入的PVP 40可与多酚形成复杂聚合体,与多糖结合,有效去除了多酚、多糖等杂质;加入的Tris-HCl(pH7.0~8.0)提供一个细胞裂解的缓冲环境,防止DNA被破坏;加入的NaCl提供一个高盐环境。
本发明副裂解缓冲液包含10%~20%SDS;优选12%~18%SDS。副裂解缓冲液中SDS可溶解细胞膜,裂解细胞,使蛋白质变性并降解蛋白质。
本发明杂质沉淀液包含2~2.5mol/L KAC,pH 5.0~6.0;优选2.2~2.4mol/LKAC,pH 5.0~6.0。杂质沉淀液中高盐的KAC能与变性的蛋白复合物作用,转变为溶解度更小的钾盐形式的复合物,使蛋白沉淀更加完全。
本发明DNA结合液包含5~6mol/L异硫氰酸胍和50~100mmol/L Tris-HCl,pH 5.5~6.5;优选5.2~5.8mol/L异硫氰酸胍和60~80mmol/L Tris-HCl,pH 5.5~6.5。DNA结合液中异硫氰酸胍为一种高离液盐,提供了一个高盐低pH的环境,使DNA与硅基质膜特异结合,而蛋白等杂质不能吸附。
本发明漂洗缓冲液包含10~20mmol/L Tris-HCl,pH 7.0~8.0,80~100mmol/LNaCl,体积浓度70%~80%乙醇;优选12~18mmol/L Tris-HCl,pH 7.0~8.0,85~95mmol/L NaCl,体积浓度75%~80%乙醇。漂洗缓冲液主要为70%~80%低盐乙醇溶液,可以将高盐离子、细胞代谢物和蛋白等杂质通过漂洗快速去除。
本发明DNA洗脱液包含5~10mmol/L Tris-HCl,pH 7.5~8.5;优选6~8mmol/LTris-HCl,pH 7.5~8.5。DNA洗脱液提供了一个低盐高pH的环境,使DNA与硅基质膜分离,从而被洗脱下来。
利用本发明提取试剂盒来提取沼液微生物DNA,包括以下步骤:
沼液中悬浮物的粒径分布较广,如不进行预处理,在微生物基因组DNA提取时,极易引起DNA得率低下。本发明先将沼液通过细胞筛网过滤,以截留沼液悬浮物等杂质,最大程度地降低了悬浮物等杂质的干扰,保证了沼液微生物DNA的纯度。优选孔径为100μm,150目的细胞筛网可以最大限度地保留沼液中的微生物,保证了沼液微生物DNA信息的全面性。
从沼液组织中提取微生物DNA,首先通过离心富集沼液微生物,在经裂解缓冲液处理后分散成单个细胞,在副裂解缓冲液SDS及较高温度作用下,破碎细胞膜及核膜,使内部的DNA释放到裂解液中,然后除去与DNA结合的组蛋白和非组蛋白,最后加入洗脱液富集微生物DNA。
在细胞筛网预处理沼液后,通过离心对沼液微生物进行富集。优选富集转速为10000~14000r/min。若离心转速低于10000r/min,沼液中的微生物收率低下;若离心转速高于14000r/min,沼液中的微生物可能会有少许损失。更优选的是,将预处理后的沼液放入离心管中,在10000~14000r/min条件下离心5~10min,弃上清液,沉淀即为沼液中的微生物。
得到富集沼液微生物后,利用裂解缓冲液和副裂解缓冲液对沼液微生物进行裂解。优选沼液微生物与裂解缓冲液混合后,加入RNaseA静置裂解,再加入副裂解缓冲液下温育裂解,离心得上清液。进一步优选的是,所述RNaseA浓度为8~20mg/mL,更优选的是10mg/mL。在沼液微生物中加入裂解缓冲液和RNaseA后,室温静置进行裂解,所述静置时间优选的为3~8min,更优选为5min;静置后加入副裂解缓冲液进行温育,所述温育裂解温度优选的为65~75℃,更优选的为70℃,温育时间优选的为5~15min,更优选的为10min。温育后离心得上清液,所述离心转速优选为10000~12000r/min,离心时间优选为5~10min。
在沼液微生物裂解后,需要进一步对沼液微生物蛋白等杂质进行去除,得到含有微生物基因组DNA的提取液。优选杂质沉淀液与裂解离心上清液混合,冰浴沉淀,离心得上清液。进一步优选冰浴时间为8~12min,更优选10min,期间轻柔混匀5~6次。
本发明得到含有微生物基因组DNA的提取液后,进行沼液中微生物DNA的结合。取微生物基因组DNA提取上清液,加入DNA结合液,混匀后室温放置进行结合。优选所述上清液与所述DNA结合液的体积比为1:0.4~0.6,更优选为1:0.5。所述结合的时间优选为10-15min,更优选10min。
本发明对沼液中微生物DNA进行吸附,优选采用离心柱法。通过离心柱法,除掉样本所有残留的杂质,使微生物基因组DNA吸附在硅胶膜表面。作为一种可选的实施方式,将微生物DNA结合混合液转移到DNA硅胶膜吸附柱上,离心,弃去过滤液,再次加入混合液离心,直至所有混合液离心完毕,将微生物基因组DNA吸附到硅胶膜上。进一步优选的是,离心条件为10000r/min离心1min。
吸附完成后对DNA吸附柱进行清洗。优选向DNA吸附柱中加入所述漂洗缓冲液离心,弃去管内收集液;优选可多次进行漂洗。优选漂洗离心条件为10000r/min离心1min。
漂洗完成后进行一次空管离心。优选10000r/min离心0.5min,室温放置3~5min。
最后,进行沼液微生物DNA洗脱。将漂洗完成后的DNA吸附柱用DNA洗脱液进行洗脱,所述DNA洗脱液的预热温度为65~75℃,更优选为70℃;加入DNA洗脱液的体积优选为50~100μL,更优选为50~60μL。DNA洗脱液在DNA吸附柱的膜中央室温放置2~5min再进行离心,收集到的液体即为沼液微生物DNA。本发明优选离心条件为10000r/min离心1min。洗脱液体积控制在50~100μL并预热到上述温度,可有效提高DNA的洗脱效率,保证得到最大产量,若洗脱液体积低于50μL,洗脱效率低下且不稳定。更优选的是,可进行DNA的二次富集洗脱,即将前次富集下来的洗脱液再次吸回到原吸附柱的滤膜中央,再次离心,使前次没有富集下来的DNA再次溶解在洗脱液里,从而提高DNA的产量。
下面结合实施例对本发明提供的技术方案进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
实施例1
不同孔径细胞筛网预处理对沼液微生物富集的影响
以畜禽粪污新鲜沼液为对象,探讨沼液预处理不同滤材对微生物富集的影响。以未经过滤的原始沼液为对照组,以经75μm、100μm和150μm(分别对应200目、150目和100目)不同孔径大小的细胞筛网滤出的沼液为试验组,取50μL上述不同处理的滤液,均匀的涂抹在培养基表面,于37℃培养箱中倒置培养24~48h计数,每个处理重复3次。
通过比较用不同孔径大小的细胞筛网过滤前后的可培养微生物数量,结果如图1所示(CK:原沼液;B1:孔径为75μm细胞筛网过滤后的沼液;B2:孔径为100μm细胞筛网过滤后的沼液;B3:孔径为150μm细胞筛网过滤后的沼液;图中不同小写字母表示处理间在0.05水平下差异显著),发现用孔径为75μm的细胞筛网过滤,虽然滤液透明清澈,但可培养微生物的回收率仅为63%,可见其对细菌有明显的拦截作用,不宜作为沼液预处理用滤材。采用孔径为100μm的细胞筛网过滤,滤液前后的可培养微生物数量基本一致,回收率可达98%,证明其对微生物基本无拦截作用;采用孔径为150μm的细胞筛网过滤,滤液浑浊不清澈,不能很好的去除沼液中的悬浮物,可培养微生物的回收率虽可达95%,但易干扰后续微生物DNA的提取,也不宜作为沼液预处理用滤材;因此,通过孔径为100μm的细胞筛网处理不仅可以有效去除沼液中的大部分悬浮物等杂质,同时能够最大限度保留其中的微生物,滤液能够满足后续微生物DNA提取的需求。
实施例2
一种沼液微生物DNA提取方法
以实施例1经孔径为100μm细胞筛网处理的滤液为对象,提取沼液微生物DNA,具体包括如下步骤:
步骤1:取10mL经100μm细胞筛网处理后的沼液,放入1.5mL灭菌的离心管中,在12000r/min条件下离心10min,弃上清液,富集下来的沉淀即为沼液中的微生物。
步骤2:取沉淀,加入裂解缓冲液A(50mmol/L Tris-HCl,50mmol/L NaCl,30mmol/LEDTA,1%PVP40,pH 7.5)500μL悬浮沉淀,加入10μL 10mg/mL RNaseA,室温静置5min。
步骤3:加入副裂解缓冲液B(10%SDS)100μL,充分混匀,70℃温育10min,10000~12000r/min,离心5min。
步骤4:取上清液,加入杂质沉淀液C(2mol/L KAC,pH 5.5)200μL,期间轻柔混匀5~6次,冰浴10min,10 000r/min,离心10min,上清液即为含有微生物基因组DNA的提取液。
步骤5:取上清液,加入0.5倍体积的DNA结合液D(含5mol/L异硫氰酸胍和50mmol/LTris-HCl,pH 6.0),上下轻柔颠倒混匀,室温放置10min。
步骤6:将步骤5中的混合液转移到DNA硅胶吸附柱中,10 000r/min离心1min,弃去收集管中的液体,再次加入混合液离心,直至所有混合液离心完毕。
步骤7:向DNA吸附柱中加入漂洗缓冲液E(含10mmol/L Tris-HCl,pH 7.5,80mmol/L NaCl,体积浓度70%乙醇)700μL,10000r/min离心1min,弃去收集管中的液体;再次加入漂洗缓冲液E 500μL重复漂洗1次。
步骤8:弃去收集管中的液体,将DNA吸附柱重新放入离心管中,空管10000r/min离心0.5min,室温放置3~5min。
步骤9:将DNA吸附柱转移到新的1.5mL离心管中,加入70℃预热的DNA洗脱液F(10mmol/L Tris-HCl,pH 7.5)50μL于DNA吸附柱的膜中央,室温放置3min,10000r/min离心1min,即得到沼液微生物DNA样品。
实施例3
一种沼液微生物DNA提取方法
以实施例1孔径为100μm细胞筛网处理的滤液为对象,提取沼液微生物DNA,具体包括如下步骤:
步骤1:取10mL经100μm细胞筛网处理后的沼液,放入1.5mL灭菌的离心管中,在10000r/min条件下离心10min,弃上清液,富集下来的沉淀即为沼液中的微生物。
步骤2:取沉淀,加入裂解缓冲液A(100mmol/L Tris-HCl,100mmol/L NaCl,50mmol/L EDTA,2%PVP40,pH 8.0)500μL悬浮沉淀,加入10μL 10mg/mL RNaseA,室温静置5min。
步骤3:加入副裂解缓冲液B(20%SDS)100μL,充分混匀,70℃温育10min,10000~12000r/min,离心5min。
步骤4:取上清液,加入杂质沉淀液C(2.5mol/LKAC,pH 5.5)200μL,期间轻柔混匀5~6次,冰浴10min,10000r/min,离心10min,上清液即为含有微生物基因组DNA的提取液。
步骤5:取上清液,加入0.5倍体积的DNA结合液D(含6mol/L异硫氰酸胍和80mmol/LTris-HCl,pH 6.4),上下轻柔颠倒混匀,室温放置10min。
步骤6:将步骤5中的混合液转移到DNA硅胶吸附柱中,10 000r/min离心1min,弃去收集管中的液体,再次加入混合液离心,直至所有混合液离心完毕。
步骤7:向DNA吸附柱中加入漂洗缓冲液E(含20mmol/L Tris-HCl,pH 8.0,100mmol/L NaCl,体积浓度80%乙醇)700μL,10 000r/min离心1min,弃去收集管中的液体;再次加入漂洗缓冲液E 500μL重复漂洗1次。
步骤8:弃去收集管中的液体,将DNA吸附柱重新放入离心管中,空管10000r/min离心0.5min,室温放置3~5min。
步骤9:将DNA吸附柱转移到新的1.5mL离心管中,加入70℃预热的DNA洗脱液F(10mmol/L Tris-HCl,pH 8.0)50μL于DNA吸附柱的膜中央,室温放置3min,10 000r/min离心1min,即得到沼液微生物DNA样品。
实施例4
一种沼液微生物DNA提取方法-传统SDS法
以实施例1经孔径为100μm细胞筛网处理的滤液为对象,提取沼液微生物DNA,具体包括如下步骤:
步骤1:取10mL经100μm细胞筛网处理后的沼液,放入1.5mL灭菌的离心管中,在12000r/min条件下离心10min,弃上清液,富集下来的沉淀即为沼液中的微生物。
步骤2:取沉淀,加入800μL的TE缓冲液(10mmol/L Tris-HCl,1mmol/L EDTA,pH8.0),用移液枪吹打重悬。
步骤3:加入30μL 10%的SDS和3μL 20mg/mL的蛋白酶K,充分混匀,于37℃温育1h。
步骤4:加入100μL 5mol/L NaCl,充分混匀,再加入80μL CTAB/NaCl溶液,混匀,于65℃温育10min。
步骤5:在10 000r/min条件下离心5min,取上清液,加入等体积的氯仿/异戊醇(24:1),混匀,10 000r/min离心5min,将上清液转入一个新管中。
步骤6:加入等体积的酚/氯仿/异戊醇(25:24:1),混匀,10 000r/min离心5min,将上清液转入一个新管中。
步骤7:加入0.6倍体积的异丙醇,混合,室温放置30min,
步骤8:10 000r/min离心弃上清,加入1mL 70%乙醇洗涤2次。
步骤9:沉淀稍晾干,加入50μL含10mg/L RNaseA的TE缓冲液,于37℃保温30min,-20℃保存备用。
实施例5
不同DNA提取方法对沼液微生物DNA提取效果的影响
(1)DNA样品完整性检测:将实施例2~实施例4提取得到的沼液微生物DNA用1%琼脂糖凝胶电泳分析,上样缓冲液为6×Loading Buffer,电泳缓冲液为0.5×TAE,分子量标准Marker为Lambda DNA/Hind III,经EB染色,在紫外凝胶成像系统中拍照记录提取DNA的完整性,结果如图2所示(泳道1:实施例4传统SDS法提取得到的微生物DNA条带;泳道M:Lambda DNA/Hind III Marker;泳道2:实施例2试剂盒提取得到的微生物DNA条带;泳道3:实施例3试剂盒提取得到的微生物DNA条带),从图2可以看出,本发明试剂盒方法和传统SDS法均可有效提取沼液样品中的微生物DNA,但两者的DNA片段长度存在差异,本发明试剂盒方法提取的DNA亮度更高,片段更加完整,泳道背景更干净,无拖尾弥散现象。
(2)DNA质量浓度和纯度分析:进一步使用微量紫外分光光度计,将实施例2~实施例4提取得到的沼液微生物DNA产物进行定量分析,分别测定DNA溶液的OD
对于DNA的纯度一般要求OD
由表1可知,传统SDS法得到的DNA样品OD
表1不同方法提取的沼液微生物DNA浓度和纯度检测结果
注:表中同列不同小写字母表示在0.05水平下差异显著。
实施例6
不同DNA提取方法下DNA提取效果PCR检测结果分析
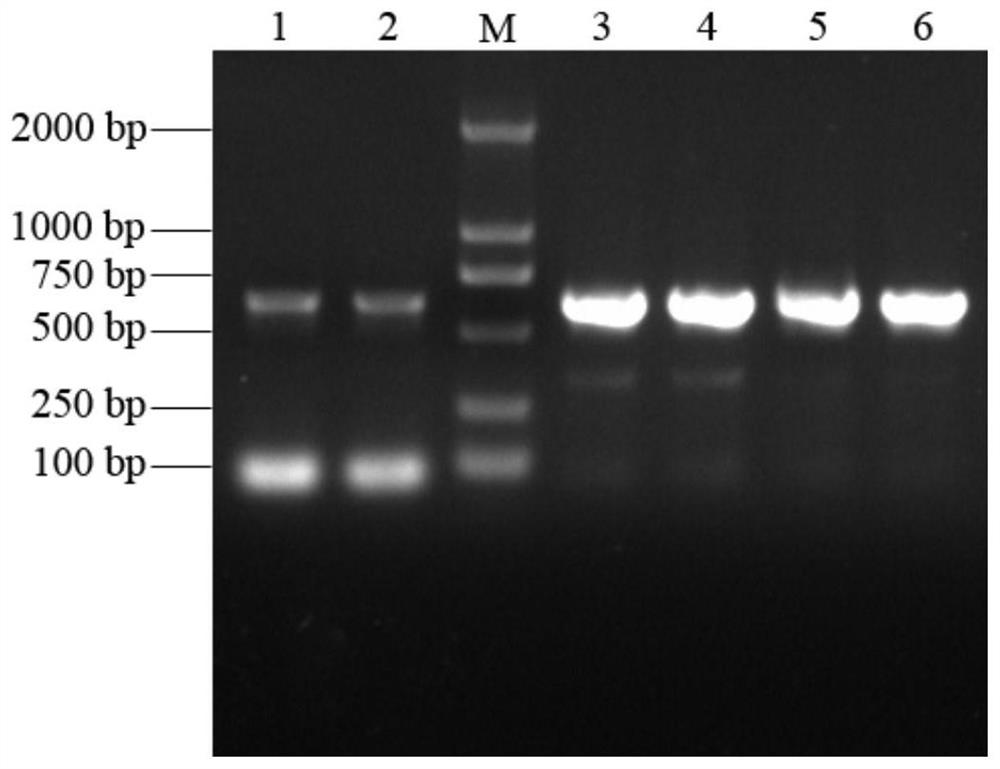
将实施例2~实施例4提取得到的沼液微生物DNA样品进行PCR扩增,采用引物16SF和16SR扩增细菌16S rDNA基因的部分片段,进一步检测所提取沼液样品基因组DNA的纯度,电泳结果如图3所示(泳道1~2:实施例4传统SDS法提取得到的沼液微生物DNA的PCR扩增产物;泳道M:DL 2000 DNA marker;泳道3~4:实施例2试剂盒方法提取得到的沼液微生物DNA的PCR扩增产物;泳道5~6:实施例3试剂盒方法提取得到的沼液微生物DNA的PCR扩增产物)。
其中,PCR扩增引物序列参见表2。
表2 PCR扩增引物序列
PCR扩增体系与扩增程序参见表3、表4。
表3 PCR扩增体系
表4 PCR扩增程序
结果显示,不同方法提取得到的沼液微生物DNA样品中均扩增出16S rDNA基因,且扩增片段位于DL 2000 DNA Marker的500bp和750bp之间,与引物设计的622bp目的扩增片段大小相符,但两者的条带亮度却存在明显差异。采用本发明试剂盒方法提取的DNA扩增出的条带更清晰、更明亮,而传统SDS法提取的DNA扩增出的条带亮度明显较暗,这可能是传统SDS法提取的DNA纯度相对较低,存在蛋白、酚类等抑制PCR扩增反应的成分,会影响PCR扩增效率,最终导致PCR产物量的降低。
因此,本发明试剂盒方法与传统SDS法相比,可以从沼液样品中提取到更高质量的微生物DNA,所获得的基因组DNA纯度更高、完整性更好,而传统SDS法除用到了有毒的苯酚/氯仿/异戊醇,提取步骤繁琐耗时,所获得的基因组DNA质量也达不到本发明试剂盒方法的有益效果。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 一种沼液微生物DNA的提取试剂盒及提取方法
- 水牛奶中微生物总DNA提取试剂盒及其提取方法和应用
