一种核酸提取用裂解结合液及其试剂盒和应用
文献发布时间:2023-06-19 11:16:08
技术领域
本发明属于生物技术领域,涉及一种核酸提取用裂解结合液,还涉及到应用该裂解结合液制备的核酸提取的试剂盒。
背景技术
核酸提取在核酸分子检测领域是极其关键的一步。自1869年Miescher首次成功发现并分离出DNA,以及1957年Meselson M等首次采用密度梯度离心法分离DNA以来,报道了多种核酸提取方法,许多研究者在核酸的提取方法上进行了不懈的探索,对核酸的各种材料和试剂进行了改进,十二烷基磺酸钠、酚、脲和胍盐等各种试剂纷纷被应用到核酸提取实验中,各种用于核酸提取的商品化试剂盒也应运而生。其中,传统的提取方法主要有:酚抽提法、碱裂解法、CTAB抽提法和EtBr-CsCl梯度离心法。这些传统提取方法可从不同组织样本中分离出DNA和RNA,但这些技术中包含沉淀和离心等操作步骤,其所需的生物样本量较大,且提取的步骤较为繁杂、费时费力,得率也不高,难以实现自动化操作,另外,大部分的传统方法中还需要用到有毒化学试剂,对操作人员的健康具有潜在危害,因此,伴随着分子生物学以及高分子材料学的发展,从液相系统中分离核酸的传统技术逐渐被以固相载体为基础的新方法所取代,目前常见固相材料有硅胶、玻璃颗粒、硅藻土、阴离子交换载体等。但这些固相法通常需采取数次快速离心、真空抽滤等步骤来实现分离,而且对于样本需求量大,耗费样品较多,不便于高通量、自动化操作,严重限制了在临床基因诊断领域的应用。
随着分子生物学技术的发展,为满足高通量处理样本和获得高质量核酸的实验要求,核酸提取分离技术也更趋向于简便快捷、高质量、高纯度和高通量发展,核酸质量的好坏直接决定了后续实验的成败。近年来分子诊断技术快速发展,随着基因测序等技术的成熟,成本进一步降低,在临床上的应用也越来越普遍。分子诊断检测的样本类型多达数十种,而处理后产物适用的检测项目也涵盖了荧光定量PCR、基因测序、基因芯片、生物质谱等各类分子生物学技术平台。然而,无论是哪一类检测项目,准确的检验结果无疑依赖于高质量的标本及标本前处理过程。因此临床分子诊断自动化趋势将逐步在国内临床实验室成为主导,而自动化首先将在目前手工操作较普及且对结果影响最大的核酸提取上实现。
采用磁珠提取法,核酸提取率和提取纯度主要受提取液的影响,如裂解液、结合液、洗涤液和洗脱液等,若提取样品的量和纯度不太高,不但不能有效的检出,甚至影响检测结果,甚至不能完全满足后续的实验要求。在为申请号201110124322.3一种增强的磁珠法核酸提取方法中也对传统的磁珠法核酸提取进行了改进,因当前的磁珠法核酸提取方法有两方面不足:首先是RNA的提取效率较低,其次是核酸提取步骤繁多,裂解与结合分为两步,磁珠在裂解完成之后才能加入溶液中结合核酸,不利于全自动化应用。该发明将样本的核酸裂解与核酸磁珠结合一步完成,游离的RNA在裂解液中高浓度盐和异丙醇作用下吸附到磁珠表面,最后通过磁力作用使离心管内磁珠紧贴于离心管壁,吸弃离心管内溶液,从而达到裂解和结合的目的。该发明在于核酸提取仅需4个步骤,分别是裂解与结合、清洗1、清洗2、洗脱,而前3个步骤都是通过加入异丙醇增强了溶液中磁珠吸附核酸的作用,从而增强了磁珠法核酸提取的效率,其裂解结合时,生物样品、异丙醇与裂解液的体积比为1:1:2。并且在应用于RNA提取时提供了一种高效提取RNA的方法。使得裂解与结合一步完成,在应用于自动化核酸提取时每一步骤的反应试剂可以预先灌装入该步骤对应的反应舱内,使该发明更适用于全自动化应用。但是异丙醇对眼、呼吸道的黏膜有刺激作用,能损伤视网膜及视神经,挥发性吸入时给人带来恶心难受感觉。其毒性、麻醉性以及对上呼吸道黏膜的刺激都比乙醇强。接触高浓度蒸气出现头痛、倦睡以及眼、鼻、喉刺激症状。食入或吸入大量的蒸汽可引起面红、头疼、精神抑郁、恶心、昏迷等。
发明内容
有鉴于此,本发明的目的在于提供一种简单有效的细菌核酸提取用裂解结合液,还提供包含该裂解结合液的细菌核酸提取试剂盒。
为达到上述目的,本发明提供如下技术方案:
1.一种核酸提取用裂解结合液,所述裂解结合液由以下物质组成:盐酸胍,EDTA,tritonX-100,Tris-HCl,NP-40,CTAB,水。
进一步,所述裂解结合液由以下物质组成:3-6M盐酸胍,5-20mM EDTA,1-20%TritonX-100,0.1-1M Tris-HCl,0.5-2%NP-40,0.1-0.5%CTAB,余量为水。
进一步,所述裂解结合液由以下物质组成:4M盐酸胍,5mM EDTA,10%TritonX-100,0.7M Tris-HCl,1%NP-40,0.1%CTAB,余量为水。
进一步,所述裂解结合液还包括3%-8%磁珠。
进一步,所述裂解结合液pH值6.0-6.5。
2.任意项上述的核酸提取用裂解结合液在制备核酸提取的试剂或试剂盒中的应用。
3.含有任意项上述的核酸提取用裂解结合液的核酸提取试剂盒,所述核酸提取试剂盒包括蛋白酶K溶液、裂解结合液、洗涤缓冲液和洗脱缓冲液。
进一步,所述蛋白酶K溶液浓度为10-30mg/ml。
进一步,洗涤缓冲液包括洗涤缓冲液1和洗涤缓冲液2,洗涤缓冲液1由以下组分组成:0.5-2M盐酸胍,10mM Tris-HCl,0.1-1M NaCl,pH值6.0-6.5,30-60%乙醇溶液;洗涤缓冲液2为70-85%乙醇水溶液。
进一步,洗脱缓冲液由以下组分组成:1-5mM EDTA,5-20mM Tris-HCl,pH值7.0-10。
4.使用上述任意项核酸提取试剂盒提取核酸的提取方法,具体步骤如下:
1)在生物样品中加入裂解结合液,再加入蛋白酶K,在70-95℃裂解5-15min,生物样品释放出核酸,在裂解结合液下与磁珠结合,在外部磁场作用下,磁珠聚集,形成磁珠-核酸复合物,收集磁珠-核酸复合物;
2)向磁珠-核酸复合物中加入洗涤缓冲液,洗涤去除磁珠-核酸复合物上的杂质,在外部磁场作用下,收集洗涤后的磁珠-核酸复合物;
3)向洗涤后的磁珠-核酸复合物中加入洗脱缓冲液,65℃-85℃洗脱3-8min可将结合在磁珠上的核酸洗脱下来,即得到提取的核酸。
进一步,所述蛋白酶K溶液浓度为10-30mg/ml。
进一步,洗涤缓冲液包括洗涤缓冲液1和洗涤缓冲液2,洗涤缓冲液1由以下组分组成:0.5-2M盐酸胍,10mM Tris-HCl,0.1-1M NaCl,pH值6.0-6.5,30-60%乙醇溶液;洗涤缓冲液2为70-85%乙醇水溶液。
进一步,洗脱缓冲液由以下组分组成:1-5mM EDTA,5-20mM Tris-HCl,pH值7.0-10。
进一步,所述生物样品包括组织、细胞、血浆、血清、体液、拭子、病毒培养液或粪便。
本发明的有益效果在于:本发明提供的裂解结合液可以将传统的磁珠法核酸提取的先裂解后节后的步骤有机的结合在一起,无需单独的结合步骤,可进行边裂解边吸附,减少了操作步骤。并且可以保证所提取的核酸纯度好,浓度高。且裂解结合液中所用组分摒弃了传统磁珠法核酸提取中所用的有机溶剂如异丙醇进行结合吸附,保障所提取的核酸样品中不存在对酶有抑制作用的有机溶剂。通常样本裂解时需要加热裂解,这更加速了有机溶剂的挥发性,对操作人员的健康危害大,且加入有机类试剂不能常温下长时间保存。本发明中不含有机溶剂,给核酸提取用户避免吸入异丙醇机会,增加良好的实验体验感。通过研究裂解液的裂解性实验,调整各试剂的配比,经过发明人的大量实验改进,获得了高效提取核酸的裂解液配方。
应用本发明提供的裂解结合液制备的细菌核酸提取试剂盒提取核酸时,全部核酸提取过程仅需3个步骤,完成特定核酸提取时间短,克服了现有磁珠法核酸提取方法步骤繁多的缺点;裂解与结合步骤一步完成,减少了操作步骤,该方法更适用于全自动化核酸提取应用;加大样本处理量和样本处理速率,快速高通量提取出生物样品中的核酸,这在临床应用时尤其能发挥技术优势和效能,减轻临床工作人员单调枯燥乏味的反复操作步骤。细菌核酸提取试剂盒成本低,核酸提取方法简单,提取的核酸完成纯度高,可以直接进行PCR等分子生物学实验研究及临床检测。
附图说明
为了使本发明的目的、技术方案和有益效果更加清楚,本发明提供如下附图进行说明:
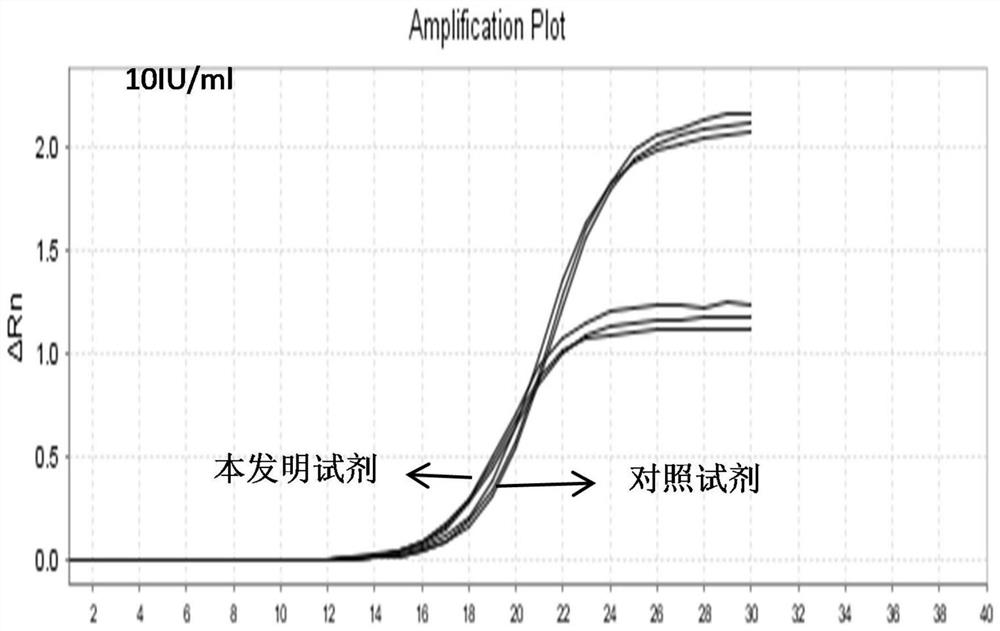
图1为10IU/ml HBV提取核酸的荧光定量PCR结果图;
图2为100IU/ml HBV提取核酸的荧光定量PCR结果图;
图3为实施例2 100IU/mL FluA提取核酸的荧光定量PCR结果。
图4为实施例2 10IU/mL FluA提取核酸的荧光定量PCR结果。
具体实施方式
下面将结合附图及实施例对本发明的技术方案做进一步说明。所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1乙型肝炎病毒核酸提取
1)将乙型肝炎病毒(HBV病毒)核酸定量的标准品用阴性血清稀释至100IU/ml和10IU/ml,取上述血清200ul置于离心管内,向离心管内加入裂解结合缓冲液500ul,加入20uL 10mg/mL蛋白酶K溶液,90℃加热混匀5分钟,再将离心管置于磁力架上,磁力分离20s,弃上清;
2)继续向所述离心管中加入500ul的洗涤缓冲液1,混匀1分钟后将离心管置于磁力架上,磁力分离20s,吸上清;
3)继续向所述离心管中加入500ul的洗涤缓冲液2,混匀1分钟后将离心管置于磁力架上,磁力分离20s,吸上清;
4)最后向离心管中加入100ul的洗脱缓冲液,80℃加热混匀5分钟后将离心管置于磁力架上,磁力分离20s,将上清液转移至另一洁净的离心管中,在-20℃温度下保存即可得到最终提取纯化的HBV病毒核酸溶液。
实施例中所述裂解结合缓冲液的组成为:盐酸胍4M,EDTA 5mM,tritonX-100 10%(v/v),Tris-HCl 0.7M,NP-40 1%(w/v),CTAB 0.1%(w/v),磁珠5%(w/v),pH值6.0。说明书中所有相关浓度相同表示,溶剂均为水。
洗涤缓冲液1的组成为:0.5M盐酸胍,10mM Tris-HCl,0.1M NaCl,pH值6.0,40%(v/v)乙醇溶液。
洗涤液缓冲液2的组分为:75%(v/v)乙醇水溶液。
洗脱缓冲液的组成为:1mM EDTA,5mM Tris-HCl,pH值8。
所述磁珠为超顺磁性氧化硅纳米微球,直径为100~1000nm,优选的磁珠直径为500nm。
本发明也可配合自动化仪器,快速高通量地提取出HBV病毒血清的核酸,使用自动核酸提取仪,程序如下表1所示:
表1:
对照试剂选用QIAamp DSP Virus Kit,提取的样本量为200ul,洗脱体积为100ul。提取方法参照其说明书操作。
提取完成后,取上述HBV核酸DNA提取液25uL作为模板,HBV反应液25uL,总反应体积50uL,利用ABI7500荧光定量PCR仪进行扩增检测。利于本发明的核酸提取试剂与对比试剂检测HBV结果如表2所示,图1为10IU/ml HBV提取的核酸PCR结果图,图2为100IU/ml HBV提取的核酸PCR结果图。
表2本发明的核酸提取试剂与对比试剂检测HBV结果
如表2结果和图1、图2所示,本发明试剂提取乙型肝炎病毒核酸检测的结果优于对照试剂提取乙型肝炎病毒核酸的检测结果。
实施例2甲型流感病毒
1)将市售的甲型流感病毒质控品(FluA病毒)用阴性样本稀释至100IU/ml和10IU/ml,取上述样本200ul置于离心管内,向离心管内加入裂解结合缓冲液500ul,加入20uL10mg/mL蛋白酶K溶液,90℃加热混匀5分钟,再将离心管置于磁力架上,磁力分离20s,弃上清;
2)继续向所述离心管中加入500ul的洗涤缓冲液1,混匀1分钟后将离心管置于磁力架上,磁力分离20s,吸上清;
3)继续向所述离心管中加入500ul的洗涤缓冲液2,混匀1分钟后将离心管置于磁力架上,磁力分离20s,吸上清;
4)最后向离心管中加入100ul的洗脱缓冲液,80℃加热混匀5分钟后将离心管置于磁力架上,磁力分离20s,将上清液转移至另一洁净的离心管中,在-20℃温度下保存即可得到最终提取纯化的FluA病毒核酸溶液。
实施例中所述裂解结合缓冲液的组成为:盐酸胍3M,EDTA 5mM,tritonX-10020%,Tris-HCl 0.2M,NP-40 2%,CTAB 0.5%,磁珠3%,pH值6.0。
洗涤缓冲液包括洗涤缓冲液1和洗涤缓冲液2,洗涤缓冲液1由以下组分组成:0.8M盐酸胍,10mM Tris-HCl,0.6M NaCl,pH值6.0,50%乙醇溶液;洗涤缓冲液2为75%乙醇水溶液。
洗脱缓冲液的组成为:1mM EDTA,5mM Tris-HCl,pH值8。
所述磁珠为超顺磁性氧化硅纳米微球,直径为100~1000nm,优选的磁珠直径为500nm。
本发明也可配合自动化仪器,快速高通量地提取出FluA病毒核酸,使用自动核酸提取仪,程序如下表3所示:
表3
对照试剂选用QIAamp DSP Virus Kit,提取的样本量为200ul,洗脱体积为100ul,提取方法按照其说明书完成。
提取完成后,采用市售FLuA的荧光定量PCR检测试剂盒,取上述核酸提取液2uL作为模板,反应液18uL,总反应体积20uL,利用荧光定量PCR仪进行扩增检测。荧光定量PCR结果表4和图3、图4所示,图3为100IU/mL FluA提取核酸的PCR结果,图4为10IU/mL FluA提取核酸的PCR结果。充分显示本发明试剂提取甲型流感病毒核酸检测的结果优于对照试剂提取甲型流感病毒核酸的检测结果。
表4:本发明的核酸提取试剂与对比试剂检测FluA结果
实施例3临床样本
收集的新型冠状病毒感染者鼻咽拭子临床样本6例和临床随机采集的鼻咽拭子样本10例,取200ul样本进行核酸提取,分别采用本发明的试剂盒和提取方法进行核酸提取,本发明实施例3中使用的所述裂解结合缓冲液、洗涤缓冲液和洗脱缓冲液与实施例1中使用的相同,即采用的试剂盒与实施例1中的试剂盒相同。对照试剂选用QIAamp viral RNAMini Kit提取的样本量为200ul,洗脱体积为100ul。提取完成后采用上海伯杰的新型冠状病毒核酸检测试剂盒(荧光PCR法)进行检测,取核酸样本5ul,总反应体积25ul,检测结果如表3所示,检测新型冠状病毒的双靶标ORF1ab和N基因结果显示,本发明的提取试剂盒和提取方法与对比试剂的提取后的检测结果阴性和阳性率均为100%。
表5本发明的核酸提取试剂与对比试剂检测新型冠状病毒结果
-表示未检测出
实施例4
1、用本发明的方法,直接裂解并结合后进行核酸的洗涤和洗脱。
1)将乙型肝炎病毒(HBV病毒)核酸定量的标准品用阴性血清稀释至100IU/ml,取上述血清200u置于离心管内(设置3个平行样),向离心管内加入裂解缓冲液500ul,加入20uL20mg/mL蛋白酶K溶液,90℃加热混匀5分钟;再将离心管置于磁力架上,磁力分离20s,弃上清;
2)继续向所述离心管中加入600ul的洗涤缓冲液1,混匀1分钟后将离心管置于磁力架上,磁力分离20s,吸上清;
3)继续向所述离心管中加入500ul的洗涤缓冲液2,混匀1分钟后将离心管置于磁力架上,磁力分离20s,吸上清;
4)最后向离心管中加入100ul的洗脱缓冲液,80℃加热混匀5分钟后将离心管置于磁力架上,磁力分离20s,将上清液转移至另一洁净的离心管中,即可得到最终提取纯化的HBV病毒核酸溶液,可在-20℃温度下保存。
其中,裂解结合缓冲液的组成为:盐酸胍4M,EDTA 5mM,tritonX-100 10%,Tris-HCl 0.7M,NP-40 1%,CTAB 0.1%,磁珠5%,pH值6.0。其中百分比(%)为质量百分比浓度,说明书中所有相关浓度相同表示,溶剂均为水。
洗涤缓冲液1的组成为:0.5M盐酸胍,10mM Tris-HCl,0.1M NaCl,pH值6.0,40%乙醇溶液。
洗涤液缓冲液2的组分为:75%乙醇水溶液。
洗脱缓冲液的组成为:1mM EDTA,5mM Tris-HCl,pH值8。
磁珠直径为500nm。
2、采用传统的方法,先进行裂解,后加入200ul-500ul异丙醇作为结合液进行结合,再进行核酸的洗涤和洗脱。裂解缓冲液:碘化钠2M,盐酸胍3M,EDTA 10mM,Tween-205%,纳米磁珠5%,SDS 2%。
3、按照申请号为201110124322.3中增强的磁珠法核酸提取方法中提及的进行操作,5M盐酸胍、异硫氰酸胍、碘化钠、碘化钾:裂解液的其组成分包括:1~2%triton X-100,1~2%壬基酚聚氧乙烯醚(NP 40),1~2%吐温20,10~20mM Tris—Hcl,pH7-8,1-2mMEDTA。且生物样品、异丙醇与裂解液的体积比为1:1:2。
提取完成后,采用达安基因乙型肝炎病毒核酸测定试剂盒(PCR-荧光探针法)取上述HBV核酸DNA提取液25uL作为模板,HBV反应液25uL,总反应体积50uL,利用ABI7500荧光定量PCR仪进行扩增检测。用紫外分光光度计检测提取纯度和浓度,结果见下表6。
表6
如表6中所示,利用本发明方法和添加结合液的结果,提取的纯度在1.7-2.1之间符合要求,但提取的浓度和Ct值不如本发明的结果。
最后说明的是,以上显示和描述了本发明的基本原理、主要特征及本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。本发明的要求保护范围由所附的权利要求书及其等效物界定。
- 核酸提取用乳化剂、含有该乳化剂的裂解结合液和核酸提取试剂盒及其应用
- 一种全血核酸提取用裂解结合液及其试剂盒和应用
