用于定位或识别恶性肿瘤的装置和方法
文献发布时间:2023-06-19 11:17:41
技术领域
实施方式总体上涉及分析含有载体蛋白(例如血清白蛋白)的细胞外液的方法和装置,并且更具体地,可以涉及用于分析载体蛋白以检测恶性肿瘤的指示物及其在人体内的定位的方法和相关装置。在实施方式中,使用电子自旋共振光谱法(ESR)进行这种分析。
背景技术
肿瘤的生长过程可能伴随有代谢物分泌到血液中。分析血液样品以检测此类代谢物的存在是已知的。然而,许多试图检测此类代谢物的已知技术灵敏度低,并且严格关注有限的一组代谢物。最常见的技术试图识别一种定位的恶性肿瘤。在某种程度上,可以同时检测到恶性生长的其他症状。结果是,某些这样的其他技术在其作为用于筛选血液样品中是否存在恶性肿瘤生长指示物的工具的适用性方面受到限制。
附图描述
从以下结合附图的详细描述中,将更充分地理解和领会本发明的实施方式,其中:
图1是用于一个实施方式的人血清白蛋白的结构示意图;
图2是根据一个实施方式的用于通过ESR光谱评价白蛋白的示例性程序的示意图;
图3是用于一个实施方式的16-氮氧自由基硬脂酸的图示;
图4是根据一个实施方式的乙醇浓度对白蛋白构象的影响的示意图;
图5示出了人血清白蛋白的9.45GHz ESR光谱。
图6显示了图5中所示光谱的五个子光谱;
图7显示了获取的ESR光谱的实例;
图8显示了包括ESR光谱仪和计算装置的实施方式的系统;和
图9显示了根据一个实施方式的方法的流程图;
图10是训练逻辑回归模型的方法的流程图。
具体实施方式
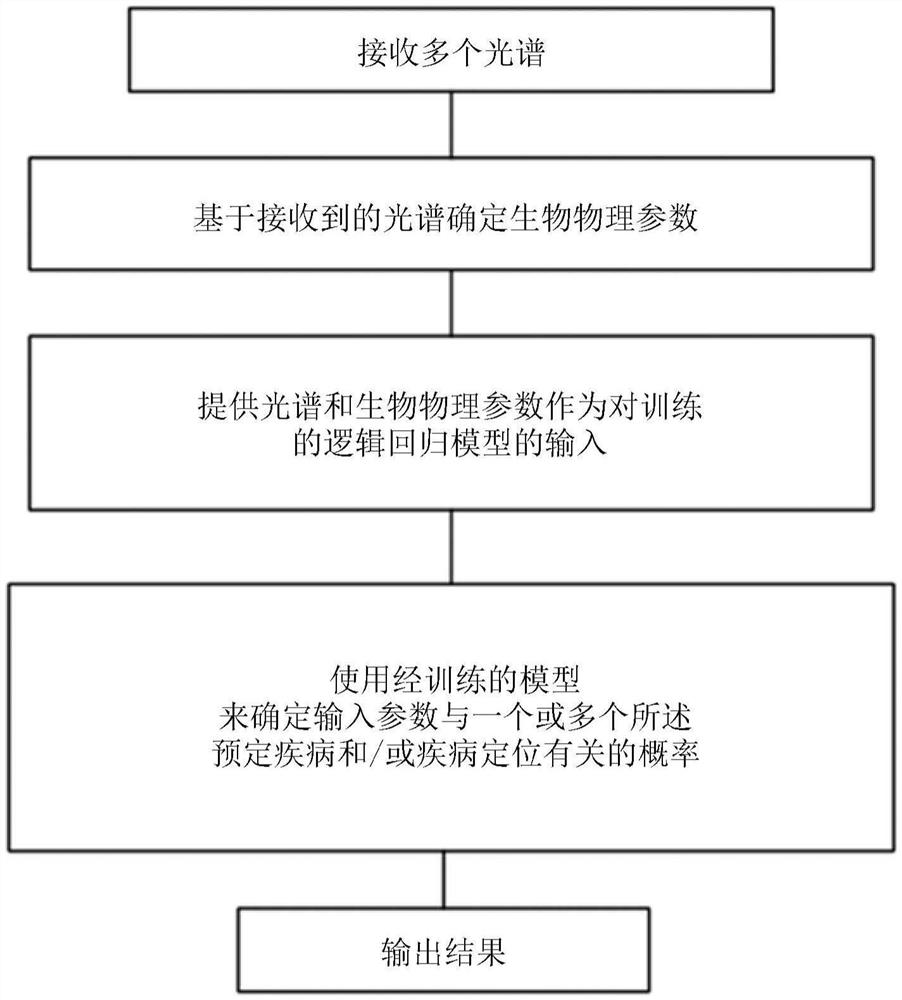
根据一个实施方式,将提供一种在计算装置中执行的方法。所述方法包括:在计算装置处接收多个光谱,所述多个光谱获取自包含生物生理学载体蛋白的相应多个等分试样,其中,自旋探针的浓度和极性试剂的浓度中的至少一个在等分试样之间变化;基于所接收的光谱由计算装置确定生物物理参数;并由计算装置将接收到的光谱和生物物理参数的至少一部分作为输入值,应用于经训练的逻辑回归模型。逻辑回归模型被训练以确定所应用的输入参数与多个预定疾病和/或疾病定位中的一个或多个有关的概率。计算装置使用训练的模型来确定输入的参数与一个或多个所述预定疾病和/或疾病定位有关的概率。输出概率的测定结果。
在一个实施方式中,确定生物物理参数包括确定以高结合亲和力与白蛋白结合的自旋探针的光谱分量,以低结合亲和力与白蛋白结合的自旋探针的光谱分量,游离自旋探针分子的光谱分量,胶束中的游离自旋探针的光谱分量,以及血清脂质组分上自旋探针的光谱分量中的一个或多个或全部。
在一个实施方式中,生物生理参数选自一个或多个高亲和力光谱分量中自旋标记周围的极性,自旋探针排序,自旋探针有效相关时间,光谱强度和光谱几何因数中的一个或多个或全部。
所述方法可以进一步包括在ESR光谱仪中接收多个包含生物生理学载体蛋白的等分试样,其中,自旋探针的浓度和极性试剂的浓度中的至少一个在等分试样之间变化,对于每个等分试样,获取ESR光谱,并将所获取的ESR光谱发送到所述计算装置。
所述方法可以进一步包括制备包含生物生理学载体蛋白的多个等分试样,其中,自旋探针的浓度和极性试剂的浓度中的至少一个在等分试样之间变化。
根据另一实施方式,提供了一种非暂时性存储介质,其储存由处理器执行的程序指令,该程序指令被配置为在由处理器执行时使处理器执行本文所述的方法。
根据另一实施方式,提供了一种分析系统,其包括处理器,存储适于由所述处理器执行的程序指令和训练的逻辑回归模型的存储器,逻辑回归模型被训练以确定所应用的输入参数与多个预定疾病和/或疾病定位中的一个或多个有关的概率,用于接收光谱数据的输入接口,和用于输出计算结果的输出接口。程序指令被配置成使处理器在由处理器执行时接收从包含生物生理学载体蛋白的等分试样中获取的多个光谱,其中,自旋探针的浓度和极性试剂的浓度中的至少一个在等分试样之间变化,基于接收到的光谱确定生物物理参数,由计算装置将接收到的光谱和生物物理参数的至少一部分作为输入值,应用于经训练的逻辑回归模型,使用训练的模型确定所输入参数与一种或多种所述预定疾病和/或疾病定位有关的概率;使用所述输出接口输出概率的所述确定的结果。
在一个实施方式中,程序指令在由处理器执行时使处理器确定以下一项或多项或全部,作为确定生物物理参数的一部分:以高结合亲和力与白蛋白结合的自旋探针的光谱分量,以低结合亲和力与白蛋白结合的自旋探针的光谱分量,游离自旋探针分子的光谱分量,胶束中的游离自旋探针的光谱分量或自旋探针对血清脂质分量的影响的光谱分量。
在一个实施方式中,生物生理参数选自一个或多个高亲和力光谱分量中自旋标记周围的极性,自旋探针排序,自旋探针有效相关时间,光谱强度和光谱几何因数中的一个或多个或全部。
所述系统还可以包括ESR光谱仪,该ESR光谱仪被配置为接收用于光谱分析的样品,并且包括输出接口,该ESR光谱仪的输出接口可通信地连接或通信地连接到所述输入接口以接收光谱数据。
在另一实施方式中,提供了一种训练逻辑回归模型的方法,用于确定所应用的输入参数与多个预定疾病和/或疾病定位中的一个或多个有关的概率。该方法包括:
a)在计算装置中提供包括模型参数的未经训练的逻辑回归模型;
b)使用所述模型对训练数据集预测疾病类型和/或定位;
c)基于预测误差和对于所述训练数据集的已知疾病类型和/或定位来更新所述模型参数;
d)使用其他训练数据集重复步骤(b)和(c)。
现在将详细参考根据本公开实现的示例性实施方式,其实例在附图中示出。在所有附图中,将尽可能使用相同的附图标记指代相同或相似的部件。
在患有癌症的患者中,肿瘤细胞释放的蛋白质及其分解产物可以在血液转运系统中与血清白蛋白结合。白蛋白是血液运输系统中的主要成分,能够将脂肪酸、色氨酸、胆红素、钙、类固醇激素和其他功能上重要的活性物质运输到靶细胞,并参与多种毒素(包括内源性毒素)的结合和分布。白蛋白是由585个氨基酸组成的多肽(分子量为68,000),对外源(药物)和内源物质具有高结合能力。脂肪酸是白蛋白的主要生理配体。
图1是用于一个实施方式的人血清白蛋白(HSA)1的结构的示意图。HSA 1的结构包含三个折叠成心形白蛋白分子1的同源域10、20、30。HSA的X射线晶体学分析确定了至少七个不同的脂肪酸结合位点(FA1-FA7),它们位于蛋白质的各个部分中(Bhattacharya等JMol Biol.2000年11月10日;303(5):721-32)并且显示出对脂肪酸的相对亲和力(Simard等J Mol Biol.2006年8月11日;361(2):336-51)。FA结合位点具有某些共同特征:在每种情况下,脂肪酸的烃链都位于一个长而窄的疏水孔中,而羧基部分位于碱性或极性残基附近(Curry等Nat Struct Biol.1998年9月;5(9):827-35)。这些FA结合位点(FA1-FA7)代表HSA中脂肪酸的特定(一级)疏水结合位点。此外,已经确定了血清白蛋白上脂肪酸的非特异性(二级)疏水结合位点。据信这些非特异性疏水结合位点位于白蛋白结构域10、20、30之间的疏水区域40中(Gurachevsky等Biochem Biophys Res Commun.2007年9日月7;360(4):852-6)。据信,在HSA的疏水区40中的非特异性结合位点与特异性FA结合位点(FA1-FA7)之间存在脂肪酸的迁移,反之亦然,该过程对于白蛋白的转运性质很重要。
如上所述,肿瘤来源的蛋白质和肽可以结合血清白蛋白。据信白蛋白通过隔离和保护它们免于分解代谢而在调节这些产物的血清浓度中起重要作用,这显著放大了它们在循环中的浓度。这些产物与白蛋白的结合可导致白蛋白的转运性质发生变化,这可以使用白蛋白的非共价自旋标记结合电子自旋共振(ESR)光谱法(也称为电子顺磁共振(EPR)光谱法)来确定。因此,ESR光谱法是评估各种配体(包括肿瘤衍生的蛋白质和肽)结合后白蛋白可能发生的结构和功能变化的有用工具。
图2是根据一个实施方式的用于通过ESR光谱法评估白蛋白的示例性程序的示意图。在国际专利申请WO 01/65270中也描述了该程序,将其全部内容通过引用并入本文,并且包括以下步骤。
在步骤(1)中,将含有白蛋白的样品等分试样放入容器中。在一个实施方式中,样品是血清样品。在一个实施方式中,样品是血液样品或包含白蛋白的药物或产品。例如,在一个实施方式中,样品是包含人或牛白蛋白制剂的商业溶液。在一个实施方式中,使用三个样品等分试样。然而,在一个替代实施方式中,使用了更少或更多的样品等分试样;例如,1、2、4、5、6、7或8。
在一个实施方式中,在步骤(1)之前,进行分析前阶段是为了保留白蛋白的原始(天然)构象状态,因为它包含在要评估的样品中。优选地,考虑以下一项或多项。
优选使用血清和EDTA血浆样品。优选避免使用具有可结合白蛋白并改变其天然构象状态的防腐剂或抗凝剂(如肝素)的制剂。在样品是全血的实施方式中,优选避免溶血过程。在一个实施方式中,为了减少溶血,在室温下采样一小时内进行全血离心以进行血清采样。在一个实施方式中,以1000至1500g离心10分钟。在一个实施方式中,在全血采样期间避免了真空采样系统,因为据信这会随着时间影响某些全血和血清样品的稳定性。优选的是避免在血清取样之前冻结全血样品,因为据信这会干扰全血成分的天然构象状态。在一个实施方式中,全血在离心之前被储存或运输冷却最多24小时。在一个实施方式中,在分析之前将分离的血清或EDTA血浆以不高于-28℃的温度在冷冻状态下存储(由于认为即使在冷冻血清中也会发生持续的生化预设)。优选的是,只解冻一次样品,并且要在程序使用前不久。在一个实施方式中,在将样品解冻与在ESR光谱仪中的测量之间的最大时间是40分钟。在样品是含有白蛋白的制剂(如市售白蛋白溶液或对照样品)的实施方式中,考虑了制造商关于对照样品的制备的建议,特别是冻干白蛋白的稀释液。优选的是,每个样品具有足够的材料,以至少一次控制重复地进行测量。
优选从分析中除去黄疸和脂血样品,因为直接评估此类样品中白蛋白的构象状态很复杂。在这种情况下,可能需要在以后的阶段重复进行分析以获得准确的结果。此外,优选排除属于某些类别的来自供体的样品。在一个实施方式中,这些类别包括患有急性炎症过程的患者,如NCI词典中所定义的侵入性手术的手术后少于21天(https://www.cancer.gov/publications/dictionaries/cancer-terms/def/invasive-procedure)和/或供体在过去14天内服用了排除的药物的患者。在一个实施方式中,排除的药物是表1中列出的药物。据信这些药物以治疗剂量影响白蛋白的构象状态。
表1:排除的物质
在图2的示例性程序的步骤(2)中,将每个样品等分试样与自旋探针在极性试剂中混合。自旋探针(也称为自旋标记)是一种有机分子,具有不成对的电子并具有与另一个分子结合的能力。在本实施方式中,自旋探针是16-氮氧自由基硬脂酸(如图3中的图示所示)。在一个替代实施方式中,自旋探针是替代的自旋标记的脂肪酸,优选为氮氧自由基硬脂酸,并且是5-,7-,12-或16-氮氧自由基硬脂酸或16-氮氧自由基硬脂酸盐(钠)中的一种。在一个实施方式中,其为氮氧自由基月桂酸,优选为7-氮氧自由基月桂酸。在一个实施方式中,可以与白蛋白发生特异性结合的任何自旋标记的化合物(包括其他的自旋标记的脂肪酸,类固醇激素或杂环烃)用作自旋探针。在一个实施方式中使用了带有硝氧基自由基标记的疏水化合物。在本实施方式中,极性试剂是乙醇。在一个替代实施方式中,使用替代的醇或DMSO。优选使用C1-C6醇。在本实施方式中,极性试剂用作自旋探针的溶剂并用于改变混合物的极性。如将在下面进一步详细描述的,在本实施方式中,三个样品等分试样的白蛋白和自旋探针的浓度不同。另外,白蛋白-自旋探针混合物中疏水相互作用的强度通过使用不同量的极性试剂而变化。在替代的实施方式中,使用少于或多于三种的不同浓度的白蛋白,自旋探针和/或极性试剂;例如,1、2、4、5、6、7或8。改变添加到白蛋白中的自旋标记的浓度并改变自旋标记混合物的离子强度,可以在不同条件下生成ESR光谱。合适的自旋探针和极性试剂是已知的,并且在WO 01/65270中公开了某些合适的自旋探针和极性试剂,将其全部内容通过引用并入本文。
在本实施方式中,将3.5、5.8和7.5mmol/l三种不同浓度的自旋探针分别与50μl的血清样品等分试样以10、12和14μl的体积混合。在一个实施方式中,自旋探针浓度与白蛋白浓度之比的平均值为2.5±0.5,并且从该平均值开始,选择至少两个另外的浓度,其与该平均值的偏差不小于1.0。选择待添加的极性试剂的浓度,使得等分试样中极性试剂最终浓度的平均值为(0.6±0.25)xCp,其中,Cp表示极性试剂的临界浓度,超过该临界浓度结果导致白蛋白变性,并且从该平均值开始,至少选择了另外两个浓度的极性试剂,其与该平均值的偏差至少为15%。关于自旋探针,白蛋白和极性试剂的比例的进一步细节US 2003/170912A1/US专利号7,166,474中描述,将其全部内容通过引用并入本文。
不希望受理论的束缚,据信通过改变自旋探针的浓度和极性试剂的浓度,可以产生多种浓度的组合,这使得能够在不同的阶段检测白蛋白的转运特性,即,疏水性化合物(如脂肪酸)结合过程中的生理状态(低浓度的自旋探针和低浓度的极性试剂),疏水化合物在血管系统中运输期间的生理状态(高浓度的自旋探针和低浓度的极性试剂),以及疏水化合物向靶细胞的递送(释放)过程中的生理状态(高浓度的自旋探针和高浓度的极性试剂)。
图4是根据一个实施方式的乙醇浓度对白蛋白构象的影响的示意图。据信,在乙醇浓度增加的情况下,白蛋白分子会发生构象变化,疏水相互作用减弱。据信该状态导致与白蛋白结合的配体解离,包括在本发明的实施方式中使用的自旋探针。因此,据信通过改变极性试剂的浓度,可以在白蛋白分子中诱导特定的构象变化,这使得能够在不同条件下产生ESR光谱。
在图2的示例性程序的步骤(3)中,将样品、自旋探针和极性试剂的混合物进行温育。在本实施方式中,在37℃,血液的生理pH下的温育时间为10分钟。在一个替代实施方式中,温育时间小于或大于10分钟;例如7至15分钟。在一个替代实施方式中,使用样品的在15℃至45℃之间的两个以上不同的温度值和/或血清样品的在7.5至3.5之间的两个以上不同的pH值。
在图2的示例性程序的步骤(4)中,混合物被毛细管吸取。在步骤(5)中,可以使用ESR光谱仪测量每个毛细管的ESR光谱。在步骤(6)中,可以分析ESR光谱并可以计算结果。
为了进行ESR光谱分析,可以将毛细管插入ESR光谱仪中。合适的ESR光谱仪可从MedInnovation GmbH(德国柏林)获得,例如型号EPR 01-08,MS-400和Espire-5000。ESR光谱法是已知技术,在本公开中不需要详细讨论。然而,简而言之,ESR光谱是通过将样品暴露于强静磁场中而获得的。施加静磁场会导致自由电子分离为两个自旋状态。以正确的频率施加微波能量会导致自旋在状态之间转变。在此过渡过程中吸收的微波能量是可测量的。在监视正在吸收的微波能量的数量的同时,可以保持微波频率恒定并改变静磁场的强度,或者在监视某个范围的扫频频率的同时监视能量吸收,同时保持静磁场不变。提供自旋所需的正确能量以在自旋状态之间转变的确切静磁场强度/微波频率组合取决于自旋的化学环境。应当理解的是,给定的自旋探针因此需要不同量的能量来完成该转变,这取决于自旋探针是否与白蛋白结合以及实际上取决于其与白蛋白结合的方式。因此,基于ESR的方法可以区分未结合和结合的自旋探针。此外,ESR能够区分位于白蛋白复合物上不同结合位点的自旋探针或处于不同未结合条件下的不同自旋探针。因此,在实施方式中在血清白蛋白上,这样的ESR是用于评估在分子上发现的结合条件的有力工具。
可以通过跟踪在静磁场强度在预定范围内上升或下降时吸收的微波能量的量以及形成跟踪的吸收谱的一阶导数来生成EPR谱。随着静磁场强度的变化,自由电子的两个自旋状态之间的间隔也随之变化。这两种自旋状态之间的间隔不仅取决于所施加的静磁场强度,还取决于自旋所处的化学环境。通过观察在每个给定的静磁场强度下吸收的能量的量,可以得出关于在结合态下产生能量分离的自旋探针的量的结论。
在实施方式中,也可以使用其他X波段EPR光谱仪(在约9-10GHz的微波频率运行)。在测量过程中,样品可以保持在37℃以模仿生理条件。
在白蛋白上产生可检测到的所有谱图的ESR谱图。对这些谱图的分析可以确定与各种结合位点结合的自旋探针的量。这就是说,ESR谱图是由不同的结合位点对相互重叠的自旋探针产生的影响而形成的,这并不罕见。
图5示出了人血清白蛋白的9.45GHz ESR光谱。该光谱由许多重叠的子光谱组成。例如,可以将图5中所示的测量光谱分解为五个子光谱,如图6所示。表2中描述的图6中提及的光谱分量,其涉及分别以高亲和力和低亲和力结合至白蛋白的自旋探针,或以表中提及的状态存在于血清中的自旋探针。
表2:光谱分量
C1代表与白蛋白中特定结合位点结合的脂肪酸自旋探针的比例(即在FA结合位点FA2,FA4和FA5处)。C2代表结合到非特异性结合位点,在白蛋白的疏水区域中的结合位点1、3、6和7的脂肪酸自旋探针的比例。C3至C5代表未结合的自旋探针分子(即未结合白蛋白的自旋探针)。更具体而言,C3代表未结合并在样品中自由存在的自旋探针分子的比例;C4代表聚集成脂肪酸胶束簇的自旋探针分子的比例;C5代表与血清样品中脂蛋白相关或结合的自旋探针分子的比例。
可以通过模拟各个光谱分量,然后将模拟分量拟合到测得的光谱,调整各个光谱分量的幅度和相位,直到满足拟合标准,来确定各个光谱分量对测量光谱的贡献。该标准例如可以是所测光谱与由上述相位和幅度项加权的各个模拟频谱分量之和之间的均方根误差的最小值。在拟合之后光谱成分具有的幅度和相位指示了表2中列出的各种结合状态下自旋探针的浓度。在一个实施方式中,光谱分量通过以下描述的方式来模拟:AndreyGurachevsky,Ekaterina Shimanovitch,Tatjana Gurachevskaya,Vladimir Muravsky(2007)Intra-albumin migration of bound fatty acid probed by spin labelESR.Biochemical and Biophysical Research Communications 360(2007)852–856,将其全部内容通过引用并入本文。在本公开中不需要详细讨论模拟光谱分量的方法的细节。
在一个实施方式中,使用最小二乘拟合将模拟的谱线拟合到测量的ESR光谱。作为另一种选择,可以使用最大似然预估。根据表2中定义的五个模拟组分C1至C5的拟合,测定上述三个等分试样中的每一个的组分C1至C5的相对浓度(以下也简称为A、B、C)。这可以以WO 2000/004387A3中描述的方式完成,将其全部内容通过引用并入本文。
也可以基于所测量的光谱来确定其他生物物理参数。这些包括:
·用于第一/高亲和力光谱分量C1和用于第二/低亲和力光谱分量C2的自旋标记周围的极性(亲水性),
·自旋探针排序,
·自旋探针有效相关时间,
·强度
·几何因数α
用于第一/高亲和力光谱分量C1和用于第二/低亲和力光谱分量C2的自旋标记周围的极性(亲水性)可以称为H
其中A
自旋探针排序与第一和第二分量的自旋标记轴旋进的角度相关,S
自旋探针有效相关时间,T
强度-是相应的ESR光谱A、B、C的绝对强度,以微波消光的相对单位表示,确定为检测到的ESR光谱的双积分。
图7显示ESR光谱A、B或C。几何因数α计算为ESR光谱最左侧光谱分量的幅度与ESR光谱右侧最后一个光谱分量的幅度之比。这两个峰以它们的的g因子相关。α是未结合的16-氮氧自由基硬脂酸自旋标记的高场线处的强度与在具有高亲和力的白蛋白结合位点中的结合的16-DSA的低场线处的光谱强度的比值。
T
其中A
T
其中I
T
AppDissConst是自旋标记与白蛋白解离的表观常数,由以下公式确定:
其中R是白蛋白的浓度,L是自旋探针的浓度,RL是两种试剂的复合物的浓度。R
根据以下公式计算白蛋白球旋转的相关时间τ1和自旋探针运动相对于球的相关时间τ2(轴旋进在角度θ之内):
从以下三种不同浓度的乙醇的结合常数方程式计算白蛋白的转运参数(结合效率BE、解毒效率DTE、实际转运质量RTQ):
其中C
上面讨论的可从ESR光谱得出的相关时间提供了有关附着在各个结合位点的自旋探针的迁移率以及蛋白质对自旋探针的亲和力的信息。另外,还可以测量与蛋白质的不同部分结合的自旋探针之间的偶极相互作用。自旋探针的迁移率和结合亲和力的变化,以及自旋探针在白蛋白分子上的分布,可以评估蛋白质的功能和结构特性。将正常健康个体中白蛋白上的自旋探针的迁移率,结合亲和力和分布发生的变化与患有癌症或某些其他疾病状态患者中观察到的那些变化进行比较,可以揭示出独特的改变。该信息在疾病(如癌症)的诊断和监测中可能是有价值的。
除了与等分试样有关的一个或多个以上讨论的生物物理参数之外,从上述三个等分试样获取的ESR光谱还用作该过程的输入参数。如上所述,尽管在本文描述的实施方式中使用了三个等分试样,但是可以替代地使用不同数量的等分试样。
可以将光谱和生物物理参数组合到行向量中,如下所示:
其中,
光谱可能具有数百或数千个数据点。这些归一化的数据点形成等分试样A的输入值
该方法的学习参数是矩阵θ∈R
逻辑回归评估具有特征向量x的对象属于类别k的概率为
k(x)=argmax
根据与训练光谱对应的属性的行向量s,可设置以下矩阵:X∈R
训练时,根据最大似然法,计算出矩阵θ,使函数最小化
C是一个正则化参数。
通过基于以上述方式获得的光谱训练逻辑回归方法,对715名具有已知疾病类型和定位的患者进行治疗,从而获得上述学习的参数。患者分为结肠直肠癌、其他肠胃癌、妇科癌症、肾癌、白血病、肺癌、淋巴瘤、乳房癌、胰腺癌、前列腺癌、胃癌、多部位癌和其他癌症。实施方式的方法在36个不同类型的定位上进行了测试,这些定位汇总在此处提到的13个组中。此外,这13个组包括实体和生血组织增殖。
使用疾病类型和定位也已知的患者的测试光谱(同样以上述方式获得)对经过训练的方法测试,发现该方法可以可靠地识别和定位恶性过程。如表1.0所示,对所有类型的淋巴瘤以及胰腺癌的鉴定和定位的诊断灵敏性和特异性在80%至90%之间,
从以上将认识到,实施发式的定位方法可广泛地应用于大量的定位任务。
图8描绘了包括ESR光谱仪10和计算装置12的系统。ESR光谱仪包括实验部分,其中以上述方式从进入样品室的样品中获取光谱。所获得的光谱通过ESR光谱仪的输出接口16和计算装置12的输入接口18输出到计算装置12。计算装置12包括处理器20和存储器22。存储器22存储通过处理器20执行的程序指令。当由处理器20执行时,该程序指令使处理器20执行本文所述的方法。计算装置12还包括输出装置24。输出装置24可以是用于向用户显示确定结果的显示器,或者可以是允许将结果发送到其他装置的电子输出接口。可以使用无线或有线方式进行任何此类传输。
图9是本发明的实施方式的流程图。在第一步中,在计算装置处接收从包含生物生理学载体蛋白的相应的多个等分试样获取的多个光谱。自旋探针的浓度和极性试剂的浓度中的至少一个在等分试样之间变化。随后,基于所接收的光谱确定生物物理参数。至少部分接收到的光谱和生物物理参数被应用到训练的逻辑回归模型作为输入。训练逻辑回归模型以确定与多个预定疾病和/或疾病定位中的一个或多个有关的所应用输入参数的概率。训练的模型用于确定与一个或多个所述预定疾病和/或疾病定位有关的输入参数的概率。输出概率的测定结果。
图10是训练逻辑回归模型的方法的流程图,该逻辑回归模型用于确定与多个预定疾病和/或疾病定位中的一个或多个有关的所应用的输入参数的概率。在第一步中,将包括模型参数的未经训练的逻辑回归模型提供给计算装置。该模型用于为训练数据集预测疾病类型和/或定位,对于该训练数据集,已经从临床诊断中得知了疾病类型和/或定位。然后基于预测误差和对于所述训练数据集的已知疾病类型和/或定位来更新模型参数。如果有其他训练数据集可用,则将它们依次用于进行如上所述的预测,并基于计算出的预测误差来校正模型参数。如果没有其他训练数据集可用,则输出训练后的模型参数。尽管已经描述了某些实施方式,但是这些实施方式仅通过示例的方式给出,并且不意图限制本发明的范围。实际上,本文描述的新颖的装置和方法可以以多种其他形式来体现。此外,在不脱离本发明的精神的情况下,可以对本文所述的装置、方法和产品的形式进行各种省略、替换和改变。所附权利要求及其等同物旨在覆盖落入本发明的范围和精神内的这些形式或修改。
- 用于定位或识别恶性肿瘤的装置和方法
- 用于触发无线网络中的协作式定位或学习的方法和装置
