SPL3和miR156基因在鉴定抗从枝病泡桐的应用
文献发布时间:2023-06-19 11:22:42
技术领域
本发明涉及分子生物学技术领域,更具体地说是涉及一种抗丛枝病泡桐的早期鉴定方法。
背景技术
泡桐,又叫白花泡桐、大果泡桐,空桐木等,树皮灰色、灰褐色或灰黑色,幼时平滑,老时纵裂。假二杈分枝,单叶,对生,叶大,卵形,全缘或有浅裂,具长柄,柄上有绒毛;喜光,较耐阴,喜温暖气候,耐寒性不强。其生长速度快,耐瘠薄,材性优良,在防风固沙、保障粮食安全和木材供应等方面起着重要的作用。
泡桐丛枝病是泡桐生产中最严重的病害之一,感病的幼苗、幼树常于当年枯死,大树感病后会引起树势衰退,材积生长量大幅度下降甚至造成死亡。目前,,丛枝病的防治目前费时费力,培育抗丛枝病的泡桐品种才是预防的根本,因此,开展抗丛枝病泡桐的选育是有必要的。
因此,如何对抗丛枝病泡桐进行早期的分子鉴定是本领域技术人员亟需解决的问题。
发明内容
有鉴于此,本发明以SPL3和miR156基因在泡桐树中的表达量为指标对抗从枝病的泡桐进行鉴定,简单高效。
为了实现上述目的,本发明采用如下技术方案:
SPL3和miR156基因在以Real-Time PCR方法鉴定抗从枝病泡桐中的应用。
miR156的靶基因为SPL,miR156和SPL特定存在于植物中,对于维持植物的生长发育、非生物胁迫和合成代谢具有关键作用,miR156对SPL3具有调控作用,而且miR156对SPL3的调控主要通过SPL3蛋白翻译后的抑制来实现的,所以在同一时期,植物体内miR156和SPL3基因的表达量呈相反趋势。MiR156通过切割SPL3转录本来影响枝条分支和植物构型。miR156的过表达促进了腋芽的萌生和生长,同时抑制了SAM的活性,导致了矮化植物的表型。SPL3通过影响独脚金内酯的信号传导进而调控植物的分枝。在选育过程中,miR156表达量较低同时SPL3表达量较高的候选植株,其出现丛枝症状的可能性较低。
一种鉴定抗从枝病泡桐的引物,以SPL3和miR156基因进行鉴定,且所述引物序列如SEQ ID NO.1~SEQ ID NO.3所示;
miR156F-5P-qF:GACAGAAGATAGAGAGCACAA,如SEQ ID NO.1所示;
miR156F-5P-qR:GeneCopoeia公司的All-in-One
pau-SPL3-qF:TTCTGTCATCTAACTCTTG,如SEQ ID NO.2所示;
pau-SPL3-qR:CCTCATCACTGGATTATAG,如SEQ ID NO.3所示。
一种抗丛枝病泡桐的早期分子鉴定方法,包括下述步骤:
(1)获取泡桐叶片:在同树龄泡桐样地,用高枝剪取待鉴定泡桐顶芽下部第一轮叶片;
(2)泡桐RNA抽提:采用研磨法提取泡桐叶片RNA,并用分光光度计评估RNA样品的纯度和浓度,最后纯化RNA样品,并将RNA保存在-80℃以备后用;
(3)合成cDNA:用Surescript
(4)SPL3和miR156表达量测定:分别以GAPDH和U6为内参基因,利用Real-Time PCR方法和权利要求2所述引物测定SPL3和miR156的相对表达量;
(5)表达量分析:参考SPL3和miR156的表达量,将高于SPL3的平均值、同时低于miR156的平均值的幼树认定为候选优株。
经由上述的技术方案可知,与现有技术相比,本发明首次以SPL3和miR156基因在待测样本中的表达量作为鉴定抗从枝病泡桐的标准,在实际鉴定时,先采集泡桐叶片,利用PCR技术,测定泡桐SPL3和miR156的表达量;最后对阈值进行筛选,通过上述方法,缩短了育种时间,为抗丛枝病泡桐的选育提供了有力帮助。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据提供的附图获得其他的附图。
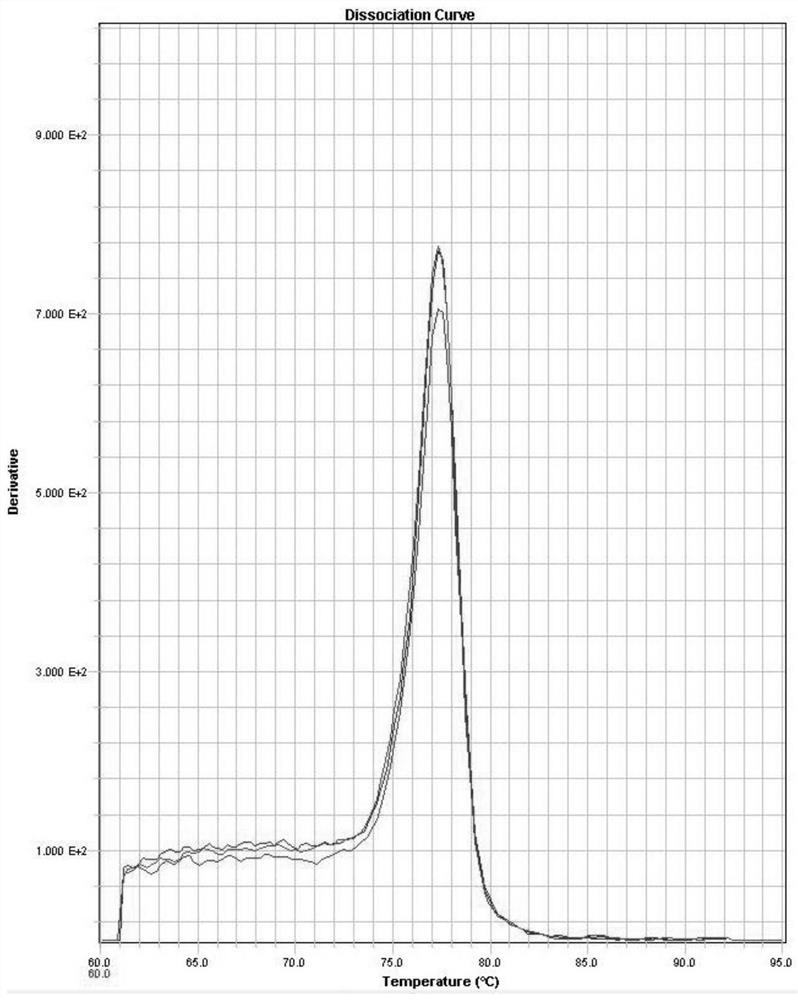
图1附图为SPL3基因的溶解曲线图;
图2附图为miR156基因的溶解曲线图。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
本发明在对miR156和SPL3定量检测时,用到的引物为:
实施例1
一种抗从枝病泡桐的早期鉴定方法,包括下述步骤:
(1)泡桐叶片获取:在一年生泡桐样地,对20株需要进行抗丛枝病选育的植株,用高枝剪取其顶芽下部第一轮叶片,放在做好标记的自封袋中,存放于装满干冰的采样箱中,回实验室后储存在-80℃冰箱;
(2)RNA抽提
1)样品处理
取约80~100mg样品至冷冻研钵中,加入液氮研磨至粉末状,转移至装有1mLTrizol的1.5mL离心管中,振荡混匀后室温静置约5min;
2)相分离
每1mL Trizol加入0.2mL氯仿,振荡混匀15s后室温静置约3min,4℃,12000rpm,离心15min;
3)沉淀
转移水相至新的1.5mL离心管中,每1mL Trizol加入0.5mL异丙醇,混匀后室温静置10min,4℃,12000rpm,离心10min;
4)洗涤
弃上清,每1mL Trizol加入1mL75%的乙醇,混匀后4℃,7500rpm,离心5min;
5)溶解
弃上清,空气干燥RNA沉淀约5min(注意不要完全干燥,只需沉淀泛白即可),加入适量的DEPC处理水溶解RNA沉淀;
6)测定浓度和纯度
用分光光度计测定RNA浓度和纯度后-80℃保存。
(3)引物设计
根据白花泡桐SPL3和miR156f-5p的碱基序列,利用Beacon Designer软件设计引物,在引物设计过程中,首先引物与模板的序列紧密互补,无错配,避免出现发卡结构;引物长度通常在18-24bp,Tm值55-65℃,GC含量在40%-60%,在符合这些条件的基础上,选择Rating值最高的。
(4)SPL3反转录
1)解冻Surescript
2)冰上配制RNA-PrimerMix,在预冷的RNase-free反应管内加入以下表1的试剂至总体积13μL;
表1
3)RNA变性:混匀RNA-Primer Mix,进行短暂离心,65℃变性10min后立即放于冰上;
4)配制反转录反应液:在RNA-Primer Mix反应管内加入以下表2中的试剂至总体积25μL;
5)反转录反应:混匀反应Mix,短暂离心后37℃孵育1小时。
6)灭活并保存反转录产物:反应结束后,85℃灭活处理5min,-20℃保存反转录产物待用。
(5)miRNA反转录
1)将模板RNA置于冰上融解,5×PAP/RT Buffer和ddH
2)轻柔混匀All-in-One
3)准备反转录反应液,将表3中试剂加入预冷的RNase-free反应管至终体积为25uL;
表3
*Total RNA中必须包含小分子RNA,以上表格中RNA质量为推荐的使用量,如果使用total RNA,使用量介于1ng-5μg。如果使用纯化的小分子RNA,使用量介于0.1ng-1μg;
4)反转录反应:动作轻柔地混匀已准备好的反应混合物,短暂离心后置于37℃孵育60分钟,接着置于85℃温育5分钟(终止逆转录反应),进行qPCR反应,先用灭菌蒸馏水稀释逆转录产物5-20倍,稀释的cDNA溶液置于-20℃保存;
(6)PCR定量检测miR156
1)解冻并轻柔混匀试剂盒中的All-in-One
2)使用ddH
3)按照表4内容,在冰上准备qPCR反应液;
表4
注:使用2×All-in-One
qPCR引物反应终浓度一般介于0.2-0.4μM之间。通常PCR反应体系中引物的终浓度为0.2μM时,可以获得比较好的实验结果。
在进行qPCR反应之前,逆转录得到的第一链cDNA需要进行稀释,避免逆转录体系中残余的一些试剂对qPCR扩增效率产生影响。
ROX Reference Dye可用于需要Dye的定量PCR扩增仪,是用以校正孔与孔之间产生的荧光信号误差。例如使用Life Technologies公司的Real Time PCR扩增仪进行实验就需要校正。不同的定量PCR仪使用的ROX Reference Dye浓度不同,因此,根据不同的定量PCR仪器,选择使用不同浓度的ROX Reference Dye。
4)轻柔混匀qPCR预混液并短暂离心,按照反应体系说明将预混液加入PCR反应管中,短暂离心确保预混反应液处于PCR反应管底部;
5)根据表5设置三步法PCR程序开始qPCR反应(以Bio-Rad iQ5定量PCR仪器推荐的反应程序为例);
表5
PCR反应后,采用以下表6的程序进行熔解曲线分析,如图2所示
表6
(7)SPL3的定量PCR检测
1)将BlazeTaq
2)冰上配制PCR Reaction Mix,如表7所示;
表7
注:在实验中设计了NTC(No Template Control),其为阴性对照,即用水来代替模板cDNA,其它试剂不变,从而质控体系是否有污染。
3)将反应管进行短暂离心,确保所有反应液在反应孔底部;
4)采用标准的三步法程序进行反应,如表8所示:
表8
PCR反应后,采用以下表9的程序进行熔解曲线分析,结果如图1所示;
表9
(8)分析miR156和SPL3的表达
1)获取Threshold Cycle(Ct)值或Crossing Point(Cp)值
Ct或Cp值的获得与基线和阀值线的设置有关,基线(Baseline)的设置一般都直接选择为仪器自动设置值,如需手动设置时,其一般的设置原则为:起始值设置为2或3,终止值的设置为整个Plate中扩增最强检测因子的Ct值减去2或3所得的值即可,如整个Plate中扩增最强的检测因子其Ct值为18,则选择的基线终值可为16或15。阀值线(Threshold)的设置,一般情况下,可选择仪器自动设置,如需改动,则在完成基线设置的基础上再设置,其设置应为超过整个96-well-qPCR反应板无规则噪音线的最高点,并且把阀值线设置在PCR的指数扩增期。
20株一年生泡桐幼苗为例Ct值见下表10和表11
表10
表11
2)ΔΔ
ΔΔ
Real-Time PCR是属于PCR的范畴,必定符合PCR的扩增理论方程:N=N0×(1+E)
表12
1-20号SPL3表达量0.05-0.55,平均值是0.30,其中16>11>14>10>20>9>13>4>18>8>平均值,1-20号miR156表达量0.04-0.21,平均值是0.125,其中1<10<5<20<17<2<14<13<9<11<平均值,初选优株为11号、10号、14号和20号。
根据SPL3的表达量比平均值大,同时miR156的表达量比平均值小的标准,初筛出抗丛枝病泡桐,这个方法可以作为抗丛枝病泡桐早期分子鉴定的方法。以此方法可作为抗丛枝病泡桐初筛的方法,填补了目前技术的空白,可缩短育种周期,提高育种效率。
本说明书中各个实施例采用递进的方式描述,每个实施例重点说明的都是与其他实施例的不同之处,各个实施例之间相同相似部分互相参见即可。对于实施例公开的装置而言,由于其与实施例公开的方法相对应,所以描述的比较简单,相关之处参见方法部分说明即可。
对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
- SPL3和miR156基因在鉴定抗从枝病泡桐的应用
- 一个抗病基因在水稻抗稻曲病改良中的应用
