检测受检者外周血中的cfDNA突变信息的方法
文献发布时间:2023-06-19 11:22:42
本申请是申请日为
技术领域
本申请涉及基因检测领域,特别涉及一种检测受检者外周血中的cfDNA突变信息的方法。
背景技术
肺癌是世界上发病率及死亡率最高的恶性肿瘤,每年死亡人数约140万,占所有恶性肿瘤死亡人数的18%。英国著名肿瘤学家Peto教授预言:如果中国不及时控制吸烟和治理空气污染,到2025年每年新发肺癌患者将超过100万。以现有的检测手段,约75%的肺癌患者在诊断时已属晚期,5年生存率约为15.6%。大众缺乏筛查意识,同时缺乏科学鉴别肺结节的方法,使肺癌发病率居高不下。肺癌是以肺结节形式表现出来,因此,肺癌早筛关键在于肺结节精确诊断。
肺结节为小的局灶类、类圆形、影像学表现密度增高的阴影,可为单发或多发。弥漫性或多发性结节,一般有胸外恶性肿瘤转移或活动性感染导致,原发性肺癌可能性相对较小。孤立性肺结节无典型症状,常为单个、边界清楚、密度增高、直径≤3cm且周围被含有气肺组织包绕的软组织影。随着肺癌中CT检查的普及和广泛应用以及近年来开展的低剂量CT筛查肺癌,使肺结节的检出率逐渐升高,它们可能代表恶性肿瘤,如原位腺癌及浸润性腺癌;或为癌前病变,如AAH;或为良性病变,包括局灶性间质纤维化或机化性肺炎、炎症及出血等。良、恶性病变的CT表现非常相似。有回顾性研究表明,通过CT影像进行8个大的肺癌筛查项目显示,肺结节的患病率是8%-51%,恶性肿瘤发病率为1.1%-12%。然而,CT仅仅是影像学结果,仅能确定结节的大小、形状等基本信息,需要经过医生肉眼观察,下定结论,依赖于医生的专业的知识和经验,并不能作为确诊的结果。
为了对肺结节进行确诊,目前临床上的做法是:在无法对影像学进行判断的情况下,进行手术取组织或穿刺活检对结节组织进行病理诊断。组织活检能够从细胞层面诊断结节是否癌变,是目前肺结节诊断的金标准。但是,由于肺结节的组织活检诊断在临床中并不提倡,有两方面原因:①肺结节大小一般小于3cm,需要凭借医生丰富的经验才能准确的穿刺取到结节组织;②手术是一种侵入性的手段,有一定的并发症风险。临床上还有另一种辅助检测手段,即肿瘤标志物。肿瘤标志物一般是与癌症相关蛋白标志物。由于这种蛋白标志物会受到受检者自身的影响,会影响结果的解读。因此,肿瘤标志物对癌症的诊断只能起辅助作用,并且灵敏度较低。临床上需要一种能够无创,高灵敏度诊断肺结节的检测手段。
液体活检(liquid biopsy)是MIT Technology Review杂志发布的2015年度十大突破技术之一,是当前转化医学研究的热门新兴领域,有望用于疾病的疗效评估和预后判断。早期研究表明循环肿瘤细胞(circulating tumor cell,CTC)捕获分析技术作为肿瘤基因分型的潜在生物标志物,但是这项技术在临床发展相当缓慢。超灵敏度的基因检测试验能够在肿瘤患者的血浆游离DNA(cell free DNA,cfDNA)中检测到突变的DNA,即循环肿瘤DNA(circulating tumor DNA,ctDNA)。ctDNA是一种无细胞状态的胞外DNA,肿瘤细胞脱落或者凋亡后释放进入血液循环。在癌症患者血浆cfDNA中,ctDNA仅占1%,甚至0.01%。随着疾病进展,在血液中的ctDNA也随之变化。在疾病进展过程中实时动态监测血液中的ctDNA,获得与肿瘤相关的变异信息,进行癌症早期筛查,指导临床用药,这对于癌症的诊疗至关重要。
ctDNA作为来源于肿瘤细胞的遗传信息,含有肿瘤的突变信息,随着组织癌变进程,基因的突变频率发生变化,通过测序技术分析出癌症相关基因突变信息,实现癌症的检测和监控。约翰霍普金斯大学医学院的Evgeny Izumchenko等研究发现,肺结节从腺瘤样增生(AAH),发展到原位癌(AIS),再到浸润性腺癌(MIA),随着细胞癌变的不断发生基因的突变率不断升高,一些基因如TP53和EGFR突变率显著上升。组织病变和组织癌变基因突变情况的差异化,可以在诊断时区别病人组织是否癌变,确保不出现误诊的情况,达到精确诊断的目的。而作为来源于肿瘤组织的外周血ctDNA,亦可通过检测肺结节患者外周血的不同基因突变情况,区分出肺结节是否癌变。
发明内容
本发明要解决的技术问题是提供一种以外周血为样本,通过高通量测序以检测肺结节为良性或恶性的试剂盒及其应用。
为解决上述技术问题,本发明采用以下技术方案:
一种检测肺结节为良性或恶性的试剂盒,其特征在于:包括以下组分:
(A)一种检测试剂,该检测试剂是链霉亲和素处理的磁珠;
(B)第一种检测组分,该检测组分是自主设计的adapter;
(C)第二种检测组分,该检测组分是针对肺结节相关的358个基因设计的引物;
(D)第三种检测组分,该检测组分是针对肺结节相关的358个基因设计的75642条捕获探针。
上述技术方案的(A)中,采用链霉亲和素处理的磁珠对样品以及PCR产物进行纯化。
上述技术方案的(B)中,所述的adapter中部分的核苷酸序列为:
5’-P-ACTGNNNNNNNNNNNNAGATCGGAAGAGCACACGTCTGAACTCCAGTCACXXXXXXXXTAGAGCATACGGCAGAAGACGAACUAATGATACGGCGACCACCGAGATCTACACTCTTTCCCTACACGACGCTCTTCCGATCT-3’。该序列中,由5’端开始,P为磷酸化标记,“ACTG”为Tag序列,“NNNNNNNNNNNN”为PolyN序列,N表示随机碱基,“AGATCGGAAGAGCACACGTCTGAACTCCAGTCAC”为发夹序列,“XXXXXXXX”为第一索引序列,同样的X表示随机序列,即第一索引序列为随机生成的8bp的序列,这是测序时区分不同样本的标记,“TAGAGCATACGGCAGAAGACGAAC”为第一通用引物结合序列,“U”为dUTP,“AATGATACGGCGACCACCGAG”为第二通用引物结合序列,“ATCTACACTCTTTCCCTACACGACGCTCTTCCGATCT”为发夹序列,前后两个发夹序列在退火时形成发夹结构。
上述技术方案的(C)中,所述针对肺结节相关的358个基因设计的引物包括针对EGFR基因L858R位点设计的正向引物和反向引物,具体如下:
EGFR基因L858R位点的正向引物:CATACCGCAGCATGTCAACTAG;
EGFR基因L858R位点的反向引物:GAGCCCTGGTCCCTGGTGGACT。
上述技术方案的(D)中,所述针对肺结节相关的358个基因设计的75642条捕获探针包括EGFR基因18号外显子上游探针和下游探针,具体如下:
EGFR基因18号外显子上游探针:
5’-CGCAGCATGTCAAGATCACAGATTTTGGGC-3’;
EGFR基因18号外显子下游探针:
5’-GGCCAAACTGCTGGGTGCGGAAGAGAAAGA-3’。
使用上述试剂盒进行肺结节诊断的方法,包括以下步骤:
获得患者提供的外周血样本,并进行血清和血细胞的分离;
(2)提取分离获得血清的DNA,并对样本DNA进行建库、杂交、捕获;捕获采用本申请所述的试剂盒;
(3)将步骤(2)捕获的文库进行测序,数据分析,确定发生突变的基因和突变频率。
本申请针对肺结节相关的358个基因自主设计了75642条捕获探针,用于血浆中的cfDNA的区域捕获,从而获得区域信息。
优选的,捕获探针的3’端具有生物素标记。需要说明的是,这种生物素标记能够与链霉亲和素结合,从而筛选出ctDNA中目的片段,去除其他不必要的cfDNA片段,捕获目的基因。
本申请所述的试剂盒只需要外周血样本进行检测,不需要进行手术或穿刺获得肺结节组织,减少了手术风险,实现了无创检测。同时,本申请设计了针对肺结节相关的358个基因的75642条捕获探针对血浆中的cfDNA进行区域捕获,经第二代测序技术,将产生的数据进行大数据分析,从而获得肺结节相关基因的突变情况。
本申请中,涉及的肺结节相关的358个基因包括:与肺癌细胞生长增殖相关的驱动基因,抑制细胞生长增殖的抑癌基因,信号通路中的相关基因,肺部其他肿瘤(如肺泡细胞癌,类癌等)相关基因,与良性肿瘤(如错构瘤,结核瘤等)相关的基因。上述基因虽然不能直接导致细胞的癌变,但间接影响着细胞的增殖分化,因此,这些基因的信息是判断肺结节良性恶性的重要参考依据。
优选的,肺结节相关的358个基因包括:35个肺癌细胞增殖分化驱动基因、41个肺癌细胞增殖分化抑癌基因、89个肺癌信号通路相关基因,124个肺部其他肿瘤相关基因,以及69个良性肿瘤相关基因。
本申请所述的试剂盒,是以血浆中的超微量cfDNA为检测对象,由于cfDNA反映的是当前的基因状态,因此能够实时反映出肺结节患者的基因突变状况,从而可以判断当前患者是良性肺结节还是恶性肺结节(肺癌)。
需要说明的是,本申请所述试剂盒的检测结果,仅仅用于分析和判断良性肺结节和肺癌基因的生物学信息,为肺结节良性恶性区分提供判断依据。
本申请所述的试剂盒检测受检者外周血中超微量的ctDNA突变信息,包括:肺部肿瘤相关基因的点突变、基因重排、扩增、缺失、插入等,从而为受检者病情诊断提供重要的分析依据。
还需要说明的是,本申请中,cfDNA是指外周血中游离的DNA片段,这些片段包括ctDNA,ctDNA是一种无细胞状态的胞外DNA,肿瘤细胞脱落或者凋亡后ctDNA被释放,从而进入血液循环。在癌症患者血浆cfDNA中,ctDNA仅占1%,甚至0.01%。因此,本申请首次提出了针对肺结节相关的358个基因设计了75642条捕获探针,利用该探针对cfDNA文库进行大范围的捕获,充分保证能够捕获到超微量的ctDNA,获得重要的信息。
优选的,数据分析包括去除低质量数据、对数据进行剪裁,以及去除polyN误差信息;去除低质量数据包括去除mapping质量为Q10的数据;对数据进行剪裁包括剪裁去除barcode数据,以及barcode后面7-10nt,以及reads最后8-10nt;去除polyN误差信息包括去除数据中连续20个以上polyN的数据。
与现有技术相比,本发明的有益效果在于:
1、本发明试剂盒以外周血中ctDNA为检测对象,并针对肺结节相关的358个基因设计了75642条捕获探针,通过高通量测序平台读取ctDNA基因信息,获得全面、准确、实时的反映肺结节相关基因的变异情况。并且,以ctDNA为检测对象,不需经过组织活检,只需要少量的外周血即可完成检测,真正实现了无创检测。
2、本发明检测试剂盒针对ctDNA中关于肺部良性、恶性肺结节的重要基因进行捕获测序分析,为肺癌早期进行疾病筛查,区分出良性和恶性肺结节提供重要依据。
附图说明
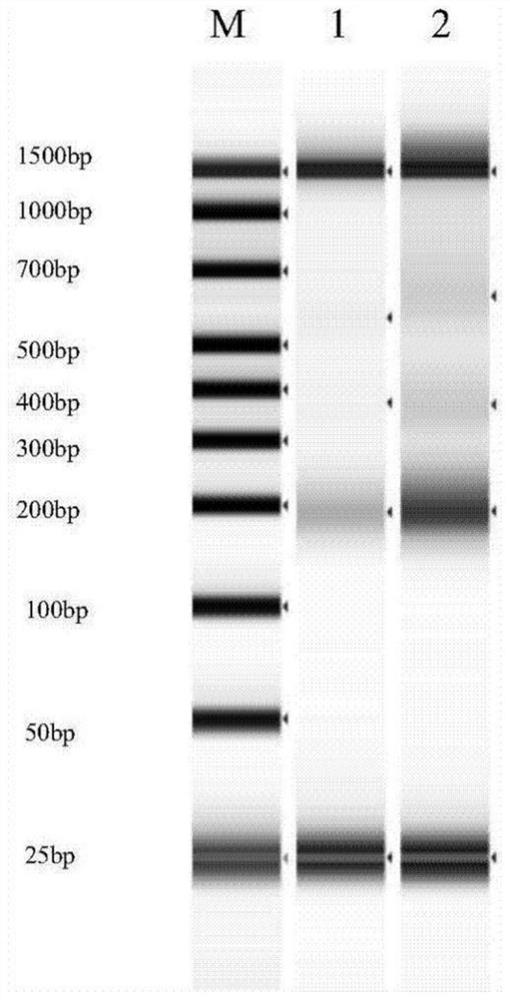
图1是本申请实施例2中LN201601(图中用“1”表示)和LN201602(图中用“2”表示)提取的cfDNA的质控检测结果凝胶图;
图2是本申请实施例2中LN201601提取的cfDNA的质控分析图;
图3是本申请实施例2中LN201602提取的cfDNA的质控分析图;
图4是本申请实施例2中LN201601(图中用“A4”表示)和LN201602(图中用“A5”表示)构建的cfDNA文库的质控检测结果凝胶图;
图5是本申请实施例2中LN201601的cfDNA文库的质控分析图;
图6是本申请实施例2中LN201602的cfDNA文库的质控分析图;
图7是本申请实施例2中ctDNA杂交文库的质控检测结果凝胶图;
图8是本申请实施例2中ctDNA杂交文库质控分析图;
图9是本申请实施例2中编号为LN201601(Nocancer)和LN201602(Cancer)样本的突变检测结果图。
具体实施方式
肺癌是世界上发病率及死亡率最高的恶性肿瘤,我国约75%的肺癌患者在诊断时已属晚期,5年生存率约为15.6%,这一现状不但与缺乏筛查有关,更与缺乏科学鉴别肺结节的方法有关。随着低剂量CT的普遍应用,肺结节的发现率成倍上升,传统的影像学诊断方法已不能满足医生和患者的精确诊断的要求。因此,对肺结节进行全面的基因组分析,将为早期肺癌的筛查提供重要依据。
本申请正是针对这一现象,结合本申请人现有的技术优势,以及市场上对肺癌早筛,肺结节诊断的迫切需求,创新性的提出了无创,精准,实时的肺结节诊断基因检测试剂盒。
相比于通过手术或穿刺活检这种有创且有风险的检测手段,本申请的检测对象是外周血中微量ctDNA,实现了无创的检测方法,大大降低检测对象的风险。并且,本申请的检测试剂盒中的探针组分,涵盖了目前已明确肺结节相关的358个基因包括,35个肺癌细胞增殖分化驱动基因、41个肺癌细胞增殖分化抑癌基因、89个肺癌信号通路相关基因,124肺部其他肿瘤相关基因,以及69个良性肿瘤相关的基因。
本申请检测对象为ctDNA,由于早期癌症细胞产生的游离循环肿瘤DNA量非常低,甚至低于总cfDNA的0.01%,而对于良性的肺结节这一比例更低,并且cfDNA的半衰期一般只有两小时,所以对于cfDNA的捕获有一定的困难。本申请通过优化从cfDNA的提取,到文库构建,再到杂交,超微量捕获扩增目的cfDNA,放大信号,实现目的基因的精确检测,保证低起始量也有非常高的灵敏度和准确性。
本申请的一种实现方式中,cfDNA的测序深度达到10,000x以上,平均有效测序深度达到2000x,使得测序的灵敏度能够达到0.1%。
本申请中涉及的名词解释如下:
捕获探针,是指与肺结节相关的358个基因的的75642条短核苷酸序列,确保能够覆盖到跟良性肺结节和恶性肺结节相关的所有基因,进行高灵敏度,高特异性的捕获。
杂交捕获,是指利用设计的358基因的探针从大量的cfDNA中结合目的cfDNA片段,去除多余cfDNA的过程。
PCR扩增,是指利用PCR技术对DNA片段进行扩增,使得超微量的DNA片段扩增为一定量的DNA片段,满足实验要求。
下面通过具体实施例和附图对本申请作进一步详细说明。以下实施例仅对本申请进行进一步说明,不应理解为对本申请的限制。
实施例1:检测肺结节为良性或恶性的试剂盒的组成
表1:检测肺结节为良性或恶性的试剂盒的组成
上述表1限定了检测肺结节为良性或恶性的试剂盒的组成,以下对试剂盒内部分成分进行进一步说明:
A)本申请的试剂盒内的链霉亲和素磁珠是采用链霉亲和素处理的磁珠吸附法对样品以及PCR产物进行纯化。可与探针3’端生物素进行特异性结合,起到纯化富集PCR产物的效果。
B)本申请试剂盒内的adapter为本申请人自行设计,adapter中部分的核苷酸序列为:
5’-P-ACTGNNNNNNNNNNNNAGATCGGAAGAGCACACGTCTGAACTCCAGTCACXXXXXXXXTAGAGCATACGGCAGAAGACGAACUAATGATACGGCGACCACCGAGATCTACACTCTTTCCCTACACGACGCTCTTCCGATCT-3’(SEQ ID NO:1)。该序列中,由5’端开始,P为磷酸化标记,“ACTG”为Tag序列,“NNNNNNNNNNNN”为Poly N序列,N表示随机碱基,“AGATCGGAAGAGCACACGTCTGAACTCCAGTCAC”为发夹序列,“XXXXXXXX”为第一索引序列,同样的X表示随机序列,即第一索引序列为随机生成的8bp的序列,这是测序时区分不同样本的标记,“TAGAGCATACGGCAGAAGACGAAC”为第一通用引物结合序列,“U”为dUTP,“AATGATACGGCGACCACCGAG”为第二通用引物结合序列,“ATCTACACTCTTTCCCTACACGACGCTCTTCCGATCT”为发夹序列,前后两个发夹序列在退火时形成发夹结构。本例的adapter序列由life technology公司合成。
C)本申请试剂盒内与肺结节相关的358个基因设计的引物,包括针对EGFR基因L858R位点设计的正向引物和反向引物,具体如下:
EGFR基因L858R位点的正向引物:CATACCGCAGCATGTCAACTAG(SEQ ID NO:2);
EGFR基因L858R位点的反向引物:GAGCCCTGGTCCCTGGTGGACT(SEQ ID NO:3)。
D)本申请试剂盒内针对肺结节相关的358个基因设计的75642条捕获探针,其中EGFR基因18号外显子上游探针和下游探针具体如下:
EGFR基因18号外显子上游探针:
5’-CGCAGCATGTCAAGATCACAGATTTTGGGC-3’(SEQ ID NO:4);
EGFR基因18号外显子下游探针:
5’-GGCCAAACTGCTGGGTGCGGAAGAGAAAGA-3’(SEQ ID NO:5)。
本申请试剂盒内针对肺结节相关的358个基因设计的引物的检测组分,涉及的肺结节相关的358个基因包括:与肺癌细胞生长增殖相关的驱动基因,抑制细胞生长增殖的抑癌基因,信号通路中的相关基因,肺部其他肿瘤(如肺泡细胞癌,类癌等)相关基因,与良性肿瘤(如错构瘤,结核瘤等)相关的基因。具体为35个肺癌细胞增殖分化驱动基因、41个肺癌细胞增殖分化抑癌基因、89个肺癌信号通路相关基因,124个肺部其他肿瘤相关基因,以及69个良性肿瘤相关基因。
肺结节相关基因筛选方法:
(1)整合现有针对肺结节病例样本测序的文献和报道,对每篇文献中的体细胞突变基因进行整合;
(2)将各个文献中整合出的优先筛选基因整合到一起,并进行筛选,去除重复基因。
上述基因虽然不能直接导致细胞的癌变,但间接影响着细胞的增殖分化,因此,这些基因的信息是判断肺结节良性恶性的重要参考依据。
实施例2:两例患者的肺结节基因检测(两个样本分别为编号LN201601的良性肺结节和LN201602的恶性肺结节样本)
检测方法包括以下步骤:
1.采集患者的血液样本并进行分离,血液分离详情如下:
抽取的外周血需要保存在4℃条件下,两个小时内进行处理。
(1)在4℃条件下1600g离心10min,离心后将上清(血浆)分装到多个2.0mL的离心管中。下层血细胞分装到2mL冻存管中,即为所需血细胞;
(2)在4℃条件下以16000g离心10min去除残余细胞,将上清转入新的2.0mL者离心管中,即得到所需的血浆。而后将样品保存到-80℃冰箱中或干冰中待测定。
2.将分离获得的血清进行cfDNA的提取,本实验采用宁波市重鼎生物技术有限公司核酸提取或纯化试剂盒,按照试剂盒说明书操作提取cfDNA。
cfDNA质控:使用Qubit2.0测定每个样本的浓度,利用Agilent 2100检测cfDNA的片段大小。
结果显示,LN201601和LN201602样本都收集到了约10mL外周血,分离出的血浆分别为4.5mL和5mL,cfDNA浓度分别为2.1ng/μL和3.6ng/μL;提取的cfDNA的片段大小跑胶图如图1所示,经过检测仪器自带软件分析,两个样本的cfDNA片段大小分布如图2和图3所示,在180bp有一个明显的峰,并且在320bp有一个小峰,符合cfDNA的特征,说明cfDNA的质控合格。
3.白细胞DNA(gDNA)提取及片段化
需要指出的是gDNA的测序、分析,是为cfDNA后续分析作为对照,过滤掉cfDNA中遗传性突变,为本申请的必要分析。
3.1血细胞中的白细胞DNA提取采用天根生化科技(北京)有限公司的血液基因组DNA提取试剂盒进行,按照试剂盒说明书操作提取gDNA。
3.2提取的白细胞gDNA采用NEBNext dsDNA Fragments酶切打断,然后经过OMEGAGel Extraction Kit回收纯化,收集100-250bp左右的片段。经Qubit2.0测定回收的片段化DNA的浓度。
结果显示,LN201601和LN201602样本回收后的片段化gDNA。
总量分别为242ng和158ng,满足文库构建起始量要求。
4.提取获得cfDNA和片段化的gDNA进行末端修复,A-tialing连接Adapter,构建Pre-PCR反应体系DNA的文库构建采用Kapa Biosystems公司KAPA HTP LibraryPreparation Kit试剂盒,其操作流程参照说明书,涉及到的反应组分均按照说明书配置;需要注意的是其中PCR所用的引物和连接的Adapter为本申请的试剂盒组分。
文库的质控:Qubit2.0对文库进行定量,测定每个样本的浓度,利用Agilent 2100检测DNA文库的片段大小。
结果显示,LN201601和LN201602样本cfDNA文库浓度分别为53.2ng/μL和65.2ng/μL,各25μL体积。cfDNA文库的片段大小跑胶图如图4所示,经过检测仪器自带软件分析,两个样本的cfDNA文库片段大小分布如图5和图6所示,在300bp左右有一个明显的峰,这是由于两端接头加起来有120bp,与目的片段加在一起,大概有300bp,这说明了构建的cfDNA文库合格。
5.目的片段的杂交捕获,DNA的测序捕获是利用Roche的杂交试剂盒SeqCap EZLibrary Kit进行,具体操作按照Roche杂交试剂盒说明书进行,其中DNA目标片段的捕获探针为本申请的试剂盒组分。
DNA文库质控:配置Qubit浓度测定试剂,测定每个样本的浓度,利用Agilent 2100检测DNA文库的片段大小。
结果显示,LN201601和LN201602样本杂交后的浓度为24ng/μL,共25μL。两样本的ctDNA杂交后文库的片段大小跑胶图如图7所示,经过检测仪器自带软件分析,两个样本杂交后的cfDNA文库片段大小分布如图8所示,在300bp左右有一个明显的峰。由于探针捕获的区域是目的片段和接头区域,片段大小没有变化,所以杂交后片段大小没有变化,符合要求。
6.将捕获的DNA文库进行测序,并对测序结果进行生物信息学分析,取变异信息,基因型信息,SNP和INDEL等,变异信息会进一步地进行校正和过滤,以获得更高质量的变异信息。
7.结果分析:图9为LN201601和LN201602两个样本的突变检测结果图。LN201601和LN201602样本经过滤后的平均测序深度超过2000x,满足了数据分析的要求,经分析LN201601样本检测的基因总突变数有12个,而LN201602样本的基因总突变数达到134个,超过LN201601样本的10倍以上,由此判定,LN201601样本为良性肺结节,LN201602样本为恶性肺结节。由于良性肺结节细胞还没有癌变,理论上基因突变较少,而由于多种因素形成的细胞癌变,是有多数的基因突变共同产生,一般的恶性肺结节样本基因突变数相对较多。并且经过病理检测结果也验证了肺结节基因检测的正确性。说明了本检测试剂盒来区分良性肺结节和恶性肺结节的可靠性。
以上内容是结合具体的实施方式对本申请所作的进一步详细说明,不能认定本申请的具体实施只局限于这些说明。对于本申请所属技术领域的普通技术人员来说,在不脱离本申请构思的前提下,还可以做出若干简单推演或替换,都应当视为属于本申请的保护范围。
SEQUENCE LISTING
<110> 深圳市海普洛斯生物科技有限公司
<120> 检测受检者外周血中的cfDNA突变信息的方法
<140> 202110262383X
<141> 2017-06-07
<160> 5
<170> PatentIn version 3.5
<210> 1
<211> 141
<212> DNA
<213> 人工序列
<220>
<221> misc_feature
<222> (5)...(16)
<223> n is a, c, g, or t
<400> 1
actgNNNNNN NNNNNNagat cggaagagca cacgtctgaa ctccagtcac XXXXXXXXta 60
gagcatacgg cagaagacga acuaatgata cggcgaccac cgagatctac actctttccc 120
tacacgacgc tcttccgatc t 141
<210> 2
<211> 22
<212> DNA
<213> 人工序列
<400> 2
cataccgcag catgtcaact ag 22
<210> 3
<211> 22
<212> DNA
<213> 人工序列
<400> 3
gagccctggt ccctggtgga ct 22
<210> 4
<211> 30
<212> DNA
<213> 人工序列
<400> 4
cgcagcatgt caagatcaca gattttgggc 30
<210> 5
<211> 30
<212> DNA
<213> 人工序列
<400> 5
ggccaaactg ctgggtgcgg aagagaaaga 30
- 检测受检者外周血中的cfDNA突变信息的方法
- 一种外周血中氯化琥珀胆碱的检测方法
