通过抑制泛素缀合酶E2 K(UBE2K)治疗癌症的方法
文献发布时间:2023-06-19 11:27:38
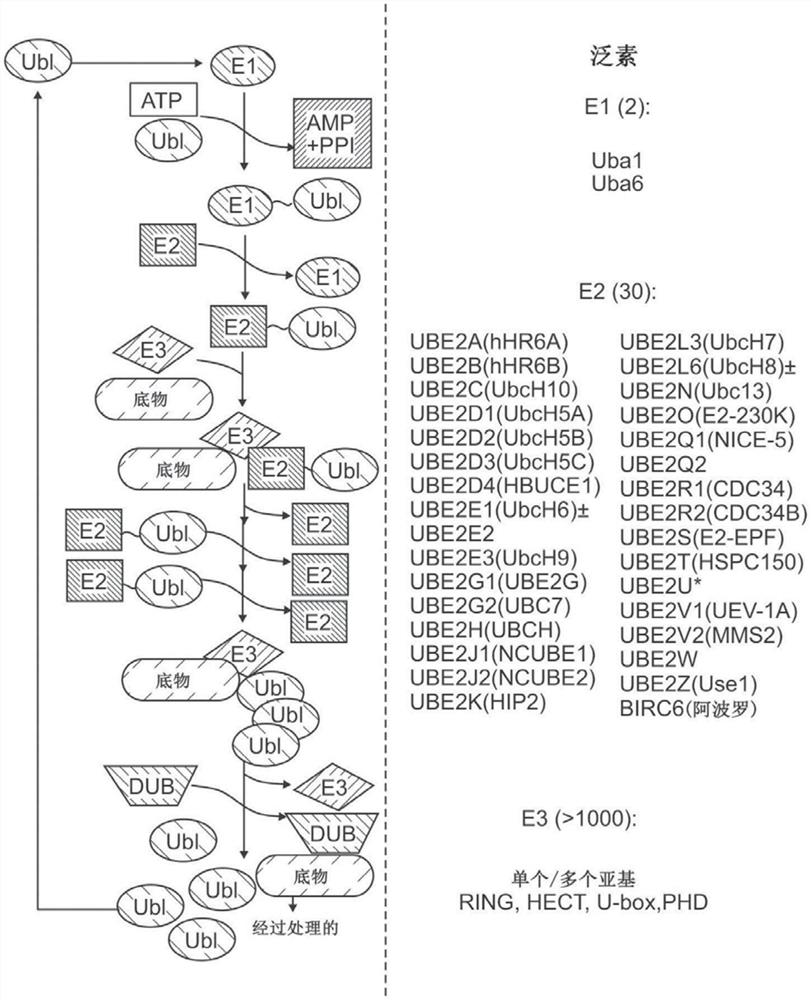
相关申请
本申请要求于2018年9月10日提交的美国临时专利申请号62/729,348的优先权,其内容通过整体引用并入本文。
序列表
本申请含有序列表,其已经以ASCII格式经由EFS-Web提交,并且在此通过整体引用合并。所述ASCII副本创建于2019年9月9日,名为119992_19420_Sequence_Listing.txt并且大小为3KB。
背景技术
目前,癌症是发达国家的主要死亡原因之一。传统上,癌症的诊断涉及严重的健康并发症。癌症可能导致毁容、慢性或急性疼痛、病变、器官衰竭或甚至死亡。传统上,许多癌症是通过外科手术、化学治疗、放射或其组合进行治疗的。已知用于治疗癌症的化学治疗剂会在患者中产生若干种严重且令人不适的副作用。例如,某些化学治疗剂会引起神经病变、肾毒性(例如高脂血症、蛋白尿、低蛋白血症、其组合等)、口腔炎、粘膜炎、脱发、厌食症、食管炎闭经、免疫力降低、贫血、高音听力损失、心脏毒性、疲劳、神经病变、骨髓抑制或其组合。通常,在治疗过程中或者在治疗方案结束后不久,化学治疗无效或者在一段时间的疗效后失去效力(即治疗方案无法治愈)。仍然需要改进的治疗癌症的方法。
发明内容
在某些方面,本公开涉及一种在有需要的受试者中治疗癌症的方法,所述方法包括向所述受试者给药泛素缀合酶E2 K(UBE2K)抑制剂,从而治疗所述受试者的癌症。
在某些方面,本公开涉及一种在有需要的受试者中减少癌细胞增殖的方法,所述方法包括向所述受试者给药泛素缀合酶E2 K(UBE2K)抑制剂,从而对所述受试者相对于未被给药所述UBE2K抑制剂的受试者减少癌细胞增殖。
在某些方面,本公开涉及一种在有需要的受试者中诱导癌细胞死亡的方法,所述方法包括向所述受试者给药泛素缀合酶E2 K(UBE2K)抑制剂,从而对所述受试者诱导癌细胞死亡。在某些实施方案中,所述癌细胞死亡是通过细胞凋亡诱导的。
在某些实施方案中,所述UBE2K抑制剂是UBE2K的特异性抑制剂。在某些实施方案中,所述UBE2K抑制剂包括小分子。在某些实施方案中,所述UBE2K抑制剂包括核酸抑制剂。在某些实施方案中,所述核酸抑制剂包括反义核酸分子。在某些实施方案中,所述核酸抑制剂包括双链核酸分子。在某些实施方案中,所述双链核酸分子包括选自由以下组成的组的双链RNA:siRNA、shRNA和切丁酶底物siRNA(DsiRNA)。在某些实施方案中,所述UBE2K抑制剂包括抗体。
在某些实施方案中,所述癌症包括实体瘤。在某些实施方案中,所述实体瘤选自由以下组成的组:上皮肿瘤、黑色素瘤、肉瘤和淋巴瘤。在某些实施方案中,所述实体瘤选自由以下组成的组:胰腺癌、肝癌、结肠直肠癌和淋巴瘤。在某些实施方案中,所述实体瘤是胰腺癌或肝癌。在某些实施方案中,所述癌症是白血病。
在某些实施方案中,所述UBE2K抑制剂与另外的药剂一起给药。在某些实施方案中,所述另外的药剂是抗癌剂。在某些实施方案中,所述另外的药剂是化学治疗剂。在某些实施方案中,所述化学治疗剂选自由以下组成的组:吉西他滨、5-氟尿嘧啶、亚叶酸、多西他赛、氟达拉滨、阿糖胞苷、环磷酰胺、紫杉醇、多西他赛、白消安、甲氨蝶呤、道诺霉素、阿霉素、美法仑、克拉屈滨、长春新碱、长春花碱、苯丁酸氮芥、它莫西芬、他克唑、喜树碱、放线菌素D、丝裂霉素C、康普瑞汀、顺铂、依托泊苷、维拉帕米、鬼臼毒素和 5-氟尿嘧啶。在某些实施方案中,所述另外的药剂是抗血管生成剂。
在某些实施方案中,所述另外的药剂是免疫治疗剂。在某些实施方案中,所述免疫治疗剂是免疫检查点分子的免疫检查点调节剂。在某些实施方案中,所述免疫检查点分子选自CD27、CD28、CD40、CD122、OX40、GITR、ICOS、4-1BB、ADORA2A、B7-H3、 B7-H4、BTLA、CTLA-4、IDO、KIR、LAG-3、PD-1、PD-L1、PD-L2、TIM-3和VISTA。在某些实施方案中,所述免疫检查点分子是刺激性免疫检查点分子,并且所述免疫检查点调节剂是所述刺激性免疫检查点分子的激动剂。在某些实施方案中,所述免疫检查点分子是抑制性免疫检查点分子,并且所述免疫检查点调节剂是所述抑制性免疫检查点分子的拮抗剂。在某些实施方案中,所述免疫检查点调节剂选自小分子、抑制性RNA、反义分子和免疫检查点分子结合蛋白。在某些实施方案中,所述免疫检查点分子是PD-1,并且所述免疫检查点调节剂是PD-1抑制剂。在某些实施方案中,所述PD-1抑制剂选自派姆单抗、纳武单抗、匹地单抗、SHR-1210、MEDI0680R01、BBg-A317、TSR-042、REGN2810和 PF-06801591。在某些实施方案中,所述免疫检查点分子是PD-L1,并且所述免疫检查点调节剂是PD-L1抑制剂。在某些实施方案中,所述PD-L1抑制剂选自德瓦鲁单抗、阿特朱单抗、阿维单抗、MDX-1105、AMP-224和LY3300054。在某些实施方案中,所述免疫检查点分子是CTLA-4,并且所述免疫检查点调节剂是CTLA-4抑制剂。在某些实施方案中,所述CTLA-4抑制剂选自伊匹木单抗、曲美木单抗、JMW-3B3和AGEN1884。
附图说明
图1示出了泛素蛋白酶体系统的概览。
图2示出了Miapaca2、HepG2和SKHEP1细胞中siRNA转染后24h和96h时的UBE2K 转录物敲低。
图3示出了在Miapaca2、HepG2和SKHEP1细胞中siRNA转染后24h和96h时UBE2K 蛋白质敲低。
图4示出了在转染后96h时的基础条件下,UBE2K siRNA介导的敲低对细胞数量的影响。
图5示出了UBE2K siRNA介导的敲低对阿霉素敏感性的影响。
图6示出了UBE2K siRNA介导的敲低对相关E2的mRNA表达的影响。
图7示出了在含0.5%或5%血清的培养基中培养时,UBE2K siRNA介导的敲低对细胞数量/存活率的影响。
图8示出了UBE2K siRNA介导的敲低对细胞死亡和细胞周期进程的影响。
图9A和图9B示出了在具有和没有MG132的情况下,UBE2K敲低细胞对比非靶向siRNA转染的MiaPaca2细胞中在蛋白质水平(A)和转录水平(B)下对UBE2K相互作用子的调节。
图10示出了MiaPaca2细胞的同步和非同步种群的细胞周期分析。用Hoechst染色剂处理沉淀的MiaPaca2细胞10分钟。通过使用流式细胞仪测量FL-3泳道中Hoechst染色的MFI来分析细胞周期分析。
图11示出了用20%FBS从血清剥夺释放后48小时、72小时和96小时时用UBE2K 敲低进行的同步MiaPaca2细胞的Cell Titer-Fluor细胞存活率测定。
图12示出了整个细胞周期中细胞周期蛋白的浓度变化。细胞周期蛋白积累与三个主要细胞周期检查点之间存在直接相关性。
图13示出了同步MiaPaca2细胞中关键细胞周期调节剂水平的时间推移。
图14示出了转染后72小时时MiaPaca2细胞中Cdc34和UBE2K敲低的确认。
图15示出了转染后72小时时,MiaPaca2细胞中的UBE2K敲低导致活细胞数量减少了大约20%。Cdc34的敲低对活细胞的数量没有影响。
图16示出了在UBE2K shRNA2和shRNA3转导的MiaPaca2细胞系中UBE2K敲低的确认。在UBE2K敲低细胞中观察到G2/M细胞周期调节蛋白的水平升高。
图17示出了平板接种72h后的细胞滴度荧光(CellTiter-Fluor)细胞存活率分析,其显示UBE2K敲低细胞中的活细胞总数显著低于非靶向(NT)siRNA对照shRNA细胞。
图18示出了MiaPaca2细胞中的直接细胞计数和单个细胞核计数。与非靶向(NT)shRNA对照对应物相比,平板接种后96h时UBE2K敲低细胞的细胞数/孔数显著较少。
图19示出了胰腺导管腺癌患者中UBE2K基因表达与存活的相关性。
图20示出了胰腺肿瘤组织对比正常邻近组织中UBE2K免疫组织化学染色的示例数据集。
详细描述和优选实施方式
发现平台技术用于将泛素缀合酶E2 K(UBE2K)标识在人类癌细胞中受到显著调节的中心节点。在癌细胞(例如胰腺癌和肝细胞癌细胞系)中敲低UBE2K,在体外减少了癌细胞数,并且进一步的研究表明,UBE2K敲低减少了癌细胞增殖并诱导了癌细胞死亡。因此,本发明提供了通过给药UBE2K抑制剂来减少癌细胞的增殖和/或诱导癌细胞的死亡的方法。本发明还提供了通过向受试者给药UBE2K抑制剂来治疗受试者的癌症的方法。
术语“给药(administer)”、“给药(administering)”或“给药(administration)”包括任何将药物组合物或药剂递送至受试者的系统中或递送至受试者体内或体表的特定区域的方法。在某些实施方案中,药剂是口服递送的。在某些实施方案中,药剂是肠胃外给药的。在某些实施方案中,药剂局部地递送,包括经粘膜地递送。在某些实施方案中,药剂通过吸入递送。在本发明的某些实施方案中,药剂通过肠胃外递送来给药,包括静脉内、肌内、皮下、髓内注射,以及鞘内、直接心室内、腹膜内、鼻内或眼内注射。在一个实施方案中,本文提供的组合物可以通过直接注射至肿瘤来给药。在一些实施方案中,药剂通过注射或输注来递送。在某些实施方案中,给药是全身性的。在某些实施方案中,给药是局部的。在一些实施方案中,可以组合一种或多种给药途径,诸如静脉内和肿瘤内、或静脉内和经口、或静脉内和口服、静脉内和局部、或静脉内和透皮或经粘膜。给药药剂可以由许多协同工作的人执行。给药药剂包括,例如,将有待向受试者给药的药剂开处方和/或提供服用特定药剂的说明(直接地或通过另一个)——通过自我递送服用,例如,通过口服递送、皮下递送、经由中心线静脉内递送等服用;或者用于由经过训练的专业人员递送,例如,静脉内递送、肌内递送、肿瘤内递送等。
如本文所使用的,术语“抗体”是指这样的免疫球蛋白分子,其通过该免疫球蛋白分子的可变区内的至少一个抗原识别位点识别并特异性结合至靶标,所述靶标诸如蛋白质、多肽、肽、碳水化合物、多核苷酸、脂质或前述物质的组合。如本文所使用的,术语“抗体”涵盖了完整的多克隆抗体、完整的单克隆抗体、抗体片段(例如,Fab、Fab’、F(ab’)
在一些实施方案中,抗体是非天然存在的抗体。在一些实施方案中,抗体是从天然组分中纯化的。在一些实施方案中,抗体是重组产生的。在一些实施方案中,抗体是由杂交瘤产生的。
术语“抗体片段”是指完整抗体的一部分,并且是指完整抗体的抗原决定可变区。抗体片段的实例包括但不限于Fab、Fab’、F(ab’)
如本文所使用的,术语“CDR”是指抗体可变序列内的互补决定区。重链和轻链的每个可变区中都有三个CDR,对于每个可变区分别被命名为CDR1、CDR2和CDR3。如本文所使用的,术语“CDR组”是指存在于能够结合抗原的单个可变区中的三个CDR的组。这些CDR的确切边界已根据不同的系统进行了不同的定义。由Kabat(Kabat等人,《具有免疫学意义的蛋白质的序列(SEQUENCES OF PROTEINS OF IMMUNOLOGICAL INTEREST)》(美国国立卫生研究院,Bethesda,马里兰州(1987)和(1991)))描述的系统不仅提供了适用于抗体任何可变区的明确的残基编号系统,还提供了定义三个CDR的精确残基边界。这些CDR可以被称为KabatCDR。Chothia及其同事发现,尽管在氨基酸序列水平上具有很大的多样性,但Kabat CDR内的某些亚部分采用几乎相同的肽主链构象 (Chothia等人(1987)《分子生物学杂志(J.MOL.BIOL.)》196:901-917,以及Chothia 等人(1989)《自然(NATURE)》342:877-883)。这些亚部分被命名为L1、L2和L3或 H1、H2和H3,其中“L”和“H”分别表示轻链区和重链区。这些区可以称为Chothia CDR,其边界与Kabat CDR重叠。与Kabat CDR重叠的定义CDR的其他边界已在Padlan等人 (1995)《美国实验生物学学会联合会杂志(FASEB J.)》9:133-139以及MacCallum等人 (1996)《分子生物学杂志(J.MOL.BIOL.)》262(5):732-45中有描述。还有其他CDR边界定义可能并不严格遵循上述系统之一,但仍会与Kabat CDR重叠,然而根据特定残基或残基组或甚至整个CDR不会显著影响抗原结合的预测或实验发现,它们可以缩短或延长。尽管优选的实施方案使用Kabat或Chothia定义的CDR,但是本文使用的方法可以利用根据这些系统中的任一系统定义的CDR。
如本文所使用的,“单克隆抗体”是指参与单个抗原决定簇或表位的高度特异性识别和结合的均质抗体群。这与通常包括针对不同抗原决定簇的不同抗体的多克隆抗体相反。术语“单克隆抗体”涵盖了完整且全长的单克隆抗体以及抗体片段(诸如Fab、Fab’、F(ab’)
如本文所使用的,术语“人源化抗体”是指作为嵌合免疫球蛋白、免疫球蛋白链或其片段(诸如Fv、Fab、Fab'、F(ab')2或抗体的其他抗原结合亚序列)的非人类(例如,鼠类)抗体,其包含源自非人免疫球蛋白的最小序列。在大多数情况下,人源化抗体及其抗体片段是人免疫球蛋白(受体抗体或抗体片段),其中来自受体互补决定区(CDR)的残基被来自非人类物种(诸如具有所需特异性、亲和力和能力的小鼠、大鼠或兔子)的CDR的残基(供体抗体)所取代。在一些情况下,人免疫球蛋白的Fv构架区(FR)残基被对应的非人残基取代。此外,人源化抗体/抗体片段可包含在受体抗体或输入的CDR或构架序列中均未发现的残基。这些修饰可以进一步改善和优化抗体或抗体片段的性能。通常,人源化抗体或其抗体片段将包含至少一个可变结构域(通常是两个可变结构域)的基本上全部,其中全部的或基本上全部的CDR区对应于非人免疫球蛋白的那些,并且FR区的所有的或重要的部分是人免疫球蛋白序列的那些。人源化抗体或抗体片段还可包含免疫球蛋白恒定区(Fc)的(通常是人免疫球蛋白的)至少一部分。有关更多详细信息,请参见Jones 等人(1986)《自然(NATURE)》321:522-525;Reichmann等人(1988)《自然(NATURE)》 332:323-329;以及Presta(1992)《结构生物学评论(CURR.OP.STRUCT.BIOL.)》2:593-596,其中的每一个通过整体引用并入本文。
“二价抗体”是指包含两个抗原结合位点的抗体或其抗原结合片段。两个抗原结合位点可以结合相同的抗原,或者它们可以各自结合不同的抗原,在这种情况下,抗体或抗原结合片段被表征为“双特异性”。“四价抗体”是指包含四个抗原结合位点的抗体或其抗原结合片段。在某些实施方案中,四价抗体是双特异性的。在某些实施方案中,四价抗体是多特异性的,即与多于两种的不同抗原结合。
Fab(片段抗原结合)抗体片段是包含抗体的单价抗原结合结构域的免疫反应性多肽,该抗体由以下构成:由重链可变区(V
术语“癌症”或“肿瘤”是本领域众所周知的,并且是指(例如在受试者中)存在具有致癌细胞的典型特征的细胞,所述特征诸如是不受控制的增殖、永生、转移潜力、快速的生长和增殖率、减少的细胞死亡/凋亡、以及某些特征性形态特征。
如本文所使用的,“癌症”是指在人类中发现的所有类型的癌症或赘生物或恶性肿瘤,包括但不限于:白血病、淋巴瘤、黑素瘤、上皮肿瘤和肉瘤。如本文所使用的,术语或语言“癌症”、“赘生物”和“肿瘤”可互换使用,并且是单数或复数形式,其是指经历了恶性转化的细胞,所述恶性转化使所述细胞对寄助物呈病态。通过成熟的技术,特别是组织学检查,可以容易地区分原发癌细胞(即从恶性转化位点附近获得的细胞)与非癌细胞。如本文所使用的,癌细胞的定义不仅包括原发癌细胞,而且包括癌症干细胞,以及癌症祖细胞或任何源自癌细胞祖先的细胞。这包括转移的癌细胞,以及源自癌细胞的体外培养物和细胞系。在某些实施方案中,癌症是实体瘤。在某些实施方案中,癌症是血液肿瘤(即非实体瘤)。
“实体瘤”是这样的肿瘤:其可基于肿瘤块被检测到,例如,通过诸如CAT扫描、MR成像、X射线、超声或触诊之类的程序检测;和/或其可由于可从患者获得的样品中的一种或多种癌症特异性抗原的表达而被检测到。肿瘤不需要具有可测量的尺寸。
用于癌症分期的特定标准取决于基于肿瘤大小、组织学特征、肿瘤标志物和本领域技术人员已知的其他标准的特定癌症类型。通常,癌症的阶段可以描述如下:
0期-原位癌
I期、II期和III期-数字越高,表示疾病越广泛:肿瘤大小越大和/或癌症扩散超出其最初发展的器官至附近的淋巴结和/或与原发肿瘤的位置相邻的组织或器官。
IV期-癌症已扩散到远处的组织或器官
RECIST标准是临床上公认的评估标准,用于提供实体瘤测量的标准方法,并提供客观评估肿瘤大小变化的定义以用于临床试验。该标准也可用于监测接受实体瘤治疗的个体的反应。RECIST 1.1标准在Eisenhauer等人(实体瘤的新反应评价标准:修订的RECIST指南(New response evaluation criteria in solid tumors:Revised RECISTguideline)(1.1版) 《欧洲癌症杂志(Eur.J.Cancer.)》45:228-247,2009)中进行了详细讨论,其全部内容通过引用并入本文。靶标病变的反应标准包括:
完全反应(CR):所有靶标病变均消失。任何病态淋巴结(无论是靶标还是非靶标)的短轴都必须减小至<10mm。
部分反应(PR):靶标病变直径的总和减少至少30%,以基线总和直径为参考。
进展性疾病(PD):靶标病变的直径总和增加至少20%,以研究中的最小总和为参考 (如果其是研究中的最小者,则包括基线总和)。除了相对增加20%外,总和还必须显示至少5mm的绝对增加。(注意:一个或多个新病变的出现也被视为进展。)
稳定疾病(SD):既没有符合PR的足够的缩减,也没有符合PD的足够的增加,从而以研究中最小的总直径为参考。
RECIST 1.1标准还考虑了非靶标病变,其被定义为可以测量但不需要测量且仅应在所需时间点进行定性评估的病变。非靶标病变的反应标准包括:
完全反应(CR):所有非靶标病变消失并且肿瘤标志物水平正常化。所有淋巴结的大小都必须是非病态的(短轴<10mm)。
非CR/非PD:一个或多个非靶标病变的持续存在和/或肿瘤标志物水平维持在正常范围以上。
进展性疾病(PD):现有非靶标病变的明确进展(强调原始情况)。一个或多个新病变的出现也被认为是进展。为了在非靶标疾病的基础上实现“明确的进展”,必须存在非靶标疾病的总体水平的实质性恶化,使得即使在靶标疾病中存在SD或PR的情况下,总体肿瘤负担也已增加至足以值得停止治疗。一个或多个非靶标病变的大小的适度“增加”通常不足以符合明确的进展状态。因此,仅基于面对靶标疾病的SD或PR的非靶标疾病的变化来指定总体进展将是极为罕见的。
急性白血病治疗反应的临床上可接受的标准如下:
完全缓解(CR):患者必须没有与白血病有关的所有症状,并且中性粒细胞绝对计数≥1.0x10
血液计数未完全恢复的完全缓解(Cri):根据CE,但有残余血小板减少症(血小板计数<100x10
部分缓解(PR):骨髓母细胞减少≥50%至骨髓中异常细胞减少5%至25%;如果存在棒状小体,则CR母细胞≤5%。
治疗失败:治疗未能达到CR、Cri或PR。复发。
确诊为CR后复发:外周血中重新出现白血病母细胞或骨髓中重新出现≥5%的母细胞而不归因于任何其他原因(例如,联合治疗后的骨髓再生),或出现新的发育异常变化。
“化学治疗剂”是指用于治疗癌症的药物。化学治疗剂包括但不限于小分子、激素和激素类似物以及生物制剂(例如,抗体、肽药物、核酸药物)。在某些实施方案中,化学治疗不包括激素和激素类似物。
“化学治疗方案”是用于治疗癌症的临床上可接受的剂量方案,包括按特定的时间表以特定的量向受试者给药一种或多种化学治疗剂。在某些实施方案中,化学治疗剂可以是临床试验中的药剂。
化学治疗方案可以包括按预确定的“周期”给药药物,其包括配量和不配量一种或多种用于治疗癌症的药剂的间隔。例如,可以连续三周每周一次或多次给药药剂,然后一周不给药药剂,从而提供四周的周期。可以重复该周期,使得受试者接受所需周期数的三个治疗周一个不治疗周、三个治疗周一个不治疗周等。在某些实施方案中,在每个周期或每隔一个周期结束时评估疗效和实验室值(例如,肝酶、血细胞计数、肾功能)。
如本文所使用的,“免疫治疗剂”是指诱导或增强免疫反应的药学上可接受的化合物、组合物或治疗。免疫治疗剂包括但不限于免疫检查点调节剂,Toll样受体(TLR)激动剂、基于细胞的治疗、细胞因子和癌症疫苗。
如本文所使用的,“免疫检查点”或“免疫检查点分子”是免疫系统中调节信号的分子。免疫检查点分子可以是刺激性检查点分子,即增加信号,或者是抑制性检查点分子,即减少信号。如本文所使用的,“刺激性检查点分子”是免疫系统中增加信号或具有共刺激性的分子。如本文所使用的,“抑制性检查点分子”是免疫系统中减少信号或具有共抑制性的分子。
如本文所使用的,“免疫检查点调节剂”是能够改变受试者中免疫检查点的活性的药剂。在某些实施方案中,免疫检查点调节剂改变一种或多种免疫检查点分子的功能,包括但不限于CD27、CD28、CD40、CD122、OX40、GITR、ICOS、4-1BB、ADORA2A、B7-H3、 B7-H4、BTLA、CTLA-4、IDO、KIR、LAG-3、PD-1、PD-L1、PD-L2、TIM-3和VISTA。免疫检查点调节剂可以是免疫检查点的激动剂或拮抗剂。在一些实施方案中,免疫检查点调节剂是免疫检查点结合蛋白(例如,抗体、抗体Fab片段、二价抗体、抗体药物缀合物、 scFv、融合蛋白、二价抗体或四价抗体)。在其他实施方案中,免疫检查点调节剂是小分子。在特定的实施方案中,免疫检查点调节剂是抗PD1、抗PD-L1或抗CTLA-4结合蛋白,例如抗体或抗体片段。
如本文所使用的,术语“增加”(或“活化”)和“减少”是指相对于参考物分别引致参数的或多或少的量、功能或活性的调节。例如,在给药本文所述的UBE2K抑制剂(例如 UBE2K的特异性抑制剂)之后,受试者中的参数(例如肿瘤大小、癌细胞增殖或癌细胞死亡)可以相对于给药前的参数量或相对于未给药UBE2K抑制剂的受试者或癌细胞增加或减少至少5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、 65%、70%、75%、80%、85%、90%、95%或98%或更多。通常,在给药后给药具有所述作用的时间(例如,在开始治疗方案后至少一天、一周、一个月、3个月、6个月)测量度量。另外,可以相对于未给药UBE2K抑制剂(例如UBE2K的特异性抑制剂)的癌细胞或受试者来测量度量。类似地,临床前参数(诸如体外癌细胞的死亡或增殖和/或通过本文所述的UBE2K抑制剂引起的UBE2K活性降低)可以相对于给药UBE2K抑制剂(例如UBE2K的特异性抑制剂)之前的参数量或相对于未经UBE2K抑制剂(例如UBE2K的特异性抑制剂)治疗的癌细胞或UBE2K酶增加或减少至少5%、10%、15%、20%、25%、 30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或98%或更多。
如本文所使用的,UBE2K的表达或活性的降低应理解为包括基因和/或蛋白质的表达或活性的改变。在实施方案中,表达或活性降低至少约10%、20%、30%、40%、50%、60%、70%、75%、80%、85%、90%、95%或99%。
如本文所使用的,“核酸”UBE2K抑制剂是引起UBE2K的表达和/或活性降低的任何基于核酸的抑制剂。在某些实施方案中,核酸抑制剂通过与来自对应基因的RNA转录物(UBE2K)的至少一部分杂交以引致UBE2K表达降低来起作用。核酸抑制剂包括例如单链核酸分子(例如反义核酸)和双链核酸(诸如siRNA、shRNA、dsiRNA)(参见,例如,美国专利公开号US2007/0104688)。如本文所使用的,双链核酸分子被设计为在至少12 个、优选至少15个核苷酸上是双链的。双链核酸分子可以是被设计为与其自身杂交的单核酸链,例如shRNA。应当理解,核酸抑制剂可以作为分离的核酸来给药。替代地,可以将核酸抑制剂作为表达构建体给药以在细胞中产生抑制剂。在某些实施方案中,核酸抑制剂包括一种或多种化学修饰以改善核酸抑制剂的活性和/或稳定性。这样的修饰在本领域中是众所周知的。使用的具体修饰将取决于例如核酸抑制剂的类型。在某些实施方案中,核酸UBE2K抑制剂是UBE2K的特异性抑制剂,即除了UBE2K以外不降低其他基因或蛋白质的表达或活性。
如本文所使用的,“小分子”UBE2K抑制剂是分子量小于1000Da、优选小于750Da 或优选小于500Da的UBE2K抑制剂分子。在某些实施方案中,“小分子”是合成有机化合物,并且不包括核酸分子。在某些实施方案中,“小分子”是合成的有机化合物,并且不包括长度超过三个氨基酸的肽。“小分子”UBE2K抑制剂是与UBE2K特异性结合并且至少部分抑制UBE2K的分子。在某些实施方案中,小分子UBE2K抑制剂是UBE2K的特异性抑制剂,即除了UBE2K以外,不显著降低其他基因或蛋白质的表达或活性。例如,在一些实施方案中,小分子UBE2K抑制剂不降低活化的B细胞的核因子κ轻链增强子(NFκB) 的活性。
如本文所使用的,术语“受试者”是指人类和非人类动物,包括兽医学受试者。术语“非人类动物”包括所有脊椎动物,例如哺乳动物和非哺乳动物,诸如非人类灵长类、小鼠、兔子、绵羊、狗、猫、马、牛、鸡、两栖动物和爬行动物。在优选的实施方案中,受试者是人类并且可以被称为患者。
“治疗有效量”是足以在受试者中治疗疾病的量。治疗有效量可以以一次或多次给药来给药。
如本文所使用的,术语“治疗(treat)”、“治疗(treating)”或“治疗(treatment)”优选地是指获得有益的或期望的临床结果的动作,包括但不限于:减轻或改善疾病或病症的一种或多种迹象或症状(例如,部分或完全消退),减轻疾病的程度,状态疾病的稳定性(即,不恶化,实现稳定的疾病),改善或减轻疾病状态,减缓进展的速度或时间,以及缓解(部分或总体)。与未治疗时的预期生存相比,癌症的“治疗”还可能意味着生存期的延长。治疗不一定是治愈性的。在某些实施方案中,治疗包括由合格的个体(例如治疗医师)判断的疼痛减轻或生活质量(QOL)提高(例如使用可接受的疼痛和QOL评估工具来判断)中的一项或多项。在某些实施方案中,由合格的个体(例如治疗医师)判断的疼痛减轻或生活质量(QOL)提高(例如使用可接受的疼痛和QOL评估工具来判断)不被认为是对癌症的“治疗”。
除非另有相反的明确指示,否则冠词“一(a)”、“一(an)”和“该(the)”在本文中用于指代该冠词的语法对象的一个或多于一个(即,至少一个)。举例来说,“要素”是指一个要素或多于一个的要素。
术语“包括”在本文中用来表示短语“包括但不限于”,并且可以与该短语互换使用。
除非上下文另有明确指示,否则术语“或”在本文中用来表示术语“和/或”,并且可以与其互换使用。
术语“诸如”在本文中用来表示短语“诸如但不限于”,并且可以与该短语互换使用。
除非特别说明或从上下文中显而易见,否则如本文所使用的,术语“约”应理解为在本领域的正常公差范围内,例如在平均值的2个标准偏差之内。约可以理解为在所述值的10%、9%、8%、7%、6%、5%、4%、3%、2%、1%、0.5%、0.1%、0.05%或0.01%内。除非从上下文中显而易见,否则本文提供的所有数值均可以用术语约来修饰。
本文提供的范围应理解为该范围内所有值的简写。例如,1到50的范围应理解为包括由1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、 22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、 42、43、44、45、46、47、48、49或50组成的组中的任何数字、数字的组合或子范围。
本文对变量的任何定义中的一个或多个化学基团的列举的叙述包括将该变量定义为任何单个基团或所列基团的组合。本文中对变量或方面的实施方案的叙述包括该实施方案作为任何单个实施方案或与任何其他实施方案或其部分的组合。
本文提供的任何组合物或方法可以与本文提供的任何其他组合物和方法中的一个或多个组合,包括但不限于配量速率、配量时间、配量的量、治疗方法、监测方法和选择方法的组合。
II.UBE2K
UBE2K是泛素依赖性蛋白水解的组分,负责蛋白质降解。泛素依赖性蛋白水解利用泛素活化酶(E1)、泛素缀合酶(E2)和泛素连接(E3)酶,这些酶依次活化、转移和连接泛素(Ub)到靶标蛋白的赖氨酸残基上。在该级联反应的中间步骤中,泛素在其C末端羧酸酯与E2酶中的催化半胱氨酸之间形成共价硫酯复合物(E2~Ub)。然后,通过充当支架蛋白的RINGE3连接酶或在底物标记之前与泛素形成另外的共价硫酯复合物的 HECT E3连接酶来介导向底物的转移。该过程的重复循环使用在泛素上发现的七个可用赖氨酸残基中的一个或多个残基(即K6、K11、K27、K29、K33、K48和/或K63)来形成聚泛素链。参见Cook等人,2015,《公共科学图书馆期刊(PLoS ONE)》10(3):e0120318。
UBE2K是该泛素蛋白酶体系统的蛋白组分,并且被很好地表征为负责各种蛋白质泛素化的酶。它也被称为亨廷顿(Huntington)相互作用蛋白2(HIP2)。UBE2K是泛素系统的大约50种E2酶中的一种,它是一种25kDa的蛋白质。人UBE2K氨基酸和核酸序列在本文中分别提供为SEQ ID NO:1和SEQ ID NO:2。UBE2K的功能是从E1酶接受泛素部分,并且经由硫酯键将它们共价键合到其他蛋白质底物上,从而标记它们被蛋白酶体降解。还已知它与泛素非共价地相互作用。已知它可合成Lys 48键合的聚泛素链,并且是 III类E2家族的成员。它在其他E2之中是唯一的,因为除了保守的UBC结构域之外,它还具有C末端泛素相关(UBA)结构域。据报告,UBE2K的UBA结构域指导聚泛素链键合中的特异性。它还增加了Lys 48键合的聚泛素链合成的进行性。使用酵母双杂交筛选,发现UBE2K与几种无名指蛋白相互作用。还发现RNF2的无名指结构域对于UBE2K的识别是必不可少的,并且RNF2起到了E3连接酶的作用。另外,UBE2K具有独立于E3 连接酶泛素化底物的能力。体外泛素化测定表明,UBC结构域中活性位点半胱氨酸残基的突变会损害UBE2K产生单泛素链或聚泛素链的能力。
尽管关于癌症中泛素蛋白酶体系统的文献很多,但有关特定E2酶的作用的报告却很少。重要的是,据报告,UBE2K与两种相关的肿瘤抑制因子协同作用,以调节与癌症相关的表型。UBE2K与BRCA1相互作用,并且泛素化G2/M细胞周期蛋白——细胞周期蛋白B1和cdc25,从而影响增殖,而BRCA1在这种情况下充当E3连接酶。另外,已经表明通过使用MDM2作为E3连接酶,UBE2K可泛素化p53,并促进其降解。
可以通过以下操作测定UBE2K活性:将UBE2K酶与荧光标记的泛素一起温育,然后对泛素化复合物进行SDS-PAGE。例如,可以在含有荧光标记的泛素的缓冲液中温育UBE2K,然后添加乙酸镁和ATP。可以通过添加2.5μl的10%(w/v)SDS终止反应,并且在75℃下加热6分钟。然后在不存在任何硫醇的情况下对样品进行SDS-PAGE。用于测定UBE2K活性的方法在例如Cook等人,2015,《公共科学图书馆期刊(PLoS ONE)》 10(3):e0120318;Middleton等人,《科学报告(Sci.Rep.)》(5):16793;以及Strickson等人,2013,《生物化学杂志(BiochemJournal)》451:427-437中有描述,其中的每一个通过整体引用并入本文。
III.UBE2K抑制剂
如本文所使用的,UBE2K抑制剂是指通过减少该酶的表达和/或活性(例如减少至少 2倍、至少3倍、至少4倍、至少5倍、至少6倍、至少7倍、至少8倍、至少9倍、至少10倍、至少20倍、至少30倍、至少50倍、至少75倍或至少100倍等;或者UBE2K 表达和/或活性减少至少约10%、20%、30%、40%、50%、60%、70%、75%、80%、85%、 90%、95%或99%)来部分或完全抑制该酶的小分子化合物(即合成有机化合物)、核酸 (例如反义、siRNA、shRNA、dsiRNA等)、蛋白质或抗体(例如,与UBE2K酶特异性结合的蛋白质或抗体)。如本文所使用的,“UBE2K抑制剂”可以通过任何机制起作用,例如通过在RNA或蛋白水平上抑制UBE2K的表达;或通过抑制UBE2K的活性,例如通过抑制泛素加载到UBE2K上。在优选的实施方案中,UBE2K抑制剂是UBE2K的特异性抑制剂,即基本上不减少UBE2K以外的多肽的表达或活性。在一些实施方案中,与一种或多种不同的E2蛋白(非UBE2K)相比,UBE2K特异性抑制剂优先抑制UBE2K至少5 倍、至少10倍、至少20倍、至少30倍、至少50倍、至少75倍、至少100倍、至少500 倍或至少1000倍。在一些实施方案中,被抑制的UBE2K是人UBE2K。在一些实施方案中,UBE2K抑制剂不减少活化的B细胞的核因子κ轻链增强子(NFκB)的活性。在一些实施方案中,UBE2K抑制剂不减少除UBE2K之外的其他E2酶的表达或活性。
可以使用本领域已知的方法标识UBE2K抑制剂。例如,可以通过在体外用假定的UBE2K抑制剂处理细胞并测量其对UBE2K表达(例如mRNA或蛋白质表达)的影响来标识减少UBE2K表达的化合物。UBE2K的蛋白质水平可以通过本领域已知的合适技术来测量,包括ELISA或蛋白印迹(Western blot)。可以使用本领域已知的合适技术来测量 UBE2K核酸(例如mRNA)的水平,包括聚合酶链反应(PCR)扩增反应、逆转录酶PCR 分析、定量实时PCR、单链构象多态性分析(SSCP)、错配切割检测、异源双链分析、RNA 印迹分析、原位杂交、阵列分析、脱氧核糖核酸测序、限制性片段长度多态性分析及其组合或亚组合。
也可以使用本领域已知的方法(诸如上述方法)通过测量其对UBE2K活性的影响来标识UBE2K抑制剂。例如,可以将假定的UBE2K抑制剂与UBE2K酶和荧光标记的泛素一起温育以确定该假定的抑制剂是否阻止UBE2K酶的泛素化。温育后,将样品进行 SDS-PAGE,并且检测到泛素/UBE2K复合物。
小分子UBE2K抑制剂包括(E)3-[(4-甲苯基)磺酰基]-2-丙烯腈(BAY 11-7082)。该化合物已显示出抑制泛素加载到E2缀合酶(诸如UBE2K)上。参见Strickson等人,2013,《生物化学杂志(Biochem Journal)》451:427-437,其通过整体引用并入本文。BAY11-7082 在例如US 2005/0124590和US 2009/0082371中有描述,其中的每一个通过整体引用并入本文。BAY 11-7082的化学结构提供如下。
BAY 11-7082
在一些实施方案中,UBE2K抑制剂不包含BAY 11-7082。在一些实施方案中,UBE2K抑制剂不包含小分子。
在一些实施方案中,UBE2K抑制剂(例如UBE2K的特异性抑制剂)是核酸。核酸抑制剂是本领域众所周知的。核酸抑制剂包括与细胞中的靶标序列互补的单链和双链核酸(即,具有长度为至少15个核苷酸的互补区的核酸)。核酸可以递送至培养基中的细胞,例如,通过将核酸单独地或与促进核酸吸收到细胞中的药剂一起添加至培养基中来递送。核酸可以通过任何给药途径递送至受试者中(即体内)的细胞。具体制剂将取决于给药途径。
如本文所使用的,并且除非另有指示,否则如本领域技术人员将理解的,术语“互补”在用于描述与第二核苷酸序列有关的第一核苷酸序列时是指包含第一核苷酸序列的寡核苷酸或多核苷酸在特定条件下与包含第二核苷酸序列的寡核苷酸或多核苷酸杂交并形成双链体结构的能力。此类条件可以是例如严格条件,其中严格条件可以包括:400mMNaCl、40mM PIPES pH 6.4、1mM EDTA,50℃或70℃持续12-16小时,然后洗涤。可以应用其他条件,诸如生物体内可能遇到的生理相关条件。技术人员将能够根据杂交核苷酸的最终应用来确定最适合于测试两个序列的互补性的一组条件。
当在第一核苷酸序列和第二核苷酸序列的整个长度上第一核苷酸序列的核苷酸与第二核苷酸序列的核苷酸存在碱基配对时,序列可以相对于每个序列“完全互补”。然而,在本文中第一序列被称为相对于第二序列“基本互补”的情况下,这两个序列可以完全互补,或者它们在杂交时可以形成一个或多个(但基本上不超过4个、3个或2个)错配碱基对,同时保留在与它们的最终应用最相关的条件下进行杂交的能力。然而,当两个寡核苷酸被设计为在杂交时形成一个或多个单链突出端时,如双链核酸治疗剂中常见的那样,就确定互补性而言,此类突出端不应视为错配。例如,出于本文描述的目的,包含一个长度为 21个核苷酸的寡核苷酸和另一个长度为23个核苷酸的寡核苷酸的dsRNA——其中较长的寡核苷酸包含与较短的寡核苷酸完全互补的21个核苷酸的序列——也可以成为“完全互补”。
就满足上述关于其杂交能力的要求而言,如本文所使用的,“互补”序列还可以包括或完全形成自非Watson-Crick碱基对和/或由非天然和修饰核苷酸形成的碱基对。这样的非 Watson-Crick碱基对包括但不限于G:U Wobble或Hoogstein碱基对。
就dsRNA的有义链和反义链之间、或dsRNA的反义核酸或反义链与靶标序列之间的碱基匹配而言,如从其使用的上下文中将理解的,本文中可以使用术语“互补”、“完全互补”和“基本上互补”。
如本文所使用的,与信使RNA(mRNA)“的至少一部分基本上互补”的多核苷酸是指与感兴趣的mRNA(例如,编码HSP90、尤其是HSP90β的mRNA)的连续部分基本上互补的多核苷酸,其包括5’UTR、开放阅读框架(ORF)或3’UTR。例如,如果序列与编码UBE2K的mRNA的非中断部分基本上互补,则多核苷酸与UBE2K mRNA的至少一部分互补。
例如,在涉及化学修饰的含RNA的治疗化合物的美国专利号5,898,031以及涉及使用这些化合物作为治疗剂的方法的美国专利号6,107,094中提供了涉及反义核酸、化学修饰和治疗用途的专利。美国专利号7,432,250涉及通过给药单链化学修饰的RNA样化合物来治疗患者的方法;而美国专利号7,432,249涉及含有单链化学修饰的RNA样化合物的药物组合物。美国专利号7,629,321涉及使用具有多个RNA核苷和至少一种化学修饰的单链寡核苷酸来切割靶标mRNA的方法。该段中列出的每项专利均通过引用并入本文。
核酸抑制剂可以包括天然碱基(即A、G、U、C或T)或修饰碱基(7-脱氮杂鸟苷、肌苷等)。另外,核苷酸中的碱基可以通过磷酸二酯键以外的键合连接,只要不干扰杂交即可。因此,抑制性核酸可以是肽核酸,其中组成碱基通过肽键而不是磷酸二酯键合。抑制性核酸可以通过使用已知方法将RNA转化为cDNA来制备(参见,例如,Ausubel等人,《分子生物学的最新方案(Current Protocols in Molecular Biology)》Wiley 1999)。抑制性核酸也可以是cRNA(参见,例如,Park等人,(2004)《生物化学与生物物理研究通讯(Biochem.Biophys.Res.Commun.)》325(4):1346-52)。
核酸抑制剂可以由合成方法生产,诸如亚磷酰胺方法、H-膦酸酯方法和亚磷酸三酯方法。抑制性核酸也可以通过PCR方法产生。这样的方法产生与mRNA互补的cDNA和 cRNA序列。合成治疗性核酸的方法不是对本发明的限制。
核酸抑制剂通常包括一种或多种化学修饰,以改善其稳定性并调节其药代动力学和药效学性质。例如,对核苷酸的修饰可以包括但不限于LNA、HNA、CeNA、2′-甲氧乙基、 2′-O-烷基、2′-O-烯丙基、2′-C-烯丙基、2′-氟代、2′-脱氧、2’-羟基及其组合。
核酸抑制剂还可以包含至少一个硫代磷酸酯或甲基膦酸酯核苷酸间键合。硫代磷酸酯或甲基膦酸酯的核苷酸间键合修饰可以发生在有义链或反义链的任何核苷酸上,或在链的任何位置上都存在于这两个链上(在包括有义链的核酸治疗剂中)。例如,核苷酸间键合修饰可以发生在有义链或反义链的每个核苷酸上;每个核苷酸间键合修饰可以在有义链或反义链上以交替的模式发生;或者有义链或反义链可以以交替的模式包含这两种核苷酸间键合修饰。有义链上的核苷酸间键合修饰的交替模式可以与反义链相同或不同,并且有义链上的核苷酸间键合修饰的交替模式可以相对于反义链上的核苷酸间键合修饰的交替模式偏移。
其他修饰包括并入修饰的碱基(或修饰的核苷或修饰的核苷酸),这些碱基是核糖核酸(即A、C、G和U)和脱氧核糖核酸(即A、C、G和T)中出现的标准碱基、糖和/ 或磷酸酯主链化学结构的变体。在该范围内包括例如:Gm(2'-甲氧基鸟苷酸)、Am(2'- 甲氧基腺苷酸)、Cf(2'-氟胞苷酸)、Uf(2'-氟尿苷酸)、Ar(核糖腺苷酸)。适体还可以包括胞嘧啶或任何胞嘧啶相关的碱基,包括5-甲基胞嘧啶、4-乙酰胞嘧啶、3-甲基胞嘧啶、 5-羟甲基胞嘧啶、2-巯基胞嘧啶、5-卤代胞嘧啶(例如,5-氟代胞嘧啶、5-溴代胞嘧啶、5- 氯代胞嘧啶和5-碘代胞嘧啶)、5-丙炔基胞嘧啶、6-偶氮胞嘧啶、5-三氟甲基胞嘧啶、N4,N4- 乙醇胞嘧啶、吩噁嗪胞苷、吩噻嗪胞苷、咔唑胞苷或吡啶吲哚胞苷。适体还可以包括鸟嘌呤或任何鸟嘌呤相关的碱基,包括6-甲基鸟嘌呤、1-甲基鸟嘌呤、2,2-二甲基鸟嘌呤、2- 甲基鸟嘌呤、7-甲基鸟嘌呤、2-丙基鸟嘌呤、6-丙基鸟嘌呤、8-卤代鸟嘌呤(例如,8-氟代鸟嘌呤、8-溴代鸟嘌呤、8-氯代鸟嘌呤和8-碘代鸟嘌呤)、8-氨基鸟嘌呤、8-巯基鸟嘌呤、 8-硫代烷基鸟嘌呤、8-羟基鸟嘌呤、7-甲基鸟嘌呤、8-氮杂鸟嘌呤、7-脱氮杂鸟嘌呤或3- 脱氮杂鸟嘌呤。适体还可以包括腺嘌呤或任何与腺嘌呤有关的碱基,包括6-甲基腺嘌呤、 N6-异戊烯腺嘌呤、N6-甲基腺嘌呤、1-甲基腺嘌呤、2-甲基腺嘌呤、2-甲硫基-N6-异戊烯腺嘌呤、8-卤代腺嘌呤(例如,8-氟代腺嘌呤、8-溴代腺嘌呤、8-氯代腺嘌呤和8-碘代腺嘌呤)、8-氨基腺嘌呤、8-巯基腺嘌呤、8-硫代烷基腺嘌呤、8-羟基腺嘌呤、7-甲基腺嘌呤、 2-卤代腺嘌呤(例如,2-氟代腺嘌呤、2-溴代腺嘌呤、2-氯代腺嘌呤和2-碘代腺嘌呤)、2- 氨基腺嘌呤、8-氮杂腺嘌呤、7-脱氮杂腺嘌呤或3-脱氮杂腺嘌呤。还包括尿嘧啶或任何与尿嘧啶相关的碱基,包括5-卤代尿嘧啶(例如,5-氟代尿嘧啶、5-溴代尿嘧啶、5-氯代尿嘧啶、5-碘代尿嘧啶)、5-(羧基羟甲基)尿嘧啶、5-羧甲基氨基甲基-2-硫代尿嘧啶、5-羧甲基氨基甲基尿嘧啶、二氢尿嘧啶、1-甲基假尿嘧啶、5-甲氧基氨基甲基-2-硫代尿嘧啶、5'- 甲氧基羰基甲基尿嘧啶、5-甲氧基尿嘧啶、5-甲基-2-硫代尿嘧啶、2-硫代尿嘧啶、4-硫代尿嘧啶、5-甲基尿嘧啶、尿嘧啶-5-氧乙酸甲酯、尿嘧啶-5-氧乙酸、假尿嘧啶、5-甲基-2- 硫代尿嘧啶、2-硫代尿嘧啶、3-(3-氨基-3-N-2-羧丙基)尿嘧啶、5-甲基氨基甲基尿嘧啶、5- 丙炔基尿嘧啶、6-偶氮尿嘧啶或4-硫代尿嘧啶。
本领域已知的其他修饰的碱基变体的实例包括但不限于,例如,4-乙酰基胞苷、5-(羧基羟甲基)尿苷、2'-甲氧基胞苷、5-羧甲基氨基甲基-2-硫代吡啶、5-羧甲基氨基甲基尿苷、二氢尿苷、2'-O-甲基假尿苷、b-D-半乳糖基肌苷、肌苷、N6-异戊烯基腺苷、1-甲基腺苷、1-甲基假尿苷、1-甲基鸟苷、1-甲基肌苷、2,2-二甲基鸟苷、2-甲基腺苷、2-甲基鸟苷、3- 甲基胞苷、5-甲基胞嘧啶、N6-甲基腺苷、7-甲基鸟苷、5-甲基氨基甲基尿苷、5-甲氧基氨基甲基-2-硫代尿苷、b-D-甘露糖基肌苷、5-甲氧基羰基甲基尿苷、5-甲氧基尿苷、2-甲硫基-N6-异戊烯基腺苷、N-((9-bD-呋喃核糖基-2-甲硫基嘌呤-6-基)氨基甲酰基)苏氨酸、 N-((9-b-D-呋喃核糖基嘌呤-6-基)N-甲基-氨基甲酰基)苏氨酸、尿嘧啶-5-氧乙酸甲酯、尿苷 -5-氧乙酸(v)、怀丁氧苷(wybutoxosine)、假尿苷、queosine、2-硫代胞苷、5-甲基-2-硫代尿苷、2-硫代尿苷、4-硫代尿苷、5-甲基尿苷、N-((9-b-D-呋喃核糖基嘌呤-6-基)氨基甲酰基)苏氨酸、2'-O-甲基-5-甲基尿苷、2'-O-甲基尿苷和怀丁苷、3-(3-氨基-3-羧丙基)尿苷。
还包括美国专利号3,687,808、3,687,808、4,845,205、5,130,302、5,134,066、5,175,273、 5,367,066、5,432,272、5,457,187、5,459,255、5,484,908、5,502,177、5,525,711、5,552,540、 5,587,469、5,594,121、5,596,091、5,614,617、5,645,985、5,830,653、5,763,588、6,005,096 和5,681,941中描述的修饰的核苷碱基,其中的每一个通过整体引用并入本文。本领域已知的修饰的核苷和核苷酸糖主链变体的实例包括但不限于具有例如2'核糖基取代基的那些,诸如F、SH、SCH
反义核酸治疗剂是单链核酸治疗剂,通常长约16至30个核苷酸,并且与培养或生物体中的靶标细胞中的靶标核酸序列互补。
在另一方面,该药剂是单链反义RNA分子。反义RNA分子与靶标mRNA内的序列互补。反义RNA可以通过与mRNA碱基配对并在物理上阻碍翻译机制而以化学计量的方式抑制翻译,参见Dias,N.等人,(2002)《分子癌症治疗(Mol Cancer Ther)》1:347-355。反义RNA分子可以具有与靶标mRNA互补的约15-30个核苷酸。例如,反义RNA分子可以具有与靶标mRNA互补的至少15、16、17、18、19、20或更多个连续核苷酸的序列。
例如,在涉及化学修饰的含RNA的治疗化合物的美国专利号5,898,031以及涉及使用这些化合物作为治疗剂的方法的美国专利号6,107,094中提供了涉及反义核酸、化学修饰和治疗用途的专利。美国专利号7,432,250涉及通过给药单链化学修饰的RNA样化合物来治疗患者的方法;而美国专利号7,432,249涉及含有单链化学修饰的RNA样化合物的药物组合物。美国专利号7,629,321涉及使用具有多个RNA核苷和至少一种化学修饰的单链寡核苷酸来切割靶标mRNA的方法。本段中列出的每项专利的全部内容均通过引用并入本文。
核酸抑制剂还包括双链核酸。如本文可互换使用的,“RNAi剂”、“双链RNAi剂”、双链RNA(dsRNA)分子(也称为“dsRNA剂”、“dsRNA”、“siRNA”、“iRNA剂”)是指核糖核酸分子的复合物,其具有双链体结构,该双链体结构包含两条反平行且基本互补的核酸链,如下文所定义。如本文所使用的,RNAi剂还可以包括dsiRNA(参见,例如,美国专利公开文件20070104688,其通过引用并入文本)。通常,每条链的大部分核苷酸是核糖核苷酸,但是如本文所述,每条链或两条链也可以包含一个或多个非核糖核苷酸,例如脱氧核糖核苷酸和/或修饰的核苷酸。另外,如本说明书中所使用的,“RNAi剂”可以包括具有化学修饰的核糖核苷酸;RNAi剂可以在多个核苷酸上包含大量修饰。这样的修改可以包括本文公开的或本领域已知的所有类型的修饰。出于本说明书和权利要求书的目的,“RNAi剂”涵盖了用于siRNA类型分子的任何此类修饰。
形成双链体结构的两条链可以是一个较大的RNA分子的不同部分,也可以是分开的 RNA分子。如果两条链是一个较大分子的一部分,并且因此通过一条链的3'端与另一条链的5'端之间的不间断的核苷酸链连接而形成双链体结构,则连接RNA链被称为“发夹循环”。如果两条链是通过一条链的3'端与相应的另一条链的5'端之间的不间断的核苷酸链以外的方式共价连接而形成双链体结构,则该连接结构被称为“接头”。RNA链可以具有相同或不同数量的核苷酸。碱基对的最大数量是dsRNA最短链中的核苷酸数量减去双链体中存在的任何突出端。除双链体结构外,RNAi剂还可以包含一个或多个核苷酸突出端。术语“siRNA”在本文中也用于指代如上所述的RNAi剂。
在许多实施方案中,双链体区的长度为15-30个核苷酸对。在一些实施方案中,双链体区的长度为17-23个核苷酸对,长度为17-25个核苷酸对,长度为23-27个核苷酸对,长度为19-21个核苷酸对,或长度为21-23个核苷酸对。
在某些实施方案中,每条链具有15-30个核苷酸。
用于本发明方法的RNAi剂包括具有化学修饰的药剂,例如,如于2011年11月18 日提交的美国临时申请号61/561,710、于2010年9月15日提交的国际申请号 PCT/US2011/051597以及PCT公开文件WO 2009/073809中所公开的,其中的每一个的全部内容通过引用并入本文。术语“反义链”是指双链RNAi剂的链,其包含与靶标序列(例如,人TTR mRNA)基本互补的区。如本文所使用的,术语“与编码运甲状腺素蛋白的mRNA 的一部分互补的区”是指反义链上与TTR mRNA序列的一部分基本互补的区。在互补区与靶标序列不完全互补的情况下,错配在末端区中最能被容忍,并且如果存在,则通常在一个或多个末端区中,例如,在5'和/或3'末端的6、5、4、3或2个核苷酸内。
如本文所使用的,术语“有义链”是指dsRNA的链,其包含与反义链的区基本互补的区。
在一些实施方案中,减少UBE2K的表达或活性的抑制剂是抗体。本发明的治疗方法可以包括使用抗体,包括多克隆和单克隆抗体。如本文所使用的,术语“单克隆抗体”或“单克隆抗体组合物”是指仅包含一种能够与特定表位免疫反应的抗原结合位点的抗体分子群。在一些实施方案中,用于本文描述的方法的抗体特异性结合UBE2K,即不结合 UBE2K以外的其他多肽。抗体可以从商业来源获得或使用已知方法生产。
多克隆抗体可以通过用本发明的蛋白质作为免疫原使合适的受试者免疫来制备。可以通过标准技术随时间推移监测免疫对象的抗体滴度,诸如使用固定化多肽利用酶联免疫吸附测定(ELISA)进行监测。在免疫后的适当时间,例如,当特异性抗体滴度最高时,可以从受试者获得产生抗体的细胞,并将所述产生抗体的细胞用于通过标准技术(诸如最初由Kohler和Milstein(1975)《自然(Nature)》256:495-497描述的杂交瘤技术)、人B细胞杂交瘤技术(参见Kozbor等人,1983,《今日免疫学(Immunol.Today 4:72)》)、EBV杂交瘤技术(参见Cole等人,《单克隆抗体与癌症治疗(Monoclonal Antibodies and Cancer Therapy)》第77-96页,Alan R.Liss,Inc.,1985)或三源杂交瘤技术来制备单克隆抗体 (mAb)。用于产生杂交瘤的技术是众所周知的(一般参见《免疫学最新方案(Current Protocols inImmunology)》,Coligan等人编辑,John Wiley&Sons,纽约,1994)。通过筛选杂交瘤培养物上清液中结合感兴趣的多肽的抗体(例如使用标准ELISA测定)来检测产生本发明的单克隆抗体的杂交瘤细胞。
作为制备分泌单克隆抗体的杂交瘤的替代方案,可以通过用感兴趣的多肽筛选重组组合免疫球蛋白库(例如,抗体噬菌体展示库)来标识和分离针对本发明蛋白质的单克隆抗体。用于产生和筛选噬菌体展示库的试剂盒是可商购的(例如,Pharmacia重组噬菌体抗体系统,目录号27-9400-01;以及Stratagene SurfZAP噬菌体展示试剂盒,目录号240612)。另外,特别适合用于产生和筛选抗体展示库的方法和试剂的实例可见于,例如,美国专利号5,223,409;PCT公开号WO 92/18619;PCT公开号WO 91/17271;PCT公开号WO 92/20791;PCT公开号WO 92/15679;PCT公开号WO 93/01288;PCT公开号WO 92/01047; PCT公开号WO 92/09690;PCT公开号WO 90/02809;Fuchs等人(1991)《生物技术 (Bio/Technology)》9:1370-1372;Hay等人(1992)《人源化抗体杂交瘤(Hum. Antibod.Hybridomas)》3:81-85;Huse等人(1989)《科学(Science)》246:1275-1281; Griffiths等人(1993)《欧洲分子生物学学会杂志(EMBO J.)》12:725-734。
特异性结合感兴趣的蛋白质(即UBE2K)的重组抗体也可以用于本发明的方法。在优选的实施方案中,重组抗体特异性结合感兴趣的蛋白质(即UBE2K)或其片段。重组抗体包括但不限于嵌合和人源化单克隆抗体(包括人类和非人类部分)、单链抗体以及多特异性抗体。嵌合抗体是这样的分子,其中不同的部分衍生自不同的动物物种,诸如具有源自鼠mAb的可变区和人免疫球蛋白恒定区的那些。(参见,例如,Cabilly等人,美国专利号4,816,567;以及Boss等人,美国专利号4,816,397,其通过整体引用并入本文。)单链抗体具有抗原结合位点并且包括单个多肽。它们可以通过本领域已知的技术来生产,例如使用以下文献中描述的方法:Ladner等人美国专利号4,946,778(其通过整体引用并入本文);Bird等人,(1988)《科学(Science)》242:423-426;Whitlow等人,(1991)《酶学方法(Methods inEnzymology)》2:1-9;Whitlow等人,(1991)《酶学方法(Methods in Enzymology)》2:97-105;以及Huston等人,(1991)《酶学分子设计与建模方法:概念与应用(Methods inEnzymology Molecular Design and Modeling:Concepts and Applications)》203:46-88。多特异性抗体是具有至少两个特异性结合不同抗原的抗原结合位点的抗体分子。这样的分子可以通过本领域已知的技术来产生,例如使用以下文献中描述的方法:Segal, 美国专利号4,676,980(其公开内容通过整体引用并入本文);Holliger等人,(1993)《美国国家科学院院刊(Proc.Natl.Acad.Sci.USA)》90:6444-6448;Whitlow等人,(1994)《蛋白质工程(Protein Eng.)》7:1017-1026以及美国专利号6,121,424。
人源化抗体是来自非人类物种的抗体分子,其具有来自非人类物种的一个或多个互补决定区(CDR)和来自人类免疫球蛋白分子的构架区。(参见,例如,Queen,美国专利号5,585,089,其通过整体引用并入本文。)人源化单克隆抗体可以通过本领域已知的重组DNA技术产生,例如使用以下文献中描述的方法:PCT公开号WO 87/02671;欧洲专利申请184,187;欧洲专利申请171,496;欧洲专利申请173,494;PCT公开号WO 86/01533;美国专利号4,816,567;欧洲专利申请125,023;Better等人(1988)《科学(Science)》 240:1041-1043;Liu等人(1987)《美国国家科学院院刊(Proc.Natl.Acad.Sci.USA)》 84:3439-3443;Liu等人(1987)《免疫学杂志(J.Immunol.)》139:3521-3526;Sun等人(1987) 《美国国家科学院院刊(Proc.Natl.Acad.Sci.USA)》84:214-218;Nishimura等人(1987) 《癌症研究(Cancer Res.)》47:999-1005;Wood等人(1985)《自然(Nature)》314:446-449;以及Shaw等人(1988)《国立癌症研究所杂志(J.Natl.Cancer Inst.)》80:1553-1559;Morrison(1985)《科学(Science)》229:1202-1207;Oi等人(1986)《生物技术 (Bio/Techniques)》4:214;美国专利5,225,539;Jones等人(1986)《自然(Nature)》 321:552-525;Verhoeyan等人(1988)《自然(Science)》239:1534;以及Beidler等人(1988) 《免疫学杂志(J.Immunol.)》141:4053-4060。
更特别地,例如,可以使用不能表达内源性免疫球蛋白重链和轻链基因但可以表达人重链和轻链基因的转基因小鼠来产生人源化抗体。用选择的抗原,例如对应于本发明标志物的全部或部分多肽,以正常方式使转基因小鼠免疫。可以使用常规杂交瘤技术获得针对抗原的单克隆抗体。转基因小鼠携带的人免疫球蛋白转基因在B细胞分化过程中会重新排列,并且随后进行类别转换和体细胞突变。因此,使用这种技术,可以产生治疗上有用的 IgG、IgA和IgE抗体。有关产生人抗体的这项技术的概述,参见Lonberg和Huszar(1995)《国际免疫学评论(Int.Rev.Immunol.)》13:65-93。对于产生人抗体和人单克隆抗体的这项技术以及产生此类抗体的方案的详细讨论,参见,例如,美国专利5,625,126;美国专利5,633,425;美国专利5,569,825;美国专利5,661,016;和美国专利5,545,806。另外,可以聘请公司使用与上述类似的技术来提供针对所选抗原的人抗体。
可以使用被称为“指导选择”的技术来产生识别选择的表位的完全人抗体。在这种方法中,使用选择的非人单克隆抗体(例如鼠抗体)来指导对识别相同表位的完全人抗体的选择(Jespers等人,1994,《生物技术(Bio/technology)》12:899-903)。
本发明的抗体可以在产生(例如,从受试者的血液或血清中产生)或合成后分离,并通过众所周知的技术进一步纯化。例如,可以使用蛋白A色谱法纯化IgG抗体。可以通过例如亲和色谱法来选择或纯化(例如,部分纯化)对本发明的蛋白质具有特异性的抗体。例如,如本文所述产生本发明的重组表达和纯化(或部分纯化)的蛋白质,并与固体支持物(诸如色谱柱)共价或非共价偶联。然后可以使用该柱从包含针对大量不同表位的抗体的样品中亲和纯化对本发明蛋白质具有特异性的抗体,从而产生基本上纯化的抗体组合物,即基本上不含污染抗体的抗体组合物。在本上下文中,基本上纯化的抗体组合物是指抗体样品含有至多仅30%(以干重计)的针对表位的污染抗体而不是本发明所需蛋白质的那些,并且样品的优选至多20%、更优选至多10%、以及最优选至多5%(以干重计)是污染抗体。纯化的抗体组合物是指组合物中至少99%的抗体针对本发明的所需蛋白质。
可以通过标准技术(诸如亲和色谱法或免疫沉淀法)将针对蛋白质(即UBE2K)的抗体用于分离蛋白质。此外,这种抗体可以用于检测靶标蛋白(例如UBE2K)或其片段 (例如,在细胞裂解液或细胞上清液中),以便评价靶标蛋白的表达水平和模式。抗体也可以作为临床测试程序的一部分用于诊断性地监测组织或体液(例如与疾病状态或与毒性状态相关的体液)中的蛋白质水平,例如,以确定给定治疗方案的功效。可以通过使用抗体衍生物来促进检测,该抗体衍生物包含本发明的与可检测物质偶联的抗体。可检测物质的实例包括各种酶、辅基、荧光材料、发光材料、生物发光材料和放射性材料。合适的酶的实例包括辣根过氧化物酶、碱性磷酸酶、β-半乳糖苷酶或乙酰胆碱酯酶;合适的辅基复合物的实例包括抗生蛋白链菌素/生物素和抗生物素蛋白/生物素;合适的荧光材料的实例包括伞形酮、荧光素、异硫氰酸荧光素、若丹明、二氯三嗪胺荧光素、丹磺酰氯或藻红蛋白;发光材料的实例包括鲁米诺;生物发光材料的实例包括萤光素酶、萤光素和水母发光蛋白,并且合适的放射性材料的实例包括
在一些实施方案中,本公开提供了通过向所述受试者给药UBE2K抑制剂(例如UBE2K的特异性抑制剂)来对所述受试者(例如,有需要的受试者)治疗癌症的方法。
在一些实施方案中,本公开提供了减少癌细胞增殖的方法,该方法包括使癌细胞与 UBE2K抑制剂(例如UBE2K的特异性抑制剂)接触,从而减少癌细胞的增殖。在一些实施方案中,本公开提供了减少癌细胞增殖的方法,该方法包括向癌细胞给药UBE2K抑制剂(例如UBE2K的特异性抑制剂),从而例如相对于未经UBE2K抑制剂处理的癌细胞减少癌细胞的增殖。在一些实施方案中,本公开提供了在受试者(例如有需要的受试者)中减少癌细胞增殖的方法,该方法包括向受试者给药UBE2K抑制剂(例如UBE2K的特异性抑制剂),从而使受试者的癌细胞增殖例如相对于未给药UBE2K抑制剂的受试者中的癌细胞减少。
在一些实施方案中,本公开提供了诱导癌细胞死亡的方法,该方法包括使癌细胞与 UBE2K抑制剂(例如UBE2K的特异性抑制剂)接触,从而诱导癌细胞的死亡。在一些实施方案中,本公开提供了诱导癌细胞死亡的方法,该方法包括向癌细胞给药UBE2K抑制剂(例如UBE2K的特异性抑制剂),从而诱导癌细胞的死亡。在一些实施方案中,本公开提供了在受试者(例如有需要的受试者)中诱导癌细胞死亡的方法,该方法包括向受试者给药UBE2K抑制剂(例如UBE2K的特异性抑制剂),从而诱导癌细胞的死亡。
在某些实施方案中,所述癌症包括实体瘤。在某些实施方案中,所述癌症包括白血病。在某些实施方案中,仅用UBE2K抑制剂治疗癌症。在某些实施方案中,所述癌症用UBE2K抑制剂和其他药剂治疗。在某些实施方案中,所述另外的药剂是化学治疗剂。
在一个实施方案中,UBE2K抑制剂(例如UBE2K的特异性抑制剂)的给药引致以下一种或多种:减少肿瘤的大小、重量或体积,增加进展时间,抑制肿瘤生长和/或延长患有肿瘤疾病的受试者的生存时间。在某些实施方案中,UBE2K抑制剂的给药对肿瘤的大小、重量或体积的减小、对进展时间的增加、对肿瘤生长的抑制和/或对受试者生存时间的延长相对于未给药UBE2K抑制剂的对应的对照受试者为至少1%、2%、3%、4%、5%、 10%、20%、30%、40%、50%、60%、70%、80%、90%、100%、200%、300%、400%或 500%。在一些实施方案中,在治疗之前,UBE2K抑制剂的给药使患有进展性肿瘤疾病的受试者的癌症稳定。
在癌症的治疗中,所述制剂可以在药学上可接受的载体中,所述载体可以通过以下方式以治疗有效量给药于受试者:作为单一治疗;针对给定的适应症与至少一种其他抗癌剂 (例如化学治疗剂)组合;与放射治疗组合,经过外科手术彻底清除肿瘤;与其他替代物和/或补充的可接受的癌症治疗物组合等等。
通常,本文描述的UBE2K抑制剂(例如UBE2K的特异性抑制剂)制剂和方法可以用于治疗任何肿瘤。在特定的实施方案中,所述制剂和方法用于在受试者中治疗实体瘤。在某些实施方案中,所述制剂和方法用于在受试者中治疗非实体瘤,例如白血病。
在一个实施方案中,与适当的对照物相比,给药本文所述的UBE2K抑制剂(例如UBE2K的特异性抑制剂)可实现至少稳定的疾病、减小肿瘤大小、抑制肿瘤生长和/或延长荷瘤受试者的生存时间。因此,本发明还涉及通过向人或其他动物给药有效的无毒量的UBE2K抑制剂来对所述人或动物治疗肿瘤的方法。通过使用本文提供的指导进行常规实验,本领域技术人员将能够确定用于治疗癌症的有效的、无毒量的UBE2K抑制剂。例如, UBE2K抑制剂的治疗有效量可以根据各种因素变化,诸如受试者的疾病阶段(例如,I 期对比IV期)、年龄、性别、医学并发症(例如,免疫抑制的病症或疾病、凝血病)和体重,以及UBE2K抑制剂在受试者中引起所需反应的能力。可以调整剂量方案以提供最佳的治疗反应。例如,可以每天给药几个分开的剂量,或者可以根据治疗情况的紧急程度按比例减少剂量。
在本发明的某些实施方案中,所述方法还包括治疗方案,其包括外科手术、放射、化学治疗(例如激素治疗、抗体治疗、生长因子治疗、细胞因子和抗血管生成治疗)中的任何一种或组合。
使用本发明的方法进行治疗的癌症包括,例如,在哺乳动物中发现的所有类型的癌症或肿瘤或恶性肿瘤,包括但不限于:白血病、淋巴瘤、黑色素瘤、上皮肿瘤和肉瘤。在一个实施方案中,使用本发明的方法治疗的癌症包括黑色素瘤、上皮肿瘤和肉瘤。在优选的实施方案中,UBE2K抑制剂组合物用于治疗各种类型的实体瘤,例如乳腺癌、膀胱癌、结肠癌和直肠癌、子宫内膜癌、肾(肾细胞)癌、肺癌、黑色素瘤、胰腺癌、前列腺癌,甲状腺癌、皮肤癌、骨癌、脑癌、宫颈癌、肝癌、胃癌、口腔癌、神经母细胞瘤、睾丸癌、子宫癌、甲状腺癌、头颈、肾脏、肺、非小细胞肺癌、黑色素瘤、间皮瘤、卵巢、肉瘤、胃、子宫和髓母细胞瘤以及外阴癌。在某些实施方案中,实体瘤包括乳腺癌,包括三阴性乳腺癌。在某些实施方案中,皮肤癌包括黑色素瘤、鳞状细胞癌、皮肤T细胞淋巴瘤 (CTCL)。在某些实施方案中,癌症包括白血病。在某些实施方案中,白血病包括急性白血病。在某些实施方案中,白血病包括慢性白血病。在某些实施方案中,白血病包括急性淋巴细胞(或淋巴母细胞)白血病(ALL)、急性骨髓性白血病(或者髓样或非淋巴性) 白血病(AML)、慢性淋巴细胞白血病(CLL)和慢性骨髓性白血病(CML)。白血病的其他类型包括毛细胞白血病(HCL)、T细胞淋巴细胞白血病(T-PLL)、大颗粒淋巴细胞白血病和成人T细胞白血病。然而,使用UBE2K抑制剂组合物的治疗不限于这些类型的癌症。
在一些实施方案中,用UBE2K抑制剂治疗的癌症选自肝癌和胰腺癌。在一些实施方案中,用UBE2K抑制剂治疗的癌症选自绒癌、卵巢癌、白血病(例如T细胞白血病、T 淋巴母细胞白血病和慢性粒细胞白血病)、淋巴瘤(例如B细胞淋巴瘤和间变性大细胞淋巴瘤)、胚胎癌、骨肉瘤、皮肤癌和结肠癌(例如大肠腺癌)。
如本文所使用的,术语“癌症”、“肿瘤(neoplasm)”和“肿瘤(tumor)”可互换使用,并且为单数或复数形式,其是指已经经历了使其对寄助物呈病态的恶性转化的细胞。通过成熟的技术,特别是组织学检查,可以容易地区分原发癌细胞(即从恶性转化位点附近获得的细胞)与非癌细胞。如本文所使用的,癌细胞的定义不仅包括原发癌细胞,还包括源自癌细胞祖先的任何细胞。这包括转移的癌细胞,以及源自癌细胞的体外培养物和细胞系。在提到通常表现为实体瘤的癌症类型时,“临床上可检测”的肿瘤是基于肿瘤块可检测的肿瘤;例如,通过诸如CAT扫描、MR成像、X射线、超声或触诊之类的程序,和/或由于可从患者获得的样品中的一个或多个癌症特异性抗原的表达而可检测到。使用全血细胞计数、苍白、血液涂片和骨髓涂片中的一种或多种可在临床上检测出白血病。某些受试者中的晚期白血病可表现为实体瘤。
不能通过成像或触诊检测到的非实体瘤(例如白血病)的实例可以例如通过中性粒细胞计数、血小板计数以及通过检测骨髓中的异常细胞来检测,例如,母细胞的存在没有其他明智的解释(例如,巩固治疗后的骨髓再生),存在棒状小体,或者出现新的发育异常变化。
术语“肉瘤”通常是指这样的肿瘤,其由类似于胚胎结缔组织的物质组成,并且通常由嵌入纤维状或均质物质中的紧密堆积的细胞构成。可以用本发明的组合物和可选的另外的抗癌剂(例如化学治疗剂)治疗的肉瘤的实例包括但不限于软骨肉瘤、纤维肉瘤、淋巴肉瘤、黑色素肉瘤、粘肉瘤、骨肉瘤、阿贝西米氏肉瘤(Abemethy's sarcoma)、脂肉瘤、脂肪肉瘤、肺泡软部分肉瘤、成釉细胞肉瘤、葡萄状肉瘤、绿藻肉瘤、绒毛膜癌、胚胎肉瘤、威尔姆斯肿瘤肉瘤(Wilms'tumor sarcoma)、子宫内膜肉瘤、间质肉瘤、尤因氏肉瘤(Ewing'ssarcoma)、筋膜肉瘤、纤维母细胞肉瘤、巨细胞肉瘤、粒细胞肉瘤、霍奇金氏肉瘤(Hodgkin'ssarcoma)、特发性多发性色素沉着出血性肉瘤、B细胞的免疫母细胞肉瘤、淋巴瘤、T细胞的免疫母细胞肉瘤、詹森氏肉瘤(Jensen's sarcoma)、卡波西氏肉瘤(Kaposi's sarcoma)、枯氏细胞肉瘤(Kupffer cell sarcoma)、血管肉瘤、白细胞肉瘤、恶性间质瘤肉瘤、骨旁肉瘤、网状细胞肉瘤、劳斯氏肉瘤(Rous sarcoma)、浆囊性肉瘤、滑膜肉瘤以及毛细血管扩张肉瘤。
术语“黑色素瘤”是指源自皮肤和其他器官的黑色素细胞系统的肿瘤。可以用本发明的组合物和可选的另外的抗癌剂(例如化学治疗剂)治疗的黑色素瘤包括但不限于,例如,急性多发性黑色素瘤、釉质黑色素瘤、良性少年黑色素瘤、克劳曼氏黑色素瘤(Cloudman's melanoma)、S91黑色素瘤、哈丁-帕西黑色素瘤(Harding-Passey melanoma)、少年黑色素瘤、扁桃体恶性黑色素瘤、恶性黑色素瘤、结节性黑色素瘤、舌下黑色素瘤以及浅表扩散性黑色素瘤。
术语“上皮肿瘤”是指由趋于浸润周围组织并引起转移的上皮细胞组成的恶性新生长。可以用本发明的组合物和可选的其他抗癌剂(例如化学治疗剂)治疗的上皮肿瘤包括但不限于,例如,腺泡癌、腺泡状癌、腺样囊性癌、腺囊癌、腺瘤癌、肾上腺皮质癌、肺泡癌、肺泡细胞癌、基底细胞癌、基底样细胞癌、基底细胞样癌、基底鳞状细胞癌、细支气管肺泡癌、细支气管癌、支气管癌、脑样癌、胆管细胞癌、绒毛膜癌、胶体癌、粉刺癌、体癌、筛状癌、铠甲状癌、皮肤癌、圆柱状癌、圆柱状细胞癌、导管癌、硬脑膜癌、胚胎癌、髓样癌、表皮样癌、上皮腺癌、外生性癌、溃疡性癌、纤维状癌、胶样癌、凝胶状癌、巨大细胞癌、巨细胞癌、腺癌、颗粒细胞癌、发基质癌、血样癌、肝细胞癌、许特耳氏细胞癌(Hurthle cell carcinoma)、透明细胞癌、颞下叶样癌(hypemephroid carcinoma)、婴儿胚胎癌、原位癌、表皮内癌、上皮内癌、克罗姆佩切氏癌(Krompecher's carcinoma)、库尔奇茨基细胞癌(Kulchitzky-cellcarcinoma)、大细胞癌、豆状癌、晶体状癌(carcinoma lenticulare)、脂肪瘤、淋巴上皮癌、髓质癌、髓样癌、黑色素瘤癌、软癌、粘液性癌、粘液癌、粘液细胞癌、粘液表皮样癌、胶样癌、黏液癌、粘液瘤样癌、鼻咽癌、燕麦细胞癌、骨样癌、类骨质癌、乳头状癌、门静脉周癌、浸润前癌、棘细胞癌、脓疱癌、肾细胞癌、储备细胞癌、肉瘤样癌、施奈德氏癌(schneideriancarcinoma)、硬癌、阴囊癌、印戒细胞癌、单纯癌、小细胞癌、螺线管癌、球状细胞癌、梭形细胞癌、海绵状癌、鳞状细胞癌、扁平上皮癌、弦癌、血管扩张性癌、毛细血管扩张性癌、移行细胞癌、结节性皮癌、结节性癌、疣状癌以及绒毛状癌。
术语“白血病”是指以被称为“母细胞”的未成熟白细胞异常增加为特征的一种血液或骨髓癌。白血病是涵盖多种疾病的广义术语。反过来,它又是影响血液、骨髓和淋巴系统的更广泛疾病的一部分,这些疾病都被称为血液肿瘤。白血病可分为四个主要类别:急性淋巴细胞白血病(ALL)、急性骨髓(或者髓系或非淋巴细胞性)白血病(AML)、慢性淋巴细胞白血病(CLL)以及慢性骨髓白血病(CML)。白血病的其他类型包括毛细胞白血病(HCL)、T细胞淋巴细胞白血病(T-PLL)、大颗粒淋巴细胞白血病和成人T细胞白血病。
“急性白血病”的特征是未成熟血细胞数量迅速增加。由于这些细胞引起的拥挤使骨髓无法产生健康的血细胞。由于恶性细胞的迅速发展和积累,然后恶性细胞溢出到血液中并扩散到身体的其他器官,所以急性白血病需要立即治疗。急性白血病是儿童中最常见的白血病。
“慢性白血病”的特征是相对成熟但仍异常的白细胞过度积聚。通常需要数月或数年的时间才有进展,这些细胞的生成速度要比正常情况高得多,从而导致许多异常的白细胞。急性白血病必须立即治疗,有时在治疗前一段时间要监测慢性形式,以确保最大程度的治疗效果。
淋巴细胞白血病或淋巴细胞性白血病是由于产生淋巴细胞(白血球)的骨髓细胞过度增殖所致,通常为B细胞。
骨髓或骨髓性白血病是由于产生红细胞、某些其他类型的白细胞和血小板的骨髓细胞过度增殖所致。
可以用本文公开的化合物治疗的其他癌症包括例如霍奇金氏病、非霍奇金氏淋巴瘤、多发性骨髓瘤、神经母细胞瘤、乳腺癌、卵巢癌、肺癌、横纹肌肉瘤、原发性血小板增多症、原发性巨球蛋白血症、小细胞肺肿瘤、原发性脑瘤、胃癌、结肠癌、恶性胰腺胰岛素瘤、恶性类癌、膀胱癌、恶变前皮肤病变、睾丸癌、淋巴瘤、甲状腺癌、神经母细胞瘤、食道癌、泌尿生殖道癌、恶性高钙血症、宫颈癌、子宫内膜癌、肾上腺皮质癌、前列腺癌、胰腺癌、子宫肉瘤、粘液样脂肪肉瘤、平滑肌肉肉瘤、软骨肉瘤、骨肉瘤、结肠的结肠腺癌、宫颈鳞状细胞癌、扁桃体鳞状细胞癌、乳头状甲状腺癌、腺样体囊性癌、滑膜细胞肉瘤、恶性纤维组织细胞瘤、增生性肉瘤、肝细胞癌、梭形细胞肉瘤、胆管癌和三阴性乳腺癌。
在一些实施方案中,癌症不是淋巴瘤。在一些实施方案中,癌症不是B细胞淋巴瘤。在一些实施方案中,癌症不是携带MyD88突变的淋巴瘤。
本文提供的癌症治疗方法包括与其他抗癌剂或干预措施的联合治疗(例如放射、外科手术、骨髓移植)。在某些实施方案中,“联合治疗”包括用UBE2K抑制剂(例如UBE2K 的特异性抑制剂)治疗以减少肿瘤负荷和/或改善临床反应。与姑息治疗或减轻药物副作用(例如,以减少恶心、疼痛、焦虑、或炎症,正常化凝血)的治疗一起给药UBE2K抑制剂不被认为是癌症的组合治疗。
在优选的实施方案中,利用UBE2K抑制剂(例如UBE2K的特异性抑制剂)治疗与治疗待治疗的特定癌症的护理标准相组合。特定癌症类型的护理标准可以由本领域技术人员基于例如癌症的类型和严重性,受试者的年龄、体重、性别和/或病史,以及先前治疗的成功或失败来确定。
在某些实施方案中,通过UBE2K抑制剂治疗患有实体瘤的受试者与以下治疗中的一种或多种组合。
1.吉西他滨,优选通过以每周600mg/m
2.5-氟代尿嘧啶(5-FU),优选以350mg/m
3.多西紫杉醇,优选每周一次以20mg/m
在某些实施方案中,将组合治疗的1、2、3、4或5个周期向受试者给药。在每个周期结束时评估受试者的反应标准。还贯穿不良事件(例如,凝血、贫血、肝和肾功能等) 的每个周期监测受试者,以确保治疗方案被充分耐受。
在某些实施方案中,UBE2K抑制剂(例如UBE2K的特异性抑制剂)以在单独递送的情况下在治疗上有效的量给药,即UBE2K抑制剂被给药和/或充当治疗剂,而非主要充当改善其他化学治疗或其他癌症治疗的副作用的药剂。UBE2K抑制剂和/或其药物制剂和另一种治疗剂可以相加地或更优选地起协同作用。在一个实施方案中,UBE2K抑制剂(例如UBE2K的特异性抑制剂)和/或其制剂与另外的抗癌剂(例如,化学治疗剂、抗血管生成剂)同时给药。在另一个实施方案中,在给药另一种抗癌剂之前或之后给药化合物和/ 或其药物制剂,其中这两种药剂同时存在于受试者中或在受试者中同时具有治疗活性。在一个实施方案中,UBE2K抑制剂和另外的抗癌剂协同作用。在一个实施方案中,UBE2K 抑制剂和另外的抗癌剂相加作用。
在一个实施方案中,本发明的治疗方法还包括给药一种或多种另外的治疗剂,例如一种或多种抗癌剂,例如,抗血管生成剂,化学治疗剂,例如,小分子抗癌剂,生物抗癌剂,包括基于蛋白质和基于核酸的治疗剂。例如,在一个实施方案中,用于本发明的治疗方法的另一种抗癌剂是化学治疗剂。
小分子化学治疗剂通常属于各种类别,例如包括:1.拓扑异构酶II抑制剂(细胞毒性抗生素),诸如蒽环类/蒽二酮类,例如,阿霉素、表柔比星、伊达比星和奈莫柔比星,蒽醌类,例如,米托蒽醌和洛索蒽醌,以及鬼臼毒素类,例如,依托泊苷和替尼泊苷;2.影响微管形成的药剂(有丝分裂抑制剂),诸如植物生物碱(例如,属于碱性家族的化合物,源自具有生物活性和细胞毒性的植物的含氮分子),例如,紫杉烷类,例如,紫杉醇和多西他赛,和长春花生物碱,例如,长春花碱、长春新碱和长春瑞滨,以及鬼臼毒素的衍生物;3.烷基化剂,诸如氮芥子气、乙撑亚胺化合物、烷基磺酸盐和其他具有烷基化作用的化合物,诸如亚硝基脲、达卡巴嗪、环磷酰胺、异环磷酰胺和美法仑;4.抗代谢物(核苷抑制剂),例如,叶酸类,例如,叶酸,氟嘧啶、嘌呤或嘧啶类似物,诸如5-氟代尿嘧啶、卡培他滨、吉西他滨、甲氨蝶呤和依达曲塞;5.拓扑异构酶I抑制剂,诸如拓扑替康、伊立替康和9-硝基喜树碱、喜树碱衍生物和视黄酸;以及6.铂化合物/复合物,诸如顺铂、奥沙利铂和卡铂;用于本发明方法的示例性化学治疗剂,包括但不限于氨磷汀(乙二醇)、顺铂、达卡巴嗪(DTIC)、放线菌素、甲氯乙胺(氮芥)、链霉菌素、环磷酰胺、卡莫司汀(BCNU)、洛莫司汀(CCNU)、阿霉素(亚德里亚霉素)、阿霉素脂质(阿霉素脂质体)、吉西他滨(健择)、柔红霉素、柔红霉素脂质(枸橼酸柔红霉素脂质体)、卡巴嗪、丝裂霉素、阿糖胞苷、依托泊苷、甲氨蝶呤、5-氟代尿嘧啶(5-FU)、长春花碱、长春新碱、博来霉素、紫杉醇(泰素)、多西他赛(泰素帝)、阿地白介素、天冬酰胺酶、白消安、卡铂、克拉屈滨、喜树碱、CPT-11、10-羟基-7-乙基-喜树碱(SN38)、达卡巴嗪、SI卡培他滨、氟托拉夫、5'脱氧氟代尿苷、UFT、恩尿嘧啶、脱氧胞苷、5-氮杂胞嘧啶、5-氮杂脱氧胞嘧啶、别嘌呤醇、2-氯代腺苷、曲美沙特、氨基蝶呤、亚甲基-10-脱氮杂氨基蝶呤(MDAM)、奥沙利铂、吡铂、四铂、沙铂、铂-DACH、奥马铂、CI-973、JM-216及其类似物、表柔比星、依托泊苷磷酸酯、9-氨基喜树碱、10,11-亚甲基二氧基喜树碱、卡瑞特霉素、9-硝基喜树碱、TAS 103、长春地辛、L-苯丙氨酸氮芥、异环磷酰胺、过磷酰胺、三磷酰胺卡莫司汀、司马汀、埃博霉素A-E、甲苯糊精、6-巯基嘌呤、6-硫代鸟嘌呤、氨茶碱、磷酸依托泊苷、卡瑞特霉素、阿昔洛韦、伐昔洛韦、更昔洛韦、金刚烷胺、金刚乙胺、拉米夫定、齐多夫定、贝伐单抗、曲妥珠单抗、利妥昔单抗、5-氟代尿嘧啶、卡培他滨、喷司他丁、三甲曲沙、克拉屈滨、氟尿苷、氟达拉滨、羟基脲、异环磷酰胺、伊达比星、美司钠、伊立替康、米托蒽醌、拓扑替康、亮丙瑞林、甲地孕酮、美法仑、巯基嘌呤、普卡霉素、米托坦、培门冬酶、喷司他丁、哌泊溴烷、普卡霉素、链脲菌素、它莫西芬、替尼泊苷、睾内酯、硫代鸟嘌呤、噻替派、乌拉莫司汀、长春瑞滨、苯丁酸氮芥、顺铂、阿霉素、紫杉醇(泰素)、博来霉素、mTor、表皮生长因子受体(EGFR)和纤维母细胞生长因子(FGF) 及其组合,基于对特定肿瘤或癌症的适当护理标准,上述这些对于本领域技术人员而言是显而易见的。
在另一个实施方案中,用于本发明的组合治疗的另外的化学治疗剂是生物药剂。生物药剂(也称为生物剂)是生物系统(例如生物体、细胞或重组系统)的产物。此类生物药剂的实例包括核酸分子(例如,反义核酸分子)、干扰素、白介素、集落刺激因子、抗体 (例如,单克隆抗体)、抗血管生成剂和细胞因子。示例性生物药剂将在下面进行更详细的讨论,并且其通常属于各种类别,例如包括:1激素、激素类似物和激素复合物,例如雌激素和雌激素类似物、孕激素、孕酮类似物和孕激素、雄激素、肾上腺皮质类固醇、抗雌激素、抗雄激素、抗睾丸激素、肾上腺类固醇抑制剂和抗黄体生成激素;以及2.酶、蛋白质、肽、多克隆和/或单克隆抗体,诸如白介素、干扰素、集落刺激因子等。
在一个实施方案中,生物剂是干扰素。干扰素(IFN)是自然存在于体内的一种类型的生物药剂。干扰素也在实验室生产,并通过生物治疗给予癌症患者。已显示它们可以改善癌症患者的免疫系统对抗癌细胞的作用方式。
干扰素可以直接作用于癌细胞以减慢其生长,也可以引致癌细胞转变为行为更正常的细胞。一些干扰素还可以刺激天然杀伤细胞(NK)、T细胞和巨噬细胞,这些细胞是血液中的白细胞类型,有助于对抗癌细胞。
在一个实施方案中,生物剂是白介素。白介素(IL)刺激许多免疫细胞的生长和活性。它们是体内天然存在的蛋白质(细胞因子和趋化因子),但也可以在实验室中制备。一些白介素刺激免疫细胞(诸如淋巴细胞)的生长和活性,这些细胞可破坏癌细胞。
在另一个实施方案中,生物剂是集落刺激因子。集落刺激因子(CSF)是给予患者以促使骨髓内的干细胞产生更多血细胞的蛋白质。人体不断需要新的白细胞、红细胞和血小板,特别是在存在癌症的情况下。CSF与化学治疗一起使用,以帮助增强免疫系统。当癌症患者接受化学治疗时,骨髓产生新血细胞的能力受到抑制,使患者更容易发生感染。免疫系统的某些部分无法在没有血细胞的情况下运作,因此集落刺激因子会促使骨髓干细胞产生白细胞、血小板和红细胞。
通过适当的细胞产生,其他癌症治疗可以继续使患者能够安全地接受更高剂量的化学治疗。
在另一个实施方案中,生物剂是抗体。抗体,例如单克隆抗体,是在实验室中产生的与癌细胞结合的药剂。
单克隆抗体不会破坏健康细胞。单克隆抗体通过多种机制达到其治疗效果。它们可以直接导致细胞凋亡或程序性细胞死亡。它们可以阻断生长因子受体,从而有效阻滞肿瘤细胞的增殖。在表达单克隆抗体的细胞中,它们可以引起抗独特型抗体的形成。
可以用于本发明的组合治疗的抗体的实例包括抗CD20抗体,诸如但不限于西妥昔单抗、托西妥玛单抗、利妥昔单抗和依鲁单抗。抗HER2抗体也可以与UBE2K抑制剂组合使用以治疗癌症。在一个实施方案中,抗HER2抗体是曲妥珠单抗(赫赛汀)。可以与UBE2K 抑制剂组合使用以治疗癌症的抗体的其他实例包括抗CD52抗体(例如,阿仑单抗)、抗 CD-22抗体(例如,依帕珠单抗)和抗CD33抗体(例如,吉妥单抗)。抗VEGF抗体也可以与UBE2K抑制剂组合用于治疗癌症。在一个实施方案中,抗VEGF抗体是贝伐单抗。在其他实施方案中,生物药剂是作为抗EGFR抗体的抗体,例如西妥昔单抗。另一个实例是抗糖蛋白17-1A抗体依决洛单抗。许多其他抗肿瘤抗体是本领域已知的,并且本领域技术人员将理解为包含在本发明中。
在另一个实施方案中,生物剂是细胞因子。细胞因子治疗使用蛋白质(细胞因子)来帮助受试者的免疫系统识别并破坏那些癌细胞。细胞因子是免疫系统在体内自然产生的,但也可以在实验室中产生。此治疗可用于晚期黑色素瘤和辅助治疗(在原发性癌症治疗之后或除此以外的治疗)。细胞因子治疗到达身体的各个部位,以杀死癌细胞并防止肿瘤的生长。
在另一个实施方案中,生物剂是融合蛋白。例如,重组人Apo2L/TRAIL(GENETECH)可用于组合治疗。Apo2/TRAIL是首个双重促凋亡受体激动剂,旨在活化参与细胞凋亡调节(程序性细胞死亡)的促凋亡受体DR4和DR5。
在一个实施方案中,生物剂是一种治疗性核酸分子。核酸治疗剂是本领域众所周知的。核酸治疗剂包括与细胞中靶标序列互补的单链和双链(即,具有长度为至少15个核苷酸的互补区的核酸治疗剂)核酸。治疗性核酸可以针对细胞中的基本上任何靶标核酸序列。在某些实施方案中,核酸治疗剂靶向编码血管生成的刺激物(例如VEGF、FGF)或肿瘤生长的刺激物(例如EGFR)的核酸序列。
反义核酸治疗剂是单链核酸治疗剂,通常长约16至30个核苷酸,并且与培养物或生物体中靶标细胞中的靶标核酸序列互补。
在另一方面,该药剂是单链反义RNA分子。反义RNA分子与靶标mRNA内的序列互补。反义RNA可以通过与mRNA碱基配对并在物理上阻碍翻译机制而以化学计量的方式抑制翻译,参见Dias,N.等人,(2002)《分子癌症治疗(Mol Cancer Ther)》1:347-355。反义RNA分子可以具有与靶标mRNA互补的约15-30个核苷酸。例如,在涉及化学修饰的含RNA的治疗化合物的美国专利号5,898,031以及涉及使用这些化合物作为治疗剂的方法的美国专利号6,107,094中提供了涉及反义核酸、化学修饰和治疗用途的专利。美国专利号7,432,250涉及通过给药单链化学修饰的RNA样化合物来治疗患者的方法;而美国专利号7,432,249涉及含有单链化学修饰的RNA样化合物的药物组合物。美国专利号 7,629,321涉及使用具有多个RNA核苷和至少一种化学修饰的单链寡核苷酸来切割靶标 mRNA的方法。本段中列出的每项专利的全部内容均通过引用并入本文。
用于本发明方法的核酸治疗剂还包括双链核酸治疗剂。如本文可互换使用的,“RNAi 剂”、“双链RNAi剂”、双链RNA(dsRNA)分子(也称为“dsRNA剂”、“dsRNA”、“siRNA”、“iRNA剂”)是指核糖核酸分子的复合物,其具有双链体结构,该双链体结构包含两条反平行且基本互补的核酸链,如下文所定义。如本文所使用的,RNAi剂还可以包括dsiRNA (参见,例如,美国专利公开文件20070104688,其通过引用并入本文)。通常,每条链的大部分核苷酸是核糖核苷酸,但是如本文所述,每条链或两条链也可以包含一个或多个非核糖核苷酸,例如脱氧核糖核苷酸和/或修饰的核苷酸。另外,如本说明书中所使用的,“RNAi剂”可以包括具有化学修饰的核糖核苷酸;RNAi剂可以在多个核苷酸上包含大量修饰。这样的修改可以包括本文公开的或本领域已知的所有类型的修饰。出于本说明书和权利要求书的目的,“RNAi剂”涵盖了用于siRNA类型分子的任何此类修饰。本发明方法中所使用的RNAi剂包括具有化学修饰的药剂,例如,如以下文献中所公开的:于2011年 11月18日提交的美国临时申请号61/561,710,于2010年9月15日提交的国际申请号 PCT/US2011/051597,以及PCT公开文件WO 2009/073809,其中的每一个的全部内容通过引用并入本文。
本发明方法中所使用的其他示例性生物药剂包括但不限于吉非替尼(易瑞沙)、阿那曲唑、二乙基雌甾醇、雌二醇、普力马、雷洛昔芬、孕酮、异炔诺酮、乙二酮、地美西酮、醋酸甲地孕酮、醋酸甲羟孕酮、己酸羟孕酮、炔诺酮、甲基睾酮、睾酮、地塞米松、泼尼松、皮质醇、甲泼尼龙、他莫昔芬、氟维司群、托瑞米芬、氨鲁米特、睾内酯、屈洛昔芬、阿那曲唑、比卡鲁胺、氟他米特、尼鲁米特、戈舍瑞林、氟他米特、亮丙瑞林、曲普瑞林、氨鲁米特、米托坦、戈舍瑞林、西妥昔单抗、埃罗替尼、伊马替尼、托西莫单抗、阿仑单抗、曲妥单抗、吉妥珠单抗、利妥昔单抗、替伊莫单抗、贝伐单抗、地尼白介素、达克珠单抗、干扰素α、干扰素β、抗4-1BB、抗4-1BBL、抗CD40、抗CD 154、抗OX40、抗 OX40L、抗CD28、抗CD80、抗CD86、抗CD70、抗CD27、抗HVEM、抗LIGHT、抗 GITR、抗GITRL、抗CTLA-4、可溶OX40L、可溶4-1BBL、可溶CD154、可溶GITRL、可溶LIGHT、可溶CD70、可溶CD80、可溶CD86、可溶CTLA4-Ig、
在一些实施方案中,所述另外的药剂是免疫治疗剂。在一些实施方案中,免疫治疗剂是免疫检查点分子的免疫检查点调节剂。实例包括LAG-3(Triebel等人,1990,《实验医学杂志(J.Exp.Med.)》171:1393-1405)、TIM-3(Sakuishi等人,2010,《实验医学杂志(J.Exp.Med.)》207:2187-2194)和VISTA(Wang等人,2011,《实验医学杂志(J.Exp. Med.)》208:577-592)。改善免疫反应的共刺激分子的实例包括ICOS(Fan等人,2014,《实验医学杂志(J.Exp.Med.)》211:715-725)、OX40(Curti等人,2013,《癌症研究(Cancer Res.)》73:7189-7198)和4-1BB(Melero等人,1997,《自然医学(Nat.Med.)》3:682-685)。
免疫检查点可以是刺激性免疫检查点(即,刺激免疫反应的分子)或抑制性免疫检查点(即,抑制免疫反应的分子)。在一些实施方案中,免疫检查点调节剂是抑制性免疫检查点的拮抗剂。在一些实施方案中,免疫检查点调节剂是刺激性免疫检查点的激动剂。在一些实施方案中,免疫检查点调节剂是免疫检查点结合蛋白(例如,抗体、抗体Fab片段、二价抗体、抗体药物缀合物、scFv、融合蛋白、二价抗体或四价抗体)。在某些实施方案中,免疫检查点调节剂能够结合多于一个的免疫检查点或调节多于一个的免疫检查点的活性。下面提供了可以在本发明的方法中使用的刺激性和抑制性免疫检查点以及调节这些免疫检查点的分子的实例。
i.刺激性免疫检查点分子
CD27支持幼稚T细胞的抗原特异性扩增,并且对于产生T细胞记忆至关重要(参见,例如,Hendriks等人(2000)《自然免疫学(Nat.Immunol.)》171(5):433–40)。CD27也是B细胞的记忆标志物(参见,例如,Agematsu等人(2000)《组织学和组织病理学(Histol.Histopathol.)》15(2):573–6。CD27活性受其配体CD70在淋巴细胞和树突状细胞上的瞬时可利用性支配(参见,例如,Borst等人(2005)《免疫学的最新观点(Curr.Opin.Immunol.)》17(3):275–81)。已经开发了多种对CD27具有特异性的免疫检查点调节剂,并且可以如本文公开的那样使用。在一些实施方案中,免疫检查点调节剂是调节CD27的活性和/或表达的药剂。在一些实施方案中,免疫检查点调节剂是与CD27结合的药剂(例如,抗CD27抗体)。在一些实施方案中,检查点调节剂是CD27激动剂。在一些实施方案中,检查点调节剂是CD27拮抗剂。在一些实施方案中,免疫检查点调节剂是CD27结合蛋白(例如,抗体)。在一些实施方案中,免疫检查点调节剂是varlilumab (CelldexTherapeutics)。另外的CD27结合蛋白(例如,抗体)是本领域已知的,并且公开于例如以下文献中:美国专利号9,248,183、9,102,737、9,169,325、9,023,999、8,481,029;美国专利申请公开号2016/0185870、2015/0337047、2015/0299330、2014/0112942、 2013/0336976、2013/0243795、2013/0183316、2012/0213771、2012/0093805、2011/0274685、 2010/0173324;以及PCT公开号WO 2015/016718、WO 2014/140374、WO 2013/138586、 WO 2012/004367、WO 2011/130434、WO 2010/001908和WO 2008/051424,其中的每一个通过引用并入本文。
CD28.分化簇28(CD28)是在T细胞上表达的蛋白质之一,其可提供T细胞活化和存活所需的共刺激信号。除T细胞受体(TCR)外,还通过CD28刺激T细胞,这可以为产生各种白介素(特别是IL-6)提供有效的信号。与在树突细胞上表达的其两个配体CD80 和CD86的结合促使T细胞扩增(参见,例如,Prasad等人(1994)《美国国家科学院院刊 (Proc.Nat’l.Acad.Sci.USA)》91(7):2834–8)。已经开发了多种对CD28具有特异性的免疫检查点调节剂,并且可以如本文公开的那样使用。在一些实施方案中,免疫检查点调节剂是调节CD28的活性和/或表达的药剂。在一些实施方案中,免疫检查点调节剂是与CD28 结合的药剂(例如,抗CD28抗体)。在一些实施方案中,检查点调节剂是CD28激动剂。在一些实施方案中,检查点调节剂是CD28拮抗剂。在一些实施方案中,免疫检查点调节剂是CD28结合蛋白(例如,抗体)。在一些实施方案中,免疫检查点调节剂选自由以下组成的组:TAB08(TheraMabLLC)、鲁利珠单抗(也称为BMS-931699、Bristol-Myers Squibb)和FR104(OSE免疫治疗剂)。另外的CD28结合蛋白(例如,抗体)是本领域已知的,并且公开于例如以下文献中:美国专利号9,119,840、8,709,414、9,085,629、8,034,585、7,939,638、8,389,016、7,585,960、8,454,959、8,168,759、8,785,604、7,723,482;美国专利申请公开号2016/0017039、2015/0299321、2015/0150968、2015/0071916、 2015/0376278、2013/0078257、2013/0230540、2013/0078236、2013/0109846、2013/0266577、 2012/0201814、2012/0082683、2012/0219553、2011/0189735、2011/0097339、2010/0266605、 2010/0168400、2009/0246204、2008/0038273;以及PCT公开号WO 2015198147、WO 2016/05421、WO 2014/1209168、WO2011/101791、WO 2010/007376、WO 2010/009391、 WO 2004/004768、WO 2002/030459、WO2002/051871和WO 2002/047721,其中的每一个通过引用并入本文。
CD40.在多种免疫系统细胞(包括抗原呈递细胞)上发现了分化簇40(CD40,也称为TNFRSF5)。CD40L,也称为CD154,是CD40的配体,并且在活化的CD4
CD122.CD122是白介素2受体的β亚基,并且已知其会增加CD8
OX40.OX40受体(也称为CD134)促进效应子和记忆T细胞的扩增。OX40还抑制T 调节细胞的分化和活性,并调节细胞因子的产生(参见,例如,Croft等人(2009)《免疫学评论(Immunol.Rev.)》229(1):173–91)。已经开发了多种对OX40具有特异性的免疫检查点调节剂,并且可以如本文公开的那样使用。在一些实施方案中,免疫检查点调节剂是调节OX40的活性和/或表达的药剂。在一些实施方案中,免疫检查点调节剂是与OX40 结合的药剂(例如,抗OX40抗体)。在一些实施方案中,检查点调节剂是OX40激动剂。在一些实施方案中,检查点调节剂是OX40拮抗剂。在一些实施方案中,免疫检查点调节剂是OX40结合蛋白(例如,抗体),其选自由以下组成的组:MEDI6469 (AgonOx/Medimmune)、泊加珠单抗(也称为MOXR0916和RG7888;Genentech,Inc.)、他伏立单抗(也称为MEDI0562;Medimmune)以及GSK3174998(GlaxoSmithKline)。另外的OX-40结合蛋白(例如,抗体)是本领域已知的,并且公开在例如以下文献中:美国专利号9,163,085、9,040,048、9,006,396、8,748,585、8,614,295、8,551,477、8,283,450、 7,550,140;美国专利申请公开号2016/0068604、2016/0031974、2015/0315281、 2015/0132288、2014/0308276、2014/0377284、2014/0044703、2014/0294824、2013/0330344、 2013/0280275、2013/0243772、2013/0183315、2012/0269825、2012/0244076、2011/0008368、 2011/0123552、2010/0254978、2010/0196359、2006/0281072;以及PCT公开号WO 2014/148895、WO 2013/068563、WO 2013/038191、WO2013/028231、WO 2010/096418、 WO 2007/062245和WO 2003/106498,其中的每一个通过引用并入本文。
GITR.糖皮质激素诱导的TNFR家族相关基因(GITR)是肿瘤坏死因子受体(TNFR)超家族的成员,在Treg、CD4和CD8 T细胞上组成性或有条件表达。在TCR连接和活化后,GITR在效应T细胞上迅速上调。人GITR配体(GITRL)在次级淋巴器官和一些非淋巴组织中的APC上组成性表达。GITR:GITRL相互作用的下游作用诱导Treg活性减弱,并增强CD4
在一些实施方案中,免疫检查点调节剂是调节GITR的活性和/或表达的药剂。在一些实施方案中,免疫检查点调节剂是与GITR结合的药剂(例如,抗GITR抗体)。在一些实施方案中,检查点调节剂是GITR激动剂。在一些实施方案中,检查点调节剂是GITR拮抗剂。在一些实施方案中,免疫检查点调节剂是选自由以下组成的组的GITR结合蛋白(例如,抗体):TRX518(Leap Therapeutics)、MK-4166(Merck&Co.)、MEDI-1873(MedImmune)、 INCAGN1876(Agenus/Incyte)以及FPA154(Five Prime Therapeutics)。另外的GITR结合蛋白(例如,抗体)是本领域已知的,并且公开于例如以下文献中:美国专利号9,309,321、 9,255,152、9,255,151、9,228,016、9,028,823、8,709,424、8,388,967;美国专利申请公开号 2016/0145342、2015/0353637、2015/0064204、2014/0348841、2014/0065152、2014/0072566、2014/0072565、2013/0183321、2013/0108641、2012/0189639;以及PCT公开号WO 2016/054638、WO 2016/057841、WO 2016/057846、WO 2015/187835、WO 2015/184099、 WO 2015/031667、WO 2011/028683和WO 2004/107618,其中的每一个通过引用并入本文。
ICOS.诱导型T细胞共刺激物(ICOS,也称为CD278)在活化的T细胞上表达。它的配体是ICOSL,主要在B细胞和树突状细胞上表达。ICOS在T细胞效应子功能中很重要。TCOS活化后ICOS表达上调(参见,例如,Fan等人(2014)《实验医学杂志(J.Exp. Med.)》211(4):715-25)。已经开发了多种对ICOS具有特异性的免疫检查点调节剂,并且可以如本文公开的那样使用。在一些实施方案中,免疫检查点调节剂是调节ICOS的活性和/或表达的药剂。在一些实施方案中,免疫检查点调节剂是与ICOS结合的药剂(例如,抗ICOS抗体)。在一些实施方案中,检查点调节剂是ICOS激动剂。在一些实施方案中,检查点调节剂是ICOS拮抗剂。在一些实施方案中,免疫检查点调节剂是选自由以下组成的组的ICOS结合蛋白(例如,抗体):MEDI-570(也称为JMab-136,Medimmune)、 GSK3359609(GlaxoSmithKline/INSERM)以及JTX-2011(Jounce Therapeutics)。另外的 ICOS结合蛋白(例如,抗体)是本领域已知的,并且公开于例如以下文献中:美国专利号9,376,493、7,998,478、7,465,445、7,465,444;美国专利申请公开号2015/0239978、 2012/0039874、2008/0199466、2008/0279851;以及PCT公开号WO 2001/087981,其中的每一个通过引用并入本文。
4-1BB.4-1BB(也称为CD137)是肿瘤坏死因子(TNF)受体超家族的成员。4-1BB(CD137)是一种II型跨膜糖蛋白,可在引发的CD4
ii.抑制性免疫检查点分子
ADORA2A.腺苷A2A受体(A2A4)是G蛋白偶联受体(GPCR)家族的成员,该家族拥有七个跨膜α螺旋,并且被认为是癌症治疗中的重要检查点。A2A受体可以负调节过度反应的免疫细胞(参见,例如,Ohta等人(2001)《自然(Nature)》414(6866):916–20)。已经开发了多种对ADORA2A具有特异性的免疫检查点调节剂,并且可以如本文公开的那样使用。在一些实施方案中,免疫检查点调节剂是调节ADORA2A的活性和/或表达的药剂。在一些实施方案中,免疫检查点调节剂是与ADORA2A结合的药剂(例如,抗 ADORA2A抗体)。在一些实施方案中,免疫检查点调节剂是ADORA2A结合蛋白(例如,抗体)。在一些实施方案中,检查点调节剂是ADORA2A激动剂。在一些实施方案中,检查点调节剂是ADORA2A拮抗剂。ADORA2A结合蛋白(例如,抗体)是本领域已知的,并且公开于例如美国专利申请公开号2014/0322236中,其通过引用并入本文。
B7-H3.B7-H3(也称为CD276)属于B7超家族,这是一组可共同刺激或下调T细胞反应的分子。B7-H3有效且持续地下调人T细胞反应(参见,例如,Leitner等人(2009)《欧洲免疫学杂志(Eur.J.Immunol.)》39(7):1754-64)。已经开发了对B7-H3具有特异性的多种免疫检查点调节剂,并且可以如本文公开的那样使用。在一些实施方案中,免疫检查点调节剂是调节B7-H3的活性和/或表达的药剂。在一些实施方案中,免疫检查点调节剂是与B7-H3结合的药剂(例如,抗B7-H3抗体)。在一些实施方案中,检查点调节剂是B7-H3 激动剂。在一些实施方案中,检查点调节剂是B7-H3拮抗剂。在一些实施方案中,免疫检查点调节剂是抗B7-H3结合蛋白,其选自由以下组成的组:DS-5573(Daiichi Sankyo, Inc.)、依诺普单抗(MacroGenics,Inc.)以及8H9(斯隆·凯特琳癌症研究所(Sloan Kettering Institutefor Cancer Research);参见,例如,Ahmed等人(2015)《生物化学杂志(J.Biol. Chem.)》290(50):30018-29)。在一些实施方案中,免疫检查点调节剂是B7-H3结合蛋白 (例如,抗体)。B7-H3结合蛋白(例如,抗体)是本领域已知的,并且公开于例如以下文献中:美国专利号9,371,395、9,150,656、9,062,110、8,802,091、8,501,471、8,414,892;美国专利申请公开号2015/0352224、2015/0297748、2015/0259434、2015/0274838、 2014/032875、2014/0161814、2013/0287798、2013/0078234、2013/0149236、2012/02947960、2010/0143245、2002/0102264;PCT公开号WO 2016/106004、WO 2016/033225、WO 2015/181267、WO 2014/057687、WO 2012/147713、WO 2011/109400、WO 2008/116219、 WO 2003/075846、WO 2002/032375;以及Shi等人(2016)《分子医学报告(Mol.Med. Rep.)》14(1):943-8,其中的每一个通过引用并入本文。
B7-H4.B7-H4(也称为O8E、OV064和含V组结构域的T细胞活化抑制剂(VTCN1)) 属于B7超家族。通过阻滞细胞周期,T细胞的B7-H4连接对细胞生长、细胞因子分泌和细胞毒性的发展具有深远的抑制作用。向小鼠中给药B7-H4Ig会损害抗原特异性T细胞反应,而特异性单克隆抗体对内源性B7-H4的阻断会促进T细胞反应(参见,例如,Sica 等人(2003)《免疫(Immunity)》18(6):849-61)。已经开发了对B7-H4具有特异性的多种免疫检查点调节剂,并且可以如本文公开的那样使用。在一些实施方案中,免疫检查点调节剂是调节B7-H4的活性和/或表达的药剂。在一些实施方案中,免疫检查点调节剂是与 B7-H4结合的药剂(例如,抗B7-H4抗体)。在一些实施方案中,免疫检查点调节剂是B7-H4 结合蛋白(例如,抗体)。在一些实施方案中,检查点调节剂是B7-H4激动剂。在一些实施方案中,检查点调节剂是B7-H4拮抗剂。B7-H4结合蛋白(例如,抗体)是本领域已知的,并且公开于例如以下文献中:美国专利号9,296,822、8,609,816、8,759,490、8,323,645;美国专利申请公开号2016/0159910、2016/0017040、2016/0168249、2015/0315275、 2014/0134180、2014/0322129、2014/0356364、2014/0328751、2014/0294861、2014/0308259、 2013/0058864、2011/0085970、2009/0074660、2009/0208489;以及PCT公开号WO 2016/040724、WO 2016/070001、WO 2014/159835、WO 2014/100483、WO 2014/100439、 WO 2013/067492、WO 2013/025779、WO 2009/073533、WO 2007/067991和WO 2006/104677,其中的每一个通过引用并入本文。
BTLA.B和T淋巴细胞衰减子(BTLA),也称为CD272,以HVEM(疱疹病毒进入介体)作为其配体。BTLA的表面表达在人CD8
CTLA-4.细胞毒性T淋巴细胞抗原4(CTLA-4)是免疫调节CD28-B7免疫球蛋白超家族的成员,作用于幼稚和静止的T淋巴细胞,以通过B7依赖性和非B7依赖性途径促进免疫抑制(参见,例如,Kim等人(2016)《免疫学研究杂志(J.Immunol.Res.)》,文章编号4683607,第14页)。CTLA-4也被称为CD152。CTLA-4调节T细胞活化的阈值。参见,例如,Gajewski等人(2001)《免疫学杂志(J.Immunol.)》166(6):3900-7。已经开发了对CTLA-4具有特异性的多种免疫检查点调节剂,并且可以如本文公开的那样使用。在一些实施方案中,免疫检查点调节剂是调节CTLA-4的活性和/或表达的药剂。在一些实施方案中,免疫检查点调节剂是与CTLA-4结合的药剂(例如,抗CTLA-4抗体)。在一些实施方案中,检查点调节剂是CTLA-4激动剂。在一些实施方案中,检查点调节剂是 CTLA-4拮抗剂。在一些实施方案中,免疫检查点调节剂是选自由以下组成的组的CTLA-4 结合蛋白(例如,抗体):伊匹单抗(Yervoy;Medarex/Bristol-Myers Squibb)、曲美单抗 (以前称为替卡单抗;Pfizer/AstraZeneca)、JMW-3B3(阿伯丁大学)和AGEN1884 (Agenus)。另外的CTLA-4结合蛋白(例如,抗体)是本领域已知的,并且公开于例如以下文献中:美国专利号8,697,845;美国专利申请公开号2014/0105914、2013/0267688、 2012/0107320、2009/0123477;以及PCT公开号WO 2014/207064、WO 2012/120125、WO 2016/015675、WO 2010/097597、WO 2006/066568和WO 2001/054732,其中的每一个通过引用并入本文。
IDO.吲哚胺2,3-二加氧酶(IDO)是一种具有免疫抑制特性的色氨酸分解代谢酶。另一个重要的分子是TDO,色氨酸2,3-二加氧酶。已知IDO可抑制T和NK细胞,产生并活化Tregs和髓样来源的抑制细胞,并促进肿瘤血管生成。Prendergast等人,2014,《癌症免疫学与免疫治疗(Cancer Immunol Immunother.)》63(7):721–35,其通过引用并入本文。
已经开发了对IDO具有特异性的多种免疫检查点调节剂,并且可以如本文公开的那样使用。在一些实施方案中,免疫检查点调节剂是调节IDO的活性和/或表达的药剂。在一些实施方案中,免疫检查点调节剂是与IDO结合的药剂(例如,IDO结合蛋白,诸如抗IDO抗体)。在一些实施方案中,检查点调节剂是IDO激动剂。在一些实施方案中,检查点调节剂是IDO拮抗剂。在一些实施方案中,免疫检查点调节剂选自由以下组成的组:去氯烷、迷迭香酸、COX-2抑制剂、α-甲基色氨酸和依帕考司他。在一个实施方案中,调节剂是依帕卡定。
KIR.杀伤性免疫球蛋白样受体(KIR)包含多种MHCI结合分子,这些分子负调节自然杀伤(NK)细胞功能,从而保护细胞免受NK介导的细胞溶解。KIR通常在NK细胞上表达,但也已在肿瘤特异性CTL上检测到。已经开发了多种对KIR具有特异性的免疫检查点调节剂,并且可以如本文公开的那样使用。在一些实施方案中,免疫检查点调节剂是调节KIR的活性和/或表达的药剂。在一些实施方案中,免疫检查点调节剂是与KIR结合的药剂(例如,抗KIR抗体)。在一些实施方案中,免疫检查点调节剂是KIR结合蛋白 (例如,抗体)。在一些实施方案中,检查点调节剂是KIR激动剂。在一些实施方案中,检查点调节剂是KIR拮抗剂。在一些实施方案中,免疫检查点调节剂是lirilumab(也称为 BMS-986015;Bristol-MyersSquibb)。另外的KIR结合蛋白(例如,抗体)是本领域已知的,并且公开于例如以下文献中:美国专利号8,981,065、9,018,366、9,067,997、8,709,411、 8,637,258、8,614,307、8,551,483、8,388,970、8,119,775;美国专利申请公开号2015/0344576、 2015/0376275、2016/0046712、2015/0191547、2015/0290316、2015/0283234、2015/0197569、 2014/0193430、2013/0143269、2013/0287770、2012/0208237、2011/0293627、2009/0081240、 2010/0189723;以及PCT公开号WO 2016/069589、WO 2015/069785、WO 2014/066532、 WO 2014/055648、WO 2012/160448、WO 2012/071411、WO 2010/065939、WO 2008/084106、 WO 2006/072625、WO 2006/072626和WO 2006/003179,其中的每一个通过引用并入本文。
LAG-3淋巴细胞活化基因3(LAG-3,也称为CD223)是与CD4相关的跨膜蛋白,可竞争性结合MHC II,并且充当T细胞活化的共抑制性检查点(参见,例如,Goldberg 和Drake(2011)《微生物学和免疫学的当前主题(Curr.Top.Microbiol.Immunol.)》344: 269-78)。已经开发了对LAG-3具有特异性的多种免疫检查点调节剂,并且可以如本文公开的那样使用。在一些实施方案中,免疫检查点调节剂是调节LAG-3的活性和/或表达的药剂。在一些实施方案中,免疫检查点调节剂是与LAG-3结合的药剂(例如,抗PD-1抗体)。在一些实施方案中,检查点调节剂是LAG-3激动剂。在一些实施方案中,检查点调节剂是LAG-3拮抗剂。在一些实施方案中,免疫检查点调节剂是选自由以下组成的组的 LAG-3结合蛋白(例如,抗体):派姆单抗(Keytruda;以前称为兰博单抗;Merck&Co., Inc.)、纳武单抗(Opdivo;Bristol-Myers Squibb)、pidilizumab(CT-011,CureTech)、SHR-1210 (Incyte/江苏恒瑞医药有限公司)、MEDI0680(也称为AMP-514;Amplimmune Inc./Medimmune)、PDR001(Novartis)、BGB-A317(BeiGene Ltd.)、TSR-042(也称为ANB011;AnaptysBio/Tesaro,Inc.)、REGN2810(Regeneron Pharmaceuticals, Inc./Sanofi-Aventis)和PF-06801591(Pfizer)。另外的PD-1结合蛋白(例如,抗体)是本领域已知的,并且公开于例如以下文献中:美国专利号9,181,342、8,927,697、7,488,802、 7,029,674;美国专利申请公开号2015/0152180、2011/0171215、2011/0171220;以及PCT 公开号WO 2004/056875、WO 2015/036394、WO 2010/029435、WO 2010/029434、WO 2014/194302,其中的每一个通过引用并入本文。
PD-1.程序性细胞死亡蛋白1(PD-1,也称为CD279和PDCD1)是一种抑制性受体,会对免疫系统产生负作用。与主要影响幼稚T细胞的CTLA-4相反,PD-1在免疫细胞上更广泛地表达,并调节外周组织和肿瘤微环境中成熟的T细胞活性。PD-1通过干扰T细胞受体信号传导来抑制T细胞反应。PD-1具有两个配体,PD-L1和PD-L2。已经开发了对PD-1具有特异性的多种免疫检查点调节剂,并且可以如本文所公开的使用。在一些实施方案中,免疫检查点调节剂是调节PD-1的活性和/或表达的药剂。在一些实施方案中,免疫检查点调节剂是与PD-1结合的药剂(例如,抗PD-1抗体)。在一些实施方案中,检查点调节剂是PD-1激动剂。在一些实施方案中,检查点调节剂是PD-1拮抗剂。在一些实施方案中,免疫检查点调节剂是选自由以下组成的组的PD-1结合蛋白(例如,抗体):派姆单抗(Keytruda;以前称为兰博单抗;Merck&Co.,Inc.)、纳武单抗(Opdivo;Bristol-Myers Squibb)、pidilizumab(CT-011,CureTech)、SHR-1210(Incyte/江苏恒瑞医药有限公司)、 MEDI0680(也称为AMP-514;Amplimmune Inc./Medimmune)、PDR001(Novartis)、 BGB-A317(BeiGene Ltd.)、TSR-042(也称为ANB011;AnaptysBio/Tesaro,Inc.)、REGN2810 (Regeneron Pharmaceuticals,Inc./Sanofi-Aventis)以及PF-06801591(Pfizer)。另外的PD-1 结合蛋白(例如,抗体)是本领域已知的,并且公开于例如以下文献中:美国专利号 9,181,342、8,927,697、7,488,802、7,029,674;美国专利申请公开号2015/0152180、 2011/0171215、2011/0171220;以及PCT公开号WO 2004/056875、WO 2015/036394、WO 2010/029435、WO 2010/029434、WO 2014/194302,其中的每一个通过引用并入本文。
PD-L1/PD-L2.PD配体1(PD-L1,也称为B7-H1)和PD配体2(PD-L2,也称为PDCD1LG2、CD273和B7-DC)与PD-1受体结合。这两个配体都属于与CD28和CTLA-4 相互作用的B7-1和B7-2蛋白相同的B7家族。PD-L1可以在许多细胞类型上表达,包括例如上皮细胞、内皮细胞和免疫细胞。PDL-1的连接减少IFNγ、TNFα和IL-2的产生,并刺激IL10的产生——其是一种与T细胞反应性和增殖降低以及抗原特异性T细胞无反应性相关的抗炎细胞因子。PDL-2主要在抗原呈递细胞(APC)上表达。PDL2的连接也可引致T细胞抑制,但在PDL-1-PD-1相互作用经由G1/G2期细胞周期阻滞抑制增殖的情况下,PDL2-PD-1的结合已被证明可通过在低抗原浓度下阻断B7:CD28信号以及在高抗原浓度下减少细胞因子的产生来抑制TCR介导的信号传导。已经开发了对PD-L1和PD-L2 具有特异性的多种免疫检查点调节剂,并且可以如本文公开的那样使用。
在一些实施方案中,免疫检查点调节剂是调节PD-L1的活性和/或表达的药剂。在一些实施方案中,免疫检查点调节剂是与PD-L1结合的药剂(例如,抗PD-L1抗体)。在一些实施方案中,检查点调节剂是PD-L1激动剂。在一些实施方案中,检查点调节剂是PD-L1 拮抗剂。在一些实施方案中,免疫检查点调节剂是选自由以下组成的组的PD-L1结合蛋白 (例如,抗体或Fc融合蛋白):杜鲁伐单抗(也称为MEDI-4736;AstraZeneca/Celgene Corp./Medimmune)、阿特朱单抗(Tecentriq;也称为MPDL3280A和RG7446;Genetech Inc.)、奥维单抗(也称为MSB0010718C;Merck Serono/AstraZeneca)、MDX-1105 (Medarex/Bristol-Meyers Squibb)、AMP-224(Amplimmune,GlaxoSmithKline)、LY3300054 (Eli Lilly和Co.)。另外的PD-L1结合蛋白是本领域已知的,并且公开于例如以下文献中:美国专利申请公开号2016/0084839、2015/0355184、2016/0175397,以及PCT公开号WO 2014/100079、WO2016/030350、WO2013181634,其中的每一个通过引用并入本文。
在一些实施方案中,免疫检查点调节剂是调节PD-L2的活性和/或表达的药剂。在一些实施方案中,免疫检查点调节剂是与PD-L2结合的药剂(例如,抗PD-L2抗体)。在一些实施方案中,检查点调节剂是PD-L2激动剂。在一些实施方案中,检查点调节剂是PD-L2 拮抗剂。PD-L2结合蛋白(例如,抗体)是本领域已知的,并且公开于例如以下文献中:美国专利号9,255,147、8,188,238;美国专利申请公开号2016/0122431、2013/0243752、 2010/0278816、2016/0137731、2015/0197571、2013/0291136、2011/0271358;以及PCT公开号WO2014/022758和WO 2010/036959,其中的每一个通过引用并入本文。
TIM-3.T细胞免疫球蛋白粘蛋白3(TIM-3,也称为甲型肝炎病毒细胞受体(HAVCR2)) 是与S型凝集素半乳糖凝集素9(Gal-9)结合的A型糖蛋白受体。TIM-3是在淋巴细胞、肝脏、小肠、胸腺、肾脏、脾脏、肺、肌肉、网状细胞和脑组织上广泛表达的配体。Tim-3最初被鉴定为在分泌IFN-γ的Th1和Tc1细胞上选择性表达(Monney等人(2002)《自然(Nature)》415:536-41)。TIM-3受体与Gal-9结合会触发下游信号传导,从而负面调节 T细胞的存活和功能。已经开发了多种对TIM-3具有特异性的免疫检查点调节剂,并且可以如本文公开的那样使用。在一些实施方案中,免疫检查点调节剂是调节TIM-3的活性和 /或表达的药剂。在一些实施方案中,免疫检查点调节剂是与TIM-3结合的药剂(例如,抗TIM-3抗体)。在一些实施方案中,检查点调节剂是TIM-3激动剂。在一些实施方案中,检查点调节剂是TIM-3拮抗剂。在一些实施方案中,免疫检查点调节剂是选自由TSR-022 (AnaptysBio/Tesaro,Inc.)和MGB453(Novartis)组成的组的抗TIM-3抗体。另外的TIM-3 结合蛋白(例如,抗体)是本领域已知的,并且公开于例如以下文献中:美国专利号 9,103,832、8,552,156、8,647,623、8,841,418;美国专利申请公开号2016/0200815、 2015/0284468、2014/0134639、2014/0044728、2012/0189617、2015/0086574、2013/0022623;以及PCT公开号WO2016/068802、WO 2016/068803、WO 2016/071448、WO 2011/155607 和WO 2013/006490,其中的每一个通过引用并入本文。
VISTA.T细胞活化的V结构域Ig抑制剂(VISTA,也称为血小板受体Gi24)是对T 细胞反应产生负调节的Ig超家族配体。参见,例如,Wang等人,2011,《实验医学杂志(J.Exp.Med.)》208:577-92。在APC上表达的VISTA直接抑制CD4
在一些实施方案中,向受试者给药多于一种(例如2种、3种、4种、5种或更多种) 的免疫检查点调节剂。在给药多于一种的免疫检查点调节剂的情况下,调节剂可以各自靶向刺激性免疫检查点分子,或各自靶向抑制性免疫检查点分子。在其他实施方案中,免疫检查点调节剂包括至少一种靶向刺激性免疫检查点的调节剂和至少一种靶向抑制性免疫检查点分子的免疫检查点调节剂。在某些实施方案中,免疫检查点调节剂是结合蛋白,例如抗体。如本文所使用的,术语“结合蛋白”是指可以特异性结合靶标分子(例如免疫检查点分子)的蛋白质或多肽。在一些实施方案中,结合蛋白是抗体或其抗原结合部分,而靶标分子是免疫检查点分子。在一些实施方案中,结合蛋白是与靶标分子(例如,免疫检查点分子)特异性结合的蛋白或多肽。在一些实施方案中,结合蛋白是配体。在一些实施方案中,结合蛋白是融合蛋白。在一些实施方案中,结合蛋白是受体。可用于本发明方法的结合蛋白的实例包括但不限于人源化抗体、抗体Fab片段、二价抗体、抗体药物缀合物、 scFv、融合蛋白、二价抗体以及四价抗体。
免疫检查点调节剂抗体包括但不限于至少4个主要类别:i)直接在T细胞或自然杀伤(NK)细胞上阻断抑制途径的抗体(例如,PD-1靶向抗体,诸如纳武单抗和派姆单抗,靶向TIM-3的抗体,以及靶向LAG-3、2B4、CD160、A2aR、BTLA、CGEN-15049和KIR 的抗体),ii)直接在T细胞或NK细胞上活化刺激途径的抗体(例如,靶向OX40、GITR 和4-1BB的抗体),iii)阻断免疫细胞抑制途径或依赖于抗体依赖性细胞毒性以消灭免疫细胞抑制种群的抗体(例如,靶向CTLA-4的抗体(诸如伊匹单抗),靶向VISTA的抗体,以及靶向PD-L2、Gr1和Ly6G的抗体),以及iv)直接在癌细胞上阻断抑制途径或依靠抗体依赖性细胞的细胞毒性以增强对癌细胞的细胞毒性的抗体(例如,利妥昔单抗,靶向 PD-L1的抗体,以及靶向B7-H3、B7-H4、Gal-9和MUC1的抗体)。检查点抑制剂的实例包括,例如,CTLA-4的抑制剂,诸如伊匹单抗或曲美单抗;PD-1途径的抑制剂,诸如抗 PD-1、抗PD-L1或抗PD-L2抗体。示例性的抗PD-1抗体描述于WO 2006/121168、WO 2008/156712、WO 2012/145493、WO 2009/014708和WO 2009/114335中。示例性的抗PD-L1 抗体描述于WO 2007/005874、WO 2010/077634和WO 2011/066389中,并且示例性的抗 PD-L2抗体描述于WO 2004/007679中。
在特定的实施方案中,免疫检查点调节剂是融合蛋白,例如,调节免疫检查点调节剂的活性的融合蛋白。
在一个实施方案中,免疫检查点调节剂是治疗性核酸分子,例如调节免疫检查点蛋白或mRNA表达的核酸。核酸治疗剂是本领域众所周知的。核酸治疗剂包括与细胞中靶标序列互补的单链和双链(即,具有长度为至少15个核苷酸的互补区的核酸治疗剂)核酸。在某些实施方案中,核酸治疗剂靶向编码免疫检查点蛋白的核酸序列。
应当注意的是,可以与本文提供的UBE2K抑制剂(例如UBE2K的特异性抑制剂) 制剂组合给药多于一种(例如2种、3种、4种、5种或更多种)的另外的抗癌剂。例如,在一个实施方案中,可以将两种另外的化学治疗剂与UBE2K抑制剂组合给药。本文提供的化学治疗剂的适当剂量和给药途径是本领域已知的。
实例
通过在体外泛癌模型中采用Interrogative Biology
假设从代表多种组织来源/细胞系的泛癌体外模型中标识出UBE2K,则选择一个子集进行初始体外验证研究。基于用于网络产生的蛋白质组学数据,在Miapaca2胰腺癌细胞系中标识了UBE2K蛋白表达的稳健变化。此外,由于UBE2K可以与两种相关的肿瘤抑制因子(p53,BRCA1)协同工作,因此我们选择了代表这些肿瘤抑制因子相关且属于泛癌体外模型的肿瘤类型的其他细胞系,即乳腺癌和肝细胞癌(HCC)。SkBr-3(乳腺)和 HepG2(HCC)用于网络产生。还将T47D、MDA-MB231和BT549(乳腺)以及SKHEP1 和Hep3B(HCC)包括在内,以提供有关p53和BRCA1状态的更多多样性,从而允许有可能在这些背景下捕获UBE2K的规范和非规范功能。表1总结了用于初始验证研究的细胞系。
表1:用于初始验证研究的细胞系
*p53热点突变密码子
为了进行初步验证研究,使用siRNA介导的方法在Miapaca2、HepG2、SKHEP1、Hep3B、MDAMB231、SKBR3、T47D和BT549细胞中瞬时敲低UBE2K。非靶向(NT) siRNA序列用作对照。在转染后24和96h时收集用于确认转录物和蛋白水平敲低的样品,并在转染后96h时使用细胞滴度荧光评估UBE2K瞬时敲低对细胞存活率/细胞数量的影响。平行地,在上述细胞系中评估了siRNA介导的UBE2K敲低对阿霉素(细胞死亡引发剂)敏感性的影响。从转染后24小时开始,将细胞暴露于阿霉素72小时。
使用这种siRNA介导的方法,转染后24h时,在所有测试细胞系的转录物和蛋白质水平上,UBE2K的敲低率均达到70%以上(参见图2和图3),这在表型测定中为评估 UBE2K敲低效果提供了合理的窗口。在基础条件下,转染后96h小时,UBE2K siRNA介导的敲低引致Miapaca2胰腺癌细胞的细胞数量减少50%,并且SKHEP1和HepG2肝癌细胞的细胞数量减少30%(图4)。在剩余的5种癌细胞系中未观察到UBE2K siRNA的影响。此外,在所有测试的细胞系中,响应于UBE2K siRNA介导的敲低,对阿霉素诱导的细胞死亡的敏感性均未改变(图5和表2)。表3列出了结果的总结。
表2.UBE2K siRNA介导的敲低对阿霉素敏感性的影响。提供了在具有和没有siRNA介导的UBE2K敲低的情况下细胞中阿霉素的IC
表3:UBE2K siRNA介导的敲低对细胞数量和阿霉素敏感性影响的结果总结。
细胞中的UBE2K敲低可以触发其他相关E2的补偿性调节。为了理解这种可能性,在siRNA介导的UBE2K敲低后研究了相关E2的表达。基于底物泛素化的常见E3(E2D1、 E2D2、E2D3)的存在或合成Lys 48键合的泛素链(E2N、cdc34、E2D)的能力选择相关的E2。E2R2也包括在研究中,因为它与cdc34密切相关。来自Miapaca2细胞的数据如图 6所示。发现UBE2K在转染后24h和96h时被敲低,并且相关E2的表达似乎在两个时间点都不受UBE2K敲低的影响,这表明缺乏补偿性转录反应。在评估的所有其他细胞系 (SKHEP1、HepG2、Hep3B、MDAMB231、BT549、SKBR3和T47D)中也获得了相似的结果。因此,siRNA介导的UBE2K敲低不会引致相关E2的代偿性转录反应。
UBE2K是泛素蛋白酶体系统的一部分,负责细胞中大约80%的蛋白质的周转。为了研究UBE2K敲低的效果是否取决于细胞的增殖状态,在存在5%血清(培养基)或0.5%血清的情况下,使UBE2K敲低的Miapaca2细胞生长,并在转染后96h时评估细胞数量。如所预期的,在5%血清条件下与0.5%血清相比,细胞数量增加,表明血清刺激增殖。然而,在两种血清条件下,UBE2K敲低的细胞数量均以相似的程度降低(在0.5%血清中为 64.1%,在5%血清中为64.3%;图8),表明UBE2K敲低的效果与增殖状态无关。
Miapaca2细胞中的UBE2K敲低引致细胞数量减少50%。为了了解细胞数量的这种变化是否是由于增加的细胞死亡或减少的细胞增殖所致,分别使用PI/Annexin V和PI细胞周期分析评估了UBE2K siRNA处理的细胞对比非靶向siRNA处理的细胞。PI/Annexin V 数据表明,在siRNA转染后96h时,UBE2K敲低引致6-8%的细胞死亡。使用PI细胞周期分析评估UBE2K敲低细胞中的细胞增殖(转染后48h)表明,与非靶向siRNA转染的细胞相比,在UBE2KsiRNA转染的细胞中在G2/M期发现的细胞多20%(图9)。G2/M 期细胞群的这种增加与G1期细胞群的减少相对应,表明细胞被阻滞在G2/M期。血清饥饿用作细胞周期改变的正对照,引致预期的G1阻滞。因此,siRNA介导的UBE2K敲低使癌细胞数量减少,这是稳健的G2/M细胞周期阻滞的结果,并适度增加了细胞凋亡/坏死。
为了标识与观察到的表型机械键合的可能的UBE2K依赖性底物,使用可用于UBE2K酵母的两种杂交筛选/共免疫沉淀技术产生了UBE2K相互作用子的精选列表(来源:BioGrid)。基于底物与其他E2的相互作用以及底物在细胞增殖/细胞死亡中的作用来选择底物(表4)。发现7种UBE2K相互作用子中有3种的蛋白质水平响应于UBE2K敲低而增加,有两种降低,而另外两种则保持不变(图9A和图9B)。未发现这些相互作用子的表达在转录物水平上发生改变,表明调节可以在翻译后发生。
表4:UBE2K相互作用子的精选列表
实例3:同步化的MiaPaca2胰腺癌细胞中siRNA介导的UBE2K敲低
siRNA介导的UBE2K敲低的细胞中细胞周期蛋白B1的积累与G2/M阻滞一致,因为细胞周期蛋白B1降解需要退出M期;因此,当发生G2/M阻滞时,其水平保持升高。为了进一步了解UBE2K对细胞周期调节的影响的机制基础,尤其是其在细胞周期蛋白B1 降解中的作用,我们随时间推移跟踪了在调节和不调节UBE2K的表达水平的情况下同步化的MiaPaca2细胞中各种细胞周期调节蛋白的水平。实验设置如下:(A)通过血清剥夺在G0/G1期同步化MiaPaCa2细胞,并且随后用siRNA转染48h,(B)通过添加2x FBS (在DMEM中为20%)培养基持续4天从血清剥夺中释放同步化的细胞,(C)测量细胞存活率以及各种细胞周期调节因子的水平,包括细胞周期蛋白D1、E1、A2和B1和Cdc20。
细胞周期分析比较了MiaPaca2细胞的异步种群(在DMEM+10%FBS中生长)与血清饥饿48h的细胞,表明约80-85%的细胞由于血清饥饿而在G1期被同步化(图10)。
与我们在未同步化的MiaPaca2细胞群中观察到的情况相似,在同步化的MiaPaCa2种群中类似地检测到siRNA介导的UBE2K敲低条件下存活细胞的数量减少。具体地,在从同步化释放后的96小时时,与非靶向(NT)siRNA对照相比,MiaPaCa-2 UBE2K敲低细胞的存活细胞减少了约40%(图11)。
细胞周期蛋白家族蛋白通过活化细胞周期蛋白依赖性激酶(Cdks)来控制整个细胞周期的细胞进程。随着细胞进入细胞周期的不同阶段,细胞周期蛋白水平会在每个检查点 (G1/S和G2/M)之后急剧下降,因为细胞周期蛋白会被细胞质酶降解。图12中示出了代表人细胞周期蛋白在细胞周期不同阶段的表达水平的示意图。细胞周期蛋白B1已显示出与UBE2K相互作用,是一种参与有丝分裂的调节蛋白。虽然细胞周期蛋白B1在整个细胞周期过程中积累并在有丝分裂过程中被活化,但其在有丝分裂结束时的降解对于细胞周期的进展至关重要。Cdc20是后期促进复合物/环体(APC/C)的高度保守的活化剂,可促进细胞周期调节的泛素化和许多关键细胞周期调节靶标的蛋白水解,包括有丝分裂细胞周期蛋白(A和B)和分离酶抑制蛋白。
从细胞同步化和释放获得的样品用于执行免疫印迹,以检查各种细胞周期调节因子的水平。蛋白印迹的结果证实48小时后,siRNA转染可敲低UBE2K。在0h时的细胞周期蛋白E1水平表明细胞已停止在G1期。在0、24和36h时的细胞周期蛋白D1和E1水平表明,细胞通过G1和S期循环而不受UBE2K敲低的干扰。相反,虽然细胞周期蛋白A2、细胞周期蛋白B1和Cdc20蛋白水平以相似的程度积累,但在UBE2K siRNA处理的细胞中,它们的水平恢复到基线的速度较慢,表明降解受损。这些观察结果以及释放后活细胞数量的减少表明,MiaPaca2细胞中UBE2K的损失会干扰中期到后期的过渡,从而引致细胞中的G2/M阻滞(图13)。
实例4:UBE2K敲低和Cdc34敲低对MiaPaCa2胰腺癌细胞存活率的影响的比较
已知UBE2K在其底物上优先催化Lys48键合的聚泛素链的形成,引致其蛋白酶体降解。Cdc34(Ube2R1)是泛素蛋白酶体系统中的另一条Lys-48链构建E2酶,可催化泛素介导的细胞周期G1调节因子降解并调节多种癌症类型的肿瘤抑制因子。上述结果表明,由于稳健的G2/M细胞周期阻滞,在MiaPaca2细胞中使用靶标siRNA敲低UBE2K引致活细胞数量减少。由于UBE2K是在泛素系统中发现的大约50个E2之中的一种,因此评估细胞中UBE2K的特异性很重要。为了确定上述表型是否特异于UBE2K的功能,在 MiaPaca2细胞中瞬时敲低功能相似的E2酶cdc34,并与UBE2K敲低的效果进行比较。在蛋白质水平上确认了基因敲低(图14)。如所预期的,与NT siRNA处理的MiaPaca2细胞相比,UBE2K敲低引致转染后72小时时细胞存活率降低约20%。相反,Cdc34敲低对 MiaPaca2细胞存活率的影响最小(图15),支持UBE2K在这种细胞类型中的独特作用。
实例5:MiaPaca2胰腺细胞中稳定的sh-RNA介导的UBE2K敲低
为了进行体内概念验证研究,产生了具有稳定UBE2K敲低的MiaPaca2细胞系。为此,用含有靶向UBE2K的shRNA或非靶向对照的慢病毒转导Miapaca2细胞。细胞系作为细胞的混合种群(“克隆池”)而产生。在mRNA(数据未显示)和蛋白质水平上验证了UBE2K 的高效敲低(图16)。此外,稳定敲低UBE2K(shRNA 2和shRNA3)会引致细胞周期调节因子细胞周期蛋白A2、细胞周期蛋白B1和cdc20的蛋白质水平增加(图16)。在接种后72h时,UBE2K shRNA还诱导了较慢的生长表型,如UBE2K稳定敲低细胞中的细胞或细胞核计数对比非靶向shRNA转导的细胞较少(图17和图18)。综上所述,这些数据表明,使用siRNA介导的UBE2K敲低观察到的关键发现在UBE2K稳定的敲低细胞中得以概括。
实例6:UBE2K在人胰腺肿瘤中的表达
使用两个数据集对人胰腺肿瘤中的UBE2K表达进行评估,一个数据集来自外部可公开获得的数据集,另一个数据集来自可商购获得的肿瘤组织阵列过程。UBE2K的肿瘤表达(mRNA)和胰腺导管腺癌患者的生存数据从可公开获得的TCGA数据库获得。结果表明较低的UBE2K表达与患者存活率增加之间存在相关性(图19)。
使用包含75个胰腺组织样品和匹配的正常邻近组织的组织微阵列对UBE2K表达(蛋白质)进行了免疫组织化学分析(图20)。病理学家对染色的组织进行评分,并评估为强、中等和弱染色。染色的局部也被记为膜、细胞质或核。染色概况的统计分析表明,对比正常的邻近组织,肿瘤组织中的UBE2K染色明显更强(表4,p值<2e-16)。此外,仅在肿瘤组织中而不在正常的邻近组织中观察到UBE2K对膜的染色(表5,p值<2e-16)。
表5.正常组织对比肿瘤组织中UBE2K染色在亚细胞定位方面的统计分析
实例7:UBE2K的小分子抑制剂在人类癌症的细胞培养物中的作用
使用以上实例2中提供的方法,确定了UBE2K小分子抑制剂对以下人类癌细胞系的细胞增殖和细胞死亡的影响:绒毛膜癌(JAR)、卵巢癌(PA-1)、T细胞白血病(Jurkat 克隆E6.1)、淋巴瘤(SR)、胚胎癌(NCCIT)、DB、B细胞淋巴瘤(SU-DHL-6)、骨肉瘤 (MG63)、皮肤癌(DU4475)、T淋巴母细胞白血病(MOLT-4)、慢性粒细胞白血病(K562 和KU812)、间变性大细胞淋巴瘤(SU-DHL-1)以及结直肠腺癌(SW48)。预期UBE2K 的小分子抑制剂将减少这些人类癌细胞系中的细胞增殖并诱导细胞死亡。
实例8:UBE2K的小分子抑制剂在人类癌症的小鼠模型中的作用
评价实例7中描述的癌症的小鼠模型,以确定小分子UBE2K抑制剂对体内肿瘤发展的影响。对于每种小鼠模型,将人类癌细胞(1x10
i.第1组-不治疗。
ii.第2组-用UBE2K小分子抑制剂治疗
观察小鼠的生存力和继发症状,并通过触诊监测形成肿瘤的癌症的生长。在死亡时,从小鼠中收获肿瘤,并且测量、称重和分析肿瘤脉管系统的存在。预期UBE2K的小分子抑制剂将增加小鼠的生存力、减轻继发症状、减小肿瘤大小。
- 通过抑制泛素缀合酶E2 K(UBE2K)治疗癌症的方法
- 泛素结合酶E2抑制剂和溶瘤病毒在制备抗肿瘤药物的应用
