一种肿瘤级别分析装置及相关组件
文献发布时间:2023-06-19 11:29:13
技术领域
本发明涉及图像分析技术领域,特别是涉及一种肿瘤级别分析装置、设备、系统及方法。
背景技术
乳腺疾病是女性的常见病,近些年的临床经验总结表明,乳腺检测的准确率低下是乳腺癌患者死亡率无法降低的原因之一。针对这一问题,现有技术中存在乳腺X光成像、核磁共振成像,超声成像和光学成像等乳腺检测方法。其中光学成像是一种无辐射,快速,简单,无痛,无创的成像方法。随着物理光学的发展以及光在组织中传播的数学模型的不断进步,光学成像领域诞生了新技术——扩散光学层析成像技术(DOT,Diffuse OpticalTomography),DOT测量速度快,设备成本低,相对于其他成熟的成像方式具有安全、无电离辐射、高灵敏度、可动态成像和可以功能性成像等优点,使乳房组织透视成像成为可能,大大提高了乳房组织光学成像的灵敏度和特异度。
基于DOT的近红外乳房成像可以重建出二维(或者伪三维)的光学吸收系数进行分析。这种成像技术获取的图像是功能成像,即根据图像的特征成像(通过找出物体的特征进行成像,以便通过对不同特征的辨认来区分肿瘤的良恶性),而非传统的形态成像(将物体的形态成像,以便通过对不同形态的辨认来区分肿瘤的良恶性)。目前在得到乳房特征成像后,需要有经验的医生分析图像,并给出是否有肿瘤及肿瘤良恶性的判断结果,但有经验的医生短缺,导致目前对于乳腺疾病的检测精准度较低。
综上所述,如何实现自动精准的乳腺图像分析以及判别,是目前本领域技术人员急需解决的技术问题。
发明内容
本发明的目的是提供一种肿瘤级别分析装置、设备、系统及方法,可以实现自动精准的乳腺图像分析以及判别。
为解决上述技术问题,本发明提供如下技术方案:
一种肿瘤级别分析装置,包括:
光学系数图生成单元,用于接收加压过程近红外LED灯照射下的乳腺图像,并根据所述乳腺图像生成乳腺组织光学系数随时间动态变化的彩图;
位置量化单元,用于根据所述彩图中的病灶区的中心与可疑标记点之间的距离确定对应的良恶性等级,作为位置等级;
空间量化单元,用于根据所述病灶区的形状随时间变化特征确定对应的良恶性等级,作为空间等级;
时间量化单元,用于确定时间曲线的曲线类型对应的良恶性等级,作为时间等级;所述时间曲线为所述病灶区的平均吸收强度随时间变化的曲线;
对比量化单元,用于确定所述时间曲线与背景曲线间的相似程度对应的良恶性等级,作为对比等级;所述背景曲线为所述彩图中绿色背景点的吸收强度随时间变化的曲线;
结果生成单元,用于根据肿瘤等级匹配规则,确定与所述位置等级、所述空间等级、所述时间等级、所述对比等级匹配的肿瘤等级。
可选地,所述位置量化单元,包括:
判断子单元,用于判断所述彩图中是否存在病灶区,若不存在,判定为良性;若存在,触发目标识别子单元;
所述目标识别子单元,用于确定所述病灶区中吸收强度最大的点,作为所述中心;并识别所述彩图中的可疑标记点,生成以所述可疑标记点为中心的三环,触发目标分类子单元;
所述目标分类子单元,用于确定所述彩图中乳房的大小;若所述乳房属于大乳房,触发第一识别子单元;若所述乳房属于小乳房,触发第二识别子单元;
所述第一识别子单元,用于判断所述中心是否位于所述三环内,或与所述三环的距离是否小于距离阈值;若所述中心位于所述三环内,或与所述三环的距离小于所述距离阈值,判定病灶区有效,位置等级为可能恶性;若所述中心不在所述三环内,且与所述三环的距离不小于所述距离阈值,判定病灶区无效,位置等级为良性;
所述第二识别子单元,用于判断所述中心是否位于所述三环内;若所述中心位于所述三环内判定病灶区有效,位置等级为可能恶性;若所述中心不在所述三环内,判定病灶区无效,位置等级为良性。
可选地,所述空间量化单元,包括:
聚焦性量化子单元,用于确定各帧所述彩图中蓝色区域与深蓝色区域相对于有效光照区域的面积比例确定聚焦性特征;
峰碗状量化子单元,用于确定各帧所述彩图中存在吸收强度最大的帧的目标彩图中最大的吸收强度值;根据所述吸收强度值设定区域分割阈值;根据所述区域分割阈值从所述目标彩图中分割出目标区域以及周围区域;根据所述目标区域与所述周围区域的平均吸收强度之比确定静态峰碗状特征;根据所述目标区域分别在各帧所述彩图中平均吸收强度间的差异确定动态峰碗状特征;根据所述静态峰碗状特征以及所述动态峰碗状特征生成峰碗状特征;
稳定性量化子单元,用于根据所述病灶区在各帧所述彩图中的位置间的偏离程度确定稳定性特征;
综合量化子单元,用于根据所述稳定性特征、所述峰碗状特征、所述聚焦性特征生成空间等级的判定结果。
可选地,所述时间量化单元,包括:
幅度量化子单元,用于根据预设上升/下降幅度特征对所述时间曲线进行识别,若在所述预设上升/下降幅度特征中存在匹配幅度特征,确定所述匹配幅度特征对应的良恶性等级,作为时间等级;
线型量化子单元,用于若在所述预设上升/下降幅度特征中不存在匹配幅度特征,调用分类器对所述时间曲线进行线型精准区分,生成匹配线型,确定所述匹配线型对应的良恶性等级,作为所述时间等级。
可选地,所述对比量化单元,具体为:差分对比量化单元;
所述差分对比量化单元,用于:生成所述时间曲线与背景曲线对应的差分曲线,根据所述差分曲线的曲线特征确定相似程度,将所述相似程度对应的良恶性等级作为所述对比等级。
可选地,所述差分对比量化单元,包括:
差分曲线生成子单元,用于生成所述时间曲线与背景曲线对应的差分曲线;
差分斜率确定子单元,用于确定所述差分曲线中各点对应的斜率;
差分分类子单元,用于若所述斜率的绝对值均小于平缓阈值,判定为像;若存在所述斜率的绝对值大于波动阈值,所述对比等级判定为不像;若存在所述斜率的绝对值不小于所述平缓阈值,且所述斜率的绝对值均不大于所述波动阈值,所述对比等级判定为不确定。
可选地,所述结果生成单元,具体用于:
若所述位置等级为良性,则肿瘤等级为良性;
若所述位置等级为可能恶性,且所述时间等级为恶性,所述空间等级以及所述对比等级至少一个为可能恶性,则肿瘤等级为恶性;
若所述位置等级为可能恶性,且所述时间等级为恶性,所述空间等级以及所述对比等级均为不确定,则肿瘤等级为可能恶性;
若所述位置等级与所述时间等级均为可能恶性,且所述空间等级以及所述对比等级至少一个为可能恶性,则肿瘤等级为可能恶性;
若所述位置等级为可能恶性,且所述时间等级为可能良性,则肿瘤等级为可能良性;
若所述位置等级为可能恶性,且所述时间等级与所述空间等级均为不确定,所述对比等级为可能良性,则肿瘤等级为可能良性;
其它所述位置等级、所述空间等级、所述时间等级、所述对比等级的组合下,肿瘤等级为不确定。
一种肿瘤级别分析设备,包括:
存储器,用于存储计算机程序;
处理器,用于执行所述计算机程序时实现接收加压过程近红外LED灯照射下的乳腺图像,并根据所述乳腺图像生成乳腺组织光学系数随时间动态变化的彩图;根据所述彩图中的病灶区的中心与可疑标记点之间的距离确定对应的良恶性等级,作为位置等级;根据所述病灶区的形状随时间变化特征确定对应的良恶性等级,作为空间等级;确定时间曲线的曲线类型对应的良恶性等级,作为时间等级;所述时间曲线为所述病灶区的平均吸收强度随时间变化的曲线;确定所述时间曲线与背景曲线间的相似程度对应的良恶性等级,作为对比等级;所述背景曲线为所述彩图中绿色背景点的吸收强度随时间变化的曲线;根据肿瘤等级匹配规则,确定与所述位置等级、所述空间等级、所述时间等级、所述对比等级匹配的肿瘤等级的步骤。
一种肿瘤级别分析方法,包括:
接收加压过程近红外LED灯照射下的乳腺图像,并根据所述乳腺图像生成乳腺组织光学系数随时间动态变化的彩图;
根据所述彩图中的病灶区的中心与可疑标记点之间的距离确定对应的良恶性等级,作为位置等级;
根据所述病灶区的形状随时间变化特征确定对应的良恶性等级,作为空间等级;
确定时间曲线的曲线类型对应的良恶性等级,作为时间等级;所述时间曲线为所述病灶区的平均吸收强度随时间变化的曲线;
确定所述时间曲线与背景曲线间的相似程度对应的良恶性等级,作为对比等级;所述背景曲线为所述彩图中绿色背景点的吸收强度随时间变化的曲线;
根据肿瘤等级匹配规则,确定与所述位置等级、所述空间等级、所述时间等级、所述对比等级匹配的肿瘤等级。
一种肿瘤级别分析系统,包括:乳腺扩散光学层析成像设备以及所述的肿瘤级别分析设备;
所述乳腺扩散光学层析成像设备用于采集加压过程近红外LED灯照射下的乳腺图像,将所述乳腺图像发送至所述肿瘤级别分析设备。
本发明实施例所提供的肿瘤级别分析装置中,根据一个时间范围内光学成像的乳腺图像进行动态肿瘤特征量化分析,具体通过光学系数图生成单元、位置量化单元、空间量化单元、时间量化单元、对比量化单元自动对肿瘤特征提取并进行分级,并根据结果生成单元进行肿瘤等级匹配,进行良恶性等级量化输出,输出具有良恶性分级的肿瘤级别,整个识别过程无需人工参与,不依赖于有经验的医生阅片,操作简单且效率高,以便于以便医生判别乳腺中有无肿瘤以及对肿瘤的良恶性进行判别。
相应地,本发明实施例还提供了与上述肿瘤级别分析装置相对应的肿瘤级别分析设备、方法、系统,具有上述技术效果,在此不再赘述。
附图说明
为了更清楚地说明本发明实施例或相关技术中的技术方案,下面将对实施例或相关技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
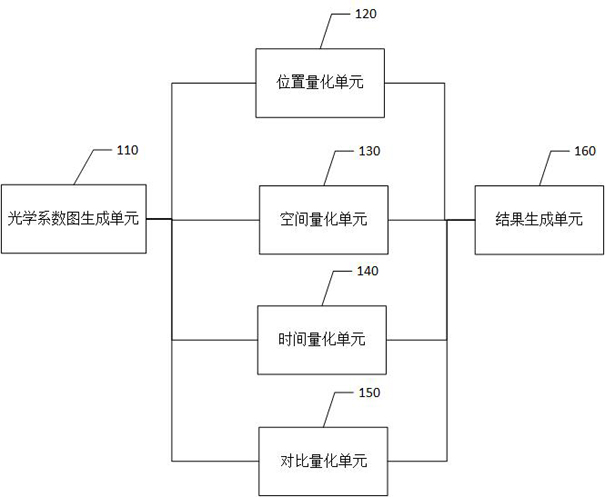
图1为本发明实施例中一种肿瘤级别分析装置的结构示意图;
图2为本发明实施例中一种位置量化单元的识别示意图;
图3为本发明实施例中一种小乳房的彩图示意图;
图4为本发明实施例中一种大乳房的彩图示意图;
图5为本发明实施例中一种蓝色区域有效标准示意图;
图6a为本发明实施例中一种快速下降型曲线示意图;
图6b为本发明实施例中另一种快速下降型曲线示意图;
图6c为本发明实施例中第三种快速下降型曲线示意图;
图7a为本发明实施例中一种缓慢下降型曲线示意图;
图7b为本发明实施例中另一种缓慢下降型曲线示意图;
图7c为本发明实施例中第三种缓慢下降型曲线示意图;
图7d为本发明实施例中第四种缓慢下降型曲线示意图;
图8a为本发明实施例中一种波动型曲线示意图;
图8b为本发明实施例中另一种波动型曲线示意图;
图8c为本发明实施例中第三种波动型曲线示意图;
图9为本发明实施例中一种分类器识别线型示意图;
图10为本发明实施例中一种由分类器识别的线型示意图;
图11为本发明实施例中一种相似差分示意图;
图12a为本发明实施例中一种不相似差分示意图;
图12b为本发明实施例中另一种不相似差分示意图;
图13为本发明实施例中一种肿瘤级别分析设备的具体结构示意图。
具体实施方式
本发明的核心是提供一种肿瘤级别分析装置,可以实现自动精准的乳腺图像分析以及判别。
为了使本技术领域的人员更好地理解本发明方案,下面结合附图和具体实施方式对本发明作进一步的详细说明。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
请参考图1,图1为本发明实施例中一种肿瘤级别分析装置的结构示意图,该装置主要包括以下单元:光学系数图生成单元110、位置量化单元120、空间量化单元130、时间量化单元140、对比量化单元150以及结果生成单元160。其中,位置量化单元120、空间量化单元130、时间量化单元140以及对比量化单元150的输入端连接至光学系数图生成单元110,输出端连接至结果生成单元160。
1、光学系数图生成单元110,主要用于接收加压过程近红外LED灯照射下的乳腺图像,并根据乳腺图像确定乳腺轮廓内的光学吸收系数的变化情况,生成乳腺组织光学系数随时间动态变化的彩图(又称为DOBI伪彩图像),需要说明的是,接收的乳腺图像中需要至少包括一次完成的加压过程中每个时刻采集到的图像,是一种动态多帧图像。
其中,光学系数图生成单元110接收的乳腺图像是一种DOT成像图像集,其采集过程可以参照相关技术的实现方式,本实施例中不做限定。
光学系数图生成单元110接收到乳腺图像后,根据乳腺图像确定乳腺轮廓内的光学吸收系数的变化情况,生成乳腺组织光学系数随时间动态变化的彩图的实现过程也可以参照相关技术的实现方式。
比如光学系数图生成单元110具体可以包括图像处理子单元以及图像重建单元。其中,图像处理子单元主要用于将乳腺图像减去暗图像得到去掉暗噪点的乳腺图像,然后进行平滑滤波处理,并对每一组的N个近红外LED灯的乳腺图像进行叠加和归一化处理后获取乳腺静态图像;对乳腺静态图像进行滤波处理后获取乳腺的血管图和血管的形态学特征,对乳腺静态图像进行轮廓提取算法处理后获取乳腺轮廓;具体来说,图像处理子单元可以包括以下单元:
(1)静态图像处理子单元,用于将乳腺图像减去暗图像后对乳腺图像进行平滑滤波处理,并对每一组的N个近红外LED灯的乳腺图像进行叠加和归一化处理后获取乳腺静态图像;
(2)轮廓提取子单元,用于对乳腺静态图像进行算法处理获取乳腺轮廓;
(3)图像整合子单元,用于对乳腺轮廓内的N组乳腺图像进行合成叠加处理获取乳腺平均图像;
(4)参数计算子单元,用于计算下述图像重建单元中衰减系数计算子单元所用的参数;
(5)矩阵参数计算子单元,用于计算出图像重建单元中吸收系数计算子单元中的权重矩阵W和输出矩阵Y中的参数。
(6)可视化子单元,用于对乳腺内部吸收系数变化矩阵X进行可视化处理和伪彩处理,得到乳腺组织光学系数动态变化的参数。
图像重建单元利用前述图像处理子单元所得到的参数矩阵,根据朗伯比尔模型对乳腺轮廓内的乳腺图像进行求解,获取乳腺轮廓内乳腺的三维几何形状和乳腺的平均衰减系数;利用近红外光学成像理论,得到乳腺组织内部的光学吸收系数。具体来说,图像重建单元可以分为以下几个单元:
(1)衰减系数计算子单元,用于基于朗伯比尔定律计算出乳腺的平均衰减系数和几何形状;
(2)吸收系数计算子单元,用于根据几何形状和DOT前向模型构建DOT前向模型对应的权重矩阵W,然后对乳腺图像进行对数处理后减去第一组的乳腺图像得到输出矩阵Y,最后根据权重矩阵W和输出矩阵Y计算乳腺内部吸收系数变化矩阵X;
(3)彩图生成子单元,用于可视化模块对乳腺内部吸收系数变化矩阵X进行可视化处理和伪彩处理得到乳腺组织光学系数动态变化的彩图。图像的吸收强度值经过DOBI标准的色谱映射之后得到(伪)彩图。
需要的是,本实施例中对于光学系数图生成单元110的主要组织结构不做限定,仅以上述组成为例进行介绍,其它结构均可参照本实施例的介绍,在此不再赘述。
本申请中调用位置量化单元120识别图像的位置量化特征、调用空间量化单元130识别图像的空间量化特征、调用时间量化单元140识别图像的时间量化特征、调用对比量化单元150识别图像的对比量化特征,根据各单元输出量化等级特征进行对应的肿瘤等级,作为分析结果。
具体地,各单元识别特征的结构以及特征识别过程如下:
2、位置量化单元120,主要用于根据所述彩图中的病灶区的中心与可疑标记点之间的距离确定对应的良恶性等级,作为位置等级;
位置量化单元120根据DOBI图像病灶区的中心(蓝色区域中吸收强度最大的点)到标记的可疑点(读片者标记的可疑点)的距离进行肿瘤良恶性的量化评判,其中,可疑点为读片者(比如医生)在彩图中标记的可疑病灶点,以该点为基准,判断实际测量的彩图中的蓝色区域中吸收强度最大的中心点的距离,距离越近,恶性程度越高;距离越远,则恶性程度越小;如若不存在病灶区,可以认定为良性。其中,距离的计算方式可以参照相关技术的介绍,不同距离对应的评判标准可以根据实际使用需要进行设定。位置等级即根据位置特征得到的良恶性等级,位置等级具体可以包括:良性(B)、可能恶性(LM)等。
距离的大小差异反映在不同的乳房大小下可能不同,比如在大乳房下,5cm可能属于小距离,而在小乳房下,5cm可能属于大距离,为进一步提升距离量化评判的精准度,在此介绍一种位置量化单元的具体组成形式。
如图2所示为一种位置量化单元的识别示意图,该所述位置量化单元120具体可以包括:
判断子单元主要用于判断所述彩图中是否存在病灶区,若不存在,判定为良性(B);若存在,触发目标识别子单元;其中,病灶区指彩图中蓝色区域,病灶区的识别可以基于DOBI伪彩图像的色谱实现,比如找出蓝色所对应的吸收强度值,根据蓝色对应的吸收强度值(吸收强度值从DBOI标准色谱中Blue_min到Blue_max)对图像进行分割,分割出若干帧彩图中的所有蓝色区域,将分割出来的区域图像作为病灶区。进一步地,为了精准化病变区域,在存在蓝色区域的基础上,可以进一步判断是否存在深蓝色区域,若存在深蓝色区域时可以以深蓝色区域为病灶区,当图像中不存在深蓝色区域时,以蓝色区域为病灶区,在此不做限定。
得到病灶区域后,目标识别子单元判断病灶区域是否有效,具体需要判断大小乳房及是否在标记点的三环范围内。具体地,所述目标识别子单元主要用于确定所述病灶区中吸收强度最大的点,作为所述中心;并识别所述彩图中的可疑标记点,生成以所述可疑标记点为中心的三环,触发目标分类子单元;
目前,以所述可疑标记点为中心的三环的间距以及半径固定,三环间的间距为1.5cm。
所述目标分类子单元主要用于确定所述彩图中乳房的大小;若所述乳房属于大乳房,触发第一识别子单元;若所述乳房属于小乳房,触发第二识别子单元;其中,大乳房与小乳房的评判标准本实施例汇总不做限定,如图3所示为一种小乳房的彩图(灰度化处理后)示意图,如图4所示为一种大乳房的彩图(灰度化处理后)示意图,比如可以通过彩图中整体乳房轮廓大小自动识别,也可以人工标记,在此不做限定。
所述第一识别子单元主要用于判断所述中心是否位于所述三环内,或与所述三环的距离是否小于距离阈值;若所述中心位于所述三环内,或与所述三环的距离小于所述距离阈值,判定病灶区有效,为可能恶性;若所述中心不在所述三环内,且与所述三环的距离不小于所述距离阈值,判定病灶区无效,为良性;
所述第二识别子单元主要用于判断所述中心是否位于所述三环内;若所述中心位于所述三环内判定病灶区有效,为可能恶性;若所述中心不在所述三环内,判定病灶区无效,为良性。
所述第一识别子单元与第二识别子单元主要用于识别蓝色区域是否有效,如图5所示为一种第一识别子单元与第二识别子单元判断蓝色区域是否有效的标准示意图,若判定有效,则生成的位置等级可以为可能恶性(LM),若判定无效,则生成的位置等级可以为良性(B),本实施例汇总仅以上述位置等级评判标准为例进行介绍,可以划分为不同的位置等级,或设置不同的位置等级评判标准,其它标准下对应的实现方式可以参照上述介绍,在此不再赘述。
3、空间量化单元130主要用于根据所述病灶区的形状随时间变化特征确定对应的良恶性等级,作为空间等级,本实施例中对于形状特征大小变化的评价标准不做限定,比如可以从形状轮廓变化、面积变化、位移变化等角度进行形状变化的大小评价。
具体地,一种空间量化单元130具体可以分为三个角度进行空间变化大小的评价:1. 聚焦性:研究图像中蓝色区域的面积与有效光照区域的比值;2. 峰碗状:可疑病变区域与有效光照区域的比值;3. 稳定性:可疑病变区域位置是否发生位置变化。则相应地,空间量化单元130,具体包括:
聚焦性量化子单元主要用于确定各帧所述彩图中蓝色区域与深蓝色区域相对于有效光照区域的面积比例确定聚焦性,若判定为聚焦,为可能恶性。具体地,聚焦性量化子单元的聚焦性判断过程具体按照下述过程来执行:分割出彩图中的蓝色区域以及深蓝色区域,并分别计算蓝色区域与有效光照区域间的面积比R1,以及深蓝色区域与有效光照区域间的面积比R2;判断R1是否大于第一阈值,若大于,判定蓝色区域聚焦,分数+1,若不大于,判定蓝色区域发散,分数+0;判断R2是否大于第二阈值,若大于,判定深蓝色区域聚焦,分数+1,若不大于,判定深蓝色区域发散,分数+0;判断总分数是否超过第三阈值,若超过,判定聚焦;若未超过,判定发散。
峰碗状量化子单元主要从静态和动态两个方面进行特征识别,静态即光的吸收最强的一帧的峰碗状特性,动态即从给乳房加压的动态图像序列中得到峰碗状特性,最后将静态和动态结合来判断峰碗状特征。
在进行静态部分峰碗状特性识别时,该子单元的流程主要如下:确定各帧所述彩图中存在吸收强度最大的帧的目标彩图中最大的吸收强度值;根据所述吸收强度值设定区域分割阈值;根据所述区域分割阈值从所述目标彩图中分割出目标区域以及周围区域;根据所述目标区域与所述周围区域的平均吸收强度之比确定静态峰碗状特征。
在大片蓝色病灶区不集中的情况认为是非峰状的,也可称之为碗状,这里蓝色病灶区用最深点强度75%作为区域分割阈值,分割出吸收强度值整体达到最深点强度75%的范围,作为目标区域。而在病灶区与周围区域对比时,周围区域的选取方法为:以分割出的病灶区做两到三次膨胀操作,膨胀区域内病灶区以外的区域为周围区域。病灶区平均强度与周围区域平均强度比大于静态阈值时,认为变化较陡峭,为静态峰状,反之为静态碗状。其中,需要说明的是,本子单元中依据吸收强度值划分目标区域以实现精准的病灶分析,也可以直接将确定的病灶区作为目标区域,在此不做限定。
在进行动态部分峰碗状特性识别时,该子单元的工作主要如下:根据所述目标区域分别在各帧所述彩图中平均吸收强度间的差异确定动态峰碗状特征。
动态峰状特性为在DOBI图像动态序列中,深蓝色病灶区颜色逐渐变深。同样地选取最深点所在一帧,可以按照上述方法分割出目标区域(最深值的75%),在连续彩图序列中每一帧都取同样的病灶区所在区域求平均强度,这样就得到连续彩图序列长度的数组,每个元素即为每帧病灶区所在区域的平均强度。“平均吸收强度间的差异”具体可以对数组序列R求差分(R(i)- R(i-1)),如果连续几帧都出现差分大于动态阈值的情况,说明颜色并没有逐渐加深,判断为动态碗状;否则判定为动态峰状。
最后根据所述静态峰碗状特征以及所述动态峰碗状特征生成峰碗状特征,综合静态和动态的峰碗状特性来判断总体的峰碗状特性,具体可各取50%的重要性结合,在此不做限定。
稳定性量化子单元主要用于根据所述病灶区在各帧所述彩图中的位置间的偏离程度确定稳定性特征。如果病灶的蓝色区域在连续彩图序列中始终保持在一个位置附近,认为是稳定的,否则为游离。判断的基准点取序列中最深点所在帧的最深点的位置,偏离这个位置超过一定距离则认为游离,否则为稳定。
需要说明的是,空间特征的聚焦性、峰碗状和稳定性特征判定中均用到阈值,这些阈值的选取可以结合医生读片结果的数据来进行分析确定,本实施例中对此不做限定。
在稳定性特征、所述峰碗状特征、所述聚焦性特征后,调用生成综合量化子单元根据所述稳定性特征、所述峰碗状特征、所述聚焦性特征生成良恶性判定结果。具体的判定方式不做限定,具体地,一种判定标准如下:若为发散的、碗状的、游离的,空间等级判定为不确定(I),若为聚焦的、稳定性、峰状的,空间等级判定为可能恶性(LM)。
4、乳房在加压下吸光程度的改变反映在病灶区的时间曲线上,时间量化单元140主要用于确定时间曲线的曲线类型对应的良恶性等级,作为时间等级(主要分为可能良性(LB),不确定(I),可能恶性(LM),恶性(M)四类);所述时间曲线为所述病灶区的平均吸收强度随时间变化的曲线。
其中,对于曲线类型的分析主要可以结合曲线幅度以及线型两方面进行分析。
其中,幅度量化子单元主要用于根据预设上升/下降幅度特征对所述时间曲线进行识别,若在所述预设上升/下降幅度特征中存在匹配幅度特征,确定所述匹配幅度特征对应的良恶性等级,作为时间等级。
具体地预设上升/下降幅度特征的设定本实施例中不做限定,以下介绍一种特征配置下的时间等级划分方法,其他特征配置下的时间等级划分过程均可参照下述介绍,在此不再赘述。
(1)如果时间曲线末尾幅值上升(比如超过0),说明时间曲线在压力作用下呈上升趋势,为强上升型,则时间(良恶性)等级判定为可能良性(LB)。
(2)如果时间曲线末尾幅值下降(比如未超过0),说明时间曲线在压力作用下呈下降趋势,则进一步区分具体线型(包括快速下降型、缓慢下降型以及波动型)。
(2.1)如果时间曲线整体下降趋势较快,为快速下降型(S2),如图6a所示为快速下降型(S2)中的直线下降线型、图6b以及图6c是为另外两种快速下降型曲线示意图。具体地快速下降型的判定可以通过斜率或幅值下降大小等因素来确定。以斜率为例,比如每个点的斜率都低于设定的阈值(负值),或每个点的斜率的绝对值都大于设定的阈值(正值),可以判定为快速下降型,在此仅以上述判定方式为例进行介绍,基于其他判定标准的快速下降型判定均可参照本实施例的介绍,在此不再赘述。
如果线形是快速下降型,则为恶性的概率很大,具体地可以进一步通过幅度值来进一步区分良恶性等级。比如线形是快速下降型且最小值幅值(或幅值下降)大于某一幅值,时间(良恶性)等级判定为可能恶性(LM),若最小值幅值(或幅值下降)不大于某一幅值,时间(良恶性)等级判定为恶性(M)。
具体地,本实施例中对于“某一幅值”的具体数值设定不做限定,可以根据实际使用需要进行设定,比如可以设定为-2,即如果线形是快速下降型,且最小值幅值在-2到0,时间(良恶性)等级判定为可能恶性(LM);如果线形是快速下降型,且最小值幅值低于-2(比如属于-4到-2,或幅值下降超过-4),时间(良恶性)等级判定为恶性(M)。
(2.2)如果曲线整体下降趋势较慢,为缓慢下降型(S1),如图7a、图7b、图7c以及图7d是为四种缓慢下降型曲线示意图。具体地缓慢下降型的判定也可以通过斜率或幅值下降大小等因素来确定。以斜率为例,比如存在不低于设定的阈值(负值)的点,或每个点的斜率的绝对值都小于设定的阈值(正值),可以判定为缓慢下降型,在此仅以上述判定方式为例进行介绍,基于其他判定标准的缓慢下降型判定均可参照本实施例的介绍,在此不再赘述。
如果线形是缓慢下降型,则为恶性的概率较大,具体地可以进一步通过幅度值来进一步区分良恶性等级。比如线形是缓慢下降型且最小值幅值(或幅值下降)大于另一幅值,时间(良恶性)等级判定为可能恶性(LM),若最小值幅值(或幅值下降)不大于另一幅值,时间(良恶性)等级判定为不确定(I)。
具体地,本实施例中对于“另一幅值”的具体数值设定不做限定,可以根据实际使用需要进行设定,比如可以设定为-2,即如果线形是缓慢下降型,且最小值幅值在-2到0,时间(良恶性)等级判定为不确定(I);如果线形是缓慢下降型,且最小值幅值低于-2(比如属于-4到-2,或幅值下降超过-4,即<-4),时间(良恶性)等级判定为可能恶性(LM)。
(2.3)如果曲线整体下降存在波动性,为波动型(S0),如图8a、图8b以及图8c是为三种波动型曲线示意图。具体地波动型的判定也可以通过斜率等因素来确定。以斜率为例,比如曲线的斜率有正有负,即可判断为波动型,在此仅以上述判定方式为例进行介绍,基于其他判定标准的波动型判定均可参照本实施例的介绍,在此不再赘述。
如果曲线为波动型,则时间(良恶性)等级判断为不确定(I)。
先判断比较容易辨别的强上升型,波动型S0和快速下降型(S2)中的直线下降线型后,调用线型量化子单元将不易区分的线型用特征进一步细分。
线型量化子单元主要用于若在所述预设上升/下降幅度特征中不存在匹配幅度特征,调用分类器对所述时间曲线对其它线型(主要包括除了直线下降线型之外的快速下降型(S2)和缓慢下降型(S1))进行线型精准区分,生成匹配线型,确定所述匹配线型对应的良恶性等级,作为所述时间等级。
其中,分类器按CLASS1-CLASS3分类进行训练,如图9所示为一种分类器识别线型示意图,图10所示为一种由分类器识别的线型示意图。需要说明的是,除了分类器,也可以选用其他精准识别方式,比如深度神经网络模型等,在此仅以分类器为例进行介绍,其他方式均可参照本实施例的介绍,在此不再赘述。
5、对比量化单元150主要用于确定所述时间曲线与背景曲线间的相似程度对应的良恶性等级,作为对比等级;其中,所述背景曲线为所述彩图中绿色背景点的吸收强度随时间变化的曲线。
对比量化单元150主要比较病灶区的吸收强度变化情况和背景的吸收强度变化情况之间的差别,研究可疑病变区的吸收强度在一定压强下随着时间的变化与背景区域(绿色区域)变化的差异性,差异越大,恶性程度越高,反之恶性程度低。本单元中的相似程度可以被划分为三个等级:像(对应的良恶性等级为:可能良性LB)、不像(对应的良恶性等级为:可能恶性LM),剩下的判断为不确定(对应的良恶性等级为:不确定I)。
为方便进行两种变化情况的差别对比,可以以曲线间的对比作为变化情况的对比,具体可以以异常点为中心,指定长度为半径的区域中的平均吸收强度随时间变化的曲线作为可疑病变区的吸收强度变化情况,可以以背景点的吸收强度随时间变化的曲线作为背景的吸收强度变化情况进行差别分析。
本实施例中对于相似程度的评判标准以及评判角度不做限定,可以根据实际评判需要进行相应设定,为体现病灶区与背景区时间曲线的差别,可以定义差分曲线,为病灶区每个时刻的值减去背景区每个时刻的值,然后对差分曲线进行分类确定相似程度,则相应地对比量化单元具体可以为:差分对比量化单元,即通过差分的角度进行相似程度的评判;所述差分对比量化单元具体可以用于:生成所述时间曲线与背景曲线对应的差分曲线,根据所述差分曲线的曲线特征确定相似程度,将所述相似程度对应的良恶性等级作为所述对比等级。
差分曲线的曲线特征本实施例中不做限定,比如可以通过斜率来判定,相应地,所述差分对比量化单元具体可以包括:
差分曲线生成子单元,用于生成所述时间曲线与背景曲线对应的差分曲线;
差分斜率确定子单元,用于确定所述差分曲线中各点对应的斜率;
差分分类子单元,用于若所述斜率的绝对值均小于平缓阈值,判定为像;若存在所述斜率的绝对值大于波动阈值,对比等级判定为不像;若存在所述斜率的绝对值不小于所述平缓阈值,且所述斜率的绝对值均不大于所述波动阈值,对比等级判定为不确定,其中,平缓阈值小于波动阈值。
如图11所示为一种相似差分示意图,当病灶区和背景区时间特性曲线相似时,它们的差分曲线应该趋于水平直线,因此用各点的斜率来判断,当斜率大于阈值时,认为不像,两曲线走向不同且发散,对比等级为可能恶性(LM)。各点处斜率均小于阈值,说明趋于水平直线,判断为像,两曲线间非常相似、曲线向上,对比等级为可能良性(LB)。
如图12a和图12b所示为两种不相似差分示意图,差分曲线斜率最大值的绝对值大于阈值,且出现了正负值变化,认为不像,对比等级为可能恶性(LM)。其它情况下(所述斜率的绝对值不小于所述平缓阈值,且所述斜率的绝对值均不大于所述波动阈值),则不能确定相似程度,两曲线间没有明显的不同以及相似之处,对比等级为不确定(I)。
需要说明的是,本实施例中仅以上述差分判定相似程度的一种具体实现方式为例进行介绍,基于其他方式确定相似程度对应的处理过程可以参照上述介绍,在此不再赘述。
6、完成DOBI图像的空间等级、时间等级、对比等级的识别分析后,需要确定当前识别的所有等级配置下对应的肿瘤等级,而需要调用结果生成单元160根据肿瘤等级匹配规则,根据上述位置量化单元、空间量化单元、时间量化单元、对比量化单元输出的位置等级、所述空间等级、所述时间等级、所述对比等级确定匹配的肿瘤等级。
其中,肿瘤等级匹配规则为一种预先设定的包含所有空间等级、时间等级、对比等级的配置可能性下的肿瘤等级匹配数据,比如当位置等级为良性(B)、空间等级为不确定(I)、时间等级为可能良性(LB)、对比等级为可能恶性(LM)时对应一种肿瘤等级,肿瘤等级比如可能良性(LB);当位置等级为可能恶性(LM)、空间等级为不确定(I)、时间等级为恶性(M)、对比等级为可能良性(LB)时对应一种肿瘤等级,肿瘤等级比如可能恶性(LM)。
根据肿瘤等级匹配规则确定匹配的肿瘤等级。本实施例中对于肿瘤等级匹配规则的具体设定不做限定。
一种等级设置下,位置特征的位置等级主要分为:良性(B)、可能恶性(LM)两类;
空间特征的空间等级主要分为:不确定 (I)、可能恶性(LM)两类;
时间特征的时间等级主要分为:可能良性(LB),不确定(I),可能恶性(LM),恶性(M)四类;
对比特征的对比等级主要分为:可能良性(LB)、可能恶性(LM)、不确定(I)三类。
根据上面LSTC等级(其中L为位置特征量化后对应的等级,简称为位置等级;S为空间特征量化后对应的等级,简称为空间等级;T为时间特征量化后对应的等级,简称为时间等级;C为对比特征量化后对应的等级,简称为对比等级)在此介绍一种对应的肿瘤等级匹配规则。本实施例提供的规则下的肿瘤等级包括:良性(B),可能良性(LB),不确定(I),可能恶性(LM),恶性(M)5个等级。
一种结果生成单元,具体用于:
若所述位置等级为良性,则肿瘤等级为良性;
若所述位置等级为可能恶性,且所述时间等级为恶性,所述空间等级以及所述对比等级至少一个为可能恶性,则肿瘤等级为恶性;
若所述位置等级为可能恶性,且所述时间等级为恶性,所述空间等级以及所述对比等级均为不确定,则肿瘤等级为可能恶性;
若所述位置等级与所述时间等级均为可能恶性,且所述空间等级以及所述对比等级至少一个为可能恶性,则肿瘤等级为可能恶性;
若所述位置等级为可能恶性,且所述时间等级为可能良性,则肿瘤等级为可能良性;
若所述位置等级为可能恶性,且所述时间等级与所述空间等级均为不确定,所述对比等级为可能良性,则肿瘤等级为可能良性;
其它所述位置等级、所述空间等级、所述时间等级、所述对比等级的组合下,肿瘤等级为不确定。
相应地肿瘤等级匹配规则如下,为简化描述,以下都以简称来进行介绍,其中,RO为输出的肿瘤等级:
1、首先判断L,如果L=B,则RO=B
2、如果L=LM,再判断T:
(2.1)如果T=M,且S,C,都是LM,则RO=M;
(2.2)如果T=M,且S,C其中之一是LM,则RO=M;
(2.3)如果T=M,且S,C都为I,则RO=LM;
(2.4)如果T=LM,且S,C,都为LM,或者其中之一是LM,则RO=LM;
(2.5)如果T=LB,则RO=LB;
(2.6)如果T=I,且S=I,C=LB,则RO=LB;
(2.7)对于其他的所有T,S,C,的组合,RO=I。
需要说明的是,本实施例中仅以上述肿瘤等级匹配规则为例进行介绍,其他匹配关系下的肿瘤等级匹配规则均可参照本实施例的介绍,在此不做限定。
基于上述介绍,本实施例提供的肿瘤级别分析装置中,根据一个时间范围内光学成像的乳腺图像进行动态肿瘤特征量化分析,具体通过光学系数图生成单元、位置量化单元、空间量化单元、时间量化单元、对比量化单元自动对肿瘤特征提取并进行分级,并根据结果生成单元进行肿瘤等级匹配,进行良恶性等级量化输出,输出具有良恶性分级的肿瘤级别,整个识别过程无需人工参与,不依赖于有经验的医生阅片,操作简单且效率高,以便于以便医生判别乳腺中有无肿瘤以及对肿瘤的良恶性进行判别。
相应于上面的装置实施例,本发明实施例还提供了一种肿瘤级别分析设备,下文描述的肿瘤级别分析设备与上文描述的肿瘤级别分析装置可相互对应参照。
该肿瘤级别分析设备包括:
存储器,用于存储计算机程序;
处理器,用于执行计算机程序时实现接收加压过程近红外LED灯照射下的乳腺图像,并根据所述乳腺图像生成乳腺组织光学系数随时间动态变化的彩图;根据所述彩图中的病灶区的中心与可疑标记点之间的距离确定对应的良恶性等级,作为位置等级;根据所述病灶区的形状随时间变化特征确定对应的良恶性等级,作为空间等级;确定时间曲线的曲线类型对应的良恶性等级,作为时间等级;所述时间曲线为所述病灶区的平均吸收强度随时间变化的曲线;确定所述时间曲线与背景曲线间的相似程度对应的良恶性等级,作为对比等级;所述背景曲线为所述彩图中绿色背景点的吸收强度随时间变化的曲线;根据肿瘤等级匹配规则,确定与所述位置等级、所述空间等级、所述时间等级、所述对比等级匹配的肿瘤等级的步骤。
具体的,请参考图13,为本实施例提供的一种肿瘤级别分析设备的具体结构示意图,该肿瘤级别分析设备可因配置或性能不同而产生比较大的差异,可以包括一个或一个以上处理器(central processing units,CPU)322(例如,一个或一个以上处理器)和存储器332,存储器332存储有一个或一个以上的计算机应用程序342或数据344。其中,存储器332可以是短暂存储或持久存储。存储在存储器332的程序可以包括一个或一个以上模块(图示没标出),每个模块可以包括对数据处理设备中的一系列指令操作。更进一步地,处理器322可以设置为与存储器332通信,在肿瘤级别分析设备301上执行存储器332中的一系列指令操作。
肿瘤级别分析设备301还可以包括一个或一个以上电源326,一个或一个以上有线或无线网络接口350,一个或一个以上输入输出接口358,和/或,一个或一个以上操作系统341。
本发明实施例还提供了一种肿瘤级别分析方法,下文描述的肿瘤级别分析方法与上文描述的肿瘤级别分析装置可相互对应参照。
S101、接收加压过程近红外LED灯照射下的乳腺图像,并根据所述乳腺图像生成乳腺组织光学系数随时间动态变化的彩图;
S102、根据所述彩图中的病灶区的中心与可疑标记点之间的距离确定对应的良恶性等级,作为位置等级;
S103、根据所述病灶区的形状随时间变化特征确定对应的良恶性等级,作为空间等级;
S104、确定时间曲线的曲线类型对应的良恶性等级,作为时间等级;所述时间曲线为所述病灶区的平均吸收强度随时间变化的曲线;
S105、确定所述时间曲线与背景曲线间的相似程度对应的良恶性等级,作为对比等级;所述背景曲线为所述彩图中绿色背景点的吸收强度随时间变化的曲线;
S106、根据肿瘤等级匹配规则,确定与所述位置等级、所述空间等级、所述时间等级、所述对比等级匹配的肿瘤等级。
本实施例提供的方法的步骤介绍可以参照上述装置实施例中对于各单元执行过程的介绍,为避免重复,在此不再赘述。
相应于上面的设备实施例,本发明实施例还提供了一种肿瘤级别分析系统,下文描述的一种肿瘤级别分析系统与上文描述的一种肿瘤级别分析设备可相互对应参照。
乳腺扩散光学层析成像设备以及如上述实施例中所介绍的肿瘤级别分析设备。
乳腺扩散光学层析成像设备主要用于采集加压过程近红外LED灯照射下的乳腺图像,其具体设备结构本实施例中不做限定,可以参照相关设备的配置方式,为加深理解,在此介绍一种成像设备的结构。
一种乳腺扩散光学层析成像设备主要由LED灯板、探测器,加压装置,和控制模块组成。
其中,灯板装置由多个近红外LED光源按照阵列式等距排列所形成的光滑透光面板,一般建议面板大小不得小于30*20cm,LED灯的数量不小于100个。
探测器位于灯板上方,一般使用高灵敏度的红外CCD成像相机,或者CMOS其它类型红外成像装置。
加压装置的作用是在检测过程中给乳房施加5-10mm Hg的压力,使得乳房中的不饱和氧血在疑似病灶区域发生生理反应(早期乳腺癌肿瘤区会有新生血管聚集的现象),通过近红外光的物理光学原理,不同生物组织具有不同的光吸收、光散射特性,因此可以通过分析近红外光的透射情况来获取乳房的组织结构分布。
控制模块则由中控主机、信号传输装置以及人际交互装置组成。成像模块的操控、光源操控、扫描操控、加压操控以及数据分析、建模、计算都将由该模块完成。
需要说明的是,本实施例中仅以上述结构为例进行介绍,其他成像设备结构均可参照本实施例的介绍,算作本申请的保护范围,在此不再赘述。
本领域技术人员还可以进一步意识到,结合本文中所公开的实施例描述的各示例的单元及算法步骤,能够以电子硬件、计算机软件或者二者的结合来实现,为了清楚地说明硬件和软件的可互换性,在上述说明中已经按照功能一般性地描述了各示例的组成及步骤。这些功能究竟以硬件还是软件方式来执行,取决于技术方案的特定应用和设计约束条件。本领域技术人员可以对每个特定的应用来使用不同方法来实现所描述的功能,但是这种实现不应认为超出本发明的范围。
- 一种肿瘤级别分析装置及相关组件
- 一种动态光学乳腺成像的肿瘤特征分析装置及相关组件
