一种待测细胞在体捕获系统及其工作方法
文献发布时间:2023-06-19 11:29:13
技术领域
本发明属于细胞在体检测技术领域,尤其涉及一种待测细胞在体捕获系统及其工作方法。
背景技术
近年来,尽管癌症治疗取得了进展,但肿瘤转移仍然是人类与癌症治疗斗争的终极挑战,也是导致癌症相关死亡的罪魁祸首。循环肿瘤细胞(circulating tumor cell,CTC)是肿瘤发生转移的重要媒介,肿瘤发生发展的过程中,CTC会被原发部位肿瘤或转移病灶释放进入血液循环,从而定植于身体远处组织或器官,形成新的转移病灶。CTC作为一种安全可靠的生物学标志物,具有无创、易获取、重复性高等优势,其在恶性肿瘤领域应用发展迅猛,相关研究覆盖于肿瘤早期诊断、治疗、预后评价及发病机制等多个领域。然而,尽管肿瘤患者的血液中可能含有成百上千个CTC,但传统检测方式的5-10毫升的血液样本(仅占全身血容量的0.1%)通常只含有少量的CTC,这种数量级的肿瘤细胞不足以对肿瘤分子生物学异质性及耐药突变等生物学行为进行全面的检测。低数量级的CTC数目可能导致肿瘤血样假阴性结果,特别是在早期肿瘤检测或肿瘤复发检测时,从而导致临床决策错误导向,造成肿瘤患者治疗和生存预后不可挽回的损失。
目前,基于CTC的物理及生物学特性,可将CTC检测技术主要分为三大类,即:基于核酸表达的CTC检测方式、基于细胞物理特性的CTC检测方式、基于细胞表面抗体的CTC检测方式。
通过核酸表达对CTC进行检测主要根据CTC具有区别于血液成分细胞的DNA或RNA表达,从而对肿瘤患者血清中游离核酸的检测,然而,肿瘤凋亡细胞、外泌体以及外周血中其他有核细胞所携带的核酸均可以显著影响检测结果,从而导致该技术具有明显的弊端。目前认为同血液成分细胞相比,CTC具有更大的体积和密度,并且细胞表面电荷分布也区别于其他细胞,另外部分CTC还可能表现出不同的细胞活性等特性,这些特异性差异已经逐步被认识并应用于细胞的检测及筛选,但是,利用该检测手段因易受到各类内在及外界因素的干扰,均难以实现CTC的准确检测。伴随着肿瘤细胞膜蛋白及相关功能验证相关研究的大量开展,为CTC的检测和分选提供了理论基础和新的选择,从而使基于细胞表面抗体的CTC检测技术的敏感度和特异度得到了明显的改善。目前应用最为广泛的技术主要依赖于CTC细胞表面特异性抗体。
上皮细胞黏附分子(epithelial cell adhesion molecule,EpCAM)由于其表达于几乎所有上皮来源的细胞而不表达于血液成分细胞,故被广泛应用于基于细胞表面抗体的CTC检测。上皮类肿瘤细胞通过与特异的抗EpCAM抗体偶联的免疫磁珠富集结合,再经过特定磁场进行筛选,已经被用于肺癌、乳腺癌及结直肠癌等恶性肿瘤CTC的检测。目前,基于此原理而开发的具有代表性的两种CTC检测技术,即美国食品药品监督管理局(Food andDrug Administration,FDA)及中国食品药品监督管理局(China Food and DrugAdministration,CFDA)获批的Veridex公司生产的商业化产品CellSearch系统,及德国Gilupi公司生产的全球唯一一个采取体内捕获CTC且获得CFDA批准的CellCollector采样针。
CellSearch系统虽然为现有检测技术方法中较为标准且已开始应用于部分临床试验的CTC检测方法,但该体系的弊端主要在于其敏感度较低(大约每毫升血液仅检测出1个CTC细胞),并且单次检测通常需要较大的血样本,且仅在肿瘤远处转移患者外周血中可实现CTC的有效检测,参见:Andree,K.C.;van Dalum,G.;Terstappen,L.W.Challenges incirculating tumor cell detection by the CellSearch system.Mol Oncol 2016;10:395-407。
与CellSearch系统相比,CellCollector采样针相关研究证明其在CTC检测细胞量获取和灵敏性更具有优势。然而,CellCollector采样针对于在体捕获CTC能力有限,其对于血管内流动的CTC细胞吸引捕获能力较差,只能捕获流经采样针表面的CTC细胞,而无法对远离采样针的CTC细胞进行捕获,参见:Vermesh,O.;Aalipour,A.;Ge,T.J.;Saenz,Y.;Guo,Y.;Alam,I.S.;Park,S.M.;Adelson,C.N.;Mitsutake,Y.;Vilches-Moure,J.,et al.Anintravascular magnetic wire for the high-throughput retrieval of circulatingtumour cells in vivo.Nat Biomed Eng 2018;2:696-705。
发明内容
鉴于现有技术存在的不足,本发明提供了一种待测细胞在体捕获系统及其工作方法,用以提高体内微量待测细胞(例如循环肿瘤细胞CTC)的捕获数量,提升后续检测的精确度。
为实现上述发明目的,本发明采用了如下技术方案:
一种待测细胞在体捕获系统,该系统包括免疫微纳米气泡供应装置、声共振免疫导引体体内输送装置、超声发射装置和声共振免疫导引体;其中,
所述免疫微纳米气泡供应装置用于提供免疫微纳米气泡,所述免疫微纳米气泡的表面偶联有能够识别待测细胞的抗体,所述免疫微纳米气泡用于注入到体内待测区域并与待测细胞发生特异性结合形成免疫微纳米气泡复合体;
所述声共振免疫导引体体内输送装置用于将所述声共振免疫导引体由体外输送至体内待测区域以及从体内待测区域输送至体外;
所述超声发射装置用于在体外发射超声波以激励位于体内的所述声共振免疫导引体产生局域强场;
所述声共振免疫导引体的表面偶联有能够识别待测细胞的抗体,用于在被输送至体内待测区域时,与待测细胞发生特异性结合直接捕获待测细胞,并且利用所述局域强场吸附所述免疫微纳米气泡复合体以捕获待测细胞。
其中,所述免疫微纳米气泡供应装置为微流控腔道装置,包括依次连接的一级腔道、二级腔道和三级腔道;所述一级腔道包括气体腔道、液体脂质腔道、成泡腔道及抗体输送腔道;所述二级腔道为抗体与微纳米气泡偶联装配的腔道;所述三级腔道为筛选获取表面偶联有能够识别待测细胞的抗体的免疫微纳米气泡的腔道。
其中,所述免疫微纳米气泡的直径为1μm~10μm。
其中,所述声共振免疫导引体的材料为柔性材料;所述声共振免疫导引体的横波速度小于体内待测区域的体液的纵波速度。
其中,所述声共振免疫导引体的材料为生物医用高分子材料。
其中,所述声共振免疫导引体为中空或实心的线状导引丝;所述声共振免疫导引体的横截面为三角形、圆形或矩形。
其中,所述声共振免疫导引体的表面被覆亲水或疏水涂层,能够识别待测细胞的抗体偶联装配在所述涂层上。
其中,所述声共振免疫导引体的圆周直径为50μm~500μm,产生局域强场模式的工作频率为1MHz~10MHz。
其中,所述声共振免疫导引体体内输送装置为穿刺外鞘管,应用预装的穿刺针通过所述穿刺外鞘管对所述体内待测区域进行穿刺,所述声共振免疫导引体通过所述穿刺外鞘管输送至内穿刺后的所述内待测区域。
其中,所述超声发射装置包括信号发生器、功率放大器和超声换能器,所述信号发生器产生的信号经所述功率放大器放大后,激励所述超声换能器发射超声波。
其中,所述待测细胞在体捕获系统还包括微流控细胞分选检测装置,用于对由所述声共振免疫导引体捕获的待测细胞进行检测。
其中,所述待测细胞为循环肿瘤细胞,所述能够识别待测细胞的抗体为识别肿瘤特异性抗原的抗体,所述体内待测区域为血管。
本发明的另一方面提供了一种如上所述的待测细胞在体捕获系统的工作方法,其包括:
控制所述免疫微纳米气泡供应装置制备获得表面偶联有能够识别待测细胞的抗体的免疫微纳米气泡,将所述免疫微纳米气泡注入到体内待测区域,以使免疫微纳米气泡与待测细胞发生特异性结合形成免疫微纳米气泡复合体;
控制所述声共振免疫导引体体内输送装置将表面偶联有能够识别待测细胞的抗体的声共振免疫导引体输送至体内待测区域,以使声共振免疫导引体与待测细胞发生特异性结合直接捕获待测细胞;
控制所述超声发射装置发射超声波,激励所述声共振免疫导引体产生局域强场,使得所述声共振免疫导引体吸附所述免疫微纳米气泡复合体从而捕获待测细胞;
控制所述声共振免疫导引体体内输送装置将捕获待测细胞后的声共振免疫导引体输送至体外。
本发明实施例提供的待测细胞在体捕获系统,通过将表面偶联有能够识别待测细胞的抗体的免疫微纳米气泡和声共振免疫导引体送入体内待检测区域,声共振免疫导引体一方面可与待测细胞发生特异性结合直接捕获待测细胞,另一方面在超声波的激励下,利用声共振免疫导引体作为产生局域声场的“二次声源”吸附富集与待测细胞结合后的免疫微纳米气泡,进一步捕获更多数量的待测细胞,提高了体内微量待测细胞(例如循环肿瘤细胞CTC)的捕获数量,提升后续检测的精确度。
以捕获CTC为例,与现有技术中的CellSearch系统相比,本发明可以在体内血液不断循环的过程中持续募集捕获CTC,从而使CTC细胞局部浓度持续升高,能够捕获更多数量的CTC细胞。与现有技术中的CellSearch系统相比,CellCollector采样针相比,本发明不仅可以捕获流经声共振免疫导引体表面的CTC细胞,还可以通过局域强场的吸附力,对共振免疫导引体周围一定距离内的CTC细胞进行捕获,能够捕获更多数量的CTC细胞。
另外,声操控主要是利用声场中粒子受到声辐射力、声流引起的拽力或剪切力等实现对粒子的捕获、排列、移动、旋转和释放等功能。由于超声已广泛应用于临床成像检测中,并已经证实低强度超声不会对机体造成明显的损伤,因此超声操控粒子是一种非接触、无创、便捷的操控方法,通过声操纵免疫微纳米气泡捕获CTC过程中不会造成细胞损伤以及确保了CTC的生物活性,即,本发明提供的待测细胞在体捕获系统及其工作方法更加安全可靠。
附图说明
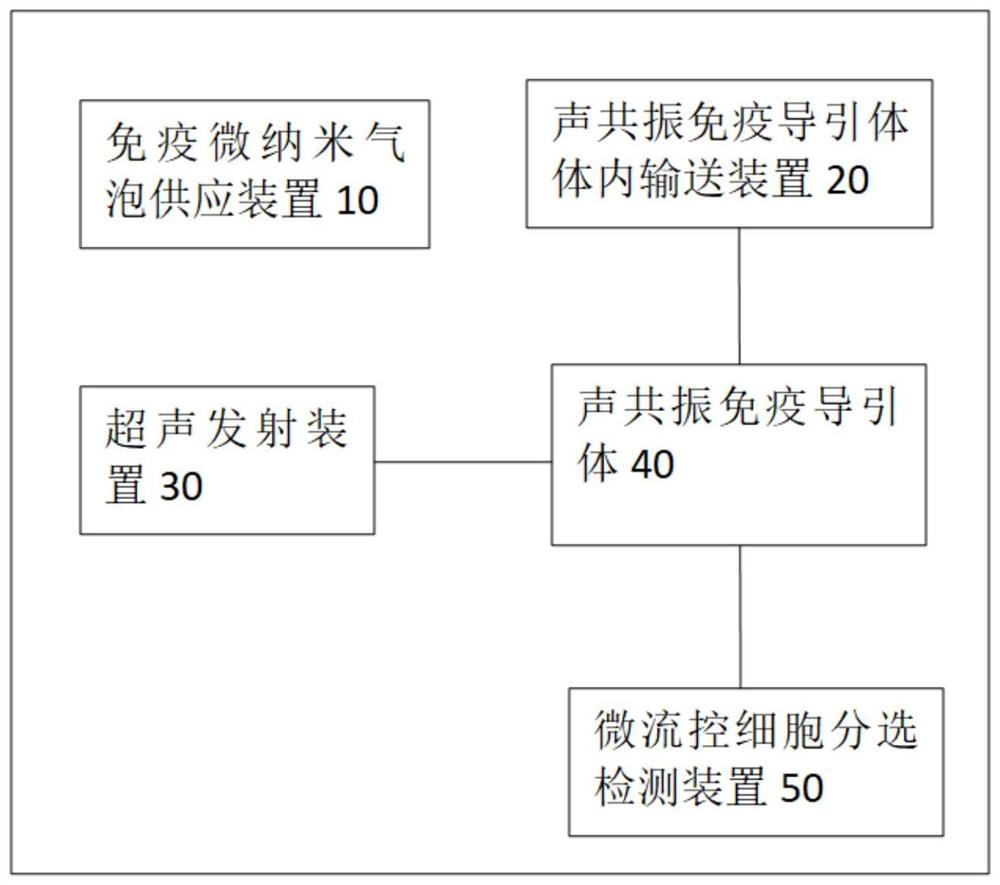
图1是本发明实施例的待测细胞在体捕获系统的结构示意图;
图2是本发明实施例中免疫微纳米气泡偶联有能够识别待测细胞的抗体的图示;
图3是本发明实施例中免疫微纳米气泡与待测细胞结合为免疫微纳米气泡复合体的图示;
图4是本发明实施例中免疫微纳米气泡供应装置的结构示意图;
图5是本发明实施例中声共振免疫导引体体内输送装置的结构及其输送声共振免疫导引体的过程的示例性图示;
图6是本发明实施例中超声发射装置的结构示意图;
图7是本发明实施例中声共振免疫导引体的结构示意图;
图8是本发明实施例的微流控细胞分选检测装置的结构示意图;
图9是本发明实施例的待测细胞在体捕获方法的工作流程图;
图10至图12是不同尺寸直径的免疫微纳米气泡在直径300微米截面为圆形的声共振导引体周围的受力分布图;
图13是本发明实施例中由声共振导引体捕获待测细胞的放大照片图示。
具体实施方式
为使本发明的目的、技术方案和优点更加清楚,下面结合附图对本发明的具体实施方式进行详细说明。这些优选实施方式的示例在附图中进行了例示。附图中所示和根据附图描述的本发明的实施方式仅仅是示例性的,并且本发明并不限于这些实施方式。
在此,还需要说明的是,为了避免因不必要的细节而模糊了本发明,在附图中仅仅示出了与根据本发明的方案密切相关的结构和/或处理步骤,而省略了与本发明关系不大的其他细节。
图1是本发明实施例的待测细胞在体捕获系统的结构示意图,如图1所示,所述待测细胞在体捕获系统包括:免疫微纳米气泡供应装置10、声共振免疫导引体体内输送装置20、超声发射装置30和声共振导引体40。优选的,本实施例的捕获系统还包括微流控细胞分选检测装置50。
所述免疫微纳米气泡供应装置10用于提供免疫微纳米气泡。参阅图2和图3,所述免疫微纳米气泡1的表面偶联有能够识别待测细胞的抗体2,所述免疫微纳米气泡1用于注入到体内待测区域并与待测细胞3发生特异性结合形成免疫微纳米气泡复合体。在具体的技术方案中,所述待测细胞3例如是循环肿瘤细胞(CTC),所述能够识别待测细胞的抗体2为识别肿瘤特异性抗原的抗体,所述体内待测区域则是指血管。
具体地,所述免疫微纳米气泡供应装置10为微流控腔道装置,如图4所示,所述微流控腔道装置包括依次连接的一级腔道11、二级腔道12和三级腔道13。
参阅图4,所述一级腔道11包括气体腔道11a、液体脂质腔道11b、成泡腔道11c及抗体输送腔道11d。所述气体腔道11a用于供应形成免疫微纳米气泡内芯的惰性气体G,例如全氟丙烷;所述液体脂质腔道11b用于供应形成免疫微纳米气泡外壳的液体脂质材料L,例如磷脂;所述成泡腔道11c与气体腔道11a和液体脂质腔道11b的输出端连接,所述成泡腔道11c为惰性气体G与液体脂质材料L结合形成免疫微纳米气泡1的腔道;所述抗体输送腔道11d用于供应能够识别待测细胞的抗体2。所述二级腔道12与成泡腔道11c和抗体输送腔道11d的输出端连接,所述二级腔道12为抗体2与免疫微纳米气泡1偶联装配的腔道,所述二级腔道12的末端的腔道外设置有超声设备14,通过发射超声波15对已装配抗体的免疫微纳米气泡进行分选。所述三级腔道13与所述二级腔道12的输出端连接,所述三级腔道13为筛选获取表面偶联有能够识别待测细胞的抗体的免疫微纳米气泡的腔道,所述三级腔道13用于筛选除出粒径均匀的免疫微纳米气泡1。进一步地,微流控腔道装置还包括排泄通道16,排泄通道16用于排出未能偶联装配的抗体、微纳米气泡以及粒径不符合要求的偶联有抗体的免疫微纳米气泡等。
与传统生产微纳米气泡技术相比,通过本发明的流控腔道装置产生的微泡可以实现粒径均匀、单一,从而极大优化微纳米气泡体内捕获效率。
本发明实施例提供的免疫微纳米气泡为脂质免疫微纳米气泡,其包括偶联有能够识别待测细胞的抗体的脂质外壳和惰性气体内芯,其直径优选为1μm~10μm的范围内。
在优选的方案中,还可以对所述免疫微纳米气泡进行化学或生物修饰,以增加其粘附效率和靶向性。
所述声共振免疫导引体体内输送装置20用于将所述声共振免疫导引体40由体外输送至体内待测区域,或者是从体内待测区域输送至体外。
本实施例中,参阅图5,所述声共振免疫导引体体内输送装置20具体是为穿刺外鞘管4,其配备有穿刺针5。所述穿刺外鞘管4包括穿刺针端口4a、导引体端口4b和穿刺口4c。所述声共振免疫导引体体内输送装置20向体内输送声共振免疫导引体40过程具体是:首先将穿刺针5从穿刺针端口4a放入穿刺外鞘管4内,将穿刺口4c对准目标区域(例如血管)进行穿刺,穿刺成功后将穿刺针5退出,并且此时将声共振免疫导引体40从导引体端口4b放入穿刺外鞘管4内,通过穿刺口4c送入到被穿刺后的目标区域。
所述超声发射装置30用于在体外发射超声波以激励位于体内的所述声共振免疫导引体40产生局域强场。
本实施例中,参阅图6,所述超声发射装置30包括信号发生器31、功率放大器32和超声换能器33,所述信号发生器31产生的信号经所述功率放大器32放大后,激励所述超声换能器33发射超声波。
具体地,超声换能器33可以是单阵元超声换能器、相控阵超声换能器、线阵超声换能器、凸阵超声换能器的一种;其中,声共振免疫导引体40的共振频率决定了发射超声的驱动频率,从而决定了超声换能器33的中心频率。信号发生器31的发生的信号可以是连续正弦信号,或是脉冲正弦信号。在一种实施方式中,信号发生器31可以是可编程信号发生器(AFG3021,Tectronix),功率放大器可以是50dB的线性功率放大器(325LA,ENI),信号发生,31产生正弦连续信号,正弦信号经功率放大器32后激励超声换能器33产生超声波。
其中,参阅图7,所述声共振免疫导引体40的表面偶联有能够识别待测细胞的抗体41,至少被送入到目标区域的部分偶联有能够识别待测细胞的抗体41;进一步地,本实施例中,所述声共振免疫导引体40的表面首先被覆亲水或疏水涂层44,能够识别待测细胞的抗体41偶联装配在所述涂层44上。所述声共振免疫导引体40上还设置有置入标志点42和退出标志点43。所述声共振免疫导引体40用于在被输送至体内待测区域时,与待测细胞发生特异性结合直接捕获待测细胞,并且利用所述局域强场吸附所述免疫微纳米气泡复合体以捕获待测细胞。
结合图5和图7,将声共振免疫导引体40从导引体端口4b放入穿刺外鞘管4内时,将声共振免疫导引体40的置入标志点42送入到与导引体端口4b平齐。在声共振免疫导引体40捕获待测细胞完成后,将声共振免疫导引体40缓慢从导引体端口4b退出至退出标志点43与导引体端口4b平齐,然后将整个穿刺外鞘管4从目标区域退出。
其中,所述声共振免疫导引体的材料为柔性材料,并且是生物医用高分子材料,例如是如聚乳酸-羟基乙酸共聚物、聚氯乙烯、聚乙烯、聚四氟乙烯、聚氨酯等。
所述声共振免疫导引体的横波速度小于体内待测区域的体液(例如血管中的血液)的纵波速度。所述声共振导引体为中空或实心的线状导引丝。所述声共振导引体的横截面为三角形、圆形或矩形。
在优选的方案中,所述声共振免疫导引体的圆周直径为50μm~500μm,产生局域强场模式的工作频率为1MHz~10MHz。
在优选的方案中,所述声共振免疫导引体的材料为聚乳酸-羟基乙酸共聚物(poly(lactic-co-glycolic acid),PLGA,纵波速2114m/s,横波速532m/s)。
在优选的方案中,还可以对所述声共振免疫导引体进行化学或生物修饰,以增加其粘附效率和靶向性。例如,根据需要,在所述声共振免疫导引体的表面被覆亲水或疏水涂层。
本发明实施例中的捕获系统还包括微流控细胞分选检测装置50,所述微流控细胞分选检测装置50用于对由所述声共振导引体40捕获的待测细胞进行计数和检测。
具体地,本发明中的微流控细胞分选检测装置50是基于超声的微流控细胞分选检测装置。如图8所示,所述微流控细胞分选检测装置50包括:待测细胞荧光染色池51、单细胞流通腔道52、超声设备53以及荧光显微镜成像系统54。所述待测细胞荧光染色池51用于将在体捕获系统捕获的待测细胞进行荧光染色,从而实现待测细胞的可视性。所述单细胞流通腔道52与所述待测细胞荧光染色池51连接,并且超声设备53设置在单细胞流通腔道52的腔道外侧,通过超声设备53发射的超声聚焦波形成声场,使荧光染色的待测细胞池内的细胞群流过单细胞流通腔道52并实现单细胞规律排列,从而利于下游的荧光显微镜成像系统54进行检测。所述荧光显微镜成像系统54设置在所述单细胞流通腔道52的末端,用于对流过单细胞流通腔道52的被荧光标记的待测细胞进行识别、计数和检测。
下面介绍如上所述的待测细胞在体捕获系统的工作方法,或者说是提供一种待测细胞在体捕获方法,参阅图9,该方法包括步骤:
S10、控制免疫微纳米气泡供应装置制备获得表面偶联有能够识别待测细胞的抗体的免疫微纳米气泡,将所述免疫脂质微纳米气泡注入到体内待测区域。该步骤中,将所述免疫微纳米气泡注入到体内待测区域之后,所述免疫微纳米气泡与待测细胞发生特异性结合形成免疫微纳米气泡复合体。
S20、提供声共振免疫导引体,确定声共振免疫导引体的工作频率。具体地,根据声共振免疫导引体的直径、材料参数,理论预测并实验测量其表面产生局域强场模式的超声工作频率。实际工作中可以将声共振免疫导引体放置在水中,通过测量透射频谱获得共振频率而确定其工作频率。在一个具体的实施方案中,PLGA声共振导引体的直径为300微米,理论预测其产生局域强场模式的工作频率为1.5MHz。
S30、控制声共振免疫导引体体内输送装置将表面偶联有能够识别待测细胞的抗体的声共振免疫导引体输送至体内待测区域。该步骤中,声共振免疫导引体输送至体内待测区域之后,所述声共振免疫导引体与待测细胞发生特异性结合直接捕获待测细胞。
S40、控制超声发射装置发射超声波,激励所述声共振免疫导引体产生局域强场,使得所述声共振免疫导引体吸附所述免疫微纳米气泡复合体从而捕获待测细胞。
该步骤中,首先要待免疫微纳米气泡和声共振免疫导引体被送入到体内待测区域一定的时间后再控制超声发射装置发射超声波,其中要根据步骤S20中确定的声共振导引体的工作频率来决定超声发射装置发射的超声波的频率范围,以使满足共振的要求。
S50、控制声共振免疫导引体体内输送装置将捕获待测细胞后的声共振导引体输送至体外。
S60、控制微流控细胞分选检测装置对由所述声共振导引体捕获的待测细胞进行计数和检测。
本发明实施例提供的待测细胞在体捕获系统及方法已经经过数值模拟验证其可行性。
图10至图12是不同尺寸直径的免疫微纳米气泡在直径为300微米截面为圆形的PLGA声共振导引体周围的受力分布图。其中,箭头表示受力方向,颜色代表受力强度,图10中免疫微纳米气泡的直径为2微米,图11中免疫微纳米气泡的直径为4微米,图12中免疫微纳米气泡的直径为6.6微米。从图10至图12可以看出,在外声场作用下,声共振导引体共振产生的局域声场,可以使得免疫微纳米气泡在导引体周围受到吸引力的作用,聚集在导引体周围,但是免疫微纳米气泡的粒径会影响力的空间分布,使得气泡被吸引或者排斥。因此,需要通过微流控的方法制备合适粒径的免疫微纳米气泡,从而使尽可能多的微泡被捕获和吸引,免疫微纳米气泡直径优选为1μm~10μm的范围内。
图13是本发明实施例中由声共振导引体捕获待测细胞的显微镜下的放大照片图示。
综上所述,本发明实施例提供的待测细胞在体捕获系统及方法,通过将表面偶联有能够识别待测细胞的抗体的免疫微纳米气泡和声共振免疫导引体送入体内待检测区域,声共振免疫导引体一方面可与待测细胞发生特异性结合直接捕获待测细胞,另一方面在超声波的激励下,利用声共振免疫导引丝作为产生局域声场的“二次声源”吸附富集与待测细胞结合后的免疫微纳米气泡,进一步捕获更多数量的待测细胞,提高了体内微量待测细胞(例如循环肿瘤细胞CTC)的捕获数量,提升后续检测的精确度。
以上所述仅是本申请的具体实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本申请原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本申请的保护范围。
- 一种待测细胞在体捕获系统及其工作方法
- 一种待测细胞在体捕获系统
