转导缓冲液
文献发布时间:2023-06-19 11:30:53
相关申请
本申请是中国专利申请201480056061.8号的分案申请,要求2013年8月28日递交的英国专利申请1315321.8号的优先权。
发明领域
本发明涉及将分子导入细胞的转导缓冲液和方法。
发明背景
将小分子或大分子导入细胞的能力在研究和医学中具有重要应用。遗憾的是,细胞膜对许多生物学活性分子的导入呈现主要障碍。
虽然将蛋白导入细胞的能力在研究和医学中具有许多应用,但是将蛋白导入细胞的可靠、无毒且有效的方法依然缺乏。
Castellot JJ Jr等人(Proc Natl Acad Sci U S A.1978Jan;75(1):351-5)考虑了使用含4.2%(w/v)氯化钠的培养基将小分子导入细胞的方法。他们证明了台盼蓝被基于高张处理的永生化仓鼠BHK细胞吸收。然而,作者并没有论证台盼蓝在吸收后被释放进细胞质或其他细胞区室。而且,台盼蓝是小分子,并不清楚所述过程是否也允许大分子的吸收。从本申请所示的数据中,特别是图2G和3E,我们证明了尽管NaCl介导的高张性诱导经巨胞饮从细胞外空间吸收大分子,但是添加转导化合物(如非去污剂磺基甜菜碱或本申请中所描述的其他化合物)是将巨胞饮体释放进细胞内腔所必需的。此外,每100mL培养基4.2克氯化钠能转换为大约1727mOsm/Kg的培养基重量克分子渗透浓度,正常情况下,该重量克分子渗透浓度不能被原代细胞耐受。同样地,不能将Castellot及其同事所描述的方法应用于将大分子转导进原代细胞和/或干细胞系。
1982年,Okada和Rechsteiner证明了通过0.5M蔗糖和10%PEG1000诱导的高张处理,随后通过短暂的低张处理,诱导了将大分子和蛋白胞内吸收进永生化细胞系
几年后,来自Green
TAT肽介导的蛋白转导的明显优势是,所述方法似乎适用于所有细胞类型包括原代细胞,并且通常无毒。然而,TAT肽的强正电荷严重地妨碍了天然重组TAT融合蛋白在大肠杆菌中的产生,大量的重组蛋白终止于包含体。此外,随后的研究证明,关于自我转导蛋白的某些较早报道实际上是在细胞固定期间导入的实验人为假象的结果
已投入了巨大的努力将核苷酸(DNA、RNA、siRNA)和/或治疗分子导入细胞,并且虽然原代细胞依然造成挑战,但是使用阳离子脂质、纳米颗粒或病毒载体作为跨膜运载体已经获得进展。
例如,US 6124207描述了使用具有促融特性的阳离子两亲转染剂来产生脂质体(去污剂胶团)。随后将这些脂质体与DNA混合以形成脂质体-DNA复合体,然后转染进细胞。当在体内进行时,向转染制剂添加“生理”盐水(9g/l的NaCl水溶液),也被称为“正常”盐水,并且非常接近于血液中NaCl的重量克分子渗透浓度。该申请说明了“裸露”DNA的转染效率低。
这样的“载体”方法还被用于靶基因修饰,其中将编码遗传修饰蛋白(例如TALEN、CRISPR/CAS和其他基因编辑系统)的DNA或mRNA转染进细胞。通常,这样的基因修饰通过病毒转导进行。这些方法导致不良反应的重大风险,包括由于高剂量注入病毒引起的急性免疫排斥反应,以及由病毒整合位置效应产生的肿瘤形成。此外,所述核酸在细胞内表达数天,导致酶的高表达以及脱靶效应的较大可能性,例如对细胞内非靶序列进行遗传修饰。对于某些细胞类型,病毒转导也依然低效。这些难点阻碍了上文提及的基因编辑系统的临床应用。
相反,用于蛋白的细胞内递送的新技术发展已处于实际上的停顿状态。尽管如此,将蛋白导入细胞的能力在疫苗研发、基因组编辑、表观遗传重编程(reprogramming)、(干)细胞分化和胞内过程操控中具有许多应用。因此非常需要发展更好的技术用于特别是原代细胞中蛋白和其他大分子的有效胞内递送。
因此,需要用于将蛋白和其他分子转导进细胞的更有效方法。将分子转导进细胞是许多治疗和科学目的(包括基因疗法)所希望的。
这里我们描述了,在不影响细胞生活力的情况下,将盐引起的高张性、小分子化合物和渗透保护剂(osmoprotectant)组合,促进了将小分子和大分子稳健而有效地导入原代细胞。我们提供了如何在各种各样的原代细胞、干细胞系及其衍生物中导入蛋白、核苷酸、纳米球和大分子的实例。此外,我们描述了将蛋白和核苷酸同时转导进细胞。
发明概述
本发明提供将目标分子转导进细胞的方法,其中所述方法包括:使所述细胞与目标分子和转导缓冲液接触,其中,所述转导缓冲液包含盐、转导化合物,以及优选地包含渗透保护剂。
所述“将目标分子转导进细胞的方法”在本文也被称为“转导方法”或“用于转导的方法”。这些术语被可互换地使用来指相同的方法。
本发明还提供包含盐和转导化合物的转导缓冲液。本发明还提供包含盐、转导化合物,以及任选地包含渗透保护剂和/或细胞培养基的转导缓冲液。
本发明还提供本发明的转导缓冲液在将目标分子转导进细胞中的用途。
本发明还提供本发明的转导缓冲液在遗传修饰例如具体靶序列的遗传修饰(在本文也被称为“基因编辑”)中的用途。使用本发明的转导化合物、缓冲液和方法,可被导入细胞的基因编辑系统的实例,通常涉及具有核酸酶活性(例如核酸内切酶或核酸外切酶活性)的蛋白。核酸酶活性可存在于蛋白的野生型中,或者例如可通过重组方法将其加入以产生融合蛋白。使用本发明的转导化合物、缓冲液和方法,可被导入细胞的基因编辑系统的实例,包括“固有地”靶向具体序列的蛋白(如锌指核酸酶(ZFN)和TALEN),以及使用核酸(例如小向导RNA[sgRNA]或向导DNA[gDNA])被“引导”至靶序列的蛋白,例如其作为CRISPR-Cas9系统、级联系统、TtAgo和其他Argonaute系统以及其他FOKI核酸酶相关蛋白的一部分。“固有地”,其意指所述蛋白到达其靶序列不需要其他向导分子。
本发明还提供用于治疗的本发明的转导缓冲液。
本发明还提供包含本发明的转导缓冲液的药物组合物。
本发明还提供渗透保护剂在将目标分子转导进细胞中的用途。例如,本发明提供甘氨酸和/或甘油作为渗透保护剂在将目标分子转导进细胞中的用途。
本发明还提供本文所述的转导化合物(如非去污剂甜菜碱或表1中所描述的任何化合物)在将目标分子转导进细胞中的用途。
本发明还提供选自表1的转导化合物在将目标分子转导进细胞中的用途。
本发明还提供下列化合物:#10、#11、#16、#42、#34、#41、#40、#39、#33、#15、#11、#29、#36和#46(如表1中的编号)。
本发明还提供修饰细胞中的核酸(如遗传序列)的方法,其中所述方法包括:使所述细胞与能够修饰核酸的蛋白以及转导缓冲液接触,其中所述转导缓冲液包含(i)转导化合物,(ii)盐或钠氢运载蛋白的激活剂/增强剂,以及优选地包含(iii)渗透保护剂。
发明详述
转导是将来自外部环境的分子内化进细胞。少量的蛋白和肽具有能够穿透细胞膜的固有特性。通过改变细胞的环境条件或通过修饰用于转导的目标蛋白,其他蛋白可被赋予该转导特性。
本发明提供用于将分子转导进细胞的改善的方法和缓冲液。具体而言,本发明提供新型缓冲液组合物,其允许在不需要修饰分子以及细胞生活力具有最小限度损失的情况下将分子有效转导进细胞。
具体地,发明人发现,包含盐、转导化合物以及优选包含渗透保护剂的转导缓冲液意外地允许将蛋白和其他分子有效吸收进细胞。为了产生iPS细胞,发明人尝试改善将细胞穿透肽(CPP)标记的OCT4运送进干细胞的效率。他们出乎意料地发现,他们用与蛋白稳定剂组合的含有盐的转导缓冲液可意外地实现高的效率,以至于将CPP标签移出,依然发生高效的转导。发明人发现,还可通过添加渗透保护剂来改善转导的水平,所述渗透保护剂增加转导的效率,并且还增加了被转导细胞的生活力和持续增殖。他们已展示,所述方法对其他分子起作用,如小分子、核酸和具有各种大小、电荷和功能的蛋白。他们还证明,所述方法适用于转导进所有测试的细胞类型,包括各种原代细胞、干细胞系及其衍生物。此外,他们考虑到,转导缓冲液可在体内使用,特别是向转导缓冲液中添加粘度增强剂时。因此,所述缓冲液在将一系列分子转导进一系列细胞(体外和体外)中具有许多用途。
不希望受理论束缚,发明人假设,包含盐和转导化合物(如下文所定义的)组合的转导缓冲液使巨胞饮通路激活。该假设被发明人的许多实验支持,所述实验涉及替代性运输通路的抑制(参见实施例)。例如,该假设被实施例14支持,该实施例描述了半乳凝素3-GFP报告基因系统的使用,并且证明了蛋白转导期间巨胞饮体囊泡的泄漏。因此,实施例14显示,本文所描述的转导缓冲液,通过巨胞饮促进蛋白和其他分子的吸收以及促进诱导巨胞饮体囊泡泄漏以将转导的目标分子释放进胞质溶胶。巨胞饮是液相胞吞作用的类型,其特征在于,其对网格蛋白的独立性以及形成相对大尺寸的囊泡(直径范围0.2至1μm)。尽管通常由极少数特定标志物较差地表征,但巨胞饮已显示出对树突状细胞的免疫监督的重要性。在其他细胞类型中,巨胞饮以低自发率发生,但在应答生长因子时其被迅速地诱导。在免疫系统外部的细胞中巨胞饮的功能依然难以捉摸。发明人假设,他们的转导缓冲液激活了巨胞饮通路,并且促进通过该通路将分子吸收进细胞。其还促进从核内体将分子释放至细胞的胞质溶胶。假设盐执行两个作用:第一,它产生高克分子渗透浓度,以及第二,盐结合并激活参与巨胞饮的关键膜运输蛋白。转导化合物被认为是促进将目标蛋白或其他分子吸收进囊泡。还认为其维持目标分子的天然结构和稳定性,并且也可能有助于从巨胞饮囊泡进行细胞内释放。看来盐与转导化合物的组合对有效转导是重要的。据我们所知,目前该组合还没有被用来刺激将蛋白或其他分子转导进细胞。
转导方法
本发明提供将目标分子转导进细胞的方法,其中所述方法包括以下步骤:使所述细胞与目标分子接触,以及使所述细胞与包含盐和转导化合物的转导缓冲液接触。
以组合的方式,使目标分子和转导缓冲液同时地、依次地或以任意顺序分别地与细胞接触。在一个优选实施方案中,它们被同时地施用(例如来自容纳有所述组合的容器)。因此,在某些实施方案中,所述转导缓冲液包含目标分子。在某些实施方案中,所述方法包括将转导缓冲液和目标分子混合的步骤。
在某些实施方案中,所述方法包括在转导之前获得细胞和/或在培养基中维持细胞的步骤。在某些实施方案中,在转导之前,将细胞接种于适合具体细胞的培养基中。在某些实施方案中,所述方法还包括在转导期间使细胞与培养基接触。在某些实施方案中,所述方法包括使转导缓冲液与培养基混合的步骤。
在某些实施方案中,所述方法包括以下步骤:在转导之前获得细胞并且在培养基中维持细胞,以及在转导期间使细胞与培养基接触。在某些实施方案中,所述方法包括以下步骤:将转导缓冲液与培养基混合,然后使细胞与转导缓冲液接触。在某些实施方案中,在转导之后,将转导缓冲液吸走,和/或将细胞洗涤例如一次或两次。通常,向该阶段的细胞添加适合具体细胞类型的常规培养基。在某些实施方案中,所述方法包括在转导之后获得细胞和/或在培养基中维持细胞的步骤。
在某些实施方案中,通过添加盐将最终转导缓冲液的重量克分子渗透浓度调节至所需的重量克分子渗透浓度。在一个优选实施方案中,包含目标分子和/或培养基的最终转导缓冲液,相对于细胞胞质溶胶是高张的。
所述转导方法可在体内或体外进行。
在某些实施方案中,所述转导方法不涉及跨膜载体,例如其选自病毒质粒、纳米颗粒、脂质体或其他脂质囊泡(包括胶团)。在某些实施方案中,所述转导方法为非病毒性的,意味着其不依赖于病毒转染系统,和/或不涉及例如作为跨膜载体的病毒质粒。在某些实施方案中,所述转导方法不涉及例如作为跨膜载体的阳离子脂类。在某些实施方案中,所述转导方法不涉及例如作为跨膜载体的脂质体。在某些实施方案中,所述转导方法不涉及例如作为跨膜载体的纳米颗粒。在某些实施方案中,所述转导方法不涉及例如作为跨膜载体的外膜囊泡(OMV)。在某些实施方案中,所述方法不涉及细胞穿透肽。
在某些实施方案中,所述方法涉及激活或促进巨胞饮和/或促进核内体裂解,因此其促进向细胞吸收分子,特别是目标分子。在本申请的环境中,应理解的是,“核内体(endosome)”不同于“脂质体”或“胶团”,所述核内体为巨胞饮涉及的细胞膜内陷并且包含脂类的复合混合物,所述脂质体或胶团为通常由更少类型的脂质分子以及由“OMV”形成的合成脂质囊泡,其为细菌囊泡,可将其修饰使得它们适合作为跨膜载体。
在一个实施方案(“第一方案(protocol)”或“方案12/500”)中,在约500mOsm/Kg的重量克分子渗透浓度下,进行约12小时的转导。例如,转导前一天(约12至24小时之前),将细胞接种于无抗生素的合适培养基中。第二天(转导当天),制备具有目标分子的1x“转导缓冲液500”(具有500mOsm/Kg的重量克分子渗透浓度的转导缓冲液)。将5x转导缓冲液和目标分子与细胞培养基混合,以获得500mOsm/Kg的重量克分子渗透浓度的1x转导缓冲液。向细胞添加该培养基/转导缓冲液/目标分子的混合物。将细胞与目标分子在转导缓冲液中孵育约12小时,该时间之后,将转导培养基移出并且更换为常规培养基。
在又一实施方案(“第二方案”或“方案3/700”)中,在约700mOsm/Kg的重量克分子渗透浓度下,进行约3小时的转导。例如,转导前一天(约12至24小时之前),将细胞接种于无抗生素的合适培养基中。第二天,制备具有目标分子的1x“转导缓冲液500”。添加NaCl或RbCl或另外的盐(参见下文),以调节最终重量克分子渗透浓度至700mOsm/Kg。例如,向98μl1x“转导缓冲液500”添加2μl 5M NaCl,以获得700mOsm/Kg的最终重量克分子渗透浓度。将细胞与目标分子在转导缓冲液中孵育约3小时,该时间之后,将转导培养基移出并且更换为常规培养基。
在又一实施方案(“第三方案”或“方案2/1000”)中,在约1000mOsm/Kg的重量克分子渗透浓度下,进行约2小时的转导。例如,转导前一天(约12至24小时之前),将细胞接种于无抗生素的合适培养基中。第二天,将4体积的1x“转导缓冲液1000”与1体积的含目标分子的5x“转导缓冲液500”混合。将细胞与目标分子在转导缓冲液中孵育约2小时,该时间之后,将转导培养基移出并且更换为常规培养基。
在又一实施方案(“第四方案”或“适合Cas9的转导方案”)中,在约1250mOsm/Kg的重量克分子渗透浓度下,进行约60至90分钟的转导。转导化合物以约250mM的浓度优选使用。该方案尤其用于转导具有低溶解度的分子,包括例如Cas9核酸酶蛋白(其为CAS/CRISPR基因编辑系统的部分)。例如,转导前一天(约12至24小时之前),将细胞接种于优选地无抗生素的合适培养基中。第二天,向转导缓冲液添加目标分子。将细胞与目标分子在转导缓冲液中孵育约60至90分钟,该时间之后,将转导培养基移出并且更换为常规培养基。
在又一实施方案中,转导以组合的重量克分子渗透浓度形式进行。例如,在约1000mOsm/Kg的重量克分子渗透浓度下进行约2小时,随后在约500mOsm/Kg的重量克分子渗透浓度下进行约10小时。例如,转导前一天(约12至24小时之前),将细胞接种于无抗生素的合适培养基中。第二天,将4体积1x“转导缓冲液1000”与1体积含目标分子的5x“转导缓冲液500”混合。将细胞与目标分子在转导缓冲液中孵育约2小时,该时间之后,将转导培养基移出,并且更换为具有或没有目标分子的1x“转导缓冲液500”(具有500mOsm/Kg的重量克分子渗透浓度的转导缓冲液)。将细胞与目标分子在1x“转导缓冲液500”中孵育约10-12小时,该时间之后,将转导培养基移出并且更换为常规培养基。
为了避免任何疑义,应理解的是,这些方法和方案与下文详细描述的转导化合物、盐、渗透保护剂和转导缓冲液中其他另外组分是兼容且可组合的。这些方案和方法可被用来将各种目标分子(包括目标分子的组合)转导进细胞,如下文详细描述。
用于转导的转导化合物
在转导缓冲液中包含转导化合物是有效转导所必需的。因此,本发明提供包含本文所描述的至少一种转导化合物的缓冲液。
发明人发现,当多种化合物被用于本发明的转导缓冲液的环境中时,其允许将目标分子有效转导进细胞。因此,本文使用的“转导化合物”,当在用于本发明的转导缓冲液的环境中使用时,指的是能促进将目标分子转导进细胞的任何化合物。实施例中所描述的β-内酰胺酶分析,可被用来测定化合物是否为转导化合物。如果需要其他分析来测试转导化合物的功效,特别是来证明与巨胞饮机理的关联,那么可使用实施例14中所描述的Gal3-GFP分析。
因此,在一个方面,提供用于鉴定转导化合物的方法,其中所述方法包括:
使用本文所描述的转导缓冲液或方案(例如上文所描述的第一方案、第二方案、第三方案或第四方案),使已被修饰以表达半乳凝素-3-GFP(GAL3-GFP)融合蛋白的细胞与候选转导化合物接触;以及
通过绿色荧光发射观察GAL3-GFP的定位;
其中GAL3-GFP针对细胞内囊泡的定位指示有效的转导化合物。
在某些实施方案中,鉴定转导化合物的方法还包括,分离有效的转导化合物,以及任选地,将所述转导化合物并入本文所描述的转导缓冲液,或者在本文所描述的转导方法中使用转导化合物。在某些实施方案中,候选转导化合物替代本文所描述的转导缓冲液或方案中的已知转导化合物。在其他实施方案中,候选转导化合物是本文所描述的转导缓冲液或方案中已知转导化合物之外的化合物。在一个优选实施方案中,将绿色荧光发射与对照细胞相比,除不含有候选转导化合物之外,用相同的方式处理所述对照细胞。在某些实施方案中,转导化合物为通过该方法鉴定的任何转导化合物。
发明人发现的第一种转导化合物为非去污剂磺基甜菜碱(NDSB;例如NDSB-201)。发明人测试了该化合物的衍生物(如非去污剂羧基甜菜碱[NDCB]),并且发现许多同样为转导化合物的其他相关化合物。虽然起作用的有多种化合物结构,但可从多种不同化合物总结出许多共同特征,如下文更详细地描述。
发明人发现,转导化合物通常包含至少一个亲水官能团。在某些实施方案中,转导化合物仅具有一个亲水官能团;这样的化合物的实例包括戊酸(表1中的示例性化合物#23)和正丁胺(表1中的示例性化合物#24)。在某些实施方案中,转导化合物具有多于一个亲水官能团,例如2、3、4、5或更多个。
虽然转导化合物允许其末端处基本上自由,但是看来在碳链每一端优选亲水基团。因此,在优选的实施方案中,转导化合物为具有至少两个亲水基团的化合物,各个亲水基团被短疏水基团(如C1-5亚烃基)隔开。该链中具有6个或更多个碳的亚烃基很可能对细胞有毒。亲水基团可为相同或不同的。
在某些实施方案中,所述转导化合物为甜菜碱。如本文所用,术语“甜菜碱”指具有不携带氢原子的阳离子官能团和具有阴离子官能团的任何中性化合物。阳离子官能团的非限制性实例包括季铵阳离子。阴离子官能团的非限制性实例包括羧酸根、磺酸根和磷酸根阴离子。
在某些实施方案中,所述转导化合物不为去污剂。在某些实施方案中,转导化合物为非去污剂甜菜碱。术语“非去污剂甜菜碱”(NDB)指在溶液中不形成胶团的甜菜碱。因此,不为去污剂的转导化合物在溶液中不形成脂质体或胶团。
例如,在某些实施方案中,所述转导化合物为非去污剂磺基甜菜碱(NDSB)。NDSB为通过短疏水基团(如C1-5亚烃基)将磺酸根基团与季氮基团隔开的甜菜碱。
在某些实施方案中,所述转导化合物为小分子化合物。在某些实施方案中,所述转导化合物具有不到50个碳原子、不到30个碳原子、不到25个碳原子,或不到20个碳原子。在某些实施方案中,所述转导化合物具有小于1000g/mol、小于500g/mol、小于400g/mol、小于360g/mol、小于300g/mol、小于200g/mol的量。
不希望受理论束缚,发明人假设,这些化合物可朝着彼此折叠,而产生分子的疏水侧和亲水侧,允许所述化合物作为转导化合物很好地起作用,例如,如下文所述。
在某些实施方案中,季氮原子为脂肪族或芳香环结构的一部分。在某些实施方案中,所述转导化合物为NDSB,其选自二甲基乙基-(3-磺丙基)-铵盐(NDSB-195,Vuillard etal(1994)FEBS Letters,353,294-296;Goldberg et al(1995/1996)Folding&Design,1,21-27)、3-(1-吡啶基)-1-丙磺酸盐(NDSB-201)、二甲基苄基铵丙磺酸盐(NDSB-256)、二甲基-叔丁基-(3-磺丙基)铵盐(NDSB-222t)、3-(1-甲基哌啶)-1-丙磺酸盐(NDSB221)、二甲基-(2-羟乙基)-(磺丙基)-铵盐(NDSB-211;Vuillard et al(1995)Anal Biochem,230,290-294)。在一个优选实施方案中,转导化合物为NDSB-201。
还发现,非去污剂羧基甜菜碱(NDCB)作为转导化合物起作用。因此,在某些实施方案中,转导化合物为NDCB。NDCB为通过短疏水基团(如C1-5亚烃基)将羧酸根基团与季氮基团隔开的甜菜碱。如上文关于NDSB所描述的,NDCB能够在溶液中折叠,而提高它们的促进转导能力。发明人发现,将NDSB的磺酸根基团置换为羧酸根基团以形成NDCB,不会负面地影响转导效率。如下文的实施例所示,与NDSB相比,许多NDCB发挥更高的效率并对细胞生活力和/或细胞增殖具有降低的影响。
在宽范围pH的溶液中为两性离子的非甜菜碱化合物也作为转导化合物起作用。例如,在溶液中为两性离子的某些氨基酸如GABA(γ-氨基丁酸)也作为转导化合物起作用。两性离子化合物通常包含至少一个酸性官能团和至少一个碱性官能团,其在溶液中可被电离。酸性基团包括羧酸、磺酸和磷酸官能团。碱性基团包括氨基基团。因此,在某些实施方案中,转导化合物为两性离子,例如,非去污剂两性离子,其优选包含至少一个酸性官能团和至少一个碱性官能团。在某些优选实施方案中,通过短疏水基团(如C1-5亚烃基)将酸性官能团与至少一个碱性基团隔开。
还意外地发现,非两性离子化合物作为转导化合物起作用。不是具有带负电荷的官能团(如上文所描述的羧酸根或磺酸根),而是包含生物等排(bioisosteric)基团(如酰胺或四唑)的化合物也作为转导化合物起作用。因此,在某些实施方案中,转导化合物包含酰胺或四唑官能团。在某些优选实施方案中,转导促进剂(所述转导化合物)包含通过短疏水基团(如C1-5亚烃基)与另一亲水基团(优选氨基或铵)隔开的酰胺或四唑官能团。
因此,在某些实施方案中,所述转导化合物为具有这样的基团的两性离子或非两性离子化合物:所述基团为针对带负电荷官能团的生物等排体。据认为,由于生物等排体基团联合带正电荷的官能团,这些非两性离子化合物具有某些“两性离子特性”,例如允许上文所描述的折叠机理。可为针对带负电荷官能团的生物等排体的基团包括但不限于,酰胺和四唑官能团(例如,参见化合物#43、#15、#29、#34、#30、#31和#45)。图6显示着眼于转导化合物的结构-功能关系的研究结果。
根据上文,所述转导化合物可为式I的化合物:
其中:
X选自:NR
Y选自:SO
n为1、2、3、4、5或6;
R
或者R
或者当X为NR
R
R
杂环基为饱和或部分不饱和的单环,如果可能,其含有独立地选自N、NR
杂芳基为5或6元芳香环,如果可能,其含有独立地选自N、NR
R
烷基为直链或支链的饱和烃;
R
C1-6羧酸意指–COOH或被COOH取代的C1-5烷基链以及其互变异构体、溶剂化物、两性离子和盐。
在某些实施方案中,所述转导化合物可包含季氮(quaternary nitrogen)或碱性氮基团。因此,在某些实施方案中,所述转导化合物为式I的化合物,其中X为NR
在某些实施方案中,R
在某些实施方案中,所述转导化合物为式I的化合物,其中Y选自:SO
在某些实施方案中,R
已发现,当隔开X和Y的碳链为三个碳原子长度时,更有效地促进转导。因此,在某些实施方案中,所述转导化合物为式I的化合物,其中n为3。在其他实施方案中,n为1、2、3、4、5或更多。在某些实施方案中,n为5或更少、4或更少、3或更少或者2或更少。
在某些优选实施方案中,所述转导化合物为属于式I的子集的化合物,如式II
其中
X选自:NR
Y选自:SO
R
以及所有其他基团,如上文在式I中所定义。
在某些实施方案中,所述转导化合物含有季氮基团。因此,在某些实施方案中,所述转导化合物为式I或II的化合物,其中X为NR
在某些实施方案中,季氮可为脂肪族或芳香环结构的部分。因此,在某些实施方案中,所述转导化合物为式I或II的化合物,其中X为
Z选自:C(R
各个R
R
优选地,R
R
在某些实施方案中,所述转导化合物为式I或II的化合物,其中X为(a),Z为NR
在其他实施方案中,所述转导化合物为式I或II的化合物,其中X为
Z选自:CR
R
R
在某些实施方案中,所述转导化合物为式I或II的化合物,其中X为(b),Z为NR
在某些实施方案中,所述转导化合物为选自表1化合物的化合物。本文所用的“化合物#”指使用表1中左手栏的化合物编号(#)的化合物。
在某些实施方案中,所述转导化合物选自:化合物#10、#11、#16、#42、#34、#41、#40、#39、#33、#15、#11、#29、#46和#36。
在某些实施方案中,所述转导化合物不为化合物#32。在某些实施方案中,所述转导化合物不为选自化合物#27、#07、#18、#09和#32的任一化合物。与对照化合物#1相比,这些化合物均表现出少于30%的转导。当表述提及“表1的化合物”时,应理解的是,在某些实施方案中,其指除化合物#32之外的表1所有化合物,或者除化合物#27、#07、#18、#09和#32之外的表1所有化合物。
在某些实施方案中,所述转导缓冲液包含一种转导化合物。在某些实施方案中,所述转导缓冲液包含以任何可能组合形式的两种或更多种(例如2、3、4、5、6或更多种)转导化合物,例如两种或更多种列举的转导化合物。所述转导化合物的组合的实例在图6F中提供。在某些实施方案中,所述转导缓冲液包含化合物#1和化合物#18。在某些实施方案中,所述转导缓冲液包含化合物#1和化合物#34。在某些实施方案中,所述转导缓冲液包含化合物#1和化合物#20。
在某些实施方案中,所述转导化合物的浓度为约0.1mM至约500mM、约1mM至约400mM、约1mM至约300mM、约1mM至约200mM、约1mM至约100mM、约2mM至约200mM、约2mM至100mM、约2mM至约80mM、约3mM至约75mM、约4mM至约70mM、约5mM至约60mM、约10mM至约50mM、约25mM至40mM,或者约30mM。在某些实施方案中,所述转导化合物的浓度为约25mM,例如在某些实施方案中,所述转导化合物的浓度为约10至约25mM,或者约25mM。在某些实施方案中,所述转导化合物的浓度为至少1mM、至少2mM、至少3mM、至少4mM、至少5mM、至少10mM、至少20mM、至少30mM、至少40mM、至少50mM、至少60mM、至少70mM或至少80mM、至少90mM、至少100mM、至少150mM、至少200mM、至少300mM、至少400mM或500mM。
在某些实施方案中,所述转导化合物的浓度为约100mM至约500mM、约200mM至约400mM、200mM至约300mM,或者约250mM。例如,当转导低溶解性的蛋白(如Cas9)时,这些更高的浓度范围特别有益。应理解的是,转导化合物的最佳浓度还将取决于化合物及其功效,但本领域技术人员例如通过使用实施例中所描述的实验和分析可容易地测定。
本发明提供了化合物#10。本发明还提供了化合物#11。本发明还提供了化合物#16。本发明还提供了化合物#42。本发明还提供了化合物#34。本发明还提供了化合物#41。本发明还提供了化合物#40。本发明还提供了化合物#39。本发明还提供了化合物#33。本发明还提供了化合物#15。本发明还提供了化合物#11。本发明还提供了化合物#29。本发明还提供了化合物#36。本发明还提供了化合物#46。这些化合物看来是新型的。本发明还提供本文任何地方所描述的转导化合物,用于通过疗法治疗人体或动物体的方法。具体而言,提供化合物#10、化合物#11或化合物#16,用于通过疗法治疗人体或动物体的方法。
在某些实施方案中,所述转导化合物为化合物#15(BU-2026-05)。该化合物是有优势的,因为即使以高浓度使用时,其导致高的转导效率,同时维持良好的细胞生活力(参见表1)。
在某些实施方案中,所述转导化合物为化合物#10。在某些实施方案中,转导化合物为化合物#11。在某些实施方案中,转导化合物为化合物#16。在某些实施方案中,转导化合物为化合物#42。在某些实施方案中,转导化合物为化合物#34。在某些实施方案中,转导化合物为化合物#41。在某些实施方案中,转导化合物为化合物#11。在某些实施方案中,转导化合物为化合物#40。在某些实施方案中,转导化合物为化合物#39。在某些实施方案中,转导化合物为化合物#33。在某些实施方案中,转导化合物为化合物#29。在某些实施方案中,转导化合物为化合物#15。在某些实施方案中,转导化合物为化合物#36。在某些实施方案中,转导化合物为化合物#46。在某些实施方案中,转导化合物为化合物#20。已表明相比于其他转导化合物,化合物#20导致特别良好的细胞存活率(例如,参见图18B)。
在某些实施方案中,相比于表1的参考化合物#1(NDSB-201),所述转导化合物为具有20%或更高、30%或更高、40%或更高、50%或更高、60%或更高、70%或更高、80%或更高、90%或更高、100%或更高、110%或更高、120%或更高、150%或更高、200%或更高、300%或更高、400%或更高、500%或更高、600%或更高、700%或更高、800%或更高、1000%或更高的转导效率的任意化合物,其通过实施例1所描述的方法测定。
同样地,在某些实施方案中,使用包括表1中所示化合物#1作为对照(即作为100%转导效率)的方法,所述转导方法(总体上)具有20%或更高、30%或更高、40%或更高、50%或更高、60%或更高、70%或更高、80%或更高、90%或更高、100%或更高、110%或更高、120%或更高、150%或更高、200%或更高、300%或更高、400%或更高、500%或更高、600%或更高、700%或更高、800%或更高、1000%或更高的转导效率。
相比于表1的参考化合物#1,具有大于100%转导效率的转导化合物的非限制性实例包括:参考化合物#30、#17、#15、#38、#35、#11、#10、#28和#37。这些化合物是特别有效的转导化合物。因此,在某些实施方案中,转导化合物选自:化合物#30、#17、#15、#38、#35、#11、#10、#28和#37。
其他优选的转导化合物包括:化合物#42、#1、#45、#43、#44、#15、#10、#11、#28、#37和#46。因此,在某些实施方案中,所述转导化合物选自:化合物#42、#1、#45、#43、#44、#15、#10、#11、#28、#37和#46。这些是相对于对照化合物#1具有或预计具有50%或更高的转导效率的化合物;和/或相对于对照化合物#1具有或预计具有75%或更高生活力的化合物。
在某些情况下,在缓冲液中使用转导化合物引起细胞增殖或生活力降低可能是有益的。例如,在疫苗研发的情况下,某些毒性可能是优点。针对免疫系统展示转入细胞中的抗原。如果展示的细胞不健康或即将死亡,那么免疫应答可被增强。适合于这样目的的转导化合物包括:化合物#40、#41、#25、#35和#38。因此,在某些实施方案中,所述转导化合物选自:化合物#40、#41、#25、#35和#38。
在其他实施方案中,所述转导化合物选自:化合物#10、#11、#16、#42、#34、#41、#40、#39、#33、#15、#11、#29、#36和#46。这些是据信为新型化合物的转导化合物。
本文所描述的转导化合物可以以单体、二聚体或多聚体的形式存在。例如,化合物#42以二聚体形式有效。因此,在某些实施方案中,所述转导化合物以其单体、二聚体或多聚体形式使用。在某些实施方案中,所述转导化合物为化合物#42的二聚体形式。
本发明还提供上文所描述的转导化合物在将一种或多种分子转导进细胞中的用途。
GABA激动剂
如上所述,被发现成为转导化合物一种化合物为γ-氨基丁酸(GABA,化合物#20),其为脑中的重要神经递质。GABA通过刺激GABA受体的活化起作用,已鉴定出其中的三个种类:GABA-A、GABA-B和GABA-C。GABA受体可被非常宽范围的化学结构刺激,从诸如乙醇和GABA本身的简单结构至看似不相关的苯并二氮杂卓、蝇蕈醇、巴氯芬。因为有效的蛋白转导化合物的化学结构还呈现自由度,所以发明人假设GABA信号转导可能在转导效果中发挥有效作用。的确,发明人发现,向包含盐和转导化合物(如NDSB-201)的转导缓冲液中添加GABA激动剂,导致转导进鼠胚胎成纤维细胞(MEF)的β-内酰胺酶增加。因此,可将GABA激动剂包含在转导缓冲液中以进一步提高转导效率。
鉴定GABA激动剂的方法是本领域已知的。例如,可通过如下的分析来确定适合在转导缓冲液中使用的GABA激动剂:其通过在大脑切片上使用膜片钳技术(Patch ClampTechniques,Springer Protocols Handbooks,2012,pp 71-83)来测量膜势能的变化,从而测量指定化合物对GABA受体的激活。还存在适合于鉴定GABA-B激动剂的商业化分析(例如Millipore的“Ready-to-assay”)。可使用这样的分析来鉴定在本文所描述的转导缓冲液中使用的合适GABA激动剂。
因此,在某些实施方案中,所述转导缓冲液还包含GABA激动剂。GABA激动剂包括激活GABA信号转导通路的任何化合物,例如结合和/或激活GABA受体(例如GABA-A、GABA-B和/或GABA-C受体)的任何化合物,例如,使用上文提及的膜片钳分析或Millipore分析进行鉴定。GABA激动剂的实例包括但不限于:SKF-97541、阿坎酸、巴比妥酸盐、苯并二氮杂卓、乙醇、安眠酮、蝇蕈醇、非苯并二氮杂卓(扎来普隆、唑吡坦、唑吡酮)、匹卡米隆、普罗加比、噻加宾、巴氯芬、1,4-丁二醇、GBL(γ-丁内酯)、GHB(γ-羟基丁酸)、GHV(γ-羟基戊酸)、GVL(γ-戊内酯)、Lesogaberan、Phenibut、(Z)-4-氨基-2-丁烯酸、(+)-顺-2-氨基甲基环丙烷羧酸、N4-氯乙酰基胞嘧啶阿拉伯糖苷、GABOB(γ-氨基-β-羟基丁酸)和普罗加比。
在某些实施方案中,转导缓冲液包含盐和转导化合物,并且还包含蝇蕈醇和/或SKF-97541。
在某些实施方案中,将GABA激动剂以微摩或纳摩范围浓度包含在转导缓冲液中。例如,在某些实施方案中,GABA激动剂的浓度为约0.1μM至约100μM、约1μM至约90μM、约2μM至约80μM、约3μM至约75μM、约4μM至约70μM、约5μM至约60μM、约10μM至约50μM、约25μM至40μM,或约30μM。在某些实施方案中,GABA激动剂的浓度为约10μM、约25μM或约50μM。在其他实施方案中,GABA激动剂的浓度为约0.1nM至约100nM、约1nM至约90nM、约2nM至约80nM、约3nM至约75nM、约4nM至约70nM、约5nM至约60nM、约10nM至约50nM、约25nM至40nM,或约30nM。在某些实施方案中,GABA激动剂的浓度为10nM、约25nM或约50nM。
其他神经递质同样可提高转导。因此,在某些实施方案中,所述转导缓冲液包含盐、转导化合物,以及还包含神经递质。
在转导缓冲液中使用的盐
在本发明的转导缓冲液中使用的盐为在本发明所述方法的环境中起作用的任何盐,即,当与转导化合物组合时,允许分子转导进细胞的任何盐。
如图5A所示,测试的所有Na相关的盐(根据周期表),包括LiCl、KCl、CsCl、RbCl,具有蛋白转导活性,Na和Rb表现出最高的活性。此外,测试了其他Na盐是否可诱导蛋白吸收。如图5A所示,葡糖酸钠有效地介导β-内酰胺酶的转导,效率类似于NaCl和RbCl。最后,测试了使用不相关的化合物增加张力是否也引起蛋白转导。如图5A所示,在700mOsm/Kg下,蔗糖、乳果糖、山梨糖醇和甘露糖醇均未能诱导蛋白转导,表明蛋白转导具体地依赖于由钠或钠相关的盐引起的高张性。用于鉴定适合在本发明的转导缓冲液中使用以引起高张性的盐的分析在实施例中提供(参见实施例6)。因此,优选地,所述盐可增加穿过细胞膜的张力,即所述盐为“高张的”盐。在下文更详细地解释张力。
因此,在某些实施方案中,所述盐为钠盐、锂盐、钾盐、铯盐或铷盐,优选钠盐或铷盐。在某些实施方案中,所述盐为氯化物、葡糖酸盐、碳酸盐、磺酸盐、硫酸盐、硫化物、溴化物、碘化物或氟化物,优选氯化物或葡糖酸盐。非限制性实例包括氯化钠、葡糖酸钠、氯化锂、葡糖酸锂、氯化钾、葡糖酸钾、氯化铯、葡糖酸铯、氯化铷和葡糖酸铷。在某些实施方案中,将一种盐包含在所述转导缓冲液中。在某些实施方案中,将多于一种盐包含在所述转导缓冲液中,例如,两种、三种、四种或五种盐。
有趣的是,蛋白转导被Na+/H+交换的特异性抑制剂(如EIPA或DMA)、钠-氢逆向转导体(Nhe)蛋白家族的特异性抑制剂强烈地抑制(图5B)。这些数据显示,转导过程涉及外源施加的化合物通过巨胞饮的有效细胞吸收。这通过将来自Nhe1敲除胚胎的鼠胚胎成纤维细胞(MEF)的转导与Nhe1杂合和野生型MEF的转导进行比较来进一步确认。如图5C所示,在Nhe1无效(null)成纤维细胞中,蛋白转导几乎完全地废除。与野生型同窝出生仔畜相比,来自Nhe1+/-杂合胚胎的成纤维细胞显示减少的蛋白转导活性(图5C)。这些结果证明,Nhe1是蛋白转导的重要中介体,但在Nhe1表达不存在下依然有剩余的蛋白转导活性。不希望受理论束缚,发明人假设,这样的Nhe运载蛋白的激活导致巨胞饮通路的激活,其为转导过程的第一步。
因此,在一个优选实施方案中,所述盐为能够结合和/或激活钠/氢(Na+/H+)运载蛋白(如Nhe运载蛋白,例如Nhe1运载蛋白)的任何盐。Nhe1为脊椎动物细胞中涉及体积和pH调节的普遍存在的膜结合酶。
在某些实施方案中,所述转导缓冲液包含钠/氢运载蛋白(如Nhe1运载蛋白)的激活剂和/或增强剂,作为盐的替代物或除盐之外的物质。例如,已显示数种生长因子通过激活Nhe1并且提高Na+/H+交换来诱导巨胞饮。因此,在某些实施方案中,所述钠/氢运载蛋白的激活剂或增强剂为细胞因子或生长因子。在某些实施方案中,所述钠/氢运载蛋白的激活剂或增强剂为表皮生长因子(EGF)、成纤维细胞生长因子(FGF)、血小板源生长因子(PDGF)、胰岛素、胰岛素样生长因子(IGF)。细胞因子或生长因子信号转导的小分子激动剂也可诱导Nhe1的活性。NHE1激活剂的其他实例包括但不限于:细胞因子或生长因子信号转导的小分子激动剂、血管紧张肽II、糖皮质素和激素(Alexander RT,J Exp Biol 212,1630-1637,2009)。在某些实施方案中,所述转导缓冲液包含多于一种钠/氢运载蛋白的激活剂和/或增强剂,例如一种、两种、三种、四种或五种。如上所述,在有或没有盐的情况下,考虑了上述激活剂和/或增强剂的任意组合。
在一个实施方案中,本发明提供包含钠/氢运载蛋白(如Nhe运载蛋白)的激活剂和/或增强剂和转导化合物的转导缓冲液。
巨胞饮或核内体裂解的其他激活剂和/或增强剂也可用于本发明的环境中。例如,本发明的发明人证明,短dTAT-HA2融合肽(之前显示其提高蛋白的巨胞饮体逃逸)提高蛋白转导,并且在小鼠胚胎干细胞(mESC)中特别有效。因此,在某些实施方案中,所述转导缓冲液还包含巨胞饮的激活剂和/或增强剂,或者巨胞饮体逃逸的促进剂。在某些实施方案中,所述转导缓冲液还包含dTAT-HA2融合肽。在某些实施方案中,所述转导缓冲液还包含溶源肽。例如,在某些实施方案中,所述转导缓冲液还包含核内体裂解的激活剂和/或增强剂。
还提供使用溶源肽提高将目标分子转导进细胞,所述溶源肽优选作为本文所描述的转导缓冲液的一部分。
转导的抑制
发明人展示了,通过巨胞饮使本文所述方法的转导发生,并且需要肌动蛋白的重构。因此,这些过程的特异性抑制剂可阻止转导。
在某些实施方案中,所述转导方法可被细胞松弛素D、或拉春库林A、或者肌动蛋白聚合作用和囊泡运输的其他特异性抑制剂抑制。同样地,所述转导方法可被Na+/H+交换的Nhe运载蛋白的特异性抑制剂(如EIPA或DMA)抑制。
重量克分子渗透浓度范围
将如上所定义的盐以合适的量加至所述转导缓冲液,以实现所需要的重量克分子渗透浓度。所述转导缓冲液的重量克分子渗透浓度可通过本领域已知方法使用渗透压计测定,或者例如如果组成缓冲液的其余体积的介质的渗透压是已知的,那么可计算转导缓冲液的重量克分子渗透浓度。因此,可添加盐以调节缓冲液的重量克分子渗透浓度至需要的水平(参见例如,实施例6)。
重量克分子渗透浓度为以每千克溶剂的溶质的渗透压克分子表示的溶液浓度。其不同于容积克分子渗透浓度,所述容积克分子渗透浓度为以每体积溶剂的溶质的渗透压克分子表示的溶液浓度。容积克分子渗透浓度为温度依赖性的,因为随着温度水改变其体积。因此,重量克分子渗透浓度为优选的测量,因为它不是温度依赖性的。如果溶质的浓度是非常低的,则认为容积克分子渗透浓度和重量克分子渗透浓度是等同。
相反,通过不穿过细胞膜的所有溶质的浓度来定义张力,即导致穿过细胞膜的渗透压的溶质浓度。在转导缓冲液的环境中,使用高张盐(如上文所描述的盐)实现高渗透压。对于起作用的转导方法,重要的是存在穿过细胞膜的渗透压。因此,当转导缓冲液可通过重量克分子渗透浓度定义(在细胞的隔离下)时,所述转导方法要求转导缓冲液相对于细胞胞质溶胶是高张的。置入高张溶液(如本文所描述的转导缓冲液)中的细胞,通过渗透作用失去水分。这引起细胞收缩,并且趋向于增加群体的细胞之间的空间。为了补偿细胞体积的损失,细胞激活巨胞饮,即来自细胞外环境的大分子的流入。应理解的是,所述转导缓冲液的最佳重量克分子渗透浓度为细胞类型特异性的,并且部分地由转导之前用来维持细胞的培养基的重量克分子渗透浓度和/或细胞胞质溶胶的重量克分子渗透浓度来限定。
因此,在某些实施方案中,将目标分子转导进细胞的方法涉及增加细胞外部的渗透压的步骤。在某些实施方案中,存在穿过细胞膜的渗透压。在某些实施方案中,所述转导缓冲液相对于转导之前维持细胞的培养基和/或相对于细胞胞质溶胶是高张的。换句话说,在某些实施方案中,所述转导缓冲液的重量克分子渗透浓度,大于转导之前维持细胞的培养基的重量克分子渗透浓度,和/或大于细胞胞质溶胶。
人血清的正常重量克分子渗透浓度为约275-295mOsm/kg。虽然暂时升高血清的重量克分子渗透浓度被用来减少中风患者的脑水肿,但在人中持续升高的总重量克分子渗透浓度可导致并发症,并且在严重的情况下可为致命性的。由于这个原因,药物组合物通常是等张的(与血清具有大约相同的重量克分子渗透浓度)。然而,个体细胞可在更高的重量克分子渗透浓度(例如,多至约1000mOsm/kg)下存活。因此,活的生物体能够耐受适度升高的重量克分子渗透浓度数天和局部暂时高的重量克分子渗透浓度。
高渗透压指溶液尤其是体液或培养基的重量克分子渗透浓度的异常增加。维持人细胞的重量克分子渗透浓度通常为约275-295mOsm/Kg,但是,例如,植入前胚胎在约250-260mOsm/Kg的重量克分子渗透浓度下生长。因此,在通常的人细胞环境中,高渗透压指大于约250mOsm/kg的重量克分子渗透浓度。因此,具有大于约295mOsm/kg的重量克分子渗透浓度的转导缓冲液,相对于通常的人细胞很可能是高张的,然而,具有大于约260mOsm/kg的重量克分子渗透浓度的转导缓冲液,相对于早期胚胎很可能是高张的。重量克分子渗透浓度降低,指溶液尤其是体液的重量克分子渗透浓度的异常减少。因此,在通常人细胞的环境中,重量克分子渗透浓度降低,指小于约295mOsm/kg的重量克分子渗透浓度。因此,具有补充性(tonic)盐介导的小于约295mOsm/kg的重量克分子渗透浓度的转导缓冲液,相对于通常的人细胞很可能是低张的。在通常胚胎的环境中,重量克分子渗透浓度降低,指小于约260mOsm/kg的重量克分子渗透浓度。因此,具有补充性盐介导的小于约260mOsm/kg的重量克分子渗透浓度的转导缓冲液,相对于通常的早期胚胎很可能是低张的。
渗透休克为细胞周围溶质浓度的突然变化,其引起水穿过其细胞膜的运动的迅速变化。在一个优选实施方案中,所述转导方法不要求或不涉及细胞的低渗休克,或者任何阶段下的低渗环境。在某些实施方案中,所述转导进细胞的方法涉及高渗休克。然而,将任何渗透休克或压力优选保持至最低限度(参见下文关于渗透保护剂的部分)。
在某些实施方案中,所述转导缓冲液相对于转导之前维持细胞的培养基,和/或相对于细胞胞质溶胶,不是等张的和/或不是等渗的。在某些实施方案中,所述转导缓冲液相对于转导之前维持细胞的培养基,和/或相对于细胞胞质溶胶不是低张的。在一个优选实施方案中,所述转导缓冲液相对于转导之前维持细胞的培养基,和/或相对于细胞胞质溶胶是高张的和/或高渗的。
在某些实施方案中,所述转导缓冲液的重量克分子渗透浓度为大于250mOsm/kg,例如大于300mOsm/kg。例如,所述转导缓冲液的重量克分子渗透浓度为大于350mOsm/kg、大于400mOsm/kg、大于450mOsm/kg、大于500mOsm/kg、大于550mOsm/kg、大于600mOsm/kg、大于650mOsm/kg、大于700mOsm/kg、大于750mOsm/kg、大于800mOsm/kg、大于850mOsm/kg、大于900mOsm/kg、大于950mOsm/kg、大于1000mOsm/kg、大于1100mOsm/kg、大于1200mOsm/kg、大于1300mOsm/kg、大于1400mOsm/kg,或大于1500mOsm/kg、大于1600mOsm/kg、大于1700mOsm/kg、大于1800mOsm/kg、或大于1900mOsm/kg、大于2000mOsm/kg、大于2100mOsm/kg、大于2200mOsm/kg、大于2300mOsm/kg、大于2400mOsm/kg、大于2500mOsm/kg、大于2500mOsm/kg、大于2600mOsm/kg、大于2700mOsm/kg、大于2800mOsm/kg、大于2900mOsm/kg,或者约3000mOsm/kg。
在某些实施方案中,所述转导缓冲液的重量克分子渗透浓度为小于3000mOsm/kg的重量克分子渗透浓度,例如小于2500mOsm/kg。例如,所述转导缓冲液的重量克分子渗透浓度为小于2000mOsm/kg、小于1900mOsm/kg、小于1800mOsm/kg、小于1700mOsm/kg、小于1600mOsm/kg、小于1500mOsm/kg、小于1400mOsm/kg、小于1300mOsm/kg、小于1200mOsm/kg、小于1000mOsm/kg、小于900mOsm/kg、小于800mOsm/kg,或小于700mOsm/kg、小于600mOsm/kg、小于500mOsm/kg、小于400mOsm/kg,或者约400mOsm/kg。
在某些实施方案中,所述转导缓冲液的重量克分子渗透浓度为至少250mOsm/kg、至少300mOsm/kg。例如,所述转导缓冲液的重量克分子渗透浓度为至少350mOsm/kg、至少400mOsm/kg、至少450mOsm/kg、至少500mOsm/kg、至少550mOsm/kg、至少600mOsm/kg、至少650mOsm/kg、至少700mOsm/kg、至少750mOsm/kg、至少800mOsm/kg、至少850mOsm/kg、至少900mOsm/kg、至少950mOsm/kg,至少1000mOsm/kg、至少1100mOsm/kg、至少1200mOsm/kg、至少1300mOsm/kg、至少1400mOsm/kg、至少1500mOsm/kg、至少1600mOsm/kg、至少1700mOsm/kg、至少1800mOsm/kg、至少1900mOsm/kg、至少2000mOsm/kg、至少2100mOsm/kg、至少2200mOsm/kg、至少2300mOsm/kg、至少2400mOsm/kg、至少2500mOsm/kg、至少2600mOsm/kg、至少2700mOsm/kg、至少2800mOsm/kg、至少2900mOsm/kg、至少3000mOsm/kg,或者约3000mOsm/kg。在某些实施方案中,所述转导缓冲液的重量克分子渗透浓度为至少1250mOsm/kg。
在某些实施方案中,所述重量克分子渗透浓度的范围为:约250mOsm/kg至约1500mOsm/kg、约300mOsm/kg至约1500mOsm/kg、约400mOsm/kg至约1500mOsm/kg、约500mOsm/kg至约1500mOsm/kg、约600mOsm/kg至约1500mOsm/kg、约700mOsm/kg至约1500mOsm/kg、约800mOsm/kg至约1500mOsm/kg、约900mOsm/kg至约1500mOsm/kg、约1000mOsm/kg至约1500mOsm/kg、约1100mOsm/kg至约1500mOsm/kg、约1200mOsm/kg至约1500mOsm/kg、约1300mOsm/kg至约1500mOsm/kg、或约1400mOsm/kg至约1500mOsm/kg,约300mOsm/kg至约1000mOsm/kg、约300mOsm/kg至约800mOsm/kg、约300mOsm/kg至约600mOsm/kg、约400mOsm/kg至约600mOsm/kg、约450mOsm/kg至约550mOsm/kg、约400mOsm/kg至约800mOsm/kg、约500mOsm/kg至约800mOsm/kg、约600mOsm/kg至约800mOsm/kg,或者约700mOsm/kg至约800mOsm/kg、约750mOsm/kg至约850mOsm/kg。在某些实施方案中,所述重量克分子渗透浓度范围为:约800mOsm/kg至约900mOsm/kg、约850mOsm/kg至约950mOsm/kg、约900mOsm/kg至约1000mOsm/kg、约950mOsm/kg至约1050mOsm/kg、约1000mOsm/kg至约1100mOsm/kg、约1050mOsm/kg至约1150mOsm/kg、约1100mOsm/kg至约1200mOsm/kg、约1150mOsm/kg至约1250mOsm/kg、约1200mOsm/kg至约1300mOsm/kg、约1250mOsm/kg至约1350mOsm/kg、约1300mOsm/kg至约1400mOsm/kg、约1350mOsm/kg至约1450mOsm/kg、约1400mOsm/kg至约1500mOsm/kg、约1600mOsm/kg至约1800mOsm/kg,或者约1700mOsm/kg至约1800mOsm/kg、约1750mOsm/kg至约1850mOsm/kg、约1800mOsm/kg至约1900mOsm/kg、约1850mOsm/kg至约1950mOsm/kg、约1900mOsm/kg至约2000mOsm/kg、约1950mOsm/kg至约2050mOsm/kg、约2000mOsm/kg至约2100mOsm/kg、约2050mOsm/kg至约2150mOsm/kg、约2100mOsm/kg至约2200mOsm/kg、约2150mOsm/kg至约2250mOsm/kg、约2200mOsm/kg至约2300mOsm/kg、约2250mOsm/kg至约2350mOsm/kg、约2300mOsm/kg至约2400mOsm/kg、约2350mOsm/kg至约2450mOsm/kg、约2400mOsm/kg至约2500mOsm/kg、约2600mOsm/kg至约2800mOsm/kg,或约2700mOsm/kg至约2800mOsm/kg、约2750mOsm/kg至约2850mOsm/kg、约2800mOsm/kg至约2900mOsm/kg、约2850mOsm/kg至约2950mOsm/kg、约2900mOsm/kg至约3000mOsm/kg。
在某些实施方案中,所述重量克分子渗透浓度范围为:约250mOsm/kg至约3000mOsm/kg、约300mOsm/kg至约3000mOsm/kg、约350mOsm/kg至约3000mOsm/kg、约400mOsm/kg至约3000mOsm/kg、约450mOsm/kg至约3000mOsm/kg、约500mOsm/kg至约3000mOsm/kg。
在一个实施方案中,所述转导缓冲液的重量克分子渗透浓度为约800mOsm/kg。已证明,该重量克分子渗透浓度适合于鼠胚胎成纤维细胞(MEF)。在又一其他实施方案中,所述转导缓冲液的重量克分子渗透浓度为约500mOsm/kg。已证明,该重量克分子渗透浓度适合于鼠胚胎干细胞(mESC)、诱导的人多能性干细胞(hIPSC)以及鼠和人神经干细胞。然而,如上所解释的,本领域技术人员应理解,根据靶细胞类型、转导分子的性质以及转导之前细胞环境的重量克分子渗透浓度,所述转导缓冲液的优选重量克分子渗透浓度将改变。
当目标分子是难溶的蛋白时,更高的重量克分子渗透浓度也可以是优选的。例如,对于难溶的蛋白,优选约1000mOsm/kg的重量克分子渗透浓度。在某些实施方案中,例如对于难溶的蛋白,例如对于在CRISPR-Cas9基因编辑环境中转导Cas9核酸酶蛋白,优选约1250mOsmol/Kg的重量克分子渗透浓度。
大体上,转导缓冲液的重量克分子渗透浓度越大,缓冲液越有效,即转导所需的时间越少。然而,也存在权衡,因为高的重量克分子渗透浓度可引起渗透压力,并且减少细胞的增殖和/或生活力(参见下文)。
本发明人研发了优化用于转导的时间(“孵育时间”或“转导时间”-参见下文)和缓冲液的重量克分子渗透浓度的分析(参见图10和实施例6)。因此,本领域技术人员可以使用这些分析来优化用于转导的时间和/或缓冲液的重量克分子渗透浓度。
用于转导的渗透保护剂
转导缓冲液中的盐增加了转导缓冲液的重量克分子渗透浓度,使得在转导方法期间,转导缓冲液相对于细胞是高张的。这可引起对细胞的渗透压力,并且在某些情况中,这可减少细胞的增殖或生活力(例如,通过BrdU并入进行测量;参见实施例部分)。本发明人发现,添加渗透保护剂可保护细胞免受这些影响。
渗透保护剂为小分子,其作为渗透物质并且帮助保护细胞和生物体免受渗透压力。在化学上,渗透保护剂可被分为三种类型:甜菜碱及相关(allied)化合物、多元醇和糖(例如甘油、甘露糖醇和海藻糖),以及氨基酸。甜菜碱为甘氨酸的甲基衍生物,其中氮原子被完全地甲基化,即它们为季铵化合物。用于本发明环境中的甘氨酸的其他甲基衍生物包括但不限于,肌氨酸和二甲基甘氨酸。本领域技术人员清楚的是,本文所描述的某些转导化合物因此可作为渗透保护剂起作用。同样作为渗透保护剂起作用的转导化合物的非限制性实例为GABA。然而,不是所有的渗透保护剂均能提高转导。同样地,不是所有的转导化合物均能作为渗透保护剂起作用。因此,在某些实施方案中,除转导化合物之外,向转导缓冲液添加渗透保护剂(在该环境中,其可以或者不作为渗透保护剂起作用)。
本发明人发现,许多不同的渗透保护剂类型和许多不同的渗透保护剂组合当被用于转导的方法时,其可增加细胞生活力(参见例如,图4)。
在某些实施方案中,所述渗透保护剂为甜菜碱或相关化合物、多元醇或糖和/或氨基酸,例如,所述氨基酸选:自甘氨酸、组氨酸、丙氨酸、异亮氨酸、精氨酸、天冬酰胺、亮氨酸、天冬氨酸、赖氨酸、谷氨酸、半胱氨酸、甲硫氨酸、苯丙氨酸、谷氨酰胺、苏氨酸、色氨酸、脯氨酸、缬氨酸、鸟氨酸、硒代半胱氨酸、丝氨酸、酪氨酸和脯氨酸。在某些实施方案中,所述渗透保护剂为甘氨酸或其衍生物。在某些实施方案中,所述渗透保护剂为甘氨酸的甲基衍生物,如肌氨酸、二甲基甘氨酸或甜菜碱。
在其他实施方案中,所述渗透保护剂选自:甘氨酸、甘油、牛磺酸、甘氨酸甜菜碱、肌醇、谷氨酰胺、谷氨酸、精氨酸、甘露糖醇和海藻糖。在一个优选实施方案中,所述渗透保护剂为甘氨酸或甘油。
在某些实施方案中,所述转导缓冲液包含多于一种类型的渗透保护剂,例如,甘氨酸和甘油。甘氨酸和甘油是优选的组合,因为它对鼠胚胎成纤维细胞(如图4B所示)、胚胎干细胞和人iPS细胞提供了最好的保护。然而,渗透保护剂的任意组合可适合于在本发明的转导缓冲液中使用。例如,本文所描述的渗透保护剂的任意组合,例如甘氨酸、甘油、牛磺酸、甘氨酸甜菜碱、肌醇、谷氨酰胺、谷氨酸、精氨酸、甘露糖醇和海藻糖中的2、3、4、5、6、7种或所有种的任意组合。
用于本发明的所选渗透保护剂的类型(或类型的组合),可取决于被转导的细胞类型。通过实施例6中所描述的分析(IV),本领域技术人员可很容易地确定渗透保护剂的适合性。
用于本发明的所选渗透保护剂的浓度,可取决于被转导的细胞的类型,但通过本领域熟知的方法,本领域技术人员可很容易地测定。在某些实施方案中,所述渗透保护剂的浓度为约5至约500mM、约1至约500mM、约1至约400mM、约1至约300mM、约1至约200mM、约1至约100mM、约10至约50mM、约15至约50mM、约20至约40mM。例如,在某些实施方案中,所述渗透保护剂以约15mM、或约20mM、或约30mM的浓度使用。在某些实施方案中,所述渗透保护剂以至少15mM、至少20mM、至少30mM、至少40mM、至少50mM至少60mM、至少70mM、至少80mM、至少90mM、至少100mM、至少200mM、至少300mM、至少400mM或约500mM的浓度使用。在某些实施方案中,所述渗透保护剂以500mM或更少、400mM或更少、300mM或更少、200mM或更少、100mM或更少、50mM或更少、40mM或更少、30mM或更少,或者20mM或更少的浓度使用。例如,在一个优选实施方案中,甘氨酸和/或牛磺酸以约15mM的浓度使用,和/或甘油以约30mM的浓度使用。
本发明还提供一种或多种(例如1、2、3、4、5、6、7、8或更多种)渗透保护剂(如本文所描述的任何渗透保护剂或渗透保护剂的组合)在将分子转导进细胞中的用途。例如,本发明提供甘氨酸和/或甘油作为渗透保护剂在将分子转导进细胞中的用途。
转导缓冲液的其他组分
应理解的是,本文所描述的转导缓冲液的任何其他组分可为转导缓冲液的一部分。可选地,可将它们以任意组合的方式同时或依次添加至细胞,作为转导方法的步骤。
所述转导缓冲液还可包含使其特别适合用于活细胞或活细胞培养或体内应用的组分。例如,在某些实施方案中,所述转导缓冲液包含生物pH缓冲液、粘度增强剂和/或一种或多种生长因子、盐、氨基酸、维生素和营养素中的一种或多种(例如2、3、4、5、6或7种)。
本发明的转导缓冲液通常在去离子水、蒸馏水中配制,虽然可使用合适的替代物,所述替代物包括但不限于细胞培养基或治疗溶液。通常,在使用之前,例如通过紫外光、加热、照射或过滤,使其无菌以防止污染。为了储存或运输可将其冷冻(例如在-20℃至-80℃,例如在-20℃,或者在-80℃)。所述转导缓冲液可含有一种或多种抗生素(如强力霉素或四环素)以防止污染。然而,某些抗生素,特别是非细胞可透过性抗生素(如青霉素和/或链霉素),当其被转导进细胞时,对细胞是有毒的。因此,在某些实施方案中,所述转导缓冲液不包含抗生素,例如,所述转导缓冲液不包含非细胞可透过性抗生素。在某些实施方案中,所述转导缓冲液不包含青霉素。
所述转导缓冲液可被pH约6至约8(例如pH约7.2至约7.6,或者pH约7.4)的生物pH缓冲液缓冲。该范围以外的pH(即高于8或低于6)可能适合施用于具体组织,被本领域技术人员容易地确定。例如,胃部pH可下降低至1或2。因此,施用于胃部的转导缓冲液的pH可小于7、小于6、小于5、小于4、小于3、小于2,例如pH为7、6、5、4、3、2或1。生物pH缓冲液为适合用于活细胞的pH缓冲液,即,其对细胞生活力具有最低的负面影响。生物pH缓冲液可为基于碳酸盐的缓冲液或任何其他合适的缓冲液。许多生物pH缓冲液是本领域已知的(参见例如于Plant Microtechnique and Microscopy,Oxford University Press,Steven E.Ruzin,ISBN:0-19-508956-1;和www.sigmaaldrich.com/life-science/core-bioreagents/biological-buffers/biological-buffer-products.html中所提供的生物缓冲液)。生物pH缓冲液的实例包括但不限于:PBS、TES、TRIS、PIPES、MOPS、MES、Good’s缓冲液、Trizma或HEPES。因此,在某些实施方案中,所述转导缓冲液还包含:PBS、TES、TRIS、PIPES、MOPS、MES、Good’s缓冲液、Trizma或HEPES。某些转导化合物也为极好的缓冲化合物,所以它们可作为代替生物缓冲液的缓冲液,或者除生物缓冲液之外的缓冲液。
所述转导缓冲液可补充有提纯的、天然的、重组的、半合成的和/或合成的生长因子(参见例如,实施例4)。可使用任何合适的生长因子或生长因子的组合。合适的生长因子的非限制性实例包括:EGF、FGF、HGF、PDGF、BDNF、VEGF或IGF。可使用合适的生长因子的任何组合。生长因子组合的非限制性实例包括由以下组成的名单中生长因子的任一种或多种(例如1、2、3、4、5或6种):EGF、FGF、HGF、PDGF、BDNF、VEGF或IGF。在某些情况下,添加的生长因子可取决于被转导的细胞,并且本领域已知,针对具体细胞如何选择合适的生长因子。
所述添加的生长因子的优选浓度为约1至约500ng/ml,或者至少5并且不高于500ng/ml。优选的浓度为至少1、2、5、10、20、25、30、40、45、50、60、70、80、90、100、200、300、400ng/ml,并且不高于600、500、450、400、350、300、250、200、150或100ng/ml。更优选的浓度为至少10ng/ml并且不高于500ng/ml。甚至更优选的浓度为约50ng/ml或为50ng/ml。本领域技术人员知道,生长因子的最佳浓度取决于生长因子和被转导的细胞。可通过本领域已知的方法和本文的实施例所描述的方法测定最佳浓度。
在某些实施方案中,所述转导缓冲液补充有细胞因子。与生长因子类似,不同的细胞因子适合于不同细胞类型的培养,并且合适的细胞因子是本领域已知的。也可向转导缓冲液添加本领域已知的其他细胞类型特异性因子,如但不限于LIF(为了维持胚胎干细胞的干细胞状态)和用于树突状细胞的GM-CSF。
本发明还提供那些信号转导通路的生长因子、细胞因子和/或神经递质和/或小分子激动剂在促进将目标分子转导进细胞中的用途,优选在本文所描述的转导缓冲液中使用,或与本文所描述的转导缓冲液一起使用。
在某些实施方案中,所述转导缓冲液还包含粘度增强剂。当转导缓冲液供体内使用时,这是特别优选的,因为其防止转导缓冲液的有害分散。因此,所述粘度增强剂帮助保持缓冲液与被转导细胞的接触。在某些实施方案中,所述粘度增强剂为:聚乙烯吡咯烷酮(PVP)、聚乙烯醇、甲基纤维素、羟丙基甲基纤维素、羟乙基纤维素、羧甲基纤维素钠(NaCMC)、丙二醇藻酸酯(PGA)或藻酸钠(SA)。优选的粘度增强剂无毒,并且适合与活细胞一起使用和/或体内使用。
在某些实施方案中,所述转导缓冲液还包含抗氧化剂,如乙二胺四乙酸(EDTA)、亚硫酸氢钠、焦亚硫酸钠、抗坏血酸或硫脲。
在某些实施方案中,所述转导缓冲液还包含基本培养基。合适的培养基可商购,并且包括但不限于:达尔伯克氏改良伊格尔培养基(DMEM)、最低必需培养基(MEM)、敲除-DMEM(KO-DMEM)、格拉斯哥最低必需培养基(G-MEM)、伊格尔基本培养基(BME)、DMEM/Ham’s F12、改进的DMEM/Ham’s F12、Iscove’s改良达尔伯克氏培养基和最低必需培养基(MEM)、Ham'sF-10、Ham’s F-12、培养基199和RPMI 1640培养基。
在某些实施方案中,所述转导缓冲液还包含血清。然而,在一个优选实施方案中,所述转导缓冲液不包含不明确的组分,如胎牛血清或胎小牛血清。各种不同的血清代替物制剂可商购,并且是本领域技术人员已知的。当使用血清代替物时,根据常规技术,例如其可以以培养基体积的约0.1%至约50%使用。
转导通常在适合于定期维持具体细胞类型的培养基中进行。当与本文所描述的任何因子一起时,该培养基可为转导缓冲液的一部分,或可在所述转导方法中将其单独地加至细胞。在一个优选实施方案中,转导期间使用的培养基中没有血清或有降低浓度的血清。
当缓冲液在供转导使用时,缓冲液的所有组分提供的浓度范围为最终的浓度(例如,当缓冲液在去离子水、蒸馏水、细胞培养基或治疗组合物中配制时的浓度)。
用于转导的蛋白通常以5X或10X浓缩物提供,当其被加至细胞培养基时,得到本文所描述的浓度。
用于转导的目标分子
在一个优选实施方案中,将多于一个目标分子(即多拷贝的目标分子)转导进细胞。例如,将至少2、至少10、至少20、至少50、至少100、至少500、至少1000、至少2000、至少5000、至少10,000个目标分子、至少10
本发明的转导缓冲液和方法可被用来将许多不同类型的生物分子和合成分子转导进细胞。例如,所述目标分子可为蛋白(包括肽和多肽)、核酸、多糖(如右旋糖酐)、囊泡(如核外体)、纳米颗粒、小分子、病毒或其他有机体。
在某些实施方案中,将一种或多种(例如1、2、3、4、5、6、7、8、9、10或更多种)不同类型的目标分子转导进细胞。在某些实施方案中,将多种目标分子例如以复合混合物的形式转导进细胞。复合混合物的非限制性实例包括细胞和/或组织提取物。例如,来自鼠胚胎干细胞的提取物表现出促使转化的293T细胞系的部分重编程,用链球菌溶血素使所述293T细胞系透化以在细胞膜中产生大孔。虽然该方法明显不能被细胞很好地耐受,但是其允许将分子扩散进细胞。本发明人假设,将鼠胚胎干细胞或人多能性干细胞的细胞提取物或核提取物有效转导进体细胞(如皮肤成纤维细胞),将允许这些细胞有效且完全的重编进多能性干细胞。同样地,其他细胞类型或组织的提取物,可赋予被转导的细胞类型具有那些细胞或组织的特性(identity)或功能属性。因此,本发明提供将细胞(如体细胞)重编程为多能细胞(即iPS细胞)的方法。这也是用于鉴定介导细胞命运或功能的新通路或转录因子的重要工具。因此,在某些实施方案中,提供用于鉴定介导细胞命运或功能的新通路或转录因子的方法,其中,所述方法包括:使用本文所描述的转导方法,将细胞和/或组织提取物转导进细胞。
在某些实施方案中,所述目标分子为大分子。
在某些实施方案中,所述目标分子为蛋白。蛋白的的非限制性实例包括单克隆抗体、细胞因子、组织生长因子和治疗蛋白。在某些实施方案中,所述目标分子为生物药物(也被称为生物制品)。在某些实施方案中,所述蛋白为酶。例如,所述酶可为靶向并修饰核酸的酶,如限制性酶、核酸内切酶、Cre重组酶或翻转酶。在某些实施方案中,所述核酸内切酶为修饰的核酸内切酶,如TAL效应因子核酸酶(TALEN)(Boch,J"TALEs of genometargeting".Nature Biotechnology29(2):135–6,2011)。这样的核酸内切酶可被用来修饰细胞中的核酸。例如,它们可被设计来靶向具体的DNA序列以导入突变或缺失以用于基因沉默或激活(例如通过外显子跳跃)。发明人展示了,可将TALEN转导进细胞,并且它们可引入基因突变,包括插入和缺失。此外,TALE-DNA结合结构域可被耦合至其他效应因子结构域,如DNA甲基转移酶结构域(其使DNA中具体位点处的胞嘧啶残基甲基化)、组蛋白修饰结构域(如甲基转移酶或酰基转移酶结构域,其修饰TALE靶位点周围的组蛋白),或者其他蛋白效应因子结构域。β-内酰胺酶为可通过本文所描述的缓冲液和方法被转导的酶的又一实例。因此,在某些实施方案中,所述目标分子为β-内酰胺酶。在某些实施方案中,所述蛋白为转录因子。将转录因子转导进细胞可被用来促使基因表达和改变(rewire)细胞命运、表型或特性。例如,OCT2、OCT3、OCT4、SOX2、KLF4、C-MYC、N-MYC、NANOG、ESRRB和LIN28均被用于产生诱导的多能性干(iPS)细胞。通常,通过病毒载体将它们转导进细胞。然而,本发明的转导方法可代替该方法。因此,在某些实施方案中,用于转导的目标分子为细胞周期和/或细胞特性的调控、限定或变化相关的转录因子。在其他实施方案中,所述转录因子为干细胞的维持或分化相关的转录因子。例如,在某些实施方案中,所述转录因子选自:OCT2、OCT3、OCT4、SOX2、KLF4、C-MYC、N-MYC、NANOG、ESRRB和LIN28。
许多转录因子还与某些疾病和病症相关(参见表A)。
表A:
通过导入来替换错误的(errant)转录因子对治疗或研究目的有益。因此,在某些实施方案中,所述转录因子为与疾病或病症相关的转录因子。在某些实施方案中,所述疾病或病症选自:癌症、代谢性疾病、心血管疾病、神经退行性疾病、自身免疫性疾病。在某些实施方案中,所述疾病或病症为遗传性疾病。例如,在某些实施方案中,所述转录因子选自:MECP2、HNFs、IPF1/Pdx1、FOXP2、FOXP3、p53、STAT和HOX。在某些实施方案中,将两种或更多种(例如2,3,4,5,6,7或更多种)转录因子包含在本发明的转导缓冲液或方法中,例如有以下组成的名单中转录因子的2、3、4、5、6、7种或全部:MECP2、HNF、IPF1/Pdx1、FOXP2、FOXP3、p53、STAT和HOX。
在某些实施方案中,当目标分子是蛋白时,其为可修饰核酸的蛋白,例如为基因编辑系统的一部分。可修饰核酸的蛋白通常具有核酸酶活性,例如核酸内切酶或核酸外切酶活性。因此,在某些实施方案中,所述目标分子具有核酸酶活性或者其为核酸酶。核酸酶活性可存在于蛋白的野生型中或者例如可通过重组方法将其加入以生成融合蛋白。因此,在某些实施方案中,所述目标分子为融合蛋白,例如具有核酸酶活性的融合蛋白,例如与具有核酸酶活性的结构域融合的转录因子。在某些实施方案中,所述目标分子为基因编辑系统,或作为基因编辑系统的一部分。在某些实施方案中,基因编辑系统包含如上所讨论的可修饰核酸的蛋白,并且任选地包含其他分子如向导分子。在某些实施方案中,所述基因编辑系统包含靶向具体序列的蛋白(如锌指核酸酶(ZFN)或TALEN)或由其组成。在某些实施方案中,所述基因编辑系统包含通过(单独的)向导分子被引导至其靶序列的蛋白。被引导至其靶序列的这样蛋白的实例包括但不限于:Cas9核酸酶、来自级联系统的蛋白、TtAgo蛋白和其他Argonaute蛋白,以及其他FOKI-核酸酶相关蛋白。
在某些实施方案中,所述向导分子为向导核酸,如sgRNA或gDNA。可通过本领域已知的方法设计靶向靶核酸中的具体序列的向导核酸,如sgRNA或gDNA(参见例如,针对sgRNA的Mali,P.,et al.,RNA-guided human genome engineering via Cas9.Science,2013.339(6121):p.823-6;和针对gDNA的Swarts,D.et al,DNA-guided DNA interferenceby a Prokaryotic Argonaute.Nature,2014.507,258-261)。因此,在某些实施方案中,所述目标分子为向导核酸,例如sgRNA或gDNA(参见与核酸有关的下文的进一步评论)。适合用于本发明的小向导RNA的实例包括:图19所示的sgRNA#1、sgRNA#2、sgRNA#3、sgRNA#4、sgRNA#5、sgRNA#6或sgRNA#7。下列小向导RNA显示出导致特别有效的基因编辑:sgRNA#2、sgRNA#3、sgRNA#5、sgRNA#6和sgRNA#7(参见图19B)。
在某些实施方案中,所述蛋白为信号转导分子。在某些实施方案中,所述蛋白激活或抑制具体的信号转导通路或信号转导通路网。例如,在某些实施方案中,所述蛋白激活或抑制生长因子诱导的信号转导通路、细胞因子信号转导通路或激素诱导的信号转导通路。在某些实施方案中,所述蛋白激活或抑制选自以下的信号转导通路:Wnt、Hedgehog、BMP、SMAD、Hippo、Notch、JAK/STAT、NF-kB、cAMP、PLC,或本领域已知的其他信号转导通路(例如参见Cell Signalling Biology,Michael J.Berridge,Module 2,Cell SignallingPathways,Portland Press Limited 2012)。
在某些实施方案中,所述目标分子为抗体。通常,抗体为细胞外分子。因此,当发现抗体与细胞内其靶向毁坏的靶标相关时,所述靶标与它们结合的任何靶分子一起被靶向毁坏。因此,本发明人假设,通过将抗体靶向至细胞内靶标,并且使用本发明的转导缓冲液和方法将它们转导进细胞,所述细胞内靶标可被特异性靶向毁坏。靶向细胞内靶标的抗体有时被称为“胞内抗体”。抗癌抗体的内在化,可通过阻止肿瘤特异性蛋白-蛋白相互作用来支持癌症治疗(Bitler,B.G.and Schroeder,J.A.Recent Patents on Anti-Cancer DrugDiscovery,5:99-108,2010)。
在某些实施方案中,所述目标蛋白为小于10、小于20、小于40、小于70、小于100、小于150、小于200、小于300、小于750、小于1000、小于1500、小于2000、小于5000、小于10,000个氨基酸长度。在其他实施方案中,所述目标蛋白为5或更多、10或更多、20或更多、40或更多、70或更多、100或更多、150或更多、200或更多、300或更多、750或更多、1000或更多、2000或更多、5000或更多个氨基酸长度。在某些实施方案中,所述目标蛋白可为选自任何上述值的任何长度范围。在某些实施方案中,所述蛋白为10-5000、12-1800、30-1200、35-800、40-500、5-200、5-50、5-30、5-20、5-12、2-50、2-30、2-20或2-12个氨基酸长度。
在本发明的一个优选实施方案中,所述转导化合物、缓冲液或方法适合于将蛋白转导进细胞。在又一优选实施方案中,所述转导化合物、缓冲液或方法适合于将蛋白和核酸同时地、依次地或分别地转导进细胞。
在目标分子为核酸的实施方案中,所述核酸为DNA、cDNA、RNA、miRNA、siRNA或其任意修饰型。在某个实施方案中,所述核酸为寡核苷酸或多核苷酸。在某些实施方案中,所述核酸为反义寡核苷酸。在某些实施方案中,所述核酸为二维或三维的核酸结构,如DNA笼(例如用于药物递送)。针对被转导进的细胞,DNA可为合成的、重组的、外来的或天然的。在某些实施方案中,所述DNA为质粒DNA。质粒DNA通常通过胞吞作用被吸收。然而,发明人意外发现,使用转导缓冲液,它们可将核酸吸收的机制从主要通过胞吞作用改变为主要通过巨胞饮。这意味着:可将用于重组和修饰的核酸和靶向核酸的酶,同时地转导进细胞,以用于遗传修饰和基因治疗。在某些实施方案中,所述核酸与细胞的目标序列具有同源区,例如以允许同源重组。在某些实施方案中,所述核酸为例如与CRISPR/Cas9基因编辑系统或其他基因编辑系统一起使用的小向导RNA(sgRNA),或者例如与TtAgo基因编辑系统或其他基因编辑系统一起使用的小向导DNA(gDNA)。在某些实施方案中,所述目标分子不是核酸。
在某些实施方案中,所述目标核酸为小于10、小于20、小于40、小于70、小于100、小于150、小于200、小于300、小于750、小于1000、小于1500、小于2000、小于5000、小于10,000个核苷酸、小于15,000个核苷酸、小于20,000个核苷酸、小于50,000个核苷酸、小于100,000个核苷酸、小于200,000个核苷酸、小于250,000个核苷酸(或者等量碱基)长度。在其他实施方案中,所述目标核酸为1或更多、5或更多、10或更多、20或更多、40或更多、70或更多、100或更多、150或更多、200或更多、300或更多、750或更多、1000或更多、2000或更多、5000或更多、10,000或更多、20,000或更多、50,000或更多、100,000或更多、200,000或更多、250,000或更多个核苷酸(或者等量碱基)长度。在某些实施方案中,所述目标核酸可为选自任何上述值的任何长度范围。在某些实施方案中,所述核酸具有10-10,000、10-5000、12-1800、30-1200、35-800、40-500、2-50、5-30、5-20,或者5-12个核苷酸(或者等量碱基)长度。在某些实施方案中,所述目标分子是染色体的整体或部分。
在某些实施方案中,所述目标分子为约30kDa至约500kDa,例如约30kDa至约200kDa。例如,在某些实施方案中,所述目标分子约30、约40、约50、约60、约70、约80、约90、约100、约110、约120、约130、约140、约150、约160、约170、约180、约190,或者约200kDa。发明人证明,使用本发明的缓冲液和方法,可将范围从约30kDa(例如Oct-4)至约140kDa(例如TALEN蛋白)的分子转导进细胞。在某些实施方案中,所述目标分子大于30、大于40、大于50、大于60、大于70、大于80、大于90、大于100、大于110、大于120、大于130、大于140、大于150、大于160、大于170、大于180、大于190,或者大于200kDa。当目标分子为蛋白或肽时,这些大小尤其可适用。当目标分子为核酸分子时,如寡核苷酸或多核苷酸,大小通常通过核苷酸的数目限定。在某些实施方案中,所述目标分子为小分子。小分子通常为低分子量(<800道尔顿)有机化合物,其可作为酶的底物或生物学过程的调控剂。
小分子的转导对药物递送是有益的。
在某些实施方案中,所述目标分子为大分子。
在某些实施方案中,所述目标分子具有净正电荷。在一个其他实施方案中,所述目标分子具有净负电荷。在某些实施方案中,所述目标分子为两性离子。在某些实施方案中,所述目标分子为极性的。在又一其他实施方案中,所述目标分子为非极性的。在某些实施方案中,所述目标分子主要是疏水的。在一个其他实施方案中,所述分子为亲水的。在一个其他实施方案中,所述分子是中性的。在某些实施方案中,所述目标分子在约pH 7下是可溶的。溶解度可通过转导缓冲液改善。
在某些实施方案中,所述转导缓冲液包含用于转导的目标分子。在其他实施方案中,所述转导缓冲液包含多于一种用于转导的目标分子,例如两种、三种、四种、五种或更多种目标分子。
可将本文所描述的目标分子的任何组合包含在转导缓冲液中,或者将其用于本文所公开的转导方法中。例如,在一个实施方案中,所述转导缓冲液包含核酸和蛋白,如核酸内切酶或Cre重组酶(例如用于所述核酸的遗传修饰),作为用于转导的目标分子。在某些实施方案中,所述转导缓冲液包含蛋白和多糖,作为用于转导的目标分子。在某些实施方案中,所述转导缓冲液包含核酸和脂质,作为用于转导的目标分子。在某些实施方案中,所述转导缓冲液包含核酸、蛋白和脂质,作为用于转导的目标分子。
在某些实施方案中,用于转导的方法涉及目标分子组合的下列非限制性实例:两种或更多种不同的蛋白(如TALEN对),两种或更多种核酸分子,核酸和蛋白(如DNA和蛋白),多糖(如右旋糖酐)和蛋白,核酸和脂类,蛋白和脂类,核酸、蛋白和脂类。核酸和蛋白对的具体实例包括,向导核酸和具有核酸酶活性的蛋白,例如sgDNA和Cas9,或者gDNA和TtAgo,在某些实施方案中,所述核酸和蛋白以核酸-蛋白复合体的形式呈现。
相同的原理应用于本发明的方法,即,可使细胞与两种、三种、四种、五种或更多种目标分子接触。例如,可将TALEN蛋白和核酸以及任选的脂质,同时地转导进细胞。
用于转导的目标分子的浓度取决于目标分子、细胞和转导目的。本领域技术人员可确定合适的浓度。在某些实施方案中,用于转导的目标分子以毫摩、微摩或纳摩浓度添加。在某些实施方案中,向转导缓冲液添加以下浓度的目标分子:约1nM至约1mM、约10nM至约500μM、约10nM至约100μM、约10nM至约50μM、约10nM至约10μM、约10nM至约1μM、约10nM至约500nM、约10nM至约100nM、约50nM至100nM、约100nM至约500nM、约100nM至约1μM、约100nM至约5μM、约100nM至约10μM、约100nM至约50μM,或者约100nM至约100μM。当所述目标分子为蛋白时,浓度可为约10nM至约1mM,例如10nM至100μM,或约100nM至约1μM。在某些实施方案中,所述目标分子的浓度为约1μM至约5μM,例如约1μM或约5μM。
在某些实施方案中,所述目标分子不被修饰。例如,在某些实施方案中,所述目标分子不与载体分子联合和/或不包含标签,其中所述标签促进转导进细胞。例如,在一个实施方案中,所述目标蛋白不被细胞穿透肽或TAT蛋白标记。在又一实例中,在一个实施方案中,核酸为裸核酸。意外地是,使用本发明方法,在没有修饰的情况下,可将任何目标分子转导进细胞。在某些实施方案中,所述目标分子不与转导化合物形成复合物。在某些实施方案中,所述目标分子不在胶团或脂质体中,或者不与其相关。在某些实施方案中,所述目标分子不与转导化合物形成复合物。在某些实施方案中,所述目标分子不在病毒载体中或者不与其相关。
本发明人展示了,本文所描述的方法和缓冲液可被用来将病毒转导进细胞(例如,参见实施例9)。因此,在某些实施方案中,本发明提供用于将病毒转导进细胞或细胞群的方法,其中所述方法包括:使细胞或细胞群与转导缓冲液接触,以及使所述细胞或细胞群与病毒接触。在一个实施方案中,本发明提供用于将病毒转导进细胞或细胞群的方法,其中所述方法包括:使细胞或细胞群与本发明的转导缓冲液接触,以及使所述细胞与病毒接触。在施用于细胞之前,可将转导缓冲液与病毒混合,或者可与病毒同时地、依次地或分别地施用。
此外,本发明人还观察到,在转导缓冲液的存在下,细胞群的收缩在细胞之间产生空间,并且使所述细胞更易接近。这可进一步提高向细胞转导病毒。因此,在某些实施方案中,将目标分子转导进细胞的方法涉及细胞尺寸的缩小,和/或细胞之间空间的增加。不希望受理论束缚,本发明人假设,收缩是由转导缓冲液中的盐引起的高渗透压的结果。然而,上文已经描述的巨胞饮机制依然很可能在提高将病毒转导进细胞中发挥重要作用。
用于转导的细胞
可使用转导方法来将目标分子转导进任何细胞,包括原代细胞或干细胞(包括其衍生物,如祖细胞)、正常健康的细胞或患病的细胞。
在一个优选实施方案中,转导方法中涉及的细胞为哺乳动物细胞。这是因为,据认为,所述转导缓冲液和方法尤其很好地适合于哺乳动物的巨胞饮系统(更多细节参见下文)。然而,还设想到,在某些实施方案中,所述方法可能有益于将分子转导进其他动物细胞、植物细胞、酵母细胞、昆虫细胞或者细菌细胞。因此,在某些实施方案中,所述细胞为动物细胞、植物细胞、酵母细胞、昆虫细胞或细菌细胞。在某些实施方案中,所述细胞不是细菌细胞。
在优选的实施方案中,哺乳动物细胞为人、灵长目动物、啮齿动物(例如小鼠或大鼠)、兔、狗、猫、马、牛或猪的细胞。这些哺乳动物有益于研究目的和/或可得益于包含本发明的转导缓冲液和方法的治疗或诊断。在某些实施方案中,所述细胞为非人细胞。
在某些实施方案中,所述细胞为体内的,任选原位细胞。例如,当治疗或诊断医学病况时,可联合缓冲液将目标分子直接或局部地施用于有需要的有机体或组织。
在一个可选的实施方案中,所述细胞为体外的。例如,所述细胞可在培养基中,其中培养基任选地支持所述细胞的维持、分化和/或扩增。
在某些实施方案中,所述细胞源自已建立的细胞系,如已建立的人细胞系。在某些实施方案中,已建立的细胞系为永生化细胞系。在其他实施方案中,所述细胞系为原代细胞系。几种现有技术的转导方法在原代细胞中不起作用(参见背景部分)。因此,意外的是,本发明的转导缓冲液和方法可被用来将分子转导进原代细胞。
适合在本发明环境中使用的已建立的人细胞系实例包括但不限于:HeLa、ESTDAB数据库、DU145(前列腺癌)、Lncap(前列腺癌)、MCF-7(乳腺癌)、MDA-MB-438(乳腺癌)、PC3(前列腺癌)、T47D(乳腺癌)、THP-1(急性髓细胞样白血病)、COS7(来自肾脏组织的永生化CV-1细胞)、U87(恶性胶质瘤)、SHSY5Y人成纤维细胞瘤细胞(克隆自骨髓瘤)、Saos-2细胞(骨癌)。ESTDAB数据库(www.ebi.ac.uk/ipd/estdab/directory.html)和国立癌症研究所(NCI-60)提供适用于本发明的癌症细胞系的其他实例。在某些实施方案中,已建立的细胞系为灵长目动物细胞系,如Vero(在1962年引进的非洲绿猴的绿猴属(Chlorocebus)肾脏上皮细胞系)。在某些实施方案中,已建立的细胞系为啮齿动物细胞系,如GH3(脑垂体肿瘤)、PC12(嗜铬细胞瘤)或MC3T3(胚胎颅盖)。适用于本文所公开的转导缓冲液和方法的其他哺乳动物的细胞系包括:Madin-Darby犬肾(MDCK)上皮细胞系、中国仓鼠卵巢(CHO)细胞系和Caco-2细胞。在某些实施方案中,所述细胞为KBM7细胞。
在某些实施方案中,所述细胞为原代细胞。原代细胞或细胞系源自从活的有机体直接取出的细胞,并且其还没有被永生化。换句话说,原代细胞或细胞系在基因和表型方面是稳定的。
在某些实施方案中,所述细胞为干细胞或由干细胞的分化得到的细胞。在某些实施方案中,所述干细胞为多能性干细胞,如胚胎干细胞,任选人胚胎干细胞。在某些实施方案中,所述细胞不是人胚胎干细胞。在某些实施方案中,所述干细胞不是通过涉及为了商业或工业目的使用人胚胎的方法获得。在某些实施方案中,所述干细胞不是通过必然涉及破坏人胚胎的方法获得。在某些实施方案中,所述干细胞为鼠胚胎干细胞。在其他实施方案中,所述干细胞为成体干细胞,如神经干细胞、脂肪干细胞或造血干细胞。在某些实施方案中,所述细胞为鼠或人的神经干细胞、神经元细胞或神经胶质细胞。在某些实施方案中,所述干细胞为诱导的多能性干细胞。在某些实施方案中,所述细胞为体细胞或生殖细胞。
在某些实施方案中,所述细胞为属于免疫系统的细胞,如T细胞、B细胞或白细胞,包括但不限于:吞噬细胞(巨噬细胞、嗜中性粒细胞或树突状细胞)、肥大细胞、嗜酸性粒细胞、嗜碱性粒细胞和自然杀伤细胞。在某些实施方案中,所述细胞为树突状细胞。
在某些实施方案中,在包含约4%至约10%CO
在所有实施方案中,当公开内容涉及“细胞”时,其指单个细胞,并且还适用于“细胞群”,例如2或更多、10或更多、100或更多、1000或更多、10
因此,本发明还提供使用本文所描述的转导缓冲液和/或方法获得或可获得的转导的细胞或细胞群。本发明提供包含目标分子的细胞或细胞群,其中已经使用本文所描述的转导缓冲液和/或方法将目标分子转导进细胞。
细胞生活力
在一个优选实施方案中,本发明的转导缓冲液和方法对细胞的生活力具有最小的影响。细胞生活力对转导的细胞的许多应用是重要的,所述应用包括但不限于:转导的细胞的移植;使用转导的细胞以产生遗传修饰的胚胎用于研究模型;以及在研究中使用转导的细胞等等(参见“本发明的用途”部分)。细胞生活力的一种测量是细胞的增殖(例如,实施例5中所描述的BrdU并入分析)。持续的细胞增殖表明正常的细胞周期依然运行。
测量增殖、生活力和细胞毒性的分析是本领域已知的,并且可商购(例如来自Sigma Aldrich)。这样的分析可被用来监测用各种刺激物处理后的培养细胞的应答和健康。分析方法的适当选择,取决于所用细胞的数目和类型以及所期望结果。细胞增殖的分析可监测一段时间内的细胞数、细胞分裂数、代谢活性或DNA合成。使用活力染料(如台盼蓝或钙黄绿素-AM)的细胞计数,可提供增殖的速率以及有活力细胞的百分比。5(6)-羧基二乙酸荧光素N-琥珀酰亚胺酯(CFSE)为用于测量群体经历的细胞分裂数目的常用选择。一旦进入细胞,CFSE就被细胞内酯酶裂解以形成荧光化合物,并且琥珀酰亚胺酯基团与细胞内蛋白上的伯胺共价地反应。一旦分裂,各个子代细胞的荧光强度被均分,其允许通过流式细胞术简单检测细胞分裂的数目。测量代谢活性的分析适合于分析增殖、生活力和细胞毒性。四唑盐(如MTT和XTT)还原为有色的甲瓒化合物或者刃天青的生物还原仅发生于有代谢活性的细胞中。尽管暴露于毒素的细胞将具有降低的活性,但是主动地增殖细胞增加了其代谢活性。
测量增殖的分析的实例为BrdU并入分析,其测量细胞增殖期间并入细胞DNA的BrdU。
在一个优选实施方案中,当对经历本发明的转导方法的细胞进行BrdU并入分析时,多于50%、多于55%、多于60%、多于65%、多于70%、多于75%、多于80%、多于85%、多于90%、多于95%、多于99%或所有细胞表现出BrdU并入了细胞的细胞DNA。
还可通过对细胞凋亡的标志物(例如膜联蛋白V、半胱天冬酶激活剂等等)进行染色,或者通过评估作为细胞死亡迹象的普罗匹定碘化物的吸收,来评估细胞的生活力。针对这类细胞凋亡标志物(例如膜联蛋白V、半胱天冬酶的激活),不染色为阳性或者不吸收普罗匹定碘化物的细胞为有活力的细胞。
在一个优选实施方案中,在一轮、两轮、三轮、四轮或五轮转导之后,如使用膜联蛋白V染色所评估,多于50%、多于55%、多于60%、多于65%、多于70%、多于75%、多于80%、多于85%、多于90%、多于95%、多于99%或所有细胞有生活力。
某些分子的转导可引发细胞中的细胞死亡通路。例如,将外来DNA/RNA导入细胞可引发导致细胞死亡的干扰素应答通路。在某些实施方案中,本发明的方法和/或转导缓冲液使用/包含细胞死亡的一种或多种抑制剂。细胞死亡抑制剂(如干扰素应答通路的抑制剂)可帮助预防细胞凋亡应答,并且因此改善细胞的存活。这样的抑制剂可在干扰素应答通路的数种水平下起作用,例如,它们可为干扰素与其受体进行胞外结合的抑制剂、细胞内干扰素信号转导的抑制剂、干扰素应答的下游效应子的抑制剂(例如RNaseL抑制剂、PKR抑制剂、Jak/STAT信号转导抑制剂、Mx抑制剂)。可使用的抑制剂其他类型包括,可改善对细胞中外来RNA/DNA的检测的蛋白或小分子化合物,如流感ANS1蛋白。还可使用抑制剂的组合。这样的抑制剂实例是本领域已知的。例如,本发明人使用干扰素抑制剂蛋白B18R(NatProtoc.2013Mar;8(3):568-82.doi:10.1038/nprot.2013.019.Epub 2013Feb21.Reprogramming human fibroblasts to pluripotency using modified mRNA.MandalPK1,Rossi DJ;和Cell.1995May 19;81(4):551-60.Vaccinia virus encodes a solubletype I interferon receptor of novel structure and broad speciesspecificity.Symons JA1,AlcamíA,Smith GL)。因此,在某些实施方案中,所述转导缓冲液还包含细胞死亡的一种或多种抑制剂,优选干扰素应答通路的抑制剂。在某些实施方案中,在转导之前、期间和/或之后添加抑制剂。在某些实施方案中,所述抑制剂以约10ng/ml至约1000ng/ml、约100ng/m至约500ng/ml、约200ng/ml至约400ng/ml、约200ng/ml至约300ng/ml,或约250ng/ml的浓度使用。在某些实施方案中,所述抑制剂为B18R,在转导之前(例如3小时前)、转导期间和转导之后(例如48小时后),其优选以约250ng/ml的浓度使用。当将核酸分子转导进细胞(例如,在基因编辑系统环境中,将小抑制RNA(siRNA)或小向导核酸分子如sgRNA或gDNA与核酸酶如Cas9转导进细胞)时,这样的抑制剂特别有用,但是可能有益于所有类型的目标分子,特别是具体地经干扰素应答通路可激活细胞死亡通路的目标分子。他们与本文所描述的所有转导缓冲液和方案兼容。
用于转导的效率/时间
为了将目标分子转导进细胞,使目标分子和细胞接触足够长的时间,以将分子转导进细胞。
通常,吸收进细胞的量与所述细胞与转导缓冲液和目标分子接触的时间量有关。在本文这被称为“孵育时间”或“转导时间”。
在一个优选实施方案中,所述孵育时间为约1至约24小时,例如约2至约12小时,或者约2至约5小时。在某些实施方案中,所述孵育时间为至少30分钟、至少1小时、至少2小时、至少3小时、至少4小时、至少5小时、至少6小时、至少7小时、至少8小时、至少9小时、至少10小时、至少11小时、至少12小时、至少13小时,或多于13小时。在某些实施方案中,所述孵育时间为少于48小时、少于24小时、少于20小时、少于15小时、少于13小时、少于12小时、少于11小时、少于10小时、少于9小时、少于8小时、少于7小时、少于6小时、少于5小时、少于4小时、少于3小时、少于2小时,或少于1小时。在某些实施方案中,所述转导时间为3小时。在某些实施方案中,所述转导时间为12小时。在某些实施方案中,所述孵育时间为约30分钟至约1小时。在某些实施方案中,所述孵育时间为约1分钟至约30分钟、约30分钟至约60分钟、约30分钟至约90分钟、约60分钟至约90分钟,或少于约90分钟,或少于约60分钟。
转导的速率将取决于细胞类型(和转导机制的功效)以及待转导的目标分子(其大小、电荷、疏水性等)。本发明人还表明,所述转导缓冲液的重量克分子渗透浓度越高,转导的速率越大。因此,在较高的重量克分子渗透浓度下,转导的速率通常较高,并且所需的孵育时间较短。相反地,在较低的重量克分子渗透浓度下,转导的速率较低,并且实现相等的转导水平所需的孵育时间较长。
然而,如本公开别处所提到的,高渗透压可负面地影响细胞生活力,并且因此,孵育时间必须与重量克分子渗透浓度和细胞生活力达成平衡。通过添加渗透保护剂来保护细胞生活力,并且因此可使用较高的重量克分子渗透浓度和较短的孵育时间。通过使用试错法和优化测试,本领域技术人员可测定最佳的重量克分子渗透浓度、孵育时间和渗透保护剂的浓度(例如,参见图3)。例如,在某些实施方案中,在MEF细胞中,使用650至800mOsm/kg的重量克分子渗透浓度,并且在转导缓冲液包含甘油和甘氨酸,用于β-内酰胺酶转导的孵育时间可为3小时。在一个可选的实施方案中,在MEF细胞中,使用仅450至650mOsm/kg的重量克分子渗透浓度(即,较低的重量克分子渗透浓度)并且包含甘油和甘氨酸,最佳转导所需的孵育时间可能更长,例如更接近12小时。同样地,在某些实施方案中,在mES细胞中,使用450至600mOsm/kg的重量克分子渗透浓度并且在转导缓冲液中包含甘油和甘氨酸,用于β-内酰胺酶的最佳转导的孵育时间可为约12小时。
可使用本领域已知且可商购的报告基因构建体(例如荧光素酶或GFP报告基因构建体)定性或定量地检测转导,其中荧光的水平对应于表达的水平(更多细节参见实施例部分)。
在某些实施方案中,所述方法包括一轮的转导。然而,在其他实施方案中,多轮的转导可能是令人满意的。例如,在某些实施方案中,对相同的细胞进行2、3、4、5、6、7、8、9、10或更多轮的转导。每轮的转导可涉及相同的目标分子或不同的目标分子的转导。
在每轮转导期间,可存在至少1、至少2、至少3、至少4、至少5、至少6、至少7、至少8、至少9、至少10、至少11或至少12小时的“恢复期”。在某些实施方案中,恢复期为至少10、至少20、至少30、至少40或至少50分钟。
在某些实施方案中,不存在恢复期,或者存在少于24小时、少于12小时、少于6小时、少于3小时、少于1小时、少于30分钟,或少于10分钟的恢复期。
恢复期期间,将转导缓冲液从细胞移出,并且通常在适合于具体细胞类型的细胞培养基中培养所述细胞。
示例性转导缓冲液和方法
下文提供了转导缓冲液和方法的非限制性实例。应理解的是,本文所描述的兼容实施方案的任意组合,可被用于转导缓冲液或包括转导缓冲液的转导方法。兼容实施方案的某些实例在下文提供。
在某些实施方案中,提供将目标分子转导进细胞的方法,其中所述方法包括:使所述细胞与目标分子接触,并且使所述细胞与包含盐(其结合和/或激活钠/氢运载蛋白)、转导化合物以及任选地包含甘氨酸和/或甘油作为渗透保护剂的转导缓冲液接触,其中,所述转导化合物为小分子化合物。在某些实施方案中,所述转导化合物为小分子化合物并且不为去污剂。在某些实施方案中,所述转导化合物为小分子化合物并且不为去污剂,并且为两性离子或具有针对带负电荷官能团的生物等排体基团的非两性离子化合物。在某些实施方案中,所述转导化合物为小分子化合物并且不为去污剂,并且为两性离子。在某些实施方案中,所述转导化合物为小分子化合物,并且为两性离子或具有针对带负电荷官能团的生物等排体基团的非两性离子化合物。
在某些实施方案中,提供将目标分子转导进细胞的方法,其中所述方法包括:使所述细胞与目标分子接触,并且使所述细胞与包含盐(其结合和/或激活钠/氢运载蛋白)、选自表1的转导化合物以及任选地包含甘氨酸和/或甘油作为渗透保护剂的转导缓冲液接触。
在某些实施方案中,提供将目标分子转导进细胞的方法,其中所述方法包括:使所述细胞与目标分子接触,并且使所述细胞与包含盐、选自表1的转导化合物以及任选地包含甘氨酸和/或甘油作为渗透保护剂的转导缓冲液接触,其中所述盐为钠、锂、钾、铯或铷的氯化物或葡糖酸盐。
在某些实施方案中,提供将目标分子转导进细胞的方法,其中所述方法包括:使所述细胞与目标分子接触,并且使所述细胞与包含氯化钠、选自表1的转导化合物以及任选地包含甘氨酸和/或甘油作为渗透保护剂的转导缓冲液接触。
在某些实施方案中,提供将目标分子转导进细胞的方法,其中所述方法包括:使所述细胞与目标分子接触,并且使所述细胞与包含氯化铷、选自表1的转导化合物以及任选地包含甘氨酸和/或甘油作为渗透保护剂的转导缓冲液接触。
在某些实施方案中,提供将目标分子转导进细胞的方法,其中所述方法包括:使所述细胞与目标分子接触,并且使所述细胞与包含盐(其结合和/或激活钠/氢运载蛋白)、式I或式II的转导化合物以及任选地包含甘氨酸和/或甘油作为渗透保护剂的转导缓冲液接触。
在某些实施方案中,提供将目标分子转导进细胞的方法,其中所述方法包括:使所述细胞与目标分子接触,并且使所述细胞与包含盐、式I或式II的转导化合物以及任选地包含甘氨酸和/或甘油作为渗透保护剂的转导缓冲液接触,其中所述盐为钠、锂、钾、铯或铷的氯化物或葡糖酸盐。
在某些实施方案中,提供将目标分子转导进细胞的方法,其中所述方法包括使所述细胞与目标分子接触,并且使所述细胞与包含氯化钠、式I或式II的转导化合物以及任选地包含甘氨酸和/或甘油作为渗透保护剂的转导缓冲液接触。
在某些实施方案中,提供将目标分子转导进细胞的方法,其中所述方法包括使所述细胞与目标分子接触,并且使所述细胞与包含盐(其结合和/或激活钠/氢运载蛋白)、作为转导化合物的GABA以及任选地包含甘氨酸和/或甘油作为渗透保护剂的转导缓冲液接触。
在某些实施方案中,提供将目标分子转导进细胞的方法,其中所述方法包括使所述细胞与目标分子接触,并且使所述细胞与包含盐、作为转导化合物的GABA以及任选地包含甘氨酸和/或甘油作为渗透保护剂的转导缓冲液接触,其中所述盐为钠、锂、钾、铯或铷的氯化物或葡糖酸盐。
在某些实施方案中,提供将目标分子转导进细胞的方法,其中所述方法包括使所述细胞与目标分子接触,并且使所述细胞与包含氯化钠、作为转导化合物的GABA以及任选地包含甘氨酸和/或甘油作为渗透保护剂的转导缓冲液接触。
在某些实施方案中,所述转导缓冲液的重量克分子渗透浓度为至少250mOsm/kg、至少300mOsm/kg,或至少700mOsm/kg。在某些实施方案中,所述转导缓冲液的重量克分子渗透浓度为至少400mOsm/kg。在某些实施方案中,所述转导缓冲液的重量克分子渗透浓度为至少1000mOsm/kg。在某些实施方案中,所述转导方法涉及诱导穿过细胞膜的渗透压的步骤。在某些实施方案中,所述转导缓冲液相对于转导之前维持细胞的培养基和/相对于细胞胞质溶胶是高张的。
在某些实施方案中,所述转导方法涉及巨胞饮的激活和/或核内体裂解的激活。在某些实施方案中,所述转导方法(总体上)具有20%或更高、30%或更高、40%或更高、50%或更高、60%或更高、70%或更高、80%或更高、90%或更高、100%或更高、110%或更高、120%或更高、150%或更高、200%或更高、300%或更高、400%或更高、500%或更高、600%或更高、700%或更高,或者800%或更高的转导效率,例如其中涉及表1中所示的化合物#1的所述方法为对照(即代表100%的转导效率)。
在一个优选实施方案中,转导之后,如使用膜联蛋白V染色所评估,多于75%的细胞有活力。
在某些实施方案中,所述转导缓冲液还包含GABA激动剂、生长因子、Tat-HA2融合肽和钠/氢运载蛋白增强剂中的一种或多种。
在某些实施方案中,所述方法包括在转导之前获得细胞和/或将细胞维持在培养基中的步骤。在某些实施方案中,所述方法还包含转导期间使细胞与优选不存在抗生素的培养基接触。
在某些实施方案中,所述转导缓冲液包含能透过细胞的抗生素,如强力霉素或四环素。
在某些实施方案中,所述转导缓冲液还包含粘度增强剂、生长因子、细胞因子、神经递质或其激动剂(如GABA激动剂)中的一种或多种(例如1、2、3、4或5种)。
在某些实施方案中,所述方法包括使所述细胞与所述转导缓冲液接触至少30分钟,优选约12小时。在某些实施方案中,所述方法涉及至少两轮的转导,即所述细胞被所述转导缓冲液和目标分子接触至少两次持续至少30分钟,之间具有恢复期。
在某些实施方案中,所述细胞为原代细胞。
在一个实施方案中,所述转导缓冲液包含氯化钠、选自表1的转导化合物和甘氨酸和/或甘油。选自表1的化合物的浓度为,约5至约50mM。甘氨酸的浓度为约15mM。甘油的浓度为约30mM。可添加氯化钠以调节重量克分子渗透浓度至大约700mOsm/Kg。可使用水或培养基(如DMEM培养基)补足最终体积。根据分子类型,用于转导的目标分子以合适的浓度添加。在一个非限制性实例中,所述目标分子的浓度可为,约10nM至约100μM。在某些实施方案中,所述转导缓冲液还包含Tat-HA2融合肽,其浓度可为约5μM。在某些实施方案中,所述缓冲液还包含GABA激动剂。在某些实施方案中,所述转导缓冲液还包含这些信号转导通路的一种或多种生长因子和/或细胞因子和/或神经递质和/或小分子激动剂。
在另一实施方案中,所述转导缓冲液包含氯化钠、选自表1的转导化合物以及甘氨酸和/或甘油。选自表1的化合物的浓度为,约50至约500mM。甘氨酸的浓度为约300mM。甘油的浓度为约150mM。可添加氯化钠以调节重量克分子渗透浓度至大约1000mOsm/Kg。可使用水或培养基(如DMEM培养基)补足最终体积。根据分子类型,以合适的浓度添加用于转导的目标分子。在一个非限制性实例中,所述目标分子的浓度可为,约10nM至约100μM。在某些实施方案中,所述转导缓冲液还包含Tat-HA2融合肽,其浓度可为约5μM。在某些实施方案中,所述缓冲液还包含GABA激动剂。在某些实施方案中,所述转导缓冲液还包含这些信号转导通路的一种或多种生长因子和/或细胞因子和/或神经递质和/或小分子激动剂。
在某些实施方案中,所述转导化合物为NDCB或NDSB,如NDSB-201或选自表1中所示的化合物#42、#1、#45、#43、#44、#15、#10、#11、#28、#37和#46的化合物。
在某些实施方案中,所述转导方法包括使mESC、iPSC、人iPSC源的神经胶质细胞或神经元与所述目标分子接触。在某些实施方案中,所述目标分子为浓度约1nM至约100μM,例如约1μM或约5μM的蛋白。在某些实施方案中,所述目标蛋白为CRE。所述转导缓冲液可包含盐和转导化合物,并且任选地还包含5μM Tat-HA2融合肽和任选地渗透保护剂。在又一实施方案中,所述方法涉及两轮连续的转导,其中,在每轮的转导中,使所述细胞与所述目标蛋白(如CRE)接触12小时,每轮转导之间具有12小时的恢复期。
使用下列方案(实施例中的“转导方案”),可转导小鼠胚胎干(mES)细胞:将每孔75,000个mES细胞接种到使用mES培养基的明胶包被板上;第二天,将5x转导缓冲液中的目标分子(例如蛋白,如Cre蛋白)用mES培养基稀释(例如以1:5);然后向细胞添加完全的混合物;约12小时后,该转导培养基被mES培养基代替。
使用下列方案(实施例中的“转导方案”),可转导小鼠神经干细胞:将神经球接种于神经元干细胞培养基中;其次,向细胞添加5x转导缓冲液中的目标分子(例如20μl蛋白,如CRE),并且小心地混合;约12小时后,转导培养基被新鲜神经干细胞培养基代替。
使用下列方案(实施例中的“转导方案12/500”),可转导人iPS细胞。例如按照mTeSR1或TeSR-E8制造商的说明书,通过机械分离,将细胞传代为小簇,并且将其接种在基质胶包被板上以达到约50%汇合。第二天,将5x转导缓冲液中的目标分子(例如蛋白,如CRE蛋白)用mTeSR1或TeSR-E8稀释(例如1:5)。然后向细胞添加完全的混合物。12小时的转导后,培养基被新鲜mTeSR1或TeSR-E8培养基代替,并且可将细胞培养24-48小时。
在某些实施方案中,所述转导缓冲液被用来将DNA和脂类转导进细胞(例如,参见实施例7和图11)。在某些实施方案中,所述转导缓冲液包含质粒DNA和脂类。例如,所述转导缓冲液包含100ng质粒DNA、0.8μl脂质体LTX脂类试剂、0.1μl plus试剂(LifeTechnologies)和20μl 5x转导缓冲液。最终的转导缓冲液包含100μl mESC培养基和白血病抑制因子(LIF)。LIF被用于ES细胞的环境中以维持干细胞的状态。
在某些实施方案中,所述转导缓冲液被用来将DNA和蛋白转导进细胞(例如,参见实施例8和图12)。例如,在某些实施方案中,所述转导缓冲液包含100ng质粒DNA、0.8μl脂质体LTX脂类、0.1μl plus试剂(Life Technologies)和20μl 5x转导缓冲液中的CRE蛋白。最终的转导缓冲液包含100μl mESC培养基和LIF。
在某些实施方案中,所述转导缓冲液促进将病毒并入细胞,如人iPS细胞(例如,参见实施例9和图13)。例如,在某些实施方案中,所述转导缓冲液还包含浓缩的病毒原液、聚凝胺和人iPSC培养基。
在某些实施方案中,所述转导的方法适合于转导具有低溶解性的蛋白(参见实施例10)。在某些实施方案中,适合于转导低溶解性蛋白的转导缓冲液具有约1000mOsm/kg的重量克分子渗透浓度,且包含浓度约250mM的转导化合物,以及包含浓度约150-300mM的渗透保护剂。
在某些实施方案中,所述转导缓冲液包含500mM NaCl、250mM NDSB-201、300mM甘氨酸、在D-MEM N2/B27中的150mM甘油和LIF。这是“2/1000”转导缓冲液。其适合于转导具有低溶解性的蛋白。
在一个实施方案中,提供用于转导mES细胞的方法。用于转导mES细胞的方法包括:向5x转导缓冲液12/500中20μl的CRE蛋白(或其他目标分子)添加80μl 2/1000转导缓冲液。将细胞孵育2小时。孵育后,用mESC培养基代替转导缓冲液。
在某些实施方案中,可用TALEN蛋白转导人iPS细胞(例如,参见实施例11)。在某些实施方案中,将人iPS细胞与约2μM TALEN蛋白孵育约12小时。例如,将约20μl 5x转导缓冲液中的TALEN蛋白与约80μl人iPS细胞培养基混合。
在某些实施方案中,所述转导缓冲液可被用于将蛋白和大分子同时转导进细胞(例如,参见实施例12)。例如,在一个实施方案中,提供用于将右旋糖酐和BSA转导进MEF的方法。所述方法包括:将所述细胞与5μg/ml右旋糖酐和1x转导培养基中的1μg BSA孵育(方案3/700)30分钟。随后,用1x转导缓冲液将细胞洗涤两次。
在某些实施方案中,所述转导缓冲液和方法可被用于将能够修饰核酸的蛋白或基因编辑系统的蛋白转导进细胞。在某些实施方案中,提供用于将能够修饰核酸的蛋白或基因编辑系统(如Cas9核酸酶和sgRNA)转导进细胞的方法,其中所述方法包括:将所述细胞与约250mM转导化合物(例如化合物#20)在约1250mOsmol/kg的重量克分子渗透浓度下孵育约60分钟。在某些实施方案中,可使用两轮连续的转导。在一个优选实施方案中,在转导前(例如转导前约3小时)和/或转导期间和/或转导之后(例如转导后约48小时),将所述细胞与约250ng/ml B18R蛋白孵育。在某些实施方案中,甘氨酸(例如15mM)和/或甘油(例如30mM)被包含作为渗透保护剂。本领域技术人员理解,或者可使用其他合适的方案,其落在本发明的范围内。
本发明还提供用于修饰细胞中核酸(如遗传序列)的方法,其中所述方法包括:使所述细胞与能够修饰核酸的蛋白和转导缓冲液接触,其中所述转导缓冲液包含(i)转导化合物,(ii)盐或钠氢运载蛋白的激活剂/增强剂,以及优选地包含(iii)渗透保护剂。在某些实施方案中,所述能够修饰核酸的蛋白靶向具体靶序列,例如其中所述蛋白为锌指核酸酶或TALEN、Cas9、Cas9类似物、靶向DNA的FokI核酸酶相关蛋白、级联复合体、TtAgo蛋白或其他Argonaute蛋白或它们的衍生物。在某些实施方案中,使细胞与向导分子进一步接触以引导蛋白至靶遗传序列。在某些实施方案中,将重量克分子渗透浓度调节至约1000mOsm/kg至约1500mOsm/kg,优选约1250mOsm/kg。在某些实施方案中,所述转导化合物以约200nM至约400nM,优选约250mM的浓度使用。在某些实施方案中,所述转导进行约1小时至约24小时,或者约1小时至约12小时。在某些实施方案中,所述转导缓冲液还包含干扰素应答通路的抑制剂,例如B18R。在某些实施方案中,所述细胞为干细胞,如iPS细胞或干细胞系,其包括例如人干细胞系。在某些实施方案中,所述渗透保护剂选自:甘氨酸、甘油、牛磺酸、甘氨酸甜菜碱、肌醇、谷氨酰胺、谷氨酸、精氨酸、甘露糖醇和海藻糖。
在某些实施方案中,在修饰细胞中核酸(如遗传序列)的方法中,能够修饰核酸的蛋白在细胞中存在少于10天、少于5天、少于4天、少于3天、少于2天、少于1天、少于12小时、少于6小时或少于1小时。如果能够修饰核酸的蛋白在细胞中存在时间太长,那么其开始具有有害的脱靶效果(即,修饰非靶序列)。这是常规转染形式的常见问题,其涉及从表达质粒表达蛋白许多天。
在某些实施方案中,修饰细胞中核酸(如遗传序列)的方法还包括分离或使用修饰的细胞。本发明还提供通过这些方法可获得的或获得的修饰细胞。在某些实施方案中,所述修饰的细胞包含转导的基因编辑系统。在某些实施方案中,所述修饰的细胞不包含病毒载体。在某些实施方案中,修饰的细胞不包含纳米颗粒载体。在某些实施方案中,细胞不包含细胞穿透肽。
药物组合物
在某些实施方案中,本发明提供包含本发明的转导缓冲液和用于转导的目标分子的药物组合物。在某些实施方案中,本发明提供包含转导缓冲液的药物组合物。在某些实施方案中,所述目标分子和转导缓冲液组分被同时或连续地施用。
药物组合物可包括除转导缓冲液和目标分子以外的其他组分。例如,药物组合物通常包含药学上可接受的载体,其可为本身不诱导产生对接受所述组合物的患者有害的抗体的任何物质,并且可将其施用而没有过度的毒性。合适的药学上可接受的载体是本领域熟知的。药学上可接受的载体可例如,包括诸如水、盐、甘油和乙醇的液体。助剂物质(如润湿剂或乳化剂、pH缓冲物质等等)也可存在于药物组合物中(参见Gennaro(2000)Remington:The Science and Practice of Pharmacy.20th edition,ISBN:0683306472)。
在某些实施方案中,提供包含转导化合物或转导化合物和能够修饰核酸的蛋白(如基因编辑系统)的药物组合物。
药物组合物可为无菌的和/或无热原的。
本发明还提供预装有本发明的药物组合物的容器(例如小瓶)或递送装置(例如注射器)。本发明还提供用于提供这样的容器或装置的过程,包括将本发明的组合物导入容器或装置。
根据被治疗个体的健康和身体状况、年龄、被治疗个体的分类组(例如人类、非人灵长目动物、灵长目动物等)、预期转导的程度、药物组合物的配方、治疗医生对医学情形的评估以及其他相关因子,合适的剂量可变化。所述剂量可落在相对宽的范围中,其可通过常规测试确定。
本发明的组合物可以各种液体形式制备。例如,所述组合物可被制备为注射剂(溶液或悬浮液)。用于局部皮肤下或肌肉内施用的注射剂是典型的。注射可经针头(例如皮下针)进行,但可选地可使用无针注射。
组合物可包含抗菌剂。抗菌剂(如硫柳汞和2-苯氧基乙醇)通常存在于药物组合物中,但是,优选使用无汞的防腐剂或完全没有防腐剂。
组合物可包含去污剂,例如吐温(聚山梨醇酯),如吐温80。去污剂通常以低水平(例如<0.01%)存在。在某些实施方案中,所述缓冲液不包含去污剂。在某些实施方案中,用于转导的方法不涉及在转导期间使用去污剂。
可常规地确定有效剂量体积,其取决于组合物的目的。例如,对于肌肉内注射(例如局部注射进目标肌肉或组织),通常人的组合物剂量可为例如约0.5ml。类似剂量可用于其他递送途径。
本发明还提供包含本发明的转导缓冲液或本发明的药物组合物的试剂盒。所述试剂盒还可包含细胞和/或用于转导的目标分子。所述试剂盒还可包含供使用的说明书。所述试剂盒可包含一个或多个分开容器(例如1、2、3、4、5、6或更多个分开容器)中的转导缓冲液的不同组分。例如,所述试剂盒可包含含有盐溶液的容器、含有转导化合物的容器、含有目标分子的容器、含有渗透保护剂的容器和/或含有稀释剂或培养基的容器。此外,所述试剂盒可包含本文所描述的另外其他组分中的任一种或多种,其中它们适合于与转导缓冲液同时、依次或分别施用。
本发明的用途
本发明提供转导缓冲液在将目标分子转导进细胞中的用途。
将分子转导进细胞可有益于研究和治疗理由。
在某些实施方案中,本发明的转导缓冲液和方法可被用于遗传修饰。例如,在某些实施方案中,将某些酶转导进细胞可导致细胞基因组的修饰或外来核酸序列的修饰。例如,该转导的分子(如酶)可导致一个或多个(例如2、3、4、5、6、7、8、9、10、20、30、40、50、60、70、80、90、100、200、300、400、500、600、700、800、900、1000、2000、10
在某些实施方案中,所述转导化合物、缓冲液或方法可被用于具体基因序列的遗传修饰,在本文也被称为“基因编辑”。在某些实施方案中,本发明还提供修饰细胞中遗传序列的方法,其中所述方法包括本发明的转导方法,并且其中目标分子为能够修饰核酸(优选具体基因序列)的蛋白,并且任选地为基因编辑系统的一部分。最近几年,已研发了两种本质上不同的基因编辑系统,其区别在于它们找到其具体基因组靶序列的方式。以锌指核酸酶(ZFN)和TALEN为代表的一种类型,利用核酸酶蛋白自身内的可定制结构域来识别基因组中具体的靶DNA序列。另一类的代表是Cas9/CRISPR、级联系统和TtAgo以及有时与核酸酶结构域(如FokI核酸酶结构域)耦合为融合蛋白的其他Argonaute蛋白系统,它们利用相同的常规蛋白(复合体)(不考虑基因组靶位点),通过相关的核苷酸序列(如sgRNA或gDNA)将它们靶向具体靶标。常规地,将这些基因编辑系统转染进细胞,作为编码蛋白/RNA机构的核酸;然后转染的核酸在细胞内表达。常规的核酸转染的方法涉及病毒载体、电穿孔法或载体纳米颗粒或脂质体。这些方法妨碍了临床应用,并且对某些细胞类型效率低,如别处所述。本发明人相反地表明,本文所描述的转导化合物、缓冲液和方法能够将蛋白和/或核酸直接地递送进细胞(例如作为基因编辑系统的一部分),其允许迅速、非病毒性和非常高效的基因编辑。具体地,他们表明,可使用本发明的转导化合物、缓冲液和方法,来转导上文提及的两种“类型”的基因编辑机构。因此,在某些实施方案中,本发明的转导方法被用于遗传修饰,其中转导不需要或不包括病毒载体的使用(具体而言,不包括在细胞内部使用表达蛋白的病毒载体)、不需要或不包括电穿孔法的使用、不需要或不包括载体纳米颗粒的使用和/或不需要或不包括脂质体的使用。
在某些实施方案中,本发明提供通过本发明的转导方法可获得的或获得的细胞,例如,其中所述细胞不包含病毒载体(例如,不包含编码可修饰基因的蛋白的病毒载体),或者例如,其中所述细胞不包含载体纳米颗粒、胶团或脂质体。
在某些实施方案中,要被转导进细胞的分子为核酸内切酶。核酸内切酶为在具体序列上切割DNA链的酶。转录激活子样效应子(TALE)为工程化转录调控子,其被设计来结合具体需要的DNA序列(Moscou,J&Bogdanove,AJ Science 326(5959):1501,2009)。通过将这样的工程化TALE与核酸内切酶结构域(其切割DNA链)组合,可设计出对任何需要的DNA序列特异的核酸内切酶。当这些限制性酶被导入细胞时,它们可被用于进行原位基因组编辑,被称为用工程化核酸酶编辑基因组的技术。转录激活子样核酸内切酶(TALEN)可被用来通过诱导双链断裂(DSB)编辑基因组,对此,细胞用修复机制来应答(Zhang,F et.al.NatureBiotechnology 29(2):149–53,2011)。因此,在某些实施方案中,本发明提供转导缓冲液在基于限制性酶或基于核酸内切酶(如基于TALEN)的遗传工程中的用途。因此,在某些实施方案中,要被转导进细胞的目标分子为TALEN。通过本发明的方法或通过替代性转导方法还可将外来核酸序列导入细胞。在外源双链DNA片段存在下,通过非同源外显子连接可将DNA任选地导入基因组。同源介导的修复还可在双链断裂处导入外来DNA,因为转染的双链序列被用作修复酶的模板。因此,TALEN被用来产生稳定修饰的人胚胎干细胞和诱导的多能性干细胞(iPS细胞)克隆,以产生基因敲除的秀丽线虫(C.elegans)、基因敲除的大鼠和基因敲除的斑马鱼。因此,在某些实施方案中,为了产生遗传修饰的动物(例如为了产生显示具体特性或具有具体遗传疾病或病症的模型生物体),通过TALEN或其他转导分子进行遗传修饰可被用来代替当前用于修饰植入前胚胎或囊胚的注入技术(Voncken JW.Method MolBiol.2011;693:11-36)。通过将其他结构域耦合在TALE骨架上,还可以以其他方式修饰或调节DNA。例如,添加反式激活结构域代替核酸内切酶结构域,将TALE转变为转录激活剂。添加抑制剂结构域导致关闭基因转录的TALE。添加甲基化结构域允许具体位置处的DNA甲基化。同样地,添加组蛋白修饰结构域(例如组蛋白乙酰基转移酶)允许在具体位置处的组蛋白修饰等等。这些均被考虑为用于本发明的分子。
在某些实施方案中,使用本发明的转导化合物、缓冲液和/或方法,将蛋白核酸酶和向导核酸(如sgRNA或gDNA)同时或依次地转导进细胞。例如,在某些实施方案中,将Cas9核酸酶和sgRNA同时或依次地转导进细胞。小向导RNA和向导DNA可被设计来靶向具体的DNA序列,并且因此该组合可被用于具体的基因编辑。如上所述,该组合被称为CRISPR/Cas9系统。针对Cas9核酸酶的其他类似系统和替代物,包括来自级联系统的蛋白、TtAgo和其他Argonaute蛋白,以及其他FOKI-核酸酶相关蛋白。
因此,在某些实施方案中,本发明提供用于将基因编辑系统(如TALEN系统、CRISPR/Cas9系统(优选包括涉及来自不同物种的Cas类似物的系统)、FokI核酸酶系统、级联系统、TtAgo系统或其他Argonaute蛋白系统)转导进细胞的方法。本文所描述的转导化合物和缓冲液可被用于这样的方法,并且其在不需要病毒转染的情况下,允许细胞中的基因编辑(参见上述评论)。
在某些实施方案中,通过基因编辑系统靶向的核酸为内源核酸,例如基因组DNA。在其他实施方案中,通过基因编辑系统靶向的核酸为外源核酸,例如,可将所述外源核酸转导进具有基因编辑系统的细胞,作为转导方法的一部分。
在某些实施方案中,这样的基因编辑系统可被用来产生靶向的基因突变,包括但不限于:单等位基因或双等位基因的基因敲除。例如,参见实施例14,其中本发明人证明了双等位基因WDR85的基因破坏。当使用本发明的方法(例如,代替使用现有技术的病毒转染方法)将基因编辑系统转导进细胞时,其导致高度有效的单等位基因或双等位基因的基因敲除。因此,在某些实施方案中,本发明的方法导致至少1%、至少2%、至少5%、至少10%、至少20%、至少30%、至少40%、至少50%、至少60%或至少70%的单等位基因或双等位基因的基因修饰(或者敲除)。
基因编辑还可被用来研究动物中的基因功能和用于动物(包括人)中的基因治疗。其还可用于将细胞和生物体工程化以实行新功能的合成生物学领域中。此外,可在修饰的细胞系(如干细胞系)中研究基因功能。因此,在某些实施方案中,本发明的转导化合物、方法或缓冲液,特别是当联合基因编辑的实施方案使用时,可被用来研究基因功能、用于基因治疗或用于合成生物学。
在某些实施方案中,在这样的方法中,可将酶(如上文所描述的酶)转导进胚胎或囊胚细胞以从遗传学角度修饰细胞,然后将其植入动物。因此,在某些实施方案中,本发明的转导缓冲液和方法可被用来产生模型生物体,如基因敲除生物体。在其他实施方案中,考虑到本发明的转导缓冲液和方法可被用于从遗传学角度治疗人的遗传性病症,例如在人胚胎或囊胚阶段(例如植入前遗传学)。因此,本发明提供将目标分子转导进细胞的方法,其中所述目标分子为核酸和/或修饰核酸的酶,并且任选地,其中所述细胞为胚胎或囊胚细胞。
在某些实施方案中,所述遗传修饰涉及将外来DNA整合进宿主基因组,其中外来DNA为目标分子,使用本发明的方法可将其转导进细胞。然而,为了避免异常整合和基因组破坏,在某些实施方案中,遗传修饰涉及非整合的方法,即,不将修饰的核酸整合进基因组。
通过以遗传学角度修饰细胞以表达涉及维持多能性干细胞的某些转录因子,或者通过将转录因子直接地转导进细胞,本发明的转导缓冲液和方法还可被用来产生iPS细胞。涉及诱导多能性的转录因子的实例包括但不限于:OCT2/3/4、SOX2、KLF4、C-MYC、N-MYC、NANOG、ESRRB和LIN28。
在某些实施方案中,本发明提供用于治疗、预防或诊断的转导缓冲液或药物组合物。
本发明还提供用于治疗或诊断的方法,其包括将目标分子转导进细胞。所述细胞可为体内细胞,在这种情况下,治疗为直接的治疗。可选地,例如用于体外诊断,细胞可被体外转导。可选地,细胞可被体外转导,然后将所述细胞移植进患者。移植可为自体的或同种异体的,即,转导的细胞可被移植回其取自的同一患者(自体的),或移植回不同个体(同种异体的)。在一个优选实施方案中,植入为自体的。
包括单克隆抗体、细胞因子、组织生长因子和治疗蛋白的生物药物(也被称为生物制剂)正越来越多地成为用于治疗的化学小分子的重要替代物。然而,存在许多与生物药物相关的难点,具体而言,涉及它们至目标靶标的递送。本发明的转导缓冲液和方法可被用来改善生物制剂向细胞的递送。例如,在某些实施方案中,本发明的方法中的目标分子为生物制剂,例如选自单克隆抗体、细胞因子、组织生长因子和治疗蛋白。所述目标细胞可被体外转导并且将其移植回患者,或者所述细胞可被体内转导。
在某些实施方案中,提供用于治疗的修饰核酸的蛋白,例如基因编辑系统(如ZNF、TALEN、CRISPR/Cas9、级联系统、TtAgo和其他Argonaute系统、以及其他FOKI-核酸酶相关蛋白)。根据本发明,在某些实施方案中,所述治疗包括将分子转导进细胞的方法。通过转导修饰核酸的蛋白(例如基因编辑系统)可治疗许多疾病和病况,并且本领域技术人员清楚可治疗哪些疾病或病况。通过转导修饰核酸的蛋白(例如基因编辑系统)可治疗的病况和疾病包括但不限于:遗传疾病,如镰刀形细胞疾病、Leber先天性黑朦、X连锁SCID、ADA-SCID、肾上腺脑白质营养不良、慢性淋巴细胞白血病(CLL)、急性淋巴细胞白血病(ALL)、多发性骨髓瘤、血友病和帕金森氏病。所述治疗可为体细胞或生殖细胞系的基因治疗,即,在某些实施方案中,转导方法中的细胞为体细胞或生殖细胞。
本发明的转导缓冲液和方法还可被用来将抗原负载至抗原呈递细胞以呈递至免疫系统。这有利地产生了新型疫苗制造方法。例如,将抗原负载至体外树突状细胞,并且然后移植回身体。然而,到目前为止,所用方法损害树突状细胞,例如因为他们使用如胞吞作用的机理强迫蛋白进入细胞。树突状细胞已经具有非常主动的巨胞饮通路。因此,通过使用本发明的方法,树突状细胞可经巨胞饮通路负载抗原,对细胞的损害可以忽略。该方法可在体外进行,然后将细胞移植进患者,或者可将抗原例如通过皮肤下注射体内转导进树突状细胞(或者其他抗原呈递细胞)。
因此,本文提供转导缓冲液在将抗原转导进抗原呈递细胞中的用途。还提供将抗原转导进抗原呈递细胞的方法。本发明还提供本发明的转导缓冲液和/或方法在制造疫苗中的用途,例如,疫苗包含通过本发明的方法已被转导的抗原呈递细胞,即,其中目标抗原已被转导进细胞。同样地,本发明提供接种疫苗、治疗或预防对象的方法,其包括向对象施用细胞,其中所述细胞已通过本发明的方法被转导。同样地,本发明提供用于接种疫苗、治疗或预防对象的方法中的细胞,其中所述方法包括向对象施用细胞,其中所述细胞已通过本发明的方法被转导。
在某些实施方案中,本发明提供本文所描述的转导缓冲液在阳离子脂类介导的DNA转染的方法中的用途。本发明提供用于将脂质和DNA转导进细胞的方法,其中所述方法如本文所述。
作为非限制性实例,本申请提供了以下实施方案。
1.将目标分子转导进细胞的方法,其中所述方法包括使所述细胞与所述目标分子和转导缓冲液接触,其中所述转导缓冲液包含(i)转导化合物,(ii)盐或钠氢运载蛋白的激活剂/增强剂,以及优选地(iii)渗透保护剂。
2.如实施方案1所述的方法,其中所述转导缓冲液包含(i)转导化合物,(ii)盐,以及优选地(iii)渗透保护剂。
3.如实施方案2所述的方法,其中所述转导缓冲液包含(i)转导化合物,(ii)盐和(iii)渗透保护剂。
4.如实施方案1至3中任一项所述的方法,其中所述盐为钠盐、锂盐、钾盐、铯盐或铷盐。
5.如实施方案1至4中任一项所述的方法,其中所述盐为氯化钠。
6.如实施方案1至5中任一项所述的方法,其中所述转导化合物a.具有通式:
其中R
R
R
R
n为1-6,即1、2、3、4、5或6;或者
b.具有通式:
其中:
X选自:NR
Y选自:SO
n为1、2、3、4、5或6;
R
或者R
或者当X为NR
R
R
杂环基为饱和或部分不饱和的单环,如果可能,其含有独立地选自N、NR
杂芳基为5或6元的芳香环,如果可能,其含有独立地选自N、NR
R
烷基为直链或支链的饱和烃;
R
C1-C6羧酸意指–COOH或被COOH取代的C1-5烷基链及其互变异构体、溶剂化物、两性离子和盐。
7.如实施方案1至6中任一项所述的方法,其中所述转导化合物为非去污剂甜菜碱(NDB)或其衍生物。
8.如实施方案7所述的方法,其中所述转导化合物具有通式:
其中
X选自NR
Y选自:SO
R
并且所有其他基团如上文在式I中所定义。
9.如实施方案6至8中任一项所述的方法,其中所述转导化合物含有季氮基团,并且其中所述季氮为脂肪族或芳香环结构的部分。
10.如实施方案6至9中任一项所述的方法,所述转导化合物为式I或式II的化合物,其中X为
(a)
Z选自:C(R
各个R
R
R
11.如前述实施方案中任一项所述的方法,其中所述转导化合物为选自表1中的化合物。
12.如前述实施方案中任一项所述的方法,其中所述转导化合物为与表1的参考化合物#1相比具有30%或更高转导效率的任何化合物。
13.如前述实施方案中任一项所述的方法,其中所述渗透保护剂为甘氨酸和/或甘油。
14.如前述实施方案中任一项所述的方法,其中所述转导缓冲液还包含生物pH缓冲液、粘度增强剂和/或生长因子。
15.如实施方案14所述的方法,其中所述生物pH缓冲液为PBS、TES或HEPES。
16.如实施方案14或15所述的方法,其中所述粘度增强剂为聚乙烯吡咯烷酮(PVP)。
17.如实施方案14至16中任一项所述的方法,其中所述生长因子选自:EGF、FGF、HGF、BDNF、PDGF、VEGF或IGF,或者上述项的任意组合。
18.如前述实施方案中任一项所述的方法,其中所述转导缓冲液的重量克分子渗透浓度范围为约300mOsm/kg至约1000mOsm/kg、或约300mOsm/kg至约2000mOsm/kg、或约300mOsm/kg至约3000mOsm/kg。
19.如前述实施方案中任一项所述的方法,其中所述转导化合物的浓度为约0.1mM至约500mM。
20.如前述实施方案中任一项所述的方法,其中所述渗透保护剂的浓度为约5mM至约500mM。
21.如前述实施方案中任一项所述的方法,其中所述目标分子为肽、蛋白、核酸、多糖、小分子、囊泡、纳米颗粒、病毒或单细胞生物体。
22.如前述实施方案中任一项所述的方法,其中所述目标分子为约30kDa至约200kDa,或约1kDa至约400kDa。
23.如前述实施方案中任一项所述的方法,其中所述目标分子为修饰核酸的酶,例如核酸内切酶或核酸酶,例如其选自:锌指核酸酶、TALEN、Cas9、Cas9类似物、靶向DNA的FokI核酸酶相关蛋白、级联系统、TtAgo或Argonaute蛋白或它们的衍生物。
24.如前述实施方案中任一项所述的方法,其中所述细胞为哺乳动物细胞如人类细胞。
25.如前述实施方案中任一项所述的方法,其中所述细胞为干细胞如胚胎干细胞或神经干细胞,或者分化细胞如神经元细胞或树突状细胞。
26.如前述实施方案中任一项所述的方法,其中所述细胞为原代细胞。
27.如前述实施方案中任一项所述的方法,其中使所述细胞与两种、三种、四种或更多种目标分子接触。
28.如前述实施方案中任一项所述的方法,其中所述方法在体外进行。
29.如前述实施方案中任一项所述的方法,其中所述方法在体内进行。
30.如前述实施方案中任一项所述的方法,其中所述转导通过巨胞饮进行。
31.通过实施方案1至30中任一项所述的方法转导的细胞或细胞群。
32.用于实施方案1至30中任一项所述的方法的实施方案1至30中任一项所述的转导缓冲液。
33.如实施方案32所述的转导缓冲液,其中所述转导缓冲液还包含用于转导的目标分子。
34.实施方案32或33所述的转导缓冲液在将目标分子转导进细胞的方法中的用途,其中所述方法为实施方案1至30中任一项所述的方法。
35.药物组合物,其包含实施方案32或33所述的转导缓冲液。
36.用于治疗或诊断的实施方案32或33所述的转导缓冲液或者实施方案35所述的药物组合物。
37.渗透保护剂,任选甘氨酸和/或甘油,在将目标分子转导进细胞的方法中的用途,例如,其中所述方法为实施方案1至30中任一项所述的方法。
38.选自表1的转导化合物在将目标分子转导进细胞中的用途,例如,其中所述方法为实施方案1至30中任一项所述的方法。
39.化合物,其选自表1中的化合物#10、#11、#16、#42、#34、#41、#40、#39、#33、#15、#11、#29、#36和#46。
40.用于修饰细胞中的核酸如遗传序列的方法,其中所述方法包括使所述细胞与能够修饰核酸的蛋白以及转导缓冲液接触,其中所述转导缓冲液包含(i)转导化合物,(ii)盐或钠氢运载蛋白的激活剂/增强剂,以及优选地(iii)渗透保护剂。
41.如实施方案40所述的方法,其中所述能够修饰核酸的蛋白固有地靶向特定的靶序列,例如其中所述蛋白为锌指核酸酶或TALEN、Cas9、Cas9类似物、靶向DNA的FokI核酸酶相关蛋白、级联复合体、TtAgo蛋白或其他Argonaute蛋白或它们的衍生物。
42.如实施方案40所述的方法,其中使所述细胞与向导分子进一步接触以将蛋白引导至靶遗传序列。
43.如实施方案40至42中任一项所述的方法,其中将所述重量克分子渗透浓度调节为约1000mOsm/kg至约1500mOsm/kg,优选约1250mOsm/kg。
44.如实施方案40至43中任一项所述的方法,其中所述转导化合物以约200nM至约400nM,优选约250mM的浓度使用。
45.如实施方案40至44中任一项所述的方法,其中所述转导缓冲液还包含干扰素应答通路的抑制剂,例如B18R。
46.如实施方案40至45中任一项所述的方法,其中所述方法还包括分离或利用修饰的细胞。
47.通过实施方案40至46中任一项所述的方法可获得的修饰细胞。
概括
术语“包含(comprising)”包括“包括(including)”以及“组成(consisting)”,例如“包含”X的组合物,可仅由X组成或者可包括某些其他组分,例如X+Y。
单词“基本上”不排除“完全地”意思,例如“基本上不含”Y的组合物,可完全地不含Y。如果需要,单词“基本上”可从本发明的定义删除。
与数值x有关的术语“约”意指,例如,x±10%。其也具体地指准确的值,例如在上面的实例中,精确地指10%。如果需要,单词“约”可从本发明的定义删除。
除非另有明确规定,否则术语“一个/种(a/an)”意指“一种或多种”。例如,其可意指“仅有一种”或者其可意指“多于一种”,例如“两种、三种、四种、五种或更多种”。
除非明确地规定,包括混合两种或更多种组分的步骤的过程,不要求任何特定的混合顺序。因此,组分可以以任意顺序混合。当存在三种组分时,那么可将两种组分彼此组合,以及然后所述组合可与第三种组分组合,等等。
应理解,本发明通过仅实例的方式描述,并且可做出修改,同时所述修改依然在本发明的范围和精神内。
附图简述
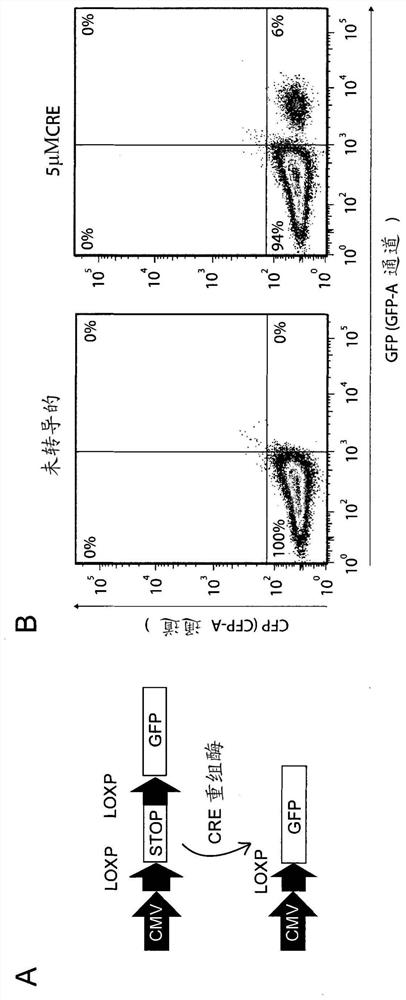
图1:使用Okada等人所描述的方法进行Cre重组酶蛋白的转导
(A)Cre重组酶报告基因的示意图。将CMV-Lox-Stop-Lox-eGFP报告基因靶向鼠ESC的ColA1基因座
(B)使用Okada的方法,用5μM重组CRE蛋白转导的mESC(右图)相比于未转导的细胞(左图)的FACS图。显示了成功转导的GFP阳性细胞的百分比。
图2:不依赖于转导肽结构域的蛋白转导
(A)重组蛋白的示意图。显示重组蛋白中的结构域:H6:6x组氨酸纯化标签;LFn:炭疽LF蛋白的N-端转导结构域;SUMO-1:Sumo切割结构域;Oct4:鼠Oct4(Pou5f1)蛋白;VP16:VP16反式激活结构域。
(B)本研究中使用的荧光素酶报告基因构建体的示意图。顶部:含有6个串联重复的Oct4 DNA识别序列的Oct4-报告基因。中间:缺乏Oct4结合序列的对照构建体;底部:监测转染效率的对照构建体,其表达海肾荧光素酶。
(C)蛋白转导分析的时间表的示意图。
(D)用6xOCT4-TK-Luc报告基因转染COS7细胞,随后进行蛋白转导。特异性对照为用空的慢病毒或表达OCT4的慢病毒组合TK-Luc报告基因(黑色柱)或6xOct4-TK-Luc(灰色柱)转染的细胞。用共转染的海肾荧光素酶构建体对萤火虫荧光素酶活性进行标准化。PA:保护性抗原,其为LFn介导的转导所需的辅助因子。
(E)本研究中使用的OCT4重组蛋白的示意图。
(F)用6xOCT4-TK-Luc报告基因转染COS7细胞,并且12小时后用所示OCT4蛋白以图中所示增加浓度的形式转导。通过如(D)中的共转染海肾荧光素酶构建体对萤火虫荧光素酶活性进行标准化。用空的慢病毒和表达OCT4的慢病毒(分别为“EV”和“OCT-4”)转导细胞,作为对照。
(G)用OCT4-TK-Luc报告基因转染COS7细胞,并且用OCT4-VP16蛋白(黑色柱“+”)或没有蛋白(白色柱“+”)转导。柱A-G代表基于减去一种组分的转导培养基用OCT4-VP16蛋白转导的细胞。用共转染海肾荧光素酶构建体对萤火虫荧光素酶活性进行标准化。
(H)非去污剂磺基甜菜碱201(NDSB-201)化合物的结构。
图3:蛋白转导依赖于时间、蛋白浓度、盐引起的高张性和NDSB-201
(A)β-内酰胺酶报告基因分析的示意图。非荧光CCF2/AM通过扩散作用穿过细胞膜并且通过细胞内酯化作用捕获在细胞质中,其还激活目前叫作CCF2的荧光特性。当CCF2在409nm处被激发时,其在520nm处发射荧光信号(绿色信号)。CCF2被细胞内β-内酰胺酶切割导致剩余切割产物的发射波长移动至447nm(蓝色信号)。绿色信号和蓝色信号之间的比值是(转导的)细胞内β-内酰胺酶的量的度量。
(B)β-内酰胺酶报告基因分析。在由NaCl引起的700mOsm/Kg的重量克分子渗透浓度下,具有25mM NDSB-201的情况下,用1μMβ-内酰胺酶蛋白转导鼠胚胎成纤维细胞(MEF)持续所指示的时间(实心柱)。按照上文但在等张培养基(300mOsm/Kg,空心圆)中处理对照细胞。
(C)MEF的β-内酰胺酶报告基因分析,在由NaCl引起的700mOsm/Kg的重量克分子渗透浓度下,具有25mM NDSB-201的情况下,用增加浓度的β-内酰胺酶蛋白(如图所示)转导MEF持续3小时(实心柱)。按照上文但在等张的培养基(300mOsm/Kg,空心圆)中处理对照细胞。
(D)MEF的β-内酰胺酶报告基因分析,在由NaCl引起的不同重量克分子渗透浓度(如图所示)下,具有25mM NDSB-201的情况下,用1μMβ-内酰胺酶蛋白转导MEF持续3小时(红色柱)。按照上文但在等张的培养基(300mOsm/Kg,空心圆)中处理对照细胞。
(E)MEF的β-内酰胺酶报告基因分析,在由NaCl引起的700mOsm/Kg重量克分子渗透浓度下,具有不同浓度的NDSB-201(如图所示)的情况下,用1μMβ-内酰胺酶蛋白转导MEF(实心柱)。按照上文但在等张的培养基(300mOsm/Kg,空心圆)中处理对照细胞。
图4:向转导培养基添加渗透保护剂以改善高张性引起的细胞周期抑制
(A)β-内酰胺酶分析(实心柱)和细胞增殖(BrdU并入)分析(白色正方形)。在不同的重量克分子渗透浓度下,具有25mM NDSB-201的情况下,用或者不用1μMβ-内酰胺酶转导MEF不同的时长(如图所示)。将在300mOsm/Kg下没有用β-内酰胺酶蛋白处理的细胞的相对β-内酰胺酶活性,设置在1。对于BrdU并入分析,将未处理的细胞和丝裂霉素C处理的细胞的相对Brdu并入值,分别设置在100%和0%。
(B)渗透保护剂对细胞增殖影响的分析。使用含有25mM NDSB-201的且被NaCl调节至700mOsm/Kg的转导培养基(对照,左边第三柱),用1μMβ-内酰胺酶转导MEF,或者添加所示的渗透保护剂在相同的条件下进行转导。未处理的细胞(柱#1)和丝裂霉素C处理的细胞(柱#2)的相对Brdu并入值,分别被认为是100%和0%。
(C)甘油和甘氨酸的组合添加改善了转导缓冲液引起的MEF的细胞周期抑制。按照所示,在添加30mM甘油和15mM甘氨酸(+2G)的情况下,用或不用β-内酰胺酶转导MEF。将300mOsm/Kg下不用β-内酰胺酶蛋白处理的细胞的相对β-内酰胺酶活性,设置在1。对于BrdU并入分析,将未处理的细胞和丝裂霉素C处理的细胞的相对Brdu并入值,分别设置在100%和0%。
(D)如(C)所述,对鼠ESC进行转导。
(E)鼠ESC的重复转导。在500mOsm/Kg下,具有25mM NDSB-201,在添加30mM甘油和15mM甘氨酸的情况下,用1μMβ-内酰胺酶转导mESC持续12小时(1轮),随后是12小时恢复期,以及第二轮12小时的转导。按照指示,每轮转导后测量β-内酰胺酶的转导和BrdU并入。将300mOsm/Kg下,没有用β-内酰胺酶蛋白处理的细胞的相对β-内酰胺酶活性,设置在1。对于BrdU并入分析,将未处理的细胞和丝裂霉素C处理的细胞的相对BrdU并入值,分别设置在100%和0%。
图5:蛋白转导通过巨胞饮介导,并且被巨胞饮诱导物和巨胞饮体逃逸的增强剂提高
(A)不同高张化合物的转导活性的分析。在由所示的不同化合物引起的700mOsm/Kg的重量克分子渗透浓度(实心柱,NDSB下的转导;空心圆,NDSB-201不存在下的对照转导)以及添加30mM甘油和15mM甘氨酸的情况下,用1μMβ-内酰胺酶蛋白转导MEF持续3小时。将等张培养基(左边柱)中的相对β-内酰胺酶蛋白吸收,设置在1。
(B)不同胞吞途径的抑制剂影响的分析。NaCl调节的700mOsm/Kg的重量克分子渗透浓度下,如所示在网格蛋白介导的胞吞作用的小分子抑制剂(Pitstop2和氯丙嗪)、小窝蛋白介导的胞吞作用的小分子抑制剂(Dynasore和制霉菌素)、巨胞饮的小分子抑制剂(5-(N-乙基N-异丙基)-氨氯吡嗪脒(EIPA)或5-(N,N-二甲基)氨氯吡嗪脒盐酸盐(DMA))或肌动蛋白聚合作用的小分子抑制剂(细胞松弛素D和拉春库林A)的存在下,在含有25mM NDSB201以及30mM甘油和15mM甘氨酸的转导缓冲液中,用1μMβ-内酰胺酶蛋白转导MEF持续3小时。将等张培养基中的相对β-内酰胺酶蛋白吸收(左边柱),设置在1。
(C)Nhe1在蛋白转导中的作用。从野生型,Nhe1杂合(+/-)和Nhe1敲除(-/-)的胚胎分离MEF,并且在NaCl调节的700mOsm/Kg的重量克分子渗透浓度下,在含有25mM NDSB201以及30mM甘油和15mM甘氨酸的转导缓冲液中,用1μMβ-内酰胺酶蛋白转导所述MEF持续3小时。将野生型细胞的相对转导,设置在100%;以及将等张培养基(左边柱)中被野生型细胞并入的β-内酰胺酶,设置在10%。
(D)生长因子和巨胞饮体逃逸的肽增强剂对MEF的蛋白转导的影响。在NaCl调节的700mOsm/Kg的重量克分子渗透浓度下,在所示的生长因子(左边第3-10柱)或不同浓度的dTAT-HA2膜融合肽(左边第11-13柱)的存在下,含有25mM NDSB201以及30mM甘油和15mM甘氨酸的转导缓冲液中,用1μMβ-内酰胺酶蛋白转导MEF持续3小时。将等张培养基中的相对β-内酰胺酶蛋白吸收(左边条),设置在1。空心圆表示转导的细胞的相对BrdU并入。将未转导的细胞的BrdU并入,设置在100%;以及将丝裂霉素C处理的细胞的BrdU并入,设置在10%。
(E)生长因子和巨胞饮体逃逸的肽增强剂对鼠ESC的蛋白转导的影响。在NaCl调节的500mOsm/Kg的重量克分子渗透浓度下,在所示生长因子(左边第3-8柱)或不同浓度的dTAT-HA2膜融合肽(左边第9-11柱)的存在下,在含有25mM NDSB201以及30mM甘油和15mM甘氨酸的转导缓冲液中,用1μMβ-内酰胺酶蛋白转导MEF持续12小时。将等张培养基中的相对β-内酰胺酶蛋白吸收(左边条),设置在1。空心圆表示转导细胞的相对BrdU并入。将未转导的细胞的BrdU并入,设置在100%;以及将丝裂霉素C处理的细胞的BrdU并入,设置在10%。
图6:蛋白转导化合物的结构-活性关系
(A)顶图:测试的转导化合物的化学结构。底图:利用所述不同转导化合物的β-内酰胺酶和BrdU并入分析。在NaCl调节的700mOsm/Kg的重量克分子渗透浓度下,在含有30mM甘油和15mM甘氨酸以及25mM示出的转导化合物的转导缓冲液中,用1μMβ-内酰胺酶蛋白转导MEF持续3小时。将参考化合物(NDSB201,#01)的β-内酰胺酶并入,设置在100%。空心圆表示转导的细胞的相对BrdU并入。将未转导的细胞的BrdU并入,设置在100%;以及将丝裂霉素C处理的细胞的BrdU并入,设置在10%。
(B)顶图:第一排:具有磺酸基的化合物的实例。第二排:具有羧基的化合物的实例。第三排:具有酰胺基的化合物的实例。第四排:具有仲酰胺基的化合物的实例。第五排:具有叔酰胺基的化合物的实例。底排:含有生物电子等排体变体和二聚物变体的其他变体。底图:利用不同转导化合物的β-内酰胺酶和BrdU并入分析。在NaCl调节的700mOsm/Kg的重量克分子渗透浓度下,在含有30mM甘油和15mM甘氨酸以及25mM所示的转导化合物的转导缓冲液中,用1μMβ-内酰胺酶蛋白转导MEF持续3小时。将参考化合物(NDSB201,#01)的β-内酰胺酶并入,设置在100%。空心圆表示转导的细胞的相对BrdU并入。将未转导的细胞的BrdU并入,设置在100%;以及将丝裂霉素C处理的细胞的BrdU并入,设置在10%。
(C)顶图:左栏的化合物含有胺基和磺酸基或羧基。中间栏示出与左边相同的无胺基的化合物。右边栏示出与左边相同的无磺酸基或羧基的化合物。底图:利用不同转导化合物的β-内酰胺酶和BrdU并入分析。在NaCl调节的700mOsm/Kg的重量克分子渗透浓度下,在含有30mM甘油和15mM甘氨酸以及25mM所述转导化合物的转导缓冲液中,用1μMβ-内酰胺酶蛋白转导MEF持续3小时。将参考化合物(NDSB201,#01)的β-内酰胺酶并入,设置在100%。空心圆表示转导的细胞的相对BrdU并入。将未转导的细胞的BrdU并入,设置在100%;以及将丝裂霉素C处理细胞的BrdU并入,设置在10%。
(D)顶图:碳链长度的作用的分析。所显示的为两种转导化合物(#11和#20,灰色阴影区)及其碳链长度的变体的实例。底图:利用顶图中所示的转导化合物的β-内酰胺酶和BrdU并入分析:在NaCl调节的700mOsm/Kg的重量克分子渗透浓度下,在含有30mM甘油和15mM甘氨酸以及25mM所示的转导化合物的转导缓冲液中,用1μMβ-内酰胺酶蛋白转导MEF持续3小时。将参考化合物(NDSB201,#01)的β-内酰胺酶并入,设置在100%。空心圆表示转导的细胞的相对BrdU并入。将未转导的细胞的BrdU并入,设置在100%;以及将丝裂霉素C处理的细胞的BrdU并入,设置在10%。
(E)基于MEF中的β-内酰胺酶蛋白转导,45种不同转导化合物的转导活性和BrdU并入。在NaCl调节的700mOsm/Kg的重量克分子渗透浓度下,在含有30mM甘油和15mM甘氨酸以及25mM所示的转导化合物的转导缓冲液中,用1μMβ-内酰胺酶蛋白转导MEF持续3小时。将参考化合物(NDSB201,#01)的β-内酰胺酶并入,设置在100%。空心圆表示转导的细胞的相对BrdU并入。将未转导的细胞的BrdU并入,设置在100%;以及将丝裂霉素C处理的细胞的BrdU并入,设置在10%。
(F)将不同转导化合物组合对总蛋白转导活性的影响。在NaCl调节的700mOsm/Kg的重量克分子渗透浓度下,在含有30mM甘油和15mM甘氨酸以及等摩尔量所示的转导化合物(使得缓冲液中的转导化合物的最终浓度是25mM)的转导缓冲液中,用1μMβ-内酰胺酶蛋白转导MEF持续3小时。将参考化合物(NDSB201,#01)的β-内酰胺酶并入,设置在100%。空心圆表示转导的细胞的相对BrdU并入。将未转导的细胞的BrdU并入,设置在100%;以及将丝裂霉素C处理的细胞的BrdU并入,设置在10%。
(G)GABA受体激动剂对蛋白转导的评价。在NaCl调节的700mOsm/Kg的重量克分子渗透浓度下,在含有30mM甘油和15mM甘氨酸以及25mM NDSB201加所示的GABA激动剂的转导缓冲液中,用1μMβ-内酰胺酶蛋白转导MEF持续3小时。将参考化合物(NDSB201,#01)的β-内酰胺酶并入设置在100%。空心圆表示转导细胞的相对BrdU并入。将未转导细胞的BrdU并入设置在100%,以及将丝裂霉素C处理细胞的BrdU并入设置在10%。
表1:
转导缓冲液中的转导化合物、它们的蛋白转导活性和对细胞增殖的影响的列表。第一栏:转导化合物编号;第二栏:转导化合物的化学结构。第三栏:相对β-内酰胺酶蛋白转导活性;第四栏:β-内酰胺酶转导后24小时的相对BrdU并入。在NaCl调节的700mOsm/Kg的重量克分子渗透浓度下,在含有30mM甘油和15mM甘氨酸以及25mM所示的转导化合物的转导缓冲液中,用1μMβ-内酰胺酶蛋白转导MEF持续3小时。将参考化合物(NDSB201,#01)的β-内酰胺酶并入,设置在100%。空心圆表示转导的细胞的相对BrdU并入。将未转导的细胞的BrdU并入设置在100%,以及将丝裂霉素C处理细胞的BrdU并入设置在10%。
图7:mES细胞中的Cre蛋白转导
(A)Cre重组酶报告基因的示意图。将CMV-Lox-Stop-Lox-eGFP报告基因靶向鼠ESC的ColA1基因座
(B)顶部示出用不同浓度CRE转导以及进行多轮转导的mES细胞的FACS密度图。下图示出在不同浓度膜融合肽下用5μM CRE蛋白转导的mES细胞。将来自CFP通道的信号用作自体荧光的对照。
(C)如(B)中所描述的两轮CRE转导的样品的显微图像。虚线表示各个克隆的边界。
(D)如(C)中所示出的样品的细胞增殖曲线。顶部&底部图。2天后,每天对转导的(白色圈)或未转导的(灰色柱)细胞进行计数,以做出细胞增殖曲线。
(E)如(C)中所示的未转导的和转导的mES细胞样品的多能性基因表达的qRT-PCR分析。将GAPDH用作内参对照。
(F)为了测试转导的mESC的多能性,将来自7B中实验的加倍转导的GFP+ESC注射进宿主囊胚胚胎,并且移植进假孕养育小鼠。如图7F所示,在没有Tat-HA2融合肽(7F,上图)和有Tat-HA2融合肽(图7F,下图)的转导中,双倍转导的mESC均有效地促进嵌合体形成。
图8:诱导的人多能性干细胞(iPSC)中的CRE蛋白转导
(A)CRE重组酶报告基因的示意图。经慢病毒感染,将EF1a-Lox-dsRED-Stop-Lox-EGFP/ires-PuroR构建体导入人iPSC中,并且随后进行嘌呤霉素选择。获得的细胞含有多拷贝的慢病毒报告基因构建体。未转导的细胞表达红色荧光蛋白。CRE介导的侧翼连有LoxP的dsRED-STOP盒的切除废除了dsRed表达,并且诱导EGFP报告基因蛋白的表达。
(B)顶图:Cre转导的人iPSC的FACS密度图。X轴示出GFP信号,y轴示出dsRED信号。用CRE蛋白或用CRE蛋白加所示的膜融合肽转导人iPSC。右图示出多轮的转导。对照为与不存在CRE蛋白的转导培养基孵育的细胞。底图:示出顶部密度图的直方图。同样,其示出基于总细胞群体的GFP阳性细胞定量。
(C)如(B)中所转导的人iPSC的代表性荧光和相位对比图像。顶排和中间排分别示出红色和绿色荧光通道。下排示出相位对比通道。
图9:不同神经细胞类型中的Cre蛋白转导
(A)CRE重组酶报告基因的示意图。如所示,经慢病毒感染,将EF1a-Lox-dsRED-Stop-Lox-EGFP/ires-PuroR构建体导入神经祖细胞和人iPSC及其衍生的神经衍生物,并且随后进行嘌呤霉素选择。获得的细胞含有多重拷贝的慢病毒报告基因构建体。未转导的细胞表达红色荧光蛋白。CRE介导的侧翼连有LoxP的dsRED终止盒的切除废除了dsRed表达,并且诱导EGFP报告基因蛋白的表达。
(B)用CRE蛋白转导的或保留未转导的不同细胞类型的代表性荧光图像。
图10:用于优化转导时间和培养基张力的多孔设置的示意图
图11:转导缓冲液促进mES细胞中的DNA-脂质转染。
将质粒DNA表达载体并入鼠胚胎干细胞的流式细胞术分析。从成功并入后的表达载体表达了红色荧光蛋白(RFP)。某些鼠胚胎干细胞系适应采用阳离子脂质的标准质粒转染。左图:使用脂质体LTX(Life technologies),根据制造商的方案用RFP表达质粒转染mESC。使用流式细胞术,针对RFP表达对细胞进行分析。右图:将转导缓冲液添加至质粒DNA/脂质体LTX转染混合物,导致报告基因DNA被有效转染进鼠ESC。Y轴显示红色通道荧光,以及x轴显示绿色通道荧光。
图12:使用转导缓冲液,DNA和蛋白的双重并入
对质粒DNA表达载体并入鼠胚胎干细胞进行流式细胞术分析。从成功并入后的表达载体表达了红色荧光蛋白(RFP)。此外,将Cre重组酶蛋白转导进Lox-Stop-Lox-GFP报告基因鼠ES细胞,导致GFP报告基因的激活。从左至右(上面所示的FACS图):在下列条件下于转导缓冲液中孵育对照mES Lox-Stop-Lox-GFP细胞12小时:无Cre重组酶蛋白或RFP报告基因质粒DNA;具有5μM Cre重组酶蛋白;具有含红色荧光蛋白(RFP)报告基因的质粒DNA;以及具有5μM CRE蛋白连同RFP-DNA/脂质复合体。Y轴显示红色通道荧光,以及x轴显示绿色通道荧光。
图13:转导缓冲液促进病毒并入人iPS细胞中
用表达红色荧光蛋白(RFP)的慢病毒颗粒转导人iPS细胞。
FACS图展示了未处理的(对照)人iPS细胞(左图);用表达红色荧光蛋白(RFP)的慢病毒颗粒转导细胞12小时(中间图);以及在1x转导缓冲液存在下,用表达RFP的慢病毒颗粒转导细胞12小时(缓冲液12/500,右图)。Y轴显示红色通道荧光,以及x轴显示绿色通道荧光。
图14:由TALEN蛋白介导的人iPS细胞中的HPRT基因破坏
用靶向X染色体上HPRT基因的TALEN蛋白对转导男性人iPS细胞。顶部显示野生型(WT)序列,靶TALEN半位点加下划线。基于TALEN的转导,将耐6TG的iPSC克隆分离,并且分析TALEN靶位点处的缺失。缺失通过蓝色破折号示出。每个突变位点的左边示出缺失(D)的大小。将突变频率计算为,鉴定的突变体数除以被分析序列的总数。
图15:多糖右旋糖酐和蛋白的共转导
A:为了评估转导缓冲液是否允许同时转导蛋白和大分子,通过表达GFP的鼠胚胎成纤维细胞(MEF),我们分析了巨胞饮介导的TMR-右旋糖酐(红色)和荧光标记BSA蛋白(蓝绿色)的吸收。
B:巨胞饮抑制剂EIPA(乙基异丙基氨氯吡嗪脒)抑制了TMR-右旋糖酐或BSA蛋白的吸收。用Hoescht 33342(蓝色)对核进行染色。
图16:NDSB-201和GABA分子诱导巨胞饮体囊泡的渗漏
(A)左图:GAL3-GFP报告基因分析的示意图。一旦开始转导,细胞外施加的蛋白就被吸收进巨胞饮体(灰色囊泡)。巨胞饮体膜的细胞内破裂将巨胞饮体内含物释放进细胞质。同时,受损的巨胞饮体膜允许细胞溶质GAL3-GFP蛋白的进入,GAL3-GFP蛋白结合巨胞饮体内的糖并且累积,导致明亮的荧光信号(白色囊泡)。右图:在有或没有巨胞饮抑制剂EIPA的情况下,将GAL3-GFP细胞与700mOsmol/Kg下的转导培养基孵育。将未处理的细胞作为阴性对照。注意到在转导条件下(中间图),GAL3-GFP累积于受损的巨胞饮体。
(B)测量NDSB-201和衍生化合物的实例的蛋白转导活性、巨胞饮和巨胞饮体囊泡释放。按照所示,将细胞与具有不同转导化合物的700mOsmol/Kg下的转导缓冲液孵育,或者留下未处理。左图:MEF细胞中相对的β-内酰胺酶蛋白并入。将来自未处理的细胞的信号,设置在1。中间图:通过如前述处理的细胞中的TMR右旋糖酐并入,测量巨胞饮水平。通过测量每个细胞中右旋糖酐阳性囊泡的总面积,测定巨胞饮水平。右图:如前所述,处理Gal3-GFPMEF细胞。通过测量每个细胞中Gal3-GFP阳性囊泡的总面积,测定囊泡渗漏水平。
图17:由siRNA转导引起的人细胞的内源基因敲减
用25μM GAPDH和杂乱(Scrambled)siRNA转导KBM7和MCF7细胞,或留下不处理。转导后3天,通过Western印迹测定GAPDH蛋白水平。将微管蛋白水平显示为内参对照。
图18:使用重组Cas9蛋白和短向导RNA(sgRNA)同时转导的基因编辑
(A)在不同浓度的NaCl和NDSB-201(化合物#01)或GABA(化合物#20)下,重组Cas9蛋白的溶解性测试。通过半定量浊度分析测定蛋白聚集。用白色正方形表示透明溶液(没有cas9蛋白聚集)。用灰色正方形描述由Cas9聚集引起的浑浊溶液。
(B)在不同的时间点下,测定与具有NDSB-201或GABA的渗透胞吞缓冲液孵育的KBM7细胞中的BrdU并入率。未处理的细胞被认为是100%的BrdU并入。
(C)顶图:CRE重组酶报告基因的示意图。经慢病毒感染将EF1a-Lox-dsRED-Stop-Lox-EGFP/ires-PuroR构建体导入KBM7细胞,并且随后进行嘌呤霉素选择。获得的细胞含有多重拷贝的慢病毒报告基因构建体。未转导的细胞表达红色荧光蛋白。CRE介导的侧翼连有LoxP的dsRED终止盒的切除废除dsRed表达,并且诱导EGFP报告基因蛋白的表达。底图:在具有250mM GABA(化合物#20)的1250mOsmol/Kg下的渗透胞吞培养基中,用CRE蛋白转导KBM7细胞60min。上图表示绿色和红色通道的荧光图。下图表示以x轴绿色荧光和y轴红色荧光或事件频率示出的FACS图。在相应的区域中标出事件百分比。
(D)顶图:体外转录的含有20nt向导序列和80nt支架序列的小向导RNA的示意图。底图:重组提纯CAS9蛋白的蛋白凝胶。
(E)CRISPR-CAS9报告基因系统的示意图。用慢病毒载体转导KBM7细胞,所述慢病毒载体含有CRISPR-CAS靶序列和随后为dTomato基因的框外序列。CRISPR-CAS9引起的靶序列的DNA双链断裂,随后进行非同源末端连接(NHEJ)修复,引起DNA缺失和/或插入,其恢复dTomato阅读框并且引起细胞荧光。
(F)用CAS9蛋白和靶上的sgRNA转导CRISPR-CAS9报告基因KBM7细胞,或保留不处理。通过用CAS9蛋白和脱靶sgRNA转导细胞得到特异性对照。通过流式细胞术分析,测定dTomato阳性细胞的百分比。下图示出所指示条件的相对比和荧光图像。
图19:由CRISPR-CAS9转导引起的内源基因破坏
(A)WDR85基因和5种不同sgRNA的结合位点的示意图。
(B)CAS9-sgRNA转导和白喉毒素选择的示意图。用CAS9-sgRNA转导KBM7细胞两次。最后一轮转导后7天,将细胞与白喉毒素蛋白组分(PA(保护性抗原)和LFn-DTA(与白喉毒素融合的致死因子N端结构域))孵育。柱状图示出白喉毒素选择后2天的活细胞数。
(C)CRISPR-CAS9引起的KBM7细胞中内源WDR85基因突变的DNA序列。顶部示出野生型(WT)序列。起始密码子用加下划线的ATG显示。缺失通过破折号显示,以及插入用下划线文本显示。每一突变位点右边指出插入(+)或缺失(D)的大小。在括号中示出各个突变体分离的次数。注意到,对于数种靶序列,我们还鉴定延伸超出CRISPR/CAS9靶位点序列的较大缺失和/或插入。
(D)顶图:定量由CAS9-sgRNA转导引起的双等位基因的基因敲除的示意图。用CAS9-sgRNA转导KBM7细胞两次。3天后,通过利用流式细胞仪,将单细胞沉积在384孔板上来分离细胞。7天后,对生长克隆进行计数,并且用白喉毒素将其处理。2天后,对白喉毒素存活克隆进行计数。将WDR85敲除效率计算为,各自的白喉毒素存活克隆与最初获得的总单细胞克隆的百分比。底图:白喉毒素存活克隆的DNA序列。A1=等位基因1,A2=等位基因2。各个突变位点右边指出插入(+)或缺失(D)的大小。在括号中示出各个突变体分离的次数。注意到,对于数种靶序列,我们还鉴定延伸超出CRISPR/CAS9靶位点序列的较大缺失和/或插入。
实施例
实施例1
将小分子或大分子导入细胞的能力在研究和医学中获得重要应用。遗憾的是,细胞膜对许多生物学活性分子的导入呈现主要障碍。已投入巨大的努力用于向细胞导入核苷酸(DNA、RNA、siRNA)和/或治疗分子,并且虽然原代细胞依然造成挑战,但使用阳离子脂类、纳米颗粒或病毒载体作为跨膜载体已取得进展。比较起来,细胞内递送蛋白的新技术发展处于实际上的停顿状态。尽管如此,将蛋白导入细胞的能力将在疫苗发展、基因组编辑、表观遗传重编程、(干)细胞分化以及细胞内过程的操作中具有许多应用。因此,更需要研发更好的技术用于蛋白和其他大分子,特别是在原代细胞中的有效胞内递送。这里,我们描述了盐引起的高张性、小分子化合物和渗透保护剂的组合,在不影响细胞生活力的情况下促使将小分子和大分子强健且有效地导入原代细胞。我们提供如何在各种各样的原代细胞、干细胞系和它们的衍生物中导入蛋白、核苷酸、纳米球和大分子的实例。
虽然将蛋白导入细胞的能力在研究和医学中具有许多应用,但是将蛋白导入细胞的可靠、无毒且有效的方法依然缺乏。在1982年,Okada和Rechsteiner证明了,由0.5M蔗糖和10%PEG1000引起的高张处理,随后通过短暂的低张处理,诱导了将大分子和蛋白胞内吸收进永生化细胞系
几年后,来自Green
TAT-肽介导的蛋白转导的明显优势是,所述方法似乎适用于所有细胞类型,包括原代细胞,并且通常无毒。然而,TAT肽的强正电荷严重地妨碍了天然重组体TAT-融合蛋白在大肠杆菌中的产生,许多重组蛋白终止于包含体。此外,随后的研究证明,关于自我转导蛋白的某些较早报道实际上是细胞进行固定期间引入的实验人为假象的结果
蛋白转导试剂
我们寻找开发更可靠且更有效的蛋白转导的方法。因为细菌毒素通常为蛋白,其以非常高的效率被转导,我们假设这样的毒素系统(的部分)可作为递送重组蛋白的运输系统。为了测试该想法,我们分析当转录调节因子OCT4(POU5F1)与炭疽致死因子(LFn)的N端结构域融合时,其是否可被转导进细胞。为了该目标,我们生成由His-纯化标签、LFn-转导结构域、SUMO切割位点、人OCT4和VP16反式激活结构域组成的重组融合蛋白(图2A)。添加VP16反式激活结构域以进一步促进重组因子的转录活性。此外,我们生成缺乏LFn转导结构域或者LFn转导结构域和SUMO切割结构域的对照构建体(图2A)。通过用报告基因构建体转染COS7细胞生成COS7报告基因细胞,所述报告基因构建体含有6个重复oct4靶序列、随后是最小的TK启动子和萤火虫荧光素酶基因(图2B)。我们用无Oct4结合位点的荧光素酶报告基因载体转导COS7细胞作为对照(图2B)。为了控制转染效率的变化,我们用广泛表达的海肾-荧光素酶载体共转染COS7细胞(图2B)。转导的时间表在图2C中示出。用重组LFn-OCT4-SUMO1-VP16蛋白转导COS7细胞,导致荧光素酶报告基因活性的激活(图2D)。然而,出乎意料的是,缺乏LFn转导结构域的对照蛋白的对照转导表现类似,即使没有稍微更好的转导效率(图2D)。此外,缺乏LFn转导结构域和SUMO切割结构域的对照蛋白显示出向COS7细胞的高效转导,比得上用表达Oct4的慢病毒载体对细胞的对照感染(图2D)。
如上所述,短肽序列能够介导重组蛋白转导穿过细胞膜。因为我们将6x组氨酸(6xHis)标签添加至重组Oct4蛋白以便于蛋白纯化,所以我们评估Oct4蛋白转导是否被该肽标签介导。为了该目标,我们制备了图2E中所示的几种重组蛋白,其含有His-纯化标签(H6)和R11转导肽
上文的结果暗示,在转导肽序列不存在下转导了重组Oct4蛋白,并且促使我们测试向培养系统添加一种或多种组分是否为导致观察到的蛋白转导的原因。通过省略含有重组蛋白的缓冲液的各个组分(在图2G的图例中示出),我们鉴定出NaCl的高渗透压和非去污剂磺基甜菜碱201(NDSB 201)作为蛋白转导过程中的重要因子(图2G和2H),任一因子的省略废除了重组Oct4-VP16蛋白对Oct4-报告基因的激活。
时间、重量克分子渗透浓度、转导化合物浓度、蛋白浓度的影响
为了进一步表征蛋白转导过程,我们分析时间、重量克分子渗透浓度、转导化合物浓度和蛋白浓度对转导过程的影响。为了该目标,我们设置了β-内酰胺酶蛋白转导分析,并且利用CCF2-AM(细胞内荧光β-内酰胺酶的底物)测量细胞内β-内酰胺酶的活性,当CCF2-AM被酶切割时,其改变发射波长(图3A)。因而,发射荧光的改变是细胞内β-内酰胺酶活性的定量测量。虽然在我们最初的研究中,我们使用永生化COS7细胞系,但我们想要知道化合物介导的蛋白转导是否也允许将蛋白转导进原代细胞。因此,利用NaCl调节的高张培养基(700mOsm/Kg)和25mM NDSB201,我们用β-内酰胺酶(1μM最终浓度)转导鼠胚胎成纤维细胞(MEF)。在开始实验时,将β-内酰胺酶活性设置在1,并且将相对细胞内β-内酰胺酶活性测量为时间的函数(图3B,柱)。在存在25mM NSDB201的等张培养基中,测量β-内酰胺酶的转导作为对照(图3B,空心圆)。如图3B所示,在这些条件下,蛋白转导起始后2.5小时可观察到细胞内β-内酰胺酶的活性。更长的转导时间导致细胞内β-内酰胺酶活性的增加(图3B)。
为了确保观察到的β-内酰胺酶活性是转导的蛋白的结果,我们在转导培养基(25mM NDSB201和700mOsm/Kg)或添加25mM NDSB201的等张培养基中进行剂量效应测试,并且将β-内酰胺酶活性测量为β-内酰胺酶浓度的函数。用β-内酰胺酶蛋白转导MEF持续3小时,并且按照描述测量细胞内β-内酰胺酶活性。如图3C所示,在转导培养基中,β-内酰胺酶蛋白以浓度依赖方式被有效地转导。相反,在等张培养基中添加β-内酰胺酶蛋白时,没有观察到细胞内β-内酰胺酶活性。
这些结果证明了β-内酰胺酶分析的准确性,并且证明β-内酰胺酶蛋白以蛋白浓度依赖方式被转导进细胞。
其次,我们测量培养基张力对转导过程的影响。如上,在含有25mM NDSB201且用NaCl调节增加培养基张力的MEF培养基中,用1μMβ-内酰胺酶转导MEF持续3小时(图3D)。作为对照,在不存在转导的β-内酰胺酶蛋白下,我们将底物切割测量为培养基重量克分子渗透浓度的函数(图3D,空心圆),以核实培养基张力本身不影响β-内酰胺酶活性分析。如所示,增加的NaCl浓度导致增加的β-内酰胺酶的转导,在大约700-800mOsm/Kg下具有最大的转导。在超过850mOsm/Kg的重量克分子渗透浓度下,我们观察到细胞的损失,大概是由于高的培养基张力的毒性。
最后,我们探索转导化合物NDSB201的浓度对β-内酰胺酶转导的影响。再一次,在用NaCl调节至700mOsm/kg且不同NDSB201浓度的高张MEF培养基中,用β-内酰胺酶(1μM最终浓度)转导MEF持续3小时(图3E)。将β-内酰胺酶转导测量为等张培养基中不同NDSB201浓度的函数作为对照(图3E,空心圆)。增加的NSDB201浓度导致β-内酰胺酶转导的瞬时增加,在10-25mM NSDB201下达到最高点(图3E)。在高渗的条件下,更高的NSDB201浓度导致细胞损失。
上文的结果表明,蛋白转导依赖于蛋白浓度、转导时间、NDSB201浓度和NaCl调节的培养基张力。
渗透保护剂的添加改善高张压力
我们注意到,虽然NaCl引起的高渗透压和NDSB201的组合允许蛋白的有效转导,但是其似乎影响细胞增殖和细胞存活,并且高的培养基张力和/或高的NSDB201浓度似乎对细胞具有有害的影响。高渗压力显示出引起哺乳动物细胞的细胞周期停滞和细胞凋亡
渗透保护剂为通过以下方式帮助细胞处理渗透压力的化合物:其在胞质溶胶中积累,从而平衡细胞内和细胞外环境之间的渗透差。我们测试向培养基添加渗透保护剂(图4B中所示)是否防止蛋白转导期间的细胞周期停滞。如前所述,转导开始后24小时,我们测量BrdU并入。如图4B中所示,在被NaCl调节至700mOsm/Kg并且具有25mM NDSB201、添加单独或组合的渗透保护剂的MEF培养基中,将β-内酰胺酶蛋白转导3小时。如所示,蛋白转导期间渗透保护剂的添加改善了由转导培养基引起的细胞周期停滞。甘油和甘氨酸的组合在改善MEF中的细胞增殖阻滞方面显示最有效,并且在700mOsm/Kg下3小时的转导期间以及500mOsm/Kg下12小时的转导期间均有效(图4C)。其次,我们测试渗透保护剂是否还可阻止其他细胞类型的转导期间的细胞周期阻滞。为了该目的,我们转导鼠ESC,在700mOsm/Kg下3小时或者500mOsm/Kg下12小时。虽然甘油和甘氨酸的渗透保护剂组合在防止700mOsm/Kg下mESC的细胞增殖的减少方面效率低,但是其能够使500mOsm/Kg下12小时的转导期间的细胞增殖持续(图4D)。最后,我们测试渗透保护剂的添加是否允许多轮连续的蛋白转导,同时防止细胞周期停滞。我们对500mOsm/Kg下的mESC进行了多轮12小时的转导,具有中间12小时的恢复期。如图4E所示,在渗透保护剂的存在下,多轮转导被mESC很好地耐受,对细胞增殖没有明显的负面影响。
蛋白转导需要经巨胞饮的主动细胞吸收
为了进一步仔细分析培养基高张性引起蛋白转导的机理,我们探索所述效果是否特定于用来增加培养基重量克分子渗透浓度的NaCl。在NDSB201(25mM)和渗透保护剂的存在下,并且使用NaCl或者根据元素周期表的相关盐(包括LiCl、KCl、CsCl和RbCl)将培养基张力调节至700mOsm/Kg,用β-内酰胺酶转导MEF持续3小时。如图5A所示,所有钠相关的盐具有蛋白转导活性,Na和Rb表现出最高活性。此外,我们测试其他Na盐是否可引起蛋白吸收。如图5A所示,葡糖酸钠以类似于NaCl和RbCl的效率有效地介导β-内酰胺酶转导。最后,我们测试使用不相关的化合物增加培养基张力是否也引发蛋白转导。如图5A所示,在700mOsm/Kg下,蔗糖、乳果糖、山梨糖醇和甘露醇均未能引起蛋白转导,暗示蛋白转导特定地依赖于钠或钠相关的盐引起的高张性。
因为引发蛋白转导的条件需要被Na+和相关离子特定地引起的高张性,所以仅仅通过提高质膜的透化似乎不太可能发生转导。我们假设,蛋白转导涉及主动的胞吞运输模式,并且使用不同类型胞吞作用的特异性抑制剂来探索被我们的蛋白转导缓冲液利用的进入机制。正如预料的那样,用细胞松弛素D或拉春库林A、肌动蛋白聚合和囊泡运输的特异性抑制剂处理细胞,完全地阻塞了蛋白转导(图5B),证实了蛋白转导需要肌动蛋白的重塑。然而,胞吞作用的特异性抑制剂,包括Pitstop2和氯丙嗪(网格蛋白介导的胞吞作用的抑制剂),以及Dynasore和制霉菌素(小窝蛋白介导的胞吞作用的抑制剂),在抑制蛋白转导方面均无效(图5B)。这些数据暗示,蛋白转导不是通过经典的网格蛋白介导或小窝蛋白介导的胞吞途径发生的。不同于其他类型的胞吞作用,巨胞饮独特地易受Na+/H+交换的抑制剂影响。有趣的是,蛋白转导被Na+/H+交换的特异性抑制剂(如EIPA或DMA)、钠-氢逆向转导体(Nhe)蛋白家族的特异性抑制剂强烈地抑制(图5B)。这些数据暗示,蛋白转导过程涉及外源施加物质通过巨胞饮的主动细胞吸收。
钠-氢逆向转导体-1(Nhe1)是广泛表达的Na+/H+交换因子,其功能是调节脊椎动物细胞的细胞体积和细胞内pH。在应答渗透压力时其被激活,导致挤出细胞内H+离子来交换细胞外Na+。尽管这种交换本身是渗透中性的,但是挤出的H+被细胞内缓冲液替换,导致细胞内体积克分子渗透浓度的净增加和由渗透作用带来的细胞体积的增加。此外,Nhe1的激活诱导巨胞饮介导的来自细胞外空间的主动液体吸收。虽然Nhe1激活和巨胞饮之间精确的分子联系依然不清楚,但是实验证据暗示,通过Nhe1局部调整质膜附近的细胞内pH是肌动蛋白聚合和巨胞饮体的形成必需的
Nhe1的激活剂提高蛋白转导
我们发现Nhe1为蛋白转导的重要中介体,促使我们探索Nhe1的激活剂是否可提高蛋白转导过程。数种生长因子显示出通过激活Nhe1诱导巨胞饮,并且提高Na+/H+交换
蛋白转导化合物的化学特性
我们发现盐引起的高张性与NDSB201的组合引发有效的蛋白转导,促使我们探索其他非去污剂磺基甜菜碱是否也可引发蛋白转导。我们测试六种可商购的NDSB(图6A中所示的化学结构)的蛋白转导活性。图6A示出通过均为25mM最终浓度的NDSB201(#01)以及5种其他NDSB化合物(#02-06),将β-内酰胺酶(700mOSm/Kg下3小时)转导进MEF。空心圆表示蛋白转导开始后24小时测量的BrdU并入。这些结果表明,虽然所有的NDSB化合物促进蛋白转导,但它们在转导效率和对细胞增殖的影响方面不同。在β-内酰胺酶转导中,NDSB201(#01)和NDSB221(#03)似乎最有效,并且因此我们探索这两种化合物的其他变体。
NDSB由一组非常不同的化合物组成,所述化合物由将一侧的磺酸端与另一侧的四价氮原子隔开的2-6个碳骨架组成。我们首先探索磺酸基团是否可被其他端基代替,将#01和#03中的磺酸替换为羧酸(得到化合物#10和#11,图6B)或酰胺(得到化合物#43和#15,图6B)。如图6B的柱状图所示,磺酸的替换对转导效率没有负面影响。然而,所述替换进一步减少转导缓冲液对细胞周期的负面影响,如通过提高的BrdU吸收所示(图6B,空心圆)。此外,转导化合物中的吡啶或哌啶环结构(分别为化合物#01和#03)也可被替换为四价胺的三价体(化合物#20和#29,图6B),转导活性没有明显变化。其次,我们检查酰胺供出质子(化合物#29和#15)的能力是否为转导活性必须的,通过用CH3替换一个或两个质子(得到化合物#30、#31和#34)。如所示,该甲基替换提高所述化合物的转导活性(图6B)。最后,我们检查了磺酸的生物电子等排体(化合物#45)或转导化合物的二聚化(化合物#42)是否影响转导活性。如图6B所示,相比于原始NDSB201(#01),化合物#45和#42表现出高的转导效率,并具有等同或更好的细胞增殖(图6B)。
因此,原始转导化合物NDSB201(#01)上的变体表明,关于吡啶环和磺酸的替换存在基本上的化学自由,其可被上文所描述的结构替换。氮的四价和/或其在环结构中的并入以及磺酸的质子供体特性均显示出对转导活性不重要。然而,所有测试的有效替换具有被疏水碳链隔开的亲水末端。因此,我们接着检查由疏水CH3基团替换这些亲水端基是否影响转导活性。我们比较NDSB195(#06)和两种衍生物的活性,在所述两种衍生物中,氮(#07)或磺酸(#08)分别被C或CH3代替(图6C)。此外,我们探索这些替换对具有三价氮和羧酸端的转导化合物的影响(图6C,#20和衍生的#23和#24)。如图6C的图表所示,每一基团的碳替换大大地减少了化合物的转导活性。而且,替换的化合物(#07、#08、#23和#24)显示出严重的细胞周期抑制(图6C,空心圆)。因此,虽然转导化合物允许在其末端基本上自由,但是在碳链的每一端优选亲水基团。
亲水端被3-碳链隔开。然后,我们测试碳链的长度对转导活性是否是关键的。我们测试链中具有1个(#18)、2个(#13和#19)、3个(参考化合物#11和#20)、4个(#12和#21)和5个(#22)碳的化合物。如图6D所示,在参考化合物(3-碳链)中,转导活性最高。具有5-碳链的化合物(图6D,#22)表现出类似的转导活性,但是显示减少的细胞周期进展。从我们的结果,呈现出虽然具有2-5碳链长度的化合物显示转导活性,但是优选3-碳链。
如上文所证明的,出乎意料的是众多化合物显示转导活性。为了进一步仔细分析有效的蛋白转导化合物的化学特性,我们探索了一系列非去污剂磺基甜菜碱相关化合物的蛋白转导活性。在图6E与表1的附图中示出了,测试化合物的全部名单以及显示蛋白转导活性以及它们对细胞增殖影响的图表。参考化合物NDSB201(#01)用蓝色表示。如所示,转导化合物显示宽范围的转导活性和细胞增殖。这促使我们测试转导化合物的组合对转导活性和/或细胞增殖是否具有加性效应或甚至协同效应。图6F显示转导化合物的不同组合的结果。参考化合物NDSB201(#01)的转导效率,设置在100%(图6F,蓝色柱)。具有单个碳链的甘氨酸(#18)显示弱的转导活性(参考化合物的9%,图6F)。当甘氨酸与参考转导化合物以等摩尔浓度组合时(各为12.5mM),转导活性为大约15%,表明组合的化合物不具有加成效应,而是具有最低转导活性的化合物控制总活性。当我们的参考化合物与本身显示180%转导效率的化合物#34组合时,这被进一步例证。然而,其与参考化合物的组合使得转导活性下降至120%。当将具有类似转导活性的化合物组合时(参考化合物#01和化合物#20),转导活性在很大程度上保持不变(图6F)。
我们测试的NDSB201衍生物之一是γ-氨基丁酸(GABA,化合物#20),其为脑中的重要神经递质。GABA的作用是刺激GABA-受体的激活,已鉴定出其中的三类:GABA-A、GABA-B和GABA-C。有趣的是,GABA受体被非常宽范围的化学结构刺激,从诸如乙醇和GABA本身的简单结构至看似不相关的苯并二氮杂卓、蝇蕈醇、巴氯芬以及一系列其他化合物。因为有效的蛋白转导化合物的化学结构也显示大的自由度,所以我们探索GABA信号转导在蛋白转导作用中是否发挥积极作用。我们测试具体的GABA激动剂对β-内酰胺酶转导的影响。在GABA激动剂蝇蕈醇和SKF-97541的存在或不存在下,在700mOsm/Kg下且具有25mM NDSB201时,用1μMβ-内酰胺酶转导MEF持续3小时。如图6G所示,GABA激动剂的添加将蛋白转导提高大约300%(图6G)。
鼠胚胎干细胞的蛋白转导
为了更详细地探索鼠胚胎干细胞的蛋白转导,我们使用转基因mESC系,其中CRE-重组酶可诱导的报告基因被稳定地整合在ColA1基因座上
诱导的人多能性干细胞(iPSC)的蛋白转导
为了探索我们的转导缓冲液是否也允许诱导的人多能性干细胞(iPSC)的转导,我们采用与用于鼠ESC(图7)类似的有轻微调整的策略。我们用慢病毒报告基因转导人iPSC,其基于CRE-重组酶的蛋白转导,导致表达的dsRed荧光报告基因的去除,以及随后eGFP报告基因的激活(图8A)。从而,成功转导的hiPSC的荧光信号会从红色变化至绿色。正如鼠ESC的情况一样,用5μM CRE蛋白转导人iPSC导致dsRed报告基因的有效去除,以及通过流式细胞术分析的在64%细胞中eGFP表达的变化(图8B,左边两图,500mOsm/Kg下12小时的转导)。注意到,某些细胞对GFP和dsRed保持双阳性。这是由于这样的事实,即多拷贝的慢病毒报告基因构建体存在于iPSC中,不是所有的拷贝被同步损失(loxed-out)。Tat-HA2融合肽的添加将转导效率进一步增加至77%(图8B,中间图)。在没有添加tat-HA2融合肽的情况下,两轮CRE蛋白转导得到78%eGFP细胞,并且当添加5μMTat-HA2融合肽时,得到84%GFP+hiPSC。图8C示出(图8B)中细胞的荧光显微图像。
鼠和人神经干细胞、神经元和神经胶质的蛋白转导
使用上文描述的CRE重组酶介导的红色至绿色报告基因变化的类似策略,评估鼠和人神经元、神经胶质和神经干细胞的转导。图9A描述所述分析的示意图。鼠神经球的CRE蛋白转导,导致eGFP报告基因的有效激活(图9B,左图)。同样地,用5μM CRE转导人iPSC源神经胶质细胞和神经元,导致eGFP报告基因的有效激活。因为利用慢病毒感染将荧光报告基因构建体导入iPSC源神经胶质细胞和神经元,所以细胞很可能并入该报告基因的多重拷贝。因此,虽然CRE蛋白转导导致eGFP报告基因的有效激活,但是细胞持续表达来自该报告基因其他拷贝的dsRed。
参考文献:
1.Okada,C.Y.&Rechsteiner,M.Introduction of macromolecules intocultured mammalian cells by osmotic lysis of pinocytic vesicles.Cell29,33–41(1982).
2.Beard,C.,Hochedlinger,K.,Plath,K.,Wutz,A.&Jaenisch,R.Efficientmethod to generate single-copy transgenic mice by site-specific integrationin embryonic stem cells.Genesis New York NY 2000 44,23–28(2006).
3.Green,M.&Loewenstein,P.M.Autonomous functional domains ofchemically synthesized human immunodeficiency virus tat trans-activatorprotein.Cell 55,1179–1188(1988).
4.Frankel,A.D.&Pabo,C.O.Cellular uptake of the tat protein from humanimmunodeficiency virus.Cell 55,1189–1193(1988).
5.Mann,D.A.&Frankel,A.D.Endocytosis and targeting of exogenous HIV-1Tat protein.the The European Molecular Biology Organization Journal 10,1733–1739(1991).
6.Fawell,S.et al.Tat-mediated delivery of heterologous proteins intocells.Proceedings of the National Academy of Sciences of the United States ofAmerica 91,664–8(1994).
7.Nagahara,H.et al.Transduction of full-length TAT fusion proteinsinto mammalian cells:TAT-p27Kip1 induces cell migration.Nature medicine 4,1449–52(1998).
8.Lundberg,M.&Johansson,M.Is VP22 nuclear homing an artifact?Naturebiotechnology 19,713–4(2001).
9.Hsieh,J.-T.,Zhou,J.,Gore,C.&Zimmern,P.R11,a novel cell-permeablepeptide,as an intravesical delivery vehicle.BJU international 108,1666–71(2011).
10.Kültz,D.,Madhany,S.&Burg,M.B.Hyperosmolality causes growth arrestof murine kidney cells.Induction of GADD45 and GADD153 by osmosensing viastress-activated protein kinase 2.The Journal of biological chemistry 273,13645–51(1998).
11.Luo,L.,Li,D.-Q.&Pflugfelder,S.C.Hyperosmolarity-induced apoptosisin human corneal epithelial cells is mediated by cytochrome c and MAPKpathways.Cornea 26,452–60(2007).
12.Reinehr,R.,Graf,D.,Fischer,R.,Schliess,F.&
13.Dawson,K.M.&Baltz,J.M.Organic osmolytes and embryos:substrates ofthe Gly and beta transport systems protect mouse zygotes against the effectsof raised osmolarity.Biology of reproduction 56,1550–8(1997).
14.Koivusalo,M.et al.Amiloride inhibits macropinocytosis by loweringsubmembranous pH and preventing Rac1 and Cdc42 signaling.The Journal of cellbiology 188,547–63(2010).
15.Jenkins,E.C.et al.Intracellular pH regulation by Na
16.Chiang,Y.,Chou,C.-Y.,Hsu,K.-F.,Huang,Y.-F.&Shen,M.-R.EGFupregulates Na+/H+exchanger NHE1 by post-translational regulation that isimportant for cervical cancer cell invasiveness.Journal of cellularphysiology 214,810–9(2008).
17.Rigor,R.R.,Damoc,C.,Phinney,B.S.&Cala,P.M.Phosphorylation andactivation of the plasma membrane Na+/H+exchanger(NHE1)during osmotic cellshrinkage.PloS one 6,e29210(2011).
18.Tattersall,A.L.&Wilkins,R.J.Modulation of Na+-H+exchange isoformsNHE1 and NHE3 by insulin-like growth factor-1in isolated bovine articularchondrocytes.Journal of orthopaedic research:official publication of theOrthopaedic Research Society 26,1428–33(2008).
19.Tattersall,A.L.,Browning,J.A.&Wilkins,R.J.Modulation of H+transport mechanisms by interleukin-1in isolated bovine articularchondrocytes.Cellular physiology and biochemistry:international journal ofexperimental cellular physiology,biochemistry,and pharmacology 16,43–50(2005).
20.Wadia,J.S.,Stan,R.V&Dowdy,S.F.Transducible TAT-HA fusogenicpeptide enhances escape of TAT-fusion proteins after lipid raftmacropinocytosis.Nature Medicine 10,310–315(2004).
材料和方法
含4.5g/l葡萄糖的DMEM(Life technologies,cat.31966-021).
含4.5g/l葡萄糖的无酚红DMEM(Life technologies,cat.21063-029).
不含钙和镁的DPBS(Life technologies,cat.14190-094).
L-谷氨酰胺,100x(Life technologies,cat.25030-123).
NEAA;非必需氨基酸溶液,100x(NEAA;Life technologies,cat.11140-035).
2-巯基乙醇溶液,14.3M(Sigma,cat.M3148-25ml).
青霉素/链霉素溶液,100x(Life technologies,cat.15140-130).
0.05%胰蛋白酶-EDTA(Life technologies,cat.25300-054).
明胶(Sigma,cat.no.G1890)(see REAGENT SETUP).
嘌呤霉素(Life technologies,Cat A11138-03).
mTeSR1
TeSR
基质胶-低生长因子(BD,Cat.354230).
分散酶(StemCell technologies,cat.7923).
鼠胚胎成纤维细胞(MEF)血清(Sigma,Cat.F7524).
鼠胚胎干细胞(mES)血清(Greiner Bio-One,Cat.758073).
5x转导缓冲液(参见试剂配制).
MEF培养基(参见试剂配制).
mES培养基(参见试剂配制).
mES转导培养基(参见试剂配制).
神经干细胞培养基(参见试剂配制).
N2补充剂,100x(Life technologies,cat.17502-048).
B27补充剂,50x(Life technologies,cat.12587-010).
溶菌酶(Sigma,Cat.L6876-1G).
核酸酶核酸内切酶(Sigma,Cat.E1014-25KU).
咪唑(Sigma,Cat.I5513-5G).
NDSB-201(Sigma,Cat.82804-50G).
NDCB-165(SYNCOM B.V.,The Netherlands).
甘油(Sigma,Cat.G2025).
甘氨酸(Sigma,Cat.50046).
NaCl–氯化钠(Sigma,Cat.S5886).
NaH
MgCl
细胞增殖ELISA,BrdU(Roche,Cat.11669915001).
半胱天冬酶-Glo 3/7分析(Promega,Cat,G8090).
EGF(Life Technologies,Cat.PHG0311).
FGF2(Life Technologies,Cat.13256-029).
PDGF(Life Technologies,Cat.PMG0044).
胰岛素(Sigma,Cat.I9278-5ML).
IGF(R&D Systems,Cat.791-MG-050).
TAT-HA2融合肽(Eurogentec Nederland b.v.,Cat.AS-64876).
INF7-TAT融合肽(Eurogentec Nederland b.v.,Cat.AS-64908).
伴侣质粒集(TAKARA,cat.3340).
氨苄青霉素(Sigma,Cat.A9518).
氯霉素(Sigma,Cat.C0378).
hLIF(人白血病抑制因子,储液1000x;R&D systems,Cat.7734-LF-025).
考马斯亮蓝染色(Biorad,Cat.161-0786).
CCF2-AM上样试剂盒(Life Technologies,Cat.K1032).
多聚-D-赖氨酸氢溴酸盐(Sigma,Cat.P6407).
设备
镍NTA超流柱(Qiagen,Cat.30622).
浓缩器式Ultra-15离心超滤装置(Millipore,Cat.UFC903008).
Zeba自旋脱盐柱(Thermo Scientific,Cat.87772).
96孔板透明底黑色聚苯乙烯TC(Corning,Cat.3603).
100mm组织培养皿(Greiner Bio-one,Cat.664160).
6孔组织培养板(Greiner Bio-one,cat.657160).
24孔组织培养板(Greiner Bio-one,cat.662160).
96孔组织培养板(Greiner Bio-one,cat.655180).
2ml塑料一次性移液管(Greiner Bio-one,cat.710180).
5ml塑料一次性移液管(Greiner Bio-one,cat.606188).
10ml塑料一次性移液管(Greiner Bio-one,cat.no.607188).
50ml塑料一次性移液管(Greiner Bio-one,cat.768180).
0.22mm孔径过滤器(Millex GP;Millipore,cat.SLGP033RS).
0.45mm孔径乙酸纤维素过滤器(FP30/0.45CA-S,Schleicher&Schuell).
10ml一次性注射器(Terumo,cat.SS-10ESZ).
解剖钳!注意用高压灭菌锅灭菌.
解剖刀!注意用高压灭菌锅灭菌.
光度计(Berthold Technologies,Centro XS
荧光计(Molecular Devices,SpectraMax M5e).
荧光显微镜(Nikon,Eclipse TS100).
流式细胞仪(BD Biosciences,FACS-ARIAII).
所用术语:
转导:靶分子(小分子、聚合体、肽、蛋白、RNA、DNA、siRNA或纳米结构)的细胞内递送
转导靶标:通过转导导入的分子(小分子、聚合体、肽、蛋白、RNA、DNA、siRNA或纳米结构)
转导高张性:引起转导的培养基高张性
试剂配制
5X转导缓冲液
25mM NaH
1x转导缓冲液500
为了制备1x转导缓冲液500,将含有目标蛋白的1体积5x转导缓冲液与4体积等张细胞培养基组合,以达到最终500mOsm/Kg的张力。
1x转导缓冲液700
为了制备1x转导缓冲液700,将含有目标蛋白的1体积5x转导缓冲液与4体积等张细胞培养基组合。最后,添加适当量的NaCl或RbCl盐,以达到最终700mOsm/Kg的张力。
MEF培养基
含有10%FBS以及50U/ml青霉素和50mg/ml链霉素的DMEM。为了制备500ml MEF培养基,将50ml MEF血清和2.5ml青霉素/链霉素混合,然后用DMEM填补至500ml。在4℃下储存。
神经干细胞培养基
含有1xB27和10ng/ml EGF以及50U青霉素和50mg/ml链霉素的DMEM/F12。为了制备500ml神经干细胞培养基,将10ml B27和2.5ml青霉素/链霉素混合,然后用DMEM/F12填补至500ml。在4℃下储存。
mES培养基
含有15%FBS(体积/体积)的DMEM、2mM L-谷氨酰胺、10mM NEAA、1x10
mES转导培养基(用于mES细胞)
含有1xN2和1xB27(体积/体积)、2mM L-谷氨酰胺、10mM NEAA、1x10
培养瓶的明胶包被
使1g明胶粉末溶解于100ml蒸馏水,高压灭菌,并且在4℃下储存,作为10×明胶储液。为了制备0.1%(1×)明胶溶液,使10×明胶储液在微波炉和/或高压灭菌器中融解,并且然后将50ml 10×溶液添加至450ml蒸馏水。用0.22μm过滤器装置过滤溶液,并且在4℃下储存。为了包被培养皿,添加适当体积的0.1%(1×)明胶溶液,以覆盖平皿底部的整个区域。例如,将1、3或5ml明胶溶液分别用于35-、60-或100-mm平皿。在无菌环境中,37℃下将平皿孵育至少30分钟。使用之前,吸出过量的明胶溶液。
将明胶储液制备为10×浓度(1%w/v)储液
方法:
细胞培养
通过分离怀孕13.5天小鼠的胚胎获得鼠胚胎成纤维细胞(MEF)。首先,用磷酸盐缓冲液(PBS)洗涤所述胚胎,并且移出头部和内脏组织。剩余组织在冷PBS中洗涤,用一把剪刀将其剪碎,并且在0.1mM胰蛋白酶/1mM EDTA溶液(每一胚胎3ml)中于37℃孵育20分钟。孵育之后,向每一胚胎添加另外3ml 0.1mM胰蛋白酶/1mM EDTA溶液,并于37℃将混合物再次孵育20分钟。胰蛋白酶消化之后,向每一胚胎添加6ml MEF培养基,并且用移液器上下吹吸数次以帮助组织解离。当组织/培养基混合物于室温下孵育5分钟之后,将上清液移入新管。通过离心(在4℃下,200x g 5分钟)收集细胞,并重悬于MEF培养基中。于37℃、5%CO
通过用含有EF1-α载体的慢病毒颗粒转导MEF细胞制备Lox-RFP/STOP-Lox-eGFPMEF细胞,所述EF1-α载体促使与IRES-嘌呤霉素抗性基因耦合的Lox-RFP/STOP-Lox-eGFP盒的表达。48小时的转导之后,将细胞在具有1μg/ml嘌呤霉素的MEF培养基中培养1周。7天的选择之后,几乎所有都细胞表达了RFP标志物。将细胞维持在具有1μg/ml嘌呤霉素的MEF培养基中。将传代N°3的细胞冷冻,用于将来的实验。
IB10 mES细胞获自Hans Clevers博士的实验室(Hubrecht Institute,TheNetherlands)。V6.5 ES细胞为来自Rudolf Jaenisch博士实验室的赠送。Lox-Stop-Lox-GFP mES细胞是Konrad Hochedlinger博士赠送。将所有mES细胞维持在mES培养基中已辐射MEF细胞层上。
如前所述,从怀孕14天小鼠的胚胎头部获得小鼠胚胎神经干细胞(REF1)。将细胞在含有10ng/ml EGF的神经干细胞培养基中维持。2周后,可以观察到神经球的形成。通过用表达与IRES嘌呤霉素抗性基因耦合的Lox-RFP/STOP-Lox-eGFP盒的慢病毒颗粒转导细胞,生成Lox-RFP/STOP-Lox-eGFP转基因神经干细胞。慢病毒转导神经干细胞后2天,将嘌呤霉素以0.75μg/ml的浓度加至培养基。10天的选择之后,超过95%的细胞表达了RFP。将细胞在具有0.75μg/ml嘌呤霉素的神经干细胞培养基中维持。
37℃下在mTeSR1或mTeSR-E8培养基的基质胶上培养人胚胎干细胞。每天更换培养基。通过用表达与IRES-嘌呤霉素抗性基因耦合的Lox-RFP/STOP-Lox-eGFP盒的慢病毒颗粒转导细胞,生成Lox-RFP/STOP-Lox-eGFP转基因H1细胞。慢病毒转导人ES细胞后2天,将嘌呤霉素以0.75μg/ml的浓度加至mTeSR1培养基。10天的选择之后,超过95%细胞表达了RFP。将细胞维持在具有0.75μg/ml嘌呤霉素的mTeSR1或TeSR-E8培养基。
蛋白表达、纯化和转导缓冲液中的缓冲液交换
从与具有目标基因的表达质粒pET15一起的具有分子伴侣的大肠杆菌菌株BL21(DE3)过表达且纯化蛋白。数组分子伴侣可购自Takara,并且对于每种蛋白,可根据制造商方案提供的分子伴侣质粒集确定最佳分子伴侣。将过夜培养物以1:100加至含有50μg/mL氨苄青霉素和20μg/ml氯霉素的x mL LB培养基,并且置于振动的37℃培养箱中。使培养物生长至OD600达到0.75,此时将培养物在16℃下振动培养。1小时后,以1mM的浓度添加IPTG,并且将培养物在16℃下振动培养16小时。通过离心收集细胞,并且通过用溶菌酶(1mg/mL)和核酸酶(1U/ml)在4℃下处理1小时将其裂解。通过离心将裂解物清除,并且将上清液上样至Ni-NTA柱。通过5x转导缓冲液中的咪唑梯度来洗脱蛋白。每一洗脱级分进行SDS凝胶电泳和考马斯亮蓝染色后,将高纯度的蛋白级分合并,并且通过浓缩器式过滤器将其浓缩。为了去除咪唑,根据制造商的说明书使用Zeba自旋脱盐柱,并且用5x转导缓冲液洗脱蛋白。这时可将蛋白进一步纯化或者等分,并且在液氮中迅速冷冻。少部分的蛋白溶液被用来进行蛋白定量,通过Bradford分析和SDS凝胶电泳联合考马斯亮蓝染色来分别地测定蛋白浓度和纯度。在我们的操作下,可以将5x转导缓冲液中的数种蛋白多次冻融,具有最低的活性损失。
转导
为了确定最佳转导条件,对于每种具体细胞类型,需要优化数个参数。具体地,这些参数是:张力和引起张力的盐类型、转导时间、渗透保护剂的类型和浓度、转导化合物的类型和浓度。下文列出优化各个参数的具体步骤。对于所有原代细胞和目前为止测试的细胞系,我们主要使用两种不同的转导方案。我们使用不含抗生素的培养基用于转导。虽然转导在血清的存在下起作用,但是我们发现其在无血清的条件下最有效。
对于具体的靶细胞类型和渗透胞吞的靶标,我们确定两种转导方案中哪种运作最好,作为优化的起点。由此,依据转导效率、细胞存活、细胞增殖和细胞功能,可按照下文的概述进一步优化能得到最好结果的转导缓冲液。在第一方案中,在500mOsm/Kg的张力下,转导进行12小时(方案12/500)。简言之,在蛋白转导前一天,将细胞接种于不含抗生素的适当培养基。第二天,制备具有渗透胞吞的靶标的1x转导缓冲液500。简言之,将5x转导缓冲液和渗透胞吞的靶标与细胞培养基混合,以获得张力500mOsm/KG下的1x转导缓冲液。向细胞添加该培养基/转导缓冲液/渗透胞吞的靶标的混合物。将细胞与转导缓冲液中的蛋白孵育12小时,此后将转导培养基移出,并且更换为常规培养基。
在第二方案中,在张力700mOsm/Kg下,蛋白转导进行3小时(方案3/700)。简言之,转导前1天,将细胞接种于不含抗生素的适当培养基中。第二天,如上文所述,制备具有渗透胞吞的靶标的1x转导缓冲液500。最后,添加NaCl或RbCl或其他引起转导高张性的盐(参见下文),以将最终张力调节至700mOsm/Kg。例如,向98μl 1x转导缓冲液500添加2μl 5MNaCl,以获得最终张力700mOsm/Kg。
在下文的实施例中,按照下文概述,通过转导β-内酰胺酶或Cre蛋白,我们测试12/500和3/700方案的效率。然而,可使用其他报告基因分子测量针对转导缓冲液的效率和靶细胞应答,所述报告基因分子包括但不限于,例如报告基因DNA、RNA、siRNA、circRNA、小分子和/或荧光探针。
向细胞添加培养基/转导缓冲液/和靶渗透胞吞的分子的混合物。将细胞与转导缓冲液中的蛋白孵育3小时。此后将转导培养基移出,并且更换为常规培养基。
可进行随后多轮的转导,恢复时间间隔通常为12至24小时。
β-内酰胺酶的转导测量
使用上文的3/700方案,在鼠胚胎成纤维细胞(MEF)中进行β-内酰胺酶转导。在室温下,用0.15mg/ml多聚-D-赖氨酸包被黑色透明底的96孔板1小时。在不含抗生素的MEF培养基中,每孔接种12,000个MEF细胞。第二天,使用上文描述的转导方案3/700,对细胞进行转导。将5x转导缓冲液中的β-内酰胺酶蛋白,以1/5用不含抗生素的无酚红DMEM培养基稀释。添加Na盐或Rb盐以将最终张力调节至700mOsm/Kg。然后向细胞添加完全混合物。3小时后,转导培养基被新鲜的MEF培养基代替,孵育30分钟。随后,用无酚红DMEM将细胞洗涤一次。使用CCF2-AM试剂盒,按照制造商的说明书测量β-内酰胺酶活性。简言之,每孔添加120μl CCF2-AM上样培养基,并且在室温下将细胞孵育1小时。用无酚红的DMEM将细胞洗涤两次,并且孵育另外30-60分钟。按照制造商的说明书,在409nm和510nm处测量荧光发射。所有测试进行三个重复。
使用12/500方案(上文),以相同的方式进行mES细胞中的β-内酰胺酶转导。以每孔75,000个细胞将mES细胞接种于明胶包被的mES培养基的96孔板中。第二天,使用上文描述的转导方案12/500,对细胞进行转导。然后,将5x转导缓冲液中的β-内酰胺酶蛋白,以1/5用mES转导培养基稀释。然后向细胞添加完全混合物。12小时的转导之后,用无酚红的DMEM将细胞洗涤两次。使用CCF2-AM试剂盒,按照制造商的说明书测量β-内酰胺酶活性。简言之,向每孔添加120μlCCF2-AM上样培养基,并且在室温下将细胞孵育1小时。用无酚红的DMEM培养基将细胞洗涤两次,并且孵育另外30-60分钟。按照制造商的说明书,在409nm和510nm处读取荧光发射并且进行分析。所有测试进行三个重复。
实施例2:CRE转导和CRE并入的定量
按照方案3/700,以96孔模式用CRE转导MEF。简言之,在使用MEF培养基的明胶包被的板中,每孔接种12,000个Lox-RFP/STOP-Lox-eGFP MEF细胞。第二天,将5x转导缓冲液中的CRE蛋白,以1/5用不含抗生素的无酚红DMEM稀释。然后向细胞添加完全混合物。3小时的转导之后,培养基被新鲜的mES培养基替换,并且孵育24-48小时。然后通过测量荧光显微镜或流式细胞仪中的绿色和红色信号,对细胞进行分析。
按照方案12/500,以96孔模式用CRE转导mES细胞。简言之,在使用mES培养基的明胶包被的板中,每孔接种75,000个Lox-STOP-Lox-GFP mES细胞。第二天,将5x转导缓冲液中的Cre蛋白,以1/5用mES转导培养基稀释。然后向细胞添加完全混合物。12小时后,转导培养基被mES培养基替换,并且将细胞孵育24-48小时。然后通过测量荧光显微镜或流式细胞仪中的绿色信号,对细胞进行分析。
按照转导方案12/500,用CRE蛋白转导小鼠神经干Lox-RED/STOP-Lox-eGFP细胞。将神经球转移至具有80μl神经元干细胞培养基的96孔板。之后,向细胞添加20μl 5x转导缓冲液中的CRE,并且小心地混合。12小时后,转导培养基被新鲜神经干细胞培养基替换,并且将细胞孵育24-48小时。然后,通过测量荧光显微镜或流式细胞仪中的绿色和红色信号,对细胞进行分析。
按照方案12/500,以96孔模式用CRE转导人ES Lox-RED/STOP-Lox-eGFP细胞。按照mTeSR1或TeSR-E8制造商说明书,通过机械分离将细胞分为小簇传代,并且接种在基质胶包被板上以达到50%汇合。第二天,将5x转导缓冲液中的CRE蛋白,以1/5用mTeSR1或TeSR-E8稀释。然后向细胞添加完全混合物。12小时的转导后,培养基被新鲜mTeSR1或TeSR-E8培养基替换,并且将细胞孵育24-48小时。然后,通过测量荧光显微镜或流式细胞仪中的绿色和红色信号,对细胞进行分析。
实施例3:TALEN转导
按照上文所述,在天然条件下表达和纯化TALEN蛋白。将重组TALEN蛋白在5x转导缓冲液中提纯。使用转导方案12/500,用TALEN蛋白转导人ES细胞。为了HPRT基因破坏,使用靶向HPRT基因的一对TALEN蛋白。转导后4天,添加2.5μM 6-TG以选择HPRT敲除细胞。两周后,挑出存活克隆并将其扩增,以用于基因组DNA纯化和HPRT基因测序。
用2μM TALEN蛋白转导男性人iPS细胞12小时。简言之,将20μl 5x转导缓冲液中的HPRT TALEN蛋白与80μl人iPS细胞培养基混合。向细胞添加最终的混合物,孵育12小时。此后培养基被150μl人iPS细胞培养基替换。5天后,将3μM 6-TG加至培养基,以选择HPRT缺陷细胞。10天后,挑出各个克隆并且将它们分别地培养。纯化各个克隆的基因组DNA,并且对HPRT基因进行测序。进行Blast比对,以测定由TALEN蛋白引起的HPRT基因的插入率和缺失率(参见图14)。
实施例4:转导增强剂
将EGF、FGF和PDGF用作蛋白转导增强剂。将生长因子以它们的活性最终浓度(就列出的生长因子来说,每种约10ng/ml)添加至转导缓冲液中。将融合肽以1至10μM的浓度范围用于转导缓冲液中。
实施例5:BrdU和半胱天冬酶测量
使用细胞增殖Elisa试剂盒Brdu(Roche),按照制造商说明书(Roche)测定细胞增殖。使用半胱天冬酶-Glo 3/7分析试剂盒(Promega),按照制造商的方案(Promega)测量半胱天冬酶-3和半胱天冬酶-7活性的定量。
实施例6:优化转导步骤和转导缓冲液的分析
重要的是注意,用不穿过细胞膜的所有溶质的浓度来定义张力。在我们的实施例中,我们使用NaCl或RbCl,张力通常在500-700mOsm/KG,但是对于具体的应用(转导靶标和靶细胞类型),应该按照下文(I)所述,对缓冲液张力以及转导时间进行优化。同样,在我们的实施例中,虽然我们使用NDSB201作为转导化合物,但是可按下文所述测定其他化合物诱导或促进转导的能力和效率,并且对于具体的应用(转导靶标和靶细胞类型),应当按照下文(II)所述对转导化合物进行优化。如上文所述,在我们的实施例中,虽然我们使用NaCl或RbCl来引起转导高张性,但是可使用其他盐或化合物。我们使用下文(III)概述的分析来测试分子或化合物是否可有效地引起转导高张性。如(I)中所概述,发现能引起转导的盐、分子或化合物,应当进一步对时间和缓冲液张力进行优化。在我们的实施例中,虽然在我们的转导缓冲液中使用的渗透保护剂为甘氨酸和甘油,但是可按照下文所述测定其他化合物作为渗透保护剂的效力,并且对于具体的应用和细胞类型,应当按照下文(IV)所述对渗透保护剂进行优化。上文参数的优化需要反复调节其他组分。例如,在确定和优化了新型转导化合物后,转导高张性和时间可能需要重新调节。
(I)优化转导张力和转导时间的分析
为了优化用于具体应用(转导靶标和靶细胞类型)的转导步骤,考虑将前述的方案12/500和3/700作为起点。这里,关于胞内吸收的效率、细胞存活以及细胞增殖(如果适用),我们描述了如何优化转导方案。在我们的实施例中,虽然我们使用β-内酰胺酶蛋白来优化转导,但是可使用其他蛋白、DNA、RNA、siRNA、(小)分子或纳米结构,只要存在可用来测定转导靶标的细胞内递送的分析。
为了优化转导培养基张力和转导时间,以图10所示的96孔模式设置滴定矩阵。
制备至少80至100毫摩在5x转导缓冲液中的β-内酰胺酶溶液。将该β-内酰胺酶蛋白溶液用作100x浓缩物,以获得0.8至1μM的最终β-内酰胺酶浓度。
为了优化缓冲液张力和转导时间,将靶细胞接种于三个不同的多孔板(板“A”用来测定细胞内β-内酰胺酶活性,板“B”用于细胞增殖测量,以及板“C”用于细胞凋亡分析)中不含抗生素的适当无酚红培养基中。
通过向无抗生素的无酚红培养基添加50mM NDSB201、15mM甘氨酸和30mM甘油,并且使用NaCl、RbCl或其他引起转导高张性的盐调节张力(对于引起转导高张性的盐的优化,参见下文(III)),制备一系列具有不同张力(范围为300至1000mOsm/Kg)的培养基。将细胞在不同张力下孵育2-24小时(参见示意图10),并且在上文所述的板A中进行β-内酰胺酶活性测量,以及用标准培养基更换板B和C中的培养基。6-8小时后,在板B的常规培养基中添加BrdU,并且测量板C中的半胱天冬酶3/7活性。将具有BrdU的板B孵育时长为将BrDU并入增殖的靶细胞所需的另外时间(参见制造商方案),并且继续测定BrdU并入(制造商说明书;细胞增殖ELISA,BrdU,Roche,Cat.11669915001)。最佳条件是具有最高β-内酰胺酶蛋白并入且对细胞存活、细胞增殖(如果适用)和细胞功能具有最小影响的条件。
(II)优化转导化合物的类型和浓度的分析
在我们的实施例中,虽然我们使用转导化合物NDSB201,但是根据应用和转导靶标,可使用不同的转导化合物。此处我们描述如何测试潜在转导化合物的性能,并且优化转导化合物的最终浓度。在该实施例中,虽然我们使用转导方案3/700将β-内酰胺酶蛋白转移进鼠胚胎成纤维细胞(MEF),但是根据靶细胞类型,应该按照(I)中所述调节转导方案。制备(I)中所描述的100xβ-内酰胺酶储液。为了优化转导化合物,该β-内酰胺酶储液需要在待测试的目标转导化合物中制备,或者针对具有250mM目标转导化合物的5x转导缓冲液进行透析。
制备(I)中确定的最佳张力的培养基。向该培养基添加浓度范围5至150mM的待测试转导化合物。按照(I)中所描述,制备具有靶细胞的多个孔板,以测试转导靶标的细胞内转移、细胞凋亡以及细胞增殖(如果适用)。添加具有转导靶标(在我们的实施例中为β-内酰胺酶)的转导培养基和不同浓度的测试转导化合物。将细胞孵育(I)中所确定的时间,并且如(I)所述测量β-内酰胺酶转导、细胞凋亡和BrdU并入。
(III)优化引起高张性的盐类型的分析
数种盐能够引起转导高张性,但是如我们的实施例所表明的,不是所有引起高张性的分子均能引起转导。这里,我们描述如何确定具体的盐是否能够引起转导,以及如何优化用于具体应用的转导盐的类型。
制备(I)中所描述的100xβ-内酰胺酶储液。为了优化转导盐,该β-内酰胺酶储液需要在待测试的目标转导盐中制备,或者针对具有250mM目标转导盐的5x转导缓冲液进行透析。
理论上,在下述步骤中,将无钠培养基用于转导培养基的制备,因为标准培养基中存在的钠可使结果混乱。使用对照转导盐(参见实施例)或待测试盐制备张力范围300-1000mOsm/Kg的培养基,并且与转导靶标(在该实施例中为β-内酰胺酶)组合。(可选地,可使用待测试盐以转导方案12/500或3/700的方式进行最初测试,以测定具体盐或分子的转导活性,随后按照(I)中所述对该盐或分子进行进一步优化)。
如(I)所述,制备具有靶细胞的多个孔板,以测试转导靶标的细胞内转移、细胞凋亡以及细胞增殖(如果适用)。添加具有不同浓度的测试转导盐的转导培养基。将细胞孵育时长为(I)中确定的最佳转导时间,并且如(I)所述测量β-内酰胺酶转导、细胞凋亡和BrdU并入。
(IV)优化渗透保护剂的类型和浓度的分析
在我们的实施例中,虽然我们使用甘油和甘氨酸的组合作为渗透保护剂,但是可根据应用和转导靶标使用不同的渗透保护剂。这里,我们描述如何测试潜在渗透保护剂的性能,以及优化渗透保护剂的最终浓度。
制备(I)中所描述的100xβ-内酰胺酶储液。使用对照渗透保护剂(参见实施例)或浓度范围1-250mM的待测试渗透保护剂制备转导培养基,并且与转导靶标(在该实施例中为β-内酰胺酶)组合。如(I)所述,制备具有靶细胞的多个孔板,以测试转导靶标的细胞内转移、细胞凋亡以及细胞增殖(如果适用)。添加具有不同浓度的测试渗透保护剂的转导培养基。将细胞孵育时长为(I)中确定的最佳转导时间,并且如(I)所述测量β-内酰胺酶转导、细胞凋亡和BrdU并入。
实施例7:转导缓冲液促进针对原代细胞的DNA-脂质转染
转导前一天,将75,000个小鼠ES细胞接种于96孔板的每一孔中。第二天,用100μl转染培养基转染细胞。简言之,转染培养基含有100ng质粒DNA、0.8μl LTX脂类、0.1μl plus试剂(LifeTechnologies)和20μl 5x转导缓冲液。总体积包含100μl mESC培养基+LIF。同样地转染对照细胞;转导缓冲液被mESC培养基+LIF代替。
结果在图11中示出。向质粒DNA/脂质体LTX转染混合物添加转导缓冲液,导致将报告基因DNA有效转染进鼠ESC。
实施例8:使用转导缓冲液,DNA和蛋白的双重细胞内并入
转导前一天,将75,000个小鼠ES细胞接种于96孔板的每一孔。第二天,将细胞与100μl转导培养基孵育。通过将5x转导缓冲液中的20μl CRE蛋白加另外80μl mESC培养基+LIF组合,来制备Cre转导培养基。RFP/DNA-脂质转染培养基含有:100ng质粒DNA、0.8μl LTX脂类、0.1μl plus试剂(Life Technologies)和20μl 5x转导缓冲液。总体积包含100μlmESC培养基+LIF。CRE和DNA/脂质转导培养基含有:100ng质粒DNA、0.8μl LTX脂类、0.1μlplus试剂(Life Technologies)和20μl在5x转导缓冲液中的CRE蛋白。总体积包含100μlmESC培养基+LIF。将细胞孵育12小时,并且培养基被mESC培养基替代。转导后32小时,通过FACS分析对细胞进行分析。
结果在图12中示出。添加转导缓冲液导致将Cre重组酶蛋白、质粒RFP-DNA以及与RFP-DNA/脂质复合体一起的CRE蛋白有效转染进鼠ESC。
实施例9:转导缓冲液促进病毒并入至人iPS细胞
以96孔模式向具有75%汇合的细胞密度的人iPS细胞进行慢病毒转导。病毒转导由1μl浓缩病毒储液、4μg/ml聚凝胺加使达到最终体积100μl的人iPSC培养基组成。
通过将1μl浓缩病毒原液、4μg/ml聚凝胺、20μl 5x转导缓冲液,加使达到最终体积100μl的人iPSC培养基组合,进行转导缓冲液条件下的病毒转导。将细胞孵育12小时,以及将培养基更换为常规人iPSC培养基。转导后36小时对细胞进行分析。第二天,用100μl转染培养基转染细胞。简言之,转染培养基由100ng质粒DNA、0.8μl LTX脂类、0.1μl plus试剂(LifeTechnologies)和20μl 5x转导缓冲液组成。总体积包含100μl mESC培养基+LIF。同样地转染对照细胞;转导缓冲液被mESC培养基+LIF代替。
结果在图13中示出。添加转导缓冲液导致将慢病毒颗粒有效转染进人iPS细胞。
实施例10:用于低溶解性蛋白的转导缓冲液
2/1000转导缓冲液–最终组成
500mM NaCl,250mM NDSB-201,300mM甘氨酸,150mM在D-MEM N2/B27+LIF中的甘油。
2/1000转导缓冲液方案
简言之,通过添加80μl 2/1000转导缓冲液+20μl在5x转导缓冲液500/12中的CRE蛋白,对mES细胞进行转导。将细胞孵育2小时。孵育后,将培养基替换为mESC培养基。转导后36小时,通过FACS对细胞进行分析。
实施例11:将TALEN转导进人iPS细胞
用2μM TALEN蛋白转导男性人iPS细胞12小时。简言之,将20μl在5x转导缓冲液中的HPRT TALEN蛋白与80μl人iPS细胞培养基混合。然后将最终混合物添加至细胞,孵育12小时。此后将培养基换成150μl人iPS细胞培养基。5天后,将3μM 6-TG加入培养基,以选择HPRT缺陷细胞。10天后,挑出各个克隆,并且将它们分别地培养。纯化各个克隆的基因组DNA,并且对HPRT基因进行测序。进行Blast比对,以测定由TALEN蛋白引起的HPRT基因中的插入率和缺失率。
结果在图14中示出。结果显示功能性TALEN被转导进iPS细胞,因为在细胞内遗传材料的TALEN靶位点处产生了插入和缺失。
实施例12:同时转导蛋白和大分子
为了评估转导缓冲液是否允许同时转导蛋白和大分子,通过表达GFP的鼠胚胎成纤维细胞(MEF),我们分析巨胞饮介导的TMR-右旋糖酐(红色)和荧光标记的BSA蛋白(蓝绿色)的吸收。简言之,将表达eGFP蛋白(绿色)的MEF与5μg/ml高分子量TMR-右旋糖酐(红色)和1μg在1x转导培养基(方案700/3)中的BSA-Alexa-647(远红外)孵育30分钟。随后,用1x转导缓冲液将细胞洗涤两次。最后,将细胞维持在1x转导缓冲液中,并且通过共聚焦显微镜对其进行直接地分析。在转导过程前和转导过程期间,通过将细胞与100μM乙基异丙基氨氯吡脒(EIPA)孵育30分钟,抑制了右旋糖酐和BSA吸收。
结果在图15中示出。在转导缓冲液的存在下,观察到右旋糖酐(多糖)和BSA蛋白的同时转导。转导被巨胞饮抑制剂EIPA抑制。
实施例13:通过转导进行基因编辑
蛋白渗透胞吞的高效率,在基因编辑中具有吸引人的应用。除上文描述的TALEN基因编辑系统之外,最近发现的CRISPR-Cas9系统提供另外的基因编辑系统。CAS/CRISPR包含酿脓链球菌(Streptococcus pyrogenes)Cas9核酸酶蛋白,其通过小向导RNA(sgRNA)被引导至具体的基因组基因座上[1,2]。CAS/CRISPR系统的吸引力为其设计上的简单性。不同于TALEN和锌指系统(其中,对于每一具体靶位点,核酸酶蛋白本身需要被设计和修饰),CAS/CRISPR系统需要单个核酸酶蛋白(Cas9),并且改变相关的短向导RNA用于靶标选择。当靶标结合时,Cas9核酸酶造成靶基因座处的双链断裂(DSB),当通过细胞DSB修复系统进行修复时,其常常造成移码缺失而导致基因破坏。通常,利用病毒载体将Cas/CRISPR系统导入靶细胞,所述Cas/CRISPR系统妨碍临床应用,并且在没有对受感染细胞进行进一步药物选择的情况下,其在某些靶细胞类型中效率低。考虑到我们的渗透胞吞系统在几种难以感染细胞系(包括人干细胞)中的功效,我们探索该系统是否还允许蛋白介导的基因编辑。
为了该目标,我们首先测试渗透胞吞是否允许将RNA有效转导进细胞。为了测试这个,我们使用700/3方案将siRNA(小干扰RNA)转导进KBM7细胞。我们转导靶向GAPDH的siRNA(Invitrogen),并且通过Western印迹测量GAPDH的敲减。如图17所示,siRNA的转导导致GAPDH蛋白表达水平的有效敲减。上文数据表明,我们的渗透胞吞系统允许将小RNA(如siRNA)有效转导进靶细胞。
其次,我们优化转导培养基,以允许重组Cas9的转导。在我们使用700/3和500/12培养基转导Cas9蛋白的首次尝试中,我们注意到Cas9蛋白在两种转导条件下均不溶。然而,当使用较高浓度的NaCl和NDSB-201(#01)或GABA(#20)时,Cas9蛋白保持为可溶(图18A)。针对该理由,我们开发“适合Cas9的转导方案”(“第四方案”),具有1250mOsmol/Kg的最终重量克分子渗透浓度,以及250mM浓度的NDSB-201(转导化合物#01)或选自表1的其他转导化合物。我们预料到,较高的重量克分子渗透浓度和NDSB将引起较快的蛋白转导,但是也可能会增加细胞毒性。为了表征该新型转导条件,基于高的重量克分子渗透浓度(1250mOsm/Kg)转导,我们在不同的短时间点下测量KBM7细胞中的BrdU并入。我们观察到,相比于NDBS-201,不同的转导化合物显示不同的KBM7细胞存活率,并且例如化合物#20产生比NDSB-201更好的存活(图18B)。
为了进一步测试具有改良转导缓冲液的转导持续时间,在1250mOsmol/Kg和250mMGABA下,我们进行不同时间点的Cre重组酶蛋白转导,并且测量具有成功cre-介导的报告基因激活以及BrdU并入(作为细胞增殖和存活的度量)的细胞百分比。在这些条件下,基于细胞存活和Cre转导,最佳转导时间为大约60分钟。在那些时间点下,一轮Cre蛋白转导得到80%GFP阳性KBM7细胞。并且两轮连续的Cre蛋白转导得到94%阳性KBM7(图18C)。第二轮蛋白转导不影响细胞存活率。因此,这些数据表明了渗透胞吞方法的灵活性,并且表明:基于待转导蛋白的特性,为了最佳蛋白并入效率和细胞存活,可以调节转导条件(转导化合物的类型和浓度和/或缓冲液的重量克分子渗透浓度)。
使用适合Cas9的转导培养基,我们旨在将Cas9蛋白与对应的sgRNA同时转导进KMB7细胞。通过体外转录从DNA模板产生sgRNA。所述sgRNA含有赋予其靶标特异性的20nt向导序列和80nt支架序列(图18D,顶图)。在大肠杆菌中表达重组Cas9蛋白(图18D,底图)。为了监测CAS9-sgRNA导入至细胞,我们开发具有稳定整合的慢病毒构建体的报告基因细胞系,所述稳定整合的慢病毒构建体具有与框外沉默tdtomato基因耦合的20nt AAVS1靶序列(图18E)。成功的Cas9-sgRNA介导的tdTomato基因上游的移码缺失的导入,将回复tdTomato报告基因的阅读框,并且允许对靶效率进行分析(图18F)。用与对应靶上的AAVS1 sgRNA一起的Cas9蛋白转导KBM7报告基因细胞。第一轮Cas9-sgRNA转导之后,30%报告基因KBM7细胞恢复了tdtomato蛋白表达(图18F,顶图)。第二轮Cas9-sgRNA转导之后,56%KBM7细胞表达了tdtomato报告基因。用Cas9蛋白和脱靶sgRNA(与AAVS1靶序列相比具有两个核苷酸替换)转导KMB7报告基因细胞,作为特异性对照(图18F,顶图)。如图18F所示,脱靶sgRNA不激活tdtomato报告基因。同时,我们的数据表明,我们的渗透胞吞缓冲液允许蛋白和RNA的有效串联转导,并且使用Cas9/CRISPR系统允许非常有效且特异的基因编辑。最近,已报道了针对Cas9/CRISPR系统的几种变体,包括通过导入异源FokI核酸酶[3,4]、来自不同物种的替代性Cas类似物[5]或基于其他细菌免疫复合物的替代性靶系统(如级联系统[6]或细菌Argonaute蛋白(评述于[7]))来提高特异性。我们发现,我们的渗透胞吞系统允许向哺乳动物(干)细胞有效导入基因编辑蛋白或蛋白-核苷酸复合体,如通过我们成功地转导了重组TALEN蛋白和重组Cas9蛋白连同其小向导RNA来例证。预期我们的转导系统还允许有效地导入其他基因编辑蛋白或蛋白-复合体(如上文提及的复合体)。
因为我们使用慢病毒报告基因系统测量CAS9/sgRNA的转导,很可能的是,各个细胞含有多拷贝的报告基因,其可使认识到的转导效率失真。为了获得CRISPR-Cas9渗透胞吞介导的靶向效率的精确判断,以及为了证明该系统还可被用来调节内源基因,我们测试我们的基因编辑蛋白转导系统修饰内源基因WDR85(DPH7)的能力。WDR85敲除细胞对白喉毒素诱导的细胞死亡有抗性,从而提供简单且可靠的分析以用于测量成功的双等位基因的基因敲除。用Cas9蛋白和针对WDR85基因的6种不同sgRNA转导二倍体KBM7细胞两次(图19A)。第二次Cas9蛋白/sgRNA转导后7天(以允许基因敲除在蛋白水平有效),用白喉毒素处理细胞48小时。仅在转导有Cas9蛋白和WDR85sgRNA的细胞中观察到细胞存活,而在白喉毒素处理的野生型KBM7细胞或转导有Cas9蛋白与脱靶sgRNA的细胞中没有检测到有活力的细胞(图19B)。在敲除WDR85方面,不同的sgRNA显示不同的效率。6种sgRNA中的4种产生特别高的细胞存活率(图19B,柱状图)。因为本实验中使用的KBM7细胞是二倍体的,所以这意味着在存活细胞的等位基因上内源WDR85均被缺失。在转导有不同WDR85 sgRNA和CAS9蛋白的耐白喉毒素细胞的库(pool)中,进行DNA序列分析。对于每一种WDR85 sgRNA,我们观察到100%基因破坏(图19C),其证实了耐白喉毒素的细胞为WDR85基因敲除型的。
为了精确地计算敲除频率,我们用CAS9蛋白和不同WDR85sgRNA转导KMB7细胞。4天后,在384孔板中,我们进行单细胞分选,一周后,我们鉴定从单细胞分选步骤后依然存活的克隆。然后用白喉毒素处理这些克隆48小时。对存活克隆进行计数,这允许我们测定耐白喉毒素克隆的百分比,在耐白喉毒素克隆中的等位基因WDR85均被敲除,因此,计算得到WDR85敲除细胞的效率。如前所述,不同sgRNA在生成WDR85敲除方面表现出不同的效率,范围为10-70%双等位基因敲除(图19D)。我们对高度有效的四种sgRNA中每种3个单细胞克隆的CAS/CRIPSR靶位点进行测序,以证实白喉毒素存活克隆的确含有双等位基因WDR85的基因破坏。如图19D所示,耐白喉毒素克隆的确表明了双等位基因WDR85的基因破坏。通过重组Cas9蛋白和sgRNA的渗透胞吞,生成双等位基因敲除的效率比之前报道的更高[2],表明该方法允许高度有效且非病毒性地在人细胞中产生靶基因突变。
在所有这些方法中,将15mM甘氨酸和30mM甘油包含在转导缓冲液中作为渗透保护剂。
当我们将RNA或DNA转导进细胞时,利用干扰素抑制剂蛋白“B18R”,我们观察到明显的细胞存活效应(Nat Protoc.2013Mar;8(3):568-82.doi:10.1038/nprot.2013.019.Epub 2013Feb 21.Reprogramming human fibroblasts topluripotency using modified mRNA.Mandal PK1,Rossi DJ.)。简言之,转导前3小时、转导期间和转导后48小时,将细胞与250ng/ml B18R蛋白孵育。近几年,已开发了两种本质上不同的基因编辑系统,区别在于它们找到其具体基因组靶序列的方式不同。以锌指核酸酶和TALEN为代表的一种类型,利用核酸酶蛋白自身内可定制的结构域来识别基因组中的具体靶DNA序列。另一类型的代表是Cas9/CRISPR、级联系统、TtAgo和其他Argonaute蛋白系统,它们利用相同的常见蛋白(复合体)—不考虑基因组靶位点,所述靶位点通过相关的核苷酸序列将它们靶向具体的靶标。我们的数据表明,这里所描述的转导系统能够将两种类型的基因编辑系统递送进哺乳动物的细胞,并且通过这样的操作允许迅速的、非病毒性且高度有效的基因编辑。
实施例14:巨胞饮转导机制的证据和评价候选转导化合物的功效的简单分析
为了发生转导,通过巨胞饮摄取的蛋白必须被释放进胞质溶胶。我们假设这通过巨胞饮囊泡的渗透发生。为了测试候选的潜在转导化合物的功效,我们设置监测巨胞饮体囊泡渗透的分析。我们使用之前描述的半乳凝素3-GFP报告基因系统,来监测由药物或病原体诱导的囊泡渗漏[8,9]。半乳糖凝集素-3为小且可溶的细胞溶质蛋白,其能结合含有β-半乳糖苷的糖。这些半乳糖凝集素-3通常仅存在于质膜的外部和细胞内胞吞囊泡的内部。基于巨胞饮体囊泡的膜的细胞内渗透,细胞质的半乳糖凝集素-3可透过囊泡并且与血管内的糖结合。因此,在细菌和病毒的研究中,将半乳糖凝集素-3的再定位用作鉴定囊泡破裂的工具,在感染期间,半乳糖凝集素-3依靠囊泡破裂进入细胞质[8,9]。我们设置了半乳糖凝集素-3蛋白与GFP融合(GAL3-GFP)的报告基因系统。细胞溶质的GAL3-GFP蛋白重新定位至通透的巨胞饮体内部,借此形成具有强的绿色荧光发射的多聚复合体。使用700/3条件对表达GAL3-GFP蛋白的MEF细胞进行转导。正如预期的,基于转导培养基,我们在细胞中观察到明亮的囊泡形成,表明了蛋白转导条件下的巨胞饮体的渗漏(图16)。当细胞与巨胞饮抑制剂EIPA(其有力地抑制蛋白转导)预孵育时,或者将细胞留下未处理时,Gal3-GFP不会重新定位至囊泡(图16)。而且,当转导化合物(NDSB-201)被几乎没有转导活性的化合物(化合物09和18)代替时,Gal3-GFP不会定位于巨胞饮体囊泡(图16)。这些结果表明,转导培养基经巨胞饮促进来自细胞外空间的蛋白吸收,并且诱导巨胞饮体囊泡渗漏以将蛋白释放进胞质溶胶。Gal3-GFP分析是测试候选转导化合物在蛋白转导中功效的简单且有效的手段。
实施例13和14的参考文献
Jinek,M.,et al.,A programmable dual-RNA-guided DNA endonuclease inadaptive bacterial immunity.Science,2012.337(6096):p.816-21.
2.Mali,P.,et al.,RNA-guided human genome engineering viaCas9.Science,2013.339(6121):p.823-6.
3.Tsai,S.Q.,et al.,Dimeric CRISPR RNA-guided FokI nucleases forhighly specific genome editing.Nat Biotechnol,2014.32(6):p.569-76.
4.Guilinger,J.P.,D.B.Thompson,and D.R.Liu,Fusion of catalyticallyinactive Cas9 to FokI nuclease improves the specificity of genomemodification.Nat Biotechnol,2014.32(6):p.577-82.
5.Esvelt,K.M.,et al.,Orthogonal Cas9 proteins for RNA-guided generegulation and editing.Nat Methods,2013.10(11):p.1116-21.
6.Westra,E.R.,et al.,Cascade-mediated binding and bending ofnegatively supercoiled DNA.RNA Biol,2012.9(9):p.1134-8.
7.Makarova,K.S.,et al.,Prokaryotic homologs of Argonaute proteins arepredicted to function as key components of a novel system of defense againstmobile genetic elements.Biol Direct,2009.4:p.29.
8.Paz,I.,et al.,Galectin-3,a marker for vacuole lysis byinvasivepathogens.Cell Microbiol,2010.12(4):p.530-44.
9.Maejima,I.,et al.,Autophagy sequesters damaged lysosomes tocontrollysosomal biogenesis and kidney injury.EMBO J,2013.32(17):p.2336-47.
序列表
<110> 荷兰皇家科学院
<120> 转导缓冲液
<130> P062506WO
<141> 2014-08-28
<150> GB 1315321.8
<151> 2013-08-28
<160> 10
<170> SeqWin2010, 1.0版
<210> 1
<211> 109
<212> RNA
<213> 人工序列(Artificial Sequence)
<220>
<221>
<222>
<223> CAS9报告基因 (靶上)
<400> 1
ggggccacta gggacaggat gttttagagc tagaaatagc aagttaaaat aaggctagtc 60
cgttatcaac ttgaaaaagt ggcaccgagt cggtgctttt ttcgctccg 109
<210> 2
<211> 109
<212> RNA
<213> 人工序列(Artificial Sequence)
<220>
<221>
<222>
<223> CAS9报告基因 (脱靶1)
<400> 2
ggggccacta ggcacacgat gttttagagc tagaaatagc aagttaaaat aaggctagtc 60
cgttatcaac ttgaaaaagt ggcaccgagt cggtgctttt ttcgctccg 109
<210> 3
<211> 109
<212> RNA
<213> 人工序列(Artificial Sequence)
<220>
<221>
<222>
<223> CAS9报告基因 (脱靶2)
<400> 3
ggggccactg gggacaggct gttttagagc tagaaatagc aagttaaaat aaggctagtc 60
cgttatcaac ttgaaaaagt ggcaccgagt cggtgctttt ttcgctccg 109
<210> 4
<211> 109
<212> RNA
<213> 人工序列(Artificial Sequence)
<220>
<221>
<222>
<223> WDR85 (sgRNA #1)
<400> 4
gggctgtttc gccctgcaaa gttttagagc tagaaatagc aagttaaaat aaggctagtc 60
cgttatcaac ttgaaaaagt ggcaccgagt cggtgctttt ttcgctccg 109
<210> 5
<211> 109
<212> RNA
<213> 人工序列(Artificial Sequence)
<220>
<221>
<222>
<223> WDR85 (sgRNA #2)
<400> 5
ggtggacacc gagctgaccg gttttagagc tagaaatagc aagttaaaat aaggctagtc 60
cgttatcaac ttgaaaaagt ggcaccgagt cggtgctttt ttcgctccg 109
<210> 6
<211> 109
<212> RNA
<213> 人工序列(Artificial Sequence)
<220>
<221>
<222>
<223> WDR85 (sgRNA #3)
<400> 6
ggtgcccgct gcaaggctgc gttttagagc tagaaatagc aagttaaaat aaggctagtc 60
cgttatcaac ttgaaaaagt ggcaccgagt cggtgctttt ttcgctccg 109
<210> 7
<211> 109
<212> RNA
<213> 人工序列(Artificial Sequence)
<220>
<221>
<222>
<223> WDR85 (sgRNA #4)
<400> 7
gggccggcag gccggtcctc gttttagagc tagaaatagc aagttaaaat aaggctagtc 60
cgttatcaac ttgaaaaagt ggcaccgagt cggtgctttt ttcgctccg 109
<210> 8
<211> 109
<212> RNA
<213> 人工序列(Artificial Sequence)
<220>
<221>
<222>
<223> WDR85 (sgRNA #5)
<400> 8
ggtggctgga catgccctct gttttagagc tagaaatagc aagttaaaat aaggctagtc 60
cgttatcaac ttgaaaaagt ggcaccgagt cggtgctttt ttcgctccg 109
<210> 9
<211> 109
<212> RNA
<213> 人工序列(Artificial Sequence)
<220>
<221>
<222>
<223> WDR85 (sgRNA #6)
<400> 9
ggcatctgcc aagcccaaga gttttagagc tagaaatagc aagttaaaat aaggctagtc 60
cgttatcaac ttgaaaaagt ggcaccgagt cggtgctttt ttcgctccg 109
<210> 10
<211> 109
<212> RNA
<213> 人工序列(Artificial Sequence)
<220>
<221>
<222>
<223> WDR85 (sgRNA #7)
<400> 10
ggctgcagaa agtggcctca gttttagagc tagaaatagc aagttaaaat aaggctagtc 60
cgttatcaac ttgaaaaagt ggcaccgagt cggtgctttt ttcgctccg 109
- 转导缓冲液
- 转导缓冲液
