TNFAIP3-TRAF1-NF-κB焦亡轴在制备防治胃炎或胃炎转胃癌药物的应用
文献发布时间:2023-06-19 11:30:53
技术领域
本发明属于生物医药领域,具体涉及TNFAIP3-TRAF1-NF-κB焦亡轴在制备防治胃炎或胃炎转胃癌药物的应用。
背景技术
胃癌是全球第五大最常见的癌症和第三大最常见的癌症死亡原因,而慢性萎缩性胃炎是胃癌发生的一个重要原因,因此寻找在萎缩性胃炎发生及炎癌转变过程起关键作用的分子是十分重要的。
目前研究发现:胃粘膜组织内免疫细胞的高度浸润、炎性细胞因子及活性氧化物的大量产生、多种致癌通路如JAK-STAT3通路、(PI3K)/Akt的活化引起胃壁细胞的死亡;壁细胞的大量丢失使多种生长因子,如双调蛋白、TGF-α、shh表达失调;这些分子的表达失调进而导致胃粘膜细胞的异常分化,最终造成癌症的发生。尽管现在已有多种将上述生物过程及通路作为治疗靶点的治疗方案,但癌症的遗传异质性以及微环境的动态变化常使得靶向药物疗效降低,甚至失去疗效。因此寻找新的胃炎发生及胃炎癌转变靶点是十分重要的。
发明内容
为解决上述技术问题,本发明通过多个临床数据库对胃炎组织、正常组织、胃癌组织或肠化生组织进行TRAF1、TNFAIP3、NLRP3以及焦亡相关分子的表达水平的分析,并对不同疾病阶段的表达上调基因进行KEGG富集分析,可以发现TRAF1、TNFAIP3、NLRP3以及焦亡相关分子在病理组织中的水平显著升高,且NF-κB通路在各个疾病阶段均发生显著活化;再根据spearman分析算TRAF1表达量、NF-κB通路富集分数及焦亡通路富集分数之间的相关系数,可知三者存在显著的正相关,说明TRAF1可通过激活NF-κB通路进而激活焦亡通路。还构建了TRAF1与其高度共表达蛋白之间的蛋白互作网络,发现TRAF1与TNFAIP3有直接的功能联系,且TNFAIP3可降低TRAF1的泛素化水平,增加TRAF1稳定性,促进TRAF1下游通路的活化;由此可知,存在TNFAIP3-TRAF1-NF-κB炎症通路-焦亡轴,促进胃炎或胃炎向胃癌转化,可以通过降低TNFAIP3/TRAF1的表达或阻止TRAF1与TNFAIP3的相互作用,进而阻止萎缩性胃炎的发生与进展。
基于上述发现,本发明的目的在于提供TNFAIP3-TRAF1-NF-κB焦亡轴在制备防治胃炎或胃炎转化为胃癌药物中的应用。
进一步的,所述药物包括:TNFAIP3和/或TRAF1的表达抑制剂、阻止TNFAIP3与TRAF1相互作用的药物。
基于同一发明构思的,本发明还提供了一种防治胃炎或胃炎转化为胃癌药物组合物,所述组合物包含TNFAIP3表达抑制剂、TRAF1表达抑制剂、阻止TNFAIP3与TRAF1相互作用的药物中的一种或多种。
进一步的,所述药物组合物还包括药学上可接受的载体、赋形剂、稀释剂、辅剂和媒介物中的至少一种。
有益效果:
本发明首次通过对临床数据数据库中胃炎不同病理阶段和正常组织中TRAF1、TNFAIP3、NLRP3和焦亡相关分子的水平分析,发现上述分子的水平显著提高,并通过相关性分析发现TRAF1表达量、NF-κB通路和焦亡通路存在显著的正相关,在此基础上构建了TRAF1的蛋白互作网络,首次发现TRAF1与TNFAIP3有直接的功能联系,TNFAIP3可降低TRAF1的泛素化水平,增加TRAF1稳定性,促进TRAF1下游通路的活化,即存在TNFAIP3-TRAF1-NF-κB炎症通路-焦亡轴,作为胃炎或胃炎转化为胃癌的治疗靶位点,首次提出了将TNFAIP3或/和TRAF1的表达抑制剂,阻止TRAF1与TNFAIP3的相互作用的药物作为组织萎缩性胃炎的发生与进展。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
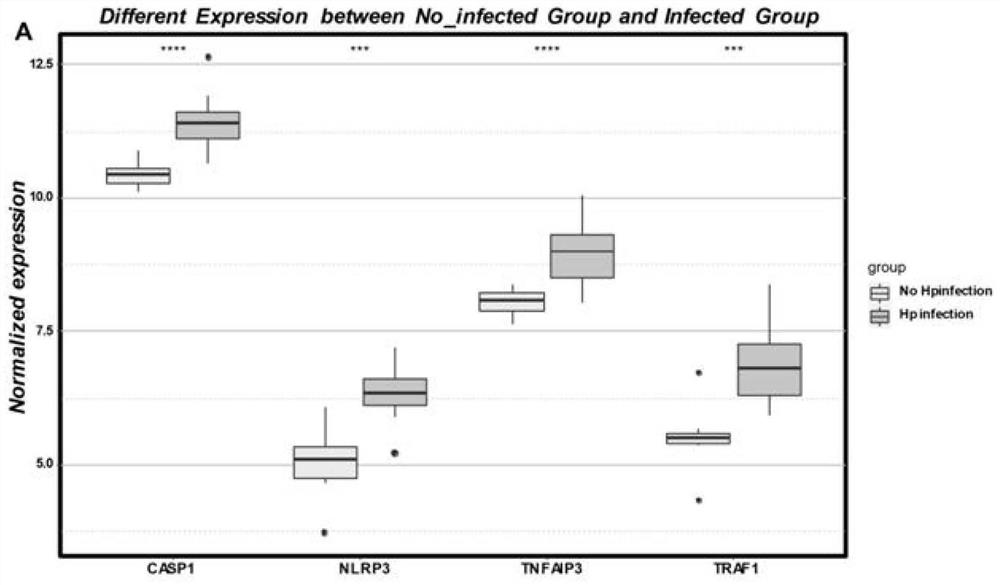
图1为本发明实施例提供的TRAF1、TNFAIP3、NLRP3、CASP1在Hp感染组及Hp非感染组表达水平对比图;
图2为本发明实施例提供的TRAF1、TNFAIP3、NLRP3、CASP1在胃炎不同病理阶段和正常组织的表达水平对比图;
图3为本发明实施例提供的TNFAIP3(A)、TRAF1(B)在正常组织(normal)、胃炎组织(Gastritis)、萎缩性胃炎组织(Atrophy)、广泛性萎缩性胃炎组织(ExtensiveAtrophy)的表达水平对比图;
图4为本发明实施例提供的焦亡相关分子在正常组织(normal)、胃炎组织(Gastritis)、萎缩性胃炎组织(Atrophy)、广泛性萎缩性胃炎组织(Extensive Atrophy)的表达水平对比图;
图5为本发明实施例提供的NAIP(D)、PYCARD(E)、GSDMD(F)在正常组织(normal)、胃炎组织(Gastritis)、萎缩性胃炎组织(Atrophy)、广泛性萎缩性胃炎组织(ExtensiveAtrophy)的表达水平对比图;
图6为本发明实施例提供的对不同疾病阶段(胃炎、萎缩性胃炎、广泛萎缩性胃炎)的表达上调基因KEGG富集分析图;(G)胃炎阶段显著富集的前20条通路;(H)为萎缩性胃炎阶段显著富集的前20条通路;(I)为NF-κB通路在上述疾病阶段的富集程度;
图7为本发明实施例提供的NF-κB通路在上述疾病阶段的富集程度(J)、焦亡通路在上述疾病阶段的富集程度(K)、TNFAIP3在胃癌组织(Primary Tumor)中与癌旁组织的表达水平对比图(L);
图8为本发明实施例提供的NF-κB通路富集分数与TRAF1表达量之间的相关性分析图;
图9为本发明实施例提供的NF-κB通路富集分数与焦亡通路富集分数之间的相关性分析图;
图10为本发明实施例提供的焦亡通路富集分数与TRAF1表达量之间的相关性分析;
图11为本发明实施例提供的构建TRAF1与高度共表达蛋白之间的蛋白互作网络的流程图;
图12为本发明实施例提供的TRAF1的蛋白互作网络图;
图13为本发明实施例提供的TRAF1与TNFAIP3蛋白互作示意图;
图14为本发明实施例提供的TRAF1存在多个泛素化位点的示意图。
具体实施方式
为使本发明要解决的技术问题、技术方案和优点更加清楚,下面将结合附图及具体实施例进行详细描述,但本发明的保护范围并不限于以下具体实施例。
除非另有定义,下文中所使用的所有专业术语与本领域技术人员通常理解含义相同。本文中所使用的专业术语只是为了描述具体实施例的目的,并不是旨在限制本发明的保护范围。
实施例1
获取GSE60427转录组表达芯片数据,具体包括Hp(幽门螺旋杆菌)阴性正常组织(Normal,n=8);Hp阳性轻度胃炎组织(Mild Gastritis,n=8)、重度胃炎组织(SevereGastritis,n=8)、肠化生组织(Intestinal Metaplasian=8),并统计上述各各组织中TRAF1、TNFAIP3、NLRP3、CASP1(焦亡相关分子)表达水平,其结果如图1、2所示,可知,TRAF1、TNFAIP3、NLRP3、CASP1(焦亡相关分子)表达水平在Hp感染组及不同病理阶段相较于正常组织均显著升高。
实施例2
在ArrayExpress数据库中获取E-MTAB-3689RNA测序数据包括正常组织(Normal,n=5)、胃炎组织(Gastritis,n=6)、萎缩性胃炎组织(Atrophy,n=9)、广泛性萎缩性胃炎组织(ExtensiveAtrophy,n=10),统计TRAF1、TNFAIP3、及多个焦亡相关分子(pyroptosisrelated moleculars,AIM2、CASP1、CASP5、MEFV、NLRC4、NLRP1、NLRP3、NAIP、PYCARD、GSDMD)在萎缩性胃炎阶段表达水平,其结果如图3-5所示,可知,上述各因子的表达水平均显著提高。另对不同疾病阶段(胃炎、萎缩性胃炎、广泛萎缩性胃炎)的表达上调基因在log2foldchange>1且p.adj<0.05为阈值条件下进行KEGG富集分析,结果如图6所示,可知NF-κB通路(NF_kappaB pathway)在各个疾病阶段均发生显著活化。此外使用GSVA算法计算出NF-κB通路及焦亡通路(Pyroptosis pathway)在每个样本中的富集分数(Enrichmentscores),结果如图7所示,可知NF-κB通路和焦亡通路在各个疾病阶段均发生显著活化。在TCGA-STAD队列中,TNFAIP3在胃癌组织(PrimaryTumor)中的表达量显著高于癌旁组织(Solid Tissue Normal)。
实施例3
在E-MTAB-3689数据中,使用spearman分析计算TRAF1表达量、NF-κB通路富集分数及焦亡通路富集分数之间的相关系数,其结果如图8-10所示。可知,TRAF1表达量、NF-κB通路富集分数及焦亡通路富集分数存在显著的正相关,TRAF1在胃黏膜组织中能够作为上游因子对NF-κB通路活化程度进行调节。其次在非胃黏膜组织也发现:NF-κB通路的活化诱导NLRP3和pro-IL1β的合成,提供NLRP3炎性小体活化的第一信号,同时NF-κB也是GSDMD的转录因子,NF-κB能够显著提高GSDMD表达水平,两者均能促进促进焦亡的发生。胃黏膜内组织内TRAF1表达水平的升高常伴随着NF-κB通路及焦亡通路的活化,这说明TRAF1可通过激活NF-κB通路进而激活焦亡通路。
实施例4
在E-MTAB-3689数据中,按照如图11的流程图构建TRAF1与其高度共表达蛋白之间的蛋白互作网络,具体包括以下步骤:
在E-MTAB-3689数据中,对胃炎组-正常组(gastritis VS normal)、萎缩性胃炎组-正常组(atrophyVS normal)、广泛萎缩性胃炎组-正常组(extensive atrophyVSnormal)进行差异分析,得到在各个病理阶段表达上调的基因(选择标准为表达量升高超过2倍(log FC>1)及调整后的p值小于0.05(p.adjust<0.05))。在表达上调的基因中,去除重复基因及非蛋白编码RNA(ncRNA),共获得1167个基因(包括TRAF1)。然后对TRAF1与其他1166个基因表达量进行spearman相关性分析,以相关性大于0.7为阈值(cutoff值)挑选TRAF1高度共表达基因,共得到345个与TRAF1表达高度共相关的基因。最后使用string对TRAF1及其表达高度共相关基因构建蛋白互作网络(如图12),可知TRAF1与TNFAIP3存在之间的功能联系,并在HDOCK SERVER上预测两者互作模型,TRAF1与TNFAIP3存在互补序列,结果如图13。TNFAIP3作为一种去泛素化酶,可通过去泛素化基序(OUT)降低靶蛋白K11、K48、K63泛素化修饰水平,影响下游蛋白的稳定性及信号通路的活化程度。在BioGrid上发现TRAF1分子存在多个泛素化位点,如图14,图中K代表泛素化位点。上述表明TNFAIP3可降低TRAF1的泛素化水平,增加TRAF1稳定性,促进TRAF1下游通路的活化,。
焦亡(pyroptosis)是一种依赖于Gasdermin的以大量促炎因子(IL1β、IL18等)释放为主要特征的程序性细胞裂解性死亡。IL-18降低抗菌肽的产生,促进Hp在胃黏膜的长期定植,IL-1β抑制酸分泌,诱导胃上皮萎缩,继而促进肠上皮化生及胃癌的形成。这说明焦亡通路的激活参与了胃炎到癌的转变。以上数据及资料证明:存在TNFAIP3-TRAF1-NF-κB炎症通路-焦亡轴,促进胃炎-癌进展。因此可将TNFAIP3-TRAF1-NF-κB-焦亡轴看做治疗胃炎或预防胃炎转化为胃癌的一个整体靶位点,通过降低TNFAIP3/TRAF1的表达或阻止TRAF1与TNFAIP3的相互作用可抑制该靶位点,进而阻止萎缩性胃炎的发生与进展。
以上所述是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明所述原理的前提下,还可以作出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- TNFAIP3-TRAF1-NF-κB焦亡轴在制备防治胃炎或胃炎转胃癌药物的应用
- 黄色当归醇和/或4-羟基德里辛在制备预防和治疗慢性萎缩性胃炎、胃癌药物中的应用
