在类风湿性关节炎中的PTPRS和蛋白聚糖
文献发布时间:2023-06-19 11:32:36
相关申请的交叉引用
本申请要求2018年9月19日提交的美国临时申请号62/733,545(其通过引用以其整体并入本文)的优先权。
关于在联邦资助的研究和开发下做出的发明权的声明
本发明在国立卫生研究院颁布的授权号R01 AR066053下在政府支持下完成。美国政府在本发明中具有某些权利。
对作为ASCII文本文件提交的序列表、表格或计算机程序列表附件的提及
在文件048513-510001WO_SEQUENCE_LISTING_ST25.txt(创建于2019年9月19日,76,475字节,机器格式IBM-PC,MS Windows操作系统)中书写的序列表特此通过引用并入。
发明背景
在美国,大约5-8%的人患有自身免疫性疾病。研究人员已经鉴定出超过80种不同的自身免疫性疾病,并怀疑多得多的疾病可能具有自身免疫组分。在美国,仅类风湿性关节炎(RA)折磨着大约250万人。RA影响关节和骨骼,但也可能影响不同的器官和生物系统。
成纤维细胞样滑膜细胞(FLS)是在类风湿性关节炎(RA)中介导炎症和关节破坏的关键因素。人们越来越关注这种细胞类型,将其作为新一代抗-RA疗法的可能靶标,所述新一代抗-RA疗法将与免疫调节剂联合使用以帮助控制疾病而不增加免疫抑制。FLS的行为由多个互连的信号转导途径控制。这些途径中的几个涉及蛋白的酪氨酸残基上的可逆磷酸化,这是蛋白酪氨酸激酶(PTK)和磷酸酶(PTP)的平衡作用的结果。PTK是FLS生长和侵袭力的介质。PTP通过从蛋白上的磷酸化的酪氨酸残基除去磷酸酯基团而起作用。受体蛋白酪氨酸磷酸酶(RPTP或PTPR)是通常具有可变长度细胞外结构域、其后是跨膜区域和C-端催化细胞质结构域的PTP。
尽管可以使用改善免疫抑制性疾病的抗风湿药(DMARD),但许多类风湿性关节炎(RA)患者仍无法获得缓解。成纤维细胞样滑膜细胞(FLS)是非免疫性的关节内衬细胞,其在RA期间变得侵袭性。与DMARD组合的靶向FLS的非免疫抑制剂具有改善RA的控制而不增强感染风险的潜力。我们最近报道了,使用RPTPσ诱饵生物学制剂(RPTPσ-Ig1&2)破坏受体蛋白酪氨酸磷酸酶σ(RPTPσ)和蛋白聚糖多配体聚糖-4之间的相互作用减少FLS软骨侵袭。
慢性炎性病况诸如RA的当前疗法包括施用肿瘤坏死因子-α(TNF)或白介素-6(IL-6)抑制剂。但是,此类疗法包括显著的副作用,并且可以改善效力。
发明内容
本文尤其提供了包含第一量的PTPRS去簇剂和第二量的TNF抑制剂的药物组合物,其中所述第二量低于所述TNF抑制剂的治疗有效水平。在一些实施方案中,通过以下项目的增加,测量TNF抑制剂的治疗有效水平:(a)疾病或疾病的一种或多种症状的改善或(b)疾病或疾病的一种或多种症状的发作的延迟。
在一些实施方案中,所述TNF抑制剂是依那西普。在一些实施方案中,所述第二量是低于50mg依那西普。在一些实施方案中,所述TNF抑制剂是阿达木单抗。在一些实施方案中,所述第二量是低于40mg阿达木单抗。在一些实施方案中,所述TNF抑制剂是英夫利昔单抗。在一些实施方案中,所述第二量是低于3mg/kg英夫利昔单抗。在一些实施方案中,所述TNF抑制剂是戈利木单抗。在一些实施方案中,所述第二量是低于50mg戈利木单抗。在一些实施方案中,所述TNF抑制剂是塞妥珠单抗或培化舍珠单抗。在一些实施方案中,所述第二量是低于200mg塞妥珠单抗或培化舍珠单抗。
本文提供了包含第一量的PTPRS去簇剂和第二量的IL-6抑制剂的药物组合物,其中所述第二量低于IL-6抑制剂的治疗有效水平。在一些实施方案中,所述IL-6抑制剂是托珠单抗或Atlizumab。在一些实施方案中,通过静脉内输注来施用所述药物,且所述第二量是低于4mg/kg托珠单抗或Atlizumab。在一些实施方案中,皮下施用所述药物,且所述第二量是低于162mg托珠单抗或Atlizumab。在一些实施方案中,所述IL-6抑制剂是Sarilumab或Kevzara。在一些实施方案中,所述第二量是低于100mg Sarilumab或Kevzara。
本文提供了以上药物组合物中的任一种,其中所述第一量低于PTPRS去簇剂的治疗有效水平。在一些实施方案中,所述PTPRS去簇剂包括PTPRS免疫球蛋白-样结构域1(Ig1)和免疫球蛋白-样结构域2(Ig2)中的一种或两种。在一些实施方案中,所述PTPRS去簇剂结合硫酸类肝素。在一些实施方案中,所述PTPRS去簇剂缺乏跨膜结构域。在一些实施方案中,所述PTPRS去簇剂缺乏细胞内结构域。
在一些实施方案中,本文提供了以组合的协同量存在的第一量的PTPRS去簇剂和第二量的TNF或IL-6抑制剂的以上组合中的任一种的药物组合物。
本文提供了通过给受试者施用上述的PTPRS去簇剂和TNF抑制剂或PTPRS去簇剂和IL-6抑制剂的任意组合的药物组合物来治疗受试者中的自身免疫性疾病的方法。在一些实施方案中,所述PTPRS去簇剂不是硫酸软骨素。所述自身免疫性疾病可以是关节炎,且可以是类风湿性关节炎。所述自身免疫性疾病可以是硬皮病或克罗恩氏病。所述方法可以包括施用所述药物组合物的给药时间表。
本文提供了通过施用上述的任意药物组合来降低受试者中的成纤维细胞活性的方法。在一些实施方案中,所述PTPRS去簇剂不是硫酸软骨素。所述成纤维细胞活性可以是成纤维细胞迁移。所述成纤维细胞活性可以是胶原产生、糖胺聚糖产生、网状和弹性纤维产生、细胞因子产生、趋化因子产生、糖蛋白产生或它们的组合。所述成纤维细胞活性可以是细胞外基质产生。所述成纤维细胞可以是滑膜成纤维细胞、真皮成纤维细胞或间质成纤维细胞。在一些实施方案中,所述受试者具有成纤维细胞介导的疾病。所述成纤维细胞介导的疾病可以是纤维化。所述纤维化可以是肺纤维化、特发性肺纤维化、肝纤维化、心内膜心肌纤维化、心房纤维化、纵隔纤维化、骨髓纤维化、腹膜后纤维化、肾源性全身性纤维化、皮肤纤维化或关节纤维化。所述成纤维细胞介导的疾病可以是成纤维细胞介导的自身免疫性疾病。所述成纤维细胞介导的自身免疫性疾病可以是克罗恩氏病、关节炎、类风湿性关节炎或硬皮病。
本文提供了通过给受试者施用有效量的上面公开的任意药物组合物来调节受试者中的细胞外基质的方法,其中施用调节受试者中的细胞外基质。细胞外基质的调节可以是细胞外基质的一种或多种组分的调节。所述受试者可以具有细胞外基质疾病。
附图简要说明
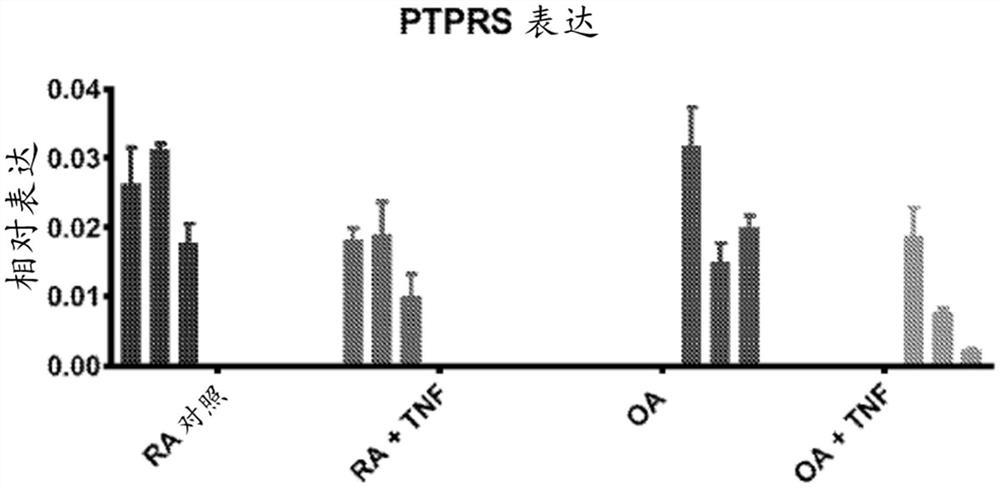
图1显示了RA和骨关节炎(OA)FLS中的PTPRS(编码RPTPσ)表达。图1A显示了RA(n=3)和OA(n=3)FLS中的相对PTPRS表达,有或没有TNF。图1B显示了RA和OA中的相对PTPRS表达合并物(n=3)。
图2显示了小鼠FLS中的TNF诱导的RPTPσ表达;将小鼠FLS血清饥饿24小时,且然后用50ng/ml TNF刺激或未刺激24小时。图2A显示了蛋白质印迹,其显示了有或没有TNF刺激下的RA FLS RPTPσ蛋白表达。图2B显示了有或没有TNF刺激下的小鼠FLS RPTPσmRNA相对表达。
图3显示了Ig1&2His-和Fc-构建体的接头区域的氨基酸序列。
图4显示了在没有或有TNF或PTPRS Fc-Ig1&2(Ig1&1)(单独或组合)存在下在血清饥饿FLS(n=3)单层上的使用Fc-Ig1&2构建体1的划痕测定的结果。图4A显示了在有或没有TNF或Ig1&2(单独或组合)存在下,在创伤时(0小时)或在创伤后12、24或48小时,在RA 1757中的创伤宽度(以任意单位计)。图4B显示了在有或没有TNF或Ig1&2(单独或组合)存在下,在创伤时(0小时)或在创伤后12、24或48小时,在RA 1775中的创伤宽度(以任意单位)。图4C显示了在有或没有TNF或Ig1&2(单独或组合)存在下,在创伤时(0小时)或在创伤后12、24或48小时,在RA 1402中的创伤宽度(以任意单位计)。图4D显示了在有或没有TNF或Ig1&2(单独或组合)存在下,在创伤时(0小时)或在创伤后12、24或48小时,在RA FLS中的创伤宽度(以任意单位计)。使用双因素方差分析(ANOVA,****,P<0.0001)分析数据。
图5显示了来自关节炎K/BxN血清转移诱导的关节炎(STIA)小鼠的单核细胞或巨噬细胞中的RPTPσ表达。图5A显示了经典的(Ly6C+CD43-)、中间的(Ly6C+CD43+)或非经典的(Ly6C-CD43+)循环单核细胞(血液单核细胞)中的RPTPσ表达;为了对比显示了浆细胞样树突细胞(pDC)中的RPTPσ表达。图5B显示了(Ly6C+CD43-)、中间的(Ly6C+CD43+)或非经典的(Ly6C-CD43+)关节巨噬细胞(踝巨噬细胞)中的RPTPσ表达;为了对比显示了浆细胞样树突细胞(pDC)中的RPTPσ表达,其已知表达高水平的RPTPσ。
图6显示,相对于野生型(WT)小鼠用来自RPTPσ-敲除(KO)(利用了His-标记的Ig1&2构建体)的骨髓重建的小鼠中的STIA在STIA模型中显示对Ig1&2的相同应答性。图6A显示了在接受Ig1&2或媒介物的注射以后,在第0、2、4、6和8天,用Ig1&2“使用中”构建体处理的WT或RPTPσ-KO STIA小鼠的临床评分。图6B显示了在接受Ig1&2或媒介物的注射以后,在第0、2、4、6和8天,用Ig1&2“使用中”构建体处理的WT或RPTPσ-KO STIA小鼠的踝厚度(以mm计)的变化。显示了平均值±均值标准差,并使用双因素方差分析(ANOVA,**,P<0.01)分析数据。
图7显示,Fc-Ig1&2“使用中”作为单一疗法或与TNF抑制剂鼠依那西普(p75mTNFr:Fc)组合有效地逆转胶原诱导的关节炎(CIA),并且Ig1&2和鼠依那西普的组合显示比单独TNF抑制剂显著更高的效力。显示了平均值±均值标准差。
图8显示,TNF抑制剂鼠依那西普(p75mTNFr:Fc)的滴定证实了在低于治疗有效水平(2mg/kg)的作用和在CIA小鼠的关节匀浆物中PTPRS的诱导。图8A显示了在第0天接受初次免疫接种并在第21天强化的小鼠的临床评分的演化。显示了平均值±均值标准差。图8B显示了用媒介物或不同剂量的鼠依那西普处理的小鼠的踝中的PTPRS的相对表达。
图9显示了用Fc-Ig1&2“构建体1”或依那西普(单独或组合)处理的小鼠的关节炎的临床评分。
图10显示了在用Fc-Ig1&2“构建体1”处理的小鼠中在第一次和第二次施用不完全弗氏佐剂(IFA)以后的抗-胶原抗体水平。
图11显示了在CIA中在Fc-Ig1&2和鼠依那西普之间的治疗协同作用。图11A显示了实验的卡通总结以及分开和一起的Fc-Ig1&2和鼠依那西普的处理后临床评分的时程。图11B显示了在实验结束时,在图11A的小鼠的血清中的抗II型胶原IgG抗体的水平。图11C显示了如在图11A中所示处理的小鼠中滑膜炎的组织病理学评分。图11D显示了如在图11A中所示处理的小鼠中骨侵蚀的组织病理学评分。图11E显示了如在图11A中所示处理的小鼠中软骨消耗的组织病理学评分。在图11B-E中,所述图显示了通过双因素方差分析(图11A相对于媒介物组)或单因素方差分析(图11C-E)的平均值±均值标准差,*P<0.05,**P<0.01,***P<0.001,****P<0.0001。
图12显示了从RA患者的滑液组织分离出的RA FLS的RNA-seq数据。
图13显示了Fc-Ig1&2在实验性小鼠关节炎中的效力。图13A显示了在小鼠模型中在处理后踝厚度的减小。图13B显示了用111-铟(
图14显示了Ig1&2(His-Ig1&2和Fc-Ig1&2)对各种临床量度的作用。图14A显示了Ig1&2对CD45.1同系小鼠中的STIA的作用,所述CD45.1同系小鼠进行了致命辐照(>1000Rad)和来自CD45.2 WT或PTPRS KO小鼠的骨髓移植。图14B显示了Ig1&2对关节炎K/BxN转基因小鼠的作用,所述关节炎K/BxN转基因小鼠在6-7周龄开始发生自发性关节炎。图14C显示了在使小鼠发生STIA之前,Ig1&2对pDC耗尽的小鼠的作用。图14D显示了Fc-Ig1&2对CIA小鼠的关节炎踝中的调节性T细胞(Treg)或Th17细胞的积累或繁殖的作用。图14E显示了Fc-Ig1&2对相同踝中的MHCII
图15显示了TNF对PTPRS表达的作用。图15A显示了在具有6个组蛋白修饰、开放染色质(ATAC-seq)、RNA-Seq和DNA甲基化的RA FLS中的PTPRS基因座的表观基因组情况。图15B显示了siRNA介导的USF2敲低对RA FLS中的PTPRS的作用。图15C显示了USF2对PTPRS的启动子区域的结合的ChIP测定。图15D显示了在有和没有USF2存在下的PTPRS萤光素酶报告测定。
图16显示了TNF对PTPRS表达的作用。图16A显示了递增量的TNF对RA中的PTPRS表达的作用。图16B显示了递增量的TNF对OA中的PTPRS表达的作用。图16C显示了在RA和OAFLS之间PTPRS的基础表达水平的对比。
图17显示了体外活动力测定。图17A显示了在没有TNF存在下创伤区域的变化。图17B显示了在有50ng/ml TNF存在下创伤区域的变化。
图18显示了作为单一疗法和与亚治疗(2mg/kg)剂量的TNF抑制剂组合施用的亚治疗(0.1和0.25mg)剂量的Ig1&2在小鼠胶原诱导的关节炎(CIA)的逆转中的作用。在初次免疫接种后第44、46和48天通过腹膜内注射,用人IgG1 Fc对照、媒介物(N=9)、2mg/kg鼠依那西普(mEtan,N=9)、0.5mg Fc-Ig1&2(N=10)、0.25mg Fc-Ig1&2(N=10)、0.1mg Fc-Ig1&2(N=10)、2mg/kg mEtan+0.1mg Fc-Ig1&2(combo,N=10)处理CIA小鼠。每2天通过临床评分评估关节炎。
图19显示了有或没有IL-6存在下,RA FLS中的相对PTPRS表达。
图20显示了Fc-Ig1&2对STIA小鼠模型中的关节炎评分的作用。从上至下,在第14天,且对于每幅图,在图20上显示的线分别代表下述:媒介物,0.05mg Fc-Ig1&2,0.1mg Fc-Ig1&2,025mg Fc-1&2,和0.5mg Fc-1&2。
发明详述
本申请涉及包括PTPRS去簇剂和TNF抑制剂或IL-6抑制剂的组合的药物组合物和与其有关的治疗方法,所述药剂或抑制剂的量低于单独的所述药剂或抑制剂的治疗有效水平。申请人发现了PTPRS去簇剂和TNF抑制剂或PTPRS去簇剂和IL-6抑制剂之间的惊人协同作用。尽管不希望受理论的限制,PTPRS去簇剂可以用于至少下述情况:(1)在部分应答者中作为助剂,或(2)对于经历不希望的感染的患者,或对于具有良好控制但想要降低它们的感染风险的患者,作为免疫抑制剂节省剂(sparing agent)。
术语”受试者”、“患者”、“个体”等不意图是限制性的,并且可以通常互换。也就是说,被描述为“患者”的个体不一定具有给定的疾病,而可能只是在寻求医疗指导。
“对照”或“标准对照”表示充当参考的样品、测量结果或值,通常是已知的参考,其用于与测试样品、测量结果或值进行对比。例如,可以从怀疑具有给定的疾病(例如自身免疫性疾病、炎性自身免疫性疾病、癌症、传染性疾病、免疫疾病或其它疾病)的患者获取测试样品,并与已知的正常的(未患病的)个体(例如标准对照受试者)对比。标准对照还可以代表从不具有给定疾病的相似个体(例如标准对照受试者,例如,具有相似医学背景、相同年龄、重量等的健康个体)的群体(即标准对照群体)收集的平均测量结果或值。也可以从相同个体,例如从在疾病发作之前从患者较早获得的样品,获得标准对照值。技术人员会认识到,可以设计标准对照来评估任意数量的参数(例如RNA水平、蛋白水平、特定细胞类型、特定体液、特定组织、滑膜细胞、滑液、滑液组织、成纤维细胞样滑膜细胞、巨噬细胞-样滑膜细胞等)。
本领域技术人员会理解哪些标准对照在给定情况下最合适,并且能够基于与标准对照值的对比来分析数据。标准对照对于确定数据的显著性(例如统计显著性)也是有价值的。例如,如果给定参数的值在标准对照中变化很大,则测试样品中的变化将不被认为是显著的。
术语“剂”和“剂量”在本文中可互换地使用。剂量表示在每次施用时施用给个体的活性成分的量。剂量将随许多因素而变化,所述因素包括给定疗法的正常剂量范围,施用频率;个体的大小和耐受性;病况的严重程度;副作用的风险;和施用途径。技术人员会认识到,可以根据上述因素或基于治疗进展来调整剂量。术语“剂型”表示药物或药物组合物的特定形式,并且取决于施用途径。例如,剂型可以是用于喷雾的液体形式,例如用于吸入剂,呈片剂或液体,例如用于口服递送,或者盐水溶液,例如用于注射。
本文中使用的术语“治疗”和“预防”可以表示发作的任何延迟,症状的频率或严重程度的降低,症状的改善,患者舒适或功能(例如关节功能)的改善,疾病状态的严重程度的降低等。可以将治疗效果与未接受给定治疗的个体或一组个体进行对比,或者与治疗之前或治疗停止之后的同一患者进行对比。术语“预防”通常表示减少给定的疾病(例如自身免疫性疾病、炎性自身免疫性疾病、癌症、传染性疾病、免疫疾病或其它疾病)或疾病症状在患者中的发生。如上面指出的,预防可以是完全的(没有可检测的症状)或部分的,使得所观察到的症状少于在没有治疗时可能发生的症状。
本文中使用的“治疗有效剂量或量”是指产生施用所追求的效果(例如治疗或预防疾病)的剂量。确切的剂量和制剂将取决于治疗的目的,并且将由本领域技术人员使用已知技术确定(参见,例如,Lieberman,Pharmaceutical Dosage Forms(第1-3卷,1992);Lloyd,The Art,Science and Technology of Pharmaceutical Compounding(1999);Remington:The Science and Practice of Pharmacy,第20版,Gennaro,Editor(2003),和Pickar,Dosage Calculations(1999))。例如,对于给定的参数,治疗有效量将显示出至少5%、10%、15%、20%、25%、40%、50%、60%、75%、80%、90%或至少100%的增加或减少。治疗效力也可以表示为“倍数”增加或减少。例如,与标准对照相比,治疗有效量可以具有至少1.2倍、1.5倍、2倍、5倍或更多的作用。治疗有效剂量或量可以改善疾病的一种或多种症状。当施用所追求的效果是治疗处于发生疾病的风险中的人时,治疗有效剂量或量可以预防或延迟疾病或疾病的一种或多种症状的发作。
术语“诊断”表示在受试者中存在疾病(例如自身免疫性疾病、炎性自身免疫性疾病、癌症、传染性疾病、免疫疾病或其它疾病)的相对概率。类似地,术语“预后”表示相对于疾病状态在受试者中可能发生某种未来结果的相对概率。例如,在本发明的上下文中,预后可以表示个体将发生疾病(例如自身免疫性疾病、炎性自身免疫性疾病、癌症、传染性疾病、免疫疾病或其它疾病)的可能性,或疾病的可能严重程度(例如疾病持续时间)。如医学诊断领域的任何技术人员所理解的,所述术语不意图是绝对的。
本文所用的“核酸”或“寡核苷酸”或“多核苷酸”或语法等效词是指至少两个共价地连接在一起的核苷酸。术语“核酸”包括单链、双链或多链DNA、RNA及其类似物(衍生物)。寡核苷酸通常为约5、6、7、8、9、10、12、15、25、30、40、50个或更多个核苷酸长度,最高达约100个核苷酸长度。核酸和多核苷酸是任何长度的聚合物,包括更长的长度,例如,200、300、500、1000、2000、3000、5000、7000、10,000等。在某些实施方案中,本文的核酸包含磷酸二酯键。在其它实施方案中,包括可具有替代主链的核酸类似物,所述替代主链包含例如氨基磷酸酯、硫代磷酸酯、二硫代磷酸酯或O-甲基亚磷酰胺键(参见Eckstein,Oligonucleotidesand Analogues:APractical Approach,Oxford University Press);和肽核酸主链和键。其它类似物核酸包括具有正主链、非离子主链和非核糖主链的那些,包括在以下文献中描述的那些:美国专利号5,235,033和5,034,506,和第6和7章,ASC Symposium Series 580,Carbohydrate Modifications in Antisense Research,Sanghui和Cook编。含有一种或多种碳环糖的核酸也被包括在核酸的定义内。出于多种原因,可以进行核糖-磷酸酯主链的修饰,例如,为了增加此类分子在生理环境中或作为生物芯片上的探针的稳定性和半衰期。可以制备天然存在的核酸和类似物的混合物;可替换地,可以制备不同的核酸类似物的混合物,以及天然存在的核酸和类似物的混合物。
特定的核酸序列也涵盖“剪接变体”。类似地,由核酸编码的特定蛋白涵盖由该核酸的剪接变体编码的任何蛋白。顾名思义,“剪接变体”是基因的选择性剪接的产物。转录后,可以剪接初始核酸转录物,使得不同的(替代)核酸剪接产物编码不同的多肽。剪接变体的产生机制会变化,但是包括外显子的交替剪接。该定义也包括通过通读转录从相同核酸衍生出的交替多肽。在该定义中包括剪接反应的任意产物,包括剪接产物的重组形式。在Leicher,等人,J.Biol.Chem.273(52):35095-35101(1998)中讨论了钾通道剪接变体的一个例子。
当核酸与另一个核酸序列发生功能关系时,所述核酸是“可操作地连接的”。例如,前序列或分泌型前导序列的DNA与多肽的DNA可操作地连接,条件是其表达为参与所述多肽的分泌的前蛋白;启动子或增强子与编码序列可操作地连接,条件是其影响所述序列的转录;或核糖体结合位点与编码序列可操作地连接,条件是其被定位为促进翻译。通常,“可操作地连接”是指,所连接的DNA序列彼此靠近,并且在分泌型前导序列的情况下,是连续的并且处于阅读阶段。但是,增强子不必是连续的。通过在方便的限制位点处连接来完成连接。如果这样的位点不存在,则根据常规实践使用合成的寡核苷酸衔接子或接头。
本文中使用的术语“探针”或“引物”被定义为一种或多种核酸片段,其与样品的特异性杂交是可检测的。探针或引物可以具有任何长度,取决于它将用于的特定技术。例如,PCR引物通常是10至40个核苷酸的长度,而用于例如DNA印迹的核酸探针可以是超过一百个核苷酸的长度。探针可以是未标记的或如下所述标记,使得可以检测其与靶标或样品的结合。探针可以由来自染色体的一个或多个特定(预选)部分的核酸来源(例如,一个或多个克隆、分离的完整染色体或染色体片段、或聚合酶链式反应(PCR)扩增产物的集合)产生。固定至靶标元件上的核酸的长度和复杂性对本发明而言不是关键的。技术人员可以调整这些因素,以为给定的杂交程序提供最佳的杂交和信号产生,并在不同的基因或基因组位置间提供所需的分辨率。
所述探针也可以是固定化在固体表面(例如,硝酸纤维素、玻璃、石英、熔化的二氧化硅载玻片)上的分离的核酸,如在阵列中。在一些实施方案中,探针可以是例如WO 96/17958中所述的核酸阵列的成员。能够产生高密度阵列的技术也可以用于该目的(参见,例如,Fodor(1991)Science 767-773;Johnston(1998)Curr.Biol.8:R171-R174;Schummer(1997)Biotechniques 23:1087-1092;Kern(1997)Biotechniques 23:120-124;美国专利号5,143,854)。
“标记的核酸探针或寡核苷酸”是这样的:其共价地(通过接头或化学键)或非共价地(通过离子键、范德华力、静电键或氢键)结合至标记物,使得探针的存在可以通过检测与探针结合的标记物的存在来检测到。可替换地,使用高亲和力相互作用的方法可以获得相同的结果,其中一对结合配偶体中的一个结合另一个,例如,生物素、链霉抗生物素蛋白。
在两个或更多个核酸或多肽序列的上下文中,术语“相同”序列或序列“同一性”百分比表示这样的两个或更多个序列或子序列:使用BLAST或BLAST 2.0序列对比算法用下述的默认参数测量,或通过手工比对和目检(参见,例如,NCBI网站ncbi.nlm.nih.gov/BLAST/等),是相同的,或者具有指定百分比的相同的氨基酸残基或核苷酸(即,当为了在对比窗或指定区域中的最大对应性而对比和比对时,在指定区域上约60%同一性,优选地65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高同一性)。这样的序列然后被说成是“基本上等同的”。该定义也表示,或可以应用于,测试序列的编译(compliment)。该定义还包括具有缺失和/或添加的序列以及具有置换的序列。采用的算法可以考虑间隙等。
为了序列对比,通常一个序列充当参照序列,测试序列与其对比。当使用序列对比算法时,将测试序列和参照序列输入计算机,如果必要的话,指定子序列坐标,并指定序列算法程序参数。优选地,可以使用默认程序参数,或可以指定可选参数。序列对比算法然后基于程序参数计算测试序列相对于参照序列的序列同一性百分比。
本文中使用的“对比窗”包括对选自20至600、通常约50至约200、更通常约100至约150的连续位置数目中的任一个的区段的提及,在两个序列最佳比对后,可以将在该区段中的序列与相同数目的连续位置的参照序列进行对比。用于对比的序列比对方法是本领域众所周知的。用于对比的序列的最佳比对可以例如通过下述方法实现:Smith&Waterman,Adv.Appl.Math.2:482(1981)的局部同源性算法,Needleman&Wunsch,J.Mol.Biol.48:443(1970)的同源性比对算法,Pearson&Lipman,Proc.Nat’l.Acad.Sci.USA85:2444(1988)的检索相似性方法,这些算法的计算机化实现(在Wisconsin Genetics Software Package,Genetics Computer Group,575Science Dr.,Madison,WI中的GAP、BESTFIT、FASTA和TFASTA),或手工比对和目检(参见,例如,Current Protocols in Molecular Biology(Ausubel等人编.1995增刊))。
适用于确定序列同一性百分比和序列相似性的算法的优选例子是BLAST和BLAST2.0算法,这些算法分别在Altschul等人,Nuc.Acids Res.25:3389-3402(1977)和Altschul等人,J.Mol.Biol.215:403-410(1990)中描述。
短语“选择性地(或特异性地)杂交”表示分子仅对特定的核苷酸序列以比其它核苷酸序列(例如,总细胞或文库DNA或RNA)更高的亲和力(例如,在更严谨的条件下)的结合、双链形成或杂交。
短语“严谨杂交条件”表示核酸将与其靶序列杂交(通常在核酸的复杂混合物中)但不与其它序列杂交的条件。严谨条件是序列依赖性的,并且在不同情况下将不同。较长的序列在较高温度下特异性地杂交。关于核酸杂交的广泛指导参见Tijssen,Techniques inBiochemistry and Molecular Biology--Hybridization with Nucleic Probes,“Overview of principles of hybridization and the strategy of nucleic acidassays”(1993)。通常,严谨杂交条件被选择为比特定序列在限定的离子强度pH下的热解链温度(Tm)低约5-10℃。Tm是50%的与靶标互补的探针与靶序列平衡杂交时的温度(在定义的离子强度、pH和核酸浓度下)(因为靶序列过量存在,在Tm,50%的探针在平衡时被占据)。严谨杂交条件也可以通过添加去稳定剂诸如甲酰胺来实现。对于选择性或特异性杂交,阳性信号是背景杂交的至少两倍,优选是背景杂交的10倍。示例性的严谨杂交条件可以是如下:50%甲酰胺、5x SSC和1%SDS,在42℃温育;或者,5x SSC、1%SDS,在65℃温育,在65℃在0.2x SSC和0.1%SDS中洗涤。示例性的“中等严谨杂交条件”包括在37℃在40%甲酰胺、1M NaCl、1%SDS的缓冲液中杂交,和在45℃在1X SSC中洗涤。阳性杂交是背景的至少2倍。普通技术人员将容易地认识到,可以利用替代性杂交和洗涤条件来提供相似严谨性的条件。在许多参考文献中提供了用于确定杂交参数的其它指南,例如,Current Protocols inMolecular Biology,Ausubel,等人编,John Wiley&Sons。
如果核酸编码的多肽是基本相同的,则所述核酸可以是基本相同的。例如,当使用遗传密码允许的最大密码子简并性创建核酸的拷贝时,就会发生这种情况。在这种情况下,核酸通常在中等严谨杂交条件下杂交。
“抑制性核酸”是这样的核酸(例如DNA、RNA、核苷酸类似物的聚合物):其能够结合靶核酸(例如可翻译为PTPRS的mRNA)并减少靶核酸的转录(例如从DNA至mRNA)或减少靶核酸的翻译(例如mRNA)或改变转录物剪接(例如单链吗啉代寡核苷酸)。“吗啉代寡核苷酸”可以可替代地称为“吗啉代核酸”,并且表示本领域通常已知的含吗啉的核酸(例如,氨基磷酸酯吗啉代寡核苷酸或“PMO”)。参见Marcos,P.,Biochemical and Biophysical ResearchCommunications 358(2007)521-527。在一些实施方案中,所述“抑制性核酸”是能够结合(例如杂交)至靶核酸(例如可翻译成RPTPσ的mRNA)并减少靶核酸翻译的核酸。靶核酸是或包括抑制性核酸所结合(例如杂交)的一个或多个靶核酸序列。因而,抑制性核酸通常是或包括能够在靶核酸序列上与靶核酸的至少一部分杂交的序列(在本文中也被称作“反义核酸序列”)。抑制性核酸的一个例子是反义核酸。抑制性核酸的另一个例子是siRNA或RNAi(包括其衍生物或前体,诸如核苷酸类似物)。其它例子包括shRNA、miRNA、shmiRNA或某些它们的衍生物或前体。在一些实施方案中,所述抑制性核酸是单链的。在其它实施方案中,所述抑制性核酸是双链的。
“反义核酸”是这样的核酸(例如DNA、RNA或其类似物):其与特定靶核酸(例如靶核酸序列)诸如mRNA分子(例如靶mRNA分子)的至少一部分至少部分地互补(参见,例如,Weintraub,Scientific American,262:40(1990)),例如反义、siRNA、shRNA、shmiRNA、miRNA(微RNA)。因此,反义核酸能够与靶核酸(例如靶mRNA)杂交(例如选择性杂交)。在一些实施方案中,反义核酸在严谨杂交条件下与靶核酸序列(例如mRNA)杂交。在一些实施方案中,反义核酸在中等严谨杂交条件下与靶核酸(例如mRNA)杂交。反义核酸可以包含天然存在的核苷酸或修饰的核苷酸,诸如例如,硫代磷酸酯、甲基膦酸酯和-端基异构糖-磷酸酯、主链-修饰的核苷酸。“抗-PTPRS反义核酸”是与编码PTPRS的至少一部分的靶核酸序列(诸如mRNA分子)的至少一部分至少部分地互补的反义核酸。在一些实施方案中,反义核酸是吗啉代寡核苷酸。在一些实施方案中,吗啉代寡核苷酸是本领域已知的单链反义核酸。在一些实施方案中,吗啉代寡核苷酸降低靶标的蛋白表达,减少靶mRNA的翻译,减少靶mRNA的翻译起始,或修饰转录物剪接。在一些实施方案中,吗啉代寡核苷酸缀合至细胞可渗透部分(例如肽)。反义核酸可以是单链或双链核酸。
在细胞中,反义核酸可以与靶mRNA杂交,从而形成双链分子。反义核酸干扰mRNA的翻译,因为细胞不会翻译双链的mRNA。反义方法用于抑制基因的体外翻译的用途是本领域众所周知的(Marcus-Sakura,Anal.Biochem.,172:289,(1988))。可以使用与DNA直接结合的反义分子。
使用本领域已知的任何适当方式可以将抑制性核酸递送至受试者,包括通过注射、吸入或口服摄入。另一种合适的递送系统是胶体分散系统,诸如例如大分子复合物、纳米囊、微球、珠子和基于脂质的系统,包括水包油乳剂、胶束、混合胶束和脂质体。本发明的胶体系统的一个例子是脂质体。脂质体是可用作体外和体内递送媒介物的人工膜囊泡。核酸(包括在脂质体内的RNA和DNA)以生物活性形式被递送至细胞(Fraley,等人,TrendsBiochem.Sci.,6:77,1981)。使用本领域已知的任何方法,可以将脂质体靶向至特定的细胞类型或组织。使用细胞可渗透的递送系统(例如细胞可渗透的肽),可以将抑制性核酸(例如反义核酸、吗啉代寡核苷酸)递送至细胞。在某些实施方案中,使用病毒载体或病毒将抑制性核酸递送至特定细胞或组织。
“siRNA”表示形成双链RNA的核酸,当siRNA在与基因或靶基因相同的细胞中存在(例如表达)时,所述双链RNA具有减少或抑制基因或靶基因的表达的能力。siRNA通常为约5至约100个核苷酸的长度,更通常为约10至约50个核苷酸的长度,更通常为约15至约30个核苷酸的长度,最通常为约20-30个碱基核苷酸的长度,或约20-25或约24-29个核苷酸的长度,例如20、21、22、23、24、25、26、27、28、29或30个核苷酸的长度。siRNA分子及其产生方法描述于,例如,Bass,2001,Nature,411,428-429;Elbashir等人,2001,Nature,411,494-498;WO 00/44895;WO 01/36646;WO 99/32619;WO 00/01846;WO 01/29058;WO 99/07409;和WO 00/44914。转录dsRNA或siRNA(例如,作为发夹双链体)的DNA分子也提供RNAi。在美国专利号6,573,099中和在美国专利申请公开号2002/0160393和2003/0027783以及Tuschl和Borkhardt,Molecular Interventions,2:158(2002)中公开了用于转录dsRNA的DNA分子。
可以直接施用siRNA,或可以使用siRNA表达载体诱导具有不同设计标准的RNAi。载体可以插入两个被短间隔序列隔开的反向重复序列并以一串T终止,这些T用于终止转录。
含有核酸序列的合适载体的构建采用本领域众所周知的标准连接和限制技术(参见Maniatis等人,Molecular Cloning:ALaboratory Manual,Cold Spring HarborLaboratory,New York(1982))。将分离的质粒、DNA序列或合成的寡核苷酸切割、剪裁并以期望形式重新连接。
“生物样品”或“样品”表示获得自或衍生自受试者或患者的材料。生物样品包括组织(诸如活组织检查和尸体剖检样品)的切片,以及用于组织学目的的冷冻切片。此类样品包括体液诸如血液和血液级分或产物(例如,血清、血浆、血小板、红血细胞等)、痰、组织、培养的细胞(例如,原代培养物、外植体和转化的细胞)粪便、尿、滑液、关节组织、滑液组织、滑膜细胞、成纤维细胞样滑膜细胞、巨噬细胞-样滑膜细胞、免疫细胞、造血细胞、成纤维细胞、巨噬细胞、T细胞等。生物样品通常获得自:真核生物,诸如哺乳动物诸如灵长类动物,例如,黑猩猩或人;奶牛;狗;猫;啮齿动物,例如,豚鼠、大鼠、小鼠;兔;或鸟;爬行动物;或鱼。
“活组织检查(样品)”表示为了诊断或预后评价而取出组织样品的过程,并且表示组织样本本身。本领域已知的任何活组织检查技术都可以应用于本发明的诊断和预后方法。应用的活组织检查技术将取决于要评价的组织类型(即,前列腺、淋巴结、肝、骨髓、血细胞、关节组织、滑液组织、滑膜细胞、成纤维细胞样滑膜细胞、巨噬细胞-样滑膜细胞、免疫细胞、造血细胞、成纤维细胞、巨噬细胞、T细胞等),以及其它因素。代表性的活组织检查技术包括切除活组织检查、切口活组织检查、针吸活组织检查、外科手术活组织检查和骨髓活组织检查。例如,在Harrison’s Principles of Internal Medicine(Kasper,等人编,2005年第16版,第70章,且贯穿第V部分)中讨论了活组织检查技术。
术语“多肽”、“肽”和“蛋白”在本文中可互换使用,以表示氨基酸残基的聚合物。该术语适用于其中一个或多个氨基酸残基是对应的天然存在的氨基酸的人工化学模拟物的氨基酸聚合物,以及适用于天然存在的氨基酸聚合物和非天然存在的氨基酸聚合物。
术语“氨基酸”表示天然存在的和合成的氨基酸,以及以与天然存在的氨基酸类似的方式发挥功能的氨基酸类似物和氨基酸模拟物。天然存在的氨基酸是由遗传密码编码的那些,以及以后修饰的那些氨基酸,例如,羟脯氨酸、γ-羧基谷氨酸和O-磷酸丝氨酸。氨基酸类似物表示这样的化合物:其具有与天然存在的氨基酸相同的基本化学结构,即,与氢、羧基、氨基和R基团结合的α碳,例如,高丝氨酸、正亮氨酸、甲硫氨酸亚砜、甲硫氨酸甲基锍。这样的类似物具有修饰的R基团(例如,正亮氨酸)或修饰的肽主链,但是保留与天然存在的氨基酸相同的基本化学结构。氨基酸模拟物表示这样的化学化合物:其结构不同于氨基酸的一般化学结构,但是其发挥功能的方式类似于天然存在的氨基酸。
氨基酸在本文中可以用它们的通常已知的三字母符号或IUPAC-IUB生物化学命名委员会推荐的单字母符号来表示。同样,核苷酸可以用它们的通常被接受的单字母代码来表示。
“保守修饰的变体”适用于氨基酸和核酸序列。关于特定的核酸序列,保守修饰的变体表示编码相同或基本相同氨基酸序列的那些核酸,或当核酸不编码氨基酸序列时,表示基本相同的序列。由于遗传密码的简并性,大量在功能上相同的核酸编码任意给定的蛋白质。例如,密码子GCA、GCC、GCG和GCU都编码氨基酸丙氨酸。因此,在每个其中丙氨酸由密码子指定的位置,可以将密码子改变成所描述的对应密码子中的任一种,而不改变编码的多肽。这样的核酸变异是“沉默变异”,它们是保守修饰的变异中的一类。本文中每种编码多肽的核酸序列也描述了所述核酸的每种可能的沉默变异。技术人员会认识到,可以修饰核酸中的每种密码子(除了AUG和TGG以外,AUG通常是甲硫氨酸的唯一密码子,TGG通常是色氨酸的唯一密码子)以产生在功能上相同的分子。因此,相对于表达产物,而不是相对于实际探针序列,编码多肽的核酸的每个沉默变异都隐含在每个所述序列中。
关于氨基酸序列,技术人员会认识到,改变、添加或删除编码的序列中的单个氨基酸或小百分比的氨基酸的对核酸、肽、多肽或蛋白序列的单个置换、缺失或添加是“保守修饰的变体”,其中所述改变导致化学上类似的氨基酸对氨基酸的置换。提供在功能上类似的氨基酸的保守置换表是本领域众所周知的。这样的保守修饰的变体加入到并且不排除本发明的多态变体、种间同系物和等位基因。
下面的八组每组含有相互为保守置换的氨基酸:1)丙氨酸(A)、甘氨酸(G);2)天冬氨酸(D)、谷氨酸(E);3)天冬酰胺(N)、谷氨酰胺(Q);4)精氨酸(R)、赖氨酸(K);5)异亮氨酸(I)、亮氨酸(L)、甲硫氨酸(M)、缬氨酸(V);6)苯丙氨酸(F)、酪氨酸(Y)、色氨酸(W);7)丝氨酸(S)、苏氨酸(T);和8)半胱氨酸(C)、甲硫氨酸(M)(参见,例如,Creighton,Proteins(1984))。
“标记物”或“可检测部分”是通过光谱、光化学、生物化学、免疫化学、化学或其它物理手段可检测的组合物。例如,有用的标记物包括32P、荧光染料、电子致密试剂、酶(例如,通常在ELISA中使用的酶)、生物素、地高辛配基或半抗原和蛋白或可以造成可检测(例如,通过将放射性标记物掺入与目标肽特异性反应的肽或抗体)的其它实体。可以使用本领域已知的将抗体与标记物缀合的任何方法,例如,使用在Hermanson,BioconjugateTechniques 1996,Academic Press,Inc.,San Diego中描述的方法。
当涉及例如细胞、或核酸、蛋白、或载体使用时,术语“重组体”指示,细胞、核酸、蛋白或载体已经通过实验室方法修饰或为实验室方法的结果。因此,例如,重组蛋白包括通过实验室方法产生的蛋白。重组蛋白可以包括在蛋白的天然(非重组)形式中找不到的氨基酸残基,或者可以包括已经被修饰(例如标记)的氨基酸残基。
当关于核酸的部分使用时,术语“异源的”指示,所述核酸包含两个或更多个在自然界中没有发现彼此具有相同关系的子序列。例如,核酸通常重组产生,具有被排列以产生新的功能性核酸的来自不相关基因的两个或更多个序列,例如来自一个来源的启动子和来自另一个来源的编码区。类似地,异源蛋白指示,该蛋白包含两个或更多个在自然界中彼此之间没有相同关系的子序列(例如,融合蛋白)。
多肽可以化学连接至另一分子。本文中使用的术语“生物缀合物”和“生物缀合物接头”表示“生物缀合物反应基团”或“生物缀合物反应部分”的原子或分子之间的所得结合。所述结合可以是直接的或间接的。例如,本文提供的第一生物缀合物反应基团(例如,-NH2、-C(O)OH、-N-羟基琥珀酰亚胺或-马来酰亚胺)和第二生物缀合物反应基团(例如,巯基、含硫的氨基酸、胺、含胺侧链的氨基酸或羧酸酯)之间的缀合物可以是直接的,例如,通过共价键或接头(例如第一接头或第二接头),或是间接的,例如,通过非共价键(例如静电相互作用(例如离子键、氢键、卤素键)、范德华相互作用(例如偶极-偶极、偶极诱导的偶极、伦敦分散)、环堆叠(π效应)、疏水相互作用等)。在实施方案中,使用生物缀合物化学(即两个生物缀合物反应基团的结合)形成生物缀合物或生物缀合物接头,所述生物缀合物化学包括、但不限于亲核取代(例如,胺和醇与酰卤、活性酯的反应),亲电子取代(例如,烯胺反应)和向碳-碳和碳-杂原子重键的加成(例如,Michael反应、第尔斯-阿尔德加成)。这些和其它有用的反应在例如以下文献中进行了讨论:March,ADVANCED ORGANIC CHEMISTRY,第3版,John Wiley&Sons,New York,1985;Hermanson,BIOCONJUGATE TECHNIQUES,AcademicPress,San Diego,1996;和Feeney等人,MODIFICATION OF PROTEINS;Advances inChemistry Series,第198卷,American Chemical Society,Washington,D.C.,1982。在实施方案中,将第一个生物缀合物反应基团(例如,马来酰亚胺部分)共价地连接至第二个生物缀合物反应基团(例如巯基)。在实施方案中,将第一个生物缀合物反应基团(例如,卤代乙酰基部分)共价地连接至第二个生物缀合物反应基团(例如巯基)。在实施方案中,将第一个生物缀合物反应基团(例如,吡啶基部分)共价地连接至第二个生物缀合物反应基团(例如巯基)。在实施方案中,将第一个生物缀合物反应基团(例如,-N-羟基琥珀酰亚胺部分)共价地连接至第二个生物缀合物反应基团(例如胺)。在实施方案中,将第一个生物缀合物反应基团(例如,马来酰亚胺部分)共价地连接至第二个生物缀合物反应基团(例如巯基)。在实施方案中,将第一个生物缀合物反应基团(例如,-磺基-N-羟基琥珀酰亚胺部分)共价地连接至第二个生物缀合物反应基团(例如胺)。
本文中使用的术语“结合”和“结合的”根据其一般和普通含义使用,并且表示原子或分子之间的结合。所述结合可以是直接的或间接的。例如,结合的原子或分子可以是直接的,例如,通过共价键或接头(例如第一接头或第二接头),或是间接的,例如,通过非共价键(例如静电相互作用(例如离子键、氢键、卤素键)、范德华相互作用(例如偶极-偶极、偶极诱导的偶极、伦敦分散)、环堆叠(π效应)、疏水相互作用等)。
“抗体”表示包含来自免疫球蛋白基因或其片段的框架区的多肽,其特异性地结合并识别抗原。公认的免疫球蛋白基因包括κ、λ、α、γ、δ、ε和μ恒定区基因,以及无数免疫球蛋白可变区基因。轻链被分类为κ或λ。重链被分类为γ、μ、α、δ或ε,它们又分别定义了免疫球蛋白类别IgG、IgM、IgA、IgD和IgE。通常,抗体的抗原结合区在结合的特异性和亲和力方面将是最关键的。在一些实施方案中,抗体或抗体的片段可以衍生自不同的生物,包括人类、小鼠、大鼠、仓鼠、骆驼等。本发明的抗体可以包括已经在一个或多个氨基酸位置进行修饰或突变以改善或调节抗体的期望功能(例如糖基化、表达、抗原识别、效应子功能、抗原结合、特异性等)的抗体。
一种示例性的免疫球蛋白(抗体)结构单元包含四聚体。每个四聚体由两对相同的多肽链组成,每对具有一个“轻”链(约25kD)和一个“重”链(约50-70kD)。每条链的N端定义了约100至110个或更多个氨基酸的可变区,所述可变区主要负责抗原识别。术语可变轻链(VL)和可变重链(VH)分别表示这些轻链和重链。
抗体存在,例如,作为完整的免疫球蛋白或作为通过用各种肽酶消化所产生的许多充分表征的片段。因而,例如,胃蛋白酶在铰链区中的二硫键下面消化抗体以产生F(ab)’2,即Fab的二聚体,其本身是通过二硫键连接至VH-CH1的轻链。可以将F(ab)’2在温和条件下还原以破坏铰链区中的二硫键,由此将F(ab)’2二聚体转化成Fab’单体。Fab’单体基本上是具有铰链区的部分的Fab(参见Fundamental Immunology(Paul编,第3版,1993年)。尽管在完整抗体的消化的方面定义各种抗体片段,但技术人员会明白,可以化学地或通过使用重组DNA方法从头合成这样的片段。因而,本文中使用的术语抗体也包括通过完整抗体的修饰而产生的抗体片段,或使用重组DNA方法从头合成的那些(例如,单链Fv)或使用噬菌体展示文库鉴别出的那些(参见,例如,McCafferty等人,Nature 348:552-554(1990))。
为了制备合适的本发明的抗体并根据本发明使用,例如,重组的、单克隆的或多克隆的抗体,可以使用本领域已知的许多技术(参见,例如,Kohler&Milstein,Nature 256:495-497(1975);Kozbor等人,Immunology Today 4:72(1983);Cole等人,MonoclonalAntibodies and Cancer Therapy中的第77-96页,Alan R.Liss,Inc.(1985);Coligan,Current Protocols in Immunology(1991);Harlow&Lane,Antibodies,ALaboratoryManual(1988);和Goding,Monoclonal Antibodies:Principles and Practice(第2版,1986年))。可以从细胞中克隆编码目标抗体的重链和轻链的基因,例如,可以从杂交瘤克隆编码单克隆抗体的基因并用于产生重组单克隆抗体。编码单克隆抗体的重链和轻链的基因文库也可以从杂交瘤或浆细胞制备。重链和轻链基因产物的随机组合产生具有不同抗原特异性的抗体的大型合并物(参见,例如,Kuby,Immunology(第3版,1997年))。用于产生单链抗体或重组抗体的技术(美国专利4,946,778,美国专利号4,816,567)可以适合产生针对本发明多肽的抗体。并且,转基因小鼠或其它生物诸如其它哺乳动物可以用于表达人源化抗体或人抗体(参见,例如,美国专利号5,545,807;5,545,806;5,569,825;5,625,126;5,633,425;5,661,016,Marks等人,Bio/Technology 10:779-783(1992);Lonberg等人,Nature368:856-859(1994);Morrison,Nature 368:812-13(1994);Fishwild等人,NatureBiotechnology 14:845-51(1996);Neuberger,Nature Biotechnology 14:826(1996);和Lonberg&Huszar,Intern.Rev.Immunol.13:65-93(1995))。可替换地,噬菌体展示技术可以用于鉴定特异性地结合所选抗原的抗体和异聚Fab片段(参见,例如,McCafferty等人,Nature348:552-554(1990);Marks等人,Biotechnology 10:779-783(1992))。也可以将抗体制成双特异性的,即能够识别两种不同的抗原(参见,例如,WO 93/08829,Traunecker等人,EMBO J.10:3655-3659(1991);和Suresh等人,Methods in Enzymology 121:210(1986))。抗体也可以是异源缀合物,例如,两种共价结合的抗体,或免疫毒素(参见,例如,美国专利号4,676,980,WO 91/00360;WO 92/200373;和EP 03089)。
用于将非人抗体人源化或灵长类源化的方法是本领域众所周知的(例如,美国专利号4,816,567;5,530,101;5,859,205;5,585,089;5,693,761;5,693,762;5,777,085;6,180,370;6,210,671;和6,329,511;WO 87/02671;EP专利申请0173494;Jones等人(1986)Nature 321:522;和Verhoyen等人(1988)Science 239:1534)。人源化抗体进一步描述于,例如,Winter和Milstein(1991)Nature 349:293。通常,人源化抗体具有一个或多个从非人来源引入它的氨基酸残基。这些非人氨基酸残基经常被称作输入残基,其通常取自输入可变结构域。人源化可以基本上遵循Winter和同事的方法(参见,例如,Morrison等人,PNASUSA,81:6851-6855(1984),Jones等人,Nature 321:522-525(1986);Riechmann等人,Nature 332:323-327(1988);Morrison和Oi,Adv.Immunol.,44:65-92(1988),Verhoeyen等人,Science 239:1534-1536(1988)和Presta,Curr.Op.Struct.Biol.2:593-596(1992),Padlan,Molec.Immun.,28:489-498(1991);Padlan,Molec.Immun.,31(3):169-217(1994)),通过用啮齿动物CDR或CDR序列置换人抗体的对应序列来进行。因此,这样的人源化抗体是嵌合抗体(美国专利号4,816,567),其中基本上小于完整的人可变结构域已经被来自非人物种的对应序列置换。在实践中,人源化抗体通常是这样的人抗体:其中一些CDR残基和可能一些FR残基被来自啮齿动物抗体中的类似位点的残基置换。例如,包含编码人源化免疫球蛋白框架区的第一序列和编码期望的免疫球蛋白互补性决定区的第二序列组的多核苷酸可以合成地产生,或通过组合适当的cDNA和基因组DNA区段而产生。可以根据众所周知的程序从多种人细胞分离人恒定区DNA序列。
“嵌合抗体”是这样的抗体分子,其中(a)恒定区或其部分被改变、替换或交换,使得抗原结合位点(可变区)连接到不同或改变类别的效应子功能和/或物种的恒定区、或给嵌合抗体赋予新特性的完全不同的分子,例如,酶、毒素、激素、生长因子、药物等;或(b)可变区或其部分用具有不同或改变的抗原特异性的可变区来改变、替换或交换。根据本发明的优选抗体和用于根据本发明的用途的优选抗体包括人源化的和/或嵌合的单克隆抗体。
用于将治疗剂缀合至抗体的技术是众所周知的(参见,例如,Arnon等人,“Monoclonal Antibodies For Immunotargeting Of Drugs In Cancer Therapy”,Monoclonal Antibodies And Cancer Therapy,Reisfeld等人(编),第243-56页(AlanR.Liss,Inc.1985);Hellstrom等人,“Antibodies For Drug Delivery”,Controlled DrugDelivery(第2版),Robinson等人(编),第623-53页(Marcel Dekker,Inc.1987);Thorpe,“Antibody Carriers Of Cytotoxic Agents In Cancer Therapy:A Review”,MonoclonalAntibodies‘84:Biological And Clinical Applications,Pinchera等人(编),第475-506页(1985);和Thorpe等人,“The Preparation And Cytotoxic Properties Of Antibody-Toxin Conjugates”,Immunol.Rev.,62:119-58(1982))。
当指蛋白或肽时,短语“特异性地(或选择性地)结合”抗体或“特异性地(或选择性地)与之免疫反应”表示决定蛋白的存在的结合反应,经常在蛋白和其它生物制品的异质群体中。因此,在指定的免疫测定条件下,指定的抗体与特定蛋白的结合是背景的至少两倍,且更通常是背景的超过10-100倍。在这样的条件下与抗体的特异性结合需要针对其对特定蛋白的特异性选择的抗体。例如,可以选择多克隆抗体以仅获得与所选抗原而不与其它蛋白特异性地免疫反应的那些多克隆抗体。该选择可以通过减去与其它分子交叉反应的抗体来实现。可以使用各种免疫测定形式来选择与特定蛋白特异性地免疫反应的抗体。例如,固相ELISA免疫测定常规地用于选择与蛋白特异性地免疫反应的抗体(关于可以用于确定特异性免疫反应性的免疫测定形式和条件的描述,参见,例如,Harlow&Lane,UsingAntibodies,A Laboratory Manual(1998))。
本文中使用的术语“药学上可接受的”与“生理上可接受的”和“药理学上可接受的”同义地使用。药物组合物通常将包含用于缓冲和在储存中保存的试剂,并且可以包括用于适当递送的缓冲液和载体,这取决于施用途径。
本发明的某些化合物可以以未溶剂化形式以及溶剂化形式(包括水合形式)存在。一般而言,所述溶剂化形式等同于未溶剂化形式,且意图被包括在本发明范围内。本发明的某些化合物可以以多晶形或无定形形式存在。一般而言,所有物理形式对于本发明预见到的用途而言是等效的,且意图在本发明范围内。
“PTPR”或“RPTP”或“rPTP”(所有术语是等同的)表示受体蛋白酪氨酸磷酸酶,其在自然界中作为蛋白酪氨酸磷酸酶被发现。
“PTPRS”表示蛋白酪氨酸磷酸酶受体类型S(或σ),它是蛋白酪氨酸磷酸酶(PTP)家族的成员。PTPRS的氨基酸序列可以参见,例如,UniProtKB/Swiss-Prot登录号Q13332和B0V2N1,以及SEQ ID NO:4。PTPRS的核酸序列可以参见,例如,GenBank登录号NC_000019.9和。PTPRS包括:细胞内结构域,例如,SEQ ID NO:8的氨基酸残基1304-1948或SEQ ID NO:4的氨基酸残基1279-1907,跨膜结构域,例如,SEQ ID NO:8的氨基酸残基1283-1303或SEQID NO:4的氨基酸残基1258-1278,和细胞外结构域,例如,SEQ ID NO:9或SEQ ID NO:10。术语跨膜结构域表示蛋白或多肽的嵌入膜并任选地跨膜的部分。术语细胞内结构域表示蛋白或多肽的延伸到细胞的细胞质中的部分。术语细胞外结构域表示蛋白或多肽的延伸到细胞外环境中的部分。PTPRS的细胞外结构域包括免疫球蛋白-样结构域1(Ig1)、免疫球蛋白-样结构域2(Ig2)和免疫球蛋白-样结构域2(Ig3)。Ig1的氨基酸序列包括SEQ ID NO:4的氨基酸残基30-127、或SEQ ID NO:8的氨基酸残基30-127、或氨基酸序列EEPRFIKEPKDQIGVSGGVASFVCQATGDPKPRVTWNKKGKKVNSQRFE TIEFDESAGAVLRIQPLRTPRDENVYECVAQNSVGEITVHAKLTVLRE(SEQ ID NO:1)或SEQ ID NO:5的氨基酸序列。Ig2的氨基酸序列包括SEQ ID NO:4的氨基酸残基128-231、或SEQ ID NO:8的氨基酸残基128-244、或氨基酸序列DQLPSGFPNIDMGPQLKVVERTRTATMLCAASGNPDPEITWFKDFLPVDPSASNGRIKQLRSETFESTPIRGALQIESSEETDQGKYECVATNSAGVRYSSPANLYVRVRRVA(SEQ ID NO:2)或SEQ ID NO:6的氨基酸序列。Ig3的氨基酸序列包括SEQ ID NO:4的氨基酸残基232-321、或SEQ ID NO:8的氨基酸残基245-334、或氨基酸序列PRFSILPMSHEIMPGGNVNITCVAVGSPMPYVKWMQGAEDLTPEDDMPVGRNVLELTDVKDSANYTCVAMSSLGVIEAVAQITVKSLPKA(SEQ ID NO:3)或SEQ ID NO:7的氨基酸序列。[需要Ig1&2和Ig1&2-Fc构建体的描述以及二者的完整序列]
“RPTP的蛋白水平”表示呈其蛋白形式(区别于其前体RNA形式)的RPTP的量(相对或绝对)。RPTP的蛋白可以包括全长蛋白(例如,从基因的完整编码区翻译的蛋白,其还可以包括翻译后修饰)、全长蛋白的功能片段(例如在测定中具有活性或功能的全长蛋白的子结构域)或RPTP的蛋白片段,其可以是全长蛋白的任何肽或寡肽。
“RPTP的RNA水平”表示存在的可以被翻译以形成RPTP的RNA的量(相对或绝对)。RPTP的RNA可以是足以形成全长RPTP的全长RNA。RPTP的RNA也可以是全长RNA的片段,从而形成全长RPTP的片段。全长RNA的片段可以形成RPTP的功能片段。在一些实施方案中,RPTP的RNA包括RPTP基因的所有剪接变体。在Pulido R,Serra-Pagès C等人,“The LAR/PTPdelta/PTP sigma subfamily of transmembrane protein-tyrosine-phosphatases:multiple human LAR,PTP delta,and PTP sigma isoforms are expressed in atissue-specific manner and associate with the LAR-interacting protein LIP.1.”Proc Natl Acad Sci U S A.1995,Dec 5;92(25):11686-90中提供了PTPRS的剪接变体。
“自身免疫治疗剂”是当以治疗有效剂量或量施用于受试者时治疗或预防自身免疫性疾病的分子(例如抗体、核酸、抑制性核酸、合成化学物质、小化学分子)。在一些实施方案中,自身免疫治疗剂是RPTP结合剂。
肿瘤坏死因子(TNF、cachexin、恶病质素、肿瘤坏死因子α、TNF-α或TNFα)是参与全身性炎症的细胞信号传导蛋白(细胞因子),并且是构成急性期反应的细胞因子之一。它主要由活化的巨噬细胞产生,尽管它可以由许多其它细胞类型(诸如CD4+淋巴细胞、NK细胞、嗜中性粒细胞、肥大细胞、嗜酸性粒细胞和神经元)产生。TNF是TNF超家族的一个成员,所述TNF超家族由具有同源TNF结构域的各种跨膜蛋白组成。
白介素(IL)是首先被发现由白血细胞(白细胞)表达的一组细胞因子(分泌的蛋白和信号分子)。基于区别性结构特征,IL可以分为四个主要组。但是,它们的氨基酸序列相似性相当弱(通常15-25%同一性)。人类基因组编码超过50种白介素和相关蛋白。免疫系统的功能在很大程度上取决于白介素,并且已经描述了其中许多的罕见缺乏,所有都特征在于自身免疫性疾病或免疫缺陷。大部分的白介素由辅助CD4 T淋巴细胞以及通过单核细胞、巨噬细胞和内皮细胞合成。它们促进T和B淋巴细胞以及造血细胞的发育和分化。
白介素6(IL-6)是充当促炎细胞因子和抗炎肌因子两者的白介素。在人类中,它由IL-6基因编码。另外,成骨细胞分泌IL-6以刺激破骨细胞形成。许多血管的中膜中的平滑肌细胞也产生IL-6作为促炎细胞因子。IL-6作为抗炎肌因子的作用通过其对TNF-α和IL-1的抑制作用以及IL-1ra和IL-10的活化而介导。
如本文中定义的,关于蛋白-抑制剂相互作用的术语“抑制(inhibition)”、“抑制(inhibit)”、“抑制(inhibiting)”等是指,相对于在没有抑制剂存在下蛋白的活性或功能,负面地影响(例如降低)蛋白的活性或功能。在实施方案中,抑制是指,相对于在没有抑制剂存在下蛋白的浓度或水平,负面地影响(例如降低)蛋白的浓度或水平。在实施方案中,抑制表示疾病或疾病症状的减轻。在实施方案中,抑制表示特定蛋白靶标的活性的降低。因此,抑制包括至少部分地、部分地或完全地阻断刺激,减少、防止或延迟活化,或失活、脱敏或下调信号转导或酶活性或蛋白的量。在实施方案中,抑制表示由直接相互作用(例如,抑制剂结合靶蛋白)导致的靶蛋白活性的降低。在实施方案中,抑制表示由间接相互作用(例如,抑制剂结合活化靶蛋白的蛋白,从而阻止靶蛋白活化)引起的靶蛋白的活性的降低。尽管不希望被理论束缚,但在一些实施方案中,抑制剂通过从其正确的作用位点和/或其底物附近除去蛋白或将蛋白带到前述地方而起作用。
术语“抑制剂”、“阻遏物”或“拮抗剂”或“下调剂”可互换地表示能够可检测地降低给定基因或蛋白的表达或活性的物质。与在没有拮抗剂存在下的对照相比,拮抗剂可以使表达或活性降低10%、20%、30%、40%、50%、60%、70%、80%、90%或更多。在某些情况下,表达或活性比在没有拮抗剂存在下的表达或活性低1.5倍、2倍、3倍、4倍、5倍、10倍或更低。
白介素6(IL-6)是作为促炎细胞因子和抗炎肌因子起作用的白介素。IL-6通过细胞表面I型细胞因子受体复合物信号传导,该复合物由结合配体的IL-6Rα链(CD126)和信号转导组分gp130(也称为CD130)组成。CD130是几种细胞因子(包括白血病抑制因子(LIF)、睫状神经营养因子、制癌蛋白M、IL-11和促心肌素-1)的共同信号转导蛋白,且在大多数组织中几乎无所不在地表达。IL-6抑制剂可以针对IL-6或其受体。
托珠单抗或atlizumab是一种免疫抑制药物,主要用于治疗类风湿性关节炎(RA)和全身性青少年特发性关节炎,后者是儿童中关节炎的一种严重形式。托珠单抗是针对白介素-6受体(IL-6R)的人源化单克隆抗体。该药物被开处方用于患有中度至重度活动性类风湿性关节炎(RA)的成年患者,所述患者对一种或多种改善疾病的抗风湿药(DMARD)具有不适当应答。有效剂量:对于通过静脉内注射治疗RA,成人中的剂量为每4周1次静脉内4mg/kg,作为60-分钟单次点滴输注,然后基于临床应答增加至每4周1次给予的静脉内8mg/kg,作为60-分钟单次点滴输注。为了管理某些剂量相关的实验室变化,包括升高的肝酶、嗜中性粒细胞减少症和血小板减少症,推荐从8mg/kg降低到4mg/kg。最大推荐剂量为每次输注800mg。对于通过皮下注射治疗RA,在小于100kg的患者中,每隔一周皮下注射162mg,然后根据临床应答增加至每周一次。对于100kg或以上的患者,每周皮下注射162mg。为了某些剂量相关的实验室变化(例如,升高的肝酶、嗜中性粒细胞减少症、血小板减少症),推荐中断剂量或将施用频率从每周一次减少至每隔一周一次。
Sarilumab或Kevzara是针对白介素-6受体的人单克隆抗体,用于在已经用一种或多种缓解疾病的抗风湿药物(DMARD)失败的18岁或以上的患者中减轻症状并减慢从中度至重度活动性RA的结构损伤的进展。有效剂量:成人中的类风湿性关节炎的剂量为每天一次皮下注射100mg。
肿瘤坏死因子(TNF、cachexin或恶病质素;肿瘤坏死因子α或TNFα)是参与全身性炎症的细胞信号传导蛋白(细胞因子),并且是构成急性期反应的细胞因子之一。它主要由活化的巨噬细胞产生,尽管它可以由许多其它细胞类型(诸如CD4+淋巴细胞、NK细胞、嗜中性粒细胞、肥大细胞、嗜酸性粒细胞和神经元)产生。TNF是TNF超家族的一个成员,所述TNF超家族由具有同源TNF结构域的各种跨膜蛋白组成。TNF可以结合两种受体:TNFR1(TNF受体类型1;CD120a;p55/60)和TNFR2(TNF受体类型2;CD120b;p75/80)。TNFR1是55-kDa,且TNFR2是75-kDa。TNFR1在大多数组织中表达,并且可以被TNF的膜结合形式和可溶性三聚体形式完全活化,而TNFR2通常在免疫系统的细胞中发现,并对TNF同源三聚体的膜结合形式做出应答。TNF促进炎性应答,其继而引起许多与自身免疫性病症(诸如类风湿性关节炎、强直性脊柱炎、炎性肠病、银屑病、化脓性汗腺炎和难治性哮喘)相关的临床问题。
TNF抑制剂可用于治疗上述病况。这种抑制可以用单克隆抗体诸如直接结合TNFα的英夫利昔单抗(Remicade)、阿达木单抗(Humira)、培化舍珠单抗(Cimzia)或用诱饵循环受体融合蛋白诸如以比TNFR更大的亲和力结合TNFα的依那西普(Enbrel)实现。
依那西普(或Enbrel)或它的生物类似物(例如Benepali)是通过经由充当TNF抑制剂来干扰肿瘤坏死因子(TNF)而治疗自身免疫性疾病的生物药物。依那西普通过抑制TNF-α来用于治疗类风湿性关节炎、青少年特发性关节炎和银屑病关节炎、斑块状银屑病和强直性脊柱炎。依那西普是由重组DNA产生的融合蛋白。它将TNF受体融合至IgG1抗体的恒定端。它是一种分子量为150kDa的大分子,它结合TNFα并降低其在涉及人类和其它动物中的过度炎症的病症(包括自身免疫性疾病诸如强直性脊柱炎、幼年型类风湿性关节炎、银屑病、银屑病关节炎、类风湿性关节炎)以及潜在的由过量TNFα介导的多种其它病症中的作用。成人中的类风湿性关节炎的有效剂量:每周一次皮下注射50mg,或每周两次皮下注射25mg。
阿达木单抗或Humira或它的生物类似物是针对TNFα的单克隆抗体,用于治疗类风湿性关节炎、银屑病关节炎、强直性脊柱炎、克罗恩氏病、溃疡性结肠炎、银屑病、化脓性汗腺炎、葡萄膜炎和青少年特发性关节炎。阿达木单抗是一种缓解疾病的抗风湿药物和单克隆抗体,其通过失活肿瘤坏死因子-α(TNFα)发挥作用。成人中的类风湿性关节炎的有效剂量:每隔一周皮下注射40mg;一些不服用伴随甲氨蝶呤的具有RA的患者可能受益于将频率增加至每周40mg。
英夫利昔单抗或Remicade或它的生物类似物是针对TNFα的单克隆抗体,用于治疗许多自身免疫性疾病诸如克罗恩氏病、溃疡性结肠炎、类风湿性关节炎、强直性脊柱炎、银屑病、银屑病关节炎和贝切特氏病。成人中的类风湿性关节炎的剂量:在0、2和6周时以静脉内诱导方案给予3mg/kg,随后是其后每8周3mg/kg IV的维持方案;对于具有不完全应答的患者,可以考虑将剂量调整至最高10mg/kg IV或每4周一次的治疗频率。
戈利木单抗或Simponi或它的生物类似物是针对TNFα的人单克隆抗体,被用作免疫抑制药物,并且在商标名称Simponi下销售。戈利木单抗被用于治疗类风湿性关节炎、银屑病关节炎和强直性脊柱炎。用于皮下施用的有效剂量:每个月1次50mg。IV的有效剂量:在第0和4周在30分钟内2mg/kg,然后此后每8周一次。
塞妥珠单抗、培化舍珠单抗或Cimzia或它的生物类似物是针对TNFα的单克隆抗体或单克隆抗体的片段,被用于治疗克罗恩氏病、类风湿性关节炎、银屑病关节炎和强直性脊柱炎。有效剂量、初始剂量:在第0、2和4周皮下注射400mg(作为两次200mg的皮下注射给予),随后每隔一周皮下注射200mg。维持剂量:在获得临床应答的患者中,每4周皮下注射400mg。应当轮换注射部位,并且不应在皮肤触痛、青肿、变红或变硬的区域中进行注射。当需要400mg剂量时(作为2次200mg的皮下注射给予),应在大腿或腹部中的不同部位进行注射。
“RPTP结合剂”是结合(例如优先结合)RPTP、可翻译为RPTP的RNA、或可转录为可翻译为RPTP的RNA的DNA的分子。当所述分子优先结合时,与生物体或细胞中存在的其它大分子生物分子相比,所述结合是优先的。与生物体或细胞中存在的其它大分子生物分子相比,化合物优先结合,例如,当优先结合是大1.1倍、1.2倍、1.3倍、1.4倍、1.5倍、1.6倍、1.7倍、1.8倍、1.9倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍、200倍、300倍、400倍、500倍、600倍、700倍、800倍、900倍、1000倍、2000倍、3000倍、4000倍、5000倍、6000倍、7000倍、8000倍、9000倍、10000倍、100,000倍、1,000,000倍时。
通过结合(例如优先结合)RPTP、编码RPTP的核酸(例如RNA或DNA)或RPTP的蛋白,药剂可以“靶向”RPTP、编码RPTP的核酸(例如RNA或DNA)或RPTP的蛋白。任选地,所述RPTP是PTPRS。例如,当与靶向分子的结合大于与相似形式的其它分子的结合时,药剂优先结合分子。在一些实施方案中,所述优先结合是大1.1倍、1.2倍、1.3倍、1.4倍、1.5倍、1.6倍、1.7倍、1.8倍、1.9倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍、200倍、300倍、400倍、500倍、600倍、700倍、800倍、900倍、1000倍、2000倍、3000倍、4000倍、5000倍、6000倍、7000倍、8000倍、9000倍、10000倍、100,000倍、1,000,000倍。在一些实施方案中,当结合测定或实验(例如凝胶电泳、色谱法、免疫测定、放射性或非放射性标记、免疫沉淀、活性测定等)揭示与单一RPTPS、单一RPTP的核酸(例如RNA或DNA)或单一RPTP的蛋白的唯一相互作用或主要相互作用时,药剂靶向RPTP、RPTP的核酸(例如RNA或DNA)或RPTP的蛋白。通过结合RPTP、RPTP的核酸(例如RNA或DNA)或RPTP的蛋白,通过相对于药剂不存在的情况减少或增加细胞或生物体中的RPTP的量,或减少RPTP与生理学或天然配体之间的相互作用,药剂也可以“靶向”RPTP、RPTP的核酸(例如RNA或DNA)或RPTPS的蛋白。使用本文提供的指导,本领域普通技术人员可以容易地确定药剂是否减少或增加细胞或生物体中RPTP的量。
本文中使用的“治疗(treating)”或“治疗(treatment of)”病况、疾病或病症或与病况、疾病或病症有关的症状表示用于获得有益或期望的结果(包括临床结果)的方法。有益的或期望的临床结果可以包括、但不限于减轻或改善一种或多种症状或病况,减轻病况、病症或疾病的程度,稳定病况、病症或疾病的状态,预防病况、病症或疾病的发展,预防病况、病症或疾病的传播,延迟或减慢病况、病症或疾病进展,延迟或减慢病况、病症或疾病发作,改善或减轻病况、病症或疾病状态,以及部分的或全部的缓解。“治疗”也可能意味着延长受试者的生存期,使其超出没有治疗时的预期。“治疗”还可以意指抑制病况、病症或疾病的进展,暂时减缓病况、病症或疾病的进展,尽管在一些情况下,它涉及永久停止病况、病症或疾病的进展。本文中使用的术语治疗(treatment)、治疗(treat)或治疗(treating)表示减少以蛋白酶表达为特征的疾病或病况的一种或多种症状的影响或以蛋白酶表达为特征的疾病或病况的症状的方法。因此,在所公开的方法中,治疗可以表示已确定的疾病、病况、或疾病或病况的症状的严重程度的10%、20%、30%、40%、50%、60%、70%、80%、90%或100%减少。例如,如果与对照相比受试者中的疾病的一种或多种症状减少10%,则认为治疗疾病的方法为治疗。因此,与天然或对照水平相比,减少可以是10%、20%、30%、40%、50%、60%、70%、80%、90%、100%或在10%至100%之间的任何减少百分比。应当理解,治疗不一定表示疾病、病况、或疾病或病况的症状的治愈或完全消融。此外,如本文中使用的,对降低、减少或抑制的提及包括,与对照水平相比10%、20%、30%、40%、50%、60%、70%、80%、90%或更大的变化,且这样的术语可以包括、但不一定包括完全消除。诸如对于关节炎,疾病的症状包括滑膜炎、骨侵蚀和软骨消耗。
本文中使用的术语“PTPRS去簇剂”等表示能够造成PTPRS蛋白的二聚化、寡聚化或分簇的水平的降低的药剂(例如,小分子,包括抗体的蛋白等)。不希望受任何理论约束,据信,HS对PTPRS的分簇可以产生无活性的二聚体或其它寡聚体形式。因此,PTPRS去簇剂的作用产生单体PTPRS,其相对于PTPRS的分簇(例如,二聚化或寡聚化)形式恢复活性。任选地,PTPRS去簇剂是非酶重组蛋白,其包含PTPRS的细胞外结构域的氨基酸序列或其子序列、部分、同系物、变体或衍生物,如本文所述。任选地,非酶重组蛋白是PTPRS的细胞外结构域。不受限于任何特定理论,PTPRS的细胞外结构域或其部分从HS置换PTPRS。这可以活化PTPRS并导致β-连环蛋白和其它底物(诸如滑膜细胞中的埃兹蛋白)的去磷酸化以及下游FLS侵袭力和促炎作用的抑制。本文提供的实施例和数据支持这一点。任选地,PTPRS去簇剂是抗-PRPRS抗体或其片段。任选地,PTPRS去簇剂是抗-PTPRS适体。任选地,PTPRS去簇剂结合硫酸类肝素。任选地,PTPRS去簇剂是抗-硫酸类肝素抗体或其片段。任选地,PTPRS去簇剂是抗-硫酸类肝素适体。任选地,PTPRS去簇剂不是硫酸软骨素。PTPRS去簇剂任选地不是硫酸软骨素模拟物或具有与硫酸软骨素相同或相似的作用机理的药剂。在其它实施方案中,PTPRS去簇剂是硫酸软骨素模拟物。
本文中使用的术语“非酶重组蛋白”表示不具有酶活性的重组蛋白(例如,该蛋白不充当生物催化剂)。因此,在一些实施方案中,包含PTPRS的细胞外结构域的氨基酸序列的非酶重组蛋白仅包括PTPRS的细胞外结构域部分,而不包括PTPRS的酶部分。在实施方案中,包含PTPRS的细胞外结构域的氨基酸序列的非酶重组蛋白仅包括PTPRS的细胞外结构域部分,而不包括PTPRS的酶部分或PTPRS的跨膜部分。在一些实施方案中,包含PTPRS的细胞外结构域的氨基酸序列的非酶重组蛋白包括连接在一起的PTPRS的两个或更多个细胞外结构域(例如通过氨基酸接头,诸如至少2、至少3、至少5、至少10、约2-50或100个氨基酸、约3-50个或100个氨基酸或约2、3、4、5、6、7、8、9、10、20、30、40、50、60、70、80、90或100个氨基酸的氨基酸接头连接在一起,其中将氨基酸序列设计为不干扰PTPRS配体结合的细胞外结构域)。术语“PTPRS的细胞外结构域”可以包括PTPRS的细胞外结构域的子序列、部分、同系物、变体或衍生物。因此,非酶重组蛋白可包含PTPRS的细胞外结构域的一部分,例如,该蛋白包含PTPRS的一个或多个免疫球蛋白-样结构域,例如,SEQ ID NO:1、SEQ ID NO:2、SEQ IDNO:3、SEQ ID NO:5、SEQ ID NO:6和/或SEQ ID NO:7或其子序列、部分、同系物、变体或衍生物。PTPRS的细胞外结构域通常能够结合(例如特异性结合)PTPRS配体诸如硫酸类肝素。任选地,PTPRS的细胞外结构域包含以下中的一个或多个:PTPRS免疫球蛋白-样结构域1(Ig1)、免疫球蛋白-样结构域2(Ig2)和免疫球蛋白-样结构域2(Ig3)或其子序列、部分、同系物、变体或衍生物。任选地,PTPRS的细胞外结构域包含PTPRS免疫球蛋白-样结构域1(Ig1)和免疫球蛋白-样结构域2(Ig2)或其子序列、部分、同系物、变体或衍生物中的一个或两个。
任选地,该蛋白包含Ig1的SEQ ID NO:4的氨基酸残基39-124、或其子序列、部分、同系物、变体或衍生物。任选地,该蛋白包含如EEPRFIKEPKDQIGVSGGVASFVCQATGDPKPRVTWNKKGKKVNSQRFETIEFDESAGAVLRIQPLRTPRDENVYECVAQNSVGEITVHAKLTVLRE(SE Q ID NO:1)所示或如SEQ ID NO:5所示的氨基酸序列、或其子序列、部分、同系物、变体或衍生物。
任选地,该蛋白包含Ig2的SEQ ID NO:4的氨基酸残基152-233或其子序列、部分、同系物、变体或衍生物。任选地,该蛋白包含如DQLPSGFPNIDMGPQLKVVERTRTATMLCAASGNPDPEITWFKDFLPVDPSASNGRIKQLRSETFESTPIRGALQIESSEETDQGKYECVATNSAGVRYSSPANLYVRVRRVA(SEQ ID NO:2)所示或如SEQ ID NO:6所示的氨基酸序列或其子序列、部分、同系物、变体或衍生物。
任选地,该蛋白包含Ig3的SEQ ID NO:4的氨基酸残基259-327或其子序列、部分、同系物、变体或衍生物。任选地,该蛋白包含如PRFSILPMSHEIMPGGNVNITCVAVGSPMPYVKWMQGAEDLTPEDDMPVGRNVLELTDVKDSANYTCVAMSSLGVIEAVAQITVKSLPKA(SEQ ID NO:3)所示或如SEQID NO:7所示的氨基酸序列或其子序列、部分、同系物、变体或衍生物。
在一些实施方案中,包含PTPRS的细胞外结构域的氨基酸序列或其部分的非酶重组蛋白缺乏跨膜结构域和/或缺乏细胞内结构域。在一些实施方案中,包含PTPRS的细胞外结构域的氨基酸序列或其部分的非酶重组蛋白缺乏跨膜结构域。在一些实施方案中,包含PTPRS的细胞外结构域的氨基酸序列或其部分的非酶重组蛋白缺乏细胞内结构域。
任选地,提供的PTPRS去簇剂结合(例如特异性地结合)硫酸类肝素。任选地,PTPRS去簇剂阻止PTPRS蛋白的寡聚化或分簇;例如,PTPRS去簇剂阻止PTPRS蛋白的二聚化。任选地,PTPRS去簇剂调节PTPRS活性;例如,PTPRS去簇剂增加PTPRS的磷酸酶活性。任选地,PTPRS去簇剂从其底物或其作用位点除去磷酸酶。
本文提供了包含本文提供的药剂的组合物。本文提供了包含PTPRS去簇剂、TNF抑制剂和药学上可接受的赋形剂的药物组合物。本文提供了包含PTPRS去簇剂、IL-6抑制剂和药学上可接受的赋形剂的药物组合物。所提供的组合物可以包含其它药剂。所提供的组合物任选地适合于配制和体外或体内施用。任选地,所述组合物包含一种或多种所提供的试剂和药学上可接受的载体。合适的载体及其制剂描述于:Remington:The Science andPractice of Pharmacy,第21版,David B.Troy,编,Lippicott Williams&Wilkins(2005)。药学上可接受的载体是指并非生物学上或在其它方面不期望的材料,即,将该材料施用于受试者而不会引起不期望的生物学效应或以有害的方式与包含它的药物组合物的其它组分相互作用。如果施用于受试者,则任选地选择载体以最小化活性成分的降解并且最小化受试者中的不良副作用。
在实施方案中,以组合的协同量施用PTPRS去簇剂和TNF或IL-6抑制剂。本文中使用的“组合的协同量”表示产生协同效应(即大于累加效应的效应)的第一量(例如,PTPRS去簇剂的量)和第二量(例如,TNF或IL-6抑制剂的量)之和。因此,在本文中可互换地使用的术语“协同作用”、“协同效应”、“协同的”、“组合的协同量”和“协同治疗效果”表示组合施用的化合物的测量效果,其中测量的效果大于作为单一药剂单独施用的每种化合物的单独效果的总和。
在实施方案中,协同量可以是当与TNF或IL-6抑制剂分开使用时PTPRS去簇剂的量的约0.1%、0.2%、0.3%、0.4%、0.5%、0.6%、0.7%、0.8%、0.9%、1.0%、1.1%、1.2%、1.3%、1.4%、1.5%、1.6%、1.7%、1.8%、1.9%、2.0%、2.1%、2.2%、2.3%、2.4%、2.5%、2.6%、2.7%、2.8%、2.9%、3.0%、3.1%、3.2%、3.3%、3.4%、3.5%、3.6%、3.7%、3.8%、3.9%、4.0%、4.1%、4.2%、4.3%、4.4%、4.5%、4.6%、4.7%、4.8%、4.9%、5.0%、5.1%、5.2%、5.3%、5.4%、5.5%、5.6%、5.7%、5.8%、5.9%、6.0%、6.1%、6.2%、6.3%、6.4%、6.5%、6.6%、6.7%、6.8%、6.9%、7.0%、7.1%、7.2%、7.3%、7.4%、7.5%、7.6%、7.7%、7.8%、7.9%、8.0%、8.1%、8.2%、8.3%、8.4%、8.5%、8.6%、8.7%、8.8%、8.9%、9.0%、9.1%、9.2%、9.3%、9.4%、9.5%、9.6%、9.7%、9.8%、9.9%、10.0%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%、25%、26%、27%、28%、29%、30%、31%、32%、33%、34%、35%、36%、37%、38%、39%、40%、41%、42%、43%、44%、45%、46%、47%、48%、49%、50%、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%。在实施方案中,协同量可以是当与PTPRS去簇剂分开使用时TNF或IL-6抑制剂的量的约0.1%、0.2%、0.3%、0.4%、0.5%、0.6%、0.7%、0.8%、0.9%、1.0%、1.1%、1.2%、1.3%、1.4%、1.5%、1.6%、1.7%、1.8%、1.9%、2.0%、2.1%、2.2%、2.3%、2.4%、2.5%、2.6%、2.7%、2.8%、2.9%、3.0%、3.1%、3.2%、3.3%、3.4%、3.5%、3.6%、3.7%、3.8%、3.9%、4.0%、4.1%、4.2%、4.3%、4.4%、4.5%、4.6%、4.7%、4.8%、4.9%、5.0%、5.1%、5.2%、5.3%、5.4%、5.5%、5.6%、5.7%、5.8%、5.9%、6.0%、6.1%、6.2%、6.3%、6.4%、6.5%、6.6%、6.7%、6.8%、6.9%、7.0%、7.1%、7.2%、7.3%、7.4%、7.5%、7.6%、7.7%、7.8%、7.9%、8.0%、8.1%、8.2%、8.3%、8.4%、8.5%、8.6%、8.7%、8.8%、8.9%、9.0%、9.1%、9.2%、9.3%、9.4%、9.5%、9.6%、9.7%、9.8%、9.9%、10.0%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%、25%、26%、27%、28%、29%、30%、31%、32%、33%、34%、35%、36%、37%、38%、39%、40%、41%、42%、43%、44%、45%、46%、47%、48%、49%、50%、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%。
协同效应可以是PTPRS去簇活性降低效应和/或TNF或IL-6活性降低效应。在实施方案中,与当个别地和单独地使用时PTPRS去簇剂或TNF或IL-6的下降的总和相比,在PTPRS去簇剂与TNF或IL-6抑制剂之间的协同作用可导致大了约0.1%、0.2%、0.3%、0.4%、0.5%、0.6%、0.7%、0.8%、0.9%、1.0%、1.1%、1.2%、1.3%、1.4%、1.5%、1.6%、1.7%、1.8%、1.9%、2.0%、2.1%、2.2%、2.3%、2.4%、2.5%、2.6%、2.7%、2.8%、2.9%、3.0%、3.1%、3.2%、3.3%、3.4%、3.5%、3.6%、3.7%、3.8%、3.9%、4.0%、4.1%、4.2%、4.3%、4.4%、4.5%、4.6%、4.7%、4.8%、4.9%、5.0%、5.1%、5.2%、5.3%、5.4%、5.5%、5.6%、5.7%、5.8%、5.9%、6.0%、6.1%、6.2%、6.3%、6.4%、6.5%、6.6%、6.7%、6.8%、6.9%、7.0%、7.1%、7.2%、7.3%、7.4%、7.5%、7.6%、7.7%、7.8%、7.9%、8.0%、8.1%、8.2%、8.3%、8.4%、8.5%、8.6%、8.7%、8.8%、8.9%、9.0%、9.1%、9.2%、9.3%、9.4%、9.5%、9.6%、9.7%、9.8%、9.9%、10.0%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%、25%、26%、27%、28%、29%、30%、31%、32%、33%、34%、35%、36%、37%、38%、39%、40%、41%、42%、43%、44%、45%、46%、47%、48%、49%、50%、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的下降(例如,PTPRS去簇活性的下降或TNF或IL-6活性的下降)。在实施方案中,与当个别地和单独地使用时PTPRS去簇剂或TNF或IL-6抑制剂的抑制的总和相比,在PTPRS去簇剂与TNF或IL-6抑制剂之间的协同作用可能导致大了0.1%、0.2%、0.3%、0.4%、0.5%、0.6%、0.7%、0.8%、0.9%、1.0%、1.1%、1.2%、1.3%、1.4%、1.5%、1.6%、1.7%、1.8%、1.9%、2.0%、2.1%、2.2%、2.3%、2.4%、2.5%、2.6%、2.7%、2.8%、2.9%、3.0%、3.1%、3.2%、3.3%、3.4%、3.5%、3.6%、3.7%、3.8%、3.9%、4.0%、4.1%、4.2%、4.3%、4.4%、4.5%、4.6%、4.7%、4.8%、4.9%、5.0%、5.1%、5.2%、5.3%、5.4%、5.5%、5.6%、5.7%、5.8%、5.9%、6.0%、6.1%、6.2%、6.3%、6.4%、6.5%、6.6%、6.7%、6.8%、6.9%、7.0%、7.1%、7.2%、7.3%、7.4%、7.5%、7.6%、7.7%、7.8%、7.9%、8.0%、8.1%、8.2%、8.3%、8.4%、8.5%、8.6%、8.7%、8.8%、8.9%、9.0%、9.1%、9.2%、9.3%、9.4%、9.5%、9.6%、9.7%、9.8%、9.9%、10.0%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%、25%、26%、27%、28%、29%、30%、31%、32%、33%、34%、35%、36%、37%、38%、39%、40%、41%、42%、43%、44%、45%、46%、47%、48%、49%、50%、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的PTPRS去簇和/或TNF或IL-6活性的抑制。
PTPRS去簇剂和TNF或IL-6抑制剂可以伴随地(例如,作为混合物)、分开但同时(例如,通过单独的静脉内管线)或依次(例如,首先施用一种药剂、然后施用第二种药剂)组合施用。因此,术语组合用于表示PTPRS去簇剂和TNF或IL-6抑制剂的伴随、同时或依次施用。在实施方案中,在依次施用PTPRS去簇剂和TNF或IL-6抑制剂的情况下,在第一时间点施用PTPRS去簇剂并在第二时间点施用TNF或IL-6抑制剂,其中所述第一时间点早于第二时间点。最好根据受试者的特定特征和所选的治疗类型,在个体基础上确定治疗过程。可以每天、每天两次、每两周、每月或在治疗上有效的任何适用的基础上对受试者施用治疗,诸如本文公开的那些。该治疗可以单独施用,或与本文公开或本领域已知的任何其它治疗组合施用。可以与第一治疗同时、在不同的时间或以完全不同的治疗方案施用额外治疗(例如,第一治疗可以是每天,而额外治疗是每周)。因而,在实施方案中,同时或依次施用PTPRS去簇剂和TNF或IL-6抑制剂。
在实施方案中,在第一时间点施用PTPRS去簇剂并在第二时间点施用TNF或IL-6抑制剂,其中所述第一时间点早于第二时间点。在实施方案中,第二时间点是在离第一时间点小于约120、90、60、50、40、30、20、19、18、17、16、15、14、13、12、10、11、9、8、7、6、5、4、3、2或1天内。在实施方案中,第二时间点是在离第一时间点小于约120天内。在实施方案中,第二时间点是在离第一时间点小于约90天内。在实施方案中,第二时间点是在离第一时间点小于约60天内。在实施方案中,第二时间点是在离第一时间点小于约50天内。在实施方案中,第二时间点是在离第一时间点小于约40天内。在实施方案中,第二时间点是在离第一时间点小于约30天内。在实施方案中,第二时间点是在离第一时间点小于约20天内。
在实施方案中,第二时间点是在离第一时间点小于约19天内。在实施方案中,第二时间点是在离第一时间点小于约18天内。在实施方案中,第二时间点是在离第一时间点小于约17天内。在实施方案中,第二时间点是在离第一时间点小于约16天内。在实施方案中,第二时间点是在离第一时间点小于约15天内。在实施方案中,第二时间点是在离第一时间点小于约14天内。在实施方案中,第二时间点是在离第一时间点小于约13天内。在实施方案中,第二时间点是在离第一时间点小于约12天内。在实施方案中,第二时间点是在离第一时间点小于约11天内。在实施方案中,第二时间点是在离第一时间点小于约10天内。在实施方案中,第二时间点是在离第一时间点小于约9天内。在实施方案中,第二时间点是在离第一时间点小于约8天内。在实施方案中,第二时间点是在离第一时间点小于约7天内。在实施方案中,第二时间点是在离第一时间点小于约6天内。在实施方案中,第二时间点是在离第一时间点小于约5天内。在实施方案中,第二时间点是在离第一时间点小于约4天内。在实施方案中,第二时间点是在离第一时间点小于约3天内。在实施方案中,第二时间点是在离第一时间点小于约2天内。在实施方案中,第二时间点是在离第一时间点小于约1天内。
在实施方案中,第二时间点是在离第一时间点约8、10或12天内。在实施方案中,第二时间点是在离第一时间点约8天内。在实施方案中,第二时间点是在离第一时间点约10天内。在实施方案中,第二时间点是在离第一时间点约12天内。在实施方案中,在第二时间点同时地施用TNF或IL-6抑制剂和PTPRS去簇剂。在实施方案中,在第二时间点伴随地施用TNF或IL-6抑制剂和PTPRS去簇剂。在实施方案中,在第二时间点施用TNF或IL-6抑制剂,并在第二时间点不施用PTPRS去簇剂。
在实施方案中,在第一时间点施用TNF或IL-6抑制剂并在第二时间点施用PTPRS去簇剂,其中所述第一时间点早于第二时间点。在实施方案中,第二时间点是在离第一时间点小于约120、90、60、50、40、30、20、19、18、17、16、15、14、13、12、10、11、9、8、7、6、5、4、3、2或1天内。在实施方案中,第二时间点是在离第一时间点小于约120天内。在实施方案中,第二时间点是在离第一时间点小于约90天内。在实施方案中,第二时间点是在离第一时间点小于约60天内。在实施方案中,第二时间点是在离第一时间点小于约50天内。在实施方案中,第二时间点是在离第一时间点小于约40天内。在实施方案中,第二时间点是在离第一时间点小于约30天内。在实施方案中,第二时间点是在离第一时间点小于约20天内。
在实施方案中,第二时间点是在离第一时间点小于约19天内。在实施方案中,第二时间点是在离第一时间点小于约18天内。在实施方案中,第二时间点是在离第一时间点小于约17天内。在实施方案中,第二时间点是在离第一时间点小于约16天内。在实施方案中,第二时间点是在离第一时间点小于约15天内。在实施方案中,第二时间点是在离第一时间点小于约14天内。在实施方案中,第二时间点是在离第一时间点小于约13天内。在实施方案中,第二时间点是在离第一时间点小于约12天内。在实施方案中,第二时间点是在离第一时间点小于约11天内。在实施方案中,第二时间点是在离第一时间点小于约10天内。在实施方案中,第二时间点是在离第一时间点小于约9天内。在实施方案中,第二时间点是在离第一时间点小于约8天内。在实施方案中,第二时间点是在离第一时间点小于约7天内。在实施方案中,第二时间点是在离第一时间点小于约6天内。在实施方案中,第二时间点是在离第一时间点小于约5天内。在实施方案中,第二时间点是在离第一时间点小于约4天内。在实施方案中,第二时间点是在离第一时间点小于约3天内。在实施方案中,第二时间点是在离第一时间点小于约2天内。在实施方案中,第二时间点是在离第一时间点小于约1天内。
在实施方案中,第二时间点是在离第一时间点约8、10或12天内。在实施方案中,第二时间点是在离第一时间点约8天内。在实施方案中,第二时间点是在离第一时间点约10天内。在实施方案中,第二时间点是在离第一时间点约12天内。在实施方案中,在第二时间点同时地施用TNF或IL-6抑制剂和PTPRS去簇剂。在实施方案中,在第二时间点伴随地施用TNF或IL-6抑制剂和PTPRS去簇剂。在实施方案中,在第二时间点施用PTPRS去簇剂,且在第二时间点不施用TNF或IL-6抑制剂。
根据本文提供的方法,向受试者施用有效量的本文提供的药剂(例如,PTPRS去簇剂和TNF或IL-6抑制剂)中的两种或更多种。“有效量”是足以实现所述目的(例如,达到施用其所追求的效果,治疗疾病(例如,RA),诱导PTPRS活性,减轻疾病或病况的一种或多种症状)的量。“有效量”的一个例子是足以有助于治疗、预防或减轻疾病(例如,癌症)的一种或多种症状的量,其也可以被称作“治疗有效量”。一种或多种症状的“减轻”(和该短语的语法等效词)是指减轻一种或多种症状的严重程度或频率,或消除一种或多种症状。对于给定类别的药物产品,可以在文献中找到适当剂量的指南。例如,对于给定的参数,治疗有效量将显示出至少5%、10%、15%、20%、25%、40%、50%、60%、75%、80%、90%或至少100%的增加或减少。效力还可以表示为“倍”增加或减少。例如,治疗有效量相对于对照可以具有至少1.2倍、1.5倍、2倍、5倍或更多的作用。确切量将取决于治疗的目的,并且将可由本领域技术人员使用已知技术确定(参见,例如,Lieberman,Pharmaceutical Dosage Forms(第1-3卷,1992);Lloyd,The Art,Science and Technology of Pharmaceutical Compounding(1999);Pickar,Dosage Calculations(1999);和Remington:The Science and Practiceof Pharmacy,第20版,2003,Gennaro,编,Lippincott,Williams&Wilkins)。
在实施方案中,以约0.5mg/kg、1mg/kg、2mg/kg、3mg/kg、4mg/kg、5mg/kg、10mg/kg、20mg/kg、30mg/kg、40mg/kg、50mg/kg、60mg/kg、70mg/kg、80mg/kg、90mg/kg、100mg/kg、200mg/kg或300mg/kg的量施用PTPRS去簇剂。在实施方案中,以约0.5mg/kg的量施用PTPRS去簇剂。在实施方案中,以约1mg/kg的量施用PTPRS去簇剂。在实施方案中,以约5mg/kg的量施用PTPRS去簇剂。在实施方案中,以约10mg/kg的量施用PTPRS去簇剂。在实施方案中,以约20mg/kg的量施用PTPRS去簇剂。在实施方案中,以约30mg/kg的量施用PTPRS去簇剂。在实施方案中,以约40mg/kg的量施用PTPRS去簇剂。在实施方案中,以约50mg/kg的量施用PTPRS去簇剂。在实施方案中,以约60mg/kg的量施用PTPRS去簇剂。在实施方案中,以约70mg/kg的量施用PTPRS去簇剂。在实施方案中,以约80mg/kg的量施用PTPRS去簇剂。在实施方案中,以约90mg/kg的量施用PTPRS去簇剂。在实施方案中,以约100mg/kg的量施用PTPRS去簇剂。在实施方案中,以约200mg/kg的量施用PTPRS去簇剂。在实施方案中,以约300mg/kg的量施用PTPRS去簇剂。应当理解,在量被称作“mg/kg”的情况下,该量是毫克/千克被施用PTPRS去簇剂的受试者的体重。
在实施方案中,以约0.5mg/kg、1mg/kg、5mg/kg、10mg/kg、20mg/kg、30mg/kg、40mg/kg、50mg/kg、60mg/kg、70mg/kg、80mg/kg、90mg/kg、100mg/kg、200mg/kg或300mg/kg的量施用PTPRS去簇剂。在实施方案中,以约1mg/kg的量施用PTPRS去簇剂。在实施方案中,以约1mg/kg至2mg/kg的量施用PTPRS去簇剂。在实施方案中,以约1mg/kg至3mg/kg的量施用PTPRS去簇剂。在实施方案中,以约1mg/kg至4mg/kg的量施用PTPRS去簇剂。在实施方案中,以约1mg/kg至5mg/kg的量施用PTPRS去簇剂。
在实施方案中,以约10mg BID、20mg BID、30mg BID、40mg BID、50mg BID、60mgBID、70mg BID、80mg BID、90mg BID、100mg BID、110mg BID、120mg BID、130mg BID、140mgBID、150mg BID、160mg BID、170mg BID、180mg BID、190mg BID、200mg BID、210mg BID、220mg BID、230mg BID、240mg BID、250mg BID、260mg BID、270mg BID、280mg BID、290mgBID或300mg BID的量施用PTPRS去簇剂。在实施方案中,以约10mg BID的量施用PTPRS去簇剂。在实施方案中,以约20mg BID的量施用PTPRS去簇剂。在实施方案中,以约30mg BID的量施用PTPRS去簇剂。在实施方案中,以约40mg BID的量施用PTPRS去簇剂。在实施方案中,以约50mg BID的量施用PTPRS去簇剂。在实施方案中,以约60mg BID的量施用PTPRS去簇剂。在实施方案中,以约70mg BID的量施用PTPRS去簇剂。在实施方案中,以约80mg BID的量施用PTPRS去簇剂。在实施方案中,以约90mg BID的量施用PTPRS去簇剂。
在实施方案中,以约100mg BID的量施用PTPRS去簇剂。应当理解,在量被称作“BID”(其代表“每天2次”)的情况下,每天2次施用该量。
在实施方案中,以约110mg BID的量施用PTPRS去簇剂。在实施方案中,以约120mgBID的量施用PTPRS去簇剂。在实施方案中,以约130mg BID的量施用PTPRS去簇剂。在实施方案中,以约140mg BID的量施用PTPRS去簇剂。在实施方案中,以约150mg BID的量施用PTPRS去簇剂。在实施方案中,以约160mg BID的量施用PTPRS去簇剂。在实施方案中,以约170mgBID的量施用PTPRS去簇剂。在实施方案中,以约180mg BID的量施用PTPRS去簇剂。在实施方案中,以约190mg BID的量施用PTPRS去簇剂。在实施方案中,以约200mg BID的量施用PTPRS去簇剂。应当理解,在量被称作“BID”(其代表“每天2次”)的情况下,每天2次施用该量。
在实施方案中,以约210mg BID的量施用PTPRS去簇剂。在实施方案中,以约220mgBID的量施用PTPRS去簇剂。在实施方案中,以约230mg BID的量施用PTPRS去簇剂。在实施方案中,以约240mg BID的量施用PTPRS去簇剂。在实施方案中,以约250mg BID的量施用PTPRS去簇剂。在实施方案中,以约260mg BID的量施用PTPRS去簇剂。在实施方案中,以约270mgBID的量施用PTPRS去簇剂。在实施方案中,以约280mg BID的量施用PTPRS去簇剂。在实施方案中,以约290mg BID的量施用PTPRS去簇剂。在实施方案中,以约300mg BID的量施用PTPRS去簇剂。应当理解,在量被称作“BID”(其代表“每天2次”)的情况下,每天2次施用该量。
在实施方案中,以约10mg QD、20mg QD、30mg QD、40mg QD、50mg QD、60mg QD、70mgQD、80mg QD、90mg QD、100mg QD、110mg QD、120mg QD、130mg QD、140mg QD、150mg QD、160mg QD、170mg QD、180mg QD、190mg QD、200mg QD、210mg QD、220mg QD、230mg QD、240mgQD、250mg QD、260mg QD、270mg QD、280mg QD、290mg QD或300mg QD的量施用PTPRS去簇剂。在实施方案中,以约10mg QD的量施用PTPRS去簇剂。在实施方案中,以约20mg QD的量施用PTPRS去簇剂。在实施方案中,以约30mg QD的量施用PTPRS去簇剂。在实施方案中,以约40mgQD的量施用PTPRS去簇剂。在实施方案中,以约50mg QD的量施用PTPRS去簇剂。在实施方案中,以约60mg QD的量施用PTPRS去簇剂。在实施方案中,以约70mg QD的量施用PTPRS去簇剂。在实施方案中,以约80mg QD的量施用PTPRS去簇剂。在实施方案中,以约90mg QD的量施用PTPRS去簇剂。在实施方案中,以约100mg QD的量施用PTPRS去簇剂。应当理解,在量被称作“QD”(其代表“每天1次”)的情况下,每天1次施用该量。
在实施方案中,以约110mg QD的量施用PTPRS去簇剂。在实施方案中,以约120mgQD的量施用PTPRS去簇剂。在实施方案中,以约130mg QD的量施用PTPRS去簇剂。在实施方案中,以约140mg QD的量施用PTPRS去簇剂。在实施方案中,以约150mg QD的量施用PTPRS去簇剂。在实施方案中,以约160mg QD的量施用PTPRS去簇剂。在实施方案中,以约170mg QD的量施用PTPRS去簇剂。在实施方案中,以约180mg QD的量施用PTPRS去簇剂。在实施方案中,以约190mg QD的量施用PTPRS去簇剂。在实施方案中,以约200mg QD的量施用PTPRS去簇剂。应当理解,在量被称作“QD”(其代表“每天1次”)的情况下,每天1次施用该量。
在实施方案中,以约210mg QD的量施用PTPRS去簇剂。在实施方案中,以约220mgQD的量施用PTPRS去簇剂。在实施方案中,以约230mg QD的量施用PTPRS去簇剂。在实施方案中,以约240mg QD的量施用PTPRS去簇剂。在实施方案中,以约250mg QD的量施用PTPRS去簇剂。在实施方案中,以约260mg QD的量施用PTPRS去簇剂。在实施方案中,以约270mg QD的量施用PTPRS去簇剂。在实施方案中,以约280mg QD的量施用PTPRS去簇剂。在实施方案中,以约290mg QD的量施用PTPRS去簇剂。在实施方案中,以约300mg QD的量施用PTPRS去簇剂。应当理解,在量被称作“QD”(其代表“每天1次”)的情况下,每天1次施用该量。
可以在患者的一生、1年、1个月或1周以本文提供的量施用PTPRS去簇剂和TNF或IL-6抑制剂。可以每天、每周或每月以本文提供的量施用PTPRS去簇剂和TNF或IL-6抑制剂。可以在28个连贯天以本文提供的量施用PTPRS去簇剂和TNF或IL-6抑制剂。可以在14个连贯天以本文提供的量施用PTPRS去簇剂和TNF或IL-6抑制剂。在实施方案中,BID或QD施用PTPRS去簇剂和TNF或IL-6抑制剂。在其它实施方案中,在365、28或14个连贯天同时施用PTPRS去簇剂和TNF或IL-6抑制剂。在其它进一步实施方案中,在14个连贯天同时施用PTPRS去簇剂和TNF或IL-6抑制剂。
在一些实施方案中,每周或每月施用PTPRS去簇剂或TNF或IL-6抑制剂。
在一些实施方案中,所述TNF抑制剂是依那西普(Enbrel)或它的生物类似物。在一些实施方案中,所述第二量是低于50mg。在一些实施方案中,所述第二量是比50mg低10%、20%、30%、40%、50%、60%、70%、80%、90%、95%、98%或99%。
在一些实施方案中,所述TNF抑制剂是阿达木单抗(Humira)或它的生物类似物。在一些实施方案中,所述第二量是低于40mg。在一些实施方案中,所述第二量是比40mg低10%、20%、30%、40%、50%、60%、70%、80%、90%、95%、98%或99%。
在一些实施方案中,所述TNF抑制剂是英夫利昔单抗(Remicade)或它的生物类似物。在一些实施方案中,所述第二量是低于3mg/kg。在一些实施方案中,所述第二量是比3mg/kg低10%、20%、30%、40%、50%、60%、70%、80%、90%、95%、98%或99%。
在一些实施方案中,所述TNF抑制剂是戈利木单抗(Simponi)或它的生物类似物。在一些实施方案中,所述第二量是低于50mg。在一些实施方案中,所述第二量是比50mg低10%、20%、30%、40%、50%、60%、70%、80%、90%、95%、98%或99%。
在一些实施方案中,所述TNF抑制剂是塞妥珠单抗、培化舍珠单抗(Cimzia)或它的生物类似物。在一些实施方案中,所述第二量是低于200mg。在一些实施方案中,所述第二量是比200mg低10%、20%、30%、40%、50%、60%、70%、80%、90%、95%、98%或99%。
本文提供了包含第一量的PTPRS去簇剂和第二量的IL-6抑制剂的药物组合物,其中所述第二量低于IL-6抑制剂的治疗有效水平。所述第二量可以是比IL-6抑制剂的治疗有效水平低10%、20%、30%、40%、50%、60%、70%、80%、90%、95%、98%或99%。
在一些实施方案中,所述IL-6抑制剂是托珠单抗(Atlizumab)或它的生物类似物。在一些实施方案中,通过静脉内输注来施用所述药物,且所述第二量是低于4mg/kg。在一些实施方案中,所述第二量是比4mg/kg低10%、20%、30%、40%、50%、60%、70%、80%、90%、95%、98%或99%。在一些实施方案中,皮下施用所述药物,且所述第二量是低于162mg。在一些实施方案中,所述第二量皮下施用且是比162mg低10%、20%、30%、40%、50%、60%、70%、80%、90%、95%、98%或99%。对于通过皮下治疗RA,在小于100kg的患者中,每隔一周皮下施用162mg,随后基于临床应答增加至每周。
在一些实施方案中,所述IL-6抑制剂是Sarilumab(Kevzara)或它的生物类似物。在一些实施方案中,所述第二量是低于100mg。在一些实施方案中,所述第二量是比100mg低10%、20%、30%、40%、50%、60%、70%、80%、90%、95%、98%或99%.对于通过皮下治疗RA,在小于100kg的患者中,每天1次皮下施用100mg。
本文提供了以上药物组合物中的任一种,其中所述第一量低于PTPRS去簇剂的治疗有效水平。在一些实施方案中,所述PTPRS去簇剂包括PTPRS免疫球蛋白-样结构域1(Ig1)和免疫球蛋白-样结构域2(Ig2)中的一种或两种。在一些实施方案中,所述PTPRS去簇剂包括Ig1的SEQ ID NO:4的氨基酸残基30-127或SEQ ID NO:8的氨基酸残基30-127。在一些实施方案中,所述PTPRS去簇剂包括如EEPRFIKEPKDQIGVSGGVASFVCQATGDPKPRVTWNKKGKKVNSQRFETIEFDESAGAVLRIQPLRTPRDENVYECVAQNSVGEITVHAKLTVLRE(SE Q ID NO:1)所示或如SEQID NO:5所示的氨基酸序列。在一些实施方案中,所述PTPRS去簇剂包括Ig2的SEQ ID NO:4的氨基酸残基128-231或SEQ ID NO:8的氨基酸残基128-244。在一些实施方案中,所述PTPRS去簇剂包括如DQLPSGFPNIDMGPQLKVVERTRTATMLCAASGNPDPEITWFKDFLPVDPSASNGRIKQLRSETFESTPIRGALQIESSEETDQGKYECVATNSAGVRYSSPANLYVRVRRVA(SEQ ID NO:2)所示或如SEQ ID NO:6所示的氨基酸序列。在一些实施方案中,所述PTPRS去簇剂包括Ig3的SEQ IDNO:4的氨基酸残基232-321或SEQ ID NO:8的氨基酸残基245-334。在一些实施方案中,所述PTPRS去簇剂包括如PRFSILPMSHEIMPGGNVNITCVAVGSPMPYVKWMQGAEDLTPEDDMPVGRNVLELTDVKDSANYTCVAMSSLGVIEAVAQITVKSLPKA(SEQ ID NO:3)所示或如SEQ ID NO:7所示的氨基酸序列。在一些实施方案中,PTPRS去簇剂的氨基酸序列可以与上面列举的序列具有约60%同一性,优选65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高的同一性。
在一些实施方案中,所述PTPRS去簇剂结合硫酸类肝素。在一些实施方案中,所述PTPRS去簇剂缺乏跨膜结构域。在一些实施方案中,所述PTPRS去簇剂缺乏细胞内结构域。
在一些实施方案中,本文提供了以组合的协同量存在的第一量的PTPRS去簇剂和第二量的TNF或IL-6抑制剂的以上组合中的任一种的药物组合物。
术语“药学上可接受的盐”或“药学上可接受的载体”意在包括活性化合物的盐,其用相对无毒的酸或碱制备,这取决于在本文所述化合物上发现的特定取代基。当本申请的化合物包含相对酸性的官能团时,通过使这类化合物的中性形式与足量的期望碱(净的或在合适的惰性溶剂中)接触,可以获得碱加成盐。药学上可接受的碱加成盐的例子包括钠盐、钾盐、钙盐、铵盐、有机氨基盐、或镁盐或类似盐。当本申请的化合物包含相对碱性的官能团时,通过使这类化合物的中性形式与足量的期望酸(净的或在合适的惰性溶剂中)接触,可以获得酸加成盐。药学上可接受的酸加成盐的例子包括从无机酸如盐酸、氢溴酸、硝酸、碳酸、一氢碳酸、磷酸、一氢磷酸、二氢磷酸、硫酸、一氢硫酸、氢碘酸或亚磷酸等衍生出的那些,以及从相对无毒的有机酸如乙酸、丙酸、异丁酸、马来酸、丙二酸、苯甲酸、琥珀酸、辛二酸、富马酸、乳酸、扁桃酸、苯二甲酸、苯磺酸、对-甲苯磺酸、柠檬酸、酒石酸、甲磺酸等衍生出的盐。还包括氨基酸诸如精氨酸等的盐和有机酸诸如葡糖醛酸或半乳糖醛酸等的盐(参见,例如,Berge等人,Journal of Pharmaceutical Science 66:1-19(1977))。本领域技术人员已知的其它药学上可接受的载体适合用于本申请的组合物。
用于施用的组合物通常包含溶解在药学上可接受的载体(优选水性载体)中的如本文中所述的药剂。可以使用多种水性载体,例如,缓冲盐水等。这些溶液是无菌的,且通常不含有不期望的物质。通过常规的众所周知的灭菌技术,可以将这些组合物灭菌。所述组合物可以根据需要含有药学上可接受的辅助物质以接近生理条件,诸如pH调节剂和缓冲剂、毒性调节剂等,例如,醋酸钠、氯化钠、氯化钾、氯化钙、乳酸钠等。这些制剂中活性剂的浓度可以宽泛地变化,并且将根据所选择的特定施用方式和受试者的需要主要基于流体体积、粘度、体重等来选择。
在水中合适地与表面活性剂诸如羟丙基纤维素混合,可以制备作为游离碱或药理学上可接受的盐的活性化合物的溶液。还可以在甘油、液体聚乙二醇、及其混合物中和在油中制备分散体。在常规的储存和使用条件下,这些制剂可以包含防腐剂以防止微生物的生长。
通过鼻内的或可吸入的溶液或喷雾剂、气雾剂或吸入剂,可以递送药物组合物。鼻溶液可以是设计成以滴剂或喷雾剂形式施用于鼻道的水溶液。可以制备鼻溶液,使得它们在许多方面与鼻分泌物相似。因此,鼻水溶液通常是等渗的,并稍加缓冲以维持5.5至6.5的pH。另外,如果需要的话,在制剂中可以包含与在眼用制剂中使用的那些相似的抗微生物防腐剂和适当的药物稳定剂。各种市售的鼻用制剂是已知的,并且可以包括例如抗生素和抗组胺药。
口服制剂可以包括赋形剂,例如,药用级的甘露醇、乳糖、淀粉、硬脂酸镁、糖精钠、纤维素、碳酸镁等。这些组合物采取溶液剂、混悬液、片剂、丸剂、胶囊剂、持续释放制剂或粉剂的形式。在一些实施方案中,口服药物组合物将包含惰性稀释剂或可同化的可食用的载体,或可以将它们封装在硬或软壳明胶胶囊中,或可以将它们压制成片剂,或可以将它们直接与饮食食品掺合。对于口服治疗性施用,可以将活性化合物与赋形剂掺合,并以可摄取的片剂、含服片剂、糖锭、胶囊剂、酏剂、混悬液、糖浆剂、糯米纸囊剂等的形式使用。这样的组合物和制剂应当含有至少0.1%的活性化合物。当然,组合物和制剂的百分比可以变化,并且可以方便地在单元重量的约2至约75%之间,或优选在25-60%之间。这样的组合物中的活性化合物的量使得可以获得合适的剂量。
对于在水溶液中的胃肠外施用,例如,应该合适地缓冲溶液,并且首先用足够的盐水或葡萄糖使液体稀释剂等渗。水溶液,具体地,无菌水性介质,特别适合于静脉内、肌肉内、皮下和腹膜内施用。例如,可以将一个剂量溶解在1ml等渗NaCl溶液中,并加入1000ml皮下输液流体或在提议的输注部位注射。
可以通过如下制备无菌可注射溶液:将所需量的活性化合物或构建体掺入适当的溶剂中,然后过滤除菌。通常,通过如下制备分散体:将各种灭菌的活性成分掺入含有基本分散介质的无菌媒介物中。真空干燥和冷冻干燥技术(其产生活性成分加任何其它期望成分的粉末)可用于制备无菌粉末以重构无菌注射溶液。也涵盖用于直接注射的更加或高度浓缩的溶液的制备。DMSO可用作溶剂以实现极快的穿透,将高浓度的活性剂递送至小区域。
化合物的制剂可以呈现于单位剂量或多次剂量密闭容器诸如安瓿和管形瓶中。因此,该组合物可以呈单位剂型。在这样的形式中,将该制剂细分成含有适当量的活性组分的单位剂量。因此,取决于施用方法,可以以多种单位剂型施用组合物。例如,适合用于口服施用的单位剂型包括、但不限于粉末、片剂、丸剂、胶囊剂和锭剂。
通过采用本领域已知的程序,可以配制组合物以在施用后提供快速、持续或延迟的释放。取决于例如施用途径和所施用的组合物的浓度,某些载体可能是更优选的。用于所提供的组合物中的合适的制剂可以参见Remington:The Science and Practice ofPharmacy,第21版,David B.Troy,编,Lippicott Williams&Wilkins(2005)。
本文提供了包含一种或多种所提供的组合物和使用说明书的试剂盒。任选地,试剂盒包含一个或多个剂量的有效量的组合物,所述组合物包含PTPRS去簇剂和TNF抑制剂或IL-6抑制剂。任选地,试剂盒包含非酶重组蛋白,其包含PTPRS的细胞外结构域的氨基酸序列或其子序列、部分、同系物、变体或衍生物。任选地,试剂盒包含PTPRS的细胞外结构域的一个或多个部分。任选地,组合物或蛋白存在于容器(例如,小瓶或袋)中。任选地,试剂盒包含用于治疗或预防炎性疾病和/或自身免疫性疾病的一种或多种症状的一种或多种其它试剂。任选地,试剂盒包含施用组合物的装置,诸如例如注射器、针头、管道、导管、贴剂等。该试剂盒还可包含在使用前需要灭菌和/或稀释的制剂和/或材料。
本文所述的组合物和药剂可用于预防性和治疗性处理。为了预防性使用,在发作初期之前或期间(例如,在自身免疫性疾病的初始体征和症状之后)将治疗有效量的本文所述的药剂施用于受试者。治疗性处理涉及在疾病的诊断或发展后向受试者施用治疗有效量的本文所述的药剂。
所提供的蛋白、试剂和组合物用于治疗患有自身免疫性疾病或具有发生自身免疫性疾病的风险的受试者,所述自身免疫性疾病包括例如关节炎诸如类风湿性关节炎。任选地,所述蛋白、试剂和组合物用于治疗患有细胞外基质疾病和/或成纤维细胞介导的疾病或具有发生细胞外基质疾病和/或成纤维细胞介导的疾病的风险的受试者。本文中使用的术语“细胞外基质疾病”表示与细胞外基质(ECM)或细胞外基质的一种或多种组分相关的病况、病症或疾病。除了参与其它生物学功能(包括、但不限于细胞内通讯)外,细胞外基质还为细胞提供结构支持。细胞外基质的组分包括、但不限于蛋白聚糖(例如,硫酸类肝素、硫酸软骨素和硫酸角蛋白)、非蛋白聚糖多糖(例如,透明质酸)、纤维、胶原、弹性蛋白、纤连蛋白和层粘连蛋白。细胞外基质还充当信号传导分子诸如生长因子和细胞因子的贮库。细胞外基质疾病包括与以下调节异常有关的疾病:ECM的一种或多种功能的调节异常(例如,调节异常的细胞内通讯和/或运动),或ECM的一种或多种组分的调节异常(例如,增加或降低的ECM的一种或多种组分的活性和/或产生)。细胞外基质疾病还包括与ECM的降解和重塑改变有关的疾病,以及与ECM中的试剂、例如免疫复合物和其它免疫产物的积累改变(例如增加或减少)有关的疾病。细胞外基质疾病包括、但不限于动脉粥样硬化、癌症、淀粉样蛋白疾病、肾小球疾病、肾小球系膜疾病、炎性病况和发育病症。本文中使用的术语“成纤维细胞介导的疾病”表示与成纤维细胞活性或运动有关的病况、病症或疾病。成纤维细胞是参与ECM和胶原的合成的细胞类型,并且是结缔组织的主要细胞类型。成纤维细胞的类型包括、但不限于滑膜成纤维细胞、真皮成纤维细胞和间质成纤维细胞。成纤维细胞的主要功能是通过连续分泌ECM的组分来维持结缔组织的完整性。成纤维细胞介导的疾病包括与成纤维细胞的活性和/或运动改变有关的疾病。因此,例如,成纤维细胞介导的疾病包括与成纤维细胞迁移改变或成纤维细胞活性改变有关的疾病。成纤维细胞活性包括、但不限于胶原产生、糖胺聚糖产生、网状和弹性纤维产生、细胞因子产生和糖蛋白产生。因此,成纤维细胞介导的疾病包括与成纤维细胞对胶原、糖胺聚糖、网状和弹性纤维、细胞因子和糖蛋白中的一种或多种的产生的改变有关的疾病。
本文中使用的术语“炎性疾病”表示以异常炎症(例如,与对照诸如没有患有疾病的健康人相比增加的炎症水平)为特征的疾病或病况。炎性疾病的例子包括自身免疫性疾病、关节炎、类风湿性关节炎、银屑病关节炎、青少年特发性关节炎、多发性硬化、系统性红斑狼疮(SLE)、重症肌无力、青少年发作糖尿病、I型糖尿病、格-巴二氏综合征、桥本脑炎、桥本甲状腺炎、强直性脊柱炎、银屑病、舍格伦综合征、血管炎、肾小球肾炎、自身免疫甲状腺炎、贝赫切特病、克罗恩氏病、溃疡性结肠炎、大疱性类天疱疮、结节病、鱼鳞病、格雷夫斯眼病、炎性肠病、阿狄森氏病、白癫风、哮喘、变应性哮喘、寻常痤疮、乳糜泻、慢性前列腺炎、炎性肠病、盆腔炎性疾病、再灌注损伤、缺血再灌注损伤、中风、结节病、移植排斥、间质性膀胱炎、动脉粥样硬化、硬皮病和特应性皮炎。
本文提供了调节受试者中的PTPRS活性的方法,所述方法包括给受试者施用有效量的PTPRS去簇剂,其中施用调节受试者中的PTPRS活性。还提供了治疗、预防和/或改善有此需要的受试者中的自身免疫性疾病或病症的方法。具体地,提供了一种治疗受试者中的自身免疫性疾病的方法,所述方法包括给受试者施用治疗有效量的如上所述的PTPRS去簇剂和TNF抑制剂或IL-6抑制剂,其中施用治疗受试者中的自身免疫性疾病。还提供了一种治疗受试者中的自身免疫性疾病的方法,所述方法包括给受试者施用治疗有效量的增加PTPRS磷酸酶活性的化合物,其中施用治疗受试者中的自身免疫性疾病。自身免疫性疾病或病症包括、但不限于炎性自身免疫性疾病。任选地,自身免疫性疾病是关节炎、类风湿性关节炎、银屑病关节炎、青少年特发性关节炎、硬皮病、全身性硬皮病、多发性硬化、系统性红斑狼疮(SLE)、重症肌无力、青少年发作糖尿病、I型糖尿病、格-巴二氏综合征、桥本脑炎、桥本甲状腺炎、强直性脊柱炎、银屑病、舍格伦综合征、血管炎、肾小球肾炎、自身免疫甲状腺炎、贝赫切特病、克罗恩氏病、溃疡性结肠炎、大疱性类天疱疮、结节病、银屑病、鱼鳞病、格雷夫斯眼病、炎性肠病、阿狄森氏病、白癫风、哮喘或变应性哮喘。任选地,自身免疫性疾病是关节炎、克罗恩氏病、硬皮病或类风湿性关节炎。任选地,所述化合物是如上所述的PTPRS去簇剂和TNF抑制剂或IL-6抑制剂。任选地,PTPRS去簇剂不是硫酸软骨素。任选地,所述去簇剂不是硫酸软骨素、硫酸软骨素模拟物或具有与硫酸软骨素相同或相似的作用机理的药剂。任选地,PTPRS去簇剂是抗-PTPRS抗体或其片段、抗-硫酸类肝素抗体或硫酸软骨素模拟物。任选地,如本文所述,PTPRS去簇剂可以是包含PTPRS的细胞外结构域的氨基酸序列或其子序列、部分、同系物变体或衍生物的非酶重组蛋白。
所述方法包括施用有效量的所提供的药剂和组合物,其中施用有效量的组合物治疗或预防受试者中的自身免疫性疾病。本文公开的组合物的施用可以是全身或局部施用。例如,治疗患有炎性自身免疫病症的受试者可以包括每天或以其它规律的时间表施用药物组合物的口服或可注射形式。任选地,可以配制用于施用的药剂和组合物,以用于递送至滑液和/或用于递送至成纤维细胞样滑膜细胞。在一些实施方案中,仅根据需要,例如在炎性自身免疫性疾病症状出现后,进行治疗。
还提供了降低受试者中的成纤维细胞活性的方法。所述方法包括给受试者施用治疗有效量的PTPRS去簇剂,其中施用降低受试者中的成纤维细胞活性。任选地,所述去簇剂不是硫酸软骨素、硫酸软骨素模拟物或具有与硫酸软骨素相同或相似的作用机理的药剂。在一些实施方案中,所述去簇剂是硫酸软骨素模拟物。任选地,PTPRS去簇剂是本文提供的非酶重组蛋白。任选地,PTPRS去簇剂结合硫酸类肝素。任选地,PTPRS去簇剂是抗-PTPRS抗体或其片段或抗-硫酸类肝素抗体或其片段。任选地,所述成纤维细胞活性包括成纤维细胞迁移。任选地,所述成纤维细胞活性包括胶原产生、糖胺聚糖产生、网状和弹性纤维产生、细胞因子产生、趋化因子产生、糖蛋白产生或它们的组合。任选地,所述成纤维细胞活性包括细胞外基质产生。成纤维细胞包括、但不限于滑膜成纤维细胞、真皮成纤维细胞和间质成纤维细胞。任选地,所述成纤维细胞是滑膜成纤维细胞。
在一些情况下,所述受试者具有成纤维细胞介导的疾病。因而,提供了治疗受试者中成纤维细胞介导的疾病的方法。所述方法包括给受试者施用治疗有效量的PTPRS去簇剂,其中施用治疗受试者中成纤维细胞介导的疾病。任选地,所述去簇剂不是硫酸软骨素、硫酸软骨素模拟物或具有与硫酸软骨素相同或相似的作用机理的药剂。在一些实施方案中,所述去簇剂是软骨素模拟物。任选地,PTPRS去簇剂是本文提供的非酶重组蛋白。任选地,PTPRS去簇剂结合硫酸类肝素。任选地,PTPRS去簇剂是抗-PTPRS抗体或其片段或抗-硫酸类肝素抗体或其片段。成纤维细胞介导的疾病包括、但不限于纤维化和成纤维细胞介导的自身免疫性疾病。纤维化可以是,例如,肺纤维化、特发性肺纤维化、肝纤维化、心内膜心肌纤维化、心房纤维化、纵隔纤维化、骨髓纤维化、腹膜后纤维化、肾源性全身性纤维化、皮肤纤维化或关节纤维化。成纤维细胞介导的自身免疫性疾病可以是,例如,克罗恩氏病、关节炎、类风湿性关节炎和硬皮病。
本文提供了调节受试者中的细胞外基质的方法,所述方法包括给受试者施用有效量的本文提供的非酶重组蛋白,其中施用调节受试者中的细胞外基质。任选地,所述方法不包括硫酸软骨素、硫酸软骨素模拟物或具有与硫酸软骨素相同或相似的作用机理的药剂的施用。细胞外基质的调节包括,例如,细胞外基质的一种或多种组分的调节。任选地,细胞外基质组分选自蛋白聚糖、多糖或纤维。任选地,细胞外基质组分是蛋白聚糖,例如,硫酸类肝素或硫酸软骨素。任选地,细胞外基质组分是硫酸类肝素。任选地,受试者具有细胞外基质疾病。细胞外基质疾病是已知的且包括、但不限于动脉粥样硬化、癌症、淀粉样蛋白疾病、炎性病况和发育病症。任选地,细胞外基质疾病是骨关节炎。任选地,淀粉样蛋白疾病是阿尔茨海默氏病或炎症相关的AA淀粉样变性。任选地,炎性病况是系统性硬化症或狼疮。
本文提供的包括治疗具有炎性病况、自身免疫性疾病、成纤维细胞介导的疾病或细胞外基质疾病的受试者的方法可以包括施用一种或多种其它药剂,所述其它药剂治疗或预防炎性病况或自身免疫性疾病。例如,所提供的方法可以进一步包括施用有效量的一种或多种抗炎剂。用于用在所提供的方法中的合适其它药剂包括、但不限于镇痛药、非甾体类抗炎药、改善疾病的抗风湿药、皮质类固醇和维生素D类似物。示例性的用于治疗或预防类风湿性关节炎的改善疾病的抗风湿药包括、但不限于硫唑嘌呤、环孢菌素A、D-青霉胺、金盐、羟氯喹、来氟米特、甲氨蝶呤(MTX)、米诺环素、柳氮磺吡啶(SSZ)和环磷酰胺。
药剂或组合物的组合可以伴随地(例如,作为混合物)、分开但同时(例如,通过单独的静脉内注射)或依次(例如,首先施用一种药剂、然后施用第二种药剂)施用。因此,术语组合用于表示两种或更多种药剂或组合物的伴随、同时或依次施用。最好根据受试者的特定特征和所选的治疗类型,在个体基础上确定治疗过程。可以每天、每天两次、每两周、每月或在治疗上有效的任何适用的基础上对受试者施用治疗,诸如本文公开的那些。该治疗可以单独施用,或与本文公开或本领域已知的任何其它治疗组合施用。可以与第一治疗同时、在不同的时间或以完全不同的治疗时间表施用额外治疗(例如,第一治疗可以是每天,而额外治疗是每周)。
根据本文提供的方法,向受试者施用有效量的一种或多种本文提供的药剂。术语有效量和有效剂量互换使用。术语“有效量”定义为产生期望的生理学应答(例如,炎症的减轻)所需的任何量。本领域技术人员可以凭经验确定施用药剂的有效量和时间表。施用的剂量范围是足够大以产生期望的效果的剂量范围,其中疾病或病症的一种或多种症状受到影响(例如,减少或延迟)。剂量不应太大以致引起严重的不利副作用,诸如不希望的交叉反应、过敏性反应等。通常,剂量将随年龄、状况、性别、疾病类型、疾病或病症的程度、施用途径或在方案中是否包括其它药物而变化,并且可以由本领域技术人员确定。在任何禁忌症的情况下,剂量可由个体医师调整。剂量可以变化,并且可以每天施用一个或多个剂量,持续一天或几天。对于给定类别的药物产品,可以在文献中找到适当剂量的指南。例如,对于给定的参数,有效量将显示出至少5%、10%、15%、20%、25%、40%、50%、60%、75%、80%、90%或至少100%的增加或减少。效力还可以表示为“倍”增加或减少。例如,治疗有效量相对于对照可以具有至少1.2倍、1.5倍、2倍、5倍或更多倍的作用。确切剂量和制剂将取决于治疗的目的,并且将可由本领域技术人员使用已知技术确定(参见,例如,Lieberman,Pharmaceutical Dosage Forms(第1-3卷,1992);Lloyd,The Art,Science andTechnology of Pharmaceutical Compounding(1999);Remington:The Science andPractice of Pharmacy,第20版,Gennaro,Editor(2003),和Pickar,Dosage Calculations(1999))。
任选地,所提供的治疗方法或调节受试者中PTPRS活性或功能的方法进一步包括从受试者获得生物样品,并确定受试者是否具有与对照相比改变的PTPRS的RNA水平或改变的PTPRS的蛋白水平,改变的RNA水平或改变的蛋白水平指示受试者具有炎性病况、自身免疫性疾病、成纤维细胞介导的疾病或细胞外基质疾病或处于发生炎性病况、自身免疫性疾病、成纤维细胞介导的疾病或细胞外基质疾病的风险中。任选地,改变的水平是与对照相比升高的水平。对照样品或值表示用作参照物(通常是已知参照物)以与测试样品进行对比的样品。例如,可以从怀疑患有自身免疫性疾病的患者获取测试样品,并与来自已知患有自身免疫性疾病的受试者或已知的正常(非疾病)受试者的样品进行对比。对照也可以代表从相似个体(例如,自身免疫性疾病患者或具有相似医学背景、相同年龄、体重等的健康个体)的群体中收集的平均值。还可以在疾病之前或治疗之前从同一个体(例如从较早获得的样品)获得对照值。
因此,还提供了确定受试者是否患有炎性病况、自身免疫性疾病、成纤维细胞介导的疾病或细胞外基质疾病或处于发生炎性病况、自身免疫性疾病、成纤维细胞介导的疾病或细胞外基质疾病的风险中的方法,所述方法包括从受试者获得生物样品并确定受试者是否具有升高的PTPRS或其同种型的RNA水平或升高的PTPRS或其同种型的蛋白水平,升高的RNA水平或升高的蛋白水平指示受试者具有自身免疫性疾病、炎性疾病、成纤维细胞介导的疾病或细胞外基质疾病或处于发生自身免疫性疾病、炎性疾病、成纤维细胞介导的疾病或细胞外基质疾病的风险中。任选地,所提供的方法进一步包括选择患有自身免疫性疾病的受试者。任选地,自身免疫性疾病是炎性自身免疫性疾病,例如,关节炎或类风湿性关节炎。本文中使用的生物样品包括、但不限于细胞、组织和体液。用于评价PTPRS RNA或蛋白的存在、不存在或水平的体液包括、但不限于全血、血浆、尿、血清、眼泪、淋巴液、胆汁、脑脊液、间隙液、房水或玻璃体液、初乳、痰、羊水、唾液、支气管肺泡灌洗液样品、汗液、漏出液、渗出物和滑液。任选地,生物样品源自关节组织或体液。任选地,所提供的方法还包括从关节组织或体液分离细胞,从而形成分离的细胞样品。这样的分离的细胞样品可以包括滑膜细胞、成纤维细胞、造血细胞、巨噬细胞、白细胞、T-细胞或它们的组合。任选地,滑膜细胞是成纤维细胞样滑膜细胞或巨噬细胞-样滑膜细胞。任选地,分离的细胞样品包含成纤维细胞样滑膜细胞。
用于检测和鉴定核酸和蛋白以及此类分子之间的相互作用的方法涉及本领域技术范围内的常规分子生物学、微生物学和重组DNA技术。此类技术在文献中得到了充分解释(参见,例如,Sambrook,Fritsch&Maniatis,Molecular Cloning:ALaboratory Manual,1989年第2版,Cold Spring Harbor Laboratory Press,Cold Spring Harbor,N.Y.;Animal Cell Culture,R.I.Freshney,编,1986)。
用于检测RNA的方法在很大程度上与核酸检测测定一起累积,并且包括例如RNA印迹、RT-PCR、包括微阵列的阵列、以及包括高通量测序方法的测序。在一些实施方案中,进行逆转录酶反应,且然后使用标准的PCR扩增靶序列。当与对照相比时,定量PCR(qPCR)或实时PCR(RT-PCR)可用于确定相对表达水平。定量PCR技术和平台是本领域已知的和商购可得的(参见,例如,qPCR Symposium网站,可在qpersymposium.com获得)。核酸阵列也可用于检测核酸表达。可定制的阵列可从例如Affymetrix获得。任选地,用于检测RNA的方法包括测序方法。RNA测序是已知的并且可以用多种平台进行,所述平台包括、但不限于由Illumina,Inc.,(La Jolla,CA)或Life Technologies(Carlsbad,CA)提供的平台。参见,例如,Wang,等人,Nat Rev Genet.10(1):57-63(2009);和Martin,Nat Rev Genet.12(10):671-82(2011)。
可以通过本领域用于定量蛋白的标准方法确定蛋白水平或浓度,所述方法诸如蛋白质印迹法、ELISA、ELISPOT、免疫沉淀、免疫荧光(例如,FACS)、免疫组织化学、免疫细胞化学等,以及目前已知的任何其它方法或后来被开发用于定量细胞中的蛋白或由细胞产生的蛋白的方法。
公开了材料、组合物和组分,所述材料、组合物和组分可用于公开的方法和组合物,可以与公开的方法和组合物结合使用,可以用于制备公开的方法和组合物,或者是公开的方法和组合物的产物。在本文中公开了这些和其它材料,并且应当理解,当公开这些材料的组合、子集、相互作用、组等时,尽管这些化合物的每个不同个体和集体组合和排列的具体提及可能未明确公开,但是每个都在本文中特别涵盖和描述。例如,如果公开和讨论了一种方法,并且讨论了可以对包括所述方法在内的许多分子进行的许多修改,则所述方法的每种和每个组合和排列以及可能的修改都被特别涵盖,除非特别相反指出。同样,这些的任何子集或组合也被特别涵盖和公开。该概念适用于本公开内容的所有方面,包括、但不限于使用所公开的组合物的方法中的步骤。因此,如果可以执行多个额外步骤,则应当理解,这些额外步骤中的每一个可以用所公开方法的任何特定方法步骤或方法步骤的组合来执行,并且每个这样的组合或组合的子集被特别涵盖并且应该认为被公开。
本文所引用的出版物及其所引用的材料特此通过引用以其整体并入本文。
已经描述了许多实施方案。尽管如此,应该理解,可以进行各种修改。因此,其它实施方案是在权利要求的范围内。
实施例
实施例1.材料和方法
多肽
下述多肽用在实验中:
“使用中”(SEQ ID NO:16):
EEPPRFIREPKDQIGVSGGVASFVCQATGDPKPRVTWNKKGKKVNSQRFETIDFDESSGAVLRIQPLRTPRDENVYECVAQNSVGEITIHAKLTVLREDQLPPGFPNIDMGPQLKVVERTRTATMLCAASGNPDPEITWFKDFLPVDPSASNGRIKQLRSGALQIESSEETDQGKYECVATNSAGVRYSSPANLYVRTSGGGSLVPRGSEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
“构建体1”(SEQ ID NO:17):
ETGEEPPRFIREPKDQIGVSGGVASFVCQATGDPKPRVTWNKKGKKVNSQRFETIDFDESSGAVLRIQPLRTPRDENVYECVAQNSVGEITIHAKLTVLREDQLPPGFPNIDMGPQLKVVERTRTATMLCAASGNPDPEITWFKDFLPVDPSASNGRIKQLRSGALQIESSEETDQGKYECVATNSAGVRYSSPANLYVRTSGGGGSGGGGSEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
“His-标记的”(SEQ ID NO:18):
ETGEEPPRFIREPKDQIGVSGGVASFVCQATGDPKPRVTWNKKGKKVNSQRFETIDFDESSGAVLRIQPLRTPRDENVYECVAQNSVGEITIHAKLTVLREDQLPPGFPNIDMGPQLKVVERTRTATMLCAASGNPDPEITWFKDFLPVDPSASNGRIKQLRSGALQIESSEETDQGKYECVATNSAGVRYSSPANLYVRGTKHHHHHH
人滑液组织和FLS的制备
从加利福尼亚大学圣地亚哥分校(University of California,San Diego,UCSD)临床和转化研究所(Clinical and Translational Research Institute,CTRI)生物存储库以及昭和大学风湿病学分部(Showa University Division of Rheumatology)获得FLS。如在(52)中所述,每个系都是先前从经历滑膜切除术的不同RA患者移取的滑液组织中获得。RA的诊断符合美国风湿病学会(American College of Rheumatology)1987年修订标准(53)。收集FLS并用于UCSD机构审查委员会(IRB)根据协议#140175批准的实验,或用于拉荷亚过敏与免疫研究所IRB根据协议#CB-120-0614批准的实验。所有患者均签署了当地IRB批准的同意表格。
在含有10%胎牛血清(FBS;Omega Scientific)、2mM L-谷氨酰胺、50μg/ml庆大霉素、100单位/ml青霉素和100μg/ml链霉素(Life Technologies)的Dulbecco氏改良的伊格尔培养基(DMEM,Corning)中在37℃在含有5%CO2的控湿气氛中培养FLS。对于所有实验,除非另外指出,否则在第4代和第10代之间使用FLS,并在实验前将细胞在0.1%FBS(血清-饥饿培养基)中同步化24-48h。
人真皮成纤维细胞
如在(54)中所述,从获得自国家疾病研究交换所(National Disease ResearchInterchange,NDRI)的皮肤样本分离出来自健康人供体(NHDF)的真皮成纤维细胞系。在与FLS相同的完全DMEM培养基和条件下培养NHDF。对于所有实验,在第3代和第8代之间使用NHDF,并在分析或功能测定前将细胞在含有0.1%FBS的血清饥饿培养基中同步化24h。
小鼠FLS系的制备
从8-周龄BALB/c小鼠分离出肘、膝和踝关节。将切碎的组织在RPMI-1640中在0.5mg/ml胶原酶IV中在轻微搅拌下在37℃消化2小时,并在含有10%胎牛血清、2mM L-谷氨酰胺、50μg/ml庆大霉素、100单位/ml青霉素和100μg/ml链霉素的FLS培养基(DMEM)中在37℃在5%CO2控湿气氛中培养4天。除非另外指出,否则在第4代和第10代之间使用鼠FLS,并在实验前在0.1%FBS(血清饥饿培养基)中同步化过夜。
FLS迁移测定
将汇合的FLS在含有0.1%FBS的DMEM中血清饥饿24小时,通过胰蛋白酶消化进行收获,并在具有8μm孔径的6.5mm-直径Transwell聚碳酸酯培养插入物(Costar)的上腔室中将5x 10
FLS侵入测定
对于侵入测定,除了使用Corning
伤口愈合测定
使RA FLS在6-孔平板中生长至汇合,并在含有0.1%FBS的DMEM中血清饥饿24小时。用1ml尖头刮擦细胞,并在20或40nM Fc-Ig1&2或媒介物对照存在的情况下在含有1%FBS的DMEM中温育。在刚刚创伤后(0h)以及在24小时后,使用Motic AE2000显微镜以4X用软件ToupView 3.7捕获创伤的4个图像。使用ImageJ(NIH,version 1.8.0_201)软件计算创伤面积,并将24h后的创伤面积针对0h的面积归一化。
免疫印迹法
将细胞在含有1mM苯基甲磺酰氟、1X蛋白酶抑制剂混合液(Roche)和PhosStop(Sigma-Aldrich)的TNE缓冲液(50mM Tris-HCl[pH 7.5],150mM NaCl,5mM EDTA[pH 8.0])中裂解。使用Pierce BCA蛋白测定试剂盒(Thermo Scientific)测定细胞裂解物的蛋白浓度。使用山羊多克隆抗-人PTPRS抗体(R&D Systems)和来自Cell Signaling的兔抗-GAPDH抗体进行免疫印迹法。
为了检测多配体聚糖-4,将RA和OA FLS系用类肝素酶I(60ng/mL)、II(88ng/mL)和III(90ng/mL)的组合在37℃处理1小时,此后将细胞用PBS洗涤并在1X RIPA裂解缓冲液(Cell Signaling Technologies)中裂解。重组P.heparanus Heparanase II和III以及重组F.heparanum Heparanase I获得自R&D systems。使用山羊多克隆抗-多配体聚糖-4抗体(R&D systems)检测多配体聚糖-4。
定量实时RT-PCR(qPCR)
使用RNeasy试剂盒(Qiagen)提取RNA。使用用于qRT-PCR的
小鼠
根据拉荷亚过敏与免疫研究所(La Jolla Institute for Allergy&Immunology)的动物实验管理小组(Institutional Animal Care and Use Committee)批准的方案(#AP140-NB4-0610)和UCSD(#S16098)进行所有动物实验。如先前在(55)中所述,产生在BALB/c背景上的PTPRS敲除的(KO)小鼠。从Jackson Laboratories获得DBA1/J(JAX 000670,DBA1/J),BALB/c(JAX 000651,BALB/cJ)和CD45.1 BALB/c(JAX 006584,CByJ.SJL(B6)-Ptprca/J)。在C57BL/6背景上的KRN小鼠是Christophe Benoist博士(HarvardUniversity)的慷慨礼物。NOD小鼠获得自Taconic。
关节炎模型
将KRN和NOD小鼠杂交以获得在6-7周龄左右发展为关节炎的后代(自发的K/BxN小鼠)。合并来自关节炎K/BxN小鼠的血清用于K/BxN血清转移诱导的关节炎(STIA)模型(35)。为了引发STIA,向6-8周龄小鼠腹膜内(i.p.)注射100μl致关节炎K/BxN血清。从血清注射当天开始,每隔一天通过临床评分(如下所述)和踝肿胀的测量结果来评价关节炎的严重程度。
如(56)中所述进行胶原诱导的关节炎(CIA)模型。简而言之,用在含有50μg结核分枝杆菌(Mycobacterium tuberculosis)(H37Ra,ATCC 25177)的弗氏佐剂(CFA,Sigma-Aldrich)中乳化的100μg鸡II型胶原(Condrex)免疫8-10周龄雄性DBA/1J。28天后,用在不完全弗氏佐剂(IFA;Sigma-Aldrich)中乳化的100μg鸡II型胶原强化小鼠。如下所述通过临床评分来评估关节炎。在所有模型中,如前(57)所述,在腕和踝上对关节炎进行临床评分:0=正常;1=极少的红斑和轻度肿胀;2=中度的红斑和轻度肿胀;3=明显的红斑和严重肿胀,尚未累及趾;4=最大的红斑和肿胀,累及趾。
His-Ig1&2、Fc-Ig1&2和鼠依那西普的体内施用
在(21)中描述了重组PTPRS 6xHisIg1&2(此处称为His-Ig1&2)的制备。人IgG1-Fc-融合的Ig1&2(此处称为Fc-Ig1&2)的制备与LakePharma(USA)签订合同。通过AmgenExtramural Research Alliance Program从Amgen获得鼠TNF-阻断生物学制品p75TNFR:Fc(鼠依那西普)。根据图例中所述的时间表施用在Tris-缓冲盐水(TBS)中的His-Ig1&2或媒介物对照(TBS)、在含有120mM NaCl的20mM Tris中的Fc-Ig1&2或人IgG1-Fc对照和鼠依那西普。
体内pDC消耗
通过经由间隔2天的腹膜内(i.p.)或眼眶后(r.o.)注射施用2次500μg抗-PDCA-1(InVivoMAb抗-小鼠CD317;BioXcell)或IgG同种型对照(BioXcell),耗尽小鼠的pDC。
血清抗-胶原抗体水平的测量
如(56)所述,通过酶联免疫吸附测定(ELISA)测量用胶原免疫的小鼠的血清中的抗-胶原抗体水平。简而言之,用II型鸡胸骨胶原(1μg/ml;Sigma)包被低结合96多孔平板(Costar)。在系列稀释物中温育血清,并使用生物素化的抗-小鼠IgG抗体(JacksonLaboratories)以及抗-小鼠IgG1、IgG2a、IgG2b和IgG3抗体(Southern Biotech)检测与胶原结合的IgG,然后与extravidin-HRP(Sigma)一起温育,并暴露于3,3’,5,5’-四甲基联苯胺(TMB)底物。使用Tecan Infinite M1000平板读数器在450nm读出平板吸光度。
小鼠关节炎关节的组织学评分
将整个后爪在10%福尔马林中固定,脱钙,修剪并包埋。从组织块制备切片,并用苏木精和曙红、番红-O或甲苯胺蓝(HistoTox)染色。如(57)所述进行组织病理学评分。简而言之,根据以下标准,基于苏木精和曙红染色,将关节炎小鼠的关节炎症评分为0-4:0=正常;1=炎性细胞在关节周围区域中的最小浸润;2=轻度浸润;3=中等浸润;和4=显著浸润。根据以下标准,基于苏木精和曙红染色,将关节炎小鼠的关节骨质吸收评分为0-4:0=正常;1=最小(小的吸收区域,在低放大率下不易观察到);2=轻度(在小梁或骨皮质中有更多的吸收区域,在低放大率下不易观察到);3=中度(小梁和骨皮质吸收明显,在皮质中没有完整厚度缺陷;一些小梁缺失;在低放大率下可见病变);和4=明显(在骨皮质中的完整厚度缺陷和明显的小梁骨丢失)。通过基质的减少的番红O或甲苯胺蓝染色来鉴定软骨消耗,并以0-4的等级评分,其中0=无软骨破坏(用番红O完全染色),1=局部软骨侵蚀,2=更延伸的软骨侵蚀,3=严重的软骨侵蚀,和4=整个软骨消耗。组织学分析以盲法进行。使用Zeiss Axioscan.Z1(Zeiss)载片扫描仪获取整个踝的图像,并使用Zen软件(Zeiss)进行分析。
微型计算机体层摄影术(microCT)
将小鼠踝置于10%中性缓冲的福尔马林中。固定后,将样品转移至70%乙醇。扫描前,将骨骼转移至磷酸盐缓冲盐水(PBS)保持48h。在50kV/200mA,使用0.5mm铝滤片,在具有9μm体素大小的Skyscan1176微-CT(Bruker)上进行扫描。曝光时间为810ms。用180°的扫描角旋转和平均4个帧的组合以0.4°的间隔获得X射线投影。使用NRECON软件(Bruker)和DataViewer(Bruker)将投影图像重建为3D图像。使用CT Analyzer软件(Bruker)处理数据,并使用CT-VOX软件(Bruker)生成图像。如(56)中所述定量骨侵蚀。
Fc-Ig1&2和鼠依那西普的放射性标记
为了进行放射性标记,首先将药剂用DOTA官能化以提供螯合位点来附着放射性原子。为了将Fc-Ig1&2共价偶联至DOTA(Tetraxetan),通常将0.8mg蛋白固定在总量为1.3ml的Tris pH 7.3、150mM NaCl中的0.5ml类肝素-琼脂糖珠子(Sigma)上。加入0.77mM浓度的DOTA-NHS酯(Macrocyclics),并在室温温育30分钟。在相同缓冲液中充分洗涤后,将蛋白洗脱在750mM NaCl、20mM Tris pH 8.3中,通过尺寸排阻色谱法(Bio-Rad SEC 650)进一步纯化,并浓缩至12-15mg/ml。除了不需要固定化在固体支持物上以外,以类似的方式修饰鼠依那西普。常规通过Native PAGE监测反应。
在该官能化步骤之后,将缀合物与铟-111一起在43℃温育3小时,并通过P10分离柱进行纯化。
生物分布
如在关节炎模型下所述,通过腹膜内注射100uL K/BxN血清来诱导STIA。放射性标记的蛋白的注射和随后的成像开始于关节炎的高峰期,其发生在血清注射后8天。
在注射和成像之前,将所有动物用异氟烷麻醉。每只动物接受放射性标记的药剂的静脉内注射,每只动物的剂量为大约170uCi。向四只关节炎小鼠注射大约170uCi的
流式细胞计量术
从淋巴结和脾脏制备单细胞悬液。为了从小鼠血液中分离细胞,通过眼眶后放血(来自活动物)或心脏穿刺(来自安乐死的动物)将血液收集到在PBS中的2mM EDTA中。使用eBiosience RBC裂解缓冲液(Thermo Fisher)从脾脏和小鼠血液中裂解红细胞。为了分离滑膜细胞,收集踝关节,并通过用钝钳拉动使胫骨和趾脱节,并冲洗骨髓以避免骨髓污染。将关节用PBS冲洗,并在37℃用Liberase TM(Roche)和DNA酶I解离60分钟。在抗体染色之前,将细胞与Fc阻断剂(BD Pharmingen)一起预温育。对于表面染色,对CD3(17A2)、CD19(6D5)、NK1.1(PK136)、CD11b(M1/70)、CD44(IM7)、Ly6G(1A8)、Ly6C(HK1.4)、CD45.1(A20)、MHCII(M5/114.15.2)、CD64(X54-5/7.1)、CD115(AFS98)特异性的荧光染料-缀合抗体获得自Biolegend。CD43(R2/60)、PD1(RMP1-30)、GL7(GL-7)、CD25(PC61.5)、B220(RA3-6B2)、CD317/BST2(eBio927)、CD62L(MEL-14)、CD45.2(104)、TCR-β(H57-597)、CD8(53-6.7)、CD4(RM4-5)获得自eBioscience/Thermo Fisher。对于细胞内细胞因子染色,将细胞在布雷菲德菌素A (3微克/mL,eBioscience/Thermo Fisher)存在的情况下与20ng/mL佛波醇12-肉豆蔻酸酯13-乙酸酯(PMA,Sigma Aldrich)和1μm离子霉素(Sigma Aldrich)一起在37°温育5小时。用IC固定缓冲液(eBioscience/Thermo Fisher)和透化缓冲液(eBioscience/Thermo Fisher)进行细胞内染色。对于转录因子的细胞内染色,使用了FoxP3/转录因子染色缓冲液组(eBioscience/Thermo Fisher)。识别FoxP3(FJK-16s)、IL-17A (eBio17B7)和IFNγ(XMG1.2)的抗体从eBioscience/Thermo Fisher获得,且BCL6从BD Bioscience获得。通过用来自eBioscience/Thermo Fisher的Fixable Viability染料染色,将死细胞排除在分析之外。
在配备Everest软件的ZE5流式细胞仪(Bio-Rad)上获取数据。使用FlowJo软件(TreeStar)进行分析。在FACSAria III仪器(BD Biosciences)上进行细胞分选。对于流式分析,使用Mix-n-Stain
骨髓重建
为了产生骨髓嵌合体,使用RS 2000Biological辐照器对雄性BALB/cByJ(CD45.1同类系)小鼠用2剂550Rads进行致死性辐照,且随后施用来自雄性PTPRS WT或KO同类系CD45.2供体小鼠的骨髓。在辐照后8周,施用KBxN血清以诱发关节炎。7周后,通过对适当的CD45等位基因(抗-CD45.1和抗-CD45.2;eBioscience)染色,通过流式细胞计量术验证嵌合体。接受者小鼠中的植入的百分比大于95%。
骨髓衍生的巨噬细胞的M1和M2极化
从8-12-周龄BALB/c小鼠分离出骨髓细胞。将总骨髓细胞铺板在6孔培养板(2x10
吞噬作用测定
从8-12-周龄BALB/c小鼠分离出骨髓细胞,并在12孔板(1x10
CD4 T细胞分化测定.
使用EasySep
对于Th1细胞的分化,在完全RPMI培养基(10%FBS,100单位/mL青霉素,100微克/mL链霉素,1X非必需氨基酸,25mM HEPES,55微摩尔β-巯基乙醇,2mM L-Glutamin)中在抗-CD3(145-2C11,Biolegend,2微克/ml)包被的平板上培养1x10
在第二个实验中,我们在抗原呈递细胞(APC)存在的情况下对原初CD4 T细胞进行了极化。在Th1、Th17或iTreg极化条件下,将从BALB/c小鼠分离出的1x10
转染和双重萤光素酶报告测定
在获得自ATCC的HEK293T细胞中进行双重萤光素酶测定。使用聚乙烯亚胺(PEI)对于每微克在Opti-MEM中的质粒以3:1的比率转染汇合的HEK293T细胞。人USF2的过表达载体或空对照载体获得自VectorBuilder Inc.。从VectorBuilder Inc.获得萤光素酶启动子区域报告载体,其含有PTPRS启动子区域(在人GRCh37/hg19位置上的UCSC Genome Browser:chr19:5,340,976-5,341,095)的120碱基对部分,该部分含有USF2的结合位点。转染后将细胞温育24小时。根据制造商的方案,使用来自Promega的Dual-Luciferase Reporter AssaySystem评估萤光素酶活性。使用Renilla萤光素酶活性来将荧火虫萤光素酶活性归一化。
染色质免疫沉淀
将RA FLS培养至汇合,血清饥饿24h,并用重组人TNFα(50ng/mL)刺激6h或不刺激。然后将细胞在室温在1%甲醛中固定15分钟。超声处理后,根据制造商的说明书,使用Pierce
siRNA介导的敲低
使RA FLS生长至汇合(70%),并根据制造商的方案使用Human DermalFibroblast Nucleofector
统计分析
基于我们的经验选择样品大小进行测定以便在进行的实验中获得足够的能力来检测生物学上相关的差异。如在图例中报告的,在适当的情况下,进行双因素或单因素方差分析(ANOVA)、Spearman关联、不成对t-检验和Mann-Whitney U检验。使用GraphPad Prism软件进行所有统计分析。如果P小于0.05,则认为对比是显著的。
实施例2
用于类风湿性关节炎的靶向滑膜细胞的联合疗法
在类风湿性关节炎(RA)和骨关节炎(OA)成纤维细胞样滑膜细胞(FLS)中研究了TNF对PTPRS(编码RPTPσ)表达的影响。在第4代和第10代之间使用FLS,并将细胞在0.1%FBS(血清-饥饿培养基)中同步化24-48h,然后用50ng/ml TNF刺激24小时。使用RNeasy试剂盒(Qiagen)提取RNA。使用用于qRT-PCR的
研究了小鼠FLS中TNF诱导的RPTPσ表达。将小鼠FLS血清饥饿24小时,且然后用50ng/ml TNF刺激或不刺激24小时。图2A显示了在有或没有TNF刺激下的RA FLS RPTPσ蛋白表达。
从8-周龄BALB/c小鼠分离出肘、膝和踝关节。将切碎的组织在RPMI-1640中在0.5mg/ml胶原酶IV中在轻微搅拌下在37℃消化2小时,并在含有10%胎牛血清、2mM L-谷氨酰胺、50μg/ml庆大霉素、100单位/ml青霉素和100μg/ml链霉素的FLS培养基(DMEM)中在37℃在5%CO2控湿气氛中培养4天。在第4代和第10代之间使用鼠FLS,并在0.1%FBS(血清-饥饿培养基)中同步化过夜,然后用50ng/ml TNF刺激或未刺激24小时。如上所述通过qPCR测量RPTPσmRNA表达水平(N=4)。图2B显示了在有或没有TNF刺激下的小鼠FLS RPTPσmRNA相对表达。通过qPCR测量RPTPσmRNA表达水平(n=4)。该图显示了针对管家基因POLR2A归一化以后相对表达的平均值±均值标准差。使用双尾Man-Whitney检验(*,P<0.05)分析数据。在OA和RA FLS中,在TNF存在的情况下,RPTPσ表达均降低。
Fc-Ig1&2“使用中”构建体(TNSAGVRYSSPANLYVRTSGGGSLVPRGSEPKSCDKTHTCPPCPAPELLGGPSVF,SEQ ID NO:15)和Fc-Ig1&2“构建体1”构建体(TNSAGVRYSSPANLYVRTSGGGGSGGGGSEPKSCDKTHTCPPCPAPELLGGPSVF,SEQ ID NO:14)的接头序列。图3显示了“使用中”的Fc-融合构建体(最初通过亚克隆在以下文献中利用的His-标记的构建体而产生:Doody KM,等人,“Targeting phosphatase-dependent proteoglycan switch for rheumatoidarthritis therapy.Sci Transl Med.2015年5月20日;7(288):288ra76)和“构建体1”(用于此处显示的大多数实施例)之间的氨基酸序列差异。“使用中”的构建体在接头(在Fc与构建体的Ig1&2部分之间的区域)中具有一个蛋白酶切割位点,该位点在新构建体1中被去除。带下划线的区域指示接头和使融合蛋白的Fc部分内的二硫键成为可能的两个半胱氨酸(在两个构建体之间未改变)。
用Fc-Ig1&2构建体1进行划痕测定。使RA FLS在6-孔平板中生长至汇合,并在含0.1%FBS的DMEM中血清饥饿24小时。用1ml尖头刮擦细胞,并在20或40nM Fc-Ig1&2或媒介物对照存在的情况下在含有1%FBS的DMEM中温育。在刚刚创伤后(0h)以及在24小时后,使用Motic AE2000显微镜以4X用软件ToupView 3.7捕获创伤的图像。使用ImageJ(NIH,version 1.8.0_201)软件计算创伤面积,并在0-12-24-48h测量创伤面积。将50ng/ml TNF、40nM PTPRS Ig1&2与50ng/ml TNF+40nM PTPRS Ig1&2进行对比。图4A显示了在有或没有TNF或Ig1&2(单独或组合,如上所述)存在的情况下,在创伤时(0小时)或在创伤后12、24或48小时,在RA 1757中的创伤宽度(以任意单位计)。图4B显示了在有或没有TNF或Ig1&2(单独或组合,如上所述)存在的情况下,在创伤时(0小时)或在创伤后12、24或48小时,在RA1775中的创伤宽度(以任意单位计)。图4C的条形图显示了在有或没有TNF或Ig1&2(单独或组合,如上所述)存在的情况下,在创伤时(0小时)或在创伤后12、24或48小时,在RA 1402中的创伤宽度(以任意单位计)。图4D显示了合并的数据。使用双因素方差分析(ANOVA,****,P<0.0001)分析数据。
这些结果提示,TNF-刺激的细胞中PTPRS的足够表达得以保留,以确保Ig1&2在单一疗法中的有效性。
将KRN和NOD小鼠杂交以获得在6-7周龄左右发生关节炎的后代(自发的K/BxN小鼠)。合并来自关节炎K/BxN小鼠的血清用于K/BxN血清转移诱导的关节炎(STIA)模型(35)。为了引起STIA,向6-8周龄小鼠腹膜内(i.p.)注射100μl致关节炎K/BxN血清。从血清注射当天开始,每隔一天通过如以前(57)描述的腕和踝的临床评分来评价关节炎的严重程度:0=正常;1=极少的红斑和轻度肿胀;2=中度红斑和轻度肿胀;3=明显的红斑和严重肿胀,尚未累及趾;4=最大的红斑和肿胀,累及趾和踝肿胀的测量。
关于流式细胞计量术,为了从小鼠血液分离细胞,通过眼眶后放血(来自活动物)或心脏穿刺(来自安乐死的动物)将血液收集到在PBS中的2mM EDTA中。使用eBiosienceRBC裂解缓冲液(Thermo Fisher)从脾脏和小鼠血液中裂解红细胞。为了分离滑膜细胞,收集踝关节,并通过用钝钳拉动使胫骨和趾脱节,并冲洗骨髓以避免骨髓污染。将关节用PBS冲洗,并在37℃用Liberase TM(Roche)和DNA酶I解离60分钟。在抗体染色之前,将细胞与Fc阻断剂(BD Pharmingen)一起预温育。对于表面染色,对CD3(17A2)、CD19(6D5)、NK1.1(PK136)、CD11b(M1/70)、CD44(IM7)、Ly6G(1A8)、Ly6C(HK1.4)、CD45.1(A20)、MHCII(M5/114.15.2)、CD64(X54-5/7.1)、CD115(AFS98)特异性的荧光染料-缀合抗体获得自Biolegend。CD43(R2/60)、PD1(RMP1-30)、GL7(GL-7)、CD25(PC61.5)、B220(RA3-6B2)、CD317/BST2(eBio927)、CD62L(MEL-14)、CD45.2(104)、TCR-β(H57-597)、CD8(53-6.7)、CD4(RM4-5)获得自eBioscience/Thermo Fisher。通过用来自eBioscience/Thermo Fisher的Fixable Viability染料染色,将死细胞排除在分析之外。在配备Everest软件的ZE5流式细胞仪(Bio-Rad)上获取数据。使用FlowJo软件(TreeStar)进行分析。对于流式分析,使用Mix-n-Stain
如在图5A中所示,经典的(Ly6C+CD43-)、中间的(Ly6C+CD43+)或非经典的(Ly6C-CD43+)循环单核细胞(血液单核细胞)都没有显示RPTPσ的显著表达。为了对比显示了在浆细胞样树突细胞(pDC)中的RPTPσ的表达。如在图5B中所示,经典的(Ly6C+CD43-)、中间的(Ly6C+CD43+)或非经典的(Ly6C-CD43+)关节巨噬细胞(踝巨噬细胞)都没有显示RPTPσ的显著表达。为了对比显示了已知表达高水平的RPTPσ的浆细胞样树突细胞(pDC)中的RPTPσ表达。
为了在体内剖析Ig1&2对FLS相对于放射敏感性骨髓衍生细胞的作用,我们对比了Ig1&2的减弱CD45.1同系小鼠中的STIA的效力,所述小鼠进行了致命辐照(>1000Rad)和来自CD45.2 WT或PTPRS KO小鼠的骨髓移植(图6A和6B)。为了产生骨髓嵌合体,使用RS2000Biological辐照器对雄性BALB/cByJ(CD45.1同类系)小鼠用2剂550Rad剂量进行致死辐照,且然后施用来自雄性PTPRS WT或KO同类系CD45.2供体小鼠的骨髓。照射后8周,施用KBxN血清以诱发关节炎。7周后,通过流式细胞计量术通过对适当的CD45等位基因(抗-CD45.1和抗-CD45.2;eBioscience)染色来证实嵌合现象。接受者小鼠中的移植物植入百分比大于95%。如结果中所述,施用Tris-缓冲盐水(TBS)或媒介物对照(TBS)中的His-Ig1&2。KO(KO)相对于野生型(WT)小鼠(利用了His-标记的Ig1&2“使用中”构建体)在STIA模型中显示出对Ig1&2的相同应答性。在血清转移后第0、2、4和6天,向骨髓重建的小鼠在眼眶后(r.o.)注射500μg Ig1&2(n=3/组)或媒介物(n=2/组)。该实验的临床评分显示在图6A中,且图6B显示了踝厚度(以mm计)的变化。在两个图中,显示了平均值±均值标准差,并使用双因素方差分析(ANOVA,**,P<0.01)分析数据。用WT或KO骨髓重建的小鼠一旦发生STIA就表现出相同的关节炎严重程度。此外,Ig1&2在两组小鼠中显示出相同的抗关节炎作用。在辐照后8周开始STIA。每隔一天通过眼眶后注射(r.o.)给小鼠施用媒介物或0.5mg His-Ig1&2一次,共4次治疗。组WT BM对照(n=4),WT BM His-Ig1&2(n=5),KO BM对照(n=6),KO BMHis-Ig1&2(n=7)。**P<0.01,通过Mann Whitney。
我们对比了治疗性Ig1&2剂量作为单一疗法以及与治疗剂量的TNF抑制剂组合在小鼠胶原诱导的关节炎(CIA)的逆转中的效力,这由适应性免疫系统驱动,并被认为是RA的临床前治疗剂开发的黄金标准。进行了胶原诱导的关节炎(CIA)模型。简而言之,对8-10周龄雄性DBA/1J用在含有50μg结核分枝杆菌(H37Ra,ATCC 25177)的弗氏佐剂(CFA,Sigma-Aldrich)中乳化的100μg鸡II型胶原(Condrex)进行免疫。28天后,用在不完全弗氏佐剂(IFA;Sigma-Aldrich)中乳化的100μg鸡II型胶原强化小鼠。如上所述,通过临床评分来评估关节炎。
重组PTPRS 6xHisIg1&2(此处称为His-Ig1&2)的制备描述在(Doody KM,等人,“Targeting phosphatase-dependent proteoglycan switch for rheumatoid arthritistherapy.Sci Transl Med.2015May 20;7(288):288ra76)。人IgG1-Fc-融合的Ig1&2(此处称为Fc-Ig1&2)的制备与LakePharma(USA)签订合同。通过Amgen Extramural ResearchAlliance Program从Amgen获得鼠TNF-阻断生物学制品p75TNFR:Fc(鼠依那西普)。根据结果中所述的时间表施用在含有120mM NaCl的20mM Tris中的Fc-Ig1&2或人IgG1-Fc对照和鼠依那西普。使用了已显示有效的4mg/kg剂量的鼠依那西普。Fc-Ig1&2和治疗剂量的鼠依那西普的组合导致临床关节炎严重程度的大幅降低。每组6只小鼠分别在免疫接种后第34、36和38天腹膜内注射IgG1Fc(对照,包括单独Fc)、媒介物、0.5mg Fc-Ig1&2“使用中”+4mg/kg鼠依那西普和0.5mg Fc-Ig1&2。每2天通过临床评分评估关节炎。显示了平均值±均值标准差。图7显示,作为单一疗法或与TNF抑制剂鼠依那西普(p75mTNFr:Fc,依那西普的小鼠等效物)组合的Fc-Ig1&2有效地逆转胶原诱导的关节炎(CIA),并且治疗剂量的Ig1&2和鼠依那西普的组合显示出与治疗剂量的单独TNF抑制剂相比显著更高的效力。在这些实验中,小鼠在第0天接受初次免疫接种,并在第21天强化。每组6只小鼠分别在免疫接种后第34、36和38天腹膜内注射IgG1Fc(对照,包括单独Fc)、媒介物、0.5mg Fc-Ig1&2“使用中”+4mg/kg鼠依那西普和0.5mg Fc-Ig1&2。每2天通过临床评分评估关节炎。显示了平均值±均值标准差。
依那西普在CIA中的剂量-响应显示,亚治疗2mg/kg剂量的鼠依那西普足以增强小鼠关节炎关节中的PTPRS表达。每组6只CIA小鼠分别在免疫接种后第34、36和38天腹膜内注射媒介物或鼠依那西普(4mg/Kg、2mg/Kg、1mg/Kg和0.5mg/Kg)。每2天通过临床评分评估关节炎。显示了平均值±均值标准差。如在图8A中所示,在第0天接受初次免疫接种并在第21天加强免疫的小鼠的临床评分的演变。每组6只CIA小鼠分别在免疫接种后第34、36和38天腹膜内注射媒介物或鼠依那西普(4mg/kg、2mg/kg、1mg/kg和0.5mg/kg)。图8B显示了针对GAPDH的表达归一化的通过qPCR的踝中的PTPRS表达。
我们评估了作为单一疗法和与亚治疗剂量(2mg/kg)的TNF抑制剂组合的亚治疗剂量(0.1和0.25mg)的Ig1&2在逆转小鼠胶原诱导的关节炎(CIA)中的效力。亚治疗剂量的Fc-Ig1&2和亚治疗剂量的鼠依那西普的组合导致临床关节炎严重程度的惊人降低。每组10只小鼠分别在免疫接种后第44、46和48天腹膜内注射:IgG1-Fc(对照,包括单独Fc),媒介物(参见上面),0.5mg Fc-Ig1&2,0.25mg Fc-Ig1&2,2mg/Kg鼠依那西普,0.1mg Fc-Ig1&2,combo 0.1mg(0.1mg Fc-Ig1&2+2mg/kg鼠依那西普)。每2天通过临床评分评估关节炎。与或不与依那西普组合的Fc-Ig1&2的滴定。如在图9中所示,用在CFA中的胶原免疫接种并在IFA中加强免疫后,用Fc-Ig1&2的处理不影响抗体滴度产生。数据表明,Ig1&2不影响小鼠中的T细胞依赖性的B细胞抗体应答,并且Ig1&2在CIA中的效力不是由于适应性免疫应答的抑制。在该实验中,小鼠在第0天接受初次免疫接种,并在第21天加强免疫。每组10只小鼠分别在免疫接种后第44、46和48天腹膜内注射IgG1-Fc(对照,包括单独Fc)、媒介物、0.5mg Fc-Ig1&2、0.25mg Fc-Ig1&2、2mg/Kg鼠依那西普、0.1mg Fc-Ig1&2或0.1mg Fc-Ig1&2+2mg/kgmEta(Combo 0.1mg)。每2天通过临床评分评估关节炎。
在受CIA影响的小鼠中,与单独的每种药剂相比,Ig1&2和TNF抑制剂(例如,依那西普的小鼠等效物)的组合导致增加的效力(图7),并且该Ig1&2和TNF抑制剂的组合低于其有效剂量的水平(图8和9),从而证明了协同效应。
在用于CIA诱导的初次或第二次抗-胶原免疫接种左右用治疗剂量(0.5mg i.p.)的Fc-Ig1&2治疗小鼠没有影响抗-胶原抗体的诱导。在一个组群中,用在CFA中的II型胶原免疫小鼠,并从免疫接种前2天开始每2天腹膜内施用0.5mg Ig1&2或媒介物,共4次注射。在治疗结束时获得血清,用于评估抗-胶原抗体滴度。在另一个组群中,用在CFA中的II型胶原免疫小鼠,并用在IFA中的胶原加强免疫(第21天)。从强化免疫接种前2天开始每2天给小鼠腹膜内施用0.5mg Ig1&2或媒介物,共4次注射。在治疗结束时获得血清,用于评估抗-胶原抗体滴度。通过ELISA评估血清抗-胶原抗体水平。通过酶联免疫吸附测定(ELISA)测量用胶原免疫的小鼠的血清中的抗-胶原抗体水平。简而言之,用II型鸡胸骨胶原(1μg/ml;Sigma)包被低结合96多孔平板(Costar)。在系列稀释物中温育血清,并使用生物素化的抗-小鼠IgG抗体(Jackson Laboratories)以及抗-小鼠IgG1、IgG2a、IgG2b和IgG3抗体(SouthernBiotech)检测与胶原结合的IgG,然后与extravidin-HRP(Sigma)一起温育并暴露于3,3’,5,5’-四甲基联苯胺(TMB)底物。使用Tecan Infinite M1000平板读数器在450nm读出平板吸光度。如在图10中所示,用在CFA中的胶原免疫接种并且在IFA中加强免疫后,用Fc-Ig1&2的治疗不影响抗体滴度产生。数据显示,Ig1&2不影响小鼠中的T细胞依赖性B细胞抗体应答,并且Ig1&2在CIA中的效力并非由于适应性免疫应答的抑制。
因此,且与Ig1&2的非免疫作用机制一致,这些结果提示,用Fc-Ig1&2治疗不会影响用胶原(其用于CIA)免疫小鼠后产生的病原性抗体的滴度。
实施例3.通过滑膜细胞-靶向疗法和TNF免疫调节对关节炎的协同逆转
通过用作为单一疗法无法有效地逆转严重关节炎的剂量的Ig1&2(0.1mg)和鼠依那西普(2mg/kg)治疗具有严重关节炎(至少8的临床评分)的小鼠,显示了亚治疗剂量的Fc-Ig1&2和鼠依那西普在CIA中的治疗协同作用。如上所述诱导了CIA并对其评分。如上所述获得并注射Fc-Ig1&2和鼠依那西普。为了小鼠关节炎关节的组织学评分,将整个后爪在10%福尔马林中固定,脱钙,修剪和包埋。从组织块制备切片,并用苏木精和曙红、番红-O或甲苯胺蓝(HistoTox)染色。如所述进行组织病理学评分。简而言之,根据以下标准,基于苏木精-曙红染色,将关节炎小鼠的关节的炎症评分为0-4:0=正常;1=炎性细胞在关节周围区域的最小浸润;2=轻度浸润;3=中等浸润;和4=显著浸润。根据以下标准,基于苏木精-曙红染色,将关节炎小鼠的关节骨质吸收评分为0-4:0=正常;1=最小(小的吸收区域,在低放大率下不易观察到);2=轻度(在小梁或骨皮质中有更多的吸收区域,在低放大率下不易观察到);3=中度(小梁和骨皮质吸收明显,在皮质中没有完整厚度缺陷;一些小梁缺失;在低放大率下可见病变);和4=明显(在骨皮质中的完整厚度缺陷和明显的小梁骨丢失)。通过基质的减少的番红O或甲苯胺蓝染色来鉴定软骨消耗,并以0-4的等级评分,其中0=无软骨破坏(用番红O完全染色),1=局部软骨侵蚀,2=更延伸的软骨侵蚀,3=严重的软骨侵蚀,和4=整个软骨消耗。组织学分析以盲法进行。使用Zeiss Axioscan.Z1(Zeiss)载片扫描仪获取整个踝的图像,并使用Zen软件(Zeiss)进行分析。
亚治疗剂量的Ig1&2和鼠依那西普的联合治疗导致CIA的协同逆转。通过用100微克鸡II型胶原进行的两次免疫接种(初次[d 0]和强化[d 28]),在DBA/1雄性小鼠中诱导CIA。在指定的时间段,每48小时用媒介物(PBS)、Fc-Ig1&2(0.1mg)、鼠依那西普(2mg/Kg)、或Fc-Ig1&2(0.1mg)和鼠依那西普(2mg/kg)的组合治疗关节炎小鼠。(图11A)N=8/组。每2天通过临床评分评估关节炎。(图11B)通过组合的Ig1&2和鼠依那西普治疗对关节炎的协同逆转与抗-胶原抗体的滴度降低无关。小图显示了在使用ELISA的实验结束时在A中的小鼠血清中的抗II型胶原IgG抗体。(图11C-E)通过组合的Ig1&2和鼠依那西普治疗对关节炎的协同逆转与组织学炎症和软骨和骨侵蚀评分的显著改善有关。请注意,采用Ig1&2和鼠依那西普的单一疗法无法改善组织学评分,这与临床关节炎的逆转的缺乏相一致。图显示了图11A中的小鼠的滑膜炎(图11C)、骨侵蚀(图11D)和软骨消耗(图11E)的组织病理学评价。图显示了平均值±均值标准差。*P<0.05,**P<0.01,***P<0.001,****P<0.0001,通过双因素方差分析(图11A,相对于媒介物组)或单因素方差分析(图11C-E)。
实施例3.PTPRS在RA滑膜中的衬层FLS中富集
为了进一步确立PTPRS作为在RA中FLS指导的疗法的靶标,我们检查了风湿性滑膜中PTPRS的表达概况。在从RA患者的滑液组织分离的RA FLS的RNA-seq数据中显示了,与亚衬RA FLS(CD34-THY1+(29))相比,衬RA FLS(CD34-THY1-(29))的滑液中PTPRS的富集表达(图12)。
Fc-Ig1&2显示出在关节炎爪子中的高积累并抑制实验性关节炎
接下来,我们试图表征Fc-Ig1&2在实验性小鼠关节炎中的效力。类似于关于6xHis-Ig1&2所示(Doody KM,等人,“Targeting phosphatase-dependent proteoglycanswitch for rheumatoid arthritis therapy.Sci Transl Med.2015年5月20日;7(288):288ra76),我们发现Fc-Ig1&2是高度有效的(图13A)。向具有建立的STIA的小鼠注射111-铟(
Fc-Ig1&2向关节炎CIA小鼠的施用造成疾病严重程度的显著降低,与使用4mg/kg剂量的依那西普的鼠同系物(鼠p75TNFR:Fc,此处称为鼠依那西普)进行的治疗相当,已显示所述4mg/kg剂量在CIA中有效(图13D)。Fc-Ig1&2在CIA中的效力与抗-胶原抗体的产生减少无关(图13E)。如通过关节的组织病理学和微型计算机体层摄影术(microCT)分析所评估的,Fc-Ig1&2施用还保护小鼠免受软骨损伤和骨侵蚀(图13F-G)。总之,这些结果提示,Ig1&2具有有利的生物分布概况,并在由先天性和/或适应性免疫系统驱动的多种关节炎模型中发挥治疗作用。
Ig1&2在不抑制先天性免疫系统的情况下减轻炎性关节炎
我们试图表征Ig1&2的治疗效果是否通过先天性或适应性免疫系统的抑制来介导。经典的(Ly6C
为了进一步排除Ig1&2对活化的巨噬细胞的任何潜在影响,我们还评价了巨噬细胞极化和细菌吞噬作用。首先,在将骨髓衍生的巨噬细胞(BMDM)极化为M1或M2效应表型的过程中添加Fc-Ig1&2。对于两种效应表型,Fc-Ig1&2的添加均不影响特征性转录因子或细胞因子的上调(图S4A,B)。类似地,Fc-Ig1&2不改变M0、M1或M2巨噬细胞对大肠杆菌或金黄色葡萄球菌的吞噬作用(图S4C-D)。这表明,Ig1&2不改变先天性免疫细胞的功能,并且其在小鼠关节炎中的治疗作用不是通过先天性免疫系统的抑制来介导。
Ig1&2在CIA中的治疗作用不是通过适应性免疫系统介导
为了评估Ig1&2是否通过对适应性免疫系统的作用而对关节炎发展产生影响,我们向关节炎K/BxN转基因小鼠施用了Ig1&2,所述关节炎K/BxN转基因小鼠从6-7周龄开始发展自发性关节炎。在用Ig1&2治疗后,我们在这些小鼠中观察到自发性关节炎的显著逆转(图14B)。但是,当将Ig1&2-处理的K/BxN小鼠的血清转移进WT接受者小鼠中以诱导STIA时,我们没有观察到来自Ig1&2-处理的K/BxN小鼠相对于媒介物-处理的K/BxN小鼠的血清的致关节炎能力的任何差异。因此,Ig1&2对自发性K/BxN关节炎的逆转不是由致关节炎抗体的滴度降低来介导。
接下来,我们使用小鼠CIA进一步确定Fc-Ig1&2对在关节炎期间的适应性免疫系统的影响。Fc-Ig1&2的治疗效果与调节性T细胞(Treg)或Th17细胞在CIA小鼠的关节炎踝中的积累或扩增改变无关(图14C-D)。与STIA数据一致,用治疗剂量的Fc-Ig1&2的治疗也没有改变相同踝中的MHCII
Ig1&2不改变对免疫接种的适应性应答
为了确定Ig1&2是否潜在地影响对免疫接种的免疫应答(其被免疫抑制性DMARD影响),我们接下来在针对II型胶原的初次和强化免疫接种期间用Fc-Ig1&2处理DBA1/J小鼠,且然后产生抗-胶原II型抗体。我们没有观察到Fc-Ig1&2对抗-胶原IgG抗体的总滴度(图14F)或抗-胶原IgG亚类IgG1、IgG2a、IgG2b和IgG3的滴度的任何作用。我们还没有观察到Fc-Ig1&2对Tfh细胞或GC B细胞的频率和数目的任何作用(图14G-H)。总之,这些结果提示,Ig1&2不影响对用II型胶原的免疫接种的体液应答。
Ig1&2不改变CD4 T细胞的极化
PTPRS-KO CD4 T细胞显示增强的向Th1和Th17细胞的极化。为了确定在胶原免疫接种期间Ig1&2是否影响CD4 T细胞极化,我们评价了在初次和强化免疫接种期间用Fc-Ig1&2处理的小鼠中的CD4 T细胞群体。我们在Fc-Ig1&2-处理的小鼠的脾脏和淋巴结中未发现原初和效应CD4 T细胞群体的任何偏移。并且,我们在相同小鼠的淋巴结(图14I-J)或脾脏中未观察到Th1、Th17或Treg的数目的任何改变。来自用Fc-Ig1&2或媒介物处理的小鼠的淋巴结和脾脏的Treg表现出相似的CTLA4表达水平。为了进一步剖析Ig1&2对CD4 T细胞极化的影响,我们进行了由平板结合的抗体或抗原呈递细胞(APC)刺激的体外极化测定。与我们在体内观察到的结果相似,无论是否存在APC,Ig1&2都不改变从BALB/c或DBA1/J小鼠分离的CD4 T细胞向Th1、Th17或Treg细胞的极化。总之,这些结果提示,Ig1&2在体外或体内不影响CD4 T细胞的极化,并支持Fc-Ig1&2的治疗效果不太可能通过免疫抑制来介导的想法。
TNF通过PI3K/GSK3β/USF2途径调节RA FLS中的PTPRS表达
对RAFLS中的PTPRS基因座的表观基因组情况的进一步评价,鉴定了在PTPRS基因第1外显子周围的活性启动子(H3K4me3)、引发增强子(H3Kme1)和抑制标记(H3K27me3)的组蛋白标记。使用ENCODE数据库和UCSC人基因组浏览器,我们在PTPRS的启动子区域中鉴定了GSK3β的两个下游靶标、上游刺激因子(USF)-1和USF2的潜在结合位点,表明这两种转录因子参与PTPRS表达的调节(图15A)。如通过RNA-seq所分析,RA和OAFLS中的USF1或USF2的表达与PTPRS的正相关性进一步支持这一点。通过使用siRNA介导的USF2敲低,我们发现USF2确实促进了RA FLS中PTPRS的表达(图15B)。使用染色质免疫沉淀(ChIP),我们可以进一步证实在静止的RA FLS中USF2结合PTPRS的启动子区域,并且在用TNF刺激后这种相互作用显著降低(图15C)。最后,使用包含PTPRS启动子区域的萤光素酶报道构建体,我们显示USF2的过表达造成PTPRS启动子的强烈活化(图15D)。总之,这些结果提示,RA FLS中PTPRS的表达通过PI3K/GSK3β/USF2途径受TNF调节。
我们确定了TNF是否调节PTPRS表达。将RA(N=13)和OA(N=13)FLS血清饥饿24h,并用不同浓度的TNF刺激12h。
如在图16A-B中所示,尽管在RA和OAFLS之间未检测到PTPRS的基础mRNA表达的差异,但用TNF刺激造成在RAFLS和OA FLS中在mRNA水平的PTPRS表达的浓度和时间依赖性下调。(图16C)使用单因素方差分析(ANOVA,*P<0.05,**P<0.01,***P<0.001****P<0.0001))分析数据。
尽管TNF下调了PTPRS的表达,但TNF-处理的RA FLS保留了对Ig1&2体外活动力测定的应答性。将FLS(N=9)单层血清饥饿,然后将其刮伤,并在有媒介物、50ng/mL TNF和20nM Ig1&2存在的情况下用1%FBS刺激。在24h测量创伤宽度,并针对在0h的创伤宽度归一化。使用双因素方差分析(ANOVA,**P<0.01,***P<0,001)分析数据。图17A显示了不存在TNF的情况下的结果,且图17B显示了在有TNF刺激存在的情况下的结果。
我们评估了作为单一疗法以及与亚治疗(2mg/kg)剂量的TNF抑制剂组合施用的亚治疗剂量(0.1和0.25mg)的Ig1&2在逆转小鼠胶原诱导的关节炎(CIA)中的效力。亚治疗剂量的Fc-Ig1&2和亚治疗剂量的鼠依那西普的组合导致临床关节炎严重程度的惊人降低(图18)。雄性DBA/J小鼠/组在第0天接受了针对II型胶原的初次免疫接种,并在第28天加强免疫。在初次免疫接种后第44、46和48天,通过腹膜内注射用人IgG1 Fc对照(Fc-hIgG1,N=10)、媒介物(N=9)、2mg/kg鼠依那西普(mEtan,N=9)、0.5mg Fc-Ig1&2(N=10)、0.25mgFc-Ig1&2(N=10)、0.1mg Fc-Ig1&2(N=10)、2mg/kg mEtan+0.1mg Fc-Ig1&2(combo,N=10)处理小鼠。每2天通过临床评分评估关节炎。使用双因素方差分析(ANOVA),*P<0.05,**P<0.01,****P<0.0001))分析数据。
IL-6下调RA FLS中的PTPRS表达。将RA FLS(n=4系)血清饥饿24小时,然后用IL-6(25ng/ml)刺激12小时。通过qPCR分析PTPRS的表达,并针对GAPDH归一化。针对未刺激的(Un)细胞计算RQ(图19)。
给BALB/c小鼠注射100微升致关节炎K/BxN血清以诱导STIA,且然后从第0天开始每隔一天腹膜内注射指定量的Fc-Ig1&2。每两天对关节炎进行评分,持续两周。左图显示了临床评分,且右图显示了通过卡尺测量的踝厚度。显示了平均值±均值标准差。*p<0.05,****p<0.0001。通过ANOVA测量差异。这些实验证明了Fc-Ig1&2对关节炎评分的影响。
序列表
<110> 拉荷亚过敏与免疫研究所
<120> 在类风湿性关节炎中的PTPRS和蛋白聚糖
<130> 048513-510001WO
<150> US 62/733454
<151> 2018-09-19
<160> 20
<170> PatentIn 3.5版
<210> 1
<211> 97
<212> PRT
<213> 人工序列
<220>
<223> 合成的构建体
<400> 1
Glu Glu Pro Arg Phe Ile Lys Glu Pro Lys Asp Gln Ile Gly Val Ser
1 5 10 15
Gly Gly Val Ala Ser Phe Val Cys Gln Ala Thr Gly Asp Pro Lys Pro
20 25 30
Arg Val Thr Trp Asn Lys Lys Gly Lys Lys Val Asn Ser Gln Arg Phe
35 40 45
Glu Thr Ile Glu Phe Asp Glu Ser Ala Gly Ala Val Leu Arg Ile Gln
50 55 60
Pro Leu Arg Thr Pro Arg Asp Glu Asn Val Tyr Glu Cys Val Ala Gln
65 70 75 80
Asn Ser Val Gly Glu Ile Thr Val His Ala Lys Leu Thr Val Leu Arg
85 90 95
Glu
<210> 2
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> 合成的构建体
<400> 2
Asp Gln Leu Pro Ser Gly Phe Pro Asn Ile Asp Met Gly Pro Gln Leu
1 5 10 15
Lys Val Val Glu Arg Thr Arg Thr Ala Thr Met Leu Cys Ala Ala Ser
20 25 30
Gly Asn Pro Asp Pro Glu Ile Thr Trp Phe Lys Asp Phe Leu Pro Val
35 40 45
Asp Pro Ser Ala Ser Asn Gly Arg Ile Lys Gln Leu Arg Ser Glu Thr
50 55 60
Phe Glu Ser Thr Pro Ile Arg Gly Ala Leu Gln Ile Glu Ser Ser Glu
65 70 75 80
Glu Thr Asp Gln Gly Lys Tyr Glu Cys Val Ala Thr Asn Ser Ala Gly
85 90 95
Val Arg Tyr Ser Ser Pro Ala Asn Leu Tyr Val Arg Val Arg Arg Val
100 105 110
Ala
<210> 3
<211> 90
<212> PRT
<213> 小家鼠
<400> 3
Pro Arg Phe Ser Ile Leu Pro Met Ser His Glu Ile Met Pro Gly Gly
1 5 10 15
Asn Val Asn Ile Thr Cys Val Ala Val Gly Ser Pro Met Pro Tyr Val
20 25 30
Lys Trp Met Gln Gly Ala Glu Asp Leu Thr Pro Glu Asp Asp Met Pro
35 40 45
Val Gly Arg Asn Val Leu Glu Leu Thr Asp Val Lys Asp Ser Ala Asn
50 55 60
Tyr Thr Cys Val Ala Met Ser Ser Leu Gly Val Ile Glu Ala Val Ala
65 70 75 80
Gln Ile Thr Val Lys Ser Leu Pro Lys Ala
85 90
<210> 4
<211> 1907
<212> PRT
<213> 小家鼠
<400> 4
Met Ala Pro Thr Trp Ser Pro Ser Val Val Ser Val Val Gly Pro Val
1 5 10 15
Gly Leu Phe Leu Val Leu Leu Ala Arg Gly Cys Leu Ala Glu Glu Pro
20 25 30
Pro Arg Phe Ile Arg Glu Pro Lys Asp Gln Ile Gly Val Ser Gly Gly
35 40 45
Val Ala Ser Phe Val Cys Gln Ala Thr Gly Asp Pro Lys Pro Arg Val
50 55 60
Thr Trp Asn Lys Lys Gly Lys Lys Val Asn Ser Gln Arg Phe Glu Thr
65 70 75 80
Ile Asp Phe Asp Glu Ser Ser Gly Ala Val Leu Arg Ile Gln Pro Leu
85 90 95
Arg Thr Pro Arg Asp Glu Asn Val Tyr Glu Cys Val Ala Gln Asn Ser
100 105 110
Val Gly Glu Ile Thr Ile His Ala Lys Leu Thr Val Leu Arg Glu Asp
115 120 125
Gln Leu Pro Pro Gly Phe Pro Asn Ile Asp Met Gly Pro Gln Leu Lys
130 135 140
Val Val Glu Arg Thr Arg Thr Ala Thr Met Leu Cys Ala Ala Ser Gly
145 150 155 160
Asn Pro Asp Pro Glu Ile Thr Trp Phe Lys Asp Phe Leu Pro Val Asp
165 170 175
Pro Ser Ala Ser Asn Gly Arg Ile Lys Gln Leu Arg Ser Gly Ala Leu
180 185 190
Gln Ile Glu Ser Ser Glu Glu Thr Asp Gln Gly Lys Tyr Glu Cys Val
195 200 205
Ala Thr Asn Ser Ala Gly Val Arg Tyr Ser Ser Pro Ala Asn Leu Tyr
210 215 220
Val Arg Val Arg Arg Val Ala Pro Arg Phe Ser Ile Leu Pro Met Ser
225 230 235 240
His Glu Ile Met Pro Gly Gly Asn Val Asn Ile Thr Cys Val Ala Val
245 250 255
Gly Ser Pro Met Pro Tyr Val Lys Trp Met Gln Gly Ala Glu Asp Leu
260 265 270
Thr Pro Glu Asp Asp Met Pro Val Gly Arg Asn Val Leu Glu Leu Thr
275 280 285
Asp Val Lys Asp Ser Ala Asn Tyr Thr Cys Val Ala Met Ser Ser Leu
290 295 300
Gly Val Ile Glu Ala Val Ala Gln Ile Thr Val Lys Ser Leu Pro Lys
305 310 315 320
Ala Pro Gly Thr Pro Val Val Thr Glu Asn Thr Ala Thr Ser Ile Thr
325 330 335
Val Thr Trp Asp Ser Gly Asn Pro Asp Pro Val Ser Tyr Tyr Val Ile
340 345 350
Glu Tyr Lys Ser Lys Ser Gln Asp Gly Pro Tyr Gln Ile Lys Glu Asp
355 360 365
Ile Thr Thr Thr Arg Tyr Ser Ile Gly Gly Leu Ser Pro Asn Ser Glu
370 375 380
Tyr Glu Ile Trp Val Ser Ala Val Asn Ser Ile Gly Gln Gly Pro Pro
385 390 395 400
Ser Glu Ser Val Val Thr Arg Thr Gly Glu Gln Ala Pro Ala Ser Ala
405 410 415
Pro Arg Asn Val Gln Ala Arg Met Leu Ser Ala Thr Thr Met Ile Val
420 425 430
Gln Trp Glu Glu Pro Val Glu Pro Asn Gly Leu Ile Arg Gly Tyr Arg
435 440 445
Val Tyr Tyr Thr Met Glu Pro Glu His Pro Val Gly Asn Trp Gln Lys
450 455 460
His Asn Val Asp Asp Ser Leu Leu Thr Thr Val Gly Ser Leu Leu Glu
465 470 475 480
Asp Glu Thr Tyr Thr Val Arg Val Leu Ala Phe Thr Ser Val Gly Asp
485 490 495
Gly Pro Leu Ser Asp Pro Ile Gln Val Lys Thr Gln Gln Gly Val Pro
500 505 510
Gly Gln Pro Met Asn Leu Arg Ala Glu Ala Lys Ser Glu Thr Ser Ile
515 520 525
Gly Leu Ser Trp Ser Ala Pro Arg Gln Glu Ser Val Ile Lys Tyr Glu
530 535 540
Leu Leu Phe Arg Glu Gly Asp Arg Gly Arg Glu Val Gly Arg Thr Phe
545 550 555 560
Asp Pro Thr Thr Ala Phe Val Val Glu Asp Leu Lys Pro Asn Thr Glu
565 570 575
Tyr Ala Phe Arg Leu Ala Ala Arg Ser Pro Gln Gly Leu Gly Ala Phe
580 585 590
Thr Ala Val Val Arg Gln Arg Thr Leu Gln Ala Lys Pro Ser Ala Pro
595 600 605
Pro Gln Asp Val Lys Cys Thr Ser Leu Arg Ser Thr Ala Ile Leu Val
610 615 620
Ser Trp Arg Pro Pro Pro Pro Glu Thr His Asn Gly Ala Leu Val Gly
625 630 635 640
Tyr Ser Val Arg Tyr Arg Pro Leu Gly Ser Glu Asp Pro Asp Pro Lys
645 650 655
Glu Val Asn Asn Ile Pro Pro Thr Thr Thr Gln Ile Leu Leu Glu Ala
660 665 670
Leu Glu Lys Trp Thr Glu Tyr Arg Val Thr Ala Val Ala Tyr Thr Glu
675 680 685
Val Gly Pro Gly Pro Glu Ser Ser Pro Val Val Val Arg Thr Asp Glu
690 695 700
Asp Val Pro Ser Ala Pro Pro Arg Lys Val Glu Ala Glu Ala Leu Asn
705 710 715 720
Ala Thr Ala Ile Arg Val Leu Trp Arg Ser Pro Thr Pro Gly Arg Gln
725 730 735
His Gly Gln Ile Arg Gly Tyr Gln Val His Tyr Val Arg Met Glu Gly
740 745 750
Ala Glu Ala Arg Gly Pro Pro Arg Ile Lys Asp Ile Met Leu Ala Asp
755 760 765
Ala Gln Glu Met Val Ile Thr Asn Leu Gln Pro Glu Thr Ala Tyr Ser
770 775 780
Ile Thr Val Ala Ala Tyr Thr Met Lys Gly Asp Gly Ala Arg Ser Lys
785 790 795 800
Pro Lys Val Val Val Thr Lys Gly Ala Val Leu Gly Arg Pro Thr Leu
805 810 815
Ser Val Gln Gln Thr Pro Glu Gly Ser Leu Leu Ala Arg Trp Glu Pro
820 825 830
Pro Ala Asp Ala Ala Glu Asp Pro Val Leu Gly Tyr Arg Leu Gln Phe
835 840 845
Gly Arg Glu Asp Ala Ala Pro Ala Thr Leu Glu Leu Ala Ala Trp Glu
850 855 860
Arg Arg Phe Ala Ala Pro Ala His Lys Gly Ala Thr Tyr Val Phe Arg
865 870 875 880
Leu Ala Ala Arg Gly Arg Ala Gly Leu Gly Glu Glu Ala Ala Ala Ala
885 890 895
Leu Ser Ile Pro Glu Asp Ala Pro Arg Gly Phe Pro Gln Ile Leu Gly
900 905 910
Ala Ala Gly Asn Val Ser Ala Gly Ser Val Leu Leu Arg Trp Leu Pro
915 920 925
Pro Val Pro Ala Glu Arg Asn Gly Ala Ile Ile Lys Tyr Thr Val Ser
930 935 940
Val Arg Glu Ala Gly Ala Pro Gly Pro Ala Thr Glu Thr Glu Leu Ala
945 950 955 960
Ala Ala Ala Gln Pro Gly Ala Glu Thr Ala Leu Thr Leu Arg Gly Leu
965 970 975
Arg Pro Glu Thr Ala Tyr Glu Leu Arg Val Arg Ala His Thr Arg Arg
980 985 990
Gly Pro Gly Pro Phe Ser Pro Pro Leu Arg Tyr Arg Leu Ala Arg Asp
995 1000 1005
Pro Val Ser Pro Lys Asn Phe Lys Val Lys Met Ile Met Lys Thr
1010 1015 1020
Ser Val Leu Leu Ser Trp Glu Phe Pro Asp Asn Tyr Asn Ser Pro
1025 1030 1035
Thr Pro Tyr Lys Ile Gln Tyr Asn Gly Leu Thr Leu Asp Val Asp
1040 1045 1050
Gly Arg Thr Thr Lys Lys Leu Ile Thr His Leu Lys Pro His Thr
1055 1060 1065
Phe Tyr Asn Phe Val Leu Thr Asn Arg Gly Ser Ser Leu Gly Gly
1070 1075 1080
Leu Gln Gln Thr Val Thr Ala Arg Thr Ala Phe Asn Met Leu Ser
1085 1090 1095
Gly Lys Pro Ser Val Ala Pro Lys Pro Asp Asn Asp Gly Phe Ile
1100 1105 1110
Val Val Tyr Leu Pro Asp Gly Gln Ser Pro Val Thr Val Gln Asn
1115 1120 1125
Tyr Phe Ile Val Met Val Pro Leu Arg Lys Ser Arg Gly Gly Gln
1130 1135 1140
Phe Pro Val Leu Leu Gly Ser Pro Glu Asp Met Asp Leu Glu Glu
1145 1150 1155
Leu Ile Gln Asp Ile Ser Arg Leu Gln Arg Arg Ser Leu Arg His
1160 1165 1170
Ser Arg Gln Leu Glu Val Pro Arg Pro Tyr Ile Ala Ala Arg Phe
1175 1180 1185
Ser Ile Leu Pro Ala Val Phe His Pro Gly Asn Gln Lys Gln Tyr
1190 1195 1200
Gly Gly Phe Asp Asn Arg Gly Leu Glu Pro Gly His Arg Tyr Val
1205 1210 1215
Leu Phe Val Leu Ala Val Leu Gln Lys Asn Glu Pro Thr Phe Ala
1220 1225 1230
Ala Ser Pro Phe Ser Asp Pro Phe Gln Leu Asp Asn Pro Asp Pro
1235 1240 1245
Gln Pro Ile Val Asp Gly Glu Glu Gly Leu Ile Trp Val Ile Gly
1250 1255 1260
Pro Val Leu Ala Val Val Phe Ile Ile Cys Ile Val Ile Ala Ile
1265 1270 1275
Leu Leu Tyr Lys Asn Lys Pro Asp Ser Lys Arg Lys Asp Ser Glu
1280 1285 1290
Pro Arg Thr Lys Cys Leu Leu Asn Asn Ala Asp Leu Ala Pro His
1295 1300 1305
His Pro Lys Asp Pro Val Glu Met Arg Arg Ile Asn Phe Gln Thr
1310 1315 1320
Pro Gly Met Leu Ser His Pro Pro Ile Pro Ile Thr Asp Met Ala
1325 1330 1335
Glu His Met Glu Arg Leu Lys Ala Asn Asp Ser Leu Lys Leu Ser
1340 1345 1350
Gln Glu Tyr Glu Ser Ile Asp Pro Gly Gln Gln Phe Thr Trp Glu
1355 1360 1365
His Ser Asn Leu Glu Ala Asn Lys Pro Lys Asn Arg Tyr Ala Asn
1370 1375 1380
Val Ile Ala Tyr Asp His Ser Arg Val Ile Leu Gln Pro Leu Glu
1385 1390 1395
Gly Ile Met Gly Ser Asp Tyr Ile Asn Ala Asn Tyr Val Asp Gly
1400 1405 1410
Tyr Arg Arg Gln Asn Ala Tyr Ile Ala Thr Gln Gly Pro Leu Pro
1415 1420 1425
Glu Thr Phe Gly Asp Phe Trp Arg Met Val Trp Glu Gln Arg Ser
1430 1435 1440
Ala Thr Val Val Met Met Thr Arg Leu Glu Glu Lys Ser Arg Ile
1445 1450 1455
Lys Cys Asp Gln Tyr Trp Pro Asn Arg Gly Thr Glu Thr Tyr Gly
1460 1465 1470
Phe Ile Gln Val Thr Leu Leu Asp Thr Met Glu Leu Ala Thr Phe
1475 1480 1485
Cys Val Arg Thr Phe Ser Leu His Lys Asn Gly Ser Ser Glu Lys
1490 1495 1500
Arg Glu Val Arg His Phe Gln Phe Thr Ala Trp Pro Asp His Gly
1505 1510 1515
Val Pro Glu Tyr Pro Thr Pro Phe Leu Ala Phe Leu Arg Arg Val
1520 1525 1530
Lys Thr Cys Asn Pro Pro Asp Ala Gly Pro Ile Val Val His Cys
1535 1540 1545
Ser Ala Gly Val Gly Arg Thr Gly Cys Phe Ile Val Ile Asp Ala
1550 1555 1560
Met Leu Glu Arg Ile Lys Thr Glu Lys Thr Val Asp Val Tyr Gly
1565 1570 1575
His Val Thr Leu Met Arg Ser Gln Arg Asn Tyr Met Val Gln Thr
1580 1585 1590
Glu Asp Gln Tyr Gly Phe Ile His Glu Ala Leu Leu Glu Ala Val
1595 1600 1605
Gly Cys Gly Asn Thr Glu Val Pro Ala Arg Ser Leu Tyr Thr Tyr
1610 1615 1620
Ile Gln Lys Leu Ala Gln Val Glu Pro Gly Glu His Val Thr Gly
1625 1630 1635
Met Glu Leu Glu Phe Lys Arg Leu Ala Ser Ser Lys Ala His Thr
1640 1645 1650
Ser Arg Phe Ile Thr Ala Ser Leu Pro Cys Asn Lys Phe Lys Asn
1655 1660 1665
Arg Leu Val Asn Ile Leu Pro Tyr Glu Ser Ser Arg Val Cys Leu
1670 1675 1680
Gln Pro Ile Arg Gly Val Glu Gly Ser Asp Tyr Ile Asn Ala Ser
1685 1690 1695
Phe Ile Asp Gly Tyr Arg Gln Gln Lys Ala Tyr Ile Ala Thr Gln
1700 1705 1710
Gly Pro Leu Ala Glu Thr Thr Glu Asp Phe Trp Arg Ala Leu Trp
1715 1720 1725
Glu Asn Asn Ser Thr Ile Val Val Met Leu Thr Lys Leu Arg Glu
1730 1735 1740
Met Gly Arg Glu Lys Cys His Gln Tyr Trp Pro Ala Glu Arg Ser
1745 1750 1755
Ala Arg Tyr Gln Tyr Phe Val Val Asp Pro Met Ala Glu Tyr Asn
1760 1765 1770
Met Pro Gln Tyr Ile Leu Arg Glu Phe Lys Val Thr Asp Ala Arg
1775 1780 1785
Asp Gly Gln Ser Arg Thr Val Arg Gln Phe Gln Phe Thr Asp Trp
1790 1795 1800
Pro Glu Gln Gly Ala Pro Lys Ser Gly Glu Gly Phe Ile Asp Phe
1805 1810 1815
Ile Gly Gln Val His Lys Thr Lys Glu Gln Phe Gly Gln Asp Gly
1820 1825 1830
Pro Ile Ser Val His Cys Ser Ala Gly Val Gly Arg Thr Gly Val
1835 1840 1845
Phe Ile Thr Leu Ser Ile Val Leu Glu Arg Met Arg Tyr Glu Gly
1850 1855 1860
Val Val Asp Ile Phe Gln Thr Val Lys Val Leu Arg Thr Gln Arg
1865 1870 1875
Pro Ala Met Val Gln Thr Glu Asp Glu Tyr Gln Phe Cys Phe Gln
1880 1885 1890
Ala Ala Leu Glu Tyr Leu Gly Ser Phe Asp His Tyr Ala Thr
1895 1900 1905
<210> 5
<211> 98
<212> PRT
<213> 智人
<400> 5
Glu Glu Pro Pro Arg Phe Ile Lys Glu Pro Lys Asp Gln Ile Gly Val
1 5 10 15
Ser Gly Gly Val Ala Ser Phe Val Cys Gln Ala Thr Gly Asp Pro Lys
20 25 30
Pro Arg Val Thr Trp Asn Lys Lys Gly Lys Lys Val Asn Ser Gln Arg
35 40 45
Phe Glu Thr Ile Glu Phe Asp Glu Ser Ala Gly Ala Val Leu Arg Ile
50 55 60
Gln Pro Leu Arg Thr Pro Arg Asp Glu Asn Val Tyr Glu Cys Val Ala
65 70 75 80
Gln Asn Ser Val Gly Glu Ile Thr Val His Ala Lys Leu Thr Val Leu
85 90 95
Arg Glu
<210> 6
<211> 117
<212> PRT
<213> 智人
<400> 6
Asp Gln Leu Pro Ser Gly Phe Pro Asn Ile Asp Met Gly Pro Gln Leu
1 5 10 15
Lys Val Val Glu Arg Thr Arg Thr Ala Thr Met Leu Cys Ala Ala Ser
20 25 30
Gly Asn Pro Asp Pro Glu Ile Thr Trp Phe Lys Asp Phe Leu Pro Val
35 40 45
Asp Pro Ser Ala Ser Asn Gly Arg Ile Lys Gln Leu Arg Ser Glu Thr
50 55 60
Phe Glu Ser Thr Pro Ile Arg Gly Ala Leu Gln Ile Glu Ser Ser Glu
65 70 75 80
Glu Thr Asp Gln Gly Lys Tyr Glu Cys Val Ala Thr Asn Ser Ala Gly
85 90 95
Val Arg Tyr Ser Ser Pro Ala Asn Leu Tyr Val Arg Glu Leu Arg Glu
100 105 110
Val Arg Arg Val Ala
115
<210> 7
<211> 90
<212> PRT
<213> 智人
<400> 7
Pro Arg Phe Ser Ile Leu Pro Met Ser His Glu Ile Met Pro Gly Gly
1 5 10 15
Asn Val Asn Ile Thr Cys Val Ala Val Gly Ser Pro Met Pro Tyr Val
20 25 30
Lys Trp Met Gln Gly Ala Glu Asp Leu Thr Pro Glu Asp Asp Met Pro
35 40 45
Val Gly Arg Asn Val Leu Glu Leu Thr Asp Val Lys Asp Ser Ala Asn
50 55 60
Tyr Thr Cys Val Ala Met Ser Ser Leu Gly Val Ile Glu Ala Val Ala
65 70 75 80
Gln Ile Thr Val Lys Ser Leu Pro Lys Ala
85 90
<210> 8
<211> 1948
<212> PRT
<213> 智人
<400> 8
Met Ala Pro Thr Trp Gly Pro Gly Met Val Ser Val Val Gly Pro Met
1 5 10 15
Gly Leu Leu Val Val Leu Leu Val Gly Gly Cys Ala Ala Glu Glu Pro
20 25 30
Pro Arg Phe Ile Lys Glu Pro Lys Asp Gln Ile Gly Val Ser Gly Gly
35 40 45
Val Ala Ser Phe Val Cys Gln Ala Thr Gly Asp Pro Lys Pro Arg Val
50 55 60
Thr Trp Asn Lys Lys Gly Lys Lys Val Asn Ser Gln Arg Phe Glu Thr
65 70 75 80
Ile Glu Phe Asp Glu Ser Ala Gly Ala Val Leu Arg Ile Gln Pro Leu
85 90 95
Arg Thr Pro Arg Asp Glu Asn Val Tyr Glu Cys Val Ala Gln Asn Ser
100 105 110
Val Gly Glu Ile Thr Val His Ala Lys Leu Thr Val Leu Arg Glu Asp
115 120 125
Gln Leu Pro Ser Gly Phe Pro Asn Ile Asp Met Gly Pro Gln Leu Lys
130 135 140
Val Val Glu Arg Thr Arg Thr Ala Thr Met Leu Cys Ala Ala Ser Gly
145 150 155 160
Asn Pro Asp Pro Glu Ile Thr Trp Phe Lys Asp Phe Leu Pro Val Asp
165 170 175
Pro Ser Ala Ser Asn Gly Arg Ile Lys Gln Leu Arg Ser Glu Thr Phe
180 185 190
Glu Ser Thr Pro Ile Arg Gly Ala Leu Gln Ile Glu Ser Ser Glu Glu
195 200 205
Thr Asp Gln Gly Lys Tyr Glu Cys Val Ala Thr Asn Ser Ala Gly Val
210 215 220
Arg Tyr Ser Ser Pro Ala Asn Leu Tyr Val Arg Glu Leu Arg Glu Val
225 230 235 240
Arg Arg Val Ala Pro Arg Phe Ser Ile Leu Pro Met Ser His Glu Ile
245 250 255
Met Pro Gly Gly Asn Val Asn Ile Thr Cys Val Ala Val Gly Ser Pro
260 265 270
Met Pro Tyr Val Lys Trp Met Gln Gly Ala Glu Asp Leu Thr Pro Glu
275 280 285
Asp Asp Met Pro Val Gly Arg Asn Val Leu Glu Leu Thr Asp Val Lys
290 295 300
Asp Ser Ala Asn Tyr Thr Cys Val Ala Met Ser Ser Leu Gly Val Ile
305 310 315 320
Glu Ala Val Ala Gln Ile Thr Val Lys Ser Leu Pro Lys Ala Pro Gly
325 330 335
Thr Pro Met Val Thr Glu Asn Thr Ala Thr Ser Ile Thr Ile Thr Trp
340 345 350
Asp Ser Gly Asn Pro Asp Pro Val Ser Tyr Tyr Val Ile Glu Tyr Lys
355 360 365
Ser Lys Ser Gln Asp Gly Pro Tyr Gln Ile Lys Glu Asp Ile Thr Thr
370 375 380
Thr Arg Tyr Ser Ile Gly Gly Leu Ser Pro Asn Ser Glu Tyr Glu Ile
385 390 395 400
Trp Val Ser Ala Val Asn Ser Ile Gly Gln Gly Pro Pro Ser Glu Ser
405 410 415
Val Val Thr Arg Thr Gly Glu Gln Ala Pro Ala Ser Ala Pro Arg Asn
420 425 430
Val Gln Ala Arg Met Leu Ser Ala Thr Thr Met Ile Val Gln Trp Glu
435 440 445
Glu Pro Val Glu Pro Asn Gly Leu Ile Arg Gly Tyr Arg Val Tyr Tyr
450 455 460
Thr Met Glu Pro Glu His Pro Val Gly Asn Trp Gln Lys His Asn Val
465 470 475 480
Asp Asp Ser Leu Leu Thr Thr Val Gly Ser Leu Leu Glu Asp Glu Thr
485 490 495
Tyr Thr Val Arg Val Leu Ala Phe Thr Ser Val Gly Asp Gly Pro Leu
500 505 510
Ser Asp Pro Ile Gln Val Lys Thr Gln Gln Gly Val Pro Gly Gln Pro
515 520 525
Met Asn Leu Arg Ala Glu Ala Arg Ser Glu Thr Ser Ile Thr Leu Ser
530 535 540
Trp Ser Pro Pro Arg Gln Glu Ser Ile Ile Lys Tyr Glu Leu Leu Phe
545 550 555 560
Arg Glu Gly Asp His Gly Arg Glu Val Gly Arg Thr Phe Asp Pro Thr
565 570 575
Thr Ser Tyr Val Val Glu Asp Leu Lys Pro Asn Thr Glu Tyr Ala Phe
580 585 590
Arg Leu Ala Ala Arg Ser Pro Gln Gly Leu Gly Ala Phe Thr Pro Val
595 600 605
Val Arg Gln Arg Thr Leu Gln Ser Lys Pro Ser Ala Pro Pro Gln Asp
610 615 620
Val Lys Cys Val Ser Val Arg Ser Thr Ala Ile Leu Val Ser Trp Arg
625 630 635 640
Pro Pro Pro Pro Glu Thr His Asn Gly Ala Leu Val Gly Tyr Ser Val
645 650 655
Arg Tyr Arg Pro Leu Gly Ser Glu Asp Pro Glu Pro Lys Glu Val Asn
660 665 670
Gly Ile Pro Pro Thr Thr Thr Gln Ile Leu Leu Glu Ala Leu Glu Lys
675 680 685
Trp Thr Gln Tyr Arg Ile Thr Thr Val Ala His Thr Glu Val Gly Pro
690 695 700
Gly Pro Glu Ser Ser Pro Val Val Val Arg Thr Asp Glu Asp Val Pro
705 710 715 720
Ser Ala Pro Pro Arg Lys Val Glu Ala Glu Ala Leu Asn Ala Thr Ala
725 730 735
Ile Arg Val Leu Trp Arg Ser Pro Ala Pro Gly Arg Gln His Gly Gln
740 745 750
Ile Arg Gly Tyr Gln Val His Tyr Val Arg Met Glu Gly Ala Glu Ala
755 760 765
Arg Gly Pro Pro Arg Ile Lys Asp Val Met Leu Ala Asp Ala Gln Trp
770 775 780
Glu Thr Asp Asp Thr Ala Glu Tyr Glu Met Val Ile Thr Asn Leu Gln
785 790 795 800
Pro Glu Thr Ala Tyr Ser Ile Thr Val Ala Ala Tyr Thr Met Lys Gly
805 810 815
Asp Gly Ala Arg Ser Lys Pro Lys Val Val Val Thr Lys Gly Ala Val
820 825 830
Leu Gly Arg Pro Thr Leu Ser Val Gln Gln Thr Pro Glu Gly Ser Leu
835 840 845
Leu Ala Arg Trp Glu Pro Pro Ala Gly Thr Ala Glu Asp Gln Val Leu
850 855 860
Gly Tyr Arg Leu Gln Phe Gly Arg Glu Asp Ser Thr Pro Leu Ala Thr
865 870 875 880
Leu Glu Phe Pro Pro Ser Glu Asp Arg Tyr Thr Ala Ser Gly Val His
885 890 895
Lys Gly Ala Thr Tyr Val Phe Arg Leu Ala Ala Arg Ser Arg Gly Gly
900 905 910
Leu Gly Glu Glu Ala Ala Glu Val Leu Ser Ile Pro Glu Asp Thr Pro
915 920 925
Arg Gly His Pro Gln Ile Leu Glu Ala Ala Gly Asn Ala Ser Ala Gly
930 935 940
Thr Val Leu Leu Arg Trp Leu Pro Pro Val Pro Ala Glu Arg Asn Gly
945 950 955 960
Ala Ile Val Lys Tyr Thr Val Ala Val Arg Glu Ala Gly Ala Leu Gly
965 970 975
Pro Ala Arg Glu Thr Glu Leu Pro Ala Ala Ala Glu Pro Gly Ala Glu
980 985 990
Asn Ala Leu Thr Leu Gln Gly Leu Lys Pro Asp Thr Ala Tyr Asp Leu
995 1000 1005
Gln Val Arg Ala His Thr Arg Arg Gly Pro Gly Pro Phe Ser Pro
1010 1015 1020
Pro Val Arg Tyr Arg Thr Phe Leu Arg Asp Gln Val Ser Pro Lys
1025 1030 1035
Asn Phe Lys Val Lys Met Ile Met Lys Thr Ser Val Leu Leu Ser
1040 1045 1050
Trp Glu Phe Pro Asp Asn Tyr Asn Ser Pro Thr Pro Tyr Lys Ile
1055 1060 1065
Gln Tyr Asn Gly Leu Thr Leu Asp Val Asp Gly Arg Thr Thr Lys
1070 1075 1080
Lys Leu Ile Thr His Leu Lys Pro His Thr Phe Tyr Asn Phe Val
1085 1090 1095
Leu Thr Asn Arg Gly Ser Ser Leu Gly Gly Leu Gln Gln Thr Val
1100 1105 1110
Thr Ala Trp Thr Ala Phe Asn Leu Leu Asn Gly Lys Pro Ser Val
1115 1120 1125
Ala Pro Lys Pro Asp Ala Asp Gly Phe Ile Met Val Tyr Leu Pro
1130 1135 1140
Asp Gly Gln Ser Pro Val Pro Val Gln Ser Tyr Phe Ile Val Met
1145 1150 1155
Val Pro Leu Arg Lys Ser Arg Gly Gly Gln Phe Leu Thr Pro Leu
1160 1165 1170
Gly Ser Pro Glu Asp Met Asp Leu Glu Glu Leu Ile Gln Asp Ile
1175 1180 1185
Ser Arg Leu Gln Arg Arg Ser Leu Arg His Ser Arg Gln Leu Glu
1190 1195 1200
Val Pro Arg Pro Tyr Ile Ala Ala Arg Phe Ser Val Leu Pro Pro
1205 1210 1215
Thr Phe His Pro Gly Asp Gln Lys Gln Tyr Gly Gly Phe Asp Asn
1220 1225 1230
Arg Gly Leu Glu Pro Gly His Arg Tyr Val Leu Phe Val Leu Ala
1235 1240 1245
Val Leu Gln Lys Ser Glu Pro Thr Phe Ala Ala Ser Pro Phe Ser
1250 1255 1260
Asp Pro Phe Gln Leu Asp Asn Pro Asp Pro Gln Pro Ile Val Asp
1265 1270 1275
Gly Glu Glu Gly Leu Ile Trp Val Ile Gly Pro Val Leu Ala Val
1280 1285 1290
Val Phe Ile Ile Cys Ile Val Ile Ala Ile Leu Leu Tyr Lys Asn
1295 1300 1305
Lys Pro Asp Ser Lys Arg Lys Asp Ser Glu Pro Arg Thr Lys Cys
1310 1315 1320
Leu Leu Asn Asn Ala Asp Leu Ala Pro His His Pro Lys Asp Pro
1325 1330 1335
Val Glu Met Arg Arg Ile Asn Phe Gln Thr Pro Asp Ser Gly Leu
1340 1345 1350
Arg Ser Pro Leu Arg Glu Pro Gly Phe His Phe Glu Ser Met Leu
1355 1360 1365
Ser His Pro Pro Ile Pro Ile Ala Asp Met Ala Glu His Thr Glu
1370 1375 1380
Arg Leu Lys Ala Asn Asp Ser Leu Lys Leu Ser Gln Glu Tyr Glu
1385 1390 1395
Ser Ile Asp Pro Gly Gln Gln Phe Thr Trp Glu His Ser Asn Leu
1400 1405 1410
Glu Val Asn Lys Pro Lys Asn Arg Tyr Ala Asn Val Ile Ala Tyr
1415 1420 1425
Asp His Ser Arg Val Ile Leu Gln Pro Ile Glu Gly Ile Met Gly
1430 1435 1440
Ser Asp Tyr Ile Asn Ala Asn Tyr Val Asp Gly Tyr Arg Cys Gln
1445 1450 1455
Asn Ala Tyr Ile Ala Thr Gln Gly Pro Leu Pro Glu Thr Phe Gly
1460 1465 1470
Asp Phe Trp Arg Met Val Trp Glu Gln Arg Ser Ala Thr Ile Val
1475 1480 1485
Met Met Thr Arg Leu Glu Glu Lys Ser Arg Ile Lys Cys Asp Gln
1490 1495 1500
Tyr Trp Pro Asn Arg Gly Thr Glu Thr Tyr Gly Phe Ile Gln Val
1505 1510 1515
Thr Leu Leu Asp Thr Ile Glu Leu Ala Thr Phe Cys Val Arg Thr
1520 1525 1530
Phe Ser Leu His Lys Asn Gly Ser Ser Glu Lys Arg Glu Val Arg
1535 1540 1545
Gln Phe Gln Phe Thr Ala Trp Pro Asp His Gly Val Pro Glu Tyr
1550 1555 1560
Pro Thr Pro Phe Leu Ala Phe Leu Arg Arg Val Lys Thr Cys Asn
1565 1570 1575
Pro Pro Asp Ala Gly Pro Ile Val Val His Cys Ser Ala Gly Val
1580 1585 1590
Gly Arg Thr Gly Cys Phe Ile Val Ile Asp Ala Met Leu Glu Arg
1595 1600 1605
Ile Lys Pro Glu Lys Thr Val Asp Val Tyr Gly His Val Thr Leu
1610 1615 1620
Met Arg Ser Gln Arg Asn Tyr Met Val Gln Thr Glu Asp Gln Tyr
1625 1630 1635
Ser Phe Ile His Glu Ala Leu Leu Glu Ala Val Gly Cys Gly Asn
1640 1645 1650
Thr Glu Val Pro Ala Arg Ser Leu Tyr Ala Tyr Ile Gln Lys Leu
1655 1660 1665
Ala Gln Val Glu Pro Gly Glu His Val Thr Gly Met Glu Leu Glu
1670 1675 1680
Phe Lys Arg Leu Ala Asn Ser Lys Ala His Thr Ser Arg Phe Ile
1685 1690 1695
Ser Ala Asn Leu Pro Cys Asn Lys Phe Lys Asn Arg Leu Val Asn
1700 1705 1710
Ile Met Pro Tyr Glu Ser Thr Arg Val Cys Leu Gln Pro Ile Arg
1715 1720 1725
Gly Val Glu Gly Ser Asp Tyr Ile Asn Ala Ser Phe Ile Asp Gly
1730 1735 1740
Tyr Arg Gln Gln Lys Ala Tyr Ile Ala Thr Gln Gly Pro Leu Ala
1745 1750 1755
Glu Thr Thr Glu Asp Phe Trp Arg Met Leu Trp Glu Asn Asn Ser
1760 1765 1770
Thr Ile Val Val Met Leu Thr Lys Leu Arg Glu Met Gly Arg Glu
1775 1780 1785
Lys Cys His Gln Tyr Trp Pro Ala Glu Arg Ser Ala Arg Tyr Gln
1790 1795 1800
Tyr Phe Val Val Asp Pro Met Ala Glu Tyr Asn Met Pro Gln Tyr
1805 1810 1815
Ile Leu Arg Glu Phe Lys Val Thr Asp Ala Arg Asp Gly Gln Ser
1820 1825 1830
Arg Thr Val Arg Gln Phe Gln Phe Thr Asp Trp Pro Glu Gln Gly
1835 1840 1845
Val Pro Lys Ser Gly Glu Gly Phe Ile Asp Phe Ile Gly Gln Val
1850 1855 1860
His Lys Thr Lys Glu Gln Phe Gly Gln Asp Gly Pro Ile Ser Val
1865 1870 1875
His Cys Ser Ala Gly Val Gly Arg Thr Gly Val Phe Ile Thr Leu
1880 1885 1890
Ser Ile Val Leu Glu Arg Met Arg Tyr Glu Gly Val Val Asp Ile
1895 1900 1905
Phe Gln Thr Val Lys Met Leu Arg Thr Gln Arg Pro Ala Met Val
1910 1915 1920
Gln Thr Glu Asp Glu Tyr Gln Phe Cys Tyr Gln Ala Ala Leu Glu
1925 1930 1935
Tyr Leu Gly Ser Phe Asp His Tyr Ala Thr
1940 1945
<210> 9
<211> 1228
<212> PRT
<213> 小家鼠
<400> 9
Glu Glu Pro Pro Arg Phe Ile Arg Glu Pro Lys Asp Gln Ile Gly Val
1 5 10 15
Ser Gly Gly Val Ala Ser Phe Val Cys Gln Ala Thr Gly Asp Pro Lys
20 25 30
Pro Arg Val Thr Trp Asn Lys Lys Gly Lys Lys Val Asn Ser Gln Arg
35 40 45
Phe Glu Thr Ile Asp Phe Asp Glu Ser Ser Gly Ala Val Leu Arg Ile
50 55 60
Gln Pro Leu Arg Thr Pro Arg Asp Glu Asn Val Tyr Glu Cys Val Ala
65 70 75 80
Gln Asn Ser Val Gly Glu Ile Thr Ile His Ala Lys Leu Thr Val Leu
85 90 95
Arg Glu Asp Gln Leu Pro Pro Gly Phe Pro Asn Ile Asp Met Gly Pro
100 105 110
Gln Leu Lys Val Val Glu Arg Thr Arg Thr Ala Thr Met Leu Cys Ala
115 120 125
Ala Ser Gly Asn Pro Asp Pro Glu Ile Thr Trp Phe Lys Asp Phe Leu
130 135 140
Pro Val Asp Pro Ser Ala Ser Asn Gly Arg Ile Lys Gln Leu Arg Ser
145 150 155 160
Gly Ala Leu Gln Ile Glu Ser Ser Glu Glu Thr Asp Gln Gly Lys Tyr
165 170 175
Glu Cys Val Ala Thr Asn Ser Ala Gly Val Arg Tyr Ser Ser Pro Ala
180 185 190
Asn Leu Tyr Val Arg Val Arg Arg Val Ala Pro Arg Phe Ser Ile Leu
195 200 205
Pro Met Ser His Glu Ile Met Pro Gly Gly Asn Val Asn Ile Thr Cys
210 215 220
Val Ala Val Gly Ser Pro Met Pro Tyr Val Lys Trp Met Gln Gly Ala
225 230 235 240
Glu Asp Leu Thr Pro Glu Asp Asp Met Pro Val Gly Arg Asn Val Leu
245 250 255
Glu Leu Thr Asp Val Lys Asp Ser Ala Asn Tyr Thr Cys Val Ala Met
260 265 270
Ser Ser Leu Gly Val Ile Glu Ala Val Ala Gln Ile Thr Val Lys Ser
275 280 285
Leu Pro Lys Ala Pro Gly Thr Pro Val Val Thr Glu Asn Thr Ala Thr
290 295 300
Ser Ile Thr Val Thr Trp Asp Ser Gly Asn Pro Asp Pro Val Ser Tyr
305 310 315 320
Tyr Val Ile Glu Tyr Lys Ser Lys Ser Gln Asp Gly Pro Tyr Gln Ile
325 330 335
Lys Glu Asp Ile Thr Thr Thr Arg Tyr Ser Ile Gly Gly Leu Ser Pro
340 345 350
Asn Ser Glu Tyr Glu Ile Trp Val Ser Ala Val Asn Ser Ile Gly Gln
355 360 365
Gly Pro Pro Ser Glu Ser Val Val Thr Arg Thr Gly Glu Gln Ala Pro
370 375 380
Ala Ser Ala Pro Arg Asn Val Gln Ala Arg Met Leu Ser Ala Thr Thr
385 390 395 400
Met Ile Val Gln Trp Glu Glu Pro Val Glu Pro Asn Gly Leu Ile Arg
405 410 415
Gly Tyr Arg Val Tyr Tyr Thr Met Glu Pro Glu His Pro Val Gly Asn
420 425 430
Trp Gln Lys His Asn Val Asp Asp Ser Leu Leu Thr Thr Val Gly Ser
435 440 445
Leu Leu Glu Asp Glu Thr Tyr Thr Val Arg Val Leu Ala Phe Thr Ser
450 455 460
Val Gly Asp Gly Pro Leu Ser Asp Pro Ile Gln Val Lys Thr Gln Gln
465 470 475 480
Gly Val Pro Gly Gln Pro Met Asn Leu Arg Ala Glu Ala Lys Ser Glu
485 490 495
Thr Ser Ile Gly Leu Ser Trp Ser Ala Pro Arg Gln Glu Ser Val Ile
500 505 510
Lys Tyr Glu Leu Leu Phe Arg Glu Gly Asp Arg Gly Arg Glu Val Gly
515 520 525
Arg Thr Phe Asp Pro Thr Thr Ala Phe Val Val Glu Asp Leu Lys Pro
530 535 540
Asn Thr Glu Tyr Ala Phe Arg Leu Ala Ala Arg Ser Pro Gln Gly Leu
545 550 555 560
Gly Ala Phe Thr Ala Val Val Arg Gln Arg Thr Leu Gln Ala Lys Pro
565 570 575
Ser Ala Pro Pro Gln Asp Val Lys Cys Thr Ser Leu Arg Ser Thr Ala
580 585 590
Ile Leu Val Ser Trp Arg Pro Pro Pro Pro Glu Thr His Asn Gly Ala
595 600 605
Leu Val Gly Tyr Ser Val Arg Tyr Arg Pro Leu Gly Ser Glu Asp Pro
610 615 620
Asp Pro Lys Glu Val Asn Asn Ile Pro Pro Thr Thr Thr Gln Ile Leu
625 630 635 640
Leu Glu Ala Leu Glu Lys Trp Thr Glu Tyr Arg Val Thr Ala Val Ala
645 650 655
Tyr Thr Glu Val Gly Pro Gly Pro Glu Ser Ser Pro Val Val Val Arg
660 665 670
Thr Asp Glu Asp Val Pro Ser Ala Pro Pro Arg Lys Val Glu Ala Glu
675 680 685
Ala Leu Asn Ala Thr Ala Ile Arg Val Leu Trp Arg Ser Pro Thr Pro
690 695 700
Gly Arg Gln His Gly Gln Ile Arg Gly Tyr Gln Val His Tyr Val Arg
705 710 715 720
Met Glu Gly Ala Glu Ala Arg Gly Pro Pro Arg Ile Lys Asp Ile Met
725 730 735
Leu Ala Asp Ala Gln Glu Met Val Ile Thr Asn Leu Gln Pro Glu Thr
740 745 750
Ala Tyr Ser Ile Thr Val Ala Ala Tyr Thr Met Lys Gly Asp Gly Ala
755 760 765
Arg Ser Lys Pro Lys Val Val Val Thr Lys Gly Ala Val Leu Gly Arg
770 775 780
Pro Thr Leu Ser Val Gln Gln Thr Pro Glu Gly Ser Leu Leu Ala Arg
785 790 795 800
Trp Glu Pro Pro Ala Asp Ala Ala Glu Asp Pro Val Leu Gly Tyr Arg
805 810 815
Leu Gln Phe Gly Arg Glu Asp Ala Ala Pro Ala Thr Leu Glu Leu Ala
820 825 830
Ala Trp Glu Arg Arg Phe Ala Ala Pro Ala His Lys Gly Ala Thr Tyr
835 840 845
Val Phe Arg Leu Ala Ala Arg Gly Arg Ala Gly Leu Gly Glu Glu Ala
850 855 860
Ala Ala Ala Leu Ser Ile Pro Glu Asp Ala Pro Arg Gly Phe Pro Gln
865 870 875 880
Ile Leu Gly Ala Ala Gly Asn Val Ser Ala Gly Ser Val Leu Leu Arg
885 890 895
Trp Leu Pro Pro Val Pro Ala Glu Arg Asn Gly Ala Ile Ile Lys Tyr
900 905 910
Thr Val Ser Val Arg Glu Ala Gly Ala Pro Gly Pro Ala Thr Glu Thr
915 920 925
Glu Leu Ala Ala Ala Ala Gln Pro Gly Ala Glu Thr Ala Leu Thr Leu
930 935 940
Arg Gly Leu Arg Pro Glu Thr Ala Tyr Glu Leu Arg Val Arg Ala His
945 950 955 960
Thr Arg Arg Gly Pro Gly Pro Phe Ser Pro Pro Leu Arg Tyr Arg Leu
965 970 975
Ala Arg Asp Pro Val Ser Pro Lys Asn Phe Lys Val Lys Met Ile Met
980 985 990
Lys Thr Ser Val Leu Leu Ser Trp Glu Phe Pro Asp Asn Tyr Asn Ser
995 1000 1005
Pro Thr Pro Tyr Lys Ile Gln Tyr Asn Gly Leu Thr Leu Asp Val
1010 1015 1020
Asp Gly Arg Thr Thr Lys Lys Leu Ile Thr His Leu Lys Pro His
1025 1030 1035
Thr Phe Tyr Asn Phe Val Leu Thr Asn Arg Gly Ser Ser Leu Gly
1040 1045 1050
Gly Leu Gln Gln Thr Val Thr Ala Arg Thr Ala Phe Asn Met Leu
1055 1060 1065
Ser Gly Lys Pro Ser Val Ala Pro Lys Pro Asp Asn Asp Gly Phe
1070 1075 1080
Ile Val Val Tyr Leu Pro Asp Gly Gln Ser Pro Val Thr Val Gln
1085 1090 1095
Asn Tyr Phe Ile Val Met Val Pro Leu Arg Lys Ser Arg Gly Gly
1100 1105 1110
Gln Phe Pro Val Leu Leu Gly Ser Pro Glu Asp Met Asp Leu Glu
1115 1120 1125
Glu Leu Ile Gln Asp Ile Ser Arg Leu Gln Arg Arg Ser Leu Arg
1130 1135 1140
His Ser Arg Gln Leu Glu Val Pro Arg Pro Tyr Ile Ala Ala Arg
1145 1150 1155
Phe Ser Ile Leu Pro Ala Val Phe His Pro Gly Asn Gln Lys Gln
1160 1165 1170
Tyr Gly Gly Phe Asp Asn Arg Gly Leu Glu Pro Gly His Arg Tyr
1175 1180 1185
Val Leu Phe Val Leu Ala Val Leu Gln Lys Asn Glu Pro Thr Phe
1190 1195 1200
Ala Ala Ser Pro Phe Ser Asp Pro Phe Gln Leu Asp Asn Pro Asp
1205 1210 1215
Pro Gln Pro Ile Val Asp Gly Glu Glu Gly
1220 1225
<210> 10
<211> 1253
<212> PRT
<213> 智人
<400> 10
Glu Glu Pro Pro Arg Phe Ile Lys Glu Pro Lys Asp Gln Ile Gly Val
1 5 10 15
Ser Gly Gly Val Ala Ser Phe Val Cys Gln Ala Thr Gly Asp Pro Lys
20 25 30
Pro Arg Val Thr Trp Asn Lys Lys Gly Lys Lys Val Asn Ser Gln Arg
35 40 45
Phe Glu Thr Ile Glu Phe Asp Glu Ser Ala Gly Ala Val Leu Arg Ile
50 55 60
Gln Pro Leu Arg Thr Pro Arg Asp Glu Asn Val Tyr Glu Cys Val Ala
65 70 75 80
Gln Asn Ser Val Gly Glu Ile Thr Val His Ala Lys Leu Thr Val Leu
85 90 95
Arg Glu Asp Gln Leu Pro Ser Gly Phe Pro Asn Ile Asp Met Gly Pro
100 105 110
Gln Leu Lys Val Val Glu Arg Thr Arg Thr Ala Thr Met Leu Cys Ala
115 120 125
Ala Ser Gly Asn Pro Asp Pro Glu Ile Thr Trp Phe Lys Asp Phe Leu
130 135 140
Pro Val Asp Pro Ser Ala Ser Asn Gly Arg Ile Lys Gln Leu Arg Ser
145 150 155 160
Glu Thr Phe Glu Ser Thr Pro Ile Arg Gly Ala Leu Gln Ile Glu Ser
165 170 175
Ser Glu Glu Thr Asp Gln Gly Lys Tyr Glu Cys Val Ala Thr Asn Ser
180 185 190
Ala Gly Val Arg Tyr Ser Ser Pro Ala Asn Leu Tyr Val Arg Glu Leu
195 200 205
Arg Glu Val Arg Arg Val Ala Pro Arg Phe Ser Ile Leu Pro Met Ser
210 215 220
His Glu Ile Met Pro Gly Gly Asn Val Asn Ile Thr Cys Val Ala Val
225 230 235 240
Gly Ser Pro Met Pro Tyr Val Lys Trp Met Gln Gly Ala Glu Asp Leu
245 250 255
Thr Pro Glu Asp Asp Met Pro Val Gly Arg Asn Val Leu Glu Leu Thr
260 265 270
Asp Val Lys Asp Ser Ala Asn Tyr Thr Cys Val Ala Met Ser Ser Leu
275 280 285
Gly Val Ile Glu Ala Val Ala Gln Ile Thr Val Lys Ser Leu Pro Lys
290 295 300
Ala Pro Gly Thr Pro Met Val Thr Glu Asn Thr Ala Thr Ser Ile Thr
305 310 315 320
Ile Thr Trp Asp Ser Gly Asn Pro Asp Pro Val Ser Tyr Tyr Val Ile
325 330 335
Glu Tyr Lys Ser Lys Ser Gln Asp Gly Pro Tyr Gln Ile Lys Glu Asp
340 345 350
Ile Thr Thr Thr Arg Tyr Ser Ile Gly Gly Leu Ser Pro Asn Ser Glu
355 360 365
Tyr Glu Ile Trp Val Ser Ala Val Asn Ser Ile Gly Gln Gly Pro Pro
370 375 380
Ser Glu Ser Val Val Thr Arg Thr Gly Glu Gln Ala Pro Ala Ser Ala
385 390 395 400
Pro Arg Asn Val Gln Ala Arg Met Leu Ser Ala Thr Thr Met Ile Val
405 410 415
Gln Trp Glu Glu Pro Val Glu Pro Asn Gly Leu Ile Arg Gly Tyr Arg
420 425 430
Val Tyr Tyr Thr Met Glu Pro Glu His Pro Val Gly Asn Trp Gln Lys
435 440 445
His Asn Val Asp Asp Ser Leu Leu Thr Thr Val Gly Ser Leu Leu Glu
450 455 460
Asp Glu Thr Tyr Thr Val Arg Val Leu Ala Phe Thr Ser Val Gly Asp
465 470 475 480
Gly Pro Leu Ser Asp Pro Ile Gln Val Lys Thr Gln Gln Gly Val Pro
485 490 495
Gly Gln Pro Met Asn Leu Arg Ala Glu Ala Arg Ser Glu Thr Ser Ile
500 505 510
Thr Leu Ser Trp Ser Pro Pro Arg Gln Glu Ser Ile Ile Lys Tyr Glu
515 520 525
Leu Leu Phe Arg Glu Gly Asp His Gly Arg Glu Val Gly Arg Thr Phe
530 535 540
Asp Pro Thr Thr Ser Tyr Val Val Glu Asp Leu Lys Pro Asn Thr Glu
545 550 555 560
Tyr Ala Phe Arg Leu Ala Ala Arg Ser Pro Gln Gly Leu Gly Ala Phe
565 570 575
Thr Pro Val Val Arg Gln Arg Thr Leu Gln Ser Lys Pro Ser Ala Pro
580 585 590
Pro Gln Asp Val Lys Cys Val Ser Val Arg Ser Thr Ala Ile Leu Val
595 600 605
Ser Trp Arg Pro Pro Pro Pro Glu Thr His Asn Gly Ala Leu Val Gly
610 615 620
Tyr Ser Val Arg Tyr Arg Pro Leu Gly Ser Glu Asp Pro Glu Pro Lys
625 630 635 640
Glu Val Asn Gly Ile Pro Pro Thr Thr Thr Gln Ile Leu Leu Glu Ala
645 650 655
Leu Glu Lys Trp Thr Gln Tyr Arg Ile Thr Thr Val Ala His Thr Glu
660 665 670
Val Gly Pro Gly Pro Glu Ser Ser Pro Val Val Val Arg Thr Asp Glu
675 680 685
Asp Val Pro Ser Ala Pro Pro Arg Lys Val Glu Ala Glu Ala Leu Asn
690 695 700
Ala Thr Ala Ile Arg Val Leu Trp Arg Ser Pro Ala Pro Gly Arg Gln
705 710 715 720
His Gly Gln Ile Arg Gly Tyr Gln Val His Tyr Val Arg Met Glu Gly
725 730 735
Ala Glu Ala Arg Gly Pro Pro Arg Ile Lys Asp Val Met Leu Ala Asp
740 745 750
Ala Gln Trp Glu Thr Asp Asp Thr Ala Glu Tyr Glu Met Val Ile Thr
755 760 765
Asn Leu Gln Pro Glu Thr Ala Tyr Ser Ile Thr Val Ala Ala Tyr Thr
770 775 780
Met Lys Gly Asp Gly Ala Arg Ser Lys Pro Lys Val Val Val Thr Lys
785 790 795 800
Gly Ala Val Leu Gly Arg Pro Thr Leu Ser Val Gln Gln Thr Pro Glu
805 810 815
Gly Ser Leu Leu Ala Arg Trp Glu Pro Pro Ala Gly Thr Ala Glu Asp
820 825 830
Gln Val Leu Gly Tyr Arg Leu Gln Phe Gly Arg Glu Asp Ser Thr Pro
835 840 845
Leu Ala Thr Leu Glu Phe Pro Pro Ser Glu Asp Arg Tyr Thr Ala Ser
850 855 860
Gly Val His Lys Gly Ala Thr Tyr Val Phe Arg Leu Ala Ala Arg Ser
865 870 875 880
Arg Gly Gly Leu Gly Glu Glu Ala Ala Glu Val Leu Ser Ile Pro Glu
885 890 895
Asp Thr Pro Arg Gly His Pro Gln Ile Leu Glu Ala Ala Gly Asn Ala
900 905 910
Ser Ala Gly Thr Val Leu Leu Arg Trp Leu Pro Pro Val Pro Ala Glu
915 920 925
Arg Asn Gly Ala Ile Val Lys Tyr Thr Val Ala Val Arg Glu Ala Gly
930 935 940
Ala Leu Gly Pro Ala Arg Glu Thr Glu Leu Pro Ala Ala Ala Glu Pro
945 950 955 960
Gly Ala Glu Asn Ala Leu Thr Leu Gln Gly Leu Lys Pro Asp Thr Ala
965 970 975
Tyr Asp Leu Gln Val Arg Ala His Thr Arg Arg Gly Pro Gly Pro Phe
980 985 990
Ser Pro Pro Val Arg Tyr Arg Thr Phe Leu Arg Asp Gln Val Ser Pro
995 1000 1005
Lys Asn Phe Lys Val Lys Met Ile Met Lys Thr Ser Val Leu Leu
1010 1015 1020
Ser Trp Glu Phe Pro Asp Asn Tyr Asn Ser Pro Thr Pro Tyr Lys
1025 1030 1035
Ile Gln Tyr Asn Gly Leu Thr Leu Asp Val Asp Gly Arg Thr Thr
1040 1045 1050
Lys Lys Leu Ile Thr His Leu Lys Pro His Thr Phe Tyr Asn Phe
1055 1060 1065
Val Leu Thr Asn Arg Gly Ser Ser Leu Gly Gly Leu Gln Gln Thr
1070 1075 1080
Val Thr Ala Trp Thr Ala Phe Asn Leu Leu Asn Gly Lys Pro Ser
1085 1090 1095
Val Ala Pro Lys Pro Asp Ala Asp Gly Phe Ile Met Val Tyr Leu
1100 1105 1110
Pro Asp Gly Gln Ser Pro Val Pro Val Gln Ser Tyr Phe Ile Val
1115 1120 1125
Met Val Pro Leu Arg Lys Ser Arg Gly Gly Gln Phe Leu Thr Pro
1130 1135 1140
Leu Gly Ser Pro Glu Asp Met Asp Leu Glu Glu Leu Ile Gln Asp
1145 1150 1155
Ile Ser Arg Leu Gln Arg Arg Ser Leu Arg His Ser Arg Gln Leu
1160 1165 1170
Glu Val Pro Arg Pro Tyr Ile Ala Ala Arg Phe Ser Val Leu Pro
1175 1180 1185
Pro Thr Phe His Pro Gly Asp Gln Lys Gln Tyr Gly Gly Phe Asp
1190 1195 1200
Asn Arg Gly Leu Glu Pro Gly His Arg Tyr Val Leu Phe Val Leu
1205 1210 1215
Ala Val Leu Gln Lys Ser Glu Pro Thr Phe Ala Ala Ser Pro Phe
1220 1225 1230
Ser Asp Pro Phe Gln Leu Asp Asn Pro Asp Pro Gln Pro Ile Val
1235 1240 1245
Asp Gly Glu Glu Gly
1250
<210> 11
<211> 86
<212> PRT
<213> 人工序列
<220>
<223> 合成的构建体
<400> 11
Pro Lys Asp Gln Ile Gly Val Ser Gly Gly Val Ala Ser Phe Val Cys
1 5 10 15
Gln Ala Thr Gly Asp Pro Lys Pro Arg Val Thr Trp Asn Lys Lys Gly
20 25 30
Lys Lys Val Asn Ser Gln Arg Phe Glu Thr Ile Glu Phe Asp Glu Ser
35 40 45
Ala Gly Ala Val Leu Arg Ile Gln Pro Leu Arg Thr Pro Arg Asp Glu
50 55 60
Asn Val Tyr Glu Cys Val Ala Gln Asn Ser Val Gly Glu Ile Thr Val
65 70 75 80
His Ala Lys Leu Thr Val
85
<210> 12
<211> 82
<212> PRT
<213> 人工序列
<220>
<223> 合成的构建体
<400> 12
Ala Thr Met Leu Cys Ala Ala Ser Gly Asn Pro Asp Pro Glu Ile Thr
1 5 10 15
Trp Phe Lys Asp Phe Leu Pro Val Asp Pro Ser Ala Ser Asn Gly Arg
20 25 30
Ile Lys Gln Leu Arg Ser Glu Thr Phe Glu Ser Thr Pro Ile Arg Gly
35 40 45
Ala Leu Gln Ile Glu Ser Ser Glu Glu Thr Asp Gln Gly Lys Tyr Glu
50 55 60
Cys Val Ala Thr Asn Ser Ala Gly Val Arg Tyr Ser Ser Pro Ala Asn
65 70 75 80
Leu Tyr
<210> 13
<211> 69
<212> PRT
<213> 人工序列
<220>
<223> 合成的构建体
<400> 13
Gly Gly Asn Val Asn Ile Thr Cys Val Ala Val Gly Ser Pro Met Pro
1 5 10 15
Tyr Val Lys Trp Met Gln Gly Ala Glu Asp Leu Thr Pro Glu Asp Asp
20 25 30
Met Pro Val Gly Arg Asn Val Leu Glu Leu Thr Asp Val Lys Asp Ser
35 40 45
Ala Asn Tyr Thr Cys Val Ala Met Ser Ser Leu Gly Val Ile Glu Ala
50 55 60
Val Ala Gln Ile Thr
65
<210> 14
<211> 55
<212> PRT
<213> 人工序列
<220>
<223> 合成的构建体
<400> 14
Thr Asn Ser Ala Gly Val Arg Tyr Ser Ser Pro Ala Asn Leu Tyr Val
1 5 10 15
Arg Thr Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Pro Lys
20 25 30
Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu
35 40 45
Leu Gly Gly Pro Ser Val Phe
50 55
<210> 15
<211> 55
<212> PRT
<213> 人工序列
<220>
<223> 合成的构建体
<400> 15
Thr Asn Ser Ala Gly Val Arg Tyr Ser Ser Pro Ala Asn Leu Tyr Val
1 5 10 15
Arg Thr Ser Gly Gly Gly Ser Leu Val Pro Arg Gly Ser Glu Pro Lys
20 25 30
Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu
35 40 45
Leu Gly Gly Pro Ser Val Phe
50 55
<210> 16
<211> 441
<212> PRT
<213> 人工序列
<220>
<223> 合成的构建体
<400> 16
Glu Glu Pro Pro Arg Phe Ile Arg Glu Pro Lys Asp Gln Ile Gly Val
1 5 10 15
Ser Gly Gly Val Ala Ser Phe Val Cys Gln Ala Thr Gly Asp Pro Lys
20 25 30
Pro Arg Val Thr Trp Asn Lys Lys Gly Lys Lys Val Asn Ser Gln Arg
35 40 45
Phe Glu Thr Ile Asp Phe Asp Glu Ser Ser Gly Ala Val Leu Arg Ile
50 55 60
Gln Pro Leu Arg Thr Pro Arg Asp Glu Asn Val Tyr Glu Cys Val Ala
65 70 75 80
Gln Asn Ser Val Gly Glu Ile Thr Ile His Ala Lys Leu Thr Val Leu
85 90 95
Arg Glu Asp Gln Leu Pro Pro Gly Phe Pro Asn Ile Asp Met Gly Pro
100 105 110
Gln Leu Lys Val Val Glu Arg Thr Arg Thr Ala Thr Met Leu Cys Ala
115 120 125
Ala Ser Gly Asn Pro Asp Pro Glu Ile Thr Trp Phe Lys Asp Phe Leu
130 135 140
Pro Val Asp Pro Ser Ala Ser Asn Gly Arg Ile Lys Gln Leu Arg Ser
145 150 155 160
Gly Ala Leu Gln Ile Glu Ser Ser Glu Glu Thr Asp Gln Gly Lys Tyr
165 170 175
Glu Cys Val Ala Thr Asn Ser Ala Gly Val Arg Tyr Ser Ser Pro Ala
180 185 190
Asn Leu Tyr Val Arg Thr Ser Gly Gly Gly Ser Leu Val Pro Arg Gly
195 200 205
Ser Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro
210 215 220
Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
225 230 235 240
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
245 250 255
Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr
260 265 270
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
275 280 285
Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
290 295 300
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
305 310 315 320
Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
325 330 335
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu
340 345 350
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
355 360 365
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
370 375 380
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
385 390 395 400
Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val
405 410 415
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
420 425 430
Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440
<210> 17
<211> 444
<212> PRT
<213> 人工序列
<220>
<223> 合成的构建体
<400> 17
Glu Thr Gly Glu Glu Pro Pro Arg Phe Ile Arg Glu Pro Lys Asp Gln
1 5 10 15
Ile Gly Val Ser Gly Gly Val Ala Ser Phe Val Cys Gln Ala Thr Gly
20 25 30
Asp Pro Lys Pro Arg Val Thr Trp Asn Lys Lys Gly Lys Lys Val Asn
35 40 45
Ser Gln Arg Phe Glu Thr Ile Asp Phe Asp Glu Ser Ser Gly Ala Val
50 55 60
Leu Arg Ile Gln Pro Leu Arg Thr Pro Arg Asp Glu Asn Val Tyr Glu
65 70 75 80
Cys Val Ala Gln Asn Ser Val Gly Glu Ile Thr Ile His Ala Lys Leu
85 90 95
Thr Val Leu Arg Glu Asp Gln Leu Pro Pro Gly Phe Pro Asn Ile Asp
100 105 110
Met Gly Pro Gln Leu Lys Val Val Glu Arg Thr Arg Thr Ala Thr Met
115 120 125
Leu Cys Ala Ala Ser Gly Asn Pro Asp Pro Glu Ile Thr Trp Phe Lys
130 135 140
Asp Phe Leu Pro Val Asp Pro Ser Ala Ser Asn Gly Arg Ile Lys Gln
145 150 155 160
Leu Arg Ser Gly Ala Leu Gln Ile Glu Ser Ser Glu Glu Thr Asp Gln
165 170 175
Gly Lys Tyr Glu Cys Val Ala Thr Asn Ser Ala Gly Val Arg Tyr Ser
180 185 190
Ser Pro Ala Asn Leu Tyr Val Arg Thr Ser Gly Gly Gly Gly Ser Gly
195 200 205
Gly Gly Gly Ser Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro
210 215 220
Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
290 295 300
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg
340 345 350
Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440
<210> 18
<211> 209
<212> PRT
<213> 人工序列
<220>
<223> 合成的构建体
<400> 18
Glu Thr Gly Glu Glu Pro Pro Arg Phe Ile Arg Glu Pro Lys Asp Gln
1 5 10 15
Ile Gly Val Ser Gly Gly Val Ala Ser Phe Val Cys Gln Ala Thr Gly
20 25 30
Asp Pro Lys Pro Arg Val Thr Trp Asn Lys Lys Gly Lys Lys Val Asn
35 40 45
Ser Gln Arg Phe Glu Thr Ile Asp Phe Asp Glu Ser Ser Gly Ala Val
50 55 60
Leu Arg Ile Gln Pro Leu Arg Thr Pro Arg Asp Glu Asn Val Tyr Glu
65 70 75 80
Cys Val Ala Gln Asn Ser Val Gly Glu Ile Thr Ile His Ala Lys Leu
85 90 95
Thr Val Leu Arg Glu Asp Gln Leu Pro Pro Gly Phe Pro Asn Ile Asp
100 105 110
Met Gly Pro Gln Leu Lys Val Val Glu Arg Thr Arg Thr Ala Thr Met
115 120 125
Leu Cys Ala Ala Ser Gly Asn Pro Asp Pro Glu Ile Thr Trp Phe Lys
130 135 140
Asp Phe Leu Pro Val Asp Pro Ser Ala Ser Asn Gly Arg Ile Lys Gln
145 150 155 160
Leu Arg Ser Gly Ala Leu Gln Ile Glu Ser Ser Glu Glu Thr Asp Gln
165 170 175
Gly Lys Tyr Glu Cys Val Ala Thr Asn Ser Ala Gly Val Arg Tyr Ser
180 185 190
Ser Pro Ala Asn Leu Tyr Val Arg Gly Thr Lys His His His His His
195 200 205
His Glu Thr Gly Glu Glu Pro Pro Arg Phe Ile Arg Glu Pro Lys Asp
1 5 10 15
Gln Ile Gly Val Ser Gly Gly Val Ala Ser Phe Val Cys Gln Ala Thr
20 25 30
Gly Asp Pro Lys Pro Arg Val Thr Trp Asn Lys Lys Gly Lys Lys Val
35 40 45
Asn Ser Gln Arg Phe Glu Thr Ile Asp Phe Asp Glu Ser Ser Gly Ala
50 55 60
Val Leu Arg Ile Gln Pro Leu Arg Thr Pro Arg Asp Glu Asn Val Tyr
65 70 75
Glu Cys Val Ala Gln Asn Ser Val Gly Glu Ile Thr Ile His Ala Lys
80 85 90 95
Leu Thr Val Leu Arg Glu Asp Gln Leu Pro Pro Gly Phe Pro Asn Ile
100 105 110
Asp Met Gly Pro Gln Leu Lys Val Val Glu Arg Thr Arg Thr Ala Thr
115 120 125
Met Leu Cys Ala Ala Ser Gly Asn Pro Asp Pro Glu Ile Thr Trp Phe
130 135 140
Lys Asp Phe Leu Pro Val Asp Pro Ser Ala Ser Asn Gly Arg Ile Lys
145 150 155
Gln Leu Arg Ser Gly Ala Leu Gln Ile Glu Ser Ser Glu Glu Thr Asp
160 165 170 175
Gln Gly Lys Tyr Glu Cys Val Ala Thr Asn Ser Ala Gly Val Arg Tyr
180 185 190
Ser Ser Pro Ala Asn Leu Tyr Val Arg Gly Thr Lys His His His His
195 200 205
His His
<210> 19
<211> 19
<212> DNA
<213> 人工序列
<220>
<223> 合成的构建体
<400> 19
tctgccccgc ttcacatcg 19
<210> 20
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 合成的构建体
<400> 20
agccgccacc accaccacca 20
- 在类风湿性关节炎中的PTPRS和蛋白聚糖
- 双糖链蛋白聚糖或双糖链蛋白聚糖活性增强剂在制备药物组合物中的用途
