一种腐皮镰刀菌的LAMP检测引物、试剂盒及检测方法
文献发布时间:2023-06-19 11:34:14
技术领域
本发明属于生物技术领域,具体涉及一种腐皮镰刀菌的LAMP检测引物、试剂盒及检测方法。
背景技术
黄芪(Astragalus membranaceus)为豆科(Leguminosae sp.)黄芪属(AstragalusLinn.)多年生草本植物,主根肥厚可以入药,有补气固表、利尿强心等功效,在中国各地多有栽培,适宜在沙质土壤中轮作。近年来,由于需求量的增加及栽培面积不断扩大,黄芪轮作周期缩短、连作面积连续增加,从而导致黄芪根腐病的发病率大大增加,发病率为10%~30%,重者高达60%,3年以上植株发病更严重,现成为限制黄芪产量的主要因素之一,严重制约着黄芪产业的持续性发展。黄芪根腐病在山西、甘肃、内蒙古等黄芪主产区均已普遍发生,已有研究表明腐皮镰刀菌(Fusarium solani)是山西省黄芪根腐病的优势病原菌。黄芪根腐病为土传性病害,发病部位在黄芪根部,危害早期地上部没有明显症状,不易察觉,容易错过最佳防治时期。因此,建立黄芪根腐病病原镰刀菌的检测方法,实现对黄芪根腐病的及时准确诊断与病原菌实时监测,是对病害精准预测预报、及时有效防治的前提与保障。
传统的病原菌鉴定主要依据形态、培养特征及致病性检测,包括菌落颜色、形态、分生孢子数量及形状、菌核完整性、孢子长度及宽度等,但其形态特征易受环境改变,影响鉴定的准确性。并且传统的病原菌鉴定需要对病菌进行分离、纯化、致病性测定等步骤,不仅耗时费力,且在分离培养过程中极易污染各种杂菌,鉴定准确度较低。该方法对操作者的实验技能和实际经验有很高的要求,易受人为因素和环境的影响,无法达到快速检验的要求。最重要一点是容易遗漏处于潜育期或出现隐症现象的病原菌,以致延误病情,导致病害的暴发,从而耽误病害的及时防治。因此传统病原学检测方法已不能满足现代植物病理学研究的需要。
近年来随着分子生物学技术的发展,为植物病原真菌的检测提供新的研究思路。对于镰刀菌的快速分子检测,目前多通过PCR、荧光定量PCR和LAMP技术实现,其中PCR技术所用时间较长,需要通过凝胶电泳检测,结果判定需要3-4h才能完成;荧光定量PCR可对结果准确定量,但仪器昂贵,使用条件受到限制;而LAMP技术具有特异性强、灵敏性高、操作便捷、检测迅速的特点,且结果判定直观,操作简便,不依赖任何专门的仪器设备,只需恒温装置即可,易于在生产中推广应用。并且LAMP检测方法不仅检测成本远低于传统PCR技术,而且比传统PCR技术的效率高。原理是针对靶基因上特定区域设计引物,即一对外部引物(FIP/BIP)、一对内部引物(F3/B3)和用来提高反应效率的一对环引物(LF/LB),然后在恒定温度(60-65℃)下,利用链置换型DNA聚合酶针对目标核酸靶序列进行快速扩增,即可在短时间内获得大量的特定核酸产物。LAMP检测技术主要优点有:(1)操作简单。该试剂盒内含检测试剂及小型操作工具,仅需离心机和恒温装置,就可完成操作;(2)检测耗时短。所有操作可在2h内完成,大大缩短了检测时间;(3)检测灵敏度高,在DNA浓度较低时,就会出现显色反应。(4)检测结果可视化。在紫外灯下就可观察结果。
目前LAMP技术已广泛应用于各种病原体的检测,可用于禾谷镰刀菌、层出镰刀菌、梨孢镰刀菌、尖孢镰刀菌等种类的LAM快速检测。但对引起黄芪根腐病的腐皮镰刀菌的LAMP检测,国内外均未见报道。
发明内容
本发明的目的在于快速检测黄芪根腐病病原菌,尤其针对腐皮镰刀菌。
为实现上述目的,本发明采用如下技术方案:
本发明的第一个方面,提供一种腐皮镰刀菌的LAMP检测引物,所述引物包括正向外引物F3、反向外引物B3、正向内引物FIP、反向内引物BIP、正向环引物LF和反向环引物LB,所述引物序列如下;
F3:5'-GATCGCGCCTTGCTATTC-3';
B3:5'-TTAGCGTCTGTTGTGAACC-3';
FIP:5'-AATTACGGTCGGACCGCAAAACATCGAATTCCCTCCCT-3';
BIP:5'-CGGGCGACGTTGGACAAACCAAGAGGGTTTGGTGTTT-3';
Loop F:5'-ATTTTGGGACTCGGGAGAAG-3';
Loop B:5'-CCTGATCCCTGCACACAA-3'。
本发明的第二个方面,提供一种腐皮镰刀菌的LAMP检测试剂盒,包括权利要求1所述的引物。
进一步的,所述LAMP检测试剂盒还包括还包括2×LAMP反应混合液和8U Bst聚合酶。
本发明的第三个方面,提供一种包含所述引物的腐皮镰刀菌的LAMP检测反应体系,所述反应体系每1mL检测溶液中含有:外引物F3和B3各0.25μM,内引物FIP和BIP各1μM,环引物Loop F和Loop B各0.5μM,2×LAMP反应混合液625μL,8U Bst聚合酶25μL。
本发明的第四个方面,提供一种基于所述反应体系的腐皮镰刀菌的LAMP检测方法,包括以下步骤:
S1、提取待测样品总DNA;
S2、制备25μL所述反应体系;
S3、将待测样品总DNA于S2所述反应体系中进行LAMP扩增,通过琼脂糖凝胶电泳检测扩增结果进行判定:出现梯形条带判断为阳性,存在腐皮镰刀菌,没有出现梯形条带判断为阴性,不存在腐皮镰刀菌。
进一步的,所述LAMP检测方法的S2中,25μL反应体系包括:外引物F3和B3各0.2μM,内引物FIP和BIP各0.8μM,环引物Loop F和Loop B各0.4μM,2×LAMP PCR等温扩增反应混合液12.5μL,8U Bst聚合酶0.5μL,DNA模板1.0μL,以灭菌超纯水补足至25μL。
更进一步的,LAMP扩增的反应条件为62℃温育60min。
本发明的第五个方面,提供一种基于所述反应体系的腐皮镰刀菌的可视化LAMP检测方法,包括以下步骤:
提取待测样品总DNA;
制备25μL所述反应体系;
将LAMP扩增产物与1μL SYBR greenⅠ显色剂混匀,在365nm紫外灯下进行可视化显色检测,观察到绿色荧光为阳性,存在腐皮镰刀菌,未观察到绿色荧光为阴性,不存在腐皮镰刀菌。
本发明的第六个方面,提供所述试剂盒在植物根腐病病原菌鉴定中的应用。
进一步的,所述植物为黄芪。
与现有技术相比,本发明具有如下有益效果:
1、本发明所设计的腐皮镰刀菌LAMP检测引物及检测试剂盒的特异性强、灵敏度高,扩增效果好,测结果准确可靠,适用于腐皮镰刀菌的快速检测。
2、本发明所建立的检测方法灵敏度高,对腐皮镰刀菌的检测灵敏度为10pg/μL。
3、黄芪根腐病发病危害严重,其病原菌的传统生物学检测方法需要对病原菌进行分离培养,试验周期长、操作复杂,技术性强,且试验过程易受环境影响。而PCR分子检测技术又需要依靠PCR仪等贵重仪器,且操作要求较高,很难在基层一线推广应用。本发明将环介导等温扩增技术用于腐皮镰刀菌的快速检测及由腐皮镰刀菌引起的黄芪根腐病的病害早期诊断,建立了引起黄芪根腐病的腐皮镰刀菌的LAMP检测新方法,可用于黄芪植株中腐皮镰刀菌的实时分子检测,尤其适合于黄芪根腐病发病的早期诊断,特别是根腐病显症之前的病原菌监测,为病害的预测预报和及时防治奠定基础。
附图说明
图1为不同LAMP反应温度的检测结果,图a为琼脂糖凝胶电泳检测扩增结果,图b为可视化显色检测结果,M为Marker2000、1-6分别为60,61,62,63,64℃和65℃。
图2为不同LAMP反应时间的检测结果,图a为琼脂糖凝胶电泳检测扩增结果,图b为可视化显色检测结果,M为Marker2000、1-5分别为15,30,45,60和75min。
图3为LAMP反应灵敏度检测结果,图a为琼脂糖凝胶电泳检测扩增结果,图b为可视化显色检测结果,M为Marker2000、1为1μg/μL、2为100ng/μL、3为10ng/μL、4为1ng/μL、5为100pg/μL、6为10pg/μL、7为1pg/μL。
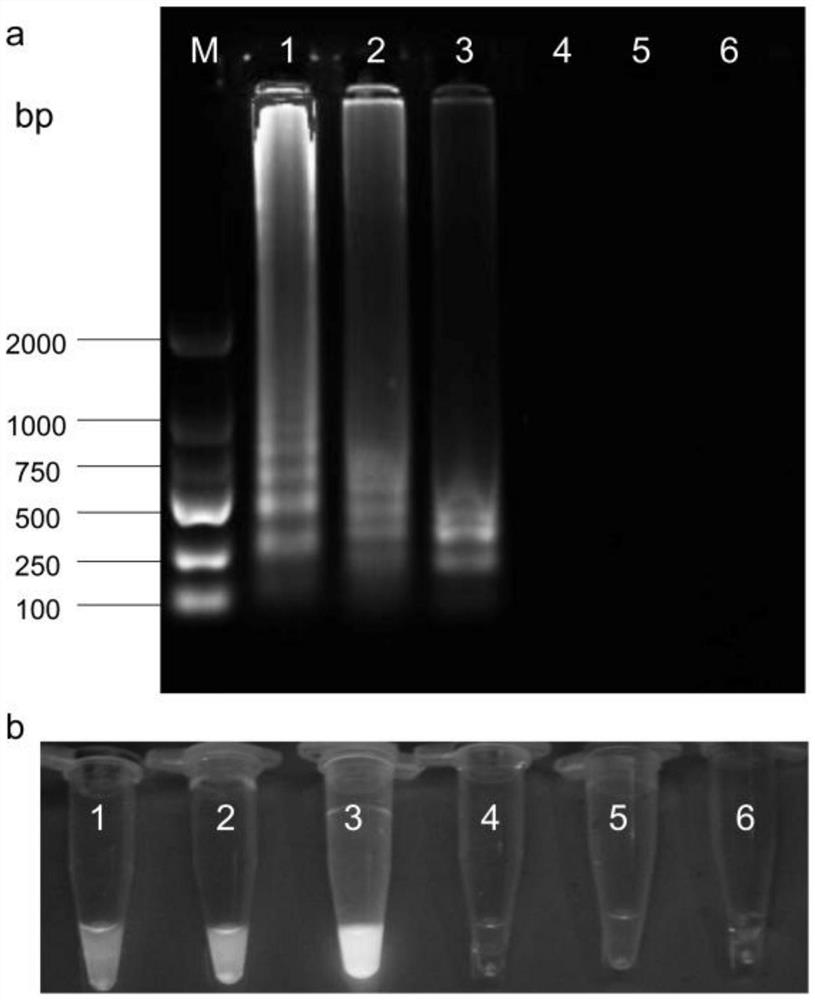
图4为实际样品的LAMP的检测结果,图a为琼脂糖凝胶电泳检测扩增结果,图b为可视化显色检测结果,M为Marker2000、1-3为发病穗粒、4-6为健康穗粒。
具体实施方式
下面结合附图和具体实施例对本发明进行详细说明,但不应理解为本发明的限制。如未特殊说明,下述实施例中所用的技术手段为本领域技术人员所熟知的常规手段,下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1:腐皮镰刀菌LAMP引物组合物的设计
测定腐皮镰刀菌(Fusarium solani)的EF-1alpha基因序列,并与GenBank数据库中其它镰刀菌(Fusarium spp.)的EF-1alpha基因序列进行比对分析,利用在线LAMP引物设计软件Primer Explorer V5 software(http://primerexplorer.jp/lampv5e),设计SEQID NO1-6所示核苷酸序列的腐皮镰刀菌的特异性LAMP引物,所述引物包括具体包括1对外引物F3/B3、1对内引物FIP/BIP和1对环引物Loop F/Loop B。具体的引物序列如下所示:
F3:5'-GATCGCGCCTTGCTATTC-3',SEQ ID NO:1;
B3:5'-TTAGCGTCTGTTGTGAACC-3',SEQ ID NO:2;
FIP:5'-AATTACGGTCGGACCGCAAAACATCGAATTCCCTCCCT-3',SEQ ID NO:3;
BIP:5'-CGGGCGACGTTGGACAAACCAAGAGGGTTTGGTGTTT-3',SEQ ID NO:4;
Loop F:5'-ATTTTGGGACTCGGGAGAAG-3',SEQ ID NO:5;
Loop B:5'-CCTGATCCCTGCACACAA-3',SEQ ID NO:6。
实施例2:病原菌基因组DNA的提取
病原菌基因组DNA的提取采用Biospin真菌基因组DNA提取试剂盒,按其操作说明进行提取:
1)挑取少量活化好的病原菌新鲜菌丝,加入液氮研磨成粉,装入1.5mL离心管,加入500μL LE Buffer,混合均匀。
2)于65℃条件下温育60min(每隔15min取出颠倒混匀);
3)加入130μL DA Buffer,混匀后于65℃水浴5min;
4)14,000×g离心3min;
5)吸取上清液,转至新的1.5mL离心管中,加入500μL E Binding Buffer,混均;
6)将混合液移至Spin Column,于6,000×g离心1min;
7)向Spin Column加入500μL G Binding Buffer,于10,000×g离心30s,弃去接液管中的液体;
8)向Spin Column加入600μL Wash Buffer,10,000×g离心30s,弃去接液管中的液体;
9)重复向Spin Column加入600μL Wash Buffer,10,000×g离心30s;
10)10,000×g离心1min;
11)Spin Column放入新的1.5mL离心管中,放置5min,加入35μL ddH
12)再向Spin Column加入25μL ddH
实施例3:腐皮镰刀菌的LAMP检测反应体系的建立
以实施例2提取的DNA为模板,采用实施例1设计的LAMP引物组合物,建立腐皮镰刀菌的LAMP检测反应体系:外引物F3和B3各0.2μM,内引物FIP和BIP各0.8μM,环引物Loop F和Loop B各0.4μM,2×LAMP PCR等温扩增反应混合液(通用型,生工生物工程(上海)股份有限公司)12.5μL,8U Bst聚合酶0.5μL,DNA模板1.0μL,用灭菌超纯水补足至25μL。扩增前在离心管盖内加入1.0μL SYBR greenⅠ显色剂。扩增结束后以5000r/min离心30s,上下颠倒混匀。反应结束后,取2.0μL LAMP扩增产物进行2.0%琼脂糖凝胶电泳检测,电泳检测条件为电压80V,电流110A,检测时间30min。
扩增结果以两种形式呈现:1.琼脂糖凝胶电泳,出现梯形条带判断为阳性,存在腐皮镰刀菌,没有出现条带判断为阴性,不存在腐皮镰刀菌。2.在365nm紫外灯下进行可视化显色检测,观察到产生绿色荧光为阳性,存在腐皮镰刀菌,不产生绿色荧光为阴性,不存在腐皮镰刀菌。
实施例4:LAMP反应条件的优化
采用实施例1设计的LAMP引物组合物,以实施例2提取的DNA为模板,依据实施例3的反应体系进行LAMP反应,并设定反应温度分别为60、61、62、63、64和65℃,检测不同温度对反应结果的影响。结果表明60-65℃均有很好扩增效果,最优为62℃,实验结果如图1所示。
设定LAMP反应温度为62℃,反应时间分别为15min、30min、45min、60min和75min,检测不同反应时间对扩增的影响。结果表明15min时不能扩增出条带,随着扩增时间的增加,LAMP特征性梯形带亮度逐渐增加,60min时扩增条带最亮,75min时条带清晰度下降,可视化显色检测结果与琼脂糖凝胶电泳一致。因而最适宜反应时间为60min,实验结果如图2所示。
实施例5:LAMP反应检测方法的特异性检测:
供试病原菌包括:腐皮镰刀菌(Fusarium solani)、锐顶镰刀菌(Fusariumacuminatum)、尖孢镰刀菌(Fusarium oxysporum)、层出镰刀菌(Fusarium proliferatum)、木贼镰刀菌(Fusarium equiseti)、变红镰孢菌(Fusarium incarnatum)、禾谷镰刀菌(Fusarium graminearum)、枝状枝孢菌(Cladosporium cladosporioides)、交链格孢菌(Alternaria alternata)、灰葡萄孢(Botrytis cinerea)、拟盘多毛孢(Pestalotiopsispaeoniicola)。用实施例4优化后的条件进行LAMP反应。实验结果如表1所示,除腐皮镰刀菌检测结果呈阳性外,其他菌株均未扩增,琼脂糖凝胶电泳与可视化显色检测结果均为阴性,说明本发明方法具有很好的特异性。
表1腐皮镰刀菌LAMP检测方法的特异性结果
实施例6:LAMP反应灵敏度检测
使用分光光度计测定实施例2提取的腐皮镰刀菌基因组DNA浓度,并调整浓度为100μg/μL,并依次稀释为1μg/μL、100ng/μL、10ng/μL、1ng/μL、100pg/μL、10pg/μL和1pg/μL,检测不同浓度的腐皮镰刀菌基因组DNA的LAMP反应。实验结果表明,本发明LAMP检测方法可以检测到的腐皮镰刀菌DNA最低浓度为10pg/μL,实验结果如图3所示。
实施例7:实际样品检测:
本实施例从田间选择自然发病的黄芪根腐病样品和健康黄芪进行实验。
首先采用NaOH快速裂解法快速提取样品中的病原菌DNA。
1)将样品置于75%乙醇中5min,无菌水清洗3遍,晾干;
2)每毫克植物组织中加入10μL 0.5mol/L NaOH溶液;
3)将样品组织充分研磨成糊状,转入1.5mL离心管中;
4)于11,000×g离心5min;
5)取上清液5μl,加入495μL 0.1mol/L Tris-HCl(pH=8.0),混合均匀,作为DNA模板进行LAMP扩增。
用实施例4优化后的条件进行LAMP反应,实验结果如图4所示,LAMP反应方法能有效扩增出发病样品中的病原菌,检测结果呈阳性,而健康样品没有扩增,再次证明本发明方法检测结果准确可靠,有很强的实用性。
尽管已描述了本发明的优选实施例,但本领域内的技术人员一旦得知了基本创造性概念,则可对这些实施例作出另外的变更和修改。所以,所附权利要求意欲解释为包括优选实施例以及落入本发明范围的所有变更和修改。
显然,本领域的技术人员可以对本发明进行各种改动和变型而不脱离本发明的精神和范围。这样,倘若本发明的这些修改和变型属于本发明权利要求及其等同技术的范围之内,则本发明也意图包含这些改动和变型在内。
序列表
<110> 山西农业大学
<>
<120> 一种腐皮镰刀菌的LAMP检测引物、试剂盒及检测方法
<>
<160> 6
<>
<170> SIPOSequenceListing 1.0
<>
<210> 1
<211> 18
<212> DNA
<213> 人工序列
<>
<400> 1
gatcgcgcct tgctattc 18<>
<>
<210> 2
<211> 19
<212> DNA
<213> 人工序列
<>
<400> 2
ttagcgtctg ttgtgaacc 19<>
<>
<210> 3
<211> 38
<212> DNA
<213> 人工序列
<>
<400> 3
aattacggtc ggaccgcaaa acatcgaatt ccctccct 38<>
<>
<210> 5
<211> 37
<212> DNA
<213> 人工序列
<>
<400> 5
cgggcgacgt tggacaaacc aagagggttt ggtgttt 37<>
<>
<210> 5
<211> 20
<212> DNA
<213> 人工序列
<>
<400> 5
attttgggac tcgggagaag 20<>
<>
<210> 6
<211> 18
<212> DNA
<213> 人工序列
<>
<400> 6
cctgatccct gcacacaa 18<>
<>
<>
<>
- 一种腐皮镰刀菌的LAMP检测引物、试剂盒及检测方法
- 腐皮镰刀菌的RT-QPCR检测的引物、探针、试剂盒及方法
