一种可注射黏附性水凝胶及其制备方法与应用
文献发布时间:2023-06-19 11:34:14
技术领域
本发明属于医学给药技术领域,具体涉及一种可注射黏附性水凝胶及其制备方法与应用。
背景技术
溃疡性结肠炎(UC)是一种累及结肠、直肠,具有腹痛、腹泻、血便等临床表现的慢性非特异性肠道疾病。据报道,UC在欧美国家年发病率最高可达8-246例/100,000人。轻、中度的UC患者通常经口服用药缓解疾病症状及提升生活质量,5-氨基水杨酸(5-ASA)是治疗溃疡性结肠炎临床上应用最多的药物之一。
柳氮磺胺吡啶(SSZ)作为口服的5-ASA前体药物在临床中是治疗UC的一线药物,具有减少5-ASA在胃和小肠内损耗、显著提高到达结肠浓度的优点。但是,经结肠肠道菌群裂解SSZ产生的磺胺吡啶(SP)增强了药物毒性,使患者因对SP不耐受产生呕吐和过敏反应等副作用。5-ASA作为抗炎制剂是一种环加氧酶抑制物,研究表明其抗炎机制为靶向作用于过氧化物酶体增殖物激活受体及多方面调节细胞内代谢。5-ASA本身因微小的副作用能更好地被患者耐受,因此成为优于SSZ的UC治疗药物。但是,当5-ASA口服应用时会经小肠大幅吸收,导致在结肠内发挥微弱的治疗作用。同时研究表明,绝大部分到达结肠的5-ASA因其低溶解度的特性无法高效发挥抗炎作用而被排出体外,从而降低了药物利用率。
尽管口服给药因其便捷性成为最广泛应用的给药途径,但是黏膜给药凭借高黏膜渗透性、直接黏膜吸收入血、降低用药过量风险和局部治疗等优点体现了出色的替代性。为了提升结肠炎症区域局部5-ASA药量,使5-ASA直接接触病变黏膜,降低上消化道对药物的吸收,临床进一步提出包括栓剂、液体灌肠剂和泡沫灌肠剂等直肠给药方法。栓剂等药物在肠腔内局部分解扩散,将5-ASA集中在肠道病变部位,使炎症性病灶处于高浓度药物环境中。5-ASA穿透由肠粘膜上皮分泌的黏液、消化液及寄生菌产生的抑菌物质构成的化学屏障,最终与肠上皮细胞接触,从而抑制肠黏膜的前列腺素合成和炎症介质白三烯形成,达到抗炎效果。
但是,灌肠剂将5-ASA以低溶解度的非离子形式悬浮于水溶液中,无论灌入肠腔内的灌肠剂体积多大,最终只有有限的离子化5-ASA穿透肠消化液和黏液接触肠上皮细胞激发抗炎作用,同时传统灌肠剂因为缺少载药位点使载药能力有限。因此为了达到更好地治疗效果,临床上往往大量(2g/120mL)多次地给患者给予灌肠剂,这往往提高了肠内压力、刺激肠壁内神经从而引起肠道疼痛和不适,同时产生的肠道应激反应使肠道蠕动频率增快、幅度加大,从而快速将没有任何黏附作用的肠道载药内容物排出体外,缩短5-ASA在肠道内的停留时间。因此,开发一种可替代传统直肠给药的具有提高5-ASA溶解度、高载药量、长停留时间的药物传递介质亟待进行。
已有研究表明,经过修饰的水凝胶作为药物传递介质具有一定黏性,提升了药物在肠道内停留时间。例如,水凝胶内壳聚糖通过静电力与肠黏膜黏蛋白相互作用,从而形成壳聚糖水凝胶在肠道组织上的黏附。但是,研究也发现这种静电力并不稳定,正负电荷形成的离子键在肠蠕动过程中极易断开,降低黏附力。广泛存在于黏性海贝足蛋白中的邻苯二酚基团可使贻蚌类生物在水下紧密黏附于不同表面,在肠道组织内研究发现该邻苯二酚基团修饰的壳聚糖水凝胶可以与肠粘膜黏蛋白形成共价键和非共价键的双重交联,从而提高壳聚糖水凝胶在肠道组织上的黏附性。然后,实验也发现肠道内注射后,肠道内有50%的水凝胶很快被小鼠以大便形式从肛门排出。此外,经不同物质修饰的各类别水凝胶与黏蛋白聚合链通过静电力、疏水键、氢键、共价键或范德华力等各种结合力可形成的黏附性水凝胶。但是,由于肠道组织的弱碱性,上述水凝胶在肠道黏附力仍然较弱,主要表现在粘附时间短、粘附力不强等。此外,由于5-ASA为疏水性药物,水凝胶以各种形式负载5-ASA后,其释放入肠液后仍以原始的难溶形式存在,溶解度不足1mg/mL,药物利用度很低。
因此,如果能够构建一种可提升水凝胶黏附性、5-氨基水杨酸药物溶解度和负载量的局部给药方式,将会大大提高药物在溃疡性结肠炎中的治疗效果,而这一问题亟待解决。
发明内容
本发明的目的就是为了解决上述技术问题,而提供一种可注射黏附性水凝胶及其制备方法与应用。本发明构建了一种可注射、粘附性和高5-氨基水杨酸负载的水凝胶,并提供了该水凝胶的制备方法及应用。具体为通过构建动态可逆的可注射性、高黏附性、高5-氨基水杨酸溶解度及负载性的树形高分子水凝胶载药系统,通过肛门注射和粘附在直肠部位,局部缓释5-氨基水杨酸治疗葡聚糖硫酸钠诱导的溃疡性结肠炎。因而本发明提供的水凝胶具有可注射性强、粘附性好等优点,并大幅度增加了难溶性药物5-氨基水杨酸的溶解性和药物利用度,体内试验表明,该水凝胶能更好维持肠道长度、显著减轻肠道炎性细胞浸润发生,且在疾病活动指数,组织学评分和免疫组化结果中表现最佳,可以很好作为用于治疗溃疡性结肠炎的药物传递介质。
本发明的目的之一是提供一种可注射黏附性水凝胶的制备方法,其包括以下步骤:
(1)将第四代树形高分子聚酰胺-胺溶于去离子水中,向其中加入5-氨基水杨酸,将混合液超声形成稳定的复合物;
(2)将氧化葡聚糖溶液与步骤(1)所得复合物进行混合形成可注射黏附性水凝胶。
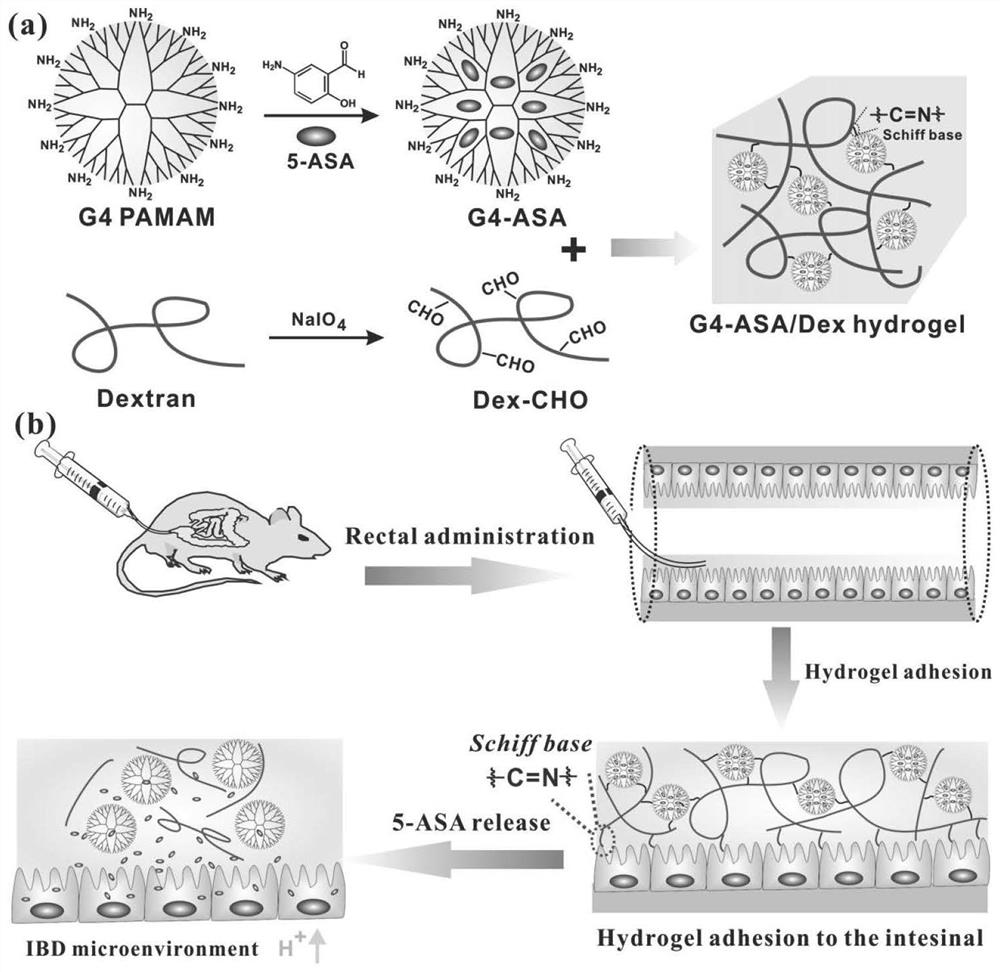
本发明提供的上述方法制得的水凝胶,可以通过肛门注射和粘附在直肠部位,通过局部缓释5-氨基水杨酸用于治疗葡聚糖硫酸钠诱导的溃疡性结肠炎。该水凝胶体系中,交联纳米粒复合物通过第四代树形高分子聚酰胺-胺将5-氨基水杨酸的溶解度显著提高了25.62倍,大幅度增加了难溶性药物5-氨基水杨酸的药物利用度。体外研究发现,该水凝胶具有可注射性和结构稳定性,在酸性微环境中,具有药物响应性释放特性。此外,该水凝胶端基的醛基能与肠道黏膜上的氨基共价结合,从而稳定的将水凝胶粘附在肠道内壁上。体内在小鼠肠炎模型中,肛门注射的该水凝胶具有可注射性强、粘附性好等优点。治疗结果发现,该水凝胶能更好维持肠道长度、显著减轻肠道炎性细胞浸润,在疾病活动指数,组织学评分和免疫组化结果中表现最佳。该方法可以显著提高5-氨基水杨酸溶解性和利用度,以及临床使用的便捷性,从而为肠道炎症提供一种局部给药的高效治疗策略。
不同于以往改性水凝胶与5-氨基水杨酸的简单混合,树形高分子因其高度支化的树枝状结构及多链末端的功能性基团为5-氨基水杨酸提供充足位点,可以直接高量负载脂溶性药物5-氨基水杨酸。由于,第四代树形高分子聚酰胺-胺侧链大量的氨基,本发明基于氨基作为活性位点,开发出了以第四代树形高分子聚酰胺-胺作为交联剂的可注射粘附性水凝胶。本发明中,通过第四代树形高分子聚酰胺-胺与5-氨基水杨酸通过疏水空腔与疏水分子的主客体反应,构建表面含有氨基的纳米颗粒复合物,以此作为交联剂与氧化葡聚糖的醛基通过席夫碱反应交联,构建可注射、粘附性和高5-氨基水杨酸负载的水凝胶,在肠道局部缓释抗炎性5-氨基水杨酸治疗葡聚糖硫酸钠诱导的溃疡性结肠炎。该水凝胶端基的醛基与肠道黏膜上活性氨基共价结合,形成稳定的化学键,将水凝胶牢固地粘附在肠道内壁上,避免因肠道蠕动作用被排出体外,减少给药频率和体积,从而减轻受试动物的用药痛苦,简化繁琐的给药操作过程。动态可逆的醛基-胺基席夫碱交联反应引起胶-液体转变,水凝胶能够被轻松注射到肠腔内。在肠道蠕动等机械刺激下的水凝胶可实现破裂-自愈合。此外,第四代树形高分子聚酰胺-胺在水溶液中具有良好的溶解能力,经过第四代树形高分子聚酰胺-胺修饰的5-氨基水杨酸复合物同时提高了疏水性5-氨基水杨酸的水溶解度,可使5-氨基水杨酸稳定长期停留在肠液或肠泌粘液,同时纳米颗粒复合物更容易穿越肠粘膜上皮细胞分泌的黏液化学屏障,直接接触肠上皮细胞,释放5-氨基水杨酸分子发挥抗炎作用。另外,该水凝胶使装载的5-氨基水杨酸具有酸刺激响应的药物缓释行为,降低其毒副作用,同时5-氨基水杨酸在稳定持续释放的过程中可不间断地刺激肠粘膜上皮细胞,保持持续的抗炎效果。
本发明的水凝胶可通过提高疏水性5-氨基水杨酸溶解度和负载量显著提升葡聚糖硫酸钠诱导的溃疡性结肠炎的治疗效果。具有亲水特性的第四代树形高分子聚酰胺-胺内部含有可包裹疏水药物(如5-氨基水杨酸)的疏水空腔,随后形成的亲水复合物在小鼠肠道内稳定地停留在肠液中,最终穿过粘液化学屏障激活肠上皮细胞的抗炎通路。同时,第四代树形高分子聚酰胺-胺因其高度支化的树枝状结构及多链末端的功能性基团为5-氨基水杨酸提供充足位点。这与Xiayan Bai和Asila Osman等团队研究的通过热引发自由基聚合法或温控膨胀吸收的方式将5-氨基水杨酸直接包裹或物理分散于水凝胶完全不同。在抗肠炎治疗过程中,后者既不能提升5-氨基水杨酸溶解度,也不能为5-氨基水杨酸提供充足位点,显然在提高5-氨基水杨酸利用率上处于劣势。
本发明的水凝胶具有出色的黏附效果,能够促进5-氨基水杨酸充分接触肠道局部,避免药物经肠蠕动快速排出体外,从而提供了稳定的抗炎环境。延长了该水凝胶的肠道局部停留时间,在对于治疗葡聚糖硫酸钠诱导的溃疡性结肠炎有重要意义。传统灌肠剂因低肠道停留时间需要大量多次给药,增加患者的痛苦和用药困难。在以往研究中,肠道黏膜表面黏蛋白与载药水凝胶通过静电力、共价键等交联形成有限的黏附力,造成肠炎治疗过程中的药物损耗。相比而言,本发明的水凝胶能够利用端基的醛基与肠道黏膜上活性氨基共价结合发生缩合反应,通过形成稳定的化学键将水凝胶牢固地粘附在肠道内壁上。在本发明中小鼠在注射该水凝胶治疗结肠炎时基本没有出现将水凝胶排出体外,给药频率仅为1次/天即可达到治疗效果。
本发明的水凝胶还具有良好的机械性能,能够减少治疗过程中引起的肠粘膜损伤。肠道器官肠壁质地柔软,例如栓剂或固体材料给药的方式往往会造成肠道黏膜撕裂和破坏,从而加重肠道炎性程度。本发明的可注射性水凝胶在压力下通过氨-醛基可逆性交联转化成液态进入肠腔,随后根据肠道空间形态重新成为胶体,因此具有顺应肠道形态、避免因损伤肠黏膜导致肠炎加重的优越性。另外,注射到小鼠体内的水凝胶因为自愈合特性使水凝胶恢复或保持完整性,避免5-氨基水杨酸由于破裂作用产生单次大量释放,从而提升给药效率。
本发明的水凝胶能更好维持肠道长度、显著降低动物死亡率,控制体重和疾病活动指数,并且在炎症因子水平和,组织学评分和免疫组化结果上也表现最佳。通过将传统口服和灌肠给药方法与本发明的新型水凝胶给药方式在各个肠炎评判指标上进行量化评价与比较,发现本发明的水凝胶在治疗溃疡性结肠炎方面具备更出色表现。与传统给药方式相比新型水凝胶能更好维持肠道长度、显著降低动物死亡率,控制体重和疾病活动指数,并且在炎症因子水平和组织学评分和免疫组化结果上也表现更佳。
本发明的新型水凝胶通过提升5-氨基水杨酸溶解性和增加水凝胶黏附性等方式表现出较传统给药方式更出色的抗炎性。同时,安全性也是材料在临床应用过程中需要重点考虑的问题,在体外细胞实验和动物新型水凝胶都表现出了出色的生物相容性。
进一步的是,步骤(1)中所述5-氨基水杨酸与第四代树形高分子聚酰胺-胺溶液(70mg/mL)的摩尔比为283:10000。
进一步的是,步骤(1)中所述超声的时间为2h,在超声完成之后进行离心操作,所述离心的条件为于10000rpm离心5分钟。
进一步的是,步骤(2)中所述氧化葡聚糖的制备方法为:将3g葡萄聚糖以100mg/mL的浓度溶解纯水中,随即逐滴加入NaIO
进一步的是,步骤(2)中所述氧化葡聚糖溶液的浓度为100mg/mL。
进一步的是,步骤(2)中所述复合物的浓度为70mg/mL。
进一步的是,步骤(2)中所述复合物与氧化葡聚糖溶液按体积比3:2进行混合。
本发明的目的之二是提供一种可注射黏附性水凝胶,其是由上述制备方法获得。
本发明的目的之三是提供上述可注射黏附性水凝胶的应用,将该水凝胶作为用于治疗溃疡性结肠炎的药物传递介质。具体的,是将该水凝胶通过肛门注射或粘附在直肠部位,通过该药物传递介质局部缓释5-氨基水杨酸用于治疗葡聚糖硫酸钠诱导的溃疡性结肠炎。
本发明的有益效果如下:
本发明解决了5-氨基水杨酸在口服和直肠用药中溶解度低的问题。本发明方法通过以第四代树形高分子聚酰胺-胺在负载5-氨基水杨酸形成的纳米复合物作为交联剂与氧化葡聚糖交联形成新型载药水凝胶,赋予了其出色的能力如下:显著提高5-氨基水杨酸溶解度和负载量,稳固的肠道黏附能力,出色的机械性能和良好的生物相容性,从而达优越的治疗葡聚糖硫酸钠诱导的溃疡性结肠炎的效果。
附图说明
图1为G4-ASA/Dex治疗DSS诱导结肠炎的原理示意图,其中:(a)G4-ASA/Dex水凝胶形成的原理和示意图;(b)G4-ASA/Dex局部注射到实验小鼠的肠腔,原位黏附肠道组织释放5-ASA治疗结肠炎。
图2为G4-ASA的表征结果图,其中:(a,b)肉眼观浑浊的5-ASA悬浮液转变为透明的G4-ASA溶液;(c)G4 PAMAM和G4-ASA的TEM结果;(d)G4 PAMAM和G4-ASA的电势电位;(e)G4PAMAM,5-ASA及G4-ASA复合物的UV-Vis吸收光谱;(f)不同浓度的G4 PAMAM以5-ASA作为模型药物时G4-ASA的载药特性;
图3为水凝胶形态学,可注射性,自愈合特性,酸响应降解性和水凝胶黏性结果,其中:(a)Dex与Dex-CHO的FTIR光谱图;(b)G4 PAMAM与Dex-CHO混合之后形成流动性溶液;(c)G4 PAMAM与Dex-CHO混合10分钟后形成不流动的G4/Dex水凝胶;(d)G4/Dex在3000×放大倍数下的SEM结果;(e)G4-ASA/Dex在3000×放大倍数下的SEM结果;(f)罗丹红染色的Dex/G4水凝胶通过1mm直径针头被注射出;(g)G4/Dex水凝胶注射到去离子水中;(h)Dex/G4水凝胶的自愈合表现,两块水凝胶接触几分钟后愈合为一整块,表面滴加DI水后分界线模糊;(i)G4/Dex水凝胶分别在pH 3.1,pH 5.1和pH 7.4水溶液中的稳定性和溶解现象。箭头示水凝胶的变化情况;(j)肠道组织和金属棒之间的G4/Dex水凝胶显示出对组织的黏附特性和本身具备的黏性。
图4为流变学特性,药物释放特点,溶胀试验和降解试验;其中,(a)G4-ASA/Dex水凝胶时间依赖的流变学测定;(b)G4-ASA/Dex水凝胶拉力依赖的流变学测定,在角频率为10rad/s时水凝胶在0.1%到1000%的拉力范围内;(c)G4-ASA/Dex水凝胶的触变学实验,分别交替采用5%和500%的拉力打破和恢复水凝胶,在整个研究中角频率在10rad/s;(d)比较和观察G4/Dex和G4-ASA/Dex在5%拉力和10rad/s角频率下的系数;(e)随时间发展的G4/Dex水凝胶的黏度测量;(f)在pH7.4环境下测定5-ASA从G4-ASA/Dex,Dex/G4/ASA水凝胶中的释放情况,以及在pH 5.1环境下5-ASA从G4-ASA/Dex水凝胶中的释放情况;(g)在pH 7.4环境下测定5-ASA分别从5-ASA溶液和G4-ASA溶液的释放情况;(h)G4-ASA/Dex和G4/Dex在PBS溶液中的膨胀百分比;(i)G4-ASA/Dex和G4/Dex在PBS中的降解情况。
图5为水凝胶在体外肠道黏附结果,其中:(a)G4-ASA/Dex水凝胶黏附于肠道组织的示意图;(b)60μL G4-ASA/Dex被注射到实验性小鼠的肠道中观察黏附状况,红色箭头示意肠道内的水凝胶;(c)黏附于组织上的G4/Dex水凝胶垂直或颠倒放置;(d)60mLPBS水溶液在40s被注射出来以冲击黏附着的水凝胶。箭头示注射器中剩余PBS的体积量;(e)水凝胶黏附的肠段在浸泡前和浸泡后被扭转以评估黏附性;(f,g)在不同摇床速度(55rpm,110rpm,165rpm和220rpm)下水凝胶分别0h和6h的横径观和纵径观;(h,i)在固定时间点(0h,6h,12h,18h和24h)测定水凝胶在55rpm速度下的横径和质量百分比;(j)在固定时间点(0h,6h,12h,18h和24h)时水凝胶在55rpm速度下的横径观和纵径观;(k)不同速度(55rpm,110rpm,165rpm和220rpm)下水凝胶6h的质量百分比;(l)在固定时间点(0h,6h,12h,18h和24h)测定水凝胶在55rpm速度下的纵径百分比;(m,n)不同速度(55rpm,110rpm,165rpm和220rpm)下水凝胶在6h的横径和纵径长度百分比。*p<0.05,**p<0.01vs.55rpm速度组。
图6为细胞的生物相容性和生存率结果;其中,(a)NCM460细胞在1-,2-,或4-天浸出液及在对照组培养液中培养3天的活/死染色图像;(b)通过CCK-8试验测定各组细胞在450nm波长下的OD值,各组间没有统计学差异;(c)采用CCK-8试验检测在1-,2-,或4-天浸出液中培养的NCM460细胞的生存率,各组间没有统计学差异。
图7为各组对DSS诱导结肠炎的治疗效果;其中:(a)各组中结肠肉眼观;(b)各组小鼠的结肠长度;(c)各组小鼠每天的体重百分比(%);(d)各组小鼠的粪便评分;(e)各组小鼠DAI评分;(f)最后一天测定各组小鼠的生存率;(g,h)通过ELISA测定各组小鼠血清中TNF-α和IL-6水平;(i-l)通过ELISA测定各组小鼠组织中TNF-α,IL-6,IL-1和IL-10水平,值通过均值±标准差表示,*p<0.05,**p<0.01,***p<0.001,****p<0.0001vs.G4-ASA/Dex组,+p<0.05,++p<0.01,+++p,++++p<0.0001vs.阴性对照组。
图8为结肠病理和组织学评分结果;其中:(a)第10天对结肠肠段进行H&E染色,第一行中箭头示组织破坏和中性粒细胞浸润,第三行中箭头示中性粒细胞;从上到下的放大倍数分别是×50,×100和×400;(b)各组小鼠组织学评分是炎症细胞浸润评分和组织损坏评分总和;(c)炎症细胞浸润评分;(d)组织损坏评分;(e)包含黏膜下层和肌层厚度结肠壁厚度评分,值通过均值±标准差表示,*p<0.05,**p<0.01,***p<0.001,****p<0.0001vs.G4-ASA/Dex组,+p<0.05,++p<0.01,+++p,++++p<0.0001vs.阴性对照组。
图9为免疫组化结果;其中:(a)各组中小鼠结肠组织中MPO免疫组化标记图,分别在×200和×400的放大倍数下的图像。第一行箭头代表MPO阳性炎症细胞在固有层中聚集,第二行箭头代表深染的细胞核阳性的炎症细胞;(d)各组中染色强度评分;(c)各组中阳性细胞数评分;(d)各组中染色强度评分和阳性细胞数评分的总和;(e)各组中阳性细胞百分比(%);值通过均值±标准差表示,*p<0.05,**p<0.01,***p<0.001vs.G4-ASA/Dex组,+p<0.05,++p<0.01vs.阴性对照组。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例对本发明进行具体描述,有必要指出的是,以下实施例仅仅用于对本发明进行解释和说明,并不用于限定本发明。本领域技术人员根据上述发明内容所做出的一些非本质的改进和调整,仍属于本发明的保护范围。
以下实施例中的部分缩略词的含义如下:
G4 PAMAM:第四代树形高分子聚酰胺-胺;5-ASA:5-氨基水杨酸;G4-ASA:纳米颗粒复合物;Dex-CHO:氧化葡聚糖;G4-ASA/Dex:经过超声制得的负载有5-氨基水杨酸的可注射黏附性水凝胶;G4/ASA/Dex:未进行超声简单混合得到的负载有5-氨基水杨酸的水凝胶;G4/Dex:未负载5-氨基水杨酸的水凝胶;DSS:葡聚糖硫酸钠;rpm:每分钟转数;MPO:髓过氧化物酶。
实施例(一)G4-ASA复合物的形成和药物溶解能力测评
具有氨基末端的第四代树形高分子聚酰胺-胺(简记为G4 PAMAM,参考文献:彭晓春.等.低代数聚酰胺-胺树状高分子的合成[J].吉首大学学报(自然科学版),2005(03):65-68.)溶解于去离子水中后再溶解不同浓度的5-ASA,将混合液超声2h形成稳定的G4-ASA复合物。用相机在宏观角度记录G4-ASA复合物和5-ASA悬浮液的外观。G4 PAMAM和G4-ASA纳米颗粒形态通过TEM(Transmission Election Microscopy)测定。电势电位通过和动态光散射(Dynamic light scattering)来测定。通过光谱仪(UV-vis spectrometer)测定G4PAMAM、5-ASA和G4-ASA的吸收光谱以确认G4-ASA复合物形成。为了评估树形高分子的药物溶解能力,称取3mg的5-ASA分别与100mL的不同浓度的G4水溶液或100mL去离子水混合后超声2h,10000rpm离心5分钟去除沉淀,取上清液,通过光谱仪(UV-vis spectrometer)测量上清液中5-ASA的溶解度(浓度)。(二)水凝胶的形成和物理化学特点
Dex-CHO的合成遵循已报道的方法,即3g葡萄聚糖以100mg/mL的浓度溶解在纯水中,随即逐滴加入NaIO
通过FTIR(Fourier Transform Infrared Spectroscop)分光光度计测得并确定Dex和Dex-CHO的转变,并确定其功能基团。将罗丹明染色的G4 PAMAM与Dex-CHO在玻璃瓶中充分混合,采用照相机分别拍摄下刚混合和混合后10min后的G4/Dex成胶过程。将水凝胶进行冻干喷金,通过SEM(Scanning Electron Microscopy)扫描评估水凝胶形态。罗丹红染色的G4/Dex通过1mm直径的针孔不断注射到空培养皿中,同时也注射到装满去离子水的离心管中。为了展示水凝胶自愈合特性,分别罗丹红和结晶紫染色的两块G4/Dex互相彼此接触10分钟,后加去离子水于两胶间分界线。将200mL G4/Dex水凝胶注入离心管,后加入pH分别为3.1,5.1和7.4的磷酸盐缓冲液。离心管在室温下放置分别在6h,12h,和24h时颠倒离心管观察水凝胶稳定度。宏观角度上测定G4/Dex水凝胶粘性时,用金属棒从肠道组织上拉起胶体直到胶体破裂。
(三)流变学测定
经流变仪测定水凝胶流变学特性。首先进行G4-ASA/Dex水凝胶时间依赖的流变学测定。对于拉力依赖的流变学,以10rad/s的角频率从0.1%拉力扫频到1000%拉力。通过对G4-ASA/Dex的连续不断应变测量进行触变学实验。在10rad/s的稳定角频率下分别交替采用5%和500%的拉力打破和恢复水凝胶。另外,G4/Dex和G4-ASA/Dex在5%拉力和10rad/s角频率下的系数被比较和观察。最后测定进行随时间发展的G4/Dex水凝胶的黏度。
(四)水凝胶和相关溶液的物理化学特性
通过平衡渗透实验法测定5-ASA从G4-ASA/Dex和G4/ASA/Dex中的释放率。G4/ASA/Dex的合成方法和G4-ASA/Dex类似,除了避免在混合G4 PAMAM和5-ASA后进行超声。同时,进一步测定5-ASA从G4 PAMAM中和水溶液中的释放率。将水凝胶或复合物溶液转至透析袋中(摩尔分子量低于3500Da)后,透析袋两端封闭后沉浸入45mL的PBS溶液。通过工作力良好的摇床在37℃下不断晃动透析袋外PBS溶液。在特定的时间点收集透析袋外PBS液1mL后再补充等量的新鲜PBS溶液。5-ASA累积释放量通过HPLC(High Performance LiquidChromatography)进行测定。为了探究酸性环境对5-ASA释放率的影响,透析袋外PBS溶液的pH值经盐酸调节至5.1。
为进一步研究水凝胶膨胀特性,200mL水凝胶冻干后一式三份并测量净重(W
(五)体外水凝胶的黏附
60μL水凝胶注射到实验小鼠的肠道中,小鼠经处死后观察水凝胶在肠道上的黏附程度。红染直径约1cm的G4/Dex水凝胶放置大鼠肠段上接触10分钟,以便与肠道组织充分反应。经以下步骤探索水凝胶对肠段的黏附程度:第一,垂直放置和颠倒黏有水凝胶的肠段来探究单纯位置的改变能否引起水凝胶移动。第二,60mLPBS水溶液在40s内注射出来并不断冲击G4/Dex水凝胶。第三,红染的3mm直径的水凝胶置于大鼠肠段表面并反应10分钟,后以不同方向扭曲肠段来探索黏附力的状况。将黏附有水凝胶的肠段浸泡于PBS溶液中30分钟后再次以不同方向扭转肠段探究是否仍保持黏附。第四,水凝胶黏附肠段后浸泡于PBS水溶液并在不同速度的摇床下晃动实现定量描述黏附力。速度为55rpm时,水凝胶的横径(与肠段纵轴垂直测量的水凝胶直径),纵径(与肠段纵轴平行测量的水凝胶直径),和质量分别在特定时间点(0h,6h,12h,18h和24h)被测定和记录。调节摇床速度分别为55rpm,110rpm,165rpm或220rpm,并于0h和6h测定直径和质量以探究速度对黏附力的影响。
(六)评估生物相容性
采用NCM460细胞(人结肠上皮细胞链)评估G4/Dex水凝胶的毒性。细胞以每孔2.5×10
(七)动物,实验设计和分组
9周龄C57BL/6J雌鼠养在无菌环境中,适应1周后随机分为6组:健康组,G4-ASA/Dex组,5-ASA灌胃组,5-ASA灌肠组,G4/Dex组和阴性对照组。除健康组正常饮食饮水未做任何处理外,其他处理组均在第0天到第9天予以4%(w/v)葡聚糖硫酸钠(Dextran sulfatesodium,DSS)诱导结肠炎,在第1天到第10天进行治疗。在G4/Dex和G4-ASA/Dex组治疗期间对应的是水凝胶行直肠给药:小鼠充分排便后用手固定,甘油润滑肛门后采用直径2mm的柔软毛细管缓慢轻柔地插入直肠至3.5cm。G4-ASA或G4 PAMAM与Dex-CHO以3:2的体积比混合后形成60μL水凝胶,通过毛细管经注射器缓缓注射于肠腔。随后毛细管保持于小鼠肠道内30s使水凝胶与肠道充分反应,并将小鼠倒立30s以免胶体泄露。5-ASA灌肠组除了注射的是5-ASA悬浮液采用类似方法处理。同样,5-ASA灌胃组用5-ASA悬浮液每天以灌胃处理。阴性对照组直接用60μLPBS灌肠处理。在5-ASA灌胃组,5-ASA灌肠组和G4-ASA/Dex组中,5-ASA的含量为0.96mg/次。
(八)临床评分
最终处死小鼠时,测量从直肠末端到盲肠末端的结肠长度以评估结肠炎和疾病严重程度。每天测定体重,粪便稠度,隐血情况直到第10天。第0天测定的结果作为临床评分的基线标准。粪便稠度评分和隐血测定方法如过往研究所述,如粪便评分标准:0分:成型粪便;1分:半成型粪便不黏附肛门;2分:不成型粪便黏附在肛门处;3分:液态粪便黏附在肛门处。DAI(disease activity index)评分依据体重下降百分比和粪便性质每日记录和评分。每日记录小鼠的死亡数量,最后一天总结并计算各组小鼠死亡率。
(九)炎症因子
第10天颈椎脱臼法处死小鼠后经眼球取血法收集小鼠血液,室温下放置10分钟后离心收取上清液以ELISA方法测定TNF-α和IL-6浓度评估小鼠系统炎症。为了测量结肠组织中炎症因子水平,结肠组织在含有1%NP-40和完全蛋白酶抑制剂中被机械性混匀,后通过ELISA(Enzyme Linked ImmunosorbentAssay)方法评估结肠组织中的TNF-α,IL-6,IL-1β和IL-10水平以反应局部组织中炎症。
(十)组织学评分
第10天处死小鼠后收集结肠,清洗后固定在10%的缓冲甲醛后包埋在石蜡中,最终通过苏木素&伊红染色法(H&E)对组织进行染色。请病理学专家采用盲审法进行组织学评分,标准如下:炎症细胞浸润(0-3分评分)和组织损伤评分(0-3)。固有层内偶尔发现炎症细胞记作1分;炎症细胞集中或伸展到粘膜下层记作2分;炎症细胞透壁性浸润记作3分。对于组织损伤,没有黏膜破坏记作0分;淋巴上皮性损伤记作1分;表面黏膜破坏或局部溃疡记作2分;黏膜破坏延展到肠壁的深层结构记作3分。组织学评分综合以上两项评分范围在0分(没有变化)到6分(广泛的浸润和组织损伤)。另外,我们通过测量黏膜下层和肌层的厚度总和的方式评估肠壁厚度。
(十一)免疫组化分析
以往研究中表明肠组织中对MPO抗原的免疫组化染色结果可评估炎症情况。结肠组织样本切成4μm厚,脱蜡后经二甲苯脱水并经过一系列酒精处理。采用3%H
(十二)统计学分析
采用Graphpad Prism(7.0版本)软件进行统计学分析。通过未配对的Student’st-test(双尾)法比较两组间均值;通过ANOVA法(One-wayAnalysis ofVariance)随后进行Tukey’spost hoc法评估三组或以上各组之间的差异。所有数据采用是均值±标准差的方式。P值小于0.05被认为具有统计学差异。
结果例(一)总体特点和G4-ASA的高溶解性
肉眼观将G4 PAMAM加入5-ASA悬浮液并经过充分超声后白色浑浊悬浮液明显地转变为透明水溶液,因此G4 PAMAM提高了5-ASA在去离子水中的溶解度(图2a-b)。TEM结果显示G4 PAMAM和G4-ASA复合物的粒径微小,呈圆点状散布,并呈现聚集现象(图2c)。通过动态光散射(dynamic light scattering)量化G4 PAMAM和G4-ASA的电势电位,证明G4-ASA复合物与G4 PAMAM相比具有更大的电势电位(图2d)。
UV-VIs吸收值表现出G4-ASA具备独立的,介于G4 PAMAM波和5-ASA波之间的独立波,表明5-ASA吸收入G4 PAMAM后形成了独立的G4-ASA复合物,使溶液波长从300nm(5-ASA)变为330nm(G4-ASA)(图2e)。不同浓度的G4溶液中5-ASA的饱和溶解度见表1。5-ASA在无G4PAMAM加入的情况下水溶解度仅为0.901mg/mL,随着G4 PAMAM加入浓度增加5-ASA溶解度呈直线式上涨,直到G4 PAMAM浓度30mg/mL时达23.132mg/mL(图2f,表1)。仅30mg/mL浓度的G4PAMAM即可有效地提升5-ASA水溶解度25.62倍,这表明G4-ASA在应用于结肠炎的治疗过程中出色的载药能力。
表1不同浓度G4溶液中5-ASA的饱和溶解度
(二)水凝胶的形成和特点
在Dex-CHO的FTIR图谱中,在1743cm
G4/Dex能通过直径1mm的针头不断以水凝胶纤维丝的形式注射出来(图3f),也可以注射入去离子水中并保持最初注射出的形态(图3g)。水凝胶可注射性证明在结肠炎治疗过程中能顺利地到达细小肠腔并发挥作用。肠道内持续产生的机械外力可引起水凝胶变形和破坏,因此水凝胶自愈合能力延长其使用时间,将破坏后的水凝胶恢复完整以阻止单次、大量药物活性分子的释放,提高给药效率。不同染料染色的G4/Dex水凝胶室温下彼此接触,10分钟后合成一块完整水凝胶,加入在表面的去离子水使两胶之间分界线模糊。沿着分界线切割水凝胶为两份后,红染部分遗留于在蓝染部分,证明两块相同质地水凝胶已经成功地融为一体(图3h)。一端黏附在肠道组织,另一端黏附在金属棒的G4/Dex水凝胶表现出了自身的黏性以及随着金属棒的离开表现出的对组织的黏附性(图3j)。
(三)G4/Dex水凝胶酸响应性降解
据报道IBD患者肠道内具有不同水平的酸化,因而进一步探究G4/ASA在pH为3.1,5.1和7.4PBS溶液中的稳定性。正如图3i所示,pH 3.1环境下PBS和G4/Dex水凝胶之间分界线在6h时模糊,G4/Dex 12h时开始溶解并在24h时完全溶解。相反,pH 7.4环境下,水凝胶和溶解间的分界线丝毫未发生模糊,直到24h水凝胶也未溶解。pH 5.1的情况介于两者之间,即胶体和液体间的分界线在12h时开始模糊,在24h时部分胶溶解并掉落于溶液中。总之,G4/Dex水凝胶在pH 7.4条件下中表现出出色的稳定性,在pH 5.1条件下逐渐降解,并在pH3.1条件下快速降解。这种酸响应的水凝胶溶解特性在肠道不同程度酸化的IBD患者体内起到促进的药物释放作用。
(四)G4-ASA/Dex水凝胶的流变学特性
我们通过动态流变仪评估了G4-ASA/Dex水凝胶的动态流变学特性。如图4所示,G4-ASA和Dex-CHO混合后的储能模量(G’)和损耗模量(G”)随时间不断增加,并在150s时达到两个值相等,表明混合物从液态转变为胶样粘弹性状态(图4a)。根据G4-ASA/Dex水凝胶的触变学行为,胶体在拉力为1000%时裂解(图4b)。500%拉力导致的破坏后的两块胶能在当拉力降低并维持在5%时恢复到最初的状态(图4c)。结果表明G4-ASA/Dex水凝胶具有良好的触变学特性。为了比较Dex-G4和G4-ASA/Dex水凝胶的动态流变学特点,我们发现Dex-G4的储能模量比G4-ASA/Dex要高,表明5-ASA的吸收降低水凝胶的机械强度。这可能是由于,5-ASA的吸收降低G4 PAMAM表面本该与Dex-CHO通过席夫碱反应的初级氨基基团,导致水凝胶黏性更低(图4d)。水凝胶的黏性随着时间增加,表明G4/Dex水凝胶在某种状态下保持黏性,可能构成水凝胶黏附组织的基础(图4e)。
(五)水凝胶的药物释放,吸水性和生物降解
本实验中探究了抗炎试剂5-ASA在不同条件下从复合物中的释放行为及影响因素。首先5-ASA从不同水凝胶中各具释放特点。pH7.4下,G4-ASA/Dex对5-ASA的24h累积释放量比G4/ASA/Dex要低(图4f),实际上,pH7.4下G4-ASA/Dex的5-ASA释放速率和累积释放量在与各组相比都是最低的。pH 5.1条件下G4-ASA/Dex的24h 5-ASA累积释放量比pH7.4下更高,表明5-ASA的释放可以通过改变pH环境以改变。酸性环境刺激的更快的5-ASA释放速度对于树形高分子-药物释放体系非常重要,促进不同程度酸化的IBD患者肠道内5-ASA释放。
我们进一步比较了5-ASA溶液和G4-ASA溶液对5-ASA的释放以排除Dex-CHO的影响(图4g)。24h时,5-ASA溶液几乎将所有的5-ASA药物以释放完毕,相比而言G4-ASA溶液展现出更低的累积释放量和更低的释放速率。这可能是由于G4 PAMAM将疏水性5-ASA包裹于内部疏水空腔,延缓了5-ASA的释放速度。G4-ASA/Dex(pH 7.4)与5-ASA和G4-ASA溶液相比展现出最低的累积释放量和释放速率(图4f,g),验证了在G4 PAMAM的加入延缓了5-ASA释放之后,Dex-CHO的加入将5-ASA的释放进一步延缓。通过这两步作用达到缓释5-ASA的效果。显然G4-ASA/Dex在缓释药物方面优于传统的5-ASA溶液和简单混合G4/ASA/Dex水凝胶。
浸入PBS液的G4-ASA/Dex和G4/Dex均在3.5h时达到了膨胀平衡,溶胀百分比分别为2278.75±205.61%和2453.89±442.28%(图4h),证明5-ASA的介入可能对胶体交联网络结构密度产生影响,从而使G4-ASA/Dex和G4/Dex在水穿透性和质量的改变上具有差别。水凝胶的生物可降解性对于在肠道疾病的应用至关重要。由于小鼠肠腔空间狭小并随时产生粪便进行排泄,不易降解的黏性的水凝胶可能会引起肠梗阻。G4-ASA/Dex和G4/Dex均可在PBS中分别维持至少33.20±11.39%和37.94±11.24%的重量百分比长达11小时(图4i)。同时在剩余的12小时里水凝胶降解速率下降并维持在稳定的剩余质量百分比。这保证水凝胶在头几个小时维持足够的胶体质量,随后在剩余时间里维持一个稳定的体内5-ASA释放微环境。水凝胶降解在保证足够胶体释放药物的同时为其他肠道内容物腾出空间以便排泄,直到第二天一块新胶的注入。
(六)水凝胶的肠组织黏附
图5a是G4-ASA/Dex对肠道黏附的原理图。注射60μL水凝胶到实验小鼠的肠道后,一块含水、胶冻样的、软而黏的水凝胶黏附于肠道上(图5b)。黏附于肠段的水凝胶被倒置和和垂直放置后水凝胶未发生移动和脱落,初步展示了G4/Dex水凝胶一定的黏附能力(图5c)。60mL PBS溶液在40秒之内注射出来产生的水流不断冲击水凝胶未使其发生移动和脱落等黏附力降低情况(图5d)。为了进一步证明水凝胶黏附性,直径3mm的水凝胶被紧密接触肠段后从不同方向扭转肠段,未发生胶体脱落。胶体连同肠段浸泡于水中30分钟后,再次扭转肠段未使水凝胶脱落(图5e)。这种扭转肠道组织引起的强力未使水凝胶脱落证明了牢固性的黏附性。为了定量水凝胶黏附,水凝胶黏附肠段被浸泡于PBS溶液并一同置于速度可调节的摇床上。增加摇床晃动速度加快了PBS溶液冲击水凝胶的频率。如图5f,g所示,所有水凝胶在0h均表现出平滑和清晰的边界,并于6小时后体积变小和边界模糊不易测量。同时,在55rpm(115.81±4.87%)转速下的水凝胶比速度110rpm(107.06±1.43%,p<0.01),165rpm(105.44±0.64%,p<0.05),220rpm(104.14±0.51%,p<0.01)时质量百分比更大(图5k)。圆形的水凝胶横径和纵径反映出残留于肠道组织上的胶体体积的变化程度。在55rpm(100±0.00%)速度下的横径百分比与165rpm(90±4.08%,p<0.05)和220rpm(88.33±2.36%,p<0.01)速度下的横径直径百分比相比更大(图5m)。各组之间纵径百分比都没有明显的差异(图5n)。无论是横径百分比还是纵径百分比在固定速度55rpm下均随时间表现出下降的趋势。尽管在6h时水凝胶由于膨胀作用质量百分比上升,但是随后发生迅速下跌(图5h,i,l)。肉眼观圆形水凝胶边界随着时间变得越来越模糊伴随体积越来越小(图5j)。虽然随着摇床速度的加快更多的水凝胶由于不断冲击作用导致肠道组织中丢失,但是仍然有大部分胶体由于出色的黏附作用残留于肠段。这种牢固的黏附力使载药水凝胶即使在长时间高机械强度下仍然在肠道上得以保留,为治疗肠道疾病的应用奠定了基础。
(七)体外生物相容性和细胞生存能力
生物相容性是应用生物材料的先决条件,如何使水凝胶注入肠道后既不会引起毒性也没有有害影响受到极大关注。活/死染色结果表明G4/Dex水凝胶对NCM460细胞几乎没有毒性。前两天各组之间几乎无差别,在第三天对照组展示出轻微增高的细胞密度(图6a)。各组均呈现细胞密度随着时间变大(图6a)。另外,各组都保持了NCM460细胞最初的梭形形状(图6a)。为了定量探究NCM460细胞的增殖情况,用水凝胶1-,2-,4-天的浸出液对NCM460细胞进行培养并行CCK-8试验。与对照组相比其他组细胞OD值相对更低但各组间无统计学差异,并且每组内OD值均随时间变化而增加(图6b)。各组细胞的每日生存率均高于80%,组间没有统计学差异(图6c),证明浸出液对NCM460细胞没有明显的生物毒性。G4/Dex水凝胶无毒并与上皮细胞具有相容性,可以在肠道疾病治疗上被广泛应用。
(八)结肠长度分析
结肠长度缩短是结肠炎进展和疾病严重性的一个指标。我们在第10天切掉整个结肠,测量和比较各组中从盲肠末端到直肠末端的结肠的长度。如图7a所示,与健康组相比各处理组的结肠长度显著缩短,盲肠部位显著变小,证明了以往研究中的DSS可以引起盲肠和结肠上部的结肠炎。图7b表现出了各组的结肠长度数值。健康组在各组中有更长的平均结肠长度(65.5±3.29mm,n=5),比阴性对照组更高(43.25±2.81mm,n=6,p<0.0001)。证明了未经治疗UC可以引起结肠缩短。和健康组一致的G4-ASA/Dex组(51.93±1.21mm,n=7)也表现出了相较于阴性对照组更长的结肠长度(P<0.0001)。5-ASA灌胃组(47.29±2.85mm,n=7)(p<0.05)比阴性对照组有更长的结肠长度。这些结果表明G4-ASA/Dex组在各个处理组之间具有更好的治疗效果。另外,G4-ASA/Dex组甚至表现出比5-ASA灌胃组(p<0.01)和5-ASA灌肠组(p<0.01)更长的结肠长度,从而证明G4-ASA/Dex具有比传统的药物具有更优越的治疗效果。Dex/G4组(43.83±1.89mm,n=6)与阴性对照组相比没有显著差异,证明是包裹在水凝胶中的5-ASA通过释放起到了抗炎作用,而不是水凝胶材料本身。
(九)体重丢失测量
体重丢失是评估DSS处理的小鼠结肠炎进展的一个关键指标,图7c展现了在实验小鼠体重丢失情况。健康组小鼠体重始终保持稳定,阴性对照组体重除了经过一个短暂的上升后在第4天就开始下降,而其他处理组的体重在前5天缓慢下降及从第5天开始显著下降。可见G4-ASA/Dex组的体重下降速度最低,阴性对照组和G4/Dex组最高,而5-ASA灌胃组和5-ASA灌肠组在两者之间。在第10天,G4-ASA/Dex组(89.88±5.48%,n=7)分别与阴性对照组(75.18±4.16%,n=7)(p<0.0001),5-ASA灌胃组(83.26±3.77%,n=7)(p<0.05)和5-ASA灌肠组(82.98±3.23%,n=7)(p<0.05)相比表现出显著更高的体重百分比,表明G4-ASA/Dex具有更优越的治疗效果。同时,5-ASA灌胃组(p<0.01)和5-ASA灌肠组(p<0.01)与阴性对照组相比在第10天表现出更好的治疗效果。体重丢失结果与结肠长度结果一致,共同证明G4-ASA/Dex与传统治疗方法相比具有更优越治疗作用。另外,G4-ASA/Dex组(91.31±5.20%,n=7)(p<0.0001)的体重百分在第9天就已经比阴性对照组(79.48±2.92%,n=6)相比更高,事实上G4-ASA/Dex组(93.66±4.62%,n=7)(p<0.001)甚至在第8天就已经比阴性对照组(84.85%±4.02%,n=6)更高。
(十)粪便评分和DAI评分
除了结肠长度和体重变化,另一个与UC有关的评判指标是粪便性状。阴性对照组早在第3天开始出现不正常粪便,同时其他各DSS处理组均在第4天出现粪便稀松。阴性对照组在第5天出现血便,其他各组紧接其后陆续出现隐血便和肉眼血便。如图7d所示,阴性对照组(2.67±0.47,n=6)具有最高的粪便评分,在第10天时与G4-ASA/Dex组(1.33±0.47,n=6)(p<0.001)相比有统计学差异。G4-ASA/Dex组与5-ASA灌胃组(2.17±0.69,n=6)(p<0.05)和5-ASA灌肠组(2.17±0.37,n=6)(p<0.05)相比粪便评分更低,表明新型水凝胶较传统治疗方法更优越。但是,在探究传统药物对结肠炎的治疗效果时只有5-ASA灌肠组比阴性对照组的粪便评分更低(p<0.05),尽管5-ASA灌胃组也有更低的粪便评分但无统计学差异。另外,G4-ASA/Dex组在第8天(1.33±0.47vs 2.33±0.47,p<0.01)和第9天(1.33±0.47vs 2.67±0.47,p<0.0001)的粪便评分分别显著高于阴性对照组。
DAI评分是综合体重丢失百分比、粪便性质和血便程度进行的(图7e)。除了健康对照组稳定保持低DAI分数,其他处理组几乎均在第3天开始出现逐步增长的DAI评分。在第9天,阴性对照组(8.67±0.94,n=6)比G4-ASA/Dex组(6.00±1.73,n=6)(p<0.01)的DAI评分更高。在第10天各组间DAI评分的差别被进一步拉大。G4-ASA/Dex组(5.83±1.57,n=6)的DAI评分显著高于G4/Dex组(10.00±1.41,n=6)(p<0.0001)和阴性对照组(10.50±1.12,n=6)(p<0.0001),这表明了G4-ASA/Dex的治疗效果。同时,G4-ASA/Dex组比5-ASA灌胃组(8.50±1.38,n=6)(p<0.01)和5-ASA灌肠组(8.50±0.50,n=6)(p<0.01)DAI评分也更高。同时,5-ASA灌胃组(p<0.05)和5-ASA灌肠组(p<0.05)与阴性对照组相比均有更高的DAI评分。
(十一)生存率分析
动物生存率表现了各组小鼠的生存状态(图7f)。阴性对照组在第10天只有60%的小鼠存活,在各组中具有最高的死亡率。G4/Dex组的小鼠比阴性对照组小鼠死亡数量上升速度慢,但最终仍达到和阴性对照组相同的最高死亡率(60%)。5-ASA灌胃组和5-ASA灌肠组具有相同的生存率(70%),尽管5-ASA灌肠组死亡数量下降得更加缓慢。G4-ASA/Dex组直到第8天才出现小鼠的死亡,并保持着最高的生存率(87.5%)。结果表明G4-ASA/Dex组可有效地保护小鼠免于死亡,并且在DSS诱导的结肠炎降低死亡率上具有重要意义。
(十二)血清中TNF-α和IL-6水平
血清中TNF-α和IL-6水平的评估是判断系统性炎症的重要参考依据,在DSS诱导的UC中两种指标表达增加。最终,5-ASA灌胃组(5.88±1.35pg/mL,n=3)(p<0.05),G4/Dexgroup组(6.85±2.44pg/mL,n=3)(p<0.01)和阴性对照组(8.50±1.56pg/mL,n=3)(p<0.001)的TNF-α水平显著高于G4-ASA/Dex组(3.37±1.59pg/mL,n=3)(图7g)。证明了G4-ASA/Dex与其他处理方式相比在降低系统性炎症上有更好的表现。其他各组的比较中5-ASA灌胃组(p<0.01)和5-ASA灌肠组(p<0.01)比阴性对照组TNF-α水平更低。血清中IL-6水平与TNF-α水平呈现一致的趋势,G4/Dex组(84.00±24.33pg/mL,n=3)(p<0.01)和阴性对照组(129.50±30.82pg/mL,n=3)(p<0.001)IL-6水平比G4-ASA/Dex组(11.63±5.69pg/mL,n=3)更高。5-ASA灌胃组(55.14±25.04pg/mL,n=3)(p<0.01)和5-ASA灌肠组(49.49±18.30pg/mL,n=3)(p<0.01)IL-6水平显著低于阴性对照组(图7h)。总之,TNF-α和IL-6水平的测定表明传统方式对肠炎具有一定的治疗效果,但是新型水凝胶在治疗DSS诱导的结肠炎中更具有明显的优越性(十三)TNF-α、IL-6、IL-1β和IL-10水平
组织中TNF-α、IL-6、IL-1β和IL-10水平是评估结肠炎状态的常规指标。组织中TNF-α炎症因子直接反应了局部炎症情况并且是反应结肠炎治疗效果的最敏感指标。5-ASA灌肠组(81.45±13.03pg/mL,n=4)(p<0.01),G4/Dex组(123.37±9.62pg/mL,n=3)(p<0.0001)以及阴性对照组(140.48±3.22pg/mL,n=3)(p<0.0001)与G4-ASA/Dex组(43.16±11.61pg/mL,n=5)相比TNF-α水平更高。5-ASA灌胃组(66.43±10.08pg/mL,n=4)(p<0.0001)和5-ASA灌肠组(p<0.0001)与阴性对照组相比具有更高的TNF-α水平(图7i)。关于IL-6,G4-ASA/Dex组(14.54±4.11pg/mL,n=4)相比于G4/Dex组(44.27±19.28pg/mL,n=4)(p<0.05)和阴性对照组(54.07±19.93pg/mL,n=4)(p<0.01)具有更低的水平(图7j)。各组中只有阴性对照组(76.61±13.29pg/mL,n=3)(p<0.01)和G4/Dex组(74.93±12.90pg/mL,n=3)(p<0.01)的组织中IL-1β水平上与G4-ASA/Dex组(29.20±1.06pg/mL,n=3)相比显著更高(图7k)。IL-10是一种抗炎细胞因子,组织中更高水平IL-10的意味着更低程度的炎症。如图7l所示,5-ASA灌胃组(119.29±30.42pg/mL,n=4)(p<0.05),5-ASA灌肠组(193.37±15.19pg/mL,n=3)(p<0.05),G4/Dex组(83.90±10.44pg/mL,n=3)(p<0.01)和阴性对照组(38.87±18.92pg/mL)(p<0.0001)与G4-ASA/Dex组(193.37±15.19pg/mL,n=3)相比更低。另外,5-ASA灌胃组(p<0.05)和5-ASA灌肠组(120.45±36.75pg/mL,n=3)(p<0.05)比阴性对照组IL-10水平更高。组织中的细胞因子水平趋势几乎与血清中的一致,均能显示出G4-ASA/Dex在治疗效应上的优越性。
(十四)组织学分析
在第10天处死小鼠后收集各组的结肠肠段进行H&E染色。与健康对照组相比,所有的DSS处理的小鼠表现出上皮细胞损坏和不同程度炎症细胞浸润。其中阴性对照组组织损坏最严重伴随上皮广泛丢失以充满炎症细胞的肉芽组织替代,同时炎性中性粒细胞在固有层中浸润并进一步延伸到黏膜下层甚至肌层(图8a)。G4/Dex组表现组织损坏和炎症细胞浸润的严重程度与阴性对照组类似。G4-ASA/Dex组组织破坏最轻,伴随的黏膜层和黏膜下层中性粒细胞的浸润更加局限。5-ASA灌胃组和5-ASA灌肠组的严重性介于以上的中间状态,伴随约一半的上皮丢失,炎症细胞浸润到黏膜下层但未突破肌层(图8a)。
综合上皮细胞丢失情况和炎症细胞浸润程度行组织学评分。健康对照组具有最低的组织学评分(图8b),不仅阴性对照组(5.60±0.49,n=6)p<0.0001)和G4/Dex组(5.17±0.69,n=6)(p<0.0001)与G4-ASA/Dex组(2.67±0.75,n=6)相比组织学评分更高,而且5-ASA灌胃组(4.17±0.37,n=6)(p<0.01)和5-ASA灌肠组(4.17±0.69,n=6)(p<0.01)与G4-ASA/Dex组组织学评分也更高。5-ASA灌胃组(p<0.01)和5-ASA灌肠组(p<0.01)比阴性对照评分更低,从而显示出传统治疗的有效性。至于在组织损伤评分和炎细胞浸润评分上,Ge-ASA/Dex组也显示了类似的治疗方面的优越性(图8c,d)。
由于肠道炎症会引起肠壁增厚,我们进一步通过测量结肠黏膜下层与肌层的厚度来评估结肠壁厚度(图8e)。G4-ASA/Dex组(111.95±14.46μm,n=3)与G4/Dex组(330.22±61.35μm,n=3)(p<0.01)和阴性对照组(295.23±56.90μm,n=3)(p<0.01)相比结肠更薄,表明新型水凝胶治疗后更乐观的肠道炎症情况。
(十五)免疫组化
髓过氧化物酶(MPO)活性反映了中性粒细胞浸润程度,G4/Dex组和阴性对照组显示出最多的炎症细胞聚集在黏膜下层,5-ASA灌胃组和5-ASA灌肠组有中等程度的炎症细胞聚集。G4-ASA/Dex组表现出最少炎症细胞密度,而健康对照组几乎没有显示染色的细胞(图9a)。对于染色强度的评分,各组间没有统计学差异(图9b)。阴性对照组(1.33±0.47,n=6)阳性细胞数评分比G4-ASA/Dex组更高(0.17±0.37,n=6)(p<0.01)。5-ASA灌胃组(0.67±0.47,n=6)(p<0.05)和5-ASA灌肠组(0.67±0.47,n=6)(p<0.05)比阴性对照组中阳性细胞数评分更低(图9c)。以上两评分之和的结果中,阴性对照组(3.67±0.94,n=6)比G4-ASA/Dex组(2.33±14.75,n=6)(p<0.05)显示为更高评分(图9d)。阳性细胞百分比显然表现出更为敏感的结果。G4-ASA/Dex组(3.07±2.14%,n=6)中阳性细胞百分比较5-ASA灌肠组(6.80±2.60%,n=6)(p<0.05)和阴性对照组(21.52±8.01%,n=6)(p<0.001)更低。同时5-ASA灌胃组(21.52±8.01%,n=6)(p<0.001)和5-ASA灌肠组(p<0.001)也比阴性对照组结果更好(图9e)。
- 一种可注射黏附性水凝胶及其制备方法与应用
- 可注射型组织黏附性止血改性壳聚糖材料、其水凝胶及其制备方法
