用于优化心室辅助设备中的流量的自适应速度控制算法和控制器
文献发布时间:2023-06-19 11:35:49
相关申请数据的交叉引用
本申请要求2018年9月25日提交的美国临时申请第62/736,013号在35 USC§119(e)下的权益,该申请的完整公开出于所有目的通过引用以其整体结合于此。
背景技术
心室辅助设备,被称为VAD,是植入式血泵,用于患者心脏无法提供足够的循环(通常被称为心力衰竭或充血性心力衰竭)的短期(即几天、几个月)和长期应用(即几年或一生)两者。根据美国心脏协会的统计,超过500万美国人患有心力衰竭,每年诊断出约670,000例新病例。患有心力衰竭的人经常会呼吸急促和疲劳。动脉阻塞或高血压的多年生活可使得心脏变得太虚弱,以致于无法向身体泵送足够的血液。随着症状恶化,发展为晚期心力衰竭。
患有心力衰竭(也称为充血性心力衰竭)的患者可在等待心脏移植时使用VAD或将VAD用作长期替代治疗(destination therapy)。在另一示例中,患者可以在他们自己的天然心脏恢复的同时使用VAD。因此,VAD可以补充虚弱的心脏(即部分支持)或可以有效替代自然心脏的功能。VAD可以植入患者体内,并由患者体内或体外的电源供电。
发明内容
以下呈现了本发明的一些实施例的简化概述以便提供对本发明的基本理解。本发明内容不是本发明的广泛概览。它并不旨在标识本发明的关键/决定性要素或者描述本发明的范围。它的唯一目的是以简化的形式呈现本发明的一些实施例,作为稍后呈现的具体实施方式的序言。
用于控制连续流血泵的旋转速度的方法以及相关的机械循环辅助系统基于泵血液流速(flow rate)来调节血泵的旋转速度,以防止在心室舒张期间通过血泵的流速下降到目标最小血流速以下。针对血泵的给定旋转速度,通过连续流血泵(诸如离心血泵或轴流血泵)的流速响应于血泵两端的压差的增大而减小。对于左心室辅助设备,血泵两端的压差基本上等于左心室压与主动脉压之间的压差。对于右心室辅助设备,血泵两端的压差基本上等于右心室压与肺动脉压之间的压差。在心室舒张期间,心室内的压力减小,从而增大血泵两端的压差,并导致通过血泵的流速减小。在一些情况下,患者的全身血压可随时间变化,使得心室舒张期间血泵两端的压差大幅度地更高,从而大幅度地减小了心室舒张期间通过血泵的流速。通过基于泵血液流速调节血泵的旋转速度,可以在患者血压的适当变化范围内防止通过血泵的流速下降到目标最小血液流速以下。
因此,在一个方面,一种控制心室辅助设备的连续流血泵的旋转速度以控制心室舒张期间通过血泵的血液流速的方法包括:经由心室辅助设备在患者的心动周期的第一段内将来自患者心室的血液泵送到患者的动脉。根据血泵的第一段操作模式,由控制器控制血泵在第一段内的旋转速率。由控制器监测通过血泵的血液流速。控制器基于通过血泵的血液流速来确定:继续在心动周期的第二段内根据第一段操作模式控制血泵的旋转速率是否将导致通过血泵的血液流速小于目标最小血液流速。响应于确定继续在第二段内根据第一段操作模式控制血泵的旋转速率将导致通过血泵的血液流速小于目标最小血液流速,控制器将血泵在第二段内的旋转速度控制成使得通过血泵的血液流速接近目标最小血液流速。
任何合适的控制器可在该方法中用来控制连续流血泵在心室舒张期间的旋转速度。例如,在一些实施例中,控制器包括与血泵成一体的速度控制器。在其他实施例中,控制器被设置在分开的植入式单元中,或者被设置在非植入的外部控制单元中。
在控制连续流血泵在心室舒张期间的旋转速度的方法中,控制器可以使用任何合适的方法来监测通过血泵的血液流速。例如,在一些实施例中,控制器可以经由泵电子器件监测通过血泵的血液流速,该泵电子器件可以与血泵成一体、被设置在分开的植入式单元中、和/或被设置在非植入的外部控制单元中。
在该方法的许多实施例中,目标最小血液流速可以是在患者的心室舒张期间通过血泵的任何合适的血液流速。例如,在该方法的许多实施例中,目标最小血液流速在大约0.0升/分钟至2.0升/分钟的范围内。在该方法的一些实施例中,目标最小血液流速在0.5升/分钟至1.5升/分钟的范围内。在该方法的一些实施例中,目标最小血液流速在0.8升/分钟至1.2升/分钟的范围内。对于另一实施例,血泵被控制以在舒张期中充当单向阀,其中净舒张血流(blood flow)为或接近0.0升/分钟。
在该方法的许多实施例中,控制器将通过血泵的当前血液流速与目标最小血液流速进行比较,以确定是继续按照第一段操作模式控制血泵的操作,还是切换到控制血泵的旋转速率以便以目标最小血液流速将血液泵送通过血泵。例如,在该方法的一些实施例中,关于继续在心动周期的第二段内根据第一段操作模式控制血泵的旋转速率是否将导致通过血泵的血液流速小于目标最小血液流速的确定包括:确定通过血泵的当前血液流速与目标最小血液流速之间的相对差值。在该方法的一些实施例中,关于继续在心动周期的第二段内根据第一段操作模式控制血泵的旋转速率是否将导致通过血泵的血液流速小于目标最小血液流速的确定进一步包括:确定通过血泵的血液流速的当前变化率。
可以结合血泵的任何合适的第一段操作模式来实践该方法。例如,在该方法的一些实施例中,血泵在第一段操作模式中的旋转速率是恒定的。在该方法的一些实施例中,改变血泵在第一段操作模式中的旋转速率以生成周期性脉动血流。在该方法的一些实施例中,周期性脉动血流与患者的心动周期同步。在该方法的一些实施例中,周期性脉动血流基于监测到的通过血泵的血流而与患者的心动周期同步。在该方法的一些实施例中,由控制器控制血泵在第一段内的旋转速率,以在心室收缩期间生成血压脉冲。
在许多实施例中,该方法进一步包括:在心动周期的适当点处切换回根据第一段操作模式来控制血泵的操作。例如,在该方法的许多实施例中,控制器通过如下方式来检测第二段的结束:检测用于以目标最小血液流速泵送血液的血泵旋转速率何时减小到或低于根据血泵的第一段操作模式的血泵旋转速率。响应于检测到第二段的结束,控制器切换回根据血泵的第一段操作模式来控制旋转速率。
在该方法的许多实施例中,第一段操作模式在心室收缩期间提供一定水平的循环支持,该水平的循环支持适合于锻炼患者的半月瓣和/或适合于尝试使患者脱离心室辅助设备。相应地,在该方法的许多实施例中,血泵在第一段操作模式中的旋转速率导致在心室收缩期间患者的半月瓣的打开和关闭。当尝试使患者脱离心室辅助设备时,可以将目标最小血液流速选择成防止通过血泵的大幅度的逆行流动速率的发生。例如,当尝试使患者脱离心室辅助设备时,目标最小血液流速可以在约0.0升/分钟至0.5升/分钟的范围内。在该方法的一些实施例中,当尝试使患者脱离心室辅助设备时,目标最小血液流速可以是0.0升/分钟。
任何合适的方法可由控制器用来监测通过血泵的血液流速。例如,在该方法的一些实施例中,控制器对通过血泵的血液流速的监测包括:基于血泵的旋转速率和指示血泵的功耗的操作参数来估计血液流速。在该方法的一些实施例中,控制器对通过血泵的血液流速的监测包括:基于血泵的旋转速率和指示血泵两端的压差的操作参数来估计血液流速。
在该方法的一些实施例中,控制器基于患者活动水平来更新目标最小血液流速。例如,在一些实施例中,该方法包括经由传感器测量指示患者活动水平的患者生理参数。在一些实施例中,控制器基于患者生理参数来更新目标最小血液流速。
在该方法的许多实施例中,可选择性地在由控制器根据第一段操作模式控制血泵在第一段内的旋转速率与经由第二段操作模式控制血泵在第一段内的旋转速率之间切换,并且反之亦然。可以使用任何合适的标准和/或临床医生输入来选择何时经由第一段操作模式或第二段操作模式控制血泵在第一段内的旋转速率。
在另一方面,机械循环辅助系统包括连续流血泵和控制器。连续流血泵可植入与患者的心室和动脉流体连通,以辅助血液从心室流向动脉。控制器可操作地连接到血泵。控制器可操作用于控制血泵的旋转速度以将血液从心室泵送到动脉。根据血泵的第一段操作模式控制血泵在第一段内的旋转速率。控制器可操作用于监测通过血泵的血液流速。基于监测到的通过血泵的血液流速,控制器确定:继续在心动周期的第二段内根据第一段操作模式控制血泵的旋转速率是否将导致通过血泵的血液流速小于目标最小血液流速。响应于确定继续在第二段内根据第一段操作模式控制血泵的旋转速率将导致通过血泵的血液流速小于目标最小血液流速,控制器将血泵在第二段内的旋转速度控制成使得通过血泵的血液流速接近目标最小血液流速。
在该系统的许多实施例中,目标最小血液流速可以是在患者的心室舒张期间通过血泵的任何合适的血液流速。例如,在该系统的许多实施例中,目标最小血液流速在大约0升/分钟至2.0升/分钟的范围内。在该系统的一些实施例中,目标最小血液流速在0.5升/分钟至1.5升/分钟的范围内。在该系统的一些实施例中,目标最小血液流速在0.8升/分钟至1.2升/分钟的范围内。对于另一实施例,血泵被控制以在舒张期中充当单向阀,其中净舒张血流为或接近0.0升/分钟。
在该系统的许多实施例中,控制器将通过血泵的当前血液流速与目标最小血液流速进行比较,以确定是继续按照第一段操作模式控制血泵的操作,还是切换到控制血泵的旋转速率以便以目标最小血液流速将血液泵送通过血泵。例如,在该系统的一些实施例中,关于继续在心动周期的第二段内根据第一段操作模式控制血泵的旋转速率是否将导致通过血泵的血液流速小于目标最小血液流速的确定包括:确定通过血泵的当前血液流速与目标最小血液流速之间的相对差值。在该系统的一些实施例中,关于继续在心动周期的第二段内根据第一段操作模式控制血泵的旋转速率是否将导致通过血泵的血液流速小于目标最小血液流速的确定进一步包括:确定通过血泵的血液流速的变化率。
在该系统的许多实施例中,可以使用血泵的任何合适的第一段操作模式。例如,在该系统的一些实施例中,血泵在第一段操作模式中的旋转速率是恒定的。在该系统的一些实施例中,改变血泵在第一段操作模式中的旋转速率以生成周期性脉动血流。在该系统的一些实施例中,周期性脉动血流与患者的心动周期同步。在该系统的一些实施例中,周期性脉动血流基于监测到的通过血泵的血流而与患者的心动周期同步。在该系统的一些实施例中,由控制器控制血泵在第一段内的旋转速率,以在心室收缩期间生成血压脉冲。
在该系统的许多实施例中,控制器在心动周期的适当点处切换回根据第一段操作模式来控制血泵的操作。例如,在该系统的许多实施例中,控制器通过如下方式来检测第二段的结束:检测用于以目标最小血液流速泵送血液的血泵旋转速率何时减小到或低于根据血泵的第一段操作模式的血泵旋转速率。响应于检测到第二段的结束,控制器切换回根据血泵的第一段操作模式来控制旋转速率。
在该系统的许多实施例中,第一段操作模式在心室收缩期间提供一定水平的循环支持,该水平的循环支持适合于锻炼患者的半月瓣和/或适合于尝试使患者脱离心室辅助设备。相应地,在该系统的许多实施例中,血泵在第一段操作模式中的旋转速率导致在心室收缩期间患者的半月瓣的打开和关闭。当尝试使患者脱离心室辅助设备时,可以将目标最小血液流速选择成防止通过血泵的大幅度的逆行流动速率的发生。例如,当尝试使患者脱离心室辅助设备时,目标血液流速可以在约0.0升/分钟至0.5升/分钟的范围内。在该系统的一些实施例中,当尝试使患者脱离心室辅助设备时,目标最小血液流速可以是0.0升/分钟。
在该系统的许多实施例中,控制器可以使用合适的方法来监测通过血泵的血液流速。例如,在该系统的一些实施例中,控制器基于血泵的旋转速率和指示血泵的功耗的操作参数来估计血液流速。在该系统的一些实施例中,控制器基于血泵的旋转速率和指示血泵两端的压差的操作参数来估计血液流速。
在该系统的一些实施例中,控制器基于患者活动水平来更新目标最小血液流速。例如,在一些实施例中,该系统包括传感器,该传感器测量指示患者活动水平的患者生理参数。在该系统的一些实施例中,控制器基于患者生理参数来更新目标最小血液流速。在该系统的一些实施例中,传感器包括心率传感器。在该系统的一些实施例中,传感器包括加速度计。
为了更完全地理解本发明的本质和优点,应当参考后续具体实施方式和附图。
附图说明
图1是根据许多实施例的机械循环支持系统的图示,该机械循环支持系统包括植入患者体内的心室辅助设备(VAD)。
图2是图1的循环支持系统的植入部件的分解图。
图3是图1的VAD的图示,该VAD附接到患者的心脏以增强患者左心室进行的血液泵送。
图4是图3的VAD的剖视图。
图5是图3的VAD的控制单元的实施例的图示。
图6是根据许多实施例的图5的控制单元的心侧视图,其示出了被包括在控制单元中的三轴加速度计。
图7是图1的机械支持系统的根据实施例的控制系统架构的示意图。
图8是在一心动周期内左心室压、左心房压和主动脉压的曲线图。
图9是在一心动周期内通过左心室辅助设备的血泵的血液流速的曲线图。
图10示出了离心血泵的典型压头-流量(head-flow)曲线。
图11示出了根据实施例的调节血泵的旋转速度以防止在心室舒张期间通过血泵的流速下降到的目标最小血液流速以下。
图12是根据实施例的在一心动周期内通过左心室辅助设备的血泵的血液流速的曲线图,其中血泵的速度在心室舒张期间被调节以防止通过血泵的流速下降到目标最小血液流速以下。
图13是根据实施例的在一心动周期内通过左心室辅助设备的血泵的血液流速的曲线图,其中血泵的速度在心室舒张期间被调节以防止通过血泵的逆行流动。
图14是根据实施例的在第一段操作模式下操作血泵以及切换到控制血泵以在心室舒张期间维持通过血泵的目标最小血液流速的方法的简化框图。
图15是根据实施例的控制血泵以在心室舒张期间维持通过血泵的目标最小血液流速的方法的简化框图。
图16是示出根据实施例的通过血泵的目标最小血液流速根据患者活动水平的变化的曲线图。
具体实施方式
在以下描述中,将描述本发明的各种实施例。出于解释的目的,阐述了具体配置和细节以便提供对实施例的透彻理解。然而,对本领域技术人员也将显而易见的是,没有这些具体细节也可实践本发明。此外,为了不混淆所描述的实施例,可省略或简化公知特征。
用于控制血泵的旋转速度的方法以及相关的机械循环辅助系统在心室舒张期间基于泵血液流速来调节血泵的旋转速度,以防止通过血泵的流速下降到目标最小血流速以下。在连续流血泵(诸如,在许多心室辅助设备(VAD)中所采用的)的情况下,通过血泵的血液流速取决于血泵的旋转速度以及血泵两端的压差。例如,对于左心室辅助设备(LVAD),血泵两端的压差大约等于主动脉压减去左心室压。在许多情况下,医生使用超声心动图和泵性能参数(诸如,估计的流量(flow))来设置VAD的旋转速度。然而,患者一旦出院,单一的设置即忘记的(set-it-and-forget-it)速度设置对于患者而言可能不是最佳的,因为体积状态可能改变,天然心脏可能改变形状,并且生理压力可能改变。本文所述的方法和系统采用自适应方法,其中血泵的旋转速度被调节以维持最佳的舒张期流动。
可以结合任何合适的连续流泵来实现本文描述的方法和系统。例如,一种特别合适的类型的血泵包括磁悬浮的转子/叶轮。在许多情况下,包括磁悬浮转子/叶轮的血泵能够进行本文所述的旋转速度调节,该旋转速度调节可在心室舒张期间在每个心动周期发生一次。通过在心室舒张期间调节血泵的旋转速度,可以降低连续流血泵(例如,离心LVAD)对血泵两端的压差变化的敏感性,从而防止在心室舒张期间通过血泵的血液流速过低。
在良好的流速估计精度的情况下,可以调节血泵的旋转速度以维持在心室舒张和/或心室收缩中最佳或期望的流动。在心室舒张期间,主动脉瓣关闭,并且血泵两端的压力梯度最大化。如果血泵的旋转速度保持恒定,则通过血泵的血液流速将在心室舒张期间达到其最小值。医生将通常将血泵的旋转速度设置得足够低,以确保通过血泵的血液流速足够低而不会引起心室抽吸事件。在通过血泵的血液流速已经足够低到避免抽吸事件的情况下,患者血压的任何后续增大将进一步降低心室舒张期间通过血泵的血液流速。本文所述的方法和系统调节血泵的旋转速度,以确保在血压的大范围变化内心室充分卸除负担(unload)。
可以在任何合适的操作场景中实现本文描述的方法和系统。例如,本文描述的方法和系统可以在正常操作场景期间使用,以便增加血泵的有效性。作为另一示例,可以与尝试使患者脱离VAD以使得能够移除设备相结合地使用该方法和系统。在许多情况下,尝试使患者脱离VAD包括暂时降低血泵的旋转速度,以暂时增加对患者天然心脏的负担。然而,血泵速度的降低可在许多情况下导致在心室舒张期间的通过血泵的逆行流动,这并不表示完全没有设备。因此,本文所述的方法和系统可在使患者脱离VAD的尝试期间采用,在该尝试中调节VAD的旋转速度,使得在心室舒张期间通过血泵的血液流速接近零(即,无舒张期卸除负担并且无逆行流动)。
现在参考附图,其中贯穿若干视图,相同的附图标记表示相同的部件,图1是机械循环支持系统10的图示,机械循环支持系统10包括植入患者身体12中的心室辅助设备(VAD)14。机械循环支持系统10包括VAD 14、心室套囊(cuff)16、流出套管18、外部系统控制器20和电源22。VAD 14可以被附接到左心室的尖端,如图所示,或者是右心室,或者分开的VAD可以被附接到心脏24的心室中的每一个。VAD 14可以能够泵送从肺循环递送到左心室的全部血流(即每分钟高至10升)。在下文并且在以下美国专利中更详细地描述适用于本发明的相关血泵:第5,695,471号、第6,071,093号、第6,116,862号、第6,186,665号、第6,234,772号、第6,264,635号、第6,688,861号、第7,699,586号、第7,976,271号、第7,997,854号、第8,007,254号、第8,152,493号、第8,419,609号、第8,652,024号、第8,668,473号、第8,852,072号、第8,864,643号、第8,882,744号、第9,068,572号、第9,091,271号、第9,265,870号和第9,382,908号,所有这些美国专利出于所有目的以其整体通过引用并入本文。参考图1和图2,VAD 14可以经由心室套囊16附接到心脏24,心室套囊16可以被缝合到心脏24并且耦合到VAD 14。在所示的实施例中,VAD 14的输出经由流出套管18连接到升主动脉,使得VAD 14有效地转移来自左心室的血液并将其推送到主动脉,以用于通过患者的血管系统的其他部分进行循环。
图1示出了在电池22供电的操作期间的机械循环支持系统10。穿过患者腹部28的传动系统26将VAD 14连接到外部系统控制器20,外部系统控制器20监测系统10的操作。在下文并且在以下专利中更详细地描述适用于本发明的相关控制器:美国专利第5,888,242号、美国专利第6,991,595号、美国专利第8,323,174号、美国专利第8,449,444号、美国专利第8,506,471号、美国专利第8,597,350号和美国专利第8,657,733号、EP 1812094以及美国专利公开第2005/0071001号和第2013/0314047号,所有这些专利出于所有目的以其整体通过引用并入本文。系统10可以由一个、两个或更多电池22供电。应当理解,尽管系统控制器20和电源22被示出为在患者身体12的外部/体外,但是传动系统26、系统控制器20和/或电源22可以部分或完全植入患者12体内,作为分开的部件或与VAD 14集成。在美国专利第8,562,508号和美国专利第9,079,043号中进一步描述了这种修改的示例,所有这些美国专利出于所有目的以其整体通过引用并入本文。
参考图3和图4,VAD 14具有圆形的壳体110,并且被示为植入在患者12体内,其中壳体110的第一面111抵靠患者的心脏24定位,并且壳体110的第二面113背向心脏24。壳体110的第一面111包括延伸到心脏24的左心室LV中的入口套管112。壳体110的第二面113具有斜切边缘114,以避免刺激可能与VAD 14接触的其他组织,诸如患者的隔膜。为了以紧凑的形式构造圆盘形壳体110的所示形状,VAD 14的定子120和电子器件130被定位在壳体的朝向第一面111的流入侧,并且VAD 14的转子140沿第二面113定位。定子120、电子器件130和转子140的这种定位允许边缘114沿着转子140的轮廓被斜切,例如,如至少在图3和图4中所示的。
参照图4,VAD 14在壳体110内包括分隔壁115,分隔壁115限定血流导管103。血流导管103从入口套管112的入口开口101延伸通过定子120延伸到由壳体110限定的出口开口105。转子140被定位在血流导管103内。定子120围绕转子140的第一部分140a(例如,围绕永磁体141)周向设置。定子120还相对于转子140被定位成使得在使用中,血液在到达转子140之前在血流导管103内流过定子120。永磁体141具有永磁北极N和永磁南极S,以用于转子140的组合的主动和被动磁悬浮以及用于转子140的旋转。转子140还具有第二部分140b,第二部分140b包括叶轮片143。叶轮片143被定位在血流导管的蜗壳107内,使得叶轮片143被定位成靠近壳体110的第二面113。
圆盘形壳体110进一步包括在第一面111与可移除盖118之间延伸的周向壁116。如图所示,周向壁116被形成为中空圆柱体,该中空圆柱体在周向壁116的相对部分之间具有宽度W。壳体110还在第一面111与第二面113之间具有小于宽度W的厚度T。厚度T为约0.5英寸至约1.5英寸,并且宽度W为约1英寸至约4英寸。例如,宽度W可以为大约2英寸,并且厚度T可以为大约1英寸。
周向壁116封围围绕分隔壁115和血流导管103的内部隔室117,其中定子120和电子器件130围绕分隔壁115设置在内部隔室117中。可移除盖118包括第二面113、斜切边缘114,并且限定出口开口105。盖118可以与周向壁116螺纹接合,以将盖118与周向壁116相接合地密封。盖118包括盖118的内表面118a,内表面118a限定与出口开口105流体连通的蜗壳107。
在内部隔室117内,电子器件130被定位成与第一表面111相邻,并且定子120被定位成在电子器件130的与第一表面111相对的一侧上与电子器件130相邻。电子器件130包括电路板131和携载在电路板131上的各种部件,用于通过控制对定子120的电力供应来控制VAD 14的操作(例如,磁悬浮和/或对转子的驱动)。壳体110被构造成将电路板131容纳在内部隔室117内,大体上与第一面111平行,以有效利用内部隔室117内的空间。电路板还朝向分隔壁115径向向内延伸并且朝向周向壁116径向向外延伸。例如,内部隔室117的大小通常被设计成不大于用于容纳电路板131、以及用于散热、材料膨胀、灌封材料和/或用于安装电路板131的其他元件的空间所需的大小。因此,靠近第一面111的壳体110的外部形状通常紧密地符合电路板131的形状,以提供不比电路板131的尺寸大很多的外部尺寸。
继续参考图4,定子120包括背铁121和极片123a-123f,极片123a-123f间隔开地布置在分隔壁115周围。背铁121围绕分隔壁115延伸,并形成为诸如钢铁之类的铁磁材料的大致平坦的盘,以便传导磁通量。背铁121被布置在控制电子器件130旁边,并为极片123a-123f提供基座。
极片123a-123f中的每一个都是L形的,并且具有用于生成电磁场以使转子140旋转的驱动线圈125。例如,极片123a具有第一腿部124a,该第一腿部124a接触背铁121并且从背铁121朝向第二面113延伸。极片123a还可具有第二腿部124b,第二腿部124b从第一腿部124a延伸穿过电路板131的开口朝向靠近转子140的永磁体141的位置的分隔壁115。在一方面,极片123a-123f的第二腿部124b中的每一个插入穿过电路板131的开口。在一方面,极片123a-123f的第一腿部124a中的每一个插入穿过电路板131的开口。在一方面,电路板的开口封围极片123a-123f的第一腿部124a。
在一般方面中,VAD 14可以包括一个或多个霍尔传感器,该一个或多个霍尔传感器可以提供输出电压,该输出电压与位于极片123a-123f中的至少一个与永磁体141之间的磁场强度成正比,并且输出电压可以向VAD 14的控制电子器件130提供反馈,以确定转子140和/或永磁体141是否不在其用于VAD 14的操作的预期位置处。例如,可以调整转子140和/或永磁体141的位置,例如,可以朝着血流导管103的中心或朝着定子120的中心推或拉转子140或永磁体141。
极片123a-123f中的每一个还具有一个悬浮线圈127,用于生成电磁场来控制转子140的径向位置。驱动线圈125和悬浮线圈127中的每一个包括围绕极片123a-123f的导体的多个绕组。特别地,驱动线圈125中的每一个都围绕极片123中的两个相邻极片(诸如,极片123d和123e)缠绕,并且每个悬浮线圈127围绕单个极片缠绕。驱动线圈125和悬浮线圈127围绕极片123的第一腿部缠绕,并且在使用期间通过使电流流过线圈125和127而生成的磁通量被传导通过极片123的第一腿部和第二腿部以及背铁121。定子120的驱动线圈125和悬浮线圈127以相对的对(pair)布置,并且被控制以通过生成与永磁体141的永磁极S和N相互作用的电磁场来驱动转子并使转子140径向悬浮。因为定子120包括驱动线圈125和悬浮线圈127两者,所以仅需要单个定子就可以仅利用被动和主动磁力来使转子140悬浮。在该配置中,永磁体141仅具有一个磁矩,并且由整体式永磁体141形成。例如,可以如在美国专利第6,351,048号中所讨论的那样控制定子120,该美国专利的全部内容出于所有目的通过引用并入本文。控制电子器件130和定子120经由线缆119(图3)从远程电源接收电功率。其他相关专利,即美国专利第5,708,346号、第6,053,705号、第6,100,618号、第6,222,290号、第6,249,067号、第6,278,251号、第6,351,048号、第6,355,998号、第6,634,224号、第6,879,074号和第7,112,903号,所有这些专利出于所有目的以其整体通过引用并入本文。
转子140被布置在壳体110内,使得其永磁体141位于叶轮片的上游且更靠近入口开口101的位置。永磁体141被容纳在血流导管103内靠近极片123的第二腿部124b,以通过永磁体141与极片123的铁磁材料的相互作用来提供被动轴向对中力(centering force)。当转子140在分隔壁115内居中时,转子140的永磁体141和分隔壁115在永磁体141和分隔壁115之间形成间隙108。间隙108可以是从大约0.2毫米到大约2毫米。例如,间隙108可以是大约1毫米。永磁体141的北永久磁极N和南永久磁极S在转子140和定子120之间提供永久磁引力,该永久磁引力用作被动轴向对中力,该被动轴向对中力倾向于使转子140大体维持在定子120内居中,并且倾向于抵抗转子140朝向第一面111或朝向第二面113移动。当间隙108较小时,永磁体141与定子120之间的磁引力较大,并且间隙108的尺寸被设计成用于允许永磁体141提供具有如下幅度的被动磁轴向对中力:足以限制转子140接触分隔壁115或盖118的内表面118a。转子140还包括护罩145,护罩145覆盖叶轮片143的面向第二面113的端部,该护罩145有助于将血流引导到蜗壳107中。当转子140被定子120悬浮时,护罩145和盖118的内表面118a在护罩145和内表面118a之间形成间隙109。间隙109可以是从大约0.2毫米到大约2毫米。例如,间隙109可以是大约1毫米。
当血液流过血流导管103时,血液流过通过永磁体141形成的中心孔141a。血液还流过转子140与分隔壁115之间的间隙108,并流过护罩145与盖118的内表面108a之间的间隙109。间隙108和109足够大,以允许足够的血液流动以限制血块形成,如果允许血液停滞,则可能发生血块形成。间隙108和109也足够大以限制作用在血细胞上的压力,使得当流过VAD 14时血液不会受到损害。由于间隙108和109的大小限制了作用在血细胞上的压力,因此间隙108和109太大而不能提供有意义的流体动力悬浮作用。也就是说,血液不充当间隙108和109内的轴承,并且转子仅被磁悬浮。在各种实施例中,间隙108和109的大小和尺寸被设计成使得流过间隙的血液形成膜,该膜提供流体动力悬浮作用。以这种方式,转子可以通过磁力、流体动力或两者而被悬浮。
由于转子140通过对如上所讨论的悬浮线圈127的主动控制而被径向地悬浮,并且由于转子140通过永磁体141和定子120的被动相互作用而被轴向地悬浮,所以在第二面113附近不需要磁场生成的转子悬浮分量。用于转子悬浮的所有部件(即,悬浮线圈127和极片123)并入定子120中允许将盖118的轮廓被设计为叶轮片143和蜗壳107的形状。附加地,所有转子悬浮部件并入定子120中消除了对从隔室117延伸到盖118的电连接器的需要,这允许盖易于安装和/或移除并且消除了潜在的泵故障源。
在使用中,定子120的驱动线圈125通过极片123生成生电磁场,该电磁场选择性地吸引和排斥转子140的磁北极N和磁南极S,以使转子140在定子120内旋转。例如,一个或多个霍尔传感器可感测转子140和/或永磁体141的当前位置,其中一个或多个霍尔传感器的输出电压可用于选择性地吸引和排斥转子140的磁北极N和磁南极S,以使转子140在定子120内旋转。当转子140旋转时,叶轮片143迫使血液进入蜗壳107,使得血液被迫使从出口开口105排出。附加地,转子通过入口开口101将血液吸入VAD 14中。当血液通过转子140的叶轮片143的旋转而被吸入血泵时,血液流经入口开口101,并流经控制电子器件130和定子120朝向转子140。血液流过永磁体141的孔141a,并在叶轮片143、护罩145和永磁体141之间流动,并进入蜗壳107。血液还围绕转子140流动,流过间隙108并且流过护罩145与盖118的内表面118a之间的间隙109。血液通过出口开口105离开蜗壳107,出口开口105可以被耦合到流出套管。
图5示出了根据许多实施例的用于VAD 14的霍尔传感器组件200。霍尔传感器组件200包括印刷电路板(PCB)202和由印刷电路板202支撑的六个单独的霍尔效应传感器208。霍尔效应传感器208被配置成转导(transduce)VAD 14的转子140的位置。在所示的实施例中,霍尔效应传感器208被支撑为相对于PCB 202正交地竖立,并且霍尔效应传感器208中的每一个的最长边缘被对齐以相对于PCB 202的表面具有正交分量。霍尔效应传感器208中的每一个生成输出电压,该输出电压正好与位于极片123a-123f中的至少一个与永磁体141之间的磁场的强度成正比。由霍尔效应传感器208中的每一个输出的电压由控制电子器件130接收,该控制电子器件130处理传感器输出电压以确定转子140的位置和取向。转子140的所确定的位置和取向用于确定转子140是否不在用于VAD 14的操作的预期位置处。例如,可以调整转子140和/或永磁体141的位置,例如,可以朝着血流导管103的中心或朝着定子120的中心推或拉转子140或永磁体141。转子140的所确定的位置还可以用于确定转子偏心率或目标转子偏心率(该转子偏心率或目标转子偏心率可以如美国专利第9,901,666号中所描述的那样使用,该美国专利的全部内容出于所有目的通过引用以其整体并入本文),以估计由VAD 14泵送的血液的流速。
图6是根据许多实施例的控制电子器件130的心侧视图,其示出了被包括在控制电子器件130中的加速度计210。在许多实施例中,加速度计210是三轴加速度计,该三轴加速度计在三个正交轴(即,X轴212、Y轴214和Z轴216)上测量由控制电子器件130(以及因此由VAD 14)所经历的加速度。在所示的实施例中,X轴212和Y轴214各自被取向成与转子140的旋转轴正交,并且Z轴216平行于转子140的旋转轴。
图7是机械支持系统10的控制系统架构的示意图。传动系统26将植入的VAD 14耦合到外部系统控制器20,该外部系统控制器20经由各种软件应用监测系统操作。
VAD 14包括控制电子器件130、霍尔效应传感器组件200、电机定子120、转子/叶轮140。在所示的实施例中,控制电子器件包括处理器218、存储设备220(该存储设备220可以包括只读存储器和/或随机存取存储器)、加速度计210、电机控制单元222和通信单元224。在一些实施例中,存储设备220存储可由处理器218执行以用于各种功能的一个或多个软件应用。例如,一个或多个软件应用可以实现对电机控制单元222的控制,以在操作期间实现转子140的径向悬浮和旋转驱动。在一些实施例中,如本文所述,一个或多个程序实现对来自加速度计210的输出和/或VAD 14的操作参数(例如,驱动电流、旋转速度、流速、叶轮两端的压差)的处理,以检测和/或测量患者生理事件和/或活动(例如,患者取向、患者活动水平、心脏壁运动、心音、心率、呼吸率、隔膜收缩、心动周期计时)。如本文所述,一个或多个程序可以实现对电机控制单元222的控制,以使VAD 14的输出的变化与患者的心动周期计时同步。例如,VAD 14的输出可以在心室收缩期间的一时间段内增加,以便增加经由心室收缩而发生的血液泵送,从而降低心室上的相关负荷。一个或多个程序可以实现对电机控制单元222的控制,以基于患者活动水平来改变VAD 14的输出。例如,在许多实施例中,VAD 14的输出响应于增加的患者活动而增加,并且响应于减少的患者活动而减少。一个或多个程序还可以用于实现对来自加速度计210的输出和/或VAD 14的操作参数的处理,以生成如本文所述的患者监测数据和/或VAD监测数据。通信单元224提供VAD 14与外部系统控制器20之间的有线和/或无线通信。在一些实施例中,电机控制单元222被包括在VAD 14中。在一些实施例中,电机控制单元222被包括在外部系统控制器20中。
外部系统控制器20进而可以被耦合到电池22或被耦合到连接到AC电插座的AC功率模块30。外部系统控制器20可以包括处理器226、存储设备228(存储设备228可以包括只读存储器和/或随机访问存储器)、用于为系统供电(例如当电池22耗尽时)的紧急备用电池(EBB)、一个或多个显示单元230、一个或多个输入/输出设备232以及通信单元234,该通信单元234可具有蓝牙功能以用于无线数据传输。具有系统监测器32的外部计算机(该外部计算机可以由临床医生或患者操作)可以进一步被耦合到循环支持系统10,以用于:配置外部系统控制器20、植入的VAD 14和/或患者特定参数;更新外部系统控制器20和/或植入的VAD14上的软件;监测系统操作;和/或作为系统输入或输出的管道。
在一些实施例中,存储设备228存储可由处理器226执行以用于各种功能的一个或多个软件应用。例如,一个或多个软件应用可以实现对电机控制单元222的控制,以在操作期间实现转子140的径向悬浮和旋转驱动。在一些实施例中,如本文所述,一个或多个程序实现对来自加速度计210的输出和/或VAD 14的操作参数(例如,驱动电流、旋转速度、流速、叶轮两端的压差)的处理,以检测和/或测量患者生理事件和/或活动(例如,患者取向、患者活动水平、心脏壁运动、心音、心率、呼吸率、隔膜收缩、心动周期计时)。如本文所述,一个或多个程序可以实现对电机控制单元222的控制,以使VAD 14的输出的变化与患者的心动周期计时同步。例如,VAD 14的输出可以在心室收缩期间的一时间段内增加,以便增加经由心室收缩而发生的血液泵送,从而降低心室上的相关负荷。一个或多个程序可以实现对电机控制单元222的控制,以基于患者活动水平来改变VAD 14的输出。例如,在许多实施例中,VAD 14的输出响应于增加的患者活动而增加,并且响应于减少的患者活动而减少。一个或多个程序还可以用于实现对来自加速度计210的输出和/或VAD 14的操作参数的处理,以生成如本文所述的患者监测数据和/或VAD监测数据。通信单元234提供外部系统控制器20与VAD 14和/或系统监测器32之间的有线和/或无线通信。
图8是在一心动周期内的左心室压302、左心房压304和主动脉压306的曲线图。在心动周期开始时,房室(AV)瓣打开,并且血液分别从左心房和右心房流入左心室和右心室。在心室收缩期间,心室收缩会关闭AV瓣并增大心室压。在左心室收缩期间,左心室压302增大到略大于主动脉压306的水平,从而导致自然主动脉瓣打开。左心室的持续收缩将血液从左心室通过自然主动脉瓣喷射到主动脉中。血液向主动脉内的喷射会升高主动脉压306,该主动脉压306稍低于来自左心室的血液喷射的初始部分上的左心室压302,而略高于来自左心室的血液喷射的末端部分上的左心室压302。在从左心室向主动脉的血液喷射结束时,自然主动脉瓣响应于左心室压302略小于主动脉压306而关闭。左心室的后续松弛导致左心室压302显著降低到左心室压302略小于左心房压304的水平,从而导致左AV瓣打开。
通过心室辅助设备的血泵的血液的流速通常在患者的心动周期内响应于血泵两端的压差在该心动周期期间的变化而变化。例如,图9是在患者的心动周期内通过左心室辅助设备的血泵的示例血液流速308的曲线图。所示的血液流速308用于血泵的恒定旋转速度操作。图9中的血液流速308与图8的心动周期对齐,以更好地将血液流速308的变化与图8所示的压差进行关联。在心动周期开始时,血液流速308由于主动脉压306与左心室压302之间的相对大的差异而相对低。在心室收缩的初始部分期间,左心室压302的增大会降低主动脉压306与左心室压302之间的差异,从而导致血液流速308由于血泵两端的压差减小而对应地增大。在血液从左心室喷射到主动脉期间,随着主动脉压306相对于左心室压302逐渐增大,血液流速308逐渐减小。在关闭自然主动脉瓣之后,响应于由于心室压302减小而导致的血泵两端的压差增大,血液流速308显著减小。在AV瓣打开之后,响应于主要是由于主动脉压306的逐渐减小而导致的血泵两端的压差逐渐减小,血液流速308逐渐增大。
VAD的连续流血泵的旋转速度通常在心室舒张期间被限制,以避免引起抽吸事件,在抽吸事件中血液以过大的速率从心室中被抽取。对应地,医生将通常将血泵的旋转速度设置得足够低,以确保通过血泵的血液流速足够低而不会引起心室抽吸事件。
在通过血泵的血液流速已经足够低到避免抽吸事件的情况下,患者血压的任何后续增大将进一步降低心室舒张期间通过血泵的血液流速。连续流血泵对血泵两端的压差在血泵的压差能力的上限处的增大特别敏感。例如,图10示出了以恒定旋转速度操作的离心血泵的典型的压头-流量曲线。在低压差下,通过血泵的流速310较高。在血泵的压差能力的上限下,通过血泵的流速310为零。在低流速310下,血泵两端的压差的相对小的变化导致流速310的相对大的变化。如本文所述,当在VAD中使用并以恒定的旋转速度操作时,离心血泵的速度将被设置成使得在心室舒张期间流速310足够低以避免引起抽吸事件。然而,以被选择为在心室舒张期间产生相对低的流速的恒定速度操作离心血泵可导致:在心室舒张期期间响应于患者血压相对小的变化而产生流速310的相对大的变化。
心室舒张期间流速310的变化可导致通过血泵的流速不合适。例如,患者的血压的大幅减小(相对于与心室舒张期间的血泵的设定的旋转速度相对应的患者血压)可导致过高的通过血泵的流速310,该过高的通过血泵的流速310引起抽吸事件。另一方面,患者血压的大幅增大可导致过低的通过血泵的流速310,该过低的通过血泵的流速310不足以使心室在心室收缩之前卸除负担(unload)。此外,尤其是当血泵以比正常情况下更低的旋转速度操作以在尝试使患者脱离VAD期间提供减少的支持时,患者血压的大幅增大可导致通过血泵的逆行流动,从而导致在尝试使患者脱离VAD期间,实际上给患者的心脏增加了非自然的额外负担。
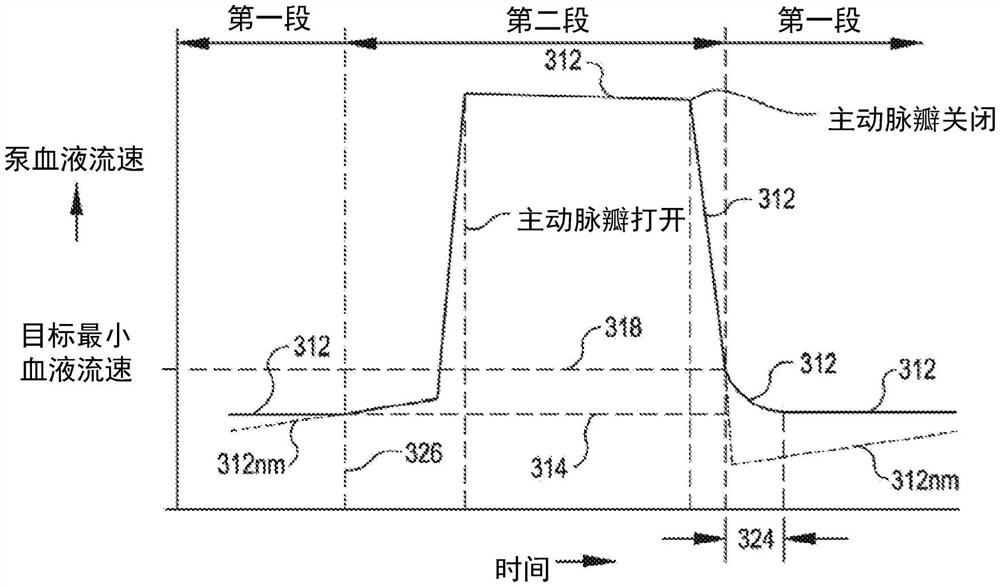
在许多实施例中,在心室舒张期期间调节VAD的血泵的旋转速度,以防止在心室舒张期期间通过血泵的不合适的流速的发生。任何合适的方法可用于监测通过血泵的血液流速。例如,可以通过基于提供给血泵的驱动电流、血泵的转子的旋转速度、血泵入口侧上的血压、和/或血泵出口侧上的血液,使用已知的方法估计血液流速,来监测通过血泵的血液流速。入口侧压力传感器和/或出口侧压力传感器可以用于测量入口侧血压和/或出口侧血压。可以基于提供给血泵的驱动电流、血泵的转子的旋转速度以及血泵两端的压差来估计血液流速。可以使用任何合适的方法来估计或测量血泵两端的压差。例如,可以如美国专利公开第2017-0021070号中所描述的那样来估计和/或测量血泵两端的压差和/或血液流速,该美国专利公开的全部内容出于所有目的通过引用以其整体并入本文。图11示出了调节血泵的旋转速度以防止在心室舒张期间通过血泵的流速312降到目标最小血液流速314以下。在所示的实施例中,在心室收缩期间血泵以恒定速度316操作。当关闭自然主动脉瓣之后血泵两端的压差增大时,通过血泵的流速312减小。在整个心室舒张期中血泵以恒定速度316操作的情况下,如果患者血压大幅度地大于与恒定速度316的选择相对应的患者血压,则流速312可降至目标最小血液流速314以下。此外,特别是在恒定速度316被选择以在尝试使患者脱离VAD期间向患者提供降低的支持时,通过血泵的流速312可能甚至在心室舒张期间在缺少对血泵的旋转速度的调节的情况下变成负值。在所示的实施例中,监测通过血泵的血液流速312,并且当流速312减小到初始流速318以下时,增大血泵的旋转速度,使得流速312在合适的转换时段内从初始流速318变为目标最小流速314。在所示的实施例中,血泵的旋转速度从恒定速度316、通过旋转速度320增加到旋转速度322。考虑到血泵的旋转速度可以以合适的速率增大的速率,初始流速318可被选择成提供合适的转换时段。在转换时段之后,血泵的旋转速度随后可被调节以使得通过血泵的流速312在心室舒张的适当部分内维持在目标最小血液流速314。例如,在一些实施例中,只要针对等于目标最小血液流速314的流速312的旋转速度大于血泵在心室收缩期间操作的恒定速度316,就调节血泵的旋转速度。在这样的实施例中,当针对等于目标最小流速的流速312的旋转速度变为小于恒定速度316时,血泵的旋转速度可以恢复为恒定速度316。
图12是根据实施例的在一心动周期内通过左心室辅助设备的血泵的血液流速312的曲线图,其中血泵的旋转速度在心室舒张期间被调节以防止通过血泵的流速下降到目标最小血液流速314以下。在心动周期的第一段期间,根据血泵的第一段操作模式(例如,恒定速度模式、脉动模式、脱离模式)来控制血泵的旋转速度,并且在心室舒张期间在该心动周期的第二段内调节血泵的旋转速度,以防止通过血泵的流速下降到目标最小血液流速314以下。在所示的实施例中,在血液从左心室喷射到主动脉期间,由于血泵两端的对应的低压差,血液流速312接近最大。在关闭自然主动脉瓣之后,流速312响应于左心室压302与主动脉压306之间的相对压力的对应增大而减小。通过监测流速312,可以在流速312减小到初始流速318时开始增大血泵的旋转速度。通过增大血泵的旋转速度,流速312的减小速率在转换时间段324内降低为零。在转换时间段324之后,调节血泵的旋转速度以在心动周期的适当部分内将流速312维持在目标最小血液流速314。在许多实施例中,用于将流速312维持在目标最小血液流速的旋转速度在恢复点326处降低到按照血泵的第一段操作模式的血泵旋转速度。可以终止对血泵的旋转速度的调节,并且对血泵的旋转速度的控制可在恢复点326处恢复为按照血泵的第一段操作模式来被控制。为了说明血泵的旋转速度的调节对通过血泵的流速312的影响,图12示出了:在整个心动周期中按照血泵的第一段操作模式来控制血泵的旋转速度的情况下将出现的流速312nm。流速312nm在恢复点326处增加回到目标最小血液流速314。
图13是根据实施例的在一心动周期内通过左心室辅助设备的血泵的血液流速312的曲线图,其中血泵的速度在舒张期间被调节以防止通过血泵的逆行流动。在所示的心动周期内,在心动周期的第一段期间根据脱离的第一段操作模式来控制血泵的旋转速度,并且在心动周期的第二段内在心室舒张期间调节血泵的旋转速度,以防止通过血泵的逆行流动。脱离的第一段操作模式提供了有限的循环支持,以便增加由患者心脏完成的总体血液泵送工作量的百分比。脱离的第一段操作模式可以采用任何合适的基本第一段操作模式,诸如恒定速度模式或脉动模式。在许多情况下,血泵在脱离的第一段操作模式中的旋转速度低于血泵在较高支持水平的第一段操作模式中的旋转速度,并且导致在心室舒张期间通过血泵的血液流速312低于针对较高支持水平的第一段操作模式的通过血泵的血液流速。在所示的心动周期期间,在血液从左心室喷射到主动脉期间,由于血泵两端的对应的低压差,血液流速312接近最大。在关闭自然主动脉瓣之后,流速312响应于左心室压302与主动脉压306之间的相对压力的对应增大而减小。通过监测流速312,可以在流速312减小到初始流速318时开始增大血泵的旋转速度。通过增大血泵的旋转速度,流速312的减小速率在转换时间段324内降低为零。在转换时间段324之后,调节血泵的旋转速度,以将流速312维持为等于在心室舒张期间适合于使患者脱离VAD的目标最小血液流速。在所示的实施例中,血泵的旋转速度被调节,使得流速312在心动周期的第二段内为零。在许多实施例中,用于将流速312维持为零的旋转速度在恢复点326处降低到按照血泵的脱离第一段操作模式的血泵旋转速度。可以终止对血泵的旋转速度的调节,并且对血泵的旋转速度的控制可在恢复点326处恢复为按照血泵的脱离第一段操作模式来被控制。为了说明血泵的旋转速度的调节对通过血泵的流速312的影响,图13示出了:在整个心动周期中按照血泵的脱离第一段操作模式来控制血泵的旋转速度的情况下将出现的流速312nm(该流速312nm是逆行的)。流速312nm在恢复点326处增加回零。
可以通过将任何合适的初始流速偏移量添加到适用的目标最小血液流速314来确定初始流速318。例如,可以根据在对应的半月瓣关闭之后观察到的血液流速312正在减小的速率,来选择合适的初始流速偏移量。对于血液流速312的更快的下降速率,可以使用较大的初始流速偏移量来抵消血液流速312的更快的下降速率。同样地,对于血液流速312的较慢的下降速率,可以使用较小的初始流速偏移量。可以根据观察到的血液流速312减小的速率,将合适的初始速率偏移量存储在存储器中存储在查找表中。替代地,可以对血泵进行编程以确定对血泵的旋转速率的适当调节,以阻止所观察到的血液流速212到目标血液流速的下降。例如,血泵可以配备有机器学习能力,以控制血泵的旋转速度的调节,以产生从下降的血液流速312到目标血液流速的适当转换。
图14是根据实施例的方法400的简化框图,方法400用于在心动周期的第一段内以第一段操作模式操作血泵并且在该心动周期的第二段内切换到控制血泵以在心室舒张期间维持通过血泵的目标最小血液流速。任何合适的机械循环辅助系统(诸如本文所述的系统)可用于实践方法400。本文中描述的方法400在心动周期的第一段内开始。该方法包括:在心动周期的第一段中根据第一段操作模式控制血泵的旋转速度(动作402)。可以使用任何合适的第一段操作模式,包括但不限于恒定速度模式、脉动模式和脱离模式。方法400包括:测量或估计通过血泵的血液流速312(动作404)。在动作406中,所测量或估计的血液流速312被存储在存储设备中(诸如,在先进先出缓冲器中),以用于监测血液流速312的变化率。在动作408中,(由控制器)处理当前血液流速312和血液流速312的当前变化率,以确定血泵继续在第一段操作模式下的操作是否将导致血液流速312下降到目标最小血液流速314以下。如果继续在第一段操作模式下的操作将不会导致血液流速312下降至目标最小血液流速314以下,则继续根据第一段操作模式控制血泵的旋转,并重复完成动作402、404、406、408,直到控制器基于当前血液流速312和血液流速312的当前变化率确定继续在第一段操作模式下的操作将导致血液流速312下降至目标最小血液流速314以下为止。例如,在当前血液流速312减小并且当前血液流速312处于初始流速318或接近初始流速318的情况下,控制器可以从根据第一段操作模式控制血泵的旋转切换到如本文所描述的控制血泵的旋转,以使得血液流速312转换到目标最小血液流速314并且随后维持在目标最小血液流速314达第二段的持续时间(动作410)。
图15是根据实施例的在心动周期的第二段期间控制血泵的旋转的方法450的简化框图。方法450开始于控制血泵以在血泵的当前旋转速度下操作(动作452)。控制器随后测量或估计当前泵血液流速312(动作454)。在动作456中,所测量或估计的血液流速312被存储在存储设备中(诸如,在先进先出缓冲器中),以用于计算当前血液流速312的变化率。控制器计算当前血液流速312与目标最小血液流速314之间的差值(动作458)。控制器还计算当前血液流速312的变化率(动作460)。基于当前血液流速312与目标最小血液流速314之间的所计算的差值以及当前血液流速312的变化率,控制器更新下一时间段的当前旋转速率(动作462)。例如,可以针对当前血液流速312与目标最小血液流速314之间的差值和当前血液流速的当前变化率的每个合适的组合,将合适的旋转速率增量存储在查找表中,使得当针对下一时间段以增量更新当前旋转速率时,血液流速312将收敛至目标最小血液流速312,并且此后维持在目标最小血液流速312达该心动周期的第二段的剩余持续时间。在动作464中,控制器检查下一时间段的当前旋转速率是否小于根据第一段操作模式的血泵旋转速率。如果下一时间段的当前旋转速率小于根据第一段操作模式的血泵旋转速率,则控制器恢复回到根据方法400按照第一段操作模式控制血泵的旋转(动作466)。如果下一时间段的当前旋转速率不小于根据第一段操作模式的血泵旋转速率,则重复动作452、454、456、458、462、464,直到控制器在动作464中检测到心动周期的第二段的结束为止。
任何合适的流速都可以用作目标最小血液流速。例如,如本文所述,当第一段操作模式向患者提供实质水平的循环支持时,目标最小血液流速可以是在约0升/分钟至2.0升/分钟的范围内的任何合适的速率。当第一段操作模式是脱离操作模式时,目标最小血液流速可以是在约0.0升/分钟至0.5升/分钟的范围内的任何合适的速率。也可以基于患者活动水平选择目标最小血液流速。例如,图16示出了根据实施例的通过血泵的目标最小血液流速根据患者活动水平的变化。控制器可以使用任何合适的方法(诸如,测量心率和/或测量患者加速度水平)来测量患者活动水平。所测量的患者活动水平随后可用于为目标最小血液流速314选择合适的血液流速。
在本文中描述了本发明的优选实施例,包括发明人已知的用于实现本发明的最佳模式。这些优选实施例的变体对本领域普通技术人员而言在阅读在前描述之后变得显而易见。例如,目标最小血液流速可以是血液流速的目标范围,并且可以在心室舒张期期间调节血流泵的旋转速率,以将血液流速312维持在血液流速的目标范围内。发明人期待本领域技术人员酌情采用这些变体,并且发明人想要本发明以本文具体描述以外的其他形式来实践。对应地,本发明包括本文所附的权利要求书中所记载的主题的所有修改和等效方案,如可适用法规所允许的。此外,上述要素在其所有可能变体中的任意组合均被本发明涵盖,除非在本文中另有说明或明显与上下文矛盾。
在描述本发明的上下文中(尤其是在以下权利要求书的上下文中)使用术语“一”、“一个”和“该”以及类似称谓旨在解释为覆盖单数和复数两者,除非在本文中另外说明或明显与上下文矛盾。术语“包括”、“具有”、“包含”和“涵盖”应当解释为开放式的术语(即,表示“包括,但不局限于”),除非另外注明。术语“连接”应当解释为部分或全部被包含在内、附连、或结合在一起,即使存在某些中介。本文中的值范围的记载仅旨在用作单独引用落在该范围内的每一单独值的速记方法,除非在本文中另外说明,并且每一个单独值被结合到本说明书中,好比它在本文中单独记载的一样。本文中描述的所有方法可以任何合适的顺序执行,除非在本文中另有说明或明显与上下文矛盾。使用本文中所提供的任何和所有示例、或示例性语言(例如,“诸如”)仅旨在更好地说明本发明的实施例,而不构成对本发明的范围的限制,除非另有要求。本说明书中的语言不应当被解释为指示任何未被要求保护的要素对于实践本发明而言是必需的。
本文中所引用的所有参考文献(包括出版物、专利申请和专利)通过引用结合于此,好比每一参考文献被单独和具体地指示为通过引用而被结合且以其整体在本文中被阐述。
可从以下条款的角度描述本公开的实施例的示例:
条款1.一种方法,用于控制心室辅助设备的连续流血泵的旋转速度以控制心室舒张期间通过血泵的血液流速,该方法包括:经由心室辅助设备在患者的心动周期的第一段内将血液从患者的心室泵送到患者的动脉;其中,血泵在第一段内的旋转速率由控制器根据血泵的第一段操作模式来控制;由控制器监测通过血泵的血液流速;由控制器并基于监测到的通过血泵的血液流速来确定:继续在心动周期的第二段内根据第一段操作模式控制血泵的旋转速率是否将导致通过血泵的血液流速小于目标最小血液流速;以及响应于确定继续在第二段内根据第一段操作模式控制血泵的旋转速率将导致通过血泵的血液流速小于目标最小血液流速,而由控制器在第二段内控制血泵的旋转速度,使得通过血泵的血液流速接近目标最小血液流速。
条款2.条款1的方法,其中目标最小血液流速在约0升/分钟至2.0升/分钟的范围内。
条款3.条款1的方法,其中目标最小血液流速在0.5升/分钟至1.5升/分钟的范围内。
条款4.条款1的方法,其中,关于继续在心动周期的第二段内根据第一段操作模式控制血泵的旋转速率是否将导致通过血泵的血液流速小于目标最小血液流速的确定包括:确定通过血泵的当前血液流速与目标最小血液流速之间的相对差值。
条款5.条款4的方法,其中,关于继续在心动周期的第二段内根据第一段操作模式控制血泵的旋转速率是否将导致通过血泵的血液流速小于目标最小血液流速的确定包括:确定通过血泵的血液流速的当前变化率。
条款6.条款1至5中任一项的方法,其中,血泵在第一段操作模式中的旋转速率是恒定的。
条款7.条款1至5中任一项的方法,其中,血泵在第一段操作模式中的旋转速率被改变以生成周期性脉动血流。
条款8.条款7的方法,其中,周期性脉动血流与患者的心动周期同步。
条款9.条款8的方法,其中,周期性脉动血流基于监测到的通过血泵的血流而与患者的心动周期同步。
条款10.条款8的方法,其中,由控制器控制血泵在第一段内的旋转速率,以在心室收缩期间生成血压脉冲。
条款11.条款1至5中任一项的方法,进一步包括:由控制器通过以下方式来检测第二段的结束:检测用于以目标最小血液流速泵送血液的血泵旋转速率何时减小到或低于根据血泵的第一段操作模式的血泵旋转速率;以及响应于检测到第二段的结束,而根据血泵的第一段操作模式控制旋转速率。
条款12.条款1、4和5中任一项的方法,其中,血泵在第一段操作模式中的旋转速率导致在心室收缩期间患者的半月瓣的打开和关闭。
条款13.条款12的方法,其中目标最小血液流速在约0.0升/分钟至0.5升/分钟的范围内。
条款14.条款13的方法,其中目标最小血液流速为0.0升/分钟。
条款15.条款1至5中任一项的方法,其中,控制器对通过血泵的血液流速的监测包括:基于血泵的旋转速率和指示血泵的功耗的操作参数来估计血液流速。
条款16.条款1至5中任一项的方法,其中,控制器对通过血泵的血液流速的监测包括:基于血泵的旋转速率和指示血泵两端的压差的操作参数来估计血液流速。
条款17.条款1至5中任一项的方法,进一步包括:经由传感器测量指示患者的活动水平的患者生理参数;以及由控制器基于患者生理参数更新目标最小血液流速。
条款18.一种机械循环辅助系统,包括:连续流血泵,该连续流血泵可植入与患者的心室和动脉流体连通以辅助血液从心室流向动脉;以及控制器,该控制器可操作地连接到血泵并且可操作用于:在患者的心动周期的第一段内控制血泵的旋转速度以将血液从心室泵送到动脉,血泵在第一段内的旋转速率是根据血泵的第一段操作模式控制的;监测通过血泵的血液流速;基于监测到的通过血泵的血液流速来确定:继续在心动周期的第二段内根据第一段操作模式控制血泵的旋转速率是否将导致通过血泵的血液流速小于目标最小血液流速;并且响应于确定继续在第二段内根据第一段操作模式控制血泵的旋转速率将导致通过血泵的血液流速小于目标最小血液流速,而在第二段内控制血泵的旋转速度,使得通过血泵的血液流速接近目标最小血液流速。
条款19.条款18的机械循环辅助系统,其中目标最小血液流速在约0升/分钟至2.0升/分钟的范围内。
条款20.条款18的机械循环辅助系统,其中目标最小血液流速在0.5升/分钟至1.5升/分钟的范围内。
条款21.条款18的机械循环辅助系统,其中,关于继续在心动周期的第二段内根据第一段操作模式控制血泵的旋转速率是否将导致通过血泵的血液流速小于目标最小血液流速的确定包括:确定通过血泵的当前血液流速与目标最小血液流速之间的相对差值。
条款22.条款21的机械循环辅助系统,其中,关于继续在心动周期的第二段内根据第一段操作模式控制血泵的旋转速率是否将导致通过血泵的血液流速小于目标最小血液流速的确定包括:确定通过血泵的血液流速的当前变化率。
条款23.条款18至22中任一项的机械循环辅助系统,其中,血泵在第一段操作模式中的旋转速率是恒定的。
条款24.条款18至22中任一项的机械循环辅助系统,其中,血泵在第一段操作模式中的旋转速率被改变以生成周期性脉动血流。
条款25.条款24的机械循环辅助系统,其中,周期性脉动血流与患者的心动周期同步。
条款26.条款25的机械循环辅助系统,其中,周期性脉动血流基于监测到的通过血泵的血流而与患者的心动周期同步。
条款27.条款25的机械循环辅助系统,其中,血泵在第一段内的旋转速率被改变,以在心室收缩期间生成血压脉冲。
条款28.条款18至22中任一项的机械循环辅助系统,其中,控制器进一步可操作用于:通过以下方式来检测第二段的结束:检测用于以目标最小血液流速泵送血液的血泵旋转速率何时减小到或低于根据血泵的第一段操作模式的血泵旋转速率;并且响应于检测到第二段的结束,而根据血泵的第一段操作模式控制旋转速率。
条款29.条款18、21和22中任一项的机械循环辅助系统,其中,血泵在第一段操作模式中的旋转速率导致在心室收缩期间患者的半月瓣的打开和关闭。
条款30.条款29的机械循环辅助系统,其中目标最小血液流速在约0.0升/分钟至0.5升/分钟的范围内。
条款31.条款30的机械循环辅助系统,其中目标最小血液流速为0.0升/分钟。
条款32.条款18至22中任一项的机械循环辅助系统,其中,控制器基于血泵的旋转速率和指示血泵的功耗的操作参数来估计血液流速。
条款33.条款18至22中任一项的机械循环辅助系统,其中,控制器基于血泵的旋转速率和指示血泵两端的压差的操作参数来估计血液流速。
条款34.条款18至22中任一项的机械循环辅助系统,进一步包括传感器,该传感器测量指示患者的活动水平的患者生理参数,并且其中控制器基于患者生理参数更新目标最小血液流速。
条款35.条款34的机械循环辅助系统,其中传感器包括心率传感器。
条款36.条款34的机械循环辅助系统,其中传感器包括加速度计。
- 用于优化心室辅助设备中的流量的自适应速度控制算法和控制器
- 控制心室辅助设备(VAD)的速度的方法和心室辅助设备
