一种超灵敏SERS免疫传感器的制备方法及其在宫颈癌血清生物标志物检测的应用
文献发布时间:2023-06-19 11:40:48
技术领域
本发明涉及一种超灵敏SERS免疫传感器的制备方法及其在宫颈癌血清生物标志物检测的应用,属于宫颈癌检测技术领域。
背景技术
宫颈癌是最常见的妇科癌症之一,对妇女的健康构成了严重威胁。宫颈癌的早期筛查和准确诊断与有效治疗密切相关,从而提高患者的生存率。但是,在早期阶段,没有典型临床症状的宫颈癌患者很难被诊断。因此,迫切需要具有高灵敏度和特异性的用于早期筛查的新型诊断工具。如今,检测技术已经取得了长足的进步,监测肿瘤标志物的变化可以筛查和诊断癌症。生存素(survivin)是凋亡蛋白家族的成员,它不仅抑制肿瘤细胞凋亡,而且还促进其增殖和侵袭的能力。骨桥蛋白(OPN)是一种分泌的糖蛋白,在各种生理和病理过程(包括肿瘤的发生和发展)中起着重要的作用。根据survivin和OPN的生物学特性,它们的血清水平在肿瘤发生过程中会发生变化,可以被认为是肿瘤筛查和诊断的生物标志物。
目前,已开发出酶联免疫吸附试验(ELISA)、比色法、化学发光免疫测定(CLIA)和局部表面等离振子共振(LSPR)来检测肿瘤标志物。尽管这些方法具有一些优势,但高成本,费时和复杂的反应条件限制了它们的临床应用。表面增强拉曼散射(SERS)是一种方便,快速且超灵敏的传感技术,由于其独特的光谱指纹图谱,在单分子水平上的高选择性和灵敏性,已被广泛用于生物标志物的定量分析。特别地,窄线宽的SERS光谱特征峰有利于同时采集不同被分析物的信号,提高检测效率并节省检测成本。Yang的小组报告了基于SERS的免疫测定的实际应用,该测定实现了对铁蛋白抗原的定量检测。Ma等研究人员开发了由Fe
拉曼信号的大幅增强是SERS技术实现高灵敏度检测的关键。目前,人们普遍认为SERS信号的放大是由于等离子体纳米材料表面等离子体共振(SPR)激发的局域电磁场增强。电磁场最强的区域称为“热点”。金属纳米颗粒之间的纳米级间隙形成强的局部电磁场,这对于获得SERS“热点”特别有益。为了获得高密度的“热点”,研究人员已经将各种形态的纳米材料组装到基底中。这些SERS基底主要分为:无序或高度有序。可重复性是定量检测方法的另一个重要因素。与无序的SERS基底相比,高度有序的SERS基底由于其出色的信号均匀性和可重复性而保证了数据的可靠性。此外,与无机物质(抗生素,农药等)的检测相比,生物标志物的检测对SERS底物的生物传感活性还有其他要求。SiO
发明内容
本发明的目的是针对上述现有技术的不足,提供基于高密度热点Au@SiO2阵列基底和Au-Ag纳米壳探针的SERS免疫传感器及其在宫颈癌血清生物标志物的超灵敏检测的应用。
本发明通过使用AuNPs@SiO
在survivin和OPN被免疫底物捕获后,添加了两个免疫探针,用于形成夹心免疫复合物。接下来,通过监测免疫传感器的SERS信号强度对这些生物标志物进行定量分析。它表现出良好的重现性,出色的灵敏度和低检测限。最后,对健康受试者和宫颈上皮内瘤样变1(CIN 1),CIN 2,CIN 3和子宫颈癌患者血清中的survivin和OPN进行了检测,取得了与ELISA一致的结果。可想而知,这种极具吸引力的SERS免疫传感器在宫颈癌早期诊断中具有出色的临床应用。
具体的,本发明SERS免疫传感器的制备方法如下:
步骤1)血液样本的采集和处理:
血清样本分为健康人群、CIN 1、CIN 2、CIN 3和宫颈癌患者五组,在早餐前抽取5mL静脉血,在4℃下3000r/min转速离心处理10min之后,将获得的血清样本保存在-80℃下。
步骤2)免疫基底的制备:
2.1)AuNPs的合成
首先,将25mL 1mM的HAuCl
2.2)SiO
遵循溶胶-凝胶法合成SiO
2.3)亲水硅片的制备
用食人鱼溶液处理硅片以获得亲水硅片;将过氧化氢以3:7的体积比加入浓硫酸中以制备食人鱼溶液;然后,将硅片切成10×15mm的小片,浸入食人鱼溶液中30min,然后用超纯水和无水乙醇超声清洗3次;
2.4)单层SiO
单层SiO2微球阵列是通过Langmuir-Bloadgate气液界面组装方法制造的;将氯仿以2:3的体积比添加到微球悬浮液中,然后每次取5μL SiO
2.5)Au@SiO
首先,将4mL AuNPs胶体溶液和2mL己烷依次加入到烧杯中,然后逐滴添加2mL乙醇;加入乙醇后,AuNPs在油水界面形成金属光泽的薄膜;其次,利用组装好的单层SiO
2.6)抗survivin抗体和抗OPN抗体偶联的Au@SiO
将抗survivin抗体(包被)和抗OPN抗体(包被)修饰到Au@SiO
接下来,用5mL 150mM的EDC和30mM的NHS混合溶液活化了修饰在底物上的DMSA的羧基(-COOH),反应0.5h后用PBS清洗底物;接下来,将20μL的200μg/mL抗survivin抗体(包被)和200μg/mL抗OPN抗体(包被)混合物添加到DMSA修饰的Au@SiO
步骤3)Au-AgNS的合成:
第一步,将1.5mL 0.01M的AgNO
第二步,将溶液混合物在室温下磁力搅拌15min后,将0.5mL0.05 M的NaBH
第三步,使用光输出为0.5mW cm
第四步,在室温下和磁力搅拌下,将150μL 0.3M的NaOH和5.5mL 100mM的L-AA依次添加到50mL Ag种子溶液中;接下来,将100μL 1mM的HAuCl
步骤4)Au-AgNSs免疫探针的制备:
首先,将200μL 1mM的4-ATP乙醇溶液添加到5mL Au-AgNSs溶液中,在室温下振动1h,4-ATP和Au-AgNSs之间形成了共价键;在5000r/min转速下离心5min后,弃去上清液,然后将其重新分散在5mL PBS中;然后,将50μL200μg/mL的抗survivin抗体(标记)添加到溶液中,然后添加50μL 150mM的EDC以激活抗survivin抗体的羧基(-COOH);将获得的溶液在37℃下孵育1h,然后通过在5000r/min转速下离心5min将溶液纯化,将制备的survivinAu-AgNSs免疫探针分散在等体积的PBS溶液中;对于OPNAu-AgNSs免疫探针的制备,将200μL1mM的DTNB乙醇溶液和5mL Au-AgNSs溶液在室温下反应1h,并通过离心纯化后再分散于5mLPBS中,然后再依次加入于50μL 150mM的EDC和50μL30 mM的NHS;接下来,通过振摇1.5h使羧基(-COOH)活化,并向溶液中加入50μL200μg/mL的抗OPN抗体(标记);最后,在37℃下孵育2h后,合成了OPNAu-AgNSs免疫探针。
宫颈癌是全世界女性癌症相关死亡的常见原因,血清肿瘤标志物的定量检测对宫颈癌的早期诊断具有实际意义。本发明提出了一种基于表面增强拉曼散射(SERS)的同时检测宫颈癌患者血清中生存素(survivin)和骨桥蛋白(OPN)的免疫传感器,该传感器由AuNPs@SiO
综上所述,本发明研制了一种由Au@SiO
附图说明
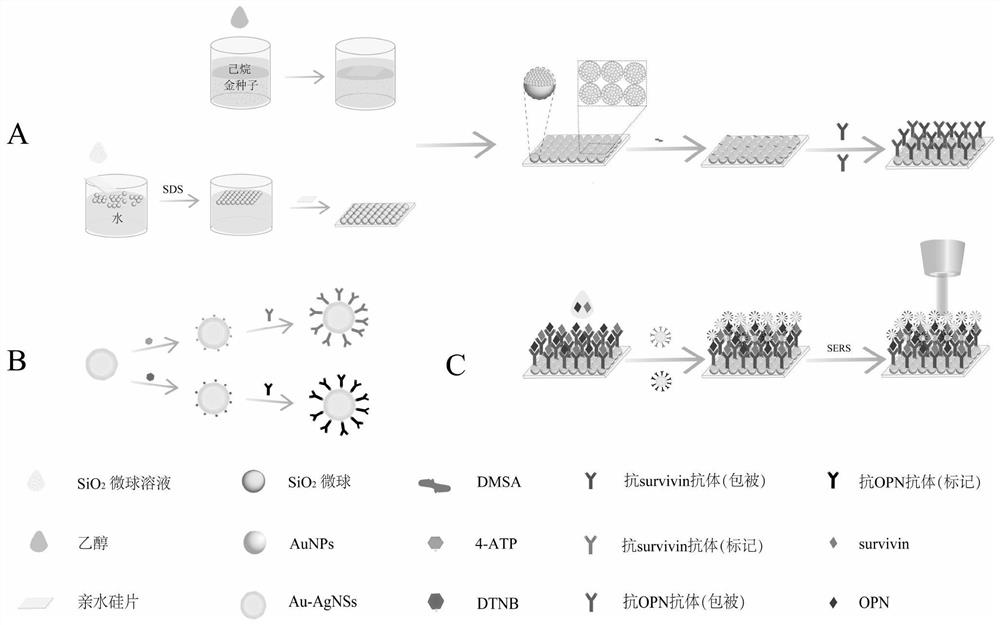
图1是用于同时检测survivin和OPN的基于SERS的免疫传感器的示意图;制备免疫基底(A);两个免疫探针(B);准备的SERS免疫传感器(C)用于定量分析survivin和OPN;
图2:(A)通过油水界面自组装获得的单层AuNPs;(B)通过L-B方法制备的单层SiO
图3:(A)通过在Au@SiO
图4:(A)FDTD从透视模型模拟了Au@SiO
图5:Au-AgNSs的(A)SEM图像;(B)TEM图像;(C)HRTEM图像和(D)部分放大图;(E)SAED图案和(F)STEM HAADF图像;其中(G)Au和(H)Ag元素映射;(I)Au-AgNSs的紫外可见吸收光谱和相应的数字照片;
图6每个制备步骤中SERS免疫传感器的FT-IR光谱:(A)DMSA标记的Au@SiO
图7不同种类的生物标志物样品和空白样品的SERS光谱,说明所制备的SERS免疫传感器具有选择性;
图8(A)免疫传感器检测不同浓度的survivin和OPN分散在PBS中的SERS光谱;根据不同浓度的survivin和OPN在1083cm
图9用10个不同批次的SERS免疫传感器检测同一份含有survivin和OPN的人血清样本(100ng/mL)的SERS光谱,以及每个光谱中(B)1083cm
图10(A)各组临床样本的平均SERS光谱,以及对应的(B)108cm
具体实施方式
一、制备方法
1.材料
所有材料均直接使用,无需进一步纯化。四水合氯金酸(HAuCl
2、血液样本的采集和处理
血清样本分为健康人群、CIN 1、CIN 2、CIN 3和宫颈癌患者五组,均来自扬州大学临床医学院。在志愿者早餐前抽取5mL静脉血,在4℃下3000r/min转速离心处理10min之后,将获得的血清样本保存在-80℃下。实验得到扬州大学临床医学院伦理委员会的批准,与志愿者签署了知情同意书,并根据《赫尔辛基宣言》遵循了涉及人类受试者的医学研究的道德原则。
3、免疫基底的制备
3.1、AuNPs的合成
首先,将25mL 1mM的HAuCl
3.2、SiO
遵循溶胶-凝胶法合成SiO
3.3、亲水硅片的制备
用食人鱼溶液处理硅片以获得亲水硅片。简而言之,将过氧化氢(30%)以3:7的体积比加入浓硫酸中以制备食人鱼溶液。然后,将硅片切成10×15mm的小片,浸入食人鱼溶液中30min,然后用超纯水和无水乙醇超声清洗3次。
3.4、单层SiO
单层SiO
3.5、Au@SiO
首先,将4mL AuNPs胶体溶液和2mL己烷依次加入到烧杯中,然后逐滴添加2mL乙醇。加入乙醇后,AuNPs在油水界面形成金属光泽的薄膜。其次,利用组装好的单层SiO
3.6、抗survivin抗体和抗OPN抗体偶联的Au@SiO
将抗survivin抗体(包被)和抗OPN抗体(包被)修饰到Au@SiO
4、Au-AgNS的合成
Au-AgNSs的合成分为四个步骤。
第一步,将1.5mL 0.01M的AgNO
第二步,将溶液混合物在室温下磁力搅拌15min后,将0.5mL0.05 M的NaBH
第三步,使用光输出为0.5mW cm
第四步,在室温下和磁力搅拌下,将150μL 0.3M的NaOH和5.5mL 100mM的L-AA依次添加到50mL Ag种子溶液中。接下来,将100μL 1mM的HAuCl
5、Au-AgNSs免疫探针的制备
首先,将200μL 1mM的4-ATP乙醇溶液添加到5mL Au-AgNSs溶液中,在室温下振动1h,4-ATP和Au-AgNSs之间形成了共价键。在5000r/min转速下离心5min后,弃去上清液,然后将其重新分散在5mL PBS中。然后,将50μL200μg/mL的抗survivin抗体(标记)添加到溶液中,然后添加50μL 150mM的EDC以激活抗survivin抗体的羧基(-COOH)。将获得的溶液在37℃下孵育1h,然后通过在5000r/min转速下离心5min将溶液纯化,将制备的survivinAu-AgNSs免疫探针分散在等体积的PBS溶液中。对于OPNAu-AgNSs免疫探针的制备,将200μL1mM的DTNB乙醇溶液和5mL Au-AgNSs溶液在室温下反应1h,并通过离心纯化后再分散于5mLPBS中,然后再依次加入于50μL 150mM的EDC和50μL30 mM的NHS。接下来,通过振摇1.5h使羧基(-COOH)活化,并向溶液中加入50μL200μg/mL的抗OPN抗体(标记)。最后,在37℃下孵育2h后,合成了OPNAu-AgNSs免疫探针。
6、同时检测
survivin和OPN的检测过程如下:首先,将20μL包含survivin和OPN的抗原溶液添加到制备的免疫基底上,并在37℃下孵育1h。接下来,滴加包含10μL survivinAu-AgNSs免疫探针和10μLOPNAu-AgNSs免疫探针的混合溶液,并在37℃下继续反应1h。用PBS溶液冲洗掉过量的反应物之后,进行SERS测量。
7、表征
使用紫外-可见分光光度计(Cary UV-5000,Agilent,美国)监测纳米材料的紫外可见吸收光谱。傅里叶变换红外光谱(FT-IR)分析在显微镜红外光谱仪(Cary 610/670,Varian,美国)进行。采用透射电镜(Tecnai 12,Philips,荷兰)和场发射扫描电镜(FESEM)(S-4800Ⅱ,Hitachi,日本)观察纳米材料的形貌和结构。采用S-twin透射电镜(Tecnai G2F30,FEI,美国)对纳米材料进行选区电子衍射(SAED)图像和高分辨率透射电镜(HRTEM)图像测量。雷尼绍拉曼光谱仪在785nm激发波长下,使用50×物镜,5mw激光功率,10s采集时间,在室温下测量样品的SERS光谱。
8、时域有限差分(FDTD)模拟
Lumerical Solutions公司的FDTD模拟软件(8.9版本)用于模拟电磁场分布和增强Au@SiO
二、本发明优势
1、Au@SiO
图1A生动地展示了金阵列基底薄膜的制作过程。当正己烷加入AuNPs溶液时,由于密度差形成了油水界面,乙醇的加入降低了AuNPs的表面电荷密度,促使其在油水界面上自组装形成单层AuNPs膜。图2A为AuNPs薄膜的数码照片和SEM图像。在这张数码照片中,可以清楚地看到位于油水界面上的均匀Au薄膜。从SEM图像可以看出,Au膜由形貌均匀,直径约为20nm的AuNPs排列,AuNPs之间的小间隙有利于SERS性能的提高。图2B为L-B方法组装的基片的SEM图像和光学照片。在亲水硅片上有序排列直径约为450nm的SiO
除了出色的增强性能外,还需要基材的均匀性和稳定性。因此,在40×40μm
2、FDTD模拟
为了确认在线性偏振光束的照射下所制备的Au@SiO
3、Au-AgNS的表征
图5给出了合成的Au-AgNS的组成和结构特征。如SEM图像所示(图5A),制备了具有完整结构和相对均匀的形态的Au-AgNS。从TEM图像可以更清楚地观察到Au-AgNSs的粒径约为40nm,具有光滑表面和致密壁的中空结构,如图5B所示。图5C中的HRTEM图像显示了Au-AgNS的更多细节,进一步证实了中空特征。壳层的厚度约为5nm,这有利于增强SPR效果。图5D是HRTEM图像的局部放大图,并且清晰可见具有0.232nm节距的晶格结构。如图5E所示,SAED图案中的明亮衍射环分别对应于{111},{200},{220}和{311}平面,表明所制备的Au-AgNSs是多晶的。STEM-HAADF图像从另一个角度证实了Au-AgNSs是一种特殊的中空壳结构,如图5F所示。此外,测量Au-AgNS的元素映射可以更直观地了解Au和Ag的分布。图5G和5H示出了Au和Ag的元素映射。Au和Ag元素的无规分布形成了结构和化学上稳定的合金结构,进一步证实了Au-AgNS的合成。这种合金结构不仅具有良好的热力学稳定性,而且具有很强的SERS活性。如图5I所示,Au-AgNSs溶液在可见光范围内为深蓝色,相应的UV-vis吸收光谱在612nm处具有最强的吸收峰。以上结果表明成功制备了均质的Au-AgNSs。
4、SERS免疫传感器的FT-IR表征
材料表面的化学键和官能团在FT-IR光谱中具有相应的吸收峰,并通过FT-IR对SERS免疫传感器的制备过程进行了表征。在免疫传感器的制备过程中,通过洗涤避免了多余试剂(EDC,NSH等)的干扰。DMSA具有巯基和羧基,并且不具有拉曼信号,这是制备免疫底物的不错选择。图6A是通过巯基基团偶联到Au@SiO
5、SERS免疫传感器的选择性
在检测真实样本的过程中,由于存在其他生物标志物,SERS免疫传感器对靶标的精确识别就显得尤为重要,其良好的选择性可以避免假阳性的发生。免疫底物捕获抗原后,加入免疫探针形成三明治免疫复合物,通过监测探针中4-ATP和DTNB的SERS信号来检测抗原的含量。检测相同浓度(1μg/mL)的CEA、APF、survivin、OPN和survivin/OPN样品,空白样品作为对照。对应的光谱如图7所示,可以清楚地看到,只有含有survivin(1083cm
6、在PBS和人血清中同时检测survivin和OPN
将survivin和OPN溶解的PBS溶液不断稀释,得到浓度梯度为1pg/mL至1μg/mL的样品。图8A为不同浓度样品经过5次SERS免疫传感器检测后的平均SERS光谱。结果表明,SERS信号随着survivin和OPN浓度的降低而降低,空白样本的微弱信号可以忽略。剂量反应曲线更直观地说明SERS信号强度与survivin(1083cm
为了验证其实际应用能力,我们使用SERS免疫传感器对含有不同浓度survivin和OPN的人体血清样本进行分析。同样,将survivin和OPN溶解于空白人血清中,然后连续稀释,得到浓度梯度为1pg/mL~1μg/mL的样品。图8D所示为每种类型样本进行5次测量的平均光谱,同样,在空白人血清中,随着survivin和OPN浓度的降低,所测量的SERS信号也随之减弱。图8E和图8F分别为空白人血清中survivin和OPN对应的剂量反应曲线,线性回归方程分别为:y=23250.310+1876.532x,y=26556.096+2142.8933x,R
此外,通过10个不同批次的SERS免疫传感器检测同一样品来评估其重复性。图9A显示了survivin和OPN浓度为100ng/mL的人血清样本的光谱。不同光谱的峰形没有明显差异,峰强也相似。为了更直观地理解SERS信号的波动,图9B和图9C分别给出了各频谱在1083cm
7、临床应用
通过对临床血清样本的分析,进一步验证了构建的SERS免疫传感器的实际操作性能。图10A显示了40名健康受试者、38名CIN 1、35名CIN 2、33名CIN 3和35名宫颈癌患者的血清样本的平均SERS光谱。每个光谱的特征峰分别为1083cm
表1临床样本中survivin和OPN的平均血清水平。
三、结论
综上所述,本发明研制了一种由Au@SiO
- 一种超灵敏SERS免疫传感器的制备方法及其在宫颈癌血清生物标志物检测的应用
- 一种苯酚识别SERS探针及其制备、应用和基于SERS通用超灵敏免疫分析方法
