一种LPS感染后检测并调控鸡RIPK2基因甲基化的方法
文献发布时间:2023-06-19 11:42:32
技术领域
本发明涉及一种LPS感染后检测并调控鸡RIPK2基因甲基化的方法,属于基因工程领域。
背景技术
RIPK2是RIPK激酶家族的一个成员,主要通过NOD/RIPK2通路进行免疫炎症调节。抑制 RIPK2 基因可减少各种炎症因子的释放和缓解炎症反应综合征。而高表达RIPK2 时可激活 p38 MAPK通路,能更有效的清除大肠杆菌。这表明RIPK2对胞内菌的识别、炎症反应的缓解以及其NOD/RIPK2通路对宿主免疫的调节都发挥着关键作用。因此,调控基因RIPK2的表达对机体免疫炎症的调节具有重要实践意义。
基因表达是一个受时间和空间等多因素调控的复杂过程。表观遗传修饰是影响基因表达的一个重要因素。DNA甲基化作为一种常见的表观遗传修饰方式,可在DNA甲基转移酶的催化作用下,使CpG二核苷酸5'-胞嘧啶变为5'-甲基胞嘧啶。DNA 甲基化能引起染色质结构、DNA 构象、DNA 稳定性及DNA与蛋白质相互作用方式的改变,从而控制基因表达,是基因转录前表达调控的重要方式。启动子DNA甲基化可通过阻碍转录因子与识别序列结合、结合甲基化CpG结合蛋白并募集辅阻遏复合物而形成转录抑制复合物等方式抑制基因的转录。目前对鸡RIPK2基因表达的表观遗传调控机制尚不清楚。
因此,如何实时调制鸡RIPK2基因的表达水平,提高机体免疫反应并降低过度炎症反应是实践应用中的重中之重。目前,新发展的焦磷酸测序技术BSP可单次快速、准确定量多个甲基化位点,在哺乳动物中应用较多,但在家禽中鲜少研究。且5-氮杂胞苷和CpG甲基转移酶M. SssI已广泛应用在人类癌症临床治疗上,具有一定的安全性。故本研究通过BSP法检测LPS感染前后鸡RIPK2基因启动子区甲基化变化;并利用DNA甲基化抑制剂5-氮杂胞苷和CpG甲基转移酶M. SssI(过甲基化)分别处理鸡HD11细胞,检测鸡RIPK2启动子活性及基因表达水平,对提高家禽免疫和控制过度性炎症反应具有非常重要的现实意义。
发明内容
为了解决家禽生产中控制免疫和过度炎症反应的问题,发明人进行了大量研究,从筛选出的抗禽致病性大肠杆菌鸡中发现RIPK2及其通路发挥着重要作用,且敲除、过表达鸡RIPK2对免疫和炎症反应具有正向调控作用,提供一种LPS感染后检测并调控鸡RIPK2基因甲基化的方法,本发明进一步探究鸡RIPK2基因的表达调控的因素,对缓解应激性病理损伤和提高家禽健康具有重要的实践意义。
本发明的目的是这样实现的,一种LPS感染后检测并调控鸡RIPK2基因甲基化的方法,其特征在于,包括以下步骤:
步骤1)、LPS感染鸡巨噬细胞HD11,检测RIPK2基因表达量变化;
登录NCBI数据库下载鸡RIPK2基因mRNA序列,鸡RIPK2基因ID为NM_001030943.1;采用Primer premier 5.0软件设计引物序列;鸡巨噬细胞HD11复苏后添加至含10%的胎牛血清DMEM培养基,置于37℃ 5% CO2培养箱中培养,次日观察细胞生长情况传代培养;10 μg/mL LPS感染细胞48 h后,利用qRT-PCR检测鸡RIPK2表达量;
步骤2)、重亚硫酸氢盐处理LPS感染前后的基因组;
利用基因组DNA试剂盒提取鸡巨噬细胞HD11基因组,核酸蛋白测定仪检测DNA浓度和纯度,利用Methylation-Gold Kit试剂盒进行重亚硫酸氢盐DNA甲基化;
步骤3)、鸡RIPK2基因启动子区CpG岛片段PCR扩增和测序分析;
利用Primer premier 5.0软件设计引物序列,PCR扩增鸡RIPK2基因启动子区CpG岛;将PCR扩增产物进行测序,利用在线软件QUMA(QUantification tool for MethylationAnalysis)分析测序结果;
步骤4)、5-氮杂胞苷和M. SssI分别处理转染鸡RIPK2启动子质粒的鸡HD11细胞;
选取鸡RIPK2基因转录起始位点上游3000bp和下游200bp,构建鸡RIPK2启动子质粒并转染鸡巨噬细胞HD11;10μmol/L 5-氮杂胞苷、50U/mL CpG甲基转移酶M. SssI分别处理转染RIPK2启动子质粒的鸡巨噬细胞HD11;双荧光素酶报告系统检测鸡RIPK2启动子活性;
步骤5)、5-氮杂胞苷和M. SssI分别处理鸡HD11细胞,检测RIPK2基因表达量;
10 μg/mL LPS感染鸡巨噬细胞HD11 48 h后,10μmol/L 5-氮杂胞苷和50U/mL M.SssI分别处理感染后的HD11细胞,检测上述不同处理组鸡RIPK2的表达水平。
步骤1)中,采用Primer premier 5.0软件设计引物序列,引物RIPK2基因上游序列为SEQ ID NO.1: 5′ - CTCGAACCAGTCCTGAGAACG -3′ ,引物RIPK2基因下游序列为SEQ IDNO.2: 5′ - AAGCGGATGTTTCCTCTTGG -3′。
步骤1)中,qRT-PCR反应体系为10 μL: 2×Master Mix 5 μL,引物工作液(2.5 μM)1μL,模板1 μL,ROX 1μL,ddH2O 2 μL;反应条件为95℃预变性3min,95℃变性10 s,58℃退火30 s,72℃延伸30 s,循环40次。
步骤2)中,重亚硫酸氢盐反应体系为DNA 样品20 μL,缓冲液130 μL;反应条件:98℃,10 min;64℃,2.5 h;4℃,放置20 h。
步骤3)中,利用Primer premier 5.0软件设计引物序列,引物RIPK2基因上游序列为SEQ ID NO.3: 5′ - AAGTTGGTTGAAGATTTAGATTTT -3′ ,引物RIPK2基因下游序列为SEQID NO.4: 5′ - AACCCTACAAACACTTAAAAACTAC -3′ 。
步骤3)中,PCR扩增体系为20 μL: 2×HieffTM PCR Master Mix 10 μL,上、下游引物各1 μL,亚硫酸氢盐处理后的基因组DNA 2 μL,ddH2O 16 μL;PCR扩增程序为95℃预变性4 min,95℃变性30 s、56℃退火30 s、72℃延伸30 s(35个循环),72℃末段延伸10 min。
步骤3)中,PCR扩增产物送至武汉金开瑞生物工程有限公司进行测序。
本发明的有益效果,本发明相对于现有技术具有如下的优势和效果:
(1)本发明通过前述方法设计的鸡RIPK2基因甲基化引物序列具有较强特异性,配合焦磷酸测序可快速、灵敏、准确、经济、有效的检测鸡RIPK2基因DNA甲基化程度。该特异性引物可用来检测各种环境下鸡RIPK2基因的甲基化状态,为进一步调控基因表达提供指示。
(2)本发明能够利用5-氮杂胞苷和CpG甲基转移酶M. SssI有效调控鸡RIPK2启动子活性及基因表达,所用方法简单、经济、有效、可行。
(3)本发明同时提供了调控家禽免疫炎症反应的方法,通过调控关键基因RIPK2基因表达水平,可简单、快速的提高家禽免疫,降低过度炎症反应,缓解应激性病理损伤,改善家禽健康。
附图说明
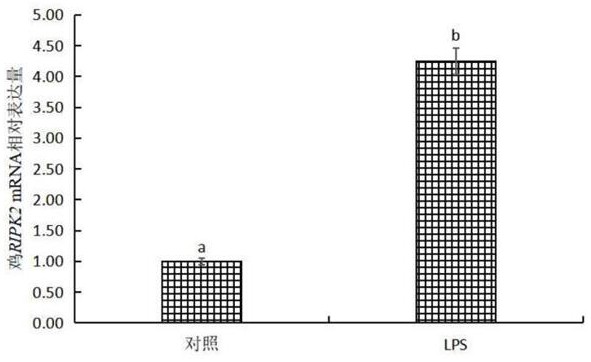
图1为本发明中LPS处理前后鸡RIPK2在HD11细胞中的表达水平。
图2为本发明中基因组DNA的电泳检测结果。
图3为本发明中鸡RIPK2基因PCR产物扩增片段电泳图。
图4为本发明中LPS处理前后鸡RIPK2基因启动子区甲基化图谱。
图5为本发明中LPS处理前后鸡RIPK2基因启动子区甲基化水平分析。
图6为本发明中不同试剂对鸡RIPK2基因启动子活性的影响。
图7为本发明中不同试剂对鸡RIPK2基因表达水平的影响。
具体实施方式
为了使本发明所解决的技术问题、技术方案及有益效果更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。
以下例子在此用于示范本发明的优选实施方案。本领域内的技术人员会明白,下述例子中披露的技术代表发明人发现的可以用于实施本发明的技术,因此可以视为实施本发明的优选方案。但是本领域内的技术人员根据本说明书应该明白,这里所公开的特定实施例可以做很多修改,仍然能得到相同的或者类似的结果,而非背离本发明的精神或范围。
除非另有定义,所有在此使用的技术和科学的术语,和本发明所属领域内的技术人员所通常理解的意思相同,在此公开引用及他们引用的材料都将以引用的方式被并入。
那些本领域内的技术人员将意识到或者通过常规试验就能了解许多这里所描述的发明的特定实施方案的许多等同技术。这些等同将被包含在权利要求书中。
下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的仪器设备,如无特殊说明,均为实验室常规仪器设备;下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。
本发明的实施例:
一、菌株、质粒以及试剂的准备;
菌株:大肠杆菌感受态细胞DH5α 购自大连TAKARA公司;
细胞系:鸡巨噬细胞系HD11购自上海雅吉生物技术有限公司;
质粒:报告载体pGL3-basic、pRL-TK购自PROMEGA公司;
试剂来源:DMEM高糖培养基购自HyClone公司;
胎牛血清购自杭州天杭生物科技有限公司;
胰酶-EDTA和PBS购自吉诺生物医药技术有限公司;
Lipofectamine 2000 Transfection Reagent购自Invitrogen公司;
双荧光素酶报告基因检测试剂盒购自碧云天公司;
LimitlessTM ELZ Fushion kit、TRIpure Total RNA Extraction Reagent、EntiLink™ 1st Strand cDNA Synthesis Kit、EnTurbo™ SYBR Green PCR SuperMix购自ELK biotechnology公司;
MiniBEST Agarose Gel DNA Extraction Kit购自TaKARa公司;
DNA高保真聚合酶Phanta Max Super-Fidelity DNA Polymerase购自Vazyme公司;
基因组DNA小量试剂盒购自AxyPrep公司;
切胶回收试剂盒购自Omega公司;
Methylation-Gold Kit试剂盒购自ZYMO公司;
其它试剂均为国产分析纯。
二、LPS感染后检测鸡RIPK2基因甲基化;
步骤1:LPS感染鸡巨噬细胞HD11,检测RIPK2基因表达量变化;
鸡巨噬细胞HD11复苏后添加至含10%的胎牛血清DMEM培养基,置于37℃ 5% CO2培养箱中培养,次日观察细胞生长情况传代培养。10 μg/mL LPS加入培养基中,孵育48 h后收集细胞。利用试剂盒TRIpure Total RNA Extraction Reagent提取鸡巨噬细胞HD11总RNA,核酸蛋白测定仪检测RNA浓度和纯度。鸡RIPK2基因扩增的上游引物核苷酸序列为SEQ IDNO.1: 5'-CTCGAACCAGTCCTGAGAACG-3',下游引物核苷酸序列为SEQ ID NO.2: 5'-AAGCGGATGTTTCCTCTTGG-3'。利用反转录试剂盒EntiLink™ 1st Strand cDNA SynthesisKit将1 μg总RNA反转录成cDNA产物。使用EnTurbo™ SYBR Green PCR SuperMix试剂盒进行荧光定量PCR检测。反应体系为10 μL: 2×Master Mix 5 μL,引物工作液(2.5 μM)1μL,模板1 μL,ROX 1μL,ddH2O 2 μL。反应条件为95℃预变性3min;95℃变性10 s,58℃退火30s,72℃延伸30 s,循环40次。以鸡RIPK2为检测基因,GAPDH为内参基因。每组3次重复。结果显示相对于空白对照组,10 μg/mL LPS处理鸡HD11细胞48 h后,鸡RIPK2基因mRNA表达量差异极显著(P < 0.05);鸡RIPK2基因在LPS处理48 h后,其表达量提高了4倍(如图1所示)。
步骤2:重亚硫酸氢盐处理LPS感染前后的基因组;
利用基因组DNA试剂盒提取鸡巨噬细胞HD11基因组,核酸蛋白测定仪检测DNA浓度和纯度。采用Methylation-Gold Kit试剂盒进行重亚硫酸氢盐DNA甲基化(基因组DNA 500pg-2 μg)。重亚硫酸氢盐反应体系中,DNA 样品20 μL,缓冲液130 μL。反应条件:98℃,10min;64℃,2.5 h;4℃,放置20 h。结果显示提取的基因组DNA条带明亮,整齐单一,无杂带(如图2所示);且样品DNA浓度为258 ng/μL,OD260/OD280比值在1.8~2.0之间。结果说明样品DNA完整、质量较高,可用于后续试验。设计重亚硫酸盐引物对CpG岛进行PCR扩增,扩增片段长度为221 bp。琼脂糖凝胶电泳显示约在250 bp处有1条特异性条带(如图3所示),与目标片段长度一致;后进行切胶回收,TA克隆后测序结果与预期序列一致。
步骤3:鸡RIPK2基因启动子区CpG岛片段PCR扩增和测序分析
重亚硫酸盐转化后RIPK2基因上游引物核苷酸序列如SEQ ID NO.3:5'-AAGTTGGTTGAAGATTTAGATTTT -3' 所示,RIPK2基因下游引物核苷酸序列如SEQ ID NO.4:5'- AACCCTACAAACACTTAAAAACTAC -3' 所示。PCR扩增鸡RIPK2基因启动子区CpG岛。扩增体系为20 μL: 2×HieffTM PCR Master Mix 10 μL,上、下游引物各1 μL,亚硫酸氢盐处理后的基因组DNA 2 μL,ddH2O 16 μL。PCR扩增程序为95℃预变性4 min,95℃变性30 s、56℃退火30 s、72℃延伸30 s(35个循环),72℃末段延伸10 min。将PCR扩增产物送至武汉金开瑞生物工程有限公司进行测序,利用在线软件QUMA(QUantification tool for MethylationAnalysis)分析测序结果,判断目的片段中CpG岛位点是否发生甲基化。结果显示不同处理状态下,鸡RIPK2基因甲基化状态不同,且差异显著(P<0.05)(如图4所示)。对照组中鸡RIPK2基因CpG位点甲基化水平为53.8%,而LPS处理后甲基化水平为15.4%;下降了40.4%(如图5所示)。
三、LPS感染后调控鸡RIPK2甲基化及基因表达;
步骤1:5-氮杂胞苷和M. SssI对鸡RIPK2启动子活性的影响;
以基因组DNA为模板,利用常规PCR反应进行鸡RIPK2启动子扩增。反应条件为:预变性95℃ 5 min,扩增阶段(95℃ 变性15 s,55℃ 退火30 s,72℃ 延伸10 s)循环30次,终延伸72℃ 10 min。反应结束后,取5μL反应产物用1.5%的琼脂糖凝胶电泳检测。按试剂盒说明书凝胶回收PCR产物。琼脂糖凝胶纯化后的PCR产物进行HindIII单酶切以及HindIII和XhoI双酶切,单酶切体系为:HindIII 0.5 µL,R Buffer 2 µL,DNA 8 µL,ddH2O 9.5 µL。双酶切体系为:XhoI和HindIII各0.5 µL,R Buffer 2 µL,DNA 8 µL,ddH2O 9 µL。反应条件为:混匀,37℃ 水浴2 h - 4 h。酶切产物用琼脂糖凝胶回收试剂盒纯化,通过T4 DNALigase将鸡RIPK2基因启动子目的片段连接到pGL3-basic载体。连接体系为:10×Ligation Buffer 2 µL,T4 DNA Ligase 1 µL,目的片段酶切回收产物16 µL,pGL3-basic酶切回收产物1 µL。混匀反应液,16℃连接过夜。分别将构建的1组重组质粒转化感受态细胞DH5α,1天后挑取单克隆进行测序检测,测序正确的单菌落进行保种和无内毒素质粒大提。
转染前一天,每孔(24孔板)0.5-2×10
将报告基因细胞裂解液充分混匀,吸尽细胞培养液后可以直接加入报告基因细胞裂解液,加入100 µL细胞裂解液,重悬细胞,充分裂解5 min后,离心收集上清液。取100 µL上清液加入到96孔板中,加入100 µL Renilla荧光素酶,开启荧光测定仪进行检测。结果显示相比于对照组和CpG甲基转移酶组,5-氮胞杂苷组极显著性提高鸡RIPK2基因启动子活性(P<0.01);相比于加入RIPK2启动子质粒的对照组,CpG甲基转移酶M. SssI组极显著性降低鸡RIPK2基因启动子活性(P<0.01)(如图6所示)。
步骤2:5-氮杂胞苷和M. SssI对鸡RIPK2基因表达的影响;
鸡巨噬细胞HD11复苏后添加至含10%的胎牛血清DMEM培养基,置于37℃ 5% CO2培养箱中培养,次日观察细胞生长情况传代培养。将干粉状5-氮杂胞苷溶解于DMSO中,PBS稀释至10μmol/L浓度。处理前一天,将细胞铺至24孔培养板上,10μmol/L5-氮杂胞苷、50U/mLCpG甲基转移酶M. SssI和2μLPBS分别加入培养基中,孵育48 h后收集细胞。利用试剂盒TRIpure Total RNA Extraction Reagent提取鸡巨噬细胞HD11总RNA,核酸蛋白测定仪检测RNA浓度和纯度。鸡RIPK2引物如核苷酸序列SEQ ID NO.1和SEQ ID NO.2所示。利用反转录试剂盒EntiLink™ 1st Strand cDNA Synthesis Kit将1 μg总RNA反转录成cDNA产物。使用EnTurbo™ SYBR Green PCR SuperMix试剂盒进行荧光定量PCR检测。反应体系为10 μL: 2×Master Mix 5 μL,引物工作液(2.5 μM)1μL,模板1 μL,ROX 1μL,ddH2O 2 μL。反应条件为95℃预变性3min;95℃变性10 s,58℃退火30 s,72℃延伸30 s,循环40次。以鸡RIPK2为检测基因,GAPDH为内参基因。每组3次重复。结果显示相比于LPS感染组和对照组,LPS感染后加入DNA甲基化抑制剂或CpG甲基转移酶M. SssI,鸡RIPK2基因表达水平显著性升高或降低(如图7所示)。
序列表
<110> 扬州大学
<120> 一种LPS感染后检测并调控鸡RIPK2基因甲基化的方法
<160> 4
<170> SIPOSequenceListing 1.0
<210> 1
<211> 21
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 1
ctcgaaccag tcctgagaac g 21
<210> 2
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 2
aagcggatgt ttcctcttgg 20
<210> 3
<211> 24
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 3
aagttggttg aagatttaga tttt 24
<210> 4
<211> 25
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 4
aaccctacaa acacttaaaa actac 25
- 一种LPS感染后检测并调控鸡RIPK2基因甲基化的方法
- 肺腺癌检测试剂盒及检测TULP2基因甲基化水平的方法
