一种固定化苏氨酸醛缩酶的制备方法、固定化苏氨酸醛缩酶及应用
文献发布时间:2023-06-19 11:42:32
技术领域
本发明涉及生物技术领域,特别是涉及一种固定化苏氨酸醛缩酶的制备方法、固定化苏氨酸醛缩酶及应用。
背景技术
苏氨酸醛缩酶是一种PLP依赖性的酶,能够催化苏氨酸裂解为甘氨酸和乙醛及其逆反应,该酶广泛存在于各类生物体中,并在其代谢途径中发挥重要的作用。在生产应用中,由于苏氨酸醛缩酶对裂解底物有较高的选择性,因此往往利用该酶催化的逆反应从简单有机物地合一步合成β-羟基-α-氨基酸。相对于步骤繁多的有机合成,利用该酶的生物催化过程更加简单、环保。但是游离的酶稳定性差,不能重复利用,而且难与产物分离,限制了其在工业化中的应用。
固定化酶技术现在已经有一百多年发展史了,人们常采用吸附法、包埋法、共价结合法,交联法等固定化技术对游离酶进行修饰以获得高稳定性、可重复利用、易于分离的固定化酶。
J.D.Tibhe等(J.D.Tibhe,H.Fu,T.Noel,Q.Wang,J.Meuldijk,V.Hessel,Beilstein J Org Chem,9(2013)2168-2179.)用间接法研究了L-TA(来源于T.maritima)固定在Eupergit上的酶活回收89%,由于固定材料价格昂贵,批次稳定性差,仍不能满足工业需求。
S.Kurjatschij等(S.Kurjatschij,M.Katzberg,M.Bertau,Journal ofMolecular Catalysis B:Enzymatic,103(2014)3-9.)将L-TA(来自大肠杆菌)嵌入原硅酸盐中仅能获得30%的活性保留。
目前还没有合适的固定化苏氨酸醛缩酶产品用于对甲砜基基苯丝氨酸的生产,也没既具有较好的批次反应稳定性又具有高的酶活回收的固定化苏氨酸醛缩酶的报道。而且在固定化酶失活后,树脂和酶都会被废弃掉,在现有的固定化苏氨酸醛缩酶的报道中没有合理的再利用树脂的策略。
发明内容
本发明的目的在于提出一种氨基树脂固定化苏氨酸醛缩酶的方法以及树脂的再利用策略及采用制备的固定化酶合成L-syn-对甲砜基苯丝氨酸。
本发明思想在于:首先对苏氨酸醛缩酶进行固定化,然后提出树脂再利用策略,最后通过固定化酶催化底物甘氨酸、对甲砜基苯甲醛合成对甲砜基苯丝氨酸。固定化酶作为催化剂,便于酶的回收和重复利用、提高酶的稳定性、可连续操作及自动化控制,在此基础上又提出固定化酶失活后,载体的再利用策略,从而大幅度降低生产对甲砜基苯丝氨酸的成本,涉及酶固定化以及利用固定化酶催化合成高价值化合物的技术领域。
一种固定化苏氨酸醛缩酶的制备方法,包括以下步骤:
(1)获取苏氨酸醛缩酶酶液;
(2)将氨基树脂NAA进行活化;
(3)将活化后的氨基树脂NAA与苏氨酸醛缩酶酶液混合固定,获得固定化苏氨酸醛缩酶。
优选的,步骤(1)中苏氨酸醛缩酶酶液由表达苏氨酸醛缩酶的工程菌菌体破碎后所得。
优选的,步骤(2)中氨基树脂NAA活化采用戊二醛作为交联剂进行活化。
更优选的,步骤(2)中活化时,将氨基树脂NAA与体积分数为0.4%的戊二醛交联剂以质量∶体积=1∶3的比例混合。
更优选的,步骤(2)中氨基树脂NAA活化时在25℃下150rpm摇床摇晃下活化2~3h。
优选的,步骤(3)中固定时,活化后的氨基树脂NAA与苏氨酸醛缩酶酶液的混合比例为:每0.6g活化后的氨基树脂NAA与3mL苏氨酸醛缩酶酶液混合。
更优选的,活化好的氨基树脂NAA与游离的苏氨酸醛缩酶酶液按每0.6g活化后的氨基树脂NAA与3mL苏氨酸醛缩酶酶液混合后,加入到10mL50mM,pH 8.0的磷酸缓冲液中在30℃、150rmp的摇床中固定化4~5h。
优选的,固定化苏氨酸醛缩酶在经过使用后至少部分失活,将至少部分失活的固定化苏氨酸醛缩酶使用戊二醛作为交联剂进行再次活化,然后与苏氨酸醛缩酶酶液混合固定,获得固定化苏氨酸醛缩酶。固定化苏氨酸醛缩酶可以用于合成L-syn-对甲砜基苯丝氨酸,经过多次使用后,固定化苏氨酸醛缩酶会逐渐失活,催化效率变差,在酶活降低到一定程度时,不适合继续使用,此时可以将至少部分失活的固定化苏氨酸醛缩酶再次使用戊二醛交联剂进行活化,借用酶表面残留的氨基基团进行再次活化,形成新的氨基结合位点,再次活化后,将游离的苏氨酸醛缩酶固定上去,获得新的固定化苏氨酸醛缩酶。这样便实现了树脂的再利用。
本发明还提供了所述制备方法制备的固定化苏氨酸醛缩酶。
本发明还提供了所述固定化苏氨酸醛缩酶在合成L-syn-对甲砜基苯丝氨酸中的应用。
本发明的有益效果为:本发明提出的使用氨基树脂NAA制备苏氨酸醛缩酶的固定化方法,固定化酶酶活回收达到119.3%,在30℃,pH 8.0的反应液中连续浸泡18天(每天测一次酶活)保留最初酶活的82.4%,在4℃条件下保存62天其酶活基本保持不变。将其应用于对甲砜基苯丝氨酸的合成,固定化酶和游离酶在相同的反应体系中反应相同的时间固定化酶的产量和de值均高于游离酶,分别为16.12g/L,98.2%;而游离酶分别为14.23g/L、95.8%。其选择性比游离酶更高,得到的产物产量也比游离酶高,具有巨大的经济效益和社会效益。
附图说明
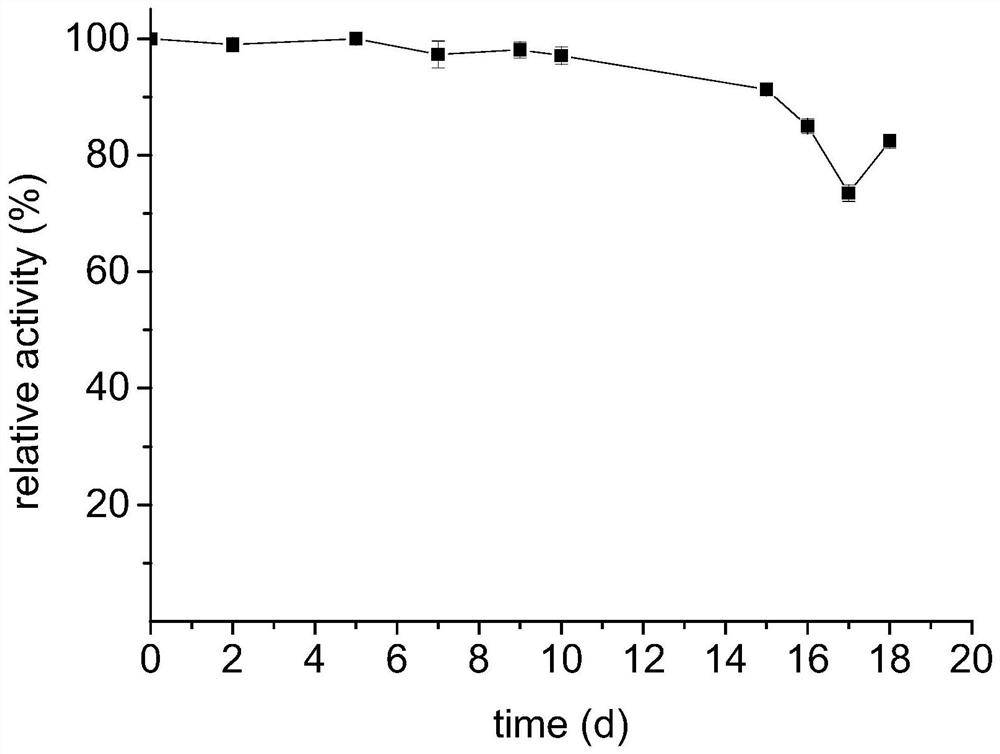
图1为固定化酶操作稳定性检测结果图。
图2为固定化酶储存稳定性检测结果图。
图3为固定化酶和游离酶反应2h催化合成对甲砜基苯丝氨酸液相图。
图4为树脂再利用原理示意图。
图5为树脂再利用实验结果图。
具体实施方式
主要仪器、材料试剂:氨基树脂NAA购自天津南开和成;戊二醛,分析纯AR购自阿拉丁;甘氨酸购自济南东轩生物工程有限公司;对甲砜基苯甲醛源自实验室储存;Freezone4.5L冷冻干燥机生产公司是美国LABCONCO公司;高效液相色谱仪FL2200生产公司是浙江福利分析仪器股份有限公司;超声波细胞粉碎机生产公司是宁波新芝生物科技股份有限公司。
实施例1:游离苏氨酸醛缩酶酶液的制备
用含有苏氨酸醛缩酶基因(基因来源于Bacillus nealsonii,GenBank accessioncode WP_016204489.1)的大肠杆菌BL21工程菌菌种(构建方法可参照我们实验室已发文章W.Zheng,K.Chen,Z.Wang,X.Cheng,G.Xu,L.Yang,J.Wu,Organic Letters,22(2020)5763-5767.),在超净台中进行平板划线,放在37℃培养箱培养12h,然后在超净台挑菌在37℃,200rpm摇床中培养2~3h,OD
实施例2:树脂的预处理
将一定量氨基树脂NAA、HAA、HA、NH、ESQ-3用50mM,pH 8.0的磷酸缓冲液清洗(清洗的时候可用玻璃棒轻轻搅动防止树脂破碎)2~3次不再有浮沫出现。将清洗好的氨基树脂NAA与体积分数为0.4%的戊二醛交联剂以质量(树脂清洗前质量):体积=1∶3的比例混合,并在25℃、150rpm摇床活化2-3h。活化后的树脂由原来的变为黄色,将活化好的氨基树脂NAA抽滤,然后用50mM,pH 8.0的磷酸缓冲液清洗2~3次出去表面残留的戊二醛,再抽滤,然后用冷冻干燥活化后的NAA储存在4℃条件下备用。取一定量D301、D301R、D354、D314先用蒸馏水浸泡24h,再用体积分数为75%乙醇浸泡2h,蒸馏水洗至中性,再用0.1mol/L NaOH溶液浸泡2h,再用蒸馏水洗至中性,再用0.1mol/L HCl溶液浸泡2h,再用蒸馏水洗至中性备用。环氧树脂EPB、EPC、ES103B用适量的pH 8.0的磷酸缓冲液液清洗2-3次备用。
实施例3:苏氨酸醛缩酶的固定化
将活化好的树脂与游离的苏氨酸醛缩酶酶液按照每0.6g载体/3mL游离酶酶液的比例加入到10mL 50mM,pH 8.0的磷酸缓冲液中在30℃、150rmp的摇床中固定化4~5h。然后将得到的固定化酶清洗2~3次除去表面残留的酶,抽滤,冷冻干燥后储存在4℃条件下备用。
海藻酸钠固定化酶:溶解(pH 8.0的磷酸缓冲溶液)配制浓度分别为3%的海藻酸钠7mL,放置于40-50℃下浴锅中加热保证海藻酸钠充分溶解,冷却后加入3mL破泡液,用玻璃棒搅拌溶解均匀。用注射器吸收溶解的海藻酸钠酶溶液,缓慢滴加到3%50mL的氯化钙溶液中,使其形成海藻酸钠包埋球颗粒,滴加完毕后,放置于室温中使其进一步硬化3h。用去离子水冲洗2-3遍,洗去表面的CaCl
实施例4:固定化苏氨酸醛缩酶酶活的测定
10mL体系中(1mol/L甘氨酸,0.1mol/L对甲砜基苯甲醛,30μL磷酸吡哆醛溶液(4mg/mL)pH 8.5)加入0.6g固定化苏氨酸醛缩酶/等量包埋法固定化酶,在30℃,200rpm中反应10min。色谱条件:色谱柱型号为CHIRALPAK ZWIX(-)(DAICEL CO.,LTD,Japan),流动相为:甲醇(1%甲酸和2%乙二胺),流动相流速为0.5mL/min,检测波长为225nm,柱温箱温度为40℃。L-syn-对甲砜基苯丝氨酸保留时间9.5min左右,L-anti-对甲砜基苯丝氨酸保留时间8.5min左右。酶活定义:在上述反应条件下,30℃,每分钟生成1μmol对甲砜基苯丝氨酸所需要的酶量为1个活力单位(U)。
酶活回收=固定化酶活/游离酶酶活×100%
操作稳定性:将按比例将固定化酶浸泡在合适的量的反应体系中,每天测一次酶活。在30℃,200rpm的条件下将固定化酶在反应液中连续浸泡18天(每天测一次酶活,定义两个小时为1个批次)保留最初酶活的82.4%。
储存稳定性:将固定化酶储存在4℃条件下,每隔一段时间测一次酶活。以第一天的酶活为100%,在冰箱储存62天,酶活基本保持不变。
固定化酶和游离酶在合成对甲砜基苯丝氨酸中的对比:分别按照固定化酶测酶活步骤中配置反应体系,加入0.6g固定化酶;游离酶液:取10mL菌液离心下来的菌体,用3mL,1mol/L,pH 8.0甘氨酸溶液悬浮、破碎。取7mL 1mol/L,pH 8.0甘氨酸溶液加入0.1842g对甲砜基苯甲醛,30μL磷酸吡哆醛溶液(4mg/mL),最后把刚才的游离酶液加入到7mL体系中,最终得到10mL反应体系,甘氨酸终浓度1mol/L、对甲砜基苯甲醛终浓度0.1mol/L,与固定化反应体系一致。固定化酶和游离酶体系各反应1.5h。取样用高效液相色谱检测,发现固定化酶和游离酶在相同的反应体系中反应相同的时间固定化酶的产量和de值均高于游离酶,分别为16.12g/L,98.2%;而游离酶分别为14.23g/L、95.8%。
实施例5
表1
材料D301、D301R、D354、D314、NAA、HAA、HA、NH、ESQ-3、EPB、EPC、ES103B、琼脂糖、海藻酸钠均按照上述实施案例1、2、3进行处理和固定化。固定化得到的固定化酶按照实施案例4进行酶活回收和操作稳定性评价得到表1结果。从表1可以看出在不同的固定化方法及不同的材料中用NAA进行交联固定化苏氨酸醛缩酶酶活回收,操作稳定性最好。
实施例6:树脂再利用
将已经失活的固定化酶(氨基树脂NAA固定化所得的固定化酶)与体积分数为0.4%的戊二醛以质量∶体积=1∶3的比例混合,在25℃,150rpm摇床中下活化1h,借用酶表面残留的氨基基团进行再次活化,形成新的氨基结合位点(如图4所示)。称取再次活化的已失活的固定化酶以0.6g/3mL游离酶液(实施例1制备的游离苏氨酸醛缩酶酶液)的比例,在30℃,150rpm摇床中固定4h形成新的固定化酶。
再次利用的树脂固定化酶操作稳定性情况。结果如图5:再次利用的树脂用于固定化连续反应230批次产率一直维持在57%以上,相比第一批次64%转化率,下降幅度很小,我们首次开发了这种树脂再利用的方案并成功应用于对甲砜基苯丝氨酸的合成。
- 一种固定化苏氨酸醛缩酶的制备方法、固定化苏氨酸醛缩酶及应用
- 一种高乙醛耐受性的壳聚糖固定化醛缩酶的制备方法与应用
