亚麻酸-甲硝唑化合物及其制备方法和应用
文献发布时间:2023-06-19 11:44:10
技术领域
本发明属于医药领域,具体涉及一种亚麻酸-甲硝唑化合物及其制备方法和应用。
背景技术
幽门螺杆菌(Helicobacter pylori,Hp)是一种革兰氏阴性菌,螺旋形、微需氧,生长条件要求苛刻。研究显示,Hp感染能导致急、慢性胃炎和胃、十二指肠溃疡及胃癌、淋巴增生性胃淋巴瘤等疾病,并与肠道的外肝癌、糖尿病等发病有关。目前,Hp感染的治疗方案是三联或新四联疗法,即同时服用“质子泵抑制剂(奥美拉唑等)+两种抗生素(从克拉霉素,阿莫西林、四环素、甲硝唑等中选两种)”或“铋剂(枸橼酸铋钾等)+质子泵抑制剂(奥美拉唑等)再+两种抗生素(从克拉霉素,阿莫西林、四环素、甲硝唑等中选两种)”。但随着抗生素的长期使用,Hp对抗生素产生不同程度的耐药,导致根治失败率越来越高。甲硝唑成本低、效果好、副作用比较少,可以作为根治Hp的一线药物;但容易产生耐药,目前耐药非常严重,不能再作为一线首选药物。周海川等2018年11月到2019年3月在重庆梁平地区采集胃粘膜样本调查耐药情况显示该地区幽门螺杆菌对甲硝唑耐药率高达96.81%。因此,如何克服甲硝唑容易耐药和提高甲硝唑对耐药幽门螺杆菌的敏感性的问题,是恢复甲硝唑作为一线药物迫切需要解决的问题。
本发明涉及的亚麻酸-甲硝唑制备是全新的制备工艺,未见有相同制备工艺的报道,该工艺流程简便、操作简单、产量比较高;而且该工艺制备的亚麻酸-甲硝唑对幽门螺杆菌、特别是对甲硝唑耐药的幽门螺杆菌有特异性的抑制作用、不容易产生耐药、细胞毒性低、酸性环境稳定,能缓解幽门螺杆菌对甲硝唑耐药的问题,其用途属于首次公开。
发明内容
解决的技术问题:为了解决幽门螺杆菌对甲硝唑容易耐药的问题,提高甲硝唑对耐药幽门螺杆菌的抑菌效果,本发明提供一种亚麻酸-甲硝唑化合物及其制备方法和应用,制备得的亚麻酸-甲硝唑对甲硝唑耐药的幽门螺杆菌有较好的抑制作用,且不容易产生耐药、有特异性抑制作用、酸性环境稳定,可作为治疗幽门螺杆菌感染的首选药物。
技术方案:一种亚麻酸-甲硝唑化合物的制备方法,包括如下步骤:第一步,脱水反应:按比例,反应容器中加入亚麻酸139mg,5毫升二氯甲烷(DCM),103mg 1,3-二环己基碳二亚胺(DCC)缩合剂,室温搅拌混匀;第二步,酯化反应:按比例,加入甲硝唑94mg,0.5mL三乙胺,5mg 4-二甲氨基吡啶(DMAP)作为催化剂,亚麻酸与甲硝唑的摩尔比为1:(1.1~1.2),室温反应过夜;第三步,过滤纯化:TLC检测亚麻酸原料消失完全,体系有白色沉淀析出,硅藻土过滤,滤液旋干后柱层析得酯化产物。
上述亚麻酸与甲硝唑的摩尔比是1:1.1。
上述制备方法制得的亚麻酸-甲硝唑化合物。
上述亚麻酸-甲硝唑化合物在制备治疗甲硝唑耐药的幽门螺杆菌药物中的应用。
有益效果:本发明成功制备亚麻酸-甲硝唑化合物,产率比较高;其次,本发明亚麻酸-甲硝唑制备方法简单、成本低;第三,本发明制备的亚麻酸-甲硝唑化合物可用于治疗甲硝唑耐药或敏感的幽门螺杆菌感染导致的急、慢性胃炎、胃、十二脂肠溃疡等疾病,而且其作用特异性高、毒副作用小、酸性环境稳定、不易产生耐药,可以缓解幽门螺杆菌对甲硝唑耐药的问题。
附图说明
图1为亚麻酸-甲硝唑化学反应示意图;
图2为亚麻酸-甲硝唑核磁氢谱鉴定图;
图3为亚麻酸-甲硝唑核磁碳谱鉴定图;
图4为亚麻酸-甲硝唑质谱鉴定图;在432.4位置有明显的特征峰.
图5为亚麻酸-甲硝唑傅里叶红外光谱鉴定图;将样品真空干燥,加入溴化钾后研磨压片,检测FTIR图谱。物的FTIR解析如下:3010cm
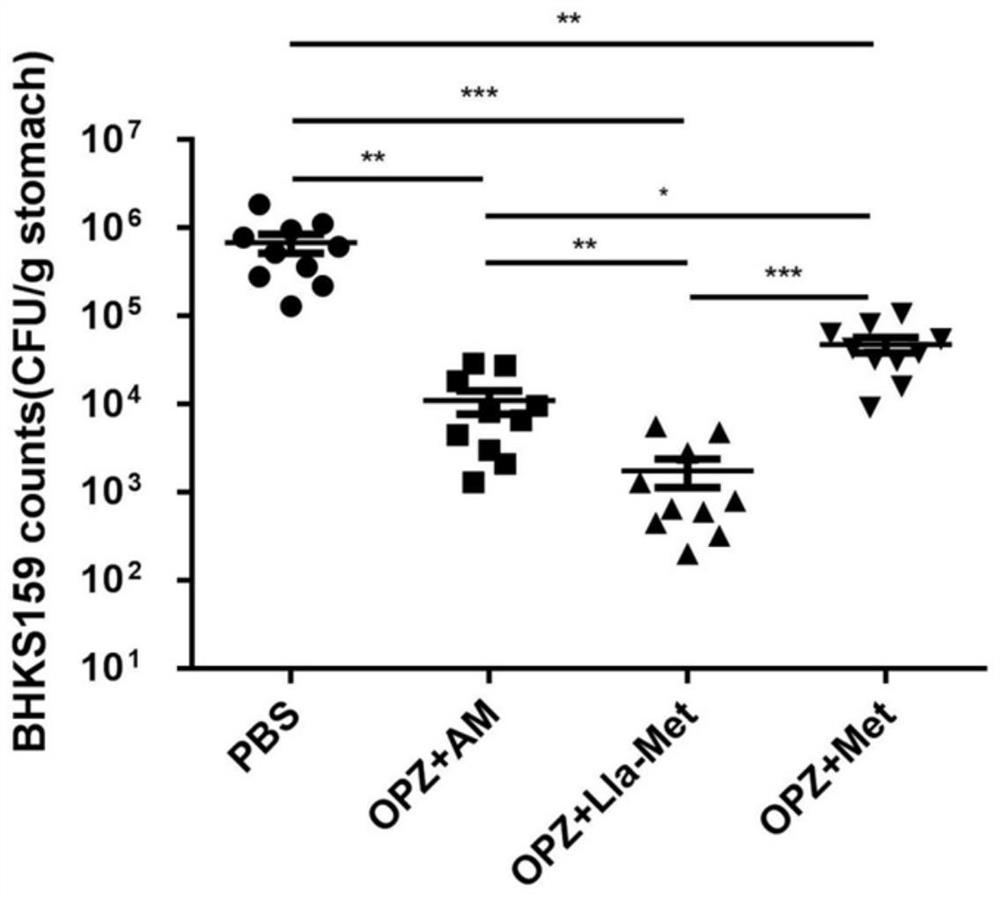
图6为亚麻酸-甲硝唑在小鼠体内对甲硝唑耐药的幽门螺杆菌的抑制作用示意图;OPZ为奥美拉唑,AM为阿莫西林加甲硝唑,Lla-Met为亚麻酸-甲硝唑,Met为甲硝唑;
图7为亚麻酸-甲硝唑化合物对小鼠胃粘膜炎症的修复作用示意图;
图8为亚麻酸-甲硝唑化合物体外对Ges-1、BGC823细胞毒性检测示意图;
图9为亚麻酸-甲硝唑体内10倍治疗量对小鼠胃、肝、肾、脾粘膜细胞的损伤情况示意图;
图10为亚麻酸-甲硝唑10倍治疗量对小鼠体重的影响示意图;
图11为亚麻酸-甲硝唑在酸性环境中的稳定性示意图;
图12为亚麻酸-甲硝唑耐药诱导示意图。
具体实施方式
实施例1
第一步:25毫升反应瓶中加入亚麻酸139mg,5毫升DCM,103mg DCC缩合剂,室温搅拌5分钟后,加入甲硝唑94mg,0.5mL三乙胺为碱,5mg DMAP作为催化剂,室温反应过夜。原料亚麻酸和甲硝唑摩尔比为1:1.1。
第二步:TLC检测亚麻酸原料消失完全,体系有白色沉淀析出,硅藻土过滤。滤液旋干后柱层析得亚麻酸-甲硝唑,约105mg,为黄色油状液体,产率:48.7%。产物经核磁、质谱、红外鉴定为亚麻酸-甲硝唑。
实施例2
第一步:25毫升反应瓶中加入亚麻酸139mg,5毫升DCM,106mg DCC缩合剂,室温搅拌8分钟后,加入甲硝唑104mg,0.6mL三乙胺为碱,5mg DMAP作为催化剂,室温反应过夜。原料亚麻酸和甲硝唑摩尔比为1:1.2。
第二步:TLC检测亚麻酸原料消失完全,体系有白色沉淀析出,硅藻土过滤。滤液旋干后柱层析得亚麻酸-甲硝唑,约102.8mg,为黄色油状液体,产率:45.3%。产物经核磁、质谱、红外鉴定为亚麻酸-甲硝唑。
实施例3
第一步:25毫升反应瓶中加入亚麻酸139mg,5毫升DCM,108mg DCC缩合剂,室温搅拌6分钟后,加入甲硝唑94mg,0.6mL三乙胺为碱,5mg DMAP作为催化剂,室温反应过夜。原料亚麻酸和甲硝唑摩尔比为1:1.1。
第二步:TLC检测亚麻酸原料消失完全,体系有白色沉淀析出,硅藻土过滤。滤液旋干后柱层析得亚麻酸-甲硝唑,约103mg,为黄色油状液体,产率:46.5%。产物经核磁、质谱、红外鉴定为亚麻酸-甲硝唑。
实施例4
亚麻酸-甲硝唑生物活性、安全性、稳定性、耐药性等评价
1.材料
1.1样品
亚麻酸-甲硝唑酯化产物用实施例1制备。
1.2菌株
(1)幽门螺杆菌菌株:标准菌株26695、G27;临床甲硝唑耐药菌株(由本实验室从临床患者胃粘膜样本分离培养获得,经革兰氏染色、氧化酶实验、尿素酶实验、过氧化物酶实验和CagA基因检测鉴定为幽门螺杆菌);左氧氟沙星和克拉霉素及甲硝唑多重耐药的小鼠胃粘膜定植菌株HP159(南京医科大学毕洪凯教授提供);
(2)非幽门螺杆菌菌株:金黄色葡萄球菌、铜绿假单胞菌、肺炎克雷伯杆菌、鲍曼不动杆菌、白色念珠菌、溶血葡萄球菌、枯草芽胞杆菌、大肠埃希菌、嗜麦芽寡氧窄食单胞菌、霍氏肠杆菌、摩氏摩根菌、奇异变形杆菌、热带假丝酵母菌、酿酒酵母菌、巴氏醋酐菌、弯曲乳杆菌、空肠弯曲菌、长双歧杆菌、脆弱拟杆菌、新生隐球菌(购自广东微生物保藏中心)。
1.3培养基和主要试剂:哥伦比亚培养基、脑心浸液培养基、选择性抗生素(万古霉素、多粘菌素B、甲氧苄氨嘧啶)、沙保罗培养基、血清、奥美拉唑、阿莫西林、克拉霉素、革兰氏染色液、细菌基因组DNA提取试剂盒、幽门螺杆菌16SrRNA特异性引物等。
1.4实验动物:C57BL/6。
1.5主要仪器:二氧化碳培养箱、恒温箱、离心机、组织破碎仪、电子天平、灌胃针、剪刀等。
1.6耗材:EP管、Tip头、离心管等。
2.方法与结果
2.1微量稀释法检测亚麻酸-甲硝唑对幽门螺杆菌的最低抑菌浓度(MIC,100μL体系)
(1)配备亚麻酸-甲硝唑化合物浓度2mg/mL。
(2)MIC板制备第一孔先加培养基167.2μL,再加12.8μL抗菌药物,倍比稀释至第10孔;第11孔不加药,保留90μL培养基,作为加菌不加药对照。
(3)菌液制备取固体平板上对数期生长的幽门螺杆菌用BHI培养基制作成菌悬液,调整浓度OD
(4)接种菌液取10μL加至第1-12孔(每孔菌液浓度约为1.0×10
(5)结果判断以在小孔内完全抑制细菌生长的最低药物浓度为MIC。当阳性对照孔第11孔(即不含抗生素)内细菌明显生长和第12孔(无菌)不生长试验才有意义。当在微量稀释法出现单一的跳孔时,应记录抑制细菌生长的最高药物浓度。如出现多处跳孔,则不应报告结果,需重复试验。每个药物重复3次试验。
(6)结果:亚麻酸-甲硝唑对甲硝唑敏感或耐药的幽门螺杆菌均有较好的抑制作用,特别是对甲硝唑耐药的幽门螺杆菌抑菌效果明显优于甲硝唑或亚麻酸或甲硝唑与亚麻酸联合的作用,结果见表1。
表1亚麻酸-甲硝唑对幽门螺杆菌的最低抑菌浓度(μg/mL)
备注:“-”甲硝唑敏感;“+”甲硝唑耐药。
2.2微量稀释法检测亚麻酸-甲硝唑对非幽门螺杆菌的最低抑菌浓度(MIC,100μL体系)
(1)配备亚麻酸-甲硝唑化合物2mg/mL。
(2)MIC板制备第一孔先加培养基167.2μL,再加12.8μL抗菌药物,倍比稀释至第6孔;第7孔保留90μL培养基,加10μL菌液;第8孔不加药,保留90μL培养基,作为加菌不加药对照。
(3)菌液制备取固体平板上对数期生长的幽门螺杆菌用BHI培养基制作成菌悬液,调整浓度OD
(4)接种菌液取10μL加至第1-8孔(每孔菌液浓度约为1.0×10
(5)结果判断以在小孔内完全抑制细菌生长的最低药物浓度为MIC。当阳性对照孔第7孔(即不含抗生素)内细菌明显生长和第8孔(无菌)不生长试验才有意义。当在微量稀释法出现单一的跳孔时,应记录抑制细菌生长的最高药物浓度。如出现多处跳孔,则不应报告结果,需重复试验。每个药物重复3次试验。
(6)结果:亚麻酸-甲硝唑对金黄色葡萄球菌等20种非幽门螺杆菌的最低抑菌浓度(MIC)均大于128μg/mL,结果见表2。
表2亚麻酸-甲硝唑对非幽门螺杆菌的抑制作用
备注:“+“有菌生长;”-“无菌生长。
2.3构建小鼠急性胃炎动物模型检测亚麻酸-甲硝唑在体内对幽门螺杆菌的抑制效果
2.3.1药物:亚麻酸-甲硝唑化合物、奥美拉唑、阿莫西林、甲硝唑均溶解稀释为10mg/mL。
2.3.2菌株:左氧氟沙星和克拉霉素及甲硝唑多重耐药的小鼠胃粘膜定植菌株HP159(南京医科大学毕洪凯教授提供)。
2.3.3动物造模:
(1)动物分组:将70只小鼠随机分出10只为阴性对照组,其余60只为感染组。对各组小鼠称重,计算平均体重。
(2)小鼠灌胃:60只感染组小鼠灌胃前12个小时禁食,然后用BHI配制的HP159悬液灌胃,菌液浓度为OD
(3)模型检查:末次灌胃后14天,对感染组和对照组小鼠称重,计算平均体重。随机取3只感染组小鼠禁食12小时,后断颈处死,解剖取小鼠胃,一部分胃组织保存在福尔马林中做病理检查;另一部分胃组织称重、匀浆后稀释10、100、1000倍,用接种环均匀涂布在含有10%血清的哥伦比亚培养基平板上,置于三气培养箱(10%CO
(4)菌株鉴定:从培养物中取针尖样大小的透明菌落进行革兰染色镜检;提取细菌DNA,用幽门螺杆菌16SrDNA特异性引物,PCR扩增,扩增产物以1.0%的琼脂糖凝胶电泳检测;胃组织进行石蜡切片并做HE染色检查。
(5)检查和鉴定结果:每只小鼠胃组织定植量范围为1×10
经HE染色检查胃粘膜病理损伤,发现有胃粘膜炎症细胞聚集,局部有粘膜有糜烂;经革兰氏染色检查培养物具有典型的幽门螺杆菌形态;经PCR扩增鉴定为幽门螺杆菌,结果汇总见表3,可以证明造模已成功。
表3造模小鼠验证
备注:“+”鉴定为幽门螺杆菌;“-”鉴定为非幽门螺杆菌
2.3.3药物治疗效果观察:
(1)动物分组:实验组将造模成功的感染组平均分成5组,分别为PBS组、奥美拉唑加阿莫西林和甲硝唑组、奥美拉唑加亚麻酸-甲硝唑组、奥美拉唑加甲硝唑化合物组,每组10只;未感染幽门螺杆菌的10只小鼠为阴性对照组。
(2)动物给药:实验组灌胃给药,有奥美拉唑的组先给予奥美拉唑,30min后再给其它药物,给完药物后禁食禁水4小时;小鼠体重按照平均20g/只计算,给药量为奥美拉唑138.2mg/kg、阿莫西林28.5mg/kg、甲硝唑30mg/kg、亚麻酸-甲硝唑化合物30mg/kg,每天给药1次,连续3次;阴性对照组给PBS液,容量、次数同上。
(3)药效检测:停药后第3天感染组的小鼠称重并计算平均体重,行断颈处死,取胃组织,HP159的分离培养和鉴定同2.3.2(3)、(4)。
(4)治疗效果:奥美拉唑+亚麻酸-甲硝唑化合物组对幽门螺杆菌菌的抑制明显优于三联治疗组(奥美拉唑+阿莫西林+甲硝唑)(P<0.05),如图6;奥美拉唑+亚麻酸-甲硝唑化合物组对炎症胃粘膜修复明显优于三联治疗组,如图7。亚麻酸-甲硝唑化合物能克服幽门螺杆菌对甲硝唑的耐药性,可以作为一线药物治疗耐药幽门螺杆菌感染导致的难治性胃炎。
2.4亚麻酸-甲硝唑化合物生物安全性评价
2.4.1亚麻酸-甲硝唑化合物体外对Ges-1、BGC823细胞毒性检测
用CCK-8法对亚麻酸-甲硝唑进行细胞毒性检测,具体步骤如下:
(1)制备Ges-1和BGC823细胞悬液,将细胞浓度调为1×10
(2)铺板:将细胞悬液加入96孔板中,每孔100μL,不同浓度的细胞做3个重复。
(3)37℃培养箱培养24小时。
(4)96孔板中分别加入亚麻酸-甲硝唑、PBS,使孔内化合物的终浓度为320μg/mL、160μg/mL、80μg/mL、40μg/mL、20μg/mL。
(5)37℃培养箱继续培养24小时。
(6)96孔板中加入10μL的CCK-8溶液,轻敲混匀后继续培养4小时。
(7)450nm测定吸光度,细胞存活率测定公式如下:
细胞存活率=[(As-Ab)]/[(Ac-Ab)]×100%
其中,As为有药物、CCK8、细胞培养基孔;Ac为没有药物,只有CCK-8和细胞培养基孔;Ab为没有药物和细胞,只有CCK-8和培养基孔。根据计算的存活率建立生存曲线。
(8)结果:亚麻酸-甲硝唑在320μg/mL与PBS的作用相当,对细胞基本无毒性,如图8.
2.4.2亚麻酸-甲硝唑体内10倍治疗量对小鼠脏器细胞的损伤情况及对体重的影响
(1)准备小鼠:20只8周龄C57BL/6小鼠,随机分为10只为给药组,10只为阴性对照组。
(2)灌胃给药:10倍亚麻酸-甲硝唑治疗量给药,即每只小鼠300mg/kg给药,连续3天,每天给药1次;阴性对照组给PBS液,次数和量同给药组。
(3)称量体重:从给药前1天开始称小鼠体重,连续称量7天。
(4)药效检测:停药后第3天感染组的小鼠称重并计算平均体重,行脱臼断颈处死,取胃、肾、肝和脾组织,做病理切片并进行HE染色。
(5)结果10倍亚麻酸-甲硝唑治疗量给药组和阴性对照组小鼠的胃、肾、肝和脾组织未见有损伤,如图9;实验组小鼠体重未见有明显变化,如图10。
2.5亚麻酸-甲硝唑化合物对酸稳定性评价
薄层色谱法检测,具体步骤如下:
(1)配制pH 3.0的酸性环境和pH 7.0的中性环境。
(2)无水乙醇将亚麻酸-甲硝唑充分溶解。
(3)将溶解好的亚麻酸-甲硝唑化合物加入到pH3.0的酸性环境和pH 7.0的中性环境中。
(4)展开剂的配制:二氯甲烷和甲醇按体积比为20:1配制,室温饱和2分钟。
(5)点样:先用铅笔在薄层板上距末端1cm处轻轻划一横线,然后用毛细管吸取中性环境亚麻酸-甲硝唑、pH3.0亚麻酸-甲硝唑点在横线的不同位置。点样与薄层板的边缘间隔至少1cm,避免边缘效应。
(6)展开:将薄层板放入展开室中,由于毛细管的虹吸作用,展开剂在薄层板上缓慢前进,前进至一定间距后,将薄层板取出。样品组分因移动速度不同而彼此分开。
(7)254nm紫外灯下观察薄层板上斑点的位置。
(8)结果判读:不同的物质在同一展开剂中极性不同,待薄层板取出后,样品组分因移动速度不同而彼此分开。紫外灯下观察时,可以看到相同的物质在薄层板上形成的斑点在同一水平线上。本实验结果pH 3.0的酸性环境和pH 7.0的中性环境的亚麻酸-甲硝唑展开的位置相同,说明亚麻酸-甲硝唑在pH 3.0的酸性环境具有较好的稳定性,如图11。
2.6亚麻酸-甲硝唑化合物对甲硝唑耐药性评价
(1)培养基的制备:新鲜的脑心浸液培养基中加入10%的胎牛血清。
(2)HP G27的增菌培养:将HP G27接种到含有10%胎牛血清的脑心浸液培养基中,三气摇床孵育72小时,转数170r/min。
(3)菌悬液的配制:将HP G27配制成1×10
(4)24孔板中加入亚麻酸-甲硝唑对HP G27进行药物诱导,亚麻酸-甲硝唑的初始诱导浓度为1/4MIC,即0.5μg/mL,孵化3天后检测HP G27的MIC,同时更换培养液1次。如果HPG27的MIC升高,要对应调整诱导的药物浓度,总共检测6次(共18天)。设置甲硝唑为阳性对照,初始诱导浓度为1/4MIC,即1μg/mL,诱导步骤同亚麻酸-甲硝唑组。
(5)结果:甲硝唑经过18天耐药诱导后,MIC已增加了64倍,即为64μg/mL;亚麻酸-甲硝唑没有产生耐药,MIC仍然为2μg/mL,如图12。
- 亚麻酸-甲硝唑化合物及其制备方法和应用
- 亚麻酸-甲硝唑化合物及其制备方法和应用
