可用于超高流速稳定捕获CTC的微流控芯片及装置
文献发布时间:2023-06-19 12:04:09
技术领域
本发明涉及医疗诊断装置领域,具体涉及一种可用于超高流速稳定捕获CTC的微流控芯片及装置。
背景技术
根据国际癌症研究机构的最新调查数据,2018年全球约出现1819万癌症新增病例,960万癌症死亡病例,而在癌症死亡病例中,转移癌是癌症致死的最大原因,因此癌症的早诊断早治疗尤为重要,能够有效防止转移癌的发生。循环肿瘤细胞(简称CTC)是由原位癌脱落进入循环系统的癌细胞,与癌症转移有着密切的关系。研究表明,大部分癌症患者在原发癌被发现的时候,其血液里已出现CTC,因此CTC对癌症的早期诊断、实时监测、预后评估中都起着重要作用,且相较于现有诊断手段,能够更早地发现癌症。但CTC属于稀有细胞,其在外周血中每毫升只有几个到几百个,由于缺乏高敏感性的技术手段对外周血中的CTC进行分离。因此,开发高效率高纯度捕获CTC且操作方便快捷的新技术无疑是当务之急。
在现有的微流控芯片设计中,一部分依赖于生化方法,通过癌细胞表面EpCAM受体进行特异性捕获,该方法往往需要复杂的前置操作,且处于上皮-间叶转化(EMT)的CTC很难被检出;另一部分使用癌细胞与红细胞、白细胞物理特性的差异进行分离,而物理方法分选往往在流速上限和对流速的鲁棒性上无法兼顾,且捕获纯度偏低。
CN 111909828 A及Lu,C.,et al.,Lab on a Chip,2020.20(22):p.4094-4105中均公开了一种适用于循环肿瘤细胞捕获的微流控芯片(如附图1所示),该芯片在5-40mL/h的流速区间均能达到90%以上的稳定捕获,且白细胞污染率较低(去除率为4log)。但是在后续研究中发现,在样品流速较高时,其对目标颗粒的捕获效率仍会有一定程度的下降。
发明内容
为了解决上述技术问题,本发明对其捕获效率降低的原因进行了探究,发现其是由微流控芯片中的样品通路(尤其是汇聚结构与分流通道的连接通道处)突然拓宽所导致的射流效应所导致的。根据上述发现,本发明对微流控芯片的结构进行了进一步优化,提供了一种高效率、高纯度、操作简单的可用于超高流速稳定捕获循环肿瘤细胞的微流控芯片及装置。
具体而言,本发明首先提供一种微流控芯片,其包含汇聚分流模块,所述汇聚分流模块包含入口、主通道、一个或多个汇聚分流单元、以及出口;
所述入口、一个或多个汇聚分流单元和出口通过主通道连通设置,样品由入口进入汇聚分流单元后由出口排出或者部分排出;
所述汇聚分流单元将样品中的目标颗粒汇聚在液流中心;同时将不含有目标颗粒的旁侧液流经出口排出或者部分排出,从而在不损失目标颗粒的情况下降低样品的流速和/或流量;
在样品通路中,当沿样品流动方向的通路拓宽时,在拓宽处通道的S
本发明发现,通过上述结构改进,可以很好地改善原芯片在样品流速较高时所具有的捕获效率损失。
作为优选,所述汇聚分流单元包括一个或多个串联排列的汇聚结构、以及分流通道;
所述汇聚结构将样品中的目标颗粒汇聚在液流中心,将分离出的不含有目标颗粒的旁侧液流经由所述分流通道向出口排出或者部分排出;
在所述汇聚结构与分流通道的连接通道处,S
本发明进一步发现,在按上述方式设定所述汇聚结构与分流通道的连接通道后,芯片在样品高流速时的捕获效率有明显改善。
更优选地,所述汇聚结构与分流通道的连接通道呈弧线状,更优选为弧线状分支型结构。
作为优选,所述汇聚结构包括中心通道以及旁侧支流通道;
其中,所述中心通道在两端均与主通道相接并且同轴排列;
所述旁侧支流通道在两端均与主通道以及中心通道相交汇;进一步优选地,所述旁侧支流通道为两条,再一步优选地,所述两条旁侧支流通道排列在中心通道两侧,更优选地,所述两条旁侧支流通道对称排列在中心通道两侧,并且具有相同的尺寸参数。
在本发明中,通过控制各通道的流阻(即流动阻力),使所述汇聚分流单元将样品中的目标颗粒汇聚在液流中心;同时将不含有目标颗粒的旁侧液流经出口排出或者部分排出,从而在不损失目标颗粒的情况下降低样品的流速和/或流量。
其中,所述流阻的比例关系基于通道的L(H+W)
流阻计算相关原理详见CN 111909828 A。
在本发明中,所述样品源自全血、血浆、血清、灌流液、尿液、组织液、脑脊液、细胞培养液或细胞混合液,更优选地,所述样品为全血或者灌流液。优选所述目标颗粒为肿瘤细胞,更优选为循环肿瘤细胞(CTC)。本领域人员可依照上述样品及目标颗粒的参数来设置微流控芯片中各样品通路的具体参数。
作为优选方案,在样品由所述主通道流入所述汇聚分流单元的位置,还设有主通道收窄处;设W
其中,d1的取值等于r
作为优选方案,设第n个汇聚结构的中心通道的流阻为R1
其中,d1的取值等于r
对于具有一定刚性的目标颗粒物而言(例如细胞,特别是癌细胞,如CTC等),d1可以认为等于r
作为优选,所述分流通道两端均与主通道相交汇,其中上游的交汇处靠近汇聚分流单元中最后一个汇聚结构,下游交汇处与靠近微流控芯片的出口;优选地,分流通道为两条,排列在主通道两侧;更优选对称排列在主通道两侧,并且具有相同的尺寸参数。
作为优选方案,第m个汇聚分流单元的分流通道的流阻确定方式如下:设所述第m个汇聚分流单元的分流通道与主通道的两个交汇处之间区域的整体流阻(或者叫做分流通道内部区域的整体流阻)为R1
作为优选,所述微流控芯片还包括捕获模块,用于捕获目标颗粒。
更优选地,所述捕获模块位于汇聚分流单元的下游,两端均与主通道连通。
进一步优选地,所述捕获模块包括多个阵列,所述阵列由任意形状(例如正方体、立方体、三棱柱、圆柱等,或者截面是正方形、矩形、三角形、圆形等形状)的小块排列而成,相邻小块之间存在间隙d,所述间隙d的大小被定义为两个相邻小块表面上距离最近的两点之间的距离;每个阵列中小块之间的间隙d是相同的,不同阵列中的小块之间的间隙d沿样品流入方向逐级递减。例如,当阵列个数为4个时,沿样品流入方向的各阵列中的所述间隙d的大小依次为12μm、10μm、8μm和6μm。
作为优选,在所述入口与第一个汇聚分流单元的连接通道间,还设有过滤单元,以防止芯片堵塞。
在本发明的一个较佳实施例中,所述微流控芯片的材料为聚二甲基硅氧烷(PDMS)。
本领域人员可对上述方案进行组合,得到本发明微流控芯片的较佳实施例。
进一步的,本发明还提供一种三维微流控芯片,其包括层叠设置的汇聚分流层芯片和捕获层芯片,
其中,汇聚分流层芯片上设有汇聚分流模块,所述汇聚分流模块的结构同前所述;
所述汇聚分流层芯片上的汇聚分流单元下游设有第一出口和第二出口,所述第一出口用于排出含有目标颗粒的液流,所述第二出口用于排出不含有目标颗粒的旁侧液流;
所述捕获层芯片上设有样品进口和样品出口,所述样品进口与所述第一出口连通设置;所述样品出口与所述第二出口连通设置。
本发明还发现,通过上述层叠设置,更有利于降低样品的流速和/或流量,因而可以在提高样品流速上限的同时,降低单层芯片的面积,这样也同时有利于控制成本。
更优选地,所述捕获层芯片的样品进口与样品出口的连接通路间设有一个或多个阵列,更优选为多个,所述阵列由任意形状(例如正方体、立方体、三棱柱、圆柱等,或者截面是正方形、矩形、三角形、圆形等形状)的小块排列而成,相邻小块之间存在间隙d,所述间隙d的大小被定义为两个相邻小块表面上距离最近的两点之间的距离;每个阵列中小块之间的间隙d是相同的,不同阵列中的小块之间的间隙d沿样品流入方向逐级递减。例如,当阵列个数为4个时,沿样品流入方向的各阵列中的所述间隙d的大小依次为12μm、10μm、8μm和6μm。
在本发明的捕获模块或捕获层芯片中,通过对阵列中小块结构的精细化改进、和/或增加阵列的面积、和/或增加阵列个数(其间隙d沿样品流入方向逐级递减),可以进一步提升流速的上限,其均属于本发明要求保护的范围。
在本发明的一个较佳实施例中,所述微流控芯片和捕获层芯片的材料为聚二甲基硅氧烷(PDMS)。
作为优选,以层叠设置的一个汇聚分流层芯片和一个捕获层芯片为一组,所述三维微流控芯片包含多组层叠设置的汇聚分流层芯片和捕获层芯片;不同组间的汇聚分流层芯片的入口连通设置,同时,不同组间的汇聚分流层芯片的第二出口及捕获层芯片的样品出口连通设置。
本领域人员可对上述方案进行组合,得到本发明中三维微流控芯片的较佳实施例。
本发明还提供一种富集和/或捕获样品中目标颗粒的装置,其包括:所述的微流控芯片,和/或,所述的三维微流控芯片。
作为优选,所述装置中还包括检测单元,用于对含有目标颗粒的液流和/或不含有目标颗粒的旁侧液流进行检测。
本发明还提供所述的微流控芯片、或所述的三维微流控芯片或所述的装置在以下任一方面的应用:
(i)富集和/或捕获样品中目标颗粒;
(ii)去除样品溶液中的目标颗粒;
(iii)降低样品流量和/或流速。
优选所述样品源自全血、血浆、血清、灌流液、尿液、组织液、脑脊液、细胞培养液或细胞混合液,更优选地,所述样品为全血或者灌流液;
优选所述目标颗粒为肿瘤细胞,更优选为循环肿瘤细胞(CTC)。
作为优选,所述样品在所述微流控芯片或三维微流控芯片中的流速为150mL/h以内,比如可以是5-150mL/h。
本发明进一步提供一种目标颗粒物富集和/或捕获方法,其包括:
将包含目标颗粒的样品溶液注入所述的微流控芯片、或所述的三维微流控芯片、或所述的装置中,收集含有目标颗粒的液流。
本发明进一步提供一种去除样品溶液中目标颗粒的方法,其包括:
将包含目标颗粒的样品溶液注入所述的微流控芯片、或所述的三维微流控芯片、或所述的装置中,收集不含有目标颗粒的旁侧液流。
作为优选,在注入样品前,使用1×磷酸缓冲液(PBS)和0.1%牛血清白蛋白溶液(BSA)对样品通路进行润湿和预处理。更优选所述润湿和预处理的时间为1.5~3h。
基于上述技术方案,本发明的有益效果如下:
本发明通过对流速限制关键结构的发现与优化,使单块的芯片流速上限提高3倍(约150mL/h),且在高流速下仍然具有优异的捕获效率与捕获纯度。同时,通过对芯片排布方式的优化,本发明的三维微流控芯片在更有利于降低样品的流速和/或流量的同时,使单层芯片的面积缩小为原来的1/6-1/4。通过对上述两种优化方式的共同使用,可以实现流速上限的倍数增长。
附图说明
图1为原设计芯片的结构示意图与实物图(Lu,C.,et al.,Lab on a Chip,2020.20(22):p.4094-4105);其中,B为实物图,而A、C-G均为结构示意图。
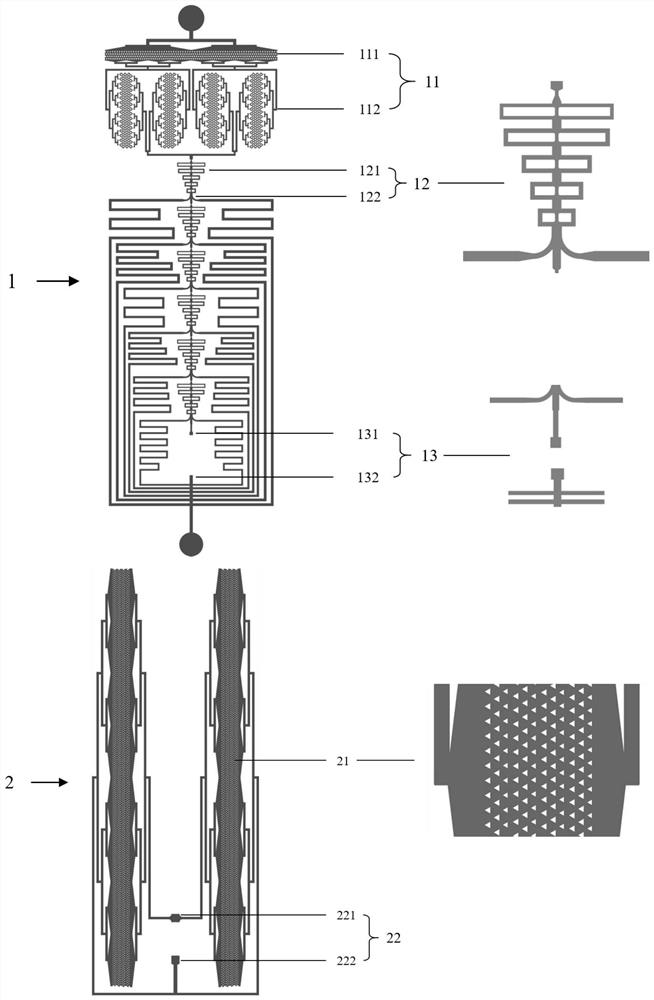
图2是本发明实施例提供的三维微流控芯片的结构的结构示意图;图2中,1、汇聚分流层芯片;11、过滤单元;111、方形过滤结构;112、S形过滤结构;12、汇聚分流单元;121、汇聚结构;122、分流通道;13、出口;131、第一出口;132、第二出口;2、捕获层芯片;21、三角捕获区域;22、样品进出口;221、样品进口;222、样品出口。
图3是本发明实施例提供的三维微流控芯片的结构的制作方法的流程示意图;
图4是本发明实施例提供的三维微流控芯片的结构的制作方法的示意图;
图5是本发明实施例提供的三维微流控芯片的结构的使用方法的流程示意图;
图6是本发明实施例提供的三维微流控芯片的结构的三角捕获区域(阵列)的间隙尺寸示意及扫描电镜图;
图7是本发明实施例提供的三维微流控芯片的结构的实物图;
图8是(i)原设计的第一个分流单元的流线模拟图与(ii)本发明实施例提供的三维微流控芯片的结构的第一个分流单元的流线模拟图的对比;
图9是(i)原设计的第一个分流单元的绿色荧光大肠杆菌实测流线图与(ii)本发明实施例提供的三维微流控芯片的结构的第一个分流单元的绿色荧光大肠杆菌实测流线图的对比;
图10是原设计与本发明实施例提供的三维微流控芯片的结构的入口流速与捕获效率的对比。
具体实施方式
以下实施例用于说明本发明,但不用来限制本发明的范围。
实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件,或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可通过正规渠道商购买得到的常规产品。
实施例1
本实施例提供一种用于检测CTC的三维微流控芯片,如图2所示,其为双层芯片,包括:汇聚分流层芯片1和捕获层芯片2。
汇聚分流层芯片1上设有汇聚分流模块,所述汇聚分流模块包括由主通道依次连通的入口、过滤单元11、串联的6个汇聚分流单元12、以及出口13。
其中,所述过滤单元11包括高度60微米的方形过滤结构111与高度30微米的S形过滤结构112,防止芯片堵塞。
所述汇聚分流单元12包括收集口、主通道收窄处、5个汇聚结构121和两侧分列的2个分流通道122,其高度均为60微米。经流阻计算,在保留癌细胞的情况下,将部分白细胞与红细胞进行分流,达到浓缩降速的效果。
具体的,收集口的最宽处截面直径W1=200μm,整体呈现漏斗状结构,主通道收窄处的截面直径W2=30μm,主通道的截面直径为90μm。对于每一个汇聚分流单元12,其中所述5个汇聚结构121的旁侧分流通道122的宽度分别为30,40,40,40,40μm,长度分别为1290,1210,830,650,490μm(单侧的长度),中心通道的宽度Ws为30μm,主通道2的宽度2W
出口13包括进入捕获层芯片2的第一出口131与捕获结束用于排出不含有目标颗粒的旁侧液流的第二出口132,高度为130微米。
捕获层芯片2(间隙尺寸示意及扫描电镜图见图6)包括:若干分支型通道结构、三角捕获区域21与2个样品进出口22,其高度均为60微米。三角捕获区域21包含4层不同间隙的三角结构,其间隙分别为12、10、8、6微米;2个样品进出口22包括与第一出口131相连的样品进口221和与第二出口132相连的样品出口222。
汇聚分流层芯片1和捕获层芯片2的材料为聚二甲基硅氧烷,即芯片加工材料为PDMS(polydimethylsiloxane)。
对芯片进行功能分区后,芯片面积可显著缩小,芯片实物图如图7所示。显而易见的,单行芯片的面积较原芯片缩小4倍有余,4×并行芯片面积小于原芯片面积,因此该设计能够允许在有限面积内进行并联以实现整体流速上限的提升。
需要提及的是,本发明中通道的尺寸高度可依据实验进行调整,原理详见CN111909828 A。
实施例2
本实施例提供一种实施例1中的三维微流控芯片的制作方法,如图3所示,主要包括如下步骤:
步骤S1:分别制备汇聚分流层芯片和捕获层芯片的模具。
步骤S2:将制备材料涂布在模具上并进行固化处理。
步骤S3:将汇聚分流层芯片与捕获层芯片的连接位点对位贴合烘烤。
步骤S4:对芯片的结构进行等离子体处理,与玻片键合烘烤。
在一个具体的实施例中,如图4所示,制作三维微流控芯片的结构的步骤如下:
(1)模具的制备。用L-Edit绘图,将其打印在塑料胶片或光学掩膜上,作为曝光掩模,用于后续实验。总共需要一块硅片模具用于制作汇聚分流层芯片芯片,一块铬板用于背曝光制作捕获层芯片。两块模具制备过程基本一致,只是掩膜有差异,使用SU8光刻胶,匀胶时以500rpm的转速预甩10s,再根据不同高度要求设置不同转速甩60s。在95度电热板上烘30min后,放入曝光机进行曝光,曝光时间需要参照曝光机的帮助文档以及实际光强来确定。之后再在95度电热板上烘15min,显影就可以得到模具。
(2)芯片的制作。细胞进样层及培养层都是通过PDMS注模得到的,汇聚分流层芯片和捕获层芯片均需要A胶(单体)与B胶(交联剂)的配比为8:1,混合均匀,抽真空去除气泡后,汇聚分流层芯片模具通过匀胶机(1000rpm,30s)将PDMS旋涂在模具上,可以得到厚度约100um的PDMS薄膜。捕获层芯片厚度在3mm以上。固化时先将两块模具放入70度烘箱中烘40min,之后取出两层芯片,此时PDMS已经初步固化。利用显微镜对通孔结构进行对位,放入烘箱中烘过夜,PDMS会继续固化,两层芯片会牢固地粘在一起。
(3)芯片封装与改性。将芯片与玻片表面进行等离子体处理,贴合烘烤过夜。在使用芯片前,需要进行20分钟的抽真空处理,方便进液时排出芯片内气体。需要注意的是真空处理后,芯片内部会慢慢和外界气压平衡,所以预处理操作需要在处理后30分钟内完成。
实施例3
本实施例提供一种实施例1中的三维微流控芯片的使用方法,如图5所示,该方法主要包括如下步骤:
步骤S1:通入1×PBS和0.1%BSA对芯片进行润湿和预处理,静置2小时。
步骤S2:将检测样本通入芯片进行CTC捕获,流出液体使用孔板收集。
步骤S3:对芯片三角捕获区及孔板进行显微拍摄计数。
需要注意的是,在进行血液样本检测时,预处理阶段需对芯片进行肝素润湿,在显微计数前可通入红细胞裂解液方便成像。
试验例
关于改进前后的微流控芯片的原理解释及效果差异,具体说明如下:
流体在管道内流动时,主要会存在两个方向相反的力:由速度分布导致的剪切力F
层流涡旋发生的条件有两个:其一是通道结构出现收窄-拓宽的结构,在更普适的三维情况下,本发明沿流体流动方向作截面,考虑将截面面积作为评判标准,研究表明,该层流涡旋现象不仅存在于二维收窄-拓宽结构中,在三维中突然增大截面面积,导致壁面力突然减小,亦会出现该现象;其二是雷诺数Re达到一定大小,雷诺数定义为Re=ρU
原设计中,如图1中C和图8中(i)所示,最后一个汇聚单元主通道宽度为30微米,在经过最后一个汇聚单元进入分流通道时,通道宽度为200-300微米,且缓冲区较短,在主通道拓宽后又迅速进入分流结构。经计算,采用流体粘度μ=0.8949mPa·s,密度ρ=1×10
培养基体系COMSOL流线模拟如图8中(i)所示,所采用参数为流体粘度μ=0.8949mPa·s,密度ρ=1×10
由层流涡旋现象产生的条件可知,若要减弱该现象对芯片功能的影响,在不降低入口流速即不减小雷诺数Re的情况下,需对通道收窄-拓宽的结构进行更改。在收窄-拓宽结构中,当截面面积之比S
因此,本发明在分流结构上进行改进,通过收窄的方式大幅减弱射流效应,进而提高单芯片流速上限。具体结构及COMSOL模拟结果如图8中(ii)所示,本发明将原设计分流结构200-300微米宽的通道更改为100微米,此时S
在一个实施例中,通过绿色荧光大肠杆菌对芯片的流速上限进行检测,如图9所示。图9中(i)为原设计芯片中第一个分流结构的实测流线图,图9中(ii)为本发明提供的准三维高通量检测芯片的第一个分流结构的实测流线图。在原设计中,20mL/h的流速下,第一个分流结构流线分布正常,在40mL/h时已出现明显的流线不稳定,当入口流速提升至60mL/h时,已能够明显看到涡旋的产生;而在本发明提供的芯片设计中,40-100mL/h的流速范围内,第一个分流结构均未出现流线不稳定的现象。可以看出,对于分流位点的改进,能够大幅提升芯片的流速上限。
在一个具体的试验例中,在培养基体系中注入一定数量的癌细胞,将样本推入原设计芯片及本发明所提供的三维微流控芯片中,捕获效率如图10所示,其中捕获效率的定义为:捕获效率=三角区捕获癌细胞数/(三角区捕获癌细胞数+流出芯片废液中癌细胞数)。可以看到,在原设计中,5-20mL/h的流速区间内,该芯片的捕获效率能够稳定在90%以上,当入口流速提升至30mL/h时,捕获效率显著下降至80%左右;而在本发明所提供的三维微流控芯片中,在入口流速5-40mL/h的区间内,芯片捕获效率均可达到90%以上,入口流速提升至60mL/h时,芯片捕获效率依然可以稳定在85%左右,入口流速达到80mL/h时,芯片捕获效率降至80%。通过对比可知,本发明所提供的三维微流控芯片结构能够将流速上限提升3倍左右。
需要说明的是,上述具体的试验例中所讨论的流速均在培养基体系内,由于培养基体系和血液样本黏度不同,因此流速上限与实际检测(样本一般为血液样本)中的100-150mL/h有所出入,此处着重讨论流速上限提升倍数。
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
- 可用于超高流速稳定捕获CTC的三维微流控芯片及装置
- 可用于超高流速稳定捕获CTC的微流控芯片及装置
