一种变形假单胞菌抑菌性适配体及其筛选方法
文献发布时间:2023-06-19 12:11:54
技术领域
本发明涉及一种核酸适配体,尤其涉及一种变形假单胞菌抑菌性适配体及其筛选方法。
背景技术
变形假单胞菌隶属于假单胞菌科,假单胞菌属,恶臭假单胞菌组,杀香鱼假单胞菌种,是一种直或微弯、不呈螺旋状的革兰氏阴性杆菌,以单极毛或数根极毛运动,需氧,不生芽孢,养殖中会引起香鱼、大黄鱼、虹鳟、斜带石斑鱼的疾病。在大黄鱼养殖中,出现的最为普遍,大黄鱼发病初期的主要症状是病鱼活力下降、游动缓慢、食欲减退或彻底丧失,但体表无明显症状,偶见溃疡;剖检后可见内脏器官病变严重,脾脏、肾脏和肝脏均出现白色结节,病情严重者整个肾脏和脾脏均被白色结节包围覆盖;对白色结节内脏进行组织病理学观察后,结果显示病鱼的肝脏、脾脏和肾脏组织均发生炎性病变,含铁血黄素沉积,变性或坏死组织细胞与菌体形成肉芽肿组织结节,即为肉眼可见的“白点”。目前,解决变形假单胞菌带来的病害问题,主要依靠抗生素。由于抗生素的广泛运用,病原菌的耐药性以及水产用药抗生素的局限性使得水产养殖在疾病暴发过程中逐渐药无可用,用无有效,给水产养殖带来巨大挑战,因此寻求能够代替抗生素治疗变形假单胞菌带来疾病问题的健康药物成为科研重点。
核酸适配体(Aptamer)是通过指数富集配体的系统进化技术(SystematicEvolution of Ligands by Exponential Enrichment,SELEX)得到的一段单链DNA或者RNA。Ellington等人在1990年首次报道,核酸适配体具有很多优势:核酸适配体可在体外筛选,过程不依赖动物、细胞、甚至不依赖体内条件;免疫原性低,无明显毒副作用;靶标范围较广,包括金属离子、蛋白质、小分子、细胞和细菌等等。核酸适配体自SELEX技术和体外筛选技术等建立以来得到了快速的发展。
适配体还被称为化学抗体,且与抗体比较起来,它又具备一些自身独有的特性:易于修饰,稳定性高:传统的蛋白质性质的抗体在高温下易发变性和降解,需要进行严格的低温保存。而作为寡核苷酸片段的适配体,其稳定性明显优于抗体;亲和力高,特异性强:适配体对靶物质通常具备较高的结合率,对应的Kd值在nM至pM范围内,有的适配体甚至比抗体对抗原的亲和力还高;筛选周期短,化学合成简便:常规抗体的获得需要利用实验动物来制备,过程不仅繁琐,往往整个过程至少需要耗费3-6个月,且其生产成本不菲。而适配体无需动物实验,只需要利用分子生物学技术体外进行多轮反复筛选即可获得目标序列,整个筛选过程只需1-2个月,并且在为了获得足够的适配体分子,在后续流程中,我们可借助聚合酶链式反应进行扩增获得大批量适配体。因此,相比抗体,适配体更适合临床应用和工业化批量生产;分子结构小由于这一优势,适配体更易于穿透组织屏障从而能在医学领域充当药物角色,发挥治疗作用。关于核酸适配体的抑菌效果,杨杨等研究了结核分枝杆菌PPK2核酸适配体的抗结核效果,结果发现PPK2蛋白核酸适配体能够与结核病人血清PPK2蛋白选择性结合,对体外结核分枝杆菌表现出良好的抑菌活性。程莉娟等将筛选出的三条沙门氏菌适配体进行序列优化后,测定其亲和力以及抑菌性,发现浮游菌的抗菌性最高达到了74%。
发明内容
本发明要解决的技术问题,在于提供一种变形假单胞菌抑菌性适配体的筛选方法以及能特异性识别抑制变形假单胞菌生长的核酸适配体。
本发明是这样实现的:
本发明首先提供了一种变形假单胞菌抑菌性适配体,其核苷酸序列按5’-3’的顺序如下:
Y1:
TCAGTCGCTTCGCCGTCTCCTTCAGCGGGATGAGGGAGTAGGAGGGCCACAGTGGACTGCACAAGAGGGAGACCCCAGAGGG,
Y2:
TCAGTCGCTTCGCCGTCTCCTTCAGGAGACGGCTCTAAGTAACGTCGCACATATCGCGGCACAAGAGGGAGACCCCAGAGGG,
Y3:
TCAGTCGCTTCGCCGTCTCCTTCAGCCGGGGTGGTCAGTAGGAGCAGCACAAGAGGGAGACCCCAGAGGG,
Y4:
TCAGTCGCTTCGCCGTCTCCTTCCGATCACTGTTGACCTAGTGGGGATGCGTCAGGGATAAGGGTGCACAAGAGGGAGACCCCAGAGGG,
Y10:
TCAGTCGCTTCGCCGTCTCCTTCGCGGACGCGAAGGAGACGGTCTTCCGGTAGCTTCGGCACAAGAGGGAGACCCCAGAGGG。
本发明还提供了一种变形假单胞菌抑菌性适配体的筛选方法,包括以下步骤:
(2)菌的处理:取培养好的变形假单胞菌洗涤后加无菌培养液混合均匀,测菌液OD值,然后取含菌量为(1-10)×10
(2)结合:取ssDNA随机文库,随机ssDNA文库为:5′
-TCAGTCGCTTCGCCGTCTCCTTC(N35)GCACAAGAGGGAGACCCCAGAGGG-3′,长度为82个碱基,N35为含35个随机碱基的核苷酸序列。用2×结合缓冲液稀释到2μmol/L 100μL,在95℃恒温金属浴中变性5min后冰浴10min,然后加入到前述的菌悬液中,混匀后在28℃,100r/min的摇床中结合2h;
(3)分步分离:结合完成后,4000r/min离心5min后弃去沉淀,留下上清,将上清100000r/min离心5min,留下沉淀,弃去上清;
(4)洗涤:将含有菌及其结合ssDNA的菌沉淀,用200μL1×结合缓冲液洗涤1次;
(5)分离:用100μL 1×结合缓冲液溶液重悬菌沉淀,95℃加热5min,使ssDNA变性,从而与菌分离,冷却后在15000r/min离心10min,取上清液,则可分离到与目标菌结合的ssDNA,该ssDNA即为获得的筛选产物,将该筛选产物用PCR管分装成每管20μL,放于-20℃保存备用;
(6)扩增:采用不对称PCR扩增来获取下一级ssDNA文库;
(7)电泳检测:取不对称PCR产物进行琼脂糖凝胶电泳,如果电泳检测后显示PCR产物中有条带,则将该轮PCR产物用作下一轮SELEX筛选的文库;
(8)重复筛选:重复上述(1)到(6)的筛选过程,在第四轮的时候用哈维氏弧菌、溶藻弧菌进行反筛,在第七轮的时候用嗜水气单胞菌、爱德华氏菌进行反筛,一共进行七轮筛选;
(9)每轮筛选产物测序后都可获得数万条的序列,这些序列中有的种类出现一次,有的出现数千次,高频序列是指测序结果中出现的频率大于等于2次的序列,对高频序列进行分析;
根据公式:相对重要性指数IRI=N%×F%,其中N%为所有筛选轮或测序轮中某种序列的出现次数占所有序列总数量的百分比,F%为该种序列出现的测序轮数占总测序轮数的百分比;根据IRI计算结果进行分类,相应的分类依据为:IRI≥1000时,该高频序列为优势高频序列;10≦IRI<100时,该种类为常见高频适配体;1≦IRI<10时,该高频序列为一般高频核酸适配体;IRI<1时,该种类为少见高频适配体;从相对重要性指数IRI来看,其中Y1属于优势高频序列,Y2、Y3、Y4、Y10属于重要高频序列,最后对筛选的适配体进行抑菌性能的验证。
本发明具有如下优点:本发明可对高频序列进行客观有效的分类,为后续核酸适配体的精准选择和验证提供了一种客观有效的依据,该方法简单,操作方便,大大减少了验证的盲目性,提高了筛选效率。从筛选结果中挑选相对重要指数最高的五个适配体Y1、Y2、Y3、Y4、Y10,其适配体的抑菌率分别33.78%、70.95%、55.15%、39.19%、58.46%。其中Y2的抑菌率最高达到了70.95%,从而验证了通过相对重要性指数筛选核酸适配体的可行性。
附图说明
下面参照附图结合实施例对本发明作进一步的说明。
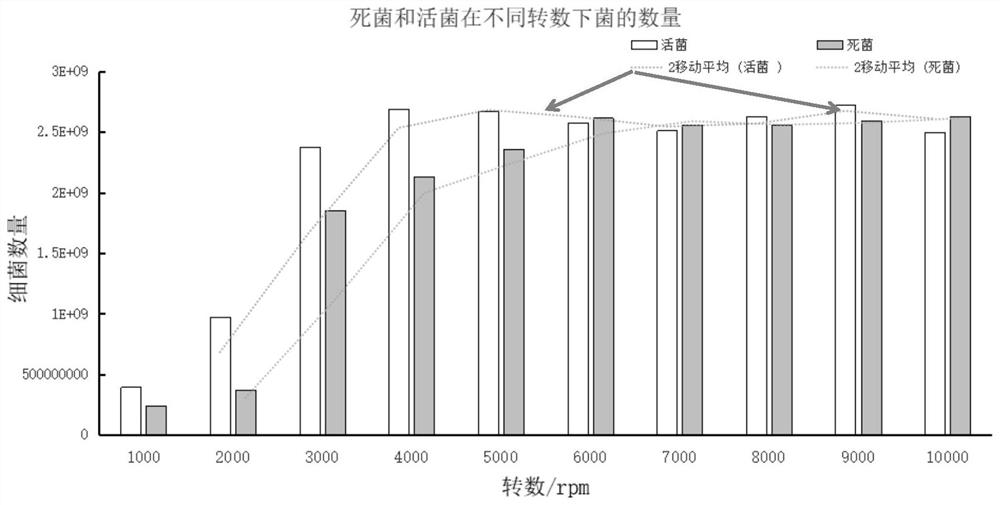
图1为不同转数下的细菌数量图。
图2为PCR产物电泳检测图。
图3为筛选产物抑菌率。
图4为高频适配体的抑菌率。
图5为高频适配体的特异性。
具体实施方式
1、抑菌性核酸适配体的SELEX筛选
(1)菌的处理:从-80℃将变形假单胞菌的保种液取出(变形假单胞菌由集美大学病原生物实验室提供),进行划线培养、活化复苏。用LB固体培养基划线培养。然后挑取生长良好的单菌落,接种到有LB液体培养基的锥形瓶中,于28℃、100r/min的摇床中进行扩大培养8h,获得的菌液用于后续实验。取培养好的变形假单胞菌离心管中,6000r/min离心5min,弃上清,洗涤菌3次后再加2×缓冲液混合均匀,测菌液OD值,然后取含菌量约为4×10
(2)结合:取ssDNA随机文库,用2×结合缓冲液稀释到2μmol/L 100μL,在95℃恒温金属浴中变性5min后冰浴10min,然后加入到前面的菌悬液中,混匀后在28℃,100r/min的摇床中结合2h。
(3)分步分离:结合完成后,4000r/min离心5min后弃去沉淀,留下上清。由于适配体和菌结合之后会导致菌的死亡,本申请采用4000rpm离心去掉大部分活菌。然后将上清100000r/min离心5min,留下沉淀,弃去上清,即得到剩余死菌。本发明采用分布离心的方法,尽可能筛选出死菌,提取死菌上的适配体验证其抑菌性。
为了在筛选过程中分离出更多的死菌,本发明采用以下试验对离心优化:
1.将培养好的菌液一分为二,一份灭活,一份不作处理。
2.热灭活:将细菌放入62.5℃水浴锅里加热1h,进行灭活。
3.离心:将死细菌与活细菌各分成10管,每管5ml。将死菌和活菌分别在1000-10000rpm转数下离心5min。
5.洗涤:将离心好的细菌弃上清,用1×缓冲液洗涤两次,最后加入200ul 2X重悬。
6.用血球计数板计数并记录。
由图1可知,活菌在4000rpm以后细菌数量趋于稳定,表明活菌在4000rpm时大部分细菌已经离心下来,而死菌在6000rpm才趋于稳定,由此可见,想要再筛选过程中获得大部分死菌,则可以在分步离心时采用4000rpm离心。
(4)洗涤:将含有菌及其结合ssDNA的菌沉淀,用200μL1×结合缓冲液洗涤1次。
(5)分离:用100μL1×结合缓冲液溶液重悬菌沉淀,95℃加热5min,使ssDNA变性,从而与菌分离,冷却后在15000r/min离心10min,取上清液,则可分离到与目标菌结合的ssDNA,该ssDNA即为获得的筛选产物,将该筛选产物用PCR管分装成每管20μL,放于-20℃保存备用。
(6)扩增:采用不对称PCR扩增来获取下一级ssDNA文库。
引物P1:5′-TCAGTCGCTTCGCCGTCTCCTTC-3′
引物P2:5′-CCCTCTGGGGTCTCCCTCTTGTGC-3′
反应体系(50μL)
不对称PCR的热力学循环参数:
(7)电泳检测:将制好的琼脂糖凝胶放置于电泳槽中,加入1×TAE电泳缓冲溶液使琼脂糖凝胶完全被覆盖。取2μL的Marker参考,取5μL的不对称PCR产物与2μL的上样缓冲液混合均匀后加入孔中,在电压为90V、45min的条件下进行电泳。最后进行观察和拍照,如图2所示。
(8)重复筛选:如果电泳检测后显示PCR产物中有条带,表明PCR效果可以,则可将该轮PCR产物用作下一轮SELEX筛选的文库,重复上述(1)到(6)的筛选过程。在第四轮的时候用哈维氏弧菌、溶藻弧菌进行反筛,在第七轮的时候用嗜水气单胞菌、爱德华氏菌进行反筛。一共进行七轮筛选,对筛选产物以及选择出现次数较多的适配体进行抑菌性能的验证。
(9)测序序列的筛选
表2适配体相对重要性指数
根据公式:相对重要性指数IRI=N%×F%,当IRI≥1000时,该高频序列为优势高频序列;10≦IRI<100时,该种类为常见高频适配体;1≦IRI<10时,该高频序列为一般高频核酸适配体;IRI<1时,该种类为少见高频适配体。从相对重要性指数IRI来看,其中Y1属于优势高频适配体,Y2、Y3、Y4、Y10属于重要高频适配体,且IRI是重要高频序列中最高的几个。然后将这些序列进行抑菌性验证。
2抑菌性能的验证
2.1材料
2.1.1核酸适配体
核酸适配体为申请人实验室前期筛选得到的变形假单菌适配体,其序列如表1(两端带下划线的是和引物结合的固定序列)。
上述适配体由生工生物工程股份有限公司合成。合成的冻干粉产物,用1×TE缓冲液配制成浓度为10μmol/L的贮存液,于-20℃冰箱保存备用。
表1变形假单菌适配体的序列
2.1.2实验用菌
变形假单菌(Vibrioanguillarum)由集美大学病害实验室鉴定并提供。
2.1.3培养基和试剂
LB固体培养基:取胰蛋白胨5g,酵母提取物2.5g,NaCl5g,琼脂粉7.5g。加超纯水溶解,用HCl或NaOH调pH至7.0,总体积至500mL,经121℃灭菌45min后备用。
20×结合缓冲液:取NaCl5.844g、KCl3.725g、Tris-HCl6.06g、MgCl2·6H2O2.033g。加超纯水溶解,用HCl或NaOH调pH至7.0定容至100mL。稀释为2×和1×结合缓冲液,经121℃灭菌后备用。
2.2实验方法
(1)菌处理:取一定量的菌液,6000r/min离心5min后弃上清,用1×缓冲液洗涤两次后用2×重悬。测其OD值,根据其OD值和菌的标准曲线,配置成浓度为10
(2)将七轮筛选产物金属浴中95℃变性5min,转于冰上10min。
(3)将核酸适配体Y1、Y2、Y3、Y4、Y10稀释成浓度1μM 100μL,在金属浴中95℃变性5min,转于冰上10min。
(4)将筛选产物以及核酸适配体和菌液各100μL混合,摇床200r/min,28℃孵育60min。
(5)混合梯度稀释后涂布平板,28℃倒置平板12h,菌落计数,设置三个平行实验,计算抑菌率。
抑菌率(%)=(N
(Nc为未加入适配体空白组的细菌菌落数,N为加入适配体实验组的菌落数)
3抑菌性结果
3.1筛选产物抑菌率
由图3可知,筛选产物的抑菌率分别为17.41%、26.19%、43.64%、42.08%、69.23%、64.78%、39.27%、31.58%。抑菌效果最高达到了69.23%,最低位17.41%。我们从筛选产物的抑菌率来看,筛选产物具有一定抑菌性,将筛选产物进行高通量测序,通过相对重要性指数从七轮高通量测序结果中挑选指数较高的序列,从而侧面验证了通过相对重要性指数筛选核酸适配体的可行性。
3.2核酸适配体抑菌率
如图4所示,从筛选结果中挑选相对重要指数最高的五个适配体Y1、Y2、Y3、Y4、Y10,其适配体的抑菌率33.78%、70.95%、55.15%、39.19%、58.46%。Y2的抑菌率最高达到了70.95%,效果颇佳,从而验证了通过相对重要性指数筛选核酸适配体的客观有效性。
3.2.3核酸适配体抑菌特异性
如图5所示,五个适配体Y1、Y2、Y3、Y4、Y10对变形假单菌的抑菌性显著高于其它菌株,证实了本发明筛选出的适配体对变形假单菌的特异性。
虽然以上描述了本发明的具体实施方式,但是熟悉本技术领域的技术人员应当理解,我们所描述的具体的实施例只是说明性的,而不是用于对本发明的范围的限定,熟悉本领域的技术人员在依照本发明的精神所作的等效的修饰以及变化,都应当涵盖在本发明的权利要求所保护的范围内。
序列表
<110> 集美大学
<120> 一种变形假单胞菌抑菌性适配体及其筛选方法
<160> 5
<170> SIPOSequenceListing 1.0
<210> 1
<211> 82
<212> DNA
<213> (人工序列)
<400> 1
tcagtcgctt cgccgtctcc ttcagcggga tgagggagta ggagggccac agtggactgc 60
acaagaggga gaccccagag gg 82
<210> 2
<211> 82
<212> DNA
<213> (人工序列)
<400> 2
tcagtcgctt cgccgtctcc ttcaggagac ggctctaagt aacgtcgcac atatcgcggc 60
acaagaggga gaccccagag gg 82
<210> 3
<211> 70
<212> DNA
<213> (人工序列)
<400> 3
tcagtcgctt cgccgtctcc ttcagccggg gtggtcagta ggagcagcac aagagggaga 60
ccccagaggg 70
<210> 4
<211> 89
<212> DNA
<213> (人工序列)
<400> 4
tcagtcgctt cgccgtctcc ttccgatcac tgttgaccta gtggggatgc gtcagggata 60
agggtgcaca agagggagac cccagaggg 89
<210> 5
<211> 82
<212> DNA
<213> (人工序列)
<400> 5
tcagtcgctt cgccgtctcc ttcgcggacg cgaaggagac ggtcttccgg tagcttcggc 60
acaagaggga gaccccagag gg 82
- 一种变形假单胞菌抑菌性适配体及其筛选方法
- 一种变形假单胞菌适配体及其筛选方法
