用于原位光生物调节的非侵入性系统和方法
文献发布时间:2023-06-19 12:18:04
本申请是针对申请号为201510641152.4、发明名称为“用于原位光生物 调节的非侵入性系统和方法”的中国专利申请的分案申请,该申请是2015 年9月30日提交的分案申请。本申请所针对的申请是申请号为 200980121111.5、发明名称为“用于原位光生物调节的非侵入性系统和方法” 的中国专利申请的分案申请,该母案申请是2009年4月2日提交的PCT国 际申请PCT/US2009/039300进入中国国家阶段的申请。
本申请涉及2007年11月5日提交的美国专利申请11/935,655;2008年 3月31日提交的美国专利申请12/059,484;2009年2月20日提交的美国专 利申请12/389,946;2008年4月4日提交的美国临时专利申请61/042,561, 其各自全部内容均通过引用并入本文。
技术领域
本发明涉及治疗对象中疾病或病症的方法和系统,其提供了对正常健康 细胞与具有疾病或病症的细胞(下文称“靶细胞”)之间更好的区分,并且优 选地可使用非侵入性或最低侵入性的方法进行。
背景技术
光生物调节也称为低强度激光疗法(low level laser therapy,LLLT)、 冷激光疗法和激光生物刺激,是新出现的医学及兽医学技术,其中暴露于低 强度激光可刺激或抑制细胞功能,产生有益的临床效果。波长、强度、持续 时间和治疗间隔的“最佳”组合是复杂的,有时对于需要不同治疗参数和技术 的不同疾病、损伤和功能障碍而言还存在争议。
例如,一定强度下一定波长的光(激光、LED或其他单色光源所产生的) 会辅助组织再生、消除炎症、止痛和增强免疫系统。其确切机制仍在研究之 中并且有争论,但是都一致认为其机制是光化学的,而不是热相关的。观察 到的生物及生理效应包括细胞膜通透性的变化,以及三磷酸腺苷和一氧化氮 的上调和下调。
所有光诱导的生物效应都取决于辐照的参数(波长、剂量、强度、辐照 时间、靶细胞深度、连续波还是脉冲模式、脉冲参数)。(参见例如,Karu IT,Low-Power LaserTherapy”,Biomedical Photonics Handbook,Vo-Dinh T. 编辑,CRC Press,Boca Raton,FL,48-1至48-25页,(2003))。激光平均功率通 常是1-500mW;一些高峰值功率、短脉冲宽度的装置为1-100W,通常脉冲 宽度为200ns。这样,平均光束幅照度通常为10mW/cm
光接受器必须首先吸收用于辐照的光。促成电子激发态之后,来自这些 状态的初级分子过程可在细胞水平导致可测量的生物效应(通过次级生化反 应,或者光信号转导级联,或者细胞信号转导)。真核细胞在红光至NIR区 域的光接受器被认为是位于细胞线粒体中的呼吸链细胞色素C氧化酶的终 末酶(terminal enzyme)。在紫至蓝光谱区域,黄素蛋白(例如呼吸链起始 处的NADH脱氢酶)也是光接受器之一。
光生物调节的临床应用包括例如治疗软组织和骨损伤、慢性疼痛、伤口 愈合、神经再生、感觉再生/恢复以及甚至可能解决病毒和细菌感染、治疗神 经疾病和精神疾病(例如癫痫症和帕金森病)(例如Zhang F.,等,Nature, 446:617-9(April 5,2007;Han X.,等,PloS ONE,2(3):e299(March 21,2007); Arany PR,等,Wound Repair Regen.,15(6):866-74(2007);Lopes CB,等, Photomed.Laser Surg.,25(2):96-101(2007))。一种显示出很有前景的临床应 用是治疗炎症,其中位置及剂量特异性激光辐照的抗炎作用与NSAID产生相似的结局,但是没有潜在的有害副作用(Biordal JM,Couppé C,Chow RT, Tunér J,Ljunggren EA(2003).″A systematic review of low level laser therapy withlocation-specific doses for pain from chronic joint disorders″. TheAustralian journal of physiotherapy 49(2):107-16)。
NIR光处理可预防培养的神经元(脑)细胞的细胞死亡(凋亡) (Wong-Reiley MT,等,JBC,280(6):4761-71(2005))。特定波长的光可促进细 胞增殖以活化线粒体——细胞中通过细胞色素C氧化酶产生能量的细胞器。NIR治疗可增强线粒体功能并刺激抗氧化剂保护途径。NIR治疗可增强线粒 体功能并刺激抗氧化剂保护途径的证据来自使用帕金森病(PD)实验室模型 (培养人多巴胺能神经元细胞)进行的光生物调节实验(Whelan H.等,SPIE, Newsroom,pages 1-3(2008))。
还已显示,在赤潮鞭毛藻海洋卡盾藻(Chattonella antique)中光对细胞 生长和分裂既具有诱导作用又具有抑制作用(Nemote Y.,Plant and Cell Physiol.,26(4):669-674(1985))。
当可激发细胞(例如神经元、心肌细胞)受到单色可见光的辐照时,光 接受器也被认为是呼吸链的组分。从实验数据中可明显看出(Karu,T.I., (2002).Low-power lasertherapy.In:CRC Biomedical Photonics Handbook, T.Vo-Dinh,Editor-in-Chief,CRCPress,Boca Raton(USA)),辐照可通过线 粒体的吸收而在非色素可激发细胞中导致生理和形态变化。后来,用神经元 进行了有关低功率激光疗法的类似辐照实验。80年代,曾显示氦氖激光辐射 改变了神经的放电模式;还发现,使用氦氖激光进行的透皮辐照模拟了行为反射的外周刺激作用。发现这些发现与疼痛治疗有关(Karu TI,等,(2002))。
当光接受器吸收光子时,发生电子激发,然后由较低激发态发生光化学 反应(单线态和三线态)。也已知,吸收中心的电子激发改变了其氧化还原 特性。截至目前,文献中已有对五种初级反应的讨论(Karu TI,等,(2002))。 它们中的两种与氧化还原特性的改变有关,两种机制包括产生反应性氧物质 (reactive oxygen species,ROE)。另外,也可能诱导对吸收发色团的局部 瞬时(极短时间)加热。这些机制的细节可见于(Karu TI,等,(2002);Karu TI,等,(1998).The Science of Low Power Laser Therapy.Gordon andBreach Sci.Publ.,London)。
通过活化呼吸链而进行的光生物作用被认为是细胞中存在的普遍机制。 此类细胞代谢活化的关键事件由于细胞氧化还原电势向更氧化的方向偏移 以及由于ATP额外合成而发生。对辐照的易感性以及活化的能力取决于辐照 细胞的生理状态:总氧化还原电势向更具还原性状态移动(例如:一些病理 状况)的细胞更易感于辐照。而最终光生物反应的特异性不在呼吸链中初级 反应的水平上决定,而是在细胞信号级联中的转录水平决定。在一些细胞中, 仅有细胞代谢的部分活化通过该机制发生(例如:淋巴细胞的氧化还原引发)。
远红外和NIR辐射已显示促进伤口愈合,例如感染性、缺血性和含氧量 低的伤口(Wong-Reley,WTT,JBC,280(6):4761-4771(2005))。在甲醇毒性啮 齿动物模型中,红至NIR辐射还保护视网膜抵抗甲醇产生的甲酸的毒性作 用,并可增强从视网膜损伤和其他推测线粒体功能障碍在其中起作用的眼部 疾病中恢复(Eells JT.,PNAS,100(6):3439-44(2003))。光生物调节的其他临 床应用有通过IR激光辐照修复软组织和骨组织(MartinezME,等,Laser in Med.Sci.,2007)。侵入性激光辅助吸脂术是最近开发的方法,其中通过管将 激光纤维引入皮肤中并直接到达脂肪细胞,造成细胞破裂并作为液体流出 (Kim KH,Dermat0l.Surg.,32(2):241-48(2006))。该区域周围的组织被凝固。 但是,光生物调节的另一个应用是非手术的静脉曲张治疗(静脉内激光疗 法),其中激光穿过切口和曲张静脉的全长(Kim HS,J.Vasc.Interv.Radiol., 18(6):811(2007))。当激光缓慢撤出时,对静脉壁加热,导致静脉永久性闭合 和消失。
技术进步(例如激光)重新定义了前列腺增大的手术治疗。绿色激光是 一种使得增大的前列腺组织蒸发并除去的激光(Heinrich E.,Eur.Urol., 52(6):1632-7(2007))。激光颜色(绿色)的重要性是这导致被红细胞中所含 的血红蛋白吸收,而不被水吸收。该方法也可称为激光前列腺切除术或者激 光经尿道前列腺切除(Transurethral resectionof the prostate,TURP)。该技 术包括用激光扫射增大的前列腺,直至达到前列腺的包膜。通过除去该部分 前列腺,患者能够更容易通过前列腺中完全开放的通道来排泄。该方法需要 在全身或脊椎麻醉下进行。该方法的优点是,由于与常规手术相比流血较少, 所以甚至服用血液稀释剂(例如阿司匹林,以预防中风)的患者也可以治疗。
光生物调节应用的另一个范围是用光直接控制脑细胞活动。该技术是基 于NIR光谱法,与其他方法例如功能性磁共振成象和正电子发射断层摄影相 比更易于使用且价格低廉。
每当脑的区域被活化时,该部分的脑就会利用更多的氧。该技术通过测 量脑中血流和氧消耗来进行。NIR激光二极管所发射的光通过光纤输送到人 的头部。光穿透颅骨,在其中评估脑的氧含量和血容量。然后,通过光纤收 集散射光,发送给检测器,由计算机进行分析。通过检查有多少光散射以及 有多少被吸收,可对与大脑活动有关的脑部分以及提取信息进行定位。通过 测量散射,确定哪里的神经元正在放电。这意味着,科学家可同时检测血灌 注和神经活动。该技术可用于许多诊断、预后和临床应用。例如,可用于发 现儿童中的血肿,以研究睡眠呼吸暂停期间脑中的血流,以及每天或者甚至 每小时(这无法使用MRI实现)监测中风患者的恢复。为了验证该技术, 比较通过NIR光谱法以及通过功能性MRI(目前脑研究中的“金标准”)同 时获得的脑中血红蛋白氧浓度。使用这两种方法来产生手指动作和静止的周 期性顺序刺激过程中脑运动皮层的功能图。显示了与手指运动相关的运动皮 层中血红蛋白信号与MRI信号之间的空间重叠。研究人员还证明了由于脑 活动导致的散射变化与血红蛋白氧含量之间的关联。与快速神经元信号相关 的散射变化来自完全相同的位置。
低强度激光-氧癌症治疗是光生物调节的另一种应用。光-氧效应(light- oxygeneffect,LOE)涉及低光学剂量的光辐射通过对溶解于生物系统中的 分子氧进行直接光激发以使其转化为单线态从而活化或破坏生物系统,即从 溶解于细胞的O
这类光生物调节方法分为两个主要类型:一类方法使用光将化合物从笼 中放出,随后变为有生化活性的,与下游效应子结合。例如,该方法包括将 “笼”化合物施加于样品,然后使用光打开笼以引发反应。修饰的谷氨酸可用 于发现神经元之间的兴奋性连接,因为出笼的谷氨酸模拟一个神经元接触到 另一个时的天然突触活动。该方法用于阐明神经元功能以及对脑切片进行成 像,使用例如双光子谷氨酰胺出笼(Harvey CD,等,Nature,450:1195-1202 (2007);Eder M,等,Rev.Neurosci.,15:167-183(2004))。其他信号分子可通过UV光刺激来释放,例如GABA、第二信使(例如Ca
另一个主要的光刺激方法是使用光来活化光敏蛋白质,例如视紫红质 (ChR2),其随后可激发表达视蛋白的细胞。
已显示,通道视紫红质-2(channelrhodopsin-2)(一种含有光传感器和 阳离子通道的整体蛋白(monolithic protein))提供了合适速度和幅度的电刺 激以激活神经元峰值放电。最近,光抑制(光对神经活动的抑制)随着诸如 光活化氯化物泵卤素视紫红质的分子应用于神经控制而成为可能。综上,蓝 光活化的通道视紫红质-2和黄光活化的氯化物泵卤素视紫红质使得可以实 现神经活动的多颜色光活化和沉默。
ChR2光刺激包括使ChR2基因靶向至神经元,并用光脉冲刺激表达ChR2蛋白的神经元。已进行了体外和小鼠中的体内实验,其通过使用光纤 将光递送进入下丘脑外侧区而进行的体内脑深部光刺激来实施 (Adamantidis AR,等Nature 450:420-425(2007))。ChR2的基因靶向允许仅 刺激确定的细胞亚群,避免了添加笼内谷氨酸的需要,有利于体内光刺激(Wang H.,等,PNAS,104(19):8143-48(2007))。ChR2光刺激已用于恢复视力 损伤的小鼠中的视觉活动,在线虫和果蝇中引发行为应答(Wang H.,等, 2007)。小鼠中ChR2辅助光刺激所诱导的强联想学习开启了在体内研究感受 和认知流程基础的大门(Huber D.,等,2007)。此类神经元靶向和刺激可能具 有临床应用,例如脑深部刺激以治疗帕金森病及其他病症,控制行为、感受 和认知特征,以及用于对脑如何工作进行成像和研究(Zhang F.,等,Nature Methods,3(10):785-792(2006);Wong-Riley MT.,等,JBC,280(6):4761-4771(2005))。
另一个基因氯泵(NpHR),其借自称为古细菌的一种微生物,可使得神 经元在黄光存在下活动性更低。两种基因ChR2和NpHR的组合目前可使得 神经元服从光脉冲,像驾驶员服从交通信号那样:蓝光代表“前进”(发射信 号),黄光代表“停止”(不发射)。
光敏蛋白质可通过多种技术引入细胞或活对象,包括电穿孔、DNA显 微注射、病毒递送、脂质体转染和磷酸钙沉淀。
第三种光刺激技术是对离子通道和受体进行化学修饰,以使得它们具有 光应答性。细胞中一些最基本的信号机制包括释放和摄取Ca
用光直接控制脑细胞活动是用于用神经回路进行实验的新方法,可产生 针对一些病症的治疗。该成果是通往以毫秒时间尺度对神经回路动态进行作 图以查看这些动态中的损伤是否导致严重的精神病学症状这一目标的一个 步骤。了解不同神经元的作用最终可帮助研究人员弄清健康和不健康的脑回 路的原理。例如,如果该技术的使用能够显示特定类型神经元活动的改变构 成症状的基础,则该发现会使得能够开发靶向性的基因或药物治疗以修复这 些神经元。可以想象,总有一天用光直接控制神经元活动本身可成为一种治 疗。
在活生物体中,科学家能够使得线虫(C.elegans)在其遗传改变的运 动神经元暴露于通过显微镜加强的黄光脉冲时停止游泳。在一些实验中,暴 露于蓝光导致线虫在平时以不会运动的方式摆动。当光关掉时,线虫恢复其 正常行为。
同时,在提取自小鼠的活体脑组织实验中,研究人员能够使用该技术导 致神经元以毫秒级时间发出信号或停止信号,如同它们天然地那样。其他实 验显示,暴露于所述光线似乎对细胞没有有害作用。一旦暴露结束,它们就 恢复到正常功能。
视神经控制的最直接应用是用神经回路进行实验,以确定为什么不健康 的回路无法工作以及健康的回路是怎样工作的。
例如,在帕金森病患者中,研究人员已显示,细胞的电“脑深部刺激”可 帮助患者,但是他们不知道到底是为什么。通过使研究人员选择性刺激或阻 遏脑中不同的神经元,光刺激技术可帮助确定具体哪种神经元受益于脑深部 刺激。这可使具有某些不希望副作用电疗法更具靶向性。
另一个潜在应用是使用刺激性神经通信进行实验。因为神经元通过产生 信号模式进行通信(有时为开有时为关,类似于二进制计算机代码的0和1), 所以以这些模式的蓝光和黄光闪光可迫使神经元发射对应于真实神经指令 的信息。将来,这可允许研究人员测试和调谐复杂的神经行为。沿着这条路 更远的将来,人工刺激神经信号(例如运动指令)的能力可使得医生能够连 同受损脊柱中的阻塞,或许能够恢复瘫痪患者四肢的一些功能。
最后,该技术可用于弄清健康大脑的大量未知功能。
目前用于生物刺激的激光系统不允许在没有手术侵入的情况下在厚组 织深处的区域进行光生物调节。激光疗法主要在表面或接近表面的靶细胞和 组织中进行,这是因为用于光生物调节和光生物刺激的紫外线和红至NIR辐 射的穿透不超过皮肤表面之下数厘米。另外,脑细胞的成像和刺激主要在薄 的脑切片中或者薄的细胞单层或悬液中是可能的。对于更深组织的原位激光 治疗,对象接受多种侵入性手术方法,例如通过切口将纤维侵入性插入到脂 肪层或静脉中,将辐射源植入深部组织,或者将玻璃窗植入到桶状皮层(Huber D.,等,Nature,451:61-66(2007))。公认与现有光生物调节方法有关 的另一个问题在于对正常细胞和靶细胞的区分。
光疗法中有两种主要的反应类型:
(1)I型反应涉及电子和氢原子,其在光活性分子(也称为光敏剂)与 底物或溶剂分子之间转移。氧可参与随后的反应:例如光分离置换发和 PUVA中的补骨脂素。
(2)II型反应涉及从最低三线态的PA分子传递能量到基态的氧而形成 单线态氧:例如光动力学治疗(Photodynamic Therapy,PDT)
光动力学治疗(PDT)是一种使用光敏剂和激光来杀伤细胞的治疗方式。 PDT是相对新的基于光的治疗,其最近被美国食品与药品管理局(FDA)批 准用于治疗早期和晚期的肺癌。其他国家也已批准PDT用于多种癌症的治 疗。不像化学疗法、辐照和手术,PDT可用于治疗所有细胞类型,不论是小 细胞还是非小细胞肿瘤。PDT包括使用光对特定光敏药物类型的作用通过体 内光动力学作用来破坏或修饰组织,从而对疾病例如癌症进行治疗。[Dougherty T.J.and Levy J.G.,“Photodynamic Therapy and ClinicalApplications”,in
PDT过程需要三个要素:(1)PA药物(即光敏剂),(2)可激发光敏剂 的光和(3)内源氧。推定的细胞毒性物质是单线态氧,根据II型光化学过 程形成的基态三线态氧的电子激发态,如下所述。
PA+hv→
其中PA=基态的光敏药物;
因为三线态具有相对长的寿命(毫秒至秒),因此仅有发生了有效的系 间跨越至激发三线态的光敏剂有充分的时间与氧碰撞以产生单线态氧。基态 与单线态氧之间的能量差为94.2kJ/mol,对应于~1270nm的近红外跃迁。 临床使用的大多数PA光敏剂具有40-60%的三线态量子产率,单线态氧产率 略低。竞争过程包括通过荧光失活至基态或内部转换的能量损失(能量损失 到环境或周围介质)。
但是,尽管单线态氧的高产率是理想的,但却不足以使光敏剂用于临床。 药代动力学、药效学、体内稳定性和可接受毒性也具有关键作用[Henderson BW,Gollnick SO,“Mechanistic Principles of Photodynamic Therapy”,in
用于PDT的有数种化学物质类型,包括基于卟啉的致敏剂。纯化的血 卟啉衍生物
PDT使得数种光敏剂在肿瘤中比在正常组织中以更长的时间存留,因此 提供了对治疗选择性的潜在改善。参见Comer C.,″Determination of[3H]- and[14C]hematoporphyrin derivative distribution in malignant and normal tissue,″Cancer Res 1979,3 9:146-15 1;Young SW,等,″Lutetium texaphyrin(PCI-0123)anear-infrared,water-soluble photosensitizer,″ Photochem Photobiol 1996,63:892-897;和Berenbaum MC,等, ″Meso-Tetra(hydroxyphenyl)porphyrins,a new classof potent tumor photosensitisers with favorable selectivity,″Br J Cancer1986,54:717-725。光 动力学治疗使用特定波长的光来活化光敏剂。已经开发出多种光源用于 PDT,其包括染料激光器和二极管激光器。激光器产生的光可与光纤偶联, 从而将光传送到所需位点。参见Pass 1-11,″Photodynamic therapy in oncology:mechanisms andclinical use,″J Natl Cancer Inst 1993, 85:443-456。研究人员称,PDT的毒性作用是光氧化反应的结果,如Foote CS, ″Mechanisms of photooxygenation,″Proa Clin BiolRes 1984,170:3-18中所 公开的。在氧存在下,光导致光敏剂的激发,以产生多种有毒物质,例如单 线态氧和羟基自由基。还不清楚DNA的直接损伤是不是主要的效果,因此, 这可能表明DNA交联的光活化并没有被有效刺激。
另外,在通过组织表面的外部照明施加激光时,PDT的治疗效果局限在 数毫米之内(即浅表的)。
此浅表局限性的原因主要是用于活化光敏剂的可见光的穿透很有限。因 此,PDT用于在不损还其下层结构的情况下治疗重要器官(例如肺或腹腔内 器官)的表面。但是,即便这些治疗也需要的高侵入性的技术来治疗患病器 官的表面。临床状况将所述方法与外科切除术联合使用,来破坏微量或小体 积疾病的残余部分。激光和少量残余的微量和小体积疾病有可能导致结构过 少或高度损伤。临床前数据显示产生了一些免疫应答,但是临床试验报道称, 在临床条件下没有产生与体外光分离置换法相似的疫苗效应。相反,免疫应答似乎仅在有限的条件下是有力的,并且仅持续有限的时间。
PDT使得数种光敏剂在肿瘤中比在正常组织中以更长的时间存留,因此 提供了对治疗选择性的潜在改善。参见Comer C.,″Determination of[3H]- and[14C]hematoporphyrin derivative distribution in malignant and normal tissue,″Cancer Res 1979,3 9:146-15 1;Young SW,等,″Lutetium texaphyrin(PCI-0123)anear-infrared,water-soluble photosensitizer,″ Photochem Photobiol 1996,63:892-897;和Berenbaum MC,等, ″Meso-Tetra(hydroxyphenyl)porphyrins,a new classof potent tumor photosensitisers with favorable selectivity,″Br J Cancer1986,54:717-725。光 动力学治疗使用特定波长的光来活化光敏剂。已经开发出多种光源用于 PDT,其包括染料激光器和二极管激光器。激光器产生的光可与光纤偶联, 从而将光传送到所需位点。参见Pass 1-11,″Photodynamic therapy in oncology:mechanisms andclinical use,″J Natl Cancer Inst 1993, 85:443-456。研究人员称,PDT的毒性作用是光氧化反应的结果,如Foote CS, ″Mechanisms of photooxygenation,″Proa Clin BiolRes 1984,170:3-18中所 公开的。在氧存在下,光导致光敏剂的激发,以产生多种有毒物质,例如单 线态氧和羟基自由基。还不清楚DNA的直接损伤是不是主要的效果,因此, 这可能表明DNA交联的光活化并没有被有效刺激。
光分离置换法已成功地用于治疗细胞增殖疾病。示例性细胞增殖病症可 包括但不限于癌症、细菌感染、对器官移植的免疫排斥应答、实体肿瘤、病 毒感染、自身免疫病(例如关节炎、狼疮、炎性肠病、干燥性综合征、多发 性硬化)或其组合,以及细胞增殖低于健康细胞的再生障碍病症,例如再生 障碍性贫血。它们之中,癌症或许是最为知名的。
PDT的其他成功应用有,例如心脏消融治疗,例如治疗心律不齐和心房 纤颤,其被认为是脑中风的重要原因。
U.S.6,811,562描述了施用可光活化的试剂以及使用侵入性方法例如纤 维光学元件对含有所施用物质的心脏组织进行波长为350至700nm的激光辐 照。
PDT的另一个应用是用于动脉疾病的光血管成形术 (photoangioplasty),其包括从头的动脉粥样硬化和血管再狭窄(Rockson AG,等,Circulation,102:591-596(2000);Hsiang YN.,等,J.Endovasc.Surg., 2:365-371(1995))。在人类临床应用中,在静脉内施用莫特沙芬镥后,通过圆 柱状纤维递送血管内光(730nm)。PDT还用于体内预防和治疗血管的内膜 增生(参见例如U.S.6,609,014)。
年龄相关性黄斑变性(AMD)是新发失明的原因之一。在许多眼病中, 脉络膜新生血管导致出血和纤维化。常规治疗利用氩激光器通过热凝结来吻 合渗漏的血管。但是,适于该治疗的患者比例是有限的。PDT用于治疗AMD, 包括注射维替泊芬,然后施加692nm的非加热光。
利用血卟啉以PUVA改善银屑病斑块和酒糟鼻的临床表观首先报道于 1937年。粉刺、斑秃、葡萄酒色斑和脱发也显示有望使用PDT进行治疗。
治疗的选择通常取决于疾病的位置和严重程度、疾病的阶段以及患者对 治疗的反应。
尽管一些治疗可能仅仅试图控制和减轻疾病的症状,但任何有效治疗的 最终目标都是完全去除或治愈全部患病细胞而不破坏身体的其余部分。
在称为体外光分离置换法(extracorporeal photopheresis,ECP)的一种 现有的治疗中,自从1988年其最初被FDA所批准以来已经观察到很好的结 果。
体外光分离置换法是基于白细胞清除术的免疫调节治疗,其已被美国食 品和药物管理局批准用于治疗皮肤T细胞淋巴瘤(CTCL)。ECP(也称为 体外光化学治疗)在世界上超过150个医疗中心实施,用于多种适应症。许 多研究者可提供长期随访数据,显示ECP对CTCL患者产生疾病消退和存 活改善。除了CTCL之外,ECP已显示了在其他T细胞介导疾病的治疗中 有效力,所述疾病包括包括慢性移植物抗宿主病(graft versus host disease,GVHD)和实体器官移植排斥。还研究了用于治疗自身免疫病的ECP 用途,例如用于治疗系统性硬化和类风湿性关节炎。
ECP通常使用Therakos,Inc(Exton,Pa)所开发的UVAR XTS光分离置 换系统进行。该过程通过一个静脉内进入孔进行,具有3个基本阶段:(1) 白细胞清除,(2)光活化和(3)再输注,需要3-4个小时来完成。典型的 治疗期会类似于下列事件序列:
(1)在患者中建立一个16号外周静脉管道或者中央静脉入口;
(2)使血液(225ml)经过3轮白细胞清除,或者使125ml血液经过6 轮,这取决于患者的血细胞比容值和身材。在每轮白细胞清除结束时,将红 细胞和血浆返回患者;
(3)将所收集的WBC(包括约5%的外周血单个核细胞)与肝素、盐 水和8-甲氧基补骨脂素(8-MOP)混合,后者在暴露于UVA光后插入淋巴 细胞的DNA中,使得它们在接触UVA辐照时更易感于凋亡;
(4)将混合物经过1-mm的膜通过UVA灯泡所围绕的无菌盒,得到平 均的UVA暴露2J/cm
(5)将处理过的WBC混合物输回患者。
在过去的20年里,进行中的研究已经探索了ECP的作用机制。8-MOP 和UVA辐射的组合导致所处理T细胞的凋亡,并且可导致活化或异常的T 细胞的优先凋亡,由此靶向CTCL或GVHD的致病细胞。但是,由于机体 的淋巴细胞中仅有小比例被治疗,这似乎不太可能是唯一的作用机制。
其他证据表明,ECP也诱导单核细胞分化成能够吞噬和加工凋亡T细 胞抗原的树突细胞。当这些活化的树突细胞回输到体循环中时,它们可应答 于所处理的凋亡T细胞抗原而产生细胞毒性CD8
最后,动物研究表明,光分离置换法可诱导抗原特异性的调节性T细胞, 其可导致对同种异体移植排斥或GVHD的抑制。
但是,ECP仍有许多局限性。例如,ECP需要患者每次治疗与机器连 接数小时。其需要建立外周静脉内管道或者中央静脉入口,这在某些疾病形 式例如系统性硬化或关节炎中可能难以进行。还有在静脉或中央静脉位点处 或者中央静脉导管中感染的风险。另外,其需要从患者取出通常几百毫升全 血,因此治疗限于有足够大的初始血容量可供抽取的患者。美国血库学会 (American Association of Blood Blanks)推荐体外体积的极限为患者全身血 容量的15%。因此,可以治疗的身材必须为至少40kg或以上。由于暴露于 受污染的作业系统而接触血液传播病原体(肝炎、HIV等)的风险也是一种 顾虑。
或者,患者可用光敏剂进行体内治疗,然后从患者抽取样品,用UV辐 射体外(离体)治疗,再将经治疗的样品注入患者。该方法已知产生自体疫 苗。还没有描述过所有步骤都在体内进行的用光敏剂治疗患者、将患者暴露 于能量来源以及产生自体疫苗作用的方法。参见WO 03/049801,U.S. 6,569,467;U.S.6,204,058;U.S.5,980,954;U.S.6,669,965;U.S.4,838,852;U.S. 7,045,124和U.S.6,849,058。此外,体外光分离置换法的副作用是公知的, 包括恶心、呕吐、皮肤红斑、对阳光的超敏反应以及继发性血液恶性肿瘤。 研究人员正在尝试在具有心、肺和肾同种异体移植排斥、自身免疫病和溃疡 性结肠炎的患者的实验性治疗中使用光分离置换法。
已知治疗方法的调查显示,这些方法往往在递送治疗时面临区分正常细 胞和靶细胞的主要困难,经常是由于产生已知非选择性攻击细胞的单线态 氧,以及需要进行离体过程,或者通过高侵入性过程(例如手术过程)来达 到对象体内数厘米以上深度的组织。
U.S.5,829,448描述了使用低能光子(例如红外线或近红外光(NRI)) 辐照依次和同时进行光敏剂的双光子激发。针对补骨脂素衍生物,比较了单 光子和同时的双光子激发,其中细胞用光敏剂处理,并用NRI或UV辐射进 行辐照。该专利表明,用低能辐照进行处理是有利的,因为以低于UV辐射 的程度吸收和散射。但是,使用NRI或UV辐射已知仅穿透数厘米深度的组 织。因此,对象中的任何深部治疗将必然需要使用离体方法或者高度侵入性的方法,以使得辐照源到达目的组织。另外,该专利未描述发射以下能量的 初始能量源:除UV、可见光和近红外能量之外的能量;在对应于UV和IR 光的范围内之外升高以及从高到低降低的能量。
Chen等,J.Nanosci.and Nanotech.,6:1159-1166(2006);Kim等,JACS, 129:2669-2675(2007)、U.S.2002/0127224和U.S.4,979,935各描述了在对象 内使用多种类型能量活化剂进行治疗的方法。但是,各自都具有以下缺点: 治疗依赖于单线态氧的产生以得到对所治疗组织的预期作用,因此很大程度 上无差别地影响健康细胞和期望治疗的患病组织。
美国专利No.6,908,591公开了使用辐照对组织灭菌的方法,以减少一种 或多种活性生物污染物或病原体的水平,例如病毒、细菌、酵母、霉菌、真 菌、孢子、朊病毒或类似物质,其单独或相组合地导致传染性海绵状脑病, 和/或单细胞或多细胞寄生虫,使得组织随后可用于移植或者替代动物中患病 和/或有其他缺陷的组织。该方法可包括使用增敏剂例如补骨脂素、补骨脂素 衍生物或其他光敏剂,以改善辐照的有效性或者减少对组织灭菌所需的暴 露。但是,该方法不适于治疗患者,也没有教导任何间接激活光敏剂的机制。
美国专利No.5,957,960公开了双光子激发装置,其用于使用具有红外或 近红外波段的光施加光动力学治疗到患者体内的治疗位点。但是,该参考文 献没有公开任何这样的光活化机制,即使用将初始能量转化为活化可活化药 物之能量的能量调节剂,并使用其他能量波段例如X射线、γ射线、电子束、 微波或无线电波。
美国专利No.6,235,508公开了用于补骨脂素及其他可光活化分子的抗 病毒应用。其教导了使来自生物溶液的病毒和细菌污染物灭活的方法。该方 法包括将血液与光敏剂和封闭剂混合,辐照混合物以激活光敏剂,使血液中 基本上所有污染物灭活而不破坏红细胞。封闭剂防止或减少在没有封闭剂存 在的情况下会发生的光敏剂有害副反应。根据该参考文献,所述封闭剂的作 用方式主要不是猝灭任何反应性氧物质。
另外,美国专利No.6,235,508提出,卤化光敏剂和封闭剂可以适于在 光分离置换法中和某些增殖性癌症的治疗中代替8-甲氧基补骨脂素 (8-MOP),所述癌症特别是通过光纤光学设备易于接近的实体局部肿瘤或 者浅表的皮肤癌。然而,该参考文献没有给出任何用于治疗淋巴瘤或任何其 它癌症的具体分子。相反,该参考文献提出了用于原始血液和血浆抗病毒处 理的光分离置换法方法。
美国专利No.6,235,508教导不使用8-MOP和4′-氨甲基-4,5′,8-三甲基 补骨脂素(AMT)和许多其它光活化分子,其被认为具有一些缺点。荧光光 敏剂被认为是优选的,但是该参考文献没有教导如何选择使用荧光光敏剂进 行荧光刺激或光活化的系统。相反,所述荧光光敏剂仅限于与DNA结合的 插入剂。该参考文献提出,荧光表明此插入剂不易激活氧自由基。
美国公开申请2002/0127224公开了光动力学治疗的方法,其包括施用发 光纳米颗粒和可光活化试剂,其可通过双光子活化事件由纳米颗粒再发出的 光进行活化。初始能量源通常为发光二极管、激光、白炽灯或卤素灯,其发 射波长范围为350至1100nm的光。初始能量被纳米颗粒所吸收。继而,纳 米颗粒再发射出500至1100nm波长的光,优选UV-A光,其中再发射的能 量活化可光活化物质。Kim等,(JACS,129:2669-75,2/9/2007)公开了光致敏 单元(能量受体)通过来自相当于300-850nm的能量范围内的双光子吸收染 料单元(能量供体)的荧光共振能转移(FRET)被间接激发。这些参考文 献没有描述下列能量源:发射除了UV、可见光和近红外能量之外能量;在 对应于350-1100nm波长范围之外升高或从高到低降低的能量。
除了UV、可见光和近红外能量的直接光活化之外,这些参考文献没有 公开可光活化分子的任何光活化机制。
美国专利No.6,235,508还教导了补骨脂素是在亚洲和非洲已在治疗上 使用了数千年的天然化合物。补骨脂素和光的作用已被用于治疗白斑病和银 屑病(PUVA治疗;补骨脂UVA)。补骨脂素能够通过插入到碱基对之间而 与核酸双螺旋相结合;腺嘌呤、鸟嘌呤、胞嘧啶和胸腺嘧啶(DNA)或尿嘧 啶(RNA)。一旦连续吸收两个UV-A光子,激发态的补骨脂素与胸腺嘧啶 或尿嘧啶双键发生反应,并共价结合到核酸螺旋的两条链上。该交联反应似 乎是胸腺嘧啶(DNA)或尿嘧啶(RNA)碱基特异性的。结合只有在补骨脂 素插入到含有胸腺嘧啶或尿嘧啶的位点中时才会进行,但是起始光加成物必 须吸收第二个UVA光子,以与双螺旋对侧链上的第二个胸腺嘧啶或尿嘧啶 反应,以使得所述双螺旋的两条链彼此交联,如下文所示。如所示这是两个 单光子的连续吸收,与两个或多个光子的同时吸收不同。
另外,该参考文献教导了8-MOP不适于用作抗病毒剂,因为它同时破 坏细胞和病毒。在补骨脂素插入到核酸双链体中相对的两条链上含有两个胸 腺嘧啶(或尿嘧啶)的位点中时,发生对细胞或病毒的致死损伤,但是只有 在它连续吸收2个UVA光子以及胸腺嘧啶(尿嘧啶)存在时才会发生。美 国专利No.4,748,120(Wiesehan)是一些取代补骨脂素通过光化学消毒方法 用于处理血液或血液制品的实例。
有时可以将添加剂例如抗氧化剂与补骨脂素(例如8-MOP、AMT和I-IMT)一起使用,以清除单线态氧及其它在补骨脂素光活化期间形成的高 反应性氧种类。UV活化产生这些能够严重损害健康细胞的反应性氧种类是 公知的。病毒失活可能大部分是由于这些反应性氧种类的作用,而不是补骨 脂素光活化的作用。尽管如此,认为并没有未观察到自身疫苗作用。
最著名的光活化化合物是补骨脂素或香豆素的衍生物,它们是核酸插入 剂。补骨脂素和香豆素光敏剂的使用可产生激发态耗散的替代性化学途径, 它们对于病毒失活的目的来说不是有益的或者事实上对所述方法是有害的。 对于补骨脂素和香豆素来说,此化学途径有可能导致多种开环物质的形成, 例如对香豆素来说如下文所示:
该领域中的研究过度简化了光活化机制和高反应性氧种类(例如单线态 氧)的形成中所涉及的机制。两者都可能导致肿瘤细胞、病毒和健康细胞的 失活损伤。但是,两者无论单独还是组合后都不产生自身疫苗作用。这需要 激活机体自身免疫系统,从而将恶性细胞或病毒识别为威胁,并建立能够持 续针对该威胁的细胞毒性作用的免疫应答。人们相信(不作为任何限制), 光活化和在体外光泳中发生的所得恶性细胞凋亡导致免疫应答的活化,其对 未处理的恶性细胞有细胞毒性作用。尽管研究人员完全了解免疫应答和细胞 毒性作用的复杂性,但是难以获得利用该系统成功刺激针对靶标(恶性细胞 除外)的自身疫苗作用的疗法,用于治疗淋巴瘤的体外光分离置换法除外。
Midden(W.R.Midden,Psoralen DNA photobiology,Vol I1(F.P. Gaspalloco编辑)CRC press第1页(1988)已经给出了补骨脂素与不饱 和脂质发生光反应以及与分子氧发生光反应而产生造成膜致死损伤的活 性氧种类(例如过氧化物和单线态氧)的证据。美国专利No.6,235,508教 导了8-MOP和AMT是不可接受的光敏剂,因为它们均不加区别地破坏 细胞和病毒。在Psoralen DNA Photobiology,第I卷,F.Gaspano,CRC Press,Inc.,BocaRaton,Fla.,第2章中综述了对呋喃香豆素上阳离子侧链作 为光敏剂的效果的研究。美国专利No.6,235,508从该综述中得出:相比 于8-MOP,大部分氨基化合物结合DNA和交联DNA的能力低得多,提 出对于光结合和交联来说,伯氨官能团是优选的离子形式。
美国专利No.5,216,176(Heindel)公开了很多作为表皮生长因子光活 化抑制剂具有一定效力的补骨脂素类和香豆素类。补骨脂素/香豆素骨架中可 包括的众多官能团中有卤素和胺。该参考文献通过参考引入本文。
美国专利No.5,984,887公开了使用利用8-MOP的体外光分离置换法来 处理用CMV感染的血液。然后,所治疗细胞和被杀伤和/或弱化的病毒、肽、 病毒自身的天然亚基(在细胞破裂后释放和/或脱落进入血液中)和/或致病 性非感染性病毒用于产生在处理前不存在的针对所述病毒的免疫应答。
公认现有的对细胞增殖疾病的诊断和治疗的方法主要问题在于对正常 细胞和靶标细胞的区分上。放射疗法通过使用高水平的高能辐射(例如高能 光子、电子或质子)照射细胞来工作。这些高能射线使构成DNA链的原子 电离,继而导致细胞死亡。与手术不同,放射疗法不需要将患者置于麻醉之 下,并且能够以最小的身体侵入性治疗身体内部深处的病症。但是,这些治 疗所需的高剂量照射对健康细胞像对患病细胞一样有效。因此,与手术类似, 在放射疗法中仅仅是通过位置来区分健康和患病细胞。对于放射线来说,也 没有一种固有的手段来区分正常细胞和患病细胞。PDT治疗遇到的另一个问 题是无法在不使用显著侵入性方法的情况下治疗超过皮肤表面之下数厘米 的靶标区域。
因此,还需要更好更有效的治疗方法,其准确靶向患病细胞而不对健康 组织造成显著副作用或附带损伤,并且能够通过非侵入性或侵入性极低的方 法治疗疾病。
发明内容
因此,本发明的一个目的是提供一种治疗对象中状态、病症或疾病的方 法,其允许治疗对象中的任何身体部位,同时又是非侵入性的并且相对于健 康细胞而言对靶细胞有高选择性。
本发明的另一个目的是提供治疗对象中状态、病症或疾病的方法,其可 使用任何合适能量源作为原位诱导对象中靶结构预定改变的初始能量源,用 以治疗所述状态、病症或疾病。
本发明的另一个目的是提供治疗状态、病症或疾病的方法,其使用将初 始能量吸收、加强或改变为实现靶结构中预定改变的调节剂。
本发明的这些和其它目的在结合单独或组合的下文优选实施方案详细 说明后会更加明确,这些目的已通过以下治疗对象中状态、病症或疾病的方 法的发现而得以实现,其包括:
将来自至少一个来源的初始能量施加于需要治疗的对象中的靶结构,其 中初始能量接触靶结构,并原位诱导所述靶结构中的预定改变,
-由此治疗所述状态、病症或疾病。
本发明的又一个目的是另外向所述对象施用至少一种能量调节剂,其将 所述初始能量吸收、加强或改变为实现所述靶结构中预定改变的能量。
本发明的另一个目的是提供治疗对象中状态、病症或疾病的方法,其可 使用任何合适能量源作为活化可活化药剂并由此导致靶结构预定改变的初 始能量源,用以治疗状态、病症或疾病。
本发明的另一个目的是提供用于治疗状态、病症或疾病的方法,其使用 能量级联来活化可活化药剂,然后所述药剂可治疗具有状态、病症或疾病的 细胞。
本发明的另一个目的是提供一种在对象中产生自身疫苗作用的方法,其 可以是体内的,从而避免对离体治疗对象组织或细胞的需要,或者其可以是 离体的。
本发明的另一个目的是提供一种在对象中产生自身疫苗的方法,其可以 是体内的,从而避免对离体治疗对象组织或细胞的需要,或者其可以是离体 的。
本发明的另一个目标是提供用于实施本发明方法的计算机系统。
本发明的另一个目标是提供在本发明方法中使用的试剂盒和药物组合 物。
本发明的这些和其它目的在结合单独或组合的下文优选实施方案详细 说明后会更加明确,这些目的已通过下述修饰介导生物活性或与其相关的靶 结构的方法的发现而得以实现,所述方法包括:
将来自至少一个来源的初始能量施加于需要治疗的对象中的靶结构,其 中实施初始能量接触靶结构,并原位诱导所述靶结构中的预定改变,
其中所述预定改变修饰所述靶结构并调节该靶结构的生物活性。
本发明的又一个目的是提供修饰介导生物活性或与其相关的靶结构的 方法,包括:
(1)将所述靶结构与至少一种能够在活化后实现靶结构中预定改变的 可活化药剂(PA)相接触,任选地在至少一个选自下列的成员存在下 进行:能量调节剂、等离子体活性剂(plasmonics-active agent)以及 其组合;和
(2)向所述靶结构施加来自初始能量源的初始能量,
-其中所述能量调节剂(如果存在的话)使得初始能量升级(upgrade) 或降级(downgrade)成能够活化所述至少一种可活化药剂的活化能;
-其中所述等离子体活性剂(如果存在的话)增强或改变所施加的初始能 量或者能量调节剂产生的活化能,或者以上两者;和
-由此导致靶结构发生预定改变,其中所述预定改变修饰所述靶结构并调 节该靶结构的生物活性;
以及用于实施所述方法的试剂盒、药物组合物、用于实施该方法的计算 机系统以及用于在对象中产生自身疫苗作用的方法和系统。
本发明的另一个目的是提供此类方法,其可使用任何合适能量源作为与 等离子体物质相组合来活化可活化药剂并由此造成预定改变的初始能量源。
本发明的另一个目的是提供此类方法,其使用能量级联中的等离子体来 活化可活化药剂,其随后造成预定改变。
本发明的另一个目的是提供原位产生能量的此类方法,所述能量直接或 间接导致预定改变。
本发明的另一个目的是提供一种治疗细胞增殖病症的方法,其允许通过 使用激发子-等离子体增强来治疗对象的任何身体区域,同时是非侵入性的并 且相对于健康细胞而言对靶细胞有高选择性。
本发明的另一个目的是提供治疗状态、病症或疾病的方法,其可使用任 何合适能量源作为初始能量源,所述初始能量源与激发子-等离子体增强相组 合地活化可活化药剂并由此导致预定改变,以治疗状态、病症或疾病。
本发明的另一个目的是提供用于治疗状态、病症或疾病的方法,其使用 能量级联中的激发子-等离子体增强来活化可活化药剂,然后所述药剂治疗具 有状态、病症或疾病的细胞。
本发明的另一个目的是治疗与对象中靶结构相关的状态、病症或疾病的 方法,其包括:
(1)向对象施用能够在活化后造成靶结构预定改变的至少一种可活化 药剂以及至少一种等离子体活性剂;和
(2)从初始能量源向所述对象施加初始能量,
其中,所述等离子体活性剂增强或修饰所施加的初始能量,使得增强的 初始能量原位活化所述可活化物质,
-由此导致靶结构发生预定改变,其中所述预定改变修饰所述靶结构并治 疗所述状态、病症或疾病。所述状态、病症或疾病可由异常细胞增殖介导, 所述预定改变可改善该异常细胞增殖。异常细胞增殖可高于或者可低于不具 有所述状态、病症或疾病的对象中的细胞。
所治疗的状态、病症或疾病可以或可以不显著地由异常细胞增殖介导, 所述预定改变不一定对细胞增殖有显著影响。
本发明的又一个目的是修饰介导生物活性或与其相关的靶结构的方法, 包括:
(1)使所述靶结构接触能够在活化后造成靶结构预定改变的至少一种 可活化药剂以及至少一种等离子体活性剂;和
(2)向所述靶结构施加来自初始能量源的初始能量,
其中,所述等离子体活性剂增强或修饰所施加的初始能量,使得增强的 初始能量原位活化所述可活化物质,
-由此导致靶结构发生预定改变,其中所述预定改变修饰所述靶结构并调 节靶结构的生物活性。所述靶结构不一定存在于生物体内部,而是可以在体 外或离体。与未治疗的相似靶结构相比,所述预定改变可增强靶结构的表达、 促进其生长或者增加其量;或者所述预定改变可增强、抑制或稳定所述靶结 构的通常生物活性。例如,所述预定改变可改变靶结构的免疫学或化学特性, 靶结构可以是细胞、细胞膜、胞内结构、多肽或非多肽化合物,其可被所述 预定改变改变成抗原性或免疫原性更高或更低。在另一个实施方案中,修饰 靶结构可以在不需要药剂或等离子体活性剂的情况下进行。
附图说明
很容易对本发明及其许多优点有更完整的了解,因为在参照以下详细描 述并结合附图之后将对其有更好的了解,其中:
图1提供了以米计的示例性无线电波谱(1nm等于10-
图2A和图2B是多种波长的能量穿透进入活组织深度的图示。
图3显示了根据本发明一个示例性实施方案的系统。
图4显示了根据本发明一个实施方案的示例性计算机系统。
图5显示了用于实施本发明多个实施方案的示例性计算机系统(1201)。
图6是等离子体纳米结构及其在不同激发波长下的理论电磁增强的示意 图。
图7提供了可用于本发明的等离子体光活化探针的代表性实施方案。
图8是用于本发明的光谱治疗的等离子体增强作用的示意图说明。
图9提供了等离子体活性纳米结构的代表性实施方案。
图10是具有远程药物释放的PEPST探针的一个实施方案的示意图。
图11是具有用于远程药物释放的多种接头的PEPST探针的几种实施方 案的示意图。
图12是具有生物受体的等离子体光活化探针的几种实施方案的示意图。
图13是组织中“治疗窗口”和生物组分吸收谱的示意图。
图14是本发明的能量调节剂(或激发能量转化剂/EEC)-光活性剂(PA) 系统的一个实施方案的示意图。
图15是等离子体光活化能量调节剂-PA探针的几种实施方案的示意图。
图16显示了显示XEOL的金复合物的多种优选实施方案的结构。
图17显示了显示XEOL的化合物的另一个实施方案的结构,即三-8-羟 基喹啉-铝复合物。
图18是本发明光敏化能量调节剂-PA探针的等离子体增强机制的示意 图。
图19显示补骨脂素的激发和发射荧光光谱。
图20是具有可分开连接的PEPST能量调节剂-PA系统一个实施方案的 示意图。
图21是用于双等离子体激发的PEPST探针的一个实施方案的示意图。
图22是包封的光活性剂用途的一个实施方案的示意图。
图23是本发明非侵入性PEPST模式的用途的简化示意图。
图24是显微照片,其显示了包含用银涂覆的聚苯乙烯纳米球的纳米帽 (半纳米壳)。
图25显示了基本EIP探针的多个示意性实施方案。
图26是PAH化合物荧光光谱的示意图。
图27显示BaFBr基质中掺杂的Eu的XEOL。
图28提供了EIP探针示意性设计的其他一些实施方案。
图29是基本EPEP探针多个实施方案的示意图。
图30是基本EPEP探针多个实施方案的示意图。
图31是具有NP、NW和NR的EPEP探针多个实施方案的示意图。
图32是具有NP、NW,NR和生物受体的EPEP探针多个实施方案的 示意图。
图33是具有NP和多个NW的EPEP探针一个实施方案的示意图。
图34显示光活化探针,其中光活化分子与等离子体探针结合。
图35显示等离子体光活化探针,其具有金属和UC材料之间的介电层。
具体实施方式
本发明描述了修饰介导生物活性或与其相关的靶结构的新方法,其包括 治疗对象中的状态、病症或疾病,该方法是有效的、特异性的并且几乎没有 副作用。具有状态、病症或疾病的细胞在本文中称为靶细胞。
本发明中文描述了合适的方法和材料,与本文所记载的那些相似或等同 的所有方法和材料都可用于本发明的实施或测试。本文提到的所有出版物、 专利申请、专利及其它参考文献通过引用以整体并入本文。在有冲突的情况 下,以本说明书(包括定义)为准。另外,所述材料、方法和实施例仅为举 例说明,而不作为限制,除非另作说明。
一般来说,本发明提供了修饰介导生物活性或与其相关的靶结构的方 法,其包括:
将来自至少一个来源的初始能量施加于需要治疗的对象中的靶结构,其 中所述初始能量接触所述靶结构并原位诱导所述靶结构中的预定改变,
其中所述预定改变修饰所述靶结构并调节该靶结构的生物活性。
本发明的又一个目的是提供修饰介导生物活性或与其相关的靶结构的 方法,包括:
(1)将所述靶结构与至少一种能够在活化后实现靶结构中预定改变的 可活化药剂(PA)相接触,任选地在至少一个选自下列的成员存在下进 行:能量调节剂、等离子体活性剂以及其组合;和
(2)向所述靶结构施加来自初始能量源的初始能量,
-其中所述能量调节剂(如果存在的话)使得初始能量升级或降级至能够 活化所述至少一种可活化药剂的活化能;
-其中所述等离子体活性剂(如果存在的话)增强或改变所施加的初始能 量或者能量调节剂所产生的活化能,或者以上两者;和
-由此导致靶结构发生预定改变,其中所述预定改变修饰靶结构并调节靶 结构的生物活性;
在一个优选实施方案中,本发明提供治疗状态、病症或疾病的方法,其 中初始能量源提供直接导致预定细胞改变的初始能量,所述细胞改变治疗对 象中的靶细胞。在一个优选实施方案中,所述初始能量源通过能量调节剂间 接施加,优选在所述靶细胞附近。本发明还提供了治疗状态、病症或疾病的 方法,其中初始能量源提供活化可活化药剂的初始能量,以治疗所述对象中 的靶细胞。在一个优选实施方案中,所述初始能量源通过能量调节剂间接施 加到可活化药剂,优选在所述靶细胞附近。本发明还提供了治疗状态、病症 或疾病的方法,其中等离子体活性剂增强或调节初始能量源,使得增强的初 始能量原位活化所述药剂。
如上所述,本发明的一个目的是使用光生物调节来修饰对象中介导生物 活性或与其相关的靶结构,在一个优选实施方案中,用以治疗状态、病症或 疾病。示例性状态、病症或疾病可包括但不限于:癌症、自身免疫病、软组 织和骨组织损伤、慢性疼痛、伤口愈合、神经再生、病毒和细菌感染、脂肪 沉积(吸脂术)、静脉曲张、前列腺增大、视网膜损伤及其他眼部疾病、帕 金森病以及行为、感受和认知疾病。示例性状态还可包括神经(脑)成像和刺激,用光直接控制脑细胞活动,控制细胞死亡(凋亡)以及改变细胞生长 和分裂。
因此,在一个实施方案中,本发明提供了能够克服现有方法缺点的方法。 一般说来,本发明的方法利用了来自至少一个来源的施加于受治对象中靶结 构的初始能量,其中所述初始能量接触靶结构并原位诱导所述靶结构中的预 定改变,由此修饰介导生物活性或与其相关的靶结构,优选治疗状态、病症 或疾病。所述初始能量可优选完全穿透对象,并且可从单个来源或者多个来 源施加。示例性初始能量可以是UV辐射、可见光、红外辐射(IR)、X射 线、γ射线、电子束、微波或无线电波。
在一个实施方案中,等离子体活性剂增强或调节所施加的初始能量,使 得增强的初始能量导致所述靶结构的预定改变。在一个不同的实施方案中, 等离子体活性剂增强或改变所施加的初始能量,使得所述调节剂将增强的初 始能量吸收、加强或改变为实现所述靶结构中预定改变的能量。
在又一个优选实施方案中,本发明的方法利用能量转移到分子药剂以及 在其中转移的原理,以通过辐照控制细胞改变的递送和活化,使得所需作用 的递送比常规方法更强、更精确且更有效。可向所述对象施用至少一种能量 调节剂,其将所述初始能量吸收、加强或改变为实现所述靶结构中预定细胞 改变的能量。所述能量调节剂可位于所述靶结构周围、所述靶结构上或所述 靶结构中。另外,所述能量调节剂可将初始光能转换为实现所述靶结构中预 定改变的光能。在一个优选实施方案中,所述能量调节剂减少了初始光能的波长。在另一个优选实施方案中,所述能量调节剂可增加初始光能的波长。 在一个不同的实施方案中,所述能量调节剂是选自下列的一项或多项:生物 相容性荧光金属纳米颗粒、荧光金属氧化物纳米颗粒、荧光染料分子、金纳 米颗粒、银纳米颗粒、用金涂覆的银纳米颗粒、用聚酰胺-胺树枝状聚合物包 封的水溶性量子点、萤光素酶、生物相容性磷光分子、联合电磁能收获分子 (combined electromagnetic energy harvester molecule)以及显示出强发光 的镧系元素螯合物。
本发明的另一个目的是使用可活化药剂在对象中治疗状态、病症或疾 病。示例性状态、病症或疾病可包括但不限于:癌症、自身免疫病、心脏消 融术(例如心脏心律不齐和心房纤颤)、光血管成形术疾病(例如从头的动 脉粥样硬化、血管再狭窄)、内膜增生、动静脉瘘、黄斑变性、银屑病、粉 刺、斑秃、葡萄酒色斑、脱发、类风湿和炎症性关节炎、关节疾病、淋巴结 疾病以及认知和行为疾病。
因此,在一个实施方案中,本发明提供了下列方法,其利用能量转移到 分子药剂以及在其中转移的原理来控制药物活性剂的递送和活化,使得所需 药物作用的递送比常规方法更集中、更精确并更有效。
在又一个优选实施方案中,所述初始能量源直接或间接(通过能量调节 剂)施加到可活化药剂,优选在所述靶细胞附近。
在本发明的背景中,短语“间接施加”(或该短语的变型,例如“间接地 施加”等等)在指代所述初始能量的施加时,表示所述初始能量穿透进入所 述对象表面下方,并到达对象内的调节剂和/或可活化药剂。在一个实施方案 中,所述初始能量与之前施用的能量调节剂相互作用,所述能量调节剂随后 活化预定的细胞改变。在另一个实施方案中,所述初始能量与之前施用的能 量调节剂相互作用,所述能量调节剂随后活化所述可活化药剂。在另一个实 施方案中,所述初始能量本身活化所述可活化药剂。在任一个实施方案中, 所述初始能量源不可在所述调节剂和/或可活化药剂的视距之内。“不可 在……视距之内”指如果假定观察者位于所述调节剂或可活化药剂的位置, 该观察者将不能看见所述初始能量源。
尽管不受到任何特定理论的限制或任何其他限制,但是提供下述对科学 原理的理论讨论和定义以帮助读者理解并认识本发明。
本文所述的术语“对象”不意为仅限于人,而是还可包括动物、植物或任 何合适的生物体。
如本发明中所使用的,短语“疾病或状态”表示状态、病症或疾病,其可 包括但不限于:癌症、软组织和骨组织损伤、慢性疼痛、伤口愈合、神经再 生、病毒和细菌感染、脂肪沉积(吸脂术)、静脉曲张、前列腺增大、视网 膜损伤及其他眼部疾病、帕金森病以及行为、感受和认知疾病。示例性状态 还可包括神经(脑)成像和激活,用光直接控制脑细胞活动,控制细胞死亡 (凋亡)以及改变细胞生长和分裂。其他示例性状态、病症或疾病可包括但不限于:心脏消融术(例如心脏心律不齐和心房纤颤)、光血管成形术疾病 (例如从头的动脉粥样硬化、血管再狭窄)、内膜增生、动静脉瘘、黄斑变 性、银屑病、粉刺、斑秃、葡萄酒色斑、脱发、类风湿和炎症性关节炎、关 节疾病和淋巴结疾病。
本文使用的术语“靶结构”表示真核细胞,原核细胞,亚细胞结构例如细 胞膜、核膜、细胞核、核酸、线粒体、核糖体或者其他细胞器或组分,胞外 结构,病毒或朊病毒及其组合。
所述预定细胞改变的性质取决于所需的药物结局。示例性细胞改变可包 括但不限于:凋亡,坏死,某些基因的上调,某些基因的下调,细胞因子的 分泌,细胞因子受体应答的改变,细胞色素C氧化酶和黄素蛋白的调节,线 粒体的活化,激活抗氧化剂保护途径,细胞生长和分裂的调节,神经放电模 式的改变,氧化还原特性的改变,反应性氧种类的产生,细胞中细胞内组分 活性、量或数目的调节,由细胞产生、分泌或与之相关的胞外组分的活性、 量或数目的调节,或者其组合。所述预定细胞改变可以导致或不导致靶结构 的破坏或失活。
本文使用的“能量调节剂”指能够从来源接受能量输入然后向接受靶标 再发射不同能量的物质。分子间的能量传递可以多种方式进行。能量形式的 性质可以是电、热、电磁、动力学或化学能量。能量可以从一个分子转移到 另一个(分子间转移)或者从分子的一部分转移到同一分子的另一部分(分 子内转移)。例如,调节剂可接受电磁能,再以热能的形式发射能量。在一 些优选实施方案中,所述能量调节剂接受较高的能量(例如x射线),再发 射较低的能量(例如UV-A)。一些调节剂可具有非常短的能量存留时间(fs 级,例如荧光分子),而其它一些可具有非常长的半衰期(分钟至小时级, 例如发光或发磷光的分子)。合适的能量调节剂包括但不限于:生物相容性 荧光金属纳米颗粒、荧光染料分子、金纳米颗粒、用聚酰胺-胺胺树枝状聚合 物包封的水溶性量子点、萤光素酶、生物相容性磷光分子、联合电磁能收获 分子以及能够强发光的镧系元素螯合物。这些物质的多种示例性用途在下文 优选实施方案中有述。
所述调节剂还可与用于细胞靶向目的的载体偶联。例如,生物相容性分 子(例如在UV-A区段发光的发荧光金属纳米颗粒或荧光染料分子)可选作 所述能量调节剂。
所述能量调节剂可以优选通过对象的全身性施用而被引导至所需位点 (例如肿瘤)。例如,发射UV-A的能量调节剂可以通过物理插入物或通过将 其与肿瘤特异性载体(例如脂类、壳多糖或壳多糖衍生物、螯合物或其它能 够在特异性靶标肿瘤中集中UV-A发射源的功能性载体)缀合而浓缩在肿瘤 位点处。
另外,所述能量调节剂可单独使用或者作为一系列两种或更多种能量调 节剂的使用,其中所述能量调节剂提供能量级联。这样,该级联中的第一种 能量调节剂吸收活化能,将其转换成不同能量,然后又被该级联的第二种能 量调节剂吸收,等等,直至到达级联的末端,该级联中最后的能量调节剂发 射活化所述可活化药物所需的能量。
示例性能量调节剂可包括但不限于至少一种选自下列的能量调节剂:生 物相容性荧光金属纳米颗粒、荧光金属氧化物纳米颗粒、荧光染料分子、金 纳米颗粒、银纳米颗粒、用金涂覆的银纳米颗粒、用聚酰胺-胺树枝状聚合物 包封的水溶性量子点、萤光素酶、生物相容性磷光分子、联合电磁能收获分 子以及显示出强发光的镧系元素螯合物。
本文所使用的“可活化药剂”是指不存在活化信号时通常以非活化状态 存在的药剂。当在活化条件下所述药剂被匹配的活化信号活化时,它能够实 现对靶细胞的预期药理学作用(即优选为预定的细胞改变)。
可用于活化相应药剂的信号可包括但不限于特定波长的光子(例如X射 线或可见光)、电磁能(例如无线电或微波)、热能、声能或其任何组合。
对所述药剂的活化可以简单到递送所述信号到所述药剂,或者可进一步 以一组活化条件为前提。例如,在前一种情况下,可活化药剂例如光敏剂可 以被UV-A照射活化。活化后,活性形式的所述药剂就可直接实现细胞改变。
在活化还以其它条件为前提的情况下,仅仅递送所述活化信号可能不足 以导致预期的细胞改变。例如,通过以活化状态结合某些细胞结构来实现其 药物作用的光活性化合物在递送所述活化信号时可能需要在物理上接近靶 细胞结构。对于这些可光活化药剂,在非活化条件下递送所述活化信号不会 得到预期药物作用。活化条件的一些实例可包括但不限于:温度、pH、位置、 细胞状态、辅因子存在与否。
可活化药剂的选择多取决于许多因素,例如期望的细胞改变、期望的活 化形式以及可施加的物理和生化约束。示例性可活化药剂可包括但不限于: 通过光能、电磁能、声能、化学或酶促反应、热能或任何其它适当活化机制 活化的药剂。
活化后,所述可活化药剂可实现细胞改变,其包括但不限于:凋亡、代 谢途径方向改变、某些基因的上调、某些基因的下调、细胞因子分泌、细胞 因子受体应答变化或其组合。
可活化药剂实现其预期作用的机制没有特别的限制。这些机制可包括直 接作用于预订靶标以及通过改变生化途径的间接作用。优选的直接作用机制 是通过所述药剂与重要细胞结构(例如核DNA、mRNA、rRNA、核糖体、 线粒体DNA或其它任何功能上重要的结构)的结合。间接机制可包括在活 化后释放代谢物,以干扰正常代谢途径,释放化学信号(例如激动剂或拮抗 剂),从而改变靶细胞应答,以及其它适当的生化或代谢改变。
本发明的治疗可通过2007年11月6日提交的美国申请序列号No. 11/935,655(其通过以上引用并入本文)中所述的独特方法进行,或者通过 常规治疗例如PDT的改进形式进行,不同在于使用等离子体活性剂以通过 改变或提高所施加的能量来增强治疗,或者在使用能量调节剂的情况下改变 所施加的能量、能量调节剂所发射的能量或者以上两者。
在一个优选实施方案中,治疗有效量的所述可活化药剂能够化学结合 DNA或线粒体。在此实施方案中,所述可活化药剂(优选可光活化药剂)原 位暴露于由能量调节剂发出的活化能,所述能量调节剂进而从初始能量源接 受能量。
合适的可活化药剂包括但不限于:光活性剂、声活性剂、热活性剂和射 线微波活性剂。可活化药剂可以是小分子;生物分子例如蛋白质、核酸或脂 质;超分子装配物;纳米颗粒;或者活化后具有药物活性的任何其它分子实 体。
所述可活化药剂可以来源于天然或合成来源。任何这些可被合适活化信 号源活化以实现预定细胞改变的分子实体都可以有利地用于本发明。
合适的光活性剂包括但不限于:补骨脂素和补骨脂素衍生物、芘油酸胆 甾醇酯、卟啉、荧光素、罗丹明、16-diazorcortisone、乙锭、博来霉素过渡 金属络合物、去糖基博来霉素过渡金属络合物、有机铂络合物、咯嗪类比如 7,8-二甲基-10-核糖醇基异咯嗪(核黄素)、7,8,10-三甲基异咯嗪(光黄素)、 7,8-二甲基异咯嗪(光色素)、异咯嗪-腺嘌呤二核苷酸(黄素腺嘌呤二核苷 酸[FAD])、咯嗪单核苷酸(亦称黄素单核苷[FMN]和核黄素-5-磷酸酯)、维 生素K类、维生素L、其代谢物和前体,以及萘醌类、萘类、萘酚类及其具 有平面分子构象的衍生物、卟啉、染料比如中性红、次甲基蓝、吖啶、甲苯 胺、黄素(盐酸吖啶黄)和吩噻嗪衍生物、香豆素类、喹诺酮类、醌类和蒽 醌类、四磺酸酞菁铝(III)、血卟啉和酞菁,以及优先吸附到核酸并且对蛋 白质作用很小或没有作用的化合物。术语“咯嗪”包括异咯嗪类。
基于内源的衍生物包括合成得到的内源光活化分子的类似物和同源物, 其可具有或不具有其来源光敏剂的低级(1至5碳)烷基或卤素取代基,其 保留了功能并且基本上无毒。内源分子固有地就是无毒的,并且在光照射之 后可能不产生有毒的光化产物。
表1列举了一些能够被光活化从而诱导自身疫苗作用的可光活化分子。
表2列出了一些另外的内源性可光活化分子。
表2:可光活化的内源性荧光团发射分子
图1提供了以米计的示例性无线电波谱(1nm等于米)。
尽管所述可活化药物和所述能量调节剂可以是不同且分离的,但应理 解,这两种物质不一定非要是独立且分离的实体。事实上,这两种物质可以 通过多种不同的构造彼此连接。当这两种物质是独立的且彼此可分别运动 时,它们通常在共同的周围介质内通过扩散和偶然相遇而彼此相互作用。当 所述可活化药物和所述能量调节剂并非分离的时,它们可组合成一个单一实 体。
所述初始能量源可以是任何能够以足以直接或通过调节剂导致细胞改 变的水平提供能量的能量源,所述调节剂将初始能量转变为能够导致预定细 胞改变的能量。所述初始能量源也可以是能够提供水平足以直接活化所述可 活化物质的能量的任何能量源,或者为所述能量调节剂提供发射所述可活化 物质的活化能所需输入能量的任何能量源(间接活化)。优选的初始能量源 包括但不限于:UV-A灯或光纤线、光针、内窥镜和产生X射线、γ-射线或 电子束的线性加速器。在一个优选实施方案中,初始能量能够完全穿透所述 对象。在本发明的背景中,短语“能够完全穿透所述对象”用于表示可穿透至 所述对象中任意深度来活化所述可活化药物的能量。并不是所施加的任何能 量都需要完全穿透所述对象,仅需要它能够使得允许穿透至活化所述可活化 药物所需的任何深度即可。能够完全穿透对象的示例性初始能量源包括但不 限于:UV光、可见光、IR辐射、X射线、γ射线、电子束、微波和无线电 波。
本发明的另一个实施方案是提供通过在有此需要的对象中原位产生能 量来治疗状态、疾病或病症的方法,其中所产生的能量可直接用于引起变化, 从而治疗状态、疾病或病症,或者所述能量可用于活化可活化药剂,其在活 化后引起变化,从而治疗状态、疾病或病症。可通过任何期望的方法原位产 生所述能量,所述方法包括但不限于,化学反应例如化学发光,或通过使用 一种或多种能量调节剂转变从对象外部施加的能量,其原位转变为不同的能 量(比所施加的能量更低或更高的能量)。
本发明的另一个实施方案将状态、疾病或病症的治疗与在受影响的靶结 构中产生热相结合,以增强治疗作用。例如,在使用可光活化药剂(例如补 骨脂素或其衍生物)对细胞增殖病症的治疗中,可通过施加初始能量来活化 可光活化药剂,所述初始能量直接或间接活化所述药剂。如本申请其他地方 所指明的,该初始能量可以是任何类型,只要其可转化为适于活化所述药物 化合物的能量即可。除了施加此初始能量之外,在本发明的该实施方案中, 施加导致加热靶结构的能量。对于细胞增殖病症例如癌症的情况来说,加热 会提高癌细胞的增殖速率。尽管最初这看起来是违反直觉的,但是在使用 DNA插入剂例如补骨脂素或其衍生物治疗细胞增殖病症时,这一细胞增殖提 高事实上可辅助补骨脂素导致凋亡。尤其是,当补骨脂素插入到DNA中时, 细胞在经过其下一个分裂周期时发生凋亡。通过提高细胞分裂的速率,可使 用本发明方法增强凋亡的发生。
对于此实施方案,可以任何期望的形式产生热。优选地,可通过施加微 波或NIR能量到靶结构或者通过使用金属纳米颗粒或具有金属壳的纳米颗 粒来产生热。在纳米颗粒实施方案中,如肿瘤热疗法中进行的那样,可使用 常规技术将磁性金属纳米颗粒靶向到癌细胞,然后通过在受控条件下向对象 施加磁场用于发热。(DeNardo SJ,DeNardo GL,Natarajan A等:Thermal dosimetry predictive of efficacy of 111In-ChL6 NPAMF-induced thermoablative therapy for human breast cancer in mice.J.Nucl. Med.48(3),437-444(2007).)
或者,可通过施加转化为热能的NIR到具有金属壳的纳米颗粒来发热。 (HirschLR,Stafford RJ,Bankson J等:Nanoshell-mediated near-infrared thermal therapyof tumors under magnetic resonance guidance.Proc.Natl Acad.Sci.USA100(23),13549-13554(2003))。
在一个实施方案中,所述初始能量源可以是发射无线电波的纳米管,例 如由加州大学伯克利分校的物理学系的K.Jensen,J.Weldon,H.Garcia,和 A.Zettl所述的(参见http://socrates.berkeley.edu/~argon/nanoradio/radio.html,其全部内容通过 引用并入本文)。这些纳米管可施用给所述对象,优选地与所述可活化药物或 所述能量调节剂或以上两者相偶联,或者位于靶细胞附近,使得在施加初始 能量后,所述纳米管接收该初始能量(优选无线电波),然后在所述可活化 药物或所述能量调节剂附近发射无线电波,或者发射到靶细胞,随后实现预 定细胞改变或所述可活化药物的活化。在此实施方案中,所述纳米管基本上 用作所述可活化药物或能量调节剂或靶细胞附近的无线电波聚焦或放大装 置。
或者,该能量发射源可以是发射形式适于被转移剂或靶细胞吸收的能量 的能量调节剂。例如,初始能量源可以是声能,一种能量调节剂可以能够接 收声能并发射光能(例如声发光分子),从而被另一种能够接收光能的能量 调节剂接受。其它例子包括接收x射线波长的能量并发射UV波长(优选 UV-A波长)的能量的转移剂。如上所述,多种这样的能量调节剂可用于形 成级联,以从初始能量源通过一系列能量调节剂转移能量,从而活化所述可活化物质或者预定细胞改变。
可以通过用对代谢途径的了解对级联事件仔细建模,以有利地开发作为 药物递送载体的信号转导方案,从而依次或同时导致预定细胞改变或活化多 个可活化药物,以达到细胞功能的多点改变。
可光活化物质可以被能量源活化成能够实现所需预定细胞改变的活化 能量态,所述能量源例如照射、共振能传递、激发子跃迁、电子注入或化学 反应。在一个优选实施方案中,所述可光活化物质在活化后与细胞中的DNA 或RNA或其它结构结合。所述物质的活化能量态能够造成细胞的破坏、诱 导凋亡。
治疗与对象中靶结构相关的状态、病症或疾病的一个优选方法包括:
(1)向对象施用至少一种能够在活化后造成靶结构预定改变的可活化 药剂;和
(2)从初始能量源向所述对象施加初始能量,
其中所施加的初始能量原位活化所述可活化药剂,
-由此导致靶结构发生预定改变,其中所述预定改变治疗所述状态、病症 或疾病。
治疗与对象中靶结构相关的状态、病症或疾病的另一个优选方法包括:
(1)向对象施用能够被多光子吸收事件活化并且能够在活化后造成靶 结构预定改变的至少所述可活化药剂;和
(2)从初始能量源向所述对象施加初始能量,
其中所施加的初始能量通过多光子吸收事件原位活化所述可活化药剂,
-由此导致发生预定改变,其中所述预定改变治疗所述状态、病症或疾病。
多光子激发的构思是基于这一想法,即在量子事件中两个或更多个低能 量的光子可激发荧光团,导致荧光光子的发射,通常为比所述两个或更多个 激发性光子更高的能量。这一构思首先由Maria
多光子激发构思或许最广为人知的应用是由康奈尔大学的Watt W. Webb实验室的Winfried Denk开发的双光子显微术。他将双光子吸收的想 法与激光扫描仪的使用相结合。
“依次”和“同时”双光子激发之间有重要的差异。在依次双光子激发至更 高容许能级中,第一个光子和第二个光子各自的能量必须适于直接将分子提 升至第二容许电子能级以及第三容许电子能级。相比之下,同时双光子激发 仅需要两个光子中第一个和第二个光子的能量和足以将分子提升至第二容 许电子能级。
在双光子激发显微术中,红外激光束通过物镜聚焦。通常使用的Ti-蓝 宝石激光器具有约100飞秒的脉冲宽度,约80MHz的重复速度,允许实现 双光子吸收所需的高光子密度和流量,并且可在大范围波长中调谐。双光子 技术的专利属于康奈尔大学的WinfriedDenk、James Strickler和Watt Webb。
两个已知的应用是双光子激发荧光(TPEF)和非线性传输(NLT)。 最常用的荧光团具有400-500nm范围的激发光谱,而用于激发荧光团的激光 为约700-1000nm(红外)的范围。如果荧光团同时吸收两个红外光子,其 将吸收足够的能量以提升至激发态。然后,荧光团将发射单个光子,其波长 取决于所用的荧光团类型(通常在可见光谱中)。因为需要吸收两个光子以 激发荧光团,因此发射概率与激发光束强度的平方相关。因此,激光束在被 严格聚焦时比较为扩散时产生多得多的双光子荧光。在焦点体积中有效地观 察到任何可察觉量的荧光,导致高度排斥焦外的物体。然后通过高灵敏度检 测器例如光电倍增管收集来自样品的荧光。此观察到的光强度成为最终图像 中的一个像素;在样品整个期望区域中扫描焦点,以形成图像的全部像素。 可通过几种方法来测量双光子吸收。
因此,在一个方面中,放射信号可以是恰好活化光敏剂所需的能量。在 该方面,辐射能可以直接靶向到光敏剂所存在的期望坐标或区域。本实施方 案中的初始能量源可以是例如X射线、γ射线、电子束、微波或无线电波。
另一个方面中,放射信号的能量可能比光敏剂的激发能量低。在该方面 中,放射信号不具有足够以常规方式活化光敏剂的能量。光敏剂的活化可以 通过“能量升级(energy upgrade)”机制来实现,例如如上所述的多光子机 制。光敏剂的活化另外可由中间能量转换剂介导。例如,辐射量可首先激发 荧光团,所述荧光团以激发光敏剂的合适能量发射光子。信号通过该中介剂 输送到靶标光敏剂。以这种方法,除了能量升级(和降级,如下所述)之外, 还引入信号接力机制。所述初始能量源可以是X射线、γ射线、电子束、微波或无线电波。另外,在一个实施方案中,如果初始能量是红外能,则活化 可活化药剂的能量不是UV或可见光量。因此,治疗对象中靶结构介导的状 态、病症或病症的另一种优选方法包括:
(1)向对象施用至少一种能量调节剂以及至少一种能够被多光子吸收 活化并且能在活化后造成靶结构预定细胞改变的可活化药剂;和
(2)从初始能量源向所述对象施加初始能量,
其中所述能量调节剂将所施加的初始能量升级为随后通过多光子吸收 事件原位活化所述可活化药剂的能量,
-由此导致发生预定的细胞改变,其中所述预定细胞改变治疗所述状态、 病症或病症。
在一个实施方案中,所述能量升级通过2、3、4或5个同时光子吸收来 获得。
治疗对象中靶结构所介导的状态、病症或病症的另一种优选方法包括:
(1)向对象施用至少一种能量调节剂和能够在活化后实现预定细胞改 变的至少一种可活化药剂;和
(2)从初始能量源向所述对象施加初始能量,
其中所述能量调节剂将所施加的初始能量升级为随后原位活化所述可 活化药剂的能量,
-由此导致发生预定细胞改变,其中所述预定细胞改变治疗所述状态、病 症或病症。
在另一个方面中,辐射能可能比光敏剂的激发能高。在该方面中,光敏 剂可以通过“能量降级”机制活化。在一种情形中,通过多光子机制,具有能 量x的两个低能光子可以被物质所吸收,以使得该物质从基态E0激发到更 高能级E2。该物质随后可通过发射具有能量y的光子降至中间能级E1,所 述能量y等于E2和E1之间的能级间距,其中y小于x。能量降级的其他机 制可由能量转换剂例如量子点、纳米管或具有合适光子辐射性能的其他物质介导。初始能量源可以是例如UV辐射、可见光、红外辐射、X射线、γ射 线、电子束、微波或无线电波。因此,治疗对象中靶结构所介导的状态、病 症或病症的另一优选方法包括:
(1)向对象施用至少一种能量调节剂和能够被多光子吸收活化并且在 活化后造成预定细胞改变的至少一种可活化药剂;和
(2)从初始能量源向所述对象施加初始能量,
其中所述能量调节剂将所施加的初始能量降级为随后通过多光子吸收 事件原位活化所述可活化药剂的能量,
-由此导致发生预定细胞改变,其中所述预定细胞改变治疗所述状态、病 症或病症。
因此,治疗对象中靶结构所介导的状态、病症或病症的另一优选方法包 括:
(1)向对象施用至少一种能量调节剂和能够在活化后实现预定细胞改 变的至少一种可活化药剂;和
(2)从初始能量源向所述对象施加初始能量,
其中所述能量调节剂将所施加的初始能量降级为随后原位活化所述可 活化药剂的能量,
-由此导致发生预定细胞改变,其中所述预定细胞改变治疗所述状态、病 症或病症。
在另一个优选实施方案中,本发明提供了治疗对象中靶结构所介导的状 态、病症或疾病的方法,包括:
(1)向对象施用能够在活化后造成所述靶结构预定改变的可活化药 剂;和
(2)从初始能量源向所述对象施加初始能量,
其中所施加初始能量和活化的可活化药剂在所述对象中产生不足以产 生细胞溶解作用的单线态氧,并且其中所述初始能量原位活化所述可活化药 剂。
-由此导致通过所述靶结构发生预定改变,其中所述预定改变靶向所述状 态、病症或疾病。
在另一个不同的优选实施方案中,本发明提供了治疗对象中靶结构所介 导的状态、病症或疾病的方法,包括:
(1)向对象施用能够被多光子吸收活化并且能够在活化后造成所述靶 结构中预定改变的可活化药剂;和
(2)从初始能量源向所述对象施加初始能量,
其中所施加初始能量和活化的可活化药剂在所述对象中产生不足以产 生细胞溶解作用的单线态氧,并且其中所述初始能量通过多光子吸收事件原 位活化所述可活化药剂。
-由此导致通过所述靶结构发生预定改变,其中所述预定改变靶向所述状 态、病症或疾病。
光动力学治疗领域的工作表明,造成细胞溶解作用及因此造成细胞死亡 所需的单线态氧的量为0.32×10
一个优点是多波长发射的辐射可用于选择性活化一种或多种可光活化 物质或者能活化所述一种或多种可光活化物质的能量调节剂。所述能量调节 剂优选在对健康细胞不造成或几乎不造成损伤的波长和能量下活化,来自一 种或多种能量调节剂被传递(例如Foerster共振能转移)到所述可光活化物 质,其损伤细胞并导致发射所需细胞改变(例如细胞凋亡)。
另一个优点是可通过限制已知损害细胞的自由基、单线态氧、氢氧化物 和其它高反应性基团的产生而大大降低了副作用。另外,其它添加剂(例如 抗氧化剂)可用于进一步减少辐照的非预期效应。
共振能转移(RET)是一种具有重叠的发射和吸收波段的两种分子之间 的能量转移机制。电磁发射体能够将到达波长转换为更长的波长。例如,被 第一种分子所吸收的UV-B能量可通过偶极子-偶极子相互作用转移到UV-B 吸收分子附近的UV-A发射分子。或者,可选择吸收较短波长的物质以提供 RET给非发射分子,所述非发射分子的吸收波段与所述转移分子的发射光谱 波段有重叠。或者,可使用磷光、化学发光或生物发光来将能量转移到可光 活化分子。
或者,可将所述初始能量源施用给所述对象。在本发明的背景下,所述 初始能量源的施用指以允许物质到达所述对象体内靶细胞的方式施用自身 产生初始能量的物质,而不通过外科手术插入对象中。施用可以采取任何形 式,包括但不限于:经口、静脉内、腹膜内、吸入等。另外,本实施方案中 的初始能量源可以是任何形式,包括但不限于:片剂、粉剂、液体溶液、液 体悬液、液体分散系、气体或蒸汽等。在本实施方案中,所述初始能量源包括但不限于:化学能量源、纳米发射器、纳米芯片及其它产生并发射所需频 率能量的纳米机械。纳米技术的最新进展提供了多种产生或发射能量的纳米 级装置的实例,例如分子开关(或Mol-Switch),该工作由Dr.Keith Firman (EC Research and DevelopmentProject)完成,或Cornell等(1997)的工 作,其描述了构建离子通道周围的仅为1.5nm大小的纳米机械,其使用在人 工膜上由两个短杆菌肽分子形成的离子通道:膜下层中的一个分子连接金电 极,上层中的一个分子连接生物学受体(例如抗体或核苷酸)。在所述受体 捕获靶分子或细胞时,所述离子通道被破坏,其导电性下降,生物化学信号 被转变为电信号。这些纳米装置还可与本发明相结合以提供对靶细胞的靶 向,从而将所述初始能量源直接递送到所需位点。
在另一个实施方案中,本发明包括施用化学能量源例如化学发光、磷光 或生物发光。化学能量源可以是两种或更多种化合物之间的化学反应,或者 可通过在所述对象外部或内部用适当的活化能活化化学发光、发磷光或生物 发光化合物来诱导,所述化学发光、磷光或生物发光允许在施用后体内活化 所述可活化药剂。在一个实施方案中,可施用可活化药剂和化学能量源。所 述施用可以以任何顺序依次进行或者同时进行。对于某些这种化学能量源来 说,所述化学能量源的施用可以在对象外活化之后进行,例如对于某些类型的磷光材料来说所述能量发射寿命达数小时。之前没有已知的尝试来使用任 何类型的共振能转移来活化插入剂以结合DNA。
另一个实施例是可引入某些原子的纳米颗粒或纳米簇,使得能够在相对 大的距离上进行共振能转移,例如大于一纳米,更优选大于五纳米,甚至更 优选至少10纳米。从功能上讲,共振能转移可能具有足够大的“Foerster”距 离(R
在一个实施方案中,侵略性细胞增殖病症具有高得多的有丝分裂速率, 其导致在即使是全身性施用治疗期间,恶性细胞也得到并非按比例分配的选 择性破坏。即使暴露于已光活化物质,干细胞和健康细胞也可免于发生大规 模程序化细胞死亡,只要这些已光活化物质在结合、有丝分裂或其它机制对 显著比例的健康干细胞造成细胞破坏之前从激发态退化至较低能级即可。因 此,可以不诱导自身免疫应答。
或者,可使用封闭剂来选择性地防止或减少对干细胞或健康细胞的破 坏,否则其将被损伤。例如,选择或施用所述封闭剂使以得不会给予恶性细 胞类似的益处。
在一个实施方案中,靶向干细胞,特别是对其进行破坏,目的是将干细 胞替换成供体细胞系或之前保存的患者的健康细胞。在这种情况下,不使用 封闭剂。取而代之地,使用特异性靶向干细胞的载体或光敏剂。
任何可光活化物质可暴露于植入对象中的激发能量源,优选在靶位点附 近。所述光活性物质可被对受体部位具有强亲和力的载体引导至所述受体部 位。在本发明背景中,“强亲和力”优选为平衡解离常数Ki至少在纳摩尔(nM) 级别或更高的亲和力。优选地,所述载体可以是多肽,例如,其可以与光活 性物质形成共价键。例如,所述多肽可以是胰岛素、白介素、胸腺生成素或 转铁蛋白。或者,光活性物质可以具有对靶细胞的强亲和力,而不是结合到 载体。
受体部位可以是下列任何部位:有核血细胞的核酸、有核血细胞的分子 受体部位、有核血细胞的抗原位点、表位或者光活化物质能够破坏靶细胞的 任何其他部位。
在一个实施方案中,将薄光纤线插入对象中,使用激光对所述物质进行 光活化。在另一个实施方案中,通过施用给患者的一种或多种分子提供用于 供应电磁辐射能或能量转移的多个来源。所述分子可在正确波段发射激活性 辐射,以直接激活靶结构或者激活所述可光活化物质,或者所述分子可通过 共振能转移或其它机制直接将能量转移给靶结构或者所述可光活化物质,或 者通过其它分子间相互作用的级联效应间接转移。
从二十世纪以来,来自细胞系统的超低发射现象已经成为许多研究的课 题。该课题可追溯到七十多年以前俄罗斯生物学家Gurwitsch Alexander G. Gurwitsch的早期研究他推测超低光子发射在细胞中传递信息[A.G. Gurwitsch,S.S.Grabje,and S.Salkind,“Die Natur des spezifischen Erregers der Zellteilung,”Arch.Entwicklungsmech.Org.100,11-40,1923]。
二十世纪七十年代,有许多研究者研究了该研究领域。来自多种细胞的 生物辐射的存在随后由欧洲和日本的几个科研小组使用低噪声灵敏光子计 数检测系统进行了研究[B.Ruth和F.-A.Popp,“Experimentelle Untersuchungen zur ultraschwachenPhotonenemission biologischer Systeme,”Z.Naturforsch.,A:Phys.Sci.31c,741-745,1976;T.I.Quickenden 和S.S.Que-Hee,“The spectral distribution of theluminescence emitted during growth of the yeast Saccharomyces cerevisiae andits relationship to mitogenetic radiation,”Photochem.Photobiol.23,201-204,1976;H.Inaba,Y. Shimizu,Y.Tsuji和A.Yamagishi,“Photon counting spectralanalysing system of extra-weak chemi-and bioluminescence for biochemicalapplications,”Photochem.Photobiol.30,169-175,1979]。Popp及其同事提出 了一些与来自生物系统的超低光子发射相关的“信息特征”的证据,常被Popp 称为“生物光子(bio-photon)”。其他研究报告了来自多个物种的超低光子 发射,包括植物和动物细胞[H.J.Niggli,C.Scaletta,Y.Yan,F.-A.Popp和 L.A.Applegate,“Ultraweak photonemission in assessing bone growth factor efficiency using fibroblasticdifferentiation,”J.Photochem.Photobiol.,B,64,62-68,2001;]。经UV辐照的皮肤成纤维细胞的实验结果显示,修复缺陷型 着色性干皮病细胞显示出与正常细胞相比超弱光子发射的高效提高。[H.J. Niggli.“Artificial sunlight irradiation inducesultraweak photon emission in human skin fibroblasts,”J.Photochem.Photobiol.,B18,281-285(1993)]。
在生物系统还观察到延迟的光发射[F.-A.Popp和Y.Yan,“Delayed luminescenceof biological systems in terms of coherent states,”Phys.Lett.A 293,93-97(2002);A.Scordino,A.Triglia,F.Musumeci,F.Grasso,and Z. Rajfur,“Influence ofthe presence of Atrazine in water on in-vivo delayed luminescence ofacetabularium acetabulum,”J.Photochem.Photobiol.,B,32, 11-17(1996);这种延迟发光用于蔬菜产品的质量控制[A.Triglia,G.La Malfa,F.Musumeci,C.Leonardi和A.Scordino,“Delayed luminescence as an indicator of tomato fruit quality,”J.Food.Sci.63,512-515(1998)]或者 用于评估生物组织的品质或品质改变[Yu Yan,Fritz-Albert Popp*,Sibylle Sigrist,Daniel Schlesinger,Andreas Dolf,ZhongchenYan,Sophie Cohen, Amodsen Chotia,“Further analysis of delayed luminescence ofplants”, Journal of Photochemistry and Photobiology B:Biology 78,235-244(2005)]。
据报道,UV激发还可增强超弱发射,使用了检测UV-A激光诱导超弱光子 发射的方法来评价癌细胞和正常细胞之间的差异.[H.J.Niggli等, Laser-ultraviolet-A-inducedultraweak photon emission in mammalian cells, Journal of Biomedical Optics 10(2),024006(2005)]。
因此,在本发明的一个实施方案中,在将来自至少一个来源的初始能量 施加于需要治疗的对象中的靶结构后,所述初始能量接触靶结构,并原位诱 导所述靶结构中的预定改变,
其中所述预定改变是来自靶标的能量发射的增强,其继而介导、引发或 提高对象中其他靶结构或者第二类型靶结构(例如不同细胞类型)的生物活 性。
在另一个实施方案中,取出患者自己的细胞,对其进行遗传修饰以提供 光子发射。例如,可取出肿瘤细胞或健康细胞,进行遗传修饰以诱导生物发 光,并可重新插入到待治疗疾病或病症的部位。可进一步修饰经修饰的生物 发光细胞,以防止细胞进一步分裂或者细胞只在调节剂存在时分裂。
在有一个实施方案中,选择在UV-A区段发光的生物相容性发射来源, 例如荧光金属纳米颗粒或荧光染料分子。将UV-A发射源引导至疾病或病症 的位点。UV-A发射源可通过全身性施用UV-A发射源而被引导至疾病或病 症的位点。优选地,UV-A发射源可在靶位点富集,通过例如物理插入或通 过将所述UV-A发射分子与如本领域中已知的能够在特定靶结构中富集 UV-A发射源的特异性载体缀合。
在一个优选实施方案中,UV-A发射源是金纳米颗粒,其包含5个金原 子的簇,例如用聚酰胺-胺树枝状聚合物包封的水溶性量子点。例如,可通过 缓慢还原金盐(例如HAuCl
在另一个实施方案中,发射UV或光光的萤光素酶被选为用于激发可光 活化物质的发射源。萤光素酶可以与ATP或其他分子结合,然后其可被另外 的分子氧化以刺激发射所需波长的光。或者,可使用磷光发射源。磷光发射 源的一个优点是发射磷光的分子或其它来源可以在插入靶位点之前电活化 或光活化,所述插入是通过全身性施用或直接插入到靶位点区域。或者,可 活化这些物质中的一些,将能量“保存”在活化的物质中,直至通过施加另 一个能量刺激发射。例如,参见下文美国专利4,705,952有关红外触发磷光 体的讨论。
磷光材料可能具有比荧光材料更长的弛豫时间,因为三线态的弛豫属于 禁止的能级跃迁,从而将能量保存在激发的三线态中,只有有限数量的量子机 械能转移过程可回到较低能级。能量发射被延迟或延长从几分之一秒至数小 时。磷光弛豫期间所发射能量在其他方面与荧光并无不同,可通过选择特定 的磷光体来选择波长范围。
在多种物质中,发光纳米颗粒具有日益提高的诱人技术和工业意义。在 本发明的上下文中,纳米颗粒表示尺寸小于一微米的颗粒。尽管本发明内容 描述了使用纳米颗粒的具体实施例,但是许多实施方案中本发明不限于尺寸 小于一微米的颗粒。不过,在许多实施方案中,小于一微米(尤其是小于 100nm)的尺寸范围产生了特别有意义的特性,例如发射寿命发光猝灭,发 光量子效率和浓缩猝灭,以及例如扩散、穿透和分散到较大尺寸颗粒无法在 其中迁移的介质中。
美国专利No.4,705,952(其内容通过引用并入本文)描述了红外触发的 磷光体,其以第一波长可见光的形式储能,在红外光触发时以第二波长可见 光的形式释放能量。在一些情况下,美国专利No.4,705,952描述“在需要新 的短刺激之前,向上转换持续了长达数天”。美国专利No.4,705,952中的磷 光体是碱土金属硫化物、稀土掺杂剂和可熔盐的组合物。美国专利No. 4,705,952中的磷光体更具体地说是由硫化锶、硫化钡以及其混合物制成的 磷光体;包括来自稀土族和氧化铕的掺杂剂,以及其混合物;和包括锂、钠、 钾、铯、镁、钙、锶和钡的氟化物、氯化物、溴化物和碘化物的可熔盐,以 及其混合物。美国专利No.4,705,952中记载的材料可用于本发明的多种实 施方案。
在一些情况下,美国专利No.4,705,952描述了“存储时间极长,数量级 为年”。因此,该材料适于接受红外光子,并以接近于1∶1的比例发射高能光 子。由于具有这样长的存储时间,这些红外触发磷光体可用于本发明的多个 实施方案,作为使用商业IR激光来活化介质中磷光的可靠机制,从而在患 者中产生可见光或紫外光。
在另一个实施方案中,设计了组合电磁能收获分子,例如J.Am.Chem. Soc.2005,127,9760-9768中公开的组合光采集物,其全部内容通过引用并入 本文。通过将一组荧光分子组合在分子结构中,可使用共振能转移级联来收 获宽波段的电磁辐射,其导致发射窄波段的荧光能量。通过将联合能量收获 剂与可光活化分子配对,进一步的共振能转移激发所述可光活化分子,这时 可光活化分子在附近激活联合能量收获分子。收获分子的另一个实例公开于 2002年5月18,Worcester Polytechnic Institute的M.O.Guler的M.S.论文“Singlet-Singlet and Triplet-Triplet Energy Transfer in Bichromophoric CyclicPeptides”的图4,其通过引用并入本文。
在另一个实施方案中,选择发射源或一系列以级联排列的发射源的斯托 克斯频移,使得将短波长能量(例如X射线)转变为较长波长的荧光发射(例 如光或UV-A),其用于激活位于肿瘤细胞中的可光活化分子。优选地,选择 所述可光活化分子以使得导致肿瘤细胞中出现凋亡,而不显著损伤正常健康 细胞。
在另一个实施方案中,可光活化物质可以是光笼复合物,其在光笼中含 有活性剂。所述活性剂与防止其结合特异性靶标并由此掩盖其活性的其他分 子混杂在一起。当光笼复合物被光活化时,体积减少,暴露出所述活性剂。 在这种光笼复合物中,光笼分子可以是光活性的(即,在光活化后,造成它 们从所述光笼复合物上脱离,从而暴露其中的活性剂),或者所述活性剂可 以是可光活化物质(其在光活化时造成所述光笼脱落),或者所述光笼和所 述活性剂都是可光活化的,具有相同或不同的波长。例如,毒性化疗剂可以 被光笼化,这在降低递送时的全身毒性。一旦所述药剂集中在肿瘤中,就用 活化能辐照所述药剂。这导致“笼”脱落,将细胞毒性剂留在肿瘤细胞中。合 适的光笼包括由Young和Deiters在“PHotochemical Control of Biological Processes”,Org.Biomol.Chem.5,第999-1005页(2007)中所公开的那些和 “Photochemical Hammerhead Ribozyme Activation”,Bioorganic& Medicinal Chemistry Letters,16(10),第2658-2661页(2006)中所公开的那些,其内容通过引用并入本文。
在一个优选实施方案中,使用光对化合物或物质卸笼,用于阐明神经元 功能和成像,例如双光子谷氨酰胺卸笼(Harvey CD,等,Nature, 450:1195-1202(2007);Eder M,等,Rev.Neurosci.,15:167-183(2004))。其他 信号分子可以由UV光刺激来释放,例如GABA、第二信使(例如Ca
基因打靶允许在形态学和电生理学上表征在遗传上确定的细胞群体。因 此,在另一个实施方案中,光敏蛋白质可通过多种技术引入细胞或活对象中, 包括电穿孔、DNA显微注射、病毒递送、脂质体转染、转基因系构建和磷酸 钙沉淀。例如,慢病毒技术提供了下列的便利组合:对稳定长期表达、高效 价载体生产以及低免疫原性的常规组合。光敏蛋白质可以是例如通道视紫红 质-2(ChR2)和氯泵卤素视紫红质(NpHR)。可将光蛋白质编码基因与细 胞特异性启动子一起引入慢病毒载体或其他载体,其提供光敏蛋白质编码基 因向靶细胞中的递送。在用光脉冲处理带有Ch2R的细胞时,含有光传感器 和阳离子通道的ChR2提供了速度和幅度合适的电刺激,以激活神经元峰值 放电。
在一个实施方案中,使用能够强烈发光的镧系元素螯合物。例如,镧系 元素螯合物可以与香豆素或香豆素衍生物或者喹诺酮或喹诺酮衍生物致敏 剂共价连接。致敏剂可以是2-或4-喹诺酮,2-或4-香豆素或者这些例子的衍 生物或组合。可使用喹诺酮124(7-氨基-4-甲基-2-喹诺酮)、香豆素120(7- 氨基-4-甲基-2-香豆素)、香豆素124(7-氨基-4-(三氟甲基)-2-香豆素)、氨乙 基三甲基补骨脂素或其它类似致敏剂。可选择螯合物以使得通过螯合基团 (例如DTPA)与镧系元素(例如铽或铕)形成高亲和力的复合物。这些螯 合物可与多种公知探针或载体中的任意种相连接,并且可用于共振能转移到 补骨脂素或补骨脂素衍生物(例如8-MOP)或其它能够结合DNA的光活性 分子。在另一个可选实施例中,使用合适的载体分子、颗粒或聚合物将镧系 元素螯合物定位于疾病部位,在暴露于所述镧系元素螯合物和光活性分子之 后,通过最小侵入性方法将电磁能源引入以辐照所述靶结构。
在另一个实施方案中,选择生物相容性内源荧光团发光体来激活共振能 转移到可光活化分子。可选择发射最大值处于所述生物相容性内源荧光团发 光体吸收范围之内的生物相容性发光体,以激发荧光团发光体的激发态。可 将一个或多个卤素原子加入到能插入核酸(DNA或RNA)中堆叠的核苷酸 碱基之间的环结构中,以赋予所述插入剂以新的光活性特性。可通过卤化或 添加非氢键离子取代基来选择性地修饰任何插入分子(补骨脂素、香豆素或 其它多环结构),以赋予其在反应光化学和竞争性结合亲和力中与细胞膜或带电蛋白质相比对核酸的优势,如本领域中已知。
皮肤光敏感性是所述光敏剂的主要毒性。如果皮肤直接暴露于阳光,即 使只是数分钟,也会发生严重的晒伤。早期在小鼠中的研究显示了强且持久 的免疫应答刺激,但是,实际的临床试验没有实现光动力学治疗之前的希望。 用于光动力学治疗的早期光敏剂靶向II类应答,其在氧存在下发生光活化时 产生单线态氧。单线态氧导致细胞坏死,并与炎症和免疫应答相关。已经开 发了另外一些光敏剂以诱导I类应答,直接损伤细胞结构。
卟吩姆钠(光卟啉;QLT Therapeutics,Vancouver,BC,Cananda) 是部分纯化的血卟啉衍生物(HpD)制剂。光卟啉已被美国食品和药物管理 局品管理局批准用于治疗梗阻性食道癌、微侵袭性支气管内非小细胞肺癌和 梗阻性支气管内非小细胞肺癌。光卟啉在630nm下活化,其具有约2至5mm 的组织穿透性。光卟啉具有相对长的皮肤光敏感持续时间(约4至6周)。
四(间羟苯基)二氢卟酚(Foscan;Scotia PHarmaceuticals,Stirling, UK)是一种合成的含氯化合物,其被652nm的光活化。临床研究表明,使 用Foscan和652nm光最多有10mm的组织效果。Foscan是对肿瘤比对正常 组织更具有选择性的光敏剂,需要相对短的光活化时间。推荐的0.1mg/kg 的剂量是相对低的,可使用相对低的光剂量。尽管如此,皮肤光敏感的持续 时间是合理的(约2周)。但是,Foscan诱导相对高的单线态氧产生,这可 能是该分子DNA损伤的主要机制。
莫特沙芬镥(德克萨卟啉镥)被近红外区域的光(732nm)活化。相比 于用于活化其它光敏剂的光量,在此波长的吸收具有可更深地穿透进入组织 的优点(图2A和2B)。德克萨卟啉镥还具有相对于正常组织选择性而言所 报道的最高肿瘤选择性之一。Young SW等:Lutetium texaphyrin(PCI-0123) a near-infrared,water-solublepphotosensitizer.Photochem Photobiol 1996, 63:892-897)。另外,其临床应用于较短的皮肤光敏感持续时间有关(24至 48小时)。已经评价了将德克萨卟啉镥用于转移性皮肤癌。目前正在研究用 于复发乳腺癌以及对局部复发前列腺癌的治疗。对肿瘤的高选择性有希望改 进临床试验中的结果。
一般说来,所述方法可使用任何激发更高电子能级的来源(例如电、化 学和/或放射),以单独使用或组合进活化可活化分子的系统中。所述方法可 以是光分离置换法方法或可类似于光泳。尽管光泳通常被认为仅限于光子激 发(例如通过UV光),但其它形式的辐射可用作系统的一部分来活化可活 化分子。辐射包括作为高能辐射的电离辐射,例如X射线或γ射线,其相互 作用以在物质中产生离子对。辐射还包括高线性能量转移辐照、低线性能量 转移辐照、α射线、β射线、中子束、加速电子束和紫外线。辐射还包括质 子、光子和裂变谱中子。高能电离辐射可以与化学方法结合,以产生适于共 振能转移的能级。如本领域中已知的,这些激发能量来源的其它组合和变化 可以相结合,以刺激可活化分子(如8-MOP)的活化。在一个实例中,电离 辐射指向实体瘤,并直接或间接刺激8-MOP的活化,以及直接损伤恶性肿 瘤细胞的DNA。在此实例中,8-MOP的电离辐射或光泳样活化的效果可以认为是其它治疗的辅助疗法。
在一个实施方案中,本发明提供了治疗对象中靶结构所介导的状态、病 症或疾病的方法,包括:
(1)向对象施用能够在活化后实现预定改变的可活化药剂;和
(2)从初始能量源向所述对象施加初始能量,
其中所述初始能量源是能够完全穿透所述对象的能量源,并且其中所施 加的能量原位活化所述可活化药剂,
-因此导致发生预定改变,其中靶结构中所述预定改变的发生造成细胞分 裂和/或生长速率提高或降低,从而治疗所述状态、疾病或病症。
在另一个优选实施方案中,本发明提供了治疗对象中靶结构所介导的状 态、病症或病症的方法,包括:
(1)向对象施用一种或多种能量调节剂和能够在活化后实现靶结构中 预定改变的可活化药剂;和
(2)从初始能量源向所述对象施加初始能量,
其中所述一种或多种能量调节剂将所施加的初始能量转换为UV-A或可 见光能,其继而原位活化所述可活化药剂,
-因此导致发生预定改变,其中靶结构中所述预定改变的发生造成细胞分 裂和/或生长速率提高或降低,从而治疗所述状态、疾病或病症。
在一个不同的实施方案中,所述可活化药剂可由单光子或多光子吸收事 件活化。
光动力学治疗领域的工作表明,造成细胞溶解作用及因此造成细胞死亡 所需的单线态氧的量是0.32×10
在另一个实施方案中,所述可活化药剂(优选光活性剂)被对受体部位 具有强亲和力的载体引导至所述受体部位。例如,所述载体可以是多肽,并 可与光活性剂形成共价键。例如,所述多肽可以是胰岛素、白介素、胸腺生 成素或转铁蛋白。或者,光活性药剂可在不与载体结合的情况下具有对靶细 胞的强亲和力。
例如,可施加治疗以使得有丝分裂减慢或暂停。此治疗能够减慢快速分 裂的健康细胞或干细胞的分裂,而不暂停癌细胞的有丝分裂。因此,进一步 区分了非靶细胞和靶细胞之间生长速率的差异,以增强本发明方法的有效 性。
在又一个实施方案中,根据本发明的方法还可包括加入添加剂来减轻治 疗副作用。示例性添加剂可包括但不限于:抗氧化剂、辅剂或其组合。在一 个示例性实施方案中,补骨脂素被用作所述可活化药剂,UV-A被用作活化 能,并且加入抗氧化剂来降低不希望的辐照副作用。
在另一个方面中,本发明还提供了产生自身疫苗的方法,其包括:(1) 提供靶细胞群;(2)用补骨脂素或其衍生物离体处理所述细胞;(3)用初始 能量源活化补骨脂素以诱导所述靶细胞群中靶结构的预定改变;和(4)将 所处理的细胞返回到宿主,以诱导针对所述靶细胞的自身疫苗作用,其中所 处理的细胞造成自身疫苗作用。
在一个不同的实施方案,产生对象的自体疫苗的方法包括:
(1)提供靶细胞群;
(2)在与对象分开且分离的环境中用能够被多光子吸收事件活化的可 活化药剂离体处理靶细胞;
(3)将经处理的靶细胞暴露于能量源;
(4)用能量源通过多光子吸收事件活化所述可活化药剂,以诱导靶细 胞中至少一种靶结构的预定改变;和
(5)将经此改变的细胞返回到对象,以在对象中诱导针对靶细胞的自 体疫苗作用,
其中经改变的细胞作为自体疫苗,能量源为X射线、γ射线、电子束、 微波或无线电波。
在另一个实施方案中,本发明的方法还可包括修饰介导生物活性或与其 相关的靶结构的方法,包括:
(1)使所述靶结构接触至少一种可活化药剂和至少一种等离子体活性 剂,所述可活化药剂能够在活化后造成该靶结构的预定改变;和
(2)向所述靶结构施加来自初始能量源的初始能量,
其中,所述等离子体活性剂增强或改变所施加的初始能量,使得增强的 初始能量原位活化所述可活化药剂,
-由此导致所述靶结构发生预定改变,其中所述预定改变修饰所述靶结构 并调节该靶结构的生物活性。
在一个不同的实施方案中,预定改变增强所述靶结构的表达,促进其生 长,或者增加其量;与未经处理的相似靶结构相比增强、抑制或稳定所述靶 结构的通常生物活性,和/或改变所述靶结构的免疫学或化学特性。在一个不 同的实施方案中,所述靶结构是被所述预定改变修饰成具有更高或更低抗原 性或免疫原性的化合物。
所述可活化药剂及其衍生物以及所述能量调节剂可掺入适于施用的药 物组合物中。这些组合物通常包括所述可活化药剂和可药用载体。所述药物 组合物还包括至少一种具有补充性治疗或诊断效果的添加剂,其中所述添加 剂选自抗氧化剂、辅药或其组合。
本文使用的“可药用载体”旨在包括与药物施用相容的任何和所有溶剂、 分散介质、包衣、抗菌剂和抗真菌剂、等渗剂和吸收延迟剂等等。这些介质 和试剂用于药物活性物质的用途是本领域中公知的。除非任何常规介质或试 剂与所属活性化合物不相容,否则均可考虑用于所述组合物中。还可将补充 性活性化合物掺入所述组合物中。可对本发明化合物进行修饰以改变所述化 合物的溶解度或清除。这些分子还可用D氨基酸进行合成,以提高对酶降解 的抗性。如果必要,所述可活化药剂可以与增溶剂(例如环糊精)一起施用。
本发明的药物组合物被配制与其预定施用途径相容。施用途径的例子包 括胃肠外例如静脉内、皮内、皮下、经口(如吸入)、透皮(局部)、经粘膜、 直肠施用,以及直接注射进受影响区域,例如直接注射进肿瘤。用于胃肠外、 皮内或皮下施用的溶液或悬液可包括下述组分:无菌稀释剂例如注射用水、 盐溶液、不挥发油、聚乙二醇、甘油、丙二醇或其它合成溶剂;抗菌剂例如 苯甲醇或对羟基苯甲酸甲酯;抗氧化剂例如抗坏血酸或亚硫酸氢钠;螯合剂 例如依地酸;缓冲剂例如醋酸盐、柠檬酸盐或磷酸盐,以及用于调节渗透性 的试剂例如氯化钠或葡萄糖。可以用酸或碱调节pH,例如盐酸或氢氧化钠。 所述胃肠外制剂可以封装进安瓿、一次性注射器或由玻璃或塑料制成的多剂 量小瓶中。
适于注射使用的药物组合物包括无菌水溶液(水溶性时)或分散系以及 无菌粉末,以用于即时制备无菌注射液或分散系。对于静脉内施用,合适的 载体包括生理盐水、抑菌水或者磷酸盐缓冲盐水(PBS)。在所有情况下,所 述组合物必须是无菌的,并且应该是易于注射程度的流体。其必须在制备和 储存条件下是稳定的,必须保存以防止微生物污染(例如细菌和真菌)。所 述载体可以是溶剂或分散介质,其含有例如水、乙醇、多元醇(例如甘油、 丙二醇和液体聚乙二醇等)以及其适当的混合物。可以例如通过使用包衣(例 如卵磷脂)、通过保持所需粒度(在分散系的情况下)以及通过使用表面活 性剂来保持合适的流动性。可通过多种抗菌和抗真菌剂(例如对羟基苯甲酸 酯类、氯代丁醇、苯酚、抗坏血酸、硫柳汞等)来防止微生物作用。在许多 情况下,优选在所述组合物中包括等渗剂,例如糖,多元醇如甘露醇、山梨 醇,氯化钠。所述注射组合物的延长吸收可通过在所述组合物中包括延迟吸 收的试剂(例如单硬脂酸铝和明胶)来实现。
可如下制备无菌注射液:将所需量的所述活性化合物与所需的一种上述 成分或成分组合掺入合适溶剂中,随后过滤除菌。通常,通过将所述活性化 合物掺入无菌载体来制备分散系,所述载体含有基本的分散介质和所需的其 它上文列举的成分。对于用来制备无菌注射液的无菌粉末来说,制备方法是 真空干燥和冻干,其从之前的其过滤除菌溶液产生所述活性成分加任何额外 所需成分的粉末。
经口组合物一般包括惰性稀释剂或可食用载体。它们可被装入明胶胶囊 中或压制成片剂。为了经口治疗施用,所述活性化合物中可掺入赋形剂并以 片剂、锭剂或胶囊剂的形式使用。也可使用流体载体制备经口组合物,以用 作嗽口水,其中流体载体中的所述化合物经口施用,漱口,然后吐出或吞下。 可包含药物相容性粘合剂和/或辅药材料作为所述组合物的一部分。所述片 剂、丸剂、胶囊剂、锭剂等可含有下列任何成分或类似性质的化合物:粘合 剂例如微晶纤维素、黄芪胶或明胶;赋形剂例如淀粉或乳糖,崩解剂例如藻 酸,羧甲基淀粉纳或玉米淀粉;润滑剂例如硬脂酸镁或Sterotes;助流剂例 如胶体二氧化硅;甜味剂例如蔗糖或糖精;或者调味剂例如薄荷、水杨酸甲 酯或橙味调味品剂。
对于吸入施用,所述化合物以来自加压容器或分药器(含有适当的抛射 剂,例如气体如二氧化碳)或者喷雾器的气溶胶喷雾的形式施用。
还可通过经粘膜或经皮方式进行全身性施用。对于经粘膜或经皮施用, 在制剂中使用对于待透过屏障来说合适的渗透剂。这些渗透剂一般是本领域 已知的,包括例如用于经粘膜施用的去污剂、胆汁酸夫西地酸衍生物。经粘 膜施用可以通过使用鼻喷雾剂或栓剂来完成。对于经皮施用,如本领域所知, 将所述活性化合物配制成软膏剂、油膏剂、凝胶剂或膏剂。
所述化合物还可制备成用于直肠递送的栓剂(例如使用常规栓剂基质, 例如可可脂及其他甘油酯)或者保留灌肠剂的形式。
在一个实施方案中,所述活性化合物与保护该化合物免受身体快速清除 的载体制备在一起,例如作为控释制剂,包括植入物和微胶囊化的递送系统。 可使用可生物降解的生物相容性聚合物,例如乙烯-乙酸乙烯共聚物、聚酐、 聚乙醇酸、胶原、聚正酯和聚乳酸。这些制剂的制备方法对于本领域技术人 员来说是显而易见的。也可购买到所述材料。脂质体悬液(包括使用病毒抗 原的单克隆抗体靶向到受感染细胞的脂质体)也可用作可药用载体。它们可 以通过本领域技术人员所知的方法制备,如美国专利No.4,522,811。
将经口或胃肠外组合物制备成剂量单位形式是尤其有利的,以便于施用 和剂量均匀性.本文使用的剂量单位形式指适于作为待治疗对象的单剂量的 物理上离散的单元;每个单元含有经计算产生所需治疗效果的预定量活性化 合物以及所需药物载体。本发明剂量单位形式的规格由所述活性化合物的独 特特征和待实现的具体治疗效果以及制备此活性化合物以用于个体治疗的 领域中固有的限制所决定,并且直接取决于它们。
所述药物组合物可以与施用说明一起包含在容器、包装或分药器中。
施用本发明药剂的方法不限于常规方法,例如注射或经口输注,还包括 更先进和复杂的能量转移方式。例如,可使用携带并表达能量调节剂的基因 工程细胞。可以用表达生物发光剂的基因工程载体转染来自宿主的细胞。可 通过原位基因治疗技术(例如注射病毒载体或基因枪)来完成转染,或者可 通过取出宿主细胞样品然后在成功转染后将其返回到该宿主的方式离体进 行。
这些转染的细胞可以被插入或以其他方式靶向到在患病细胞所处的部 位。在此实施方案中,所述初始能量源可以是生物化学源例如ATP,在这种 情况下所述初始能量源被认为直接植入到转染细胞中。或者,可以将能够用 作初始能量源常规微发射装置植入患病细胞的部位。
应理解,不同药剂的施用顺序没有特别的限制。因此,在一些实施方案 中,所述可活化药剂可以在所述能量调节剂之前施用,而在另一些实施方案 中,所述能量调节剂可以在所述可活化药剂之前施用。应理解,根据例如所 述药剂吸收率、所述药剂的定位和分子运输特性以及其它药代动力学或药效 学因素,可有利地采用不同的顺序组合。
另一个实施方案是本发明用于治疗皮肤癌的用途。在此实例中,将可光 活化药剂(优选补骨脂素)施用给患者,并通过血液供给递送到皮肤病变处。 具有有限穿透能力的活化源(例如UV或IR)直接照射在皮肤上,使用补骨 脂素时,其会是UV光或IR源。使用IR源,辐照会穿透得更深并通过与补 骨脂素的双单光子事件产生UV。
在另一个实施方案中,根据本发明此方面的方法还包括以下步骤:将经 处理细胞的组分分为级分,并测试每个级分在宿主中的自身疫苗作用。随后, 这样分离并鉴定的组分可用作有效的自身疫苗来刺激宿主的免疫系统,从而 抑制靶细胞的生长。
在另一个方面,本发明还提供了用于实施上述方法的系统和试剂盒。
在一个实施方案中,在对象中产生自体疫苗的系统包括:
至少一种可活化药剂,其能够被多光子吸收事件活化,并且能够通过所 述对象的靶细胞中的至少一种靶结构来诱导预定的细胞改变;
用于将所述至少一种可活化药剂置于所述对象中的装置;和
初始能量源,以提供能够在所述靶细胞中通过多光子吸收事件活化所述 至少一种可活化药剂的初始能量,其中活化是直接或间接的。
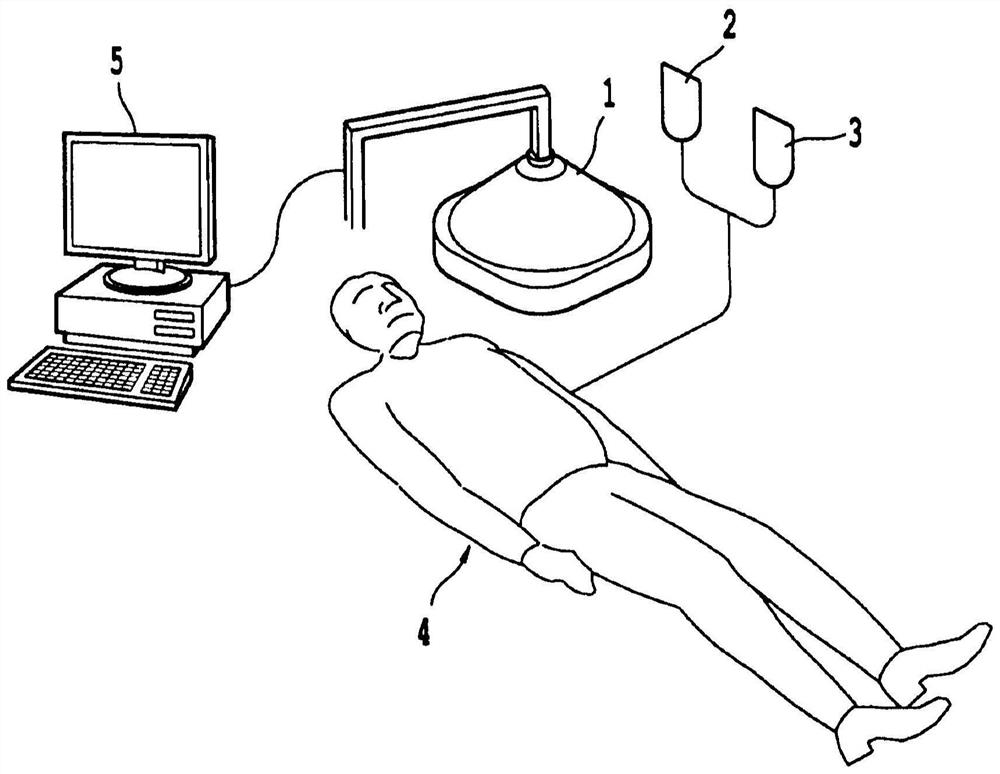
在一个不同的实施方案中,根据本发明的系统包括:(1)初始能量源; (2)一种或多种能量调节剂。该系统还可包含(3)一种或多种可活化药剂。 在另一个实施方案中,该系统可仅仅包含(1)初始能量源。在另一个实施 方案中,根据本发明的系统包含(1)初始能量源;和(3)一种或多种可活 化药剂。图3显示了本发明一个示例性实施方案的系统。参考图3,本发明 一个实施方案的示例性系统可具有导向对象4的初始能量源1。施用可活化 药剂2和能量调节剂3给对象4。所述初始能量源可另外受到能够指导所述 初始能量的递送的计算机系统5的控制。
在一些优选实施方案中,所述初始能量源可以是配有成像指导的计算机 控制能力的线性加速器,以递送精确校准的照射束到预先选择的坐标。这些 线性加速器的一个例子是SmartBeam
在其它一些实施方案中,配备有合适的初始能量发射器的内窥镜或腹腔 镜设备可用作初始能量源。在这些系统中,所述初始能量可航行并定位到预 先选择的坐标,以递送所需量的初始能量到该部位。
在另一些实施方案中,剂量计算和机器人控制设备也可包括在所述系统 中。
在另一个实施方案中,还提供了用于设计和选择初始能量源、能量转移 剂和可活化药剂之合适组合的计算机系统,其包括:
中央处理器(CPU),其上提供有存储介质:
可激发化合物数据库;
用于鉴定和设计能够与靶标细胞结构或组分相结合的可激发化合物的 第一计算模块;和
预测所述可激发化合物共振吸收能的第二计算模块,
其中,所述系统在选择靶细胞结构或组分之后计算出能够与所述靶结构 结合的可激发化合物,然后计算以预测所述可激发化合物的共振吸收能。
图4显示了根据本发明此实施方案的示例性电脑实施系统。参考图4, 根据本发明一个实施方案的示例性电脑实施系统可具有与存储单元相连的 中央处理器(CPU),其配置成使得所述CPU能够处理用户输入并能够根据 能量谱比较来选择初始能量源、可活化药剂和能量转移剂的组合,以用于本 发明的方法。
图5显示了用于实施本发明多个实施方案的计算机系统1201。计算机 系统1201可用作控制器55,以实施如上所述CPU的任何或全部功能。计算 机系统1201包括总线1202或其它用于交流信息的交流机制,以及与总线 1202相连的处理器1203以处理信息。计算机系统1201还包括主存储器1204, 例如随机存取存储器(RAM)或其它动态存储器(例如动态RAM(DRAM)、 静态RAM(SRAM)、和同步DRAM(SDRAM),其与总线1202相连用以 存储信息和将由处理器1203执行的指令。另外,主存储器1204可用于存储 处理器1203执行指令过程中的临时变量或其它中间信息。计算机系统1201 还包括只读存储器(ROM)1205或其它静态存储设备(例如可编程序ROM (PROM)、可擦PROM(EPROM)和电可擦PROM(EFPROM)),其与 总线1202相连以存储处理器1203的静态信息和指令。
计算机系统1201还包括与总线1202相连的磁盘控制器1206,以控制一 个或多个存储设备,用于存储信息和指令,例如硬盘1207,和可移动介质驱 动器1208(例如软盘驱动器、只读光盘驱动器、可读/写光盘驱动器、光盘 播放器、磁带机和可移动磁光驱动器)。可使用合适的设备接口将所述存储 设备加入到计算机系统1201中,所述设备接口例如小型计算机系统接口 (SCSI)、集成设备电路(IDE)、增强IDE(E-IDE)、存储器直接访问(DMA) 或超-DMA)。
计算机系统1201还可包括特殊目的的逻辑设备(例如专用集成电路 (ASIC))或可配置的逻辑设备(例如简单可编程逻辑器件(SPLD)、复杂 可编程逻辑设备(CPLD)和场可编程门阵列(FPGA))。
计算机系统1201还可包括显示控制器1209,其与总线1202相连以控制 显示器1210,例如阴极射线管(CRT),用于显示信息给计算机用户。所述 计算机系统包括输入装置,例如键盘1211和定点设备1212,用于与计算机 用户的交互和提供信息给处理器1203。定点设备1212例如可以是鼠标、轨 迹球或指点杆,用于与处理器1203通信传达方向信息和命令选择,以及用 于控制显示器1210上的光标移动。另外,打印机可提供由计算机系统1201 所存储和/或产生数据的打印列表。
计算机系统1201实施本发明处理步骤的部分或全部(例如与图5相关 的实施例所述),其响应于执行存储器(例如主存储器1204)中所含的一个 或多个指令的一个或多个序列的处理器1203。这些指令可从另一种电脑可读 介质(例如硬盘1207或可移动介质驱动器1208)中读入到主存储器1204。 还可利用多处理结构中的一个或多个处理器来执行主存储器1204中所含的 指令序列。在另一些实施方案中,可在适当地方使用硬件电路来代替软件指 令或与其相结合。因此,实施方案不限于任何特定的硬件电路和软件的组合。
如上所述,计算机系统1201包括至少一个计算机可读介质或存储器, 以容纳根据本发明的教导编程的指令,以及用于包含本文所述数据结构、表 格、记录或其它数据。计算机可读介质的例子有光盘、硬盘、软盘、磁带、 磁光盘、PROM(EPROM、EFPROM、闪存EPROM)、DRAM、SRAM、 SDRAM或任何其它磁介质、光盘(例如CD-ROM)或任何其它光学介质、 穿孔卡片、纸带或其它具有孔图案的物理介质,载体波(如下所述)或任何 其它计算机可读的介质。
本发明包括用于控制计算机系统1201从而驱动设备来实施本发明以及 用于使得计算机系统1201能与人用户(例如打印操作员)交互的存储于任 何计算机可读介质或其组合之上的软件。这些软件可包括但不限于:设备驱 动程序、操作系统、开发工具和应用软件。这些计算机可读介质还包括本发 明的计算机程序产品,其用于实施在实施本发明中进行的全部或部分(如果 处理是分散的)处理。
本发明的计算机代码装置可以是任何可编译的或可执行的程序代码机 制,包括但不限于:脚本、可编译的程序、动态连接库(DLL)、Java类别 以及完整的可执行程序。另外,本发明处理的一部分可以分派出去,以获得 更好的性能、可靠性和/或成本。
本文使用的术语“计算机可读介质”指参与提供指令给处理器1203用于 执行的任何介质。计算机可读介质可采取许多形式,包括但不限于:非易失 性媒介、易失性介质和传输介质。非易失性介质包括:例如,光盘、磁盘和 磁光盘,例如硬盘1207或可移动介质驱动器1208。易失性介质包括动态存 储器,例如主存储器1204。传输介质包括同轴电缆、铜线和光纤,包括制成 总线1202的电线。传输介质也可采取声波或光波的形式,例如在无线电波和红外数据传输过程中的产生的那些。
多种形式的计算机可读介质可参与传输一个或多个指令的一个或多个 序列给处理器1203来执行。例如,所述指令最先可以是包含在远程计算机 的磁盘上。所述远程计算机可将用以实施本发明的全部或部分的指令远程加 载进入动态存储器,然后使用调制解调器通过电话线传送指令。计算机系统 1201本地的调制解调器可接收电话线上的数据,并使用红外发射器将数据转 化成红外信号。与总线1202相连的红外探测器可接收红外信号中携带的数 据,并将数据置于总线1202。总线1202将数据传送至主存储器1204,处理 器1203由其中获取并执行指令。在处理器1203执行之前或之后,主存储器 1204所接收的指令可任选地存储在存储装置1207或1208上。
计算机系统1201还包括与总线1202相连的通信接口1213。通信接口 1213提供了与网络连接1214相连的双向数据通信,所述网络连接1214连接 到例如局域网(LAN)1215或者另一个通信网络1216,例如因特网。例如, 通信接口1213可以是连接到任何包交换局域网的网络接口卡。作为另一个 例子,通信接口1213可以是不对称数字用户线(ADSL)卡,综合服务数字 网(ISDN)卡或调制解调器,以提供与相应类型通信线路相连的数据通信连接。也可进行无线连接。在任何这些实施方式中,通信接口1213传送和接 收携带有表示各种信息的数字数据流的电信号、电磁信号或光信号。
网络连接1214通常通过一个或多个网络提供与其它数据设备的数据通 信。例如,网络连接1214可通过局域网1215(例如LAN)或通过由服务商 (其通过通信网络1216提供通信服务)操作的设备提供与另一台计算机的 连接。局域网1214和通信网络1216利用例如携带数字数据流的电信号、电 磁信号或光信号,和相关的物理层面(例如CAT5电缆、同轴电缆、光纤等)。 携带有往返于计算机系统1201的数字数据的经过多种网络的信号以及网络连接1214上的信号和经过通信接口1213的信号可在基带信号或者载波信号 中工作。基带信号将数字数据作为未调制电脉冲(其用于描述数字数据比特 流)的形式传输,其中术语“比特”广义地解释为符号,其中每个符号传输至 少一个或多个信息比特。所述数字数据还可用于调制载波,例如用振幅、相 位和/或频移键控信号,其沿传导介质传送,或者无线电波通过传播介质传送。 因此,所述数字数据可作为未调制基带数据的形式通过“有线”通信信道传送 和/或在不同于基带的预定频带中通过调制载波传送。计算机系统1201可通 过网络1215和1216、网络连接1214和通信接口1213发送与接收数据,包 括程序代码。另外,网络连接1214可提供通过LAN1215与移动装置1217 (例如个人数字助理(PDA)、笔记本电脑或移动电话)的连接。
在上文显示于图1的示例性能量谱也可用于此计算机实施系统。
用于本发明方法和系统的试剂和化学品可包装成试剂盒,以便于实施本 发明。在一个示例性实施方案中,试剂盒包括补骨脂素以及便于分级和分离 自身疫苗的分级分离容器。试剂盒的另一个实施方案包括至少一种能够导致 预定细胞改变的可活化药剂、至少一种在激发后能够活化所述至少一种可活 化药剂的能量调节剂,以及适于以稳定形式存储所述试剂的容器,优选地还 包括对对象施用所述至少一种可活化药剂和至少一种能量调节剂的说明,以 及施加来自初始能量源的初始能量以活化所述可活化药剂的说明。该说明可 以是任何期望的形式,包括但不限于:印刷到试剂盒(药盒)插页上,印刷 到一个或多个容器上,以及在电子存储介质(例如计算机可读存储介质)上 提供的电子化存储的说明。还任选地包括计算机可读存储介质上的软件包, 其允许用户综合信息并计算对照剂量,从而计算和控制辐照源的强度。
在本发明的一个不同方面,修饰介导生物活性或与其相关的靶结构的试 剂盒包括:
选自能量调节剂、等离子体活性剂及其组合的至少一种试剂;
-其中所述能量调节剂(如果存在的话)将初始能量升级或降级成能够直 接或间接导致靶结构中预定改变的活化能;
-其中所述表面等离子体活性剂(如果存在的话)增强或改变所施加的初 始能量或者能量调节剂产生的活化能,或者以上两者;和
一个或多个适于以稳定形式存储所述试剂的容器。
在一个不同的实施方案中,用于进行状态、病症或疾病治疗的试剂盒包 括:
至少一种能量调节剂,其能够将初始能量吸收、加强或改变成能够导致 靶结构中预定改变的能量;和
适于以稳定形式存储所述试剂的容器。
在另一个实施方案中,所述试剂盒还可包含向对象施用至少一种能量调 节剂的说明。
在本发明的PEPST实施方案中,本发明与通常称为光热治疗 (Photo-thermalTherapy,PTT)的光照治疗技术存在显著差异。为了说明 本发明PEPST(一种形式的光谱治疗,PST)与PTT技术之间的差异,下 文讨论了PST和PPT中中涉及的光化学过程。
当药物分子吸收激发光时,电子发生从基态到电子激发态的跃迁。电子 激发能随后通过辐射发射(发光)和无辐射衰变通道释放。当分子吸收激发 能时,从S
但是,本发明的PST方法基于辐射过程(荧光、磷光、发光、拉曼等), 而PTT方法基于分子中的非辐射过程(IC、VR和热转化)。
等离子体和增强的电磁场的基本原理
尽管等离子体金属纳米颗粒的光热特性已有使用,但等离子体活性纳米 颗粒在光疗法中的光谱吸收和发射尚未有报道。
在本发明中,PEPST(等离子体增强光谱特性(光谱吸收、发射、散射)) 是治疗所涉及的主要因素。
PEPST原理是基于电磁场作用的增强机制。电磁增强有两个主要来源: (1)第一,由于加入了金属颗粒极化所造成的场,激光电磁场被增强;(2) 除了激发激光场增强之外,还有另一种由于辐射出放大发射(发光、拉曼等) 场的分子所致的增强,其进一步极化金属颗粒,由此作为进一步放大拉曼/ 发光信号的天线。
电磁增强分为两个主要类别:a)仅在辐射场存在下发生的增强,和b) 即使没有辐射场时也发生的增强。第一类增强又分为几种过程。基底表面上 的等离子体共振,也称为表面等离体(surface plasmon),对电磁增强提供 了主要贡献。等离子体活性基底的有效类型包括纳米结构化金属颗粒、金属 材料的突出或粗糙表面。辐照这些表面的入射光激发金属中的传导电子,诱 导表面等离子体的激发,导致拉曼/发光增强。在等离子体频率上,金属纳米 颗粒(或纳米结构的粗糙)变成有极性,导致大的场诱导极化,因此导致表 面上的大局部场。这些局部场提高了发光/拉曼发射强度,与施加于分子上的 场的平方成正比。因而,这些表面上的分析物分子所经受的有效电磁场远大 于实际施加的场。随着远离表面,该场以1/r
电磁增强有两个主要来源:(1)第一,由于加入了金属颗粒极化所造成 的场,激光电磁场被增强;(2)除了激发激光场增强之外,还有另一种由于 辐射放大拉曼/发光场的分子所致的增强,由此进一步使金属颗粒极化,从而 作为进一步放大拉曼/发光信号的天线。等离子体活性金属纳米颗粒还显示出 大大增强的可见光和近红外光吸收,比常规激光光疗法试剂高几个数量级。 因此,等离子体纳米颗粒作为大幅增强的光吸收剂的用途提供了选择性且有 效的光疗法策略。金属纳米颗粒的光谱特性的可调谐性以及等离子体纳米结构的生物靶向能力使得PEPST方法非常有前途。
本发明的PEPST基于几种重要机制:
等离子体金属纳米颗粒对激发光的吸收提高,导致药物分子的光活化增 强
等离子体金属纳米颗粒对激发光的吸收提高,其用作更有效的能量调节 剂系统,产生更多光以提高对PA分子的激发
吸附于等离子体金属纳米颗粒上或其附近的光敏药物系统对激发光的 吸收提高
吸附于金属纳米颗粒上或其附近的能量调节剂分子的光吸收提高
吸附于金属纳米颗粒上或其附近的能量调节剂分子的光发射放大
PA分子对能量调节剂所发出的的吸收提高
可提高吸附于金属纳米结构或其附近的分子发射的光效率(拉曼或发 光)的几种现象之一拉曼散射是表面增强拉曼散射(SERS)作用。1984年, 本发明人之一首先报道了SERS作为分析技术的一般应用,以及对于多种化 学品(包括几种同素环和杂环多芳香化合物)进行SERS测量的可能性[T. Vo-Dinh,M.Y.K.Hiromoto,G.M.Begun and R.L.Moody,“Surface-enhanced Raman spectroscopy for trace organic analysis,”Anal.Chem.,vol.56,1667, 1984]。自从二十世纪八十年代中期以来,已经有大量研究致力于了解SERS中的拉曼增强以及对其建模。例如,图6显示了早在1984年的Kerker的早 期工作,其对球形银纳米颗粒和围绕电介质芯的金属纳米壳的电磁场增强进 行建模[M.M.Kerker,Acc.Chem.Res.,17,370(1984)]。该图显示了分离的球 形纳米球和纳米壳在不同激发波长下电磁增强的理论计算的结果。对于吸附 于SERS基底上的化合物,通常弱拉曼散射过程的强度最大增加10
理论模型显示,可以调整纳米颗粒和纳米壳的大小至激发波长。实验证 据表明,10
根据经典电磁学理论,在光入射到金属纳米结构上时,电磁场可局部放 大。这些场增强可以是相当大的(通常为10
PEPST探针的设计、制造和操作
(A)包含与金属(金)纳米颗粒结合的PA分子的探针;
(B)用金属纳米颗粒覆盖的含PA纳米颗粒;
(C)用PA纳米帽覆盖的金属纳米颗粒;
(D)用金属纳米帽覆盖的含PA纳米颗粒;
(E)用PA纳米壳覆盖的金属纳米颗粒;
(F)用金属纳米壳覆盖的含PA纳米颗粒;和
(G)用具有防护性涂层的金属纳米壳覆盖的含PA纳米颗粒。
PEPST探针的基本实施方案显示于图7的A。该探针包含与金属(例如 金)纳米颗粒结合的PA分子。图8举例说明了PEPST探针的等离子体增强 作用。金纳米颗粒可用作药物递送平台。已有描述金纳米颗粒作为基于颗粒 的肿瘤靶向药物递送领域的新技术[GiulioF.Paciotti and Lonnie Myer, DavidWeinreich,Dan Goia,Nicolae Pavel,RichardE.McLaughlin,Lawrence Tamarkin,“Colloidal Gold:A Novel Nanoparticle Vectorfor Tumor Directed Drug Delivery,Drug Delivery,11:169-183,2004]。能够逃脱网状内皮系统 (RES)的噬细胞清除的颗粒递送系统有利于将癌症治疗剂靶向到实体瘤。 这些递送系统可在理想条件下优先积累于肿瘤微环境中。能够将光治疗药物 选择性置于肿瘤内的颗粒递送系统还可降低药物在健康器官中的积累。因 此,这些递送系统可提高治疗的相对效力或安全性(较低的辐射能和强度), 因此会提高药物的治疗效力。
使用合适能量的辐射来激发PA药物分子(例如氨基-γ-酮戊酸(ALA)、 卟啉)并使它们具有光活性。例如,对于PDT药物ALA,氦氖激光器(632.8-nm 激发)的光可用于激发。在这种情况下,金属纳米颗粒设计成在632.8nm周 围显示强等离子体共振波段。表面等离子体共振效应放大了纳米颗粒处的激 发光,导致PA药物分子的光活化提高以及治疗效力改善。等离子体增强机 制还可用于图7的B、C、D、E、F和G中的其他PEPST探针。
图34显示了等离子体光活性探针的另一实施方案。图35显示等离子体 光活性探针的另一实施方案,其具有金属和UC材料之间的介电层。
在一个实施方案中,本发明治疗状态、病症或疾病的方法包括:
(1)向对象施用能够在活化时造成靶结构预定改变的至少一种可活化 药剂,以及至少一种等离子体活性剂;和
(2)从初始能量源向所述对象施加初始能量,
其中,所述等离子体活性剂增强或改变所施加的初始能量,使得增强的 初始能量原位活化所述可活化药剂,
-由此导致靶结构发生预定改变,其中所述预定改变修饰所述靶结构并治 疗所述状态、病症或疾病。
在一个不同的实施方案中,根据本发明的方法包括:
(1)使所述靶结构接触能够在活化时造成靶结构预定改变的至少一种 可活化药剂以及至少一种等离子体活性剂;和
(2)向所述靶结构施加来自初始能量源的初始能量,
其中,所述等离子体活性剂增强或改变所施加的初始能量,使得增强的 初始能量活化所述可活化药剂,
-由此导致靶结构发生预定改变,其中所述预定改变修饰所述靶结构并调 节该靶结构的生物活性。
在一个不同的实施方案中,还可加入至少一种能量调节剂和/或产生激发 的能量调节剂材料。在一个实施方案中,所述能量调节剂或产生激发的能量 调节剂材料可吸收、加强或改变初始能量,其随后被至少一种等离子体试剂 增强。在一个不同的实施方案中,所述能量调节剂或产生激发的能量调节剂 材料可吸收、加强或改变被所述至少一种等离子体活性剂增强的能量,并且 发射能够活化可活化药剂的能量。
在另一个实施方案中,所述预定改变增强了所述靶结构的表达、促进其 生长或者增加其量。在另一个不同的实施方案中,与未处理的相似靶结构相 比,所述预定改变增强、抑制或稳定所述靶结构的通常生物活性。在一个不 同的实施方案中,所述预定改变改变所述靶结构的免疫学或化学特性。在一 个不同的实施方案中,所述靶结构是被所述预定改变修饰为具有更高或更低 抗原性或免疫原性的化合物。
等离子体活性金属纳米结构的结构
等离子体共振在来自入射光场驱动的自由电子总体振荡的金属纳米颗 粒中出现。纳米颗粒的等离子体响应在越来越多的应用中起作用,包括表面 增强拉曼散射(surface-enhanced Raman scattering,SERS)、化学传感、药 物递送、光热癌症治疗和新光子设备。本发明人之一已将等离子体纳米基材 的研究和应用用于SERS检测超过二十年[T.Vo-Dinh,“Surface-Enhanced Raman Spectroscopy Using MetallicNanostructures,”
图9显示了可设计的等离子体活性纳米结构多个实施方案中的一些,并 且为本发明的优选实施方案:
(A)金属纳米颗粒;
(B)用金属纳米帽覆盖的电介质纳米颗粒芯;
(C)覆盖电介质球形芯的球形金属纳米壳;
(D)覆盖电介质球形芯的扁圆金属纳米壳;
(E)用电介质纳米壳覆盖的金属纳米颗粒芯;
(F)具有防护涂层的金属纳米壳;
(G)覆盖电介质球形芯的多层金属纳米壳;
(H)多纳米颗粒结构;
(I)金属纳米管和纳米三角/纳米棱柱;和
(J)金属圆柱。
具有远程活化药物释放的PEPST探针
在本发明的另一个实施方案中,PA药物分子可掺入可在金属(金)纳 米颗粒上形成纳米帽的材料(例如生物相容性聚合物)中。该材料可以是凝 胶或生物相容性聚合物,其可具有长期持续药物释放特性。合适的凝胶或生 物相容性聚合物包括但不限于:基于聚交酯(PLA)、聚乙交酯(PGA)、聚 己内酯(PCL)的聚酯以及其共聚物,和PHB-PHV类的聚羟基链烷酸酯, 其他聚酯,天然聚合物,特别是改性聚糖类,例如淀粉、纤维素和壳聚糖, 聚环氧乙烷,聚醚酯嵌段共聚物和乙烯乙酸乙烯酯共聚物。药物释放机制还 可由非侵入性技术触发,例如RF、MW、超声、光子(图10)。
图11显示另一些可能的实施方案,其中PA药物分子通过接头与金属纳 米颗粒连接,所述接头可被光子辐射切割。这些接头包括但不限于生物化学 连接(图11的A)、DNA连接(图11的B)或者抗体-抗原连接(图11的C)。 在另一个实施方案中,接头是化学不稳定连接,其将被细胞内部的化学环境 所打断。这些类型的探针可用于PA分子必须进入细胞核的治疗形式(例如 补骨脂素分子需要进入细胞的细胞核,并插入DNA上)。因为金属纳米颗粒比小分子更加难以进入细胞核,所以期望具有可释放PA分子的PEPST探针。
疾病靶向性PEPST探针
金属(例如银或金)纳米颗粒(纳米球、纳米棒等)的聚集是常见的问 题,尤其是对于柠檬酸加帽的金纳米球、十六烷基三甲基溴化铵(CTAB)加 帽的金纳米球和纳米棒和纳米壳,因为它们在分散于缓冲溶液中时由于盐离 子的聚集效应而稳定性差。可通过用聚乙二醇(PEG)给纳米颗粒加帽(通 过硫醇官能化PEG与金属纳米颗粒的缀合)来改善生物相容性以及防止纳米 颗粒聚集。此外,由于增强的通透性和驻留效应(称为EPR效应),PEG化纳米颗粒优先积累到肿瘤组织中[Maedaa H,Fanga J,Inutsukaa T,Kitamoto Y (2003)Vascular permeability enhancement in solid tumor:various factors, mechanismsinvolved and its implications.Int Immunopharmacol 3:319-328; Paciotti GF,MyerL,Weinreich D,Goia D,Pavel N,McLaughlin RE,Tamarkin L(2004)Colloidal gold.anovel nanoparticles vector for tumor directed drug delivery.Drug Deliv 11:169-183]。肿瘤组织中的血管比正常组织中的更具“泄 漏性”,因此,颗粒或大的大分子物质或聚合物质优先渗出进入肿瘤组织。由 于淋巴系统降低,颗粒和大分子倾向于在肿瘤组织中停留较长的时间,而它 们在正常组织被快速地清除。此肿瘤靶向策略常常称为被动靶向,而抗体靶 向策略称为主动靶向。
为了特异性靶向患病细胞、特定基因或蛋白质标志物,本发明的药物系 统可与生物受体结合(例如抗体、合成的分子印记系统、DNA、蛋白质、脂 类、细胞表面受体、适配体等)。选择性递送PA剂到患病细胞和组织的免疫 靶向形式提供了有效的策略,以实现特异性、使得对健康细胞的非特异性损 伤最小化以及降低所用的辐射强度。金属纳米颗粒(例如金、银)的生物官 能化可使用通常开发和广泛使用的方法进行。有几种靶向策略可用于本发 明:(a)与识别患病细胞特异性生物标志物的抗体缀合的纳米颗粒;(b)聚 乙二醇(PEG)钝化的纳米颗粒,其用于提高纳米颗粒的生物相容性和生物 稳定性,并使得它们血液驻留时间增加。
具有生物受体的PEPST探针
生物受体是靶向患病细胞、突变基因或特异性生物标志物的特异性的关 键。它们负责目的生物靶标与用于治疗的药物系统的结合。这些生物受体可 采取许多形式,已经使用的不同生物受体与已使用生物传感器监测的不同分 析物一样为数众多。但是,生物受体一般可分为五个不同的主要类型。这些 类型包括:1)抗体/抗原,2)酶,3)核酸/DNA,4)细胞结构/细胞和5) 生物模拟物。图12说明了可设计的具有生物受体的多种PEPST探针的多个实施方案。探针类似于图2中的,但是还具有用于肿瘤靶向的生物受体。
生物活性DNA探针可直接或间接固定于药物系统上,例如能量调节剂 系统(例如金纳米颗粒、半导体、量子点、玻璃/石英纳米颗粒等)表面,以 确保最佳接触和最大结合。当固定于金纳米颗粒上时,基因探针是稳定的, 因此可重复使用。可使用几种方法将DNA结合到不同的载体上。常用于将 DNA与玻璃结合的方法包括将玻璃表面硅烷化,然后用碳二亚胺或戊二醛活 化。硅烷化方法已用于使用3甲基丙烯酰氧丙基三甲氧基硅烷(GOP)或氨基丙基三甲氧基硅烷(APTS)结合玻璃表面,随后通过DNA合成期间掺入 分子3′或5′端的氨基接头共价连接DNA。
用于PEPST探针的PEG化载体
这些颗粒的合成首先由Michael Faraday在1857年报道,其描述了从氯 化金和柠檬酸钠产生AuO纳米颗粒的化学过程(Faraday 1857)。通过仅将 TNF与颗粒结合而制造的初始载体制剂比天然TNF毒性低,并且在小鼠模 型中有效降低肿瘤负载。随后的研究显示,该载体的安全性主要是由于其在 RES中的快速摄取和清除。重新配制该载体以包含硫醇衍生化聚乙二醇 (PEG-THIOL)分子,其与金纳米颗粒表面上TNF分子结合。新载体 PT-cAu-TNF避免了RES的检测和清除,主动并且特异性地结合实体瘤内的 TNF。改变的生物分布与改善相关。在本发明中,优选实施方案包括使用PEG 化-Au纳米颗粒-PA药物系统来避免RES的检测和清除。
将生物分子固定在金属纳米颗粒上
生物分子(PA分子、药物、蛋白质、酶、抗体、DNA等)在固体支持 物上的固定可使用文献公开的多种方法。结合可通过共价键利用天然存在或 可引入生物分子结构中的活性基团例如胺(-NH
本发明中的目的固体支持物是金属(优选金或银)纳米颗粒。涉及金属 表面例如金或银的主要固定方案利用了之前用烷基硫醇衍生化的表面,形成 稳定的连接。烷基硫醇易于以微摩尔浓度在银表面上形成自组装单层 (self-assembled monolayer,SAM)。烷基硫醇链的末端可用于结合生物分 子,或者可容易地修饰成这样作。已发现烷基硫醇链的长度是重要的参数, 保持生物分子远离表面,烷基长度优选4至20个碳。例如,就DNA杂交来说,这已显示代替了非特异性吸附的HS-(CH2)6-ss-DNA和转向化学连接的 HS-(CH2)6-ss-DNA,以这种方式产生易于杂交的大多数表面结合探针。(M. Culha,D.L.Stokes和T.Vo-Dinh,“Surface-Enhanced Raman Scattering for Cancer Diagnostics:Detection ofthe BLC2 Gene,”Expert Rev.Mol. Diagnostics,3,669-675(2003))。此外,为了避免表面上直接非特异性DNA 吸附,烷基硫醇已用于封闭对表面的进一步接近,仅允许通过接头进行共价 固定[Steel,A.B.;Herne,T.M.;Tarlov,M.J.Anal.Chem.1998,70,4670-7; Herne,T.M.;Tarlov,M.J.J.Am.Chem.Soc.1997,119,8916-20]。
有许多方法涉及稳定寡核苷酸与金颗粒的缀合物的制备,其通过使用硫 醇官能化生物分子,之前已显示其形成金硫醇强连接。具有作为锚点的5′- 端烷基硫醇官能团的寡核苷酸可结合金纳米颗粒的表面,所得标记在高温和 低温条件下都是耐用且稳定的[R.Elghanian,J.J.Storhoff,R.C.Mucic,R.L. Letsinger和C.A.Mirkin,Selectivecolorimetric detection of polynucleotides based on the distance-dependentoptical properties of gold nanoparticles. Science 277(1997),1078-1081页]。已开发了环状二噻烷-表雄甾酮二硫化物 接头用于将寡核苷酸与金表面结合[R.Elghanian,J.J.Storhoff,R.C.Mucic, R.R.L.Letsinger和C.A.Mirkin,Selective colorimetricdetection of polynucleotides based on thc distance-dependent opticalproperties of gold nanoparticles.Science 277(1997),pp.1078-1081]。Li等报道了三硫醇加帽的 寡核苷酸,其可稳定直径≥100nm的金金属纳米颗粒,同时保留与非环或二 巯基寡核苷酸修饰颗粒相当的杂交特性。[Z.Li,R.C.Jin,C.A.Mirkin and R.L. Letsinger,Multiple thiol-anchor capped DNA-gold nanoparticle conjugates. Nucleic AcidsRes.30(2002),pp.1558-1562]。
一般说来,不能使用针对金颗粒开发的已有实验方案使银纳米颗粒被烷 基硫醇修饰寡核苷酸有效钝化。产生包含银芯和金薄壳的核壳颗粒的方法使 得银纳米颗粒能够使用用于制备纯金颗粒-寡核苷酸缀合物的已有方法方便 地进行烷基硫醇-寡核苷酸官能化。[Y.W.Cao,R.Jin and C.A.Mirkin, DNA-modified core-shell Ag/Aunanoparticles.J.Am.Chem.Soc.123(2001), pp.7961-7962]。
为了便于使用生物分子缀合的等离子体活性纳米探针 (plasmonics-activenanoprobe,PAN),生物靶标可以充分接近生物分子的识 别区域是非常重要的。通常,加入多核苷酸延伸序列以作为PAN和寡核苷 酸识别区域之间的间隔区。为了在基于DNA杂交的测定中实现高灵敏度和 选择性,很重要的是PAN标记胶体溶液是稳定的。最近Storhoff等[J.J. Storhoff,R.Elghanian.C.A.Mirkin and R.R.L.Letsinger,Sequence-dependentstability of DNA-modified gold nanoparticles.Langmuir 18(2002),pp. 6666-6670]已显示,寡核苷酸的碱基组成对胶体稳定性和寡核苷酸表面覆盖 度有显著影响。Otsuka等已使用异二官能化硫醇-PEG(聚乙二醇)衍生物 作为接头来稳定金PRP[H.Otsuka,Y.Akiyama,Y.Nagasaki and K.Kataoka, Quantitative and reversible lectin-induced association of gold nanoparticles modified with α-lactosyl-ω-mercapto-poly(ethylene glycol).J.Am.Chem.Soc. 123(2001),pp.8226-8230]。
蛋白质通常使用非共价被动吸附与PAN结合。或者,可使用巯基-十一 烷酸接头/间隔分子将NeutrAvidin共价附着至金和银的节段化纳米棒[I.D. Walton,S.M.Norton,A.Balasingham,L.He,D.F.Oviso,D.Gupta,P.A.Raju, M.J.Natan and R.G.Freeman,Particles for multiplexed analysis in solution: detection and identificationof striped metallic particles using optical microscopy.Anal.Chem.74(2002),2240-2247页]。结合在金属表面的硫醇基 和颗粒表面上的羧基官能团使用EDC和s-NHS试剂活化,然后与 NeutrAvidin中的氨基交联。制造核壳颗粒的能力提供了一种固定生物分子 以及改造颗粒表面的有前途的替代方法,所述颗粒中芯是金属,壳由乳胶、 二氧化硅、聚苯乙烯或其他非金属材料构成[T.K.Mandal,M.S.Fleming and D.R.Walt,Preparationof polymer coated gold nanoparticles by surface-confined living radicalpolymerization at ambient temperature.Nano Letters 2(2002),pp..3-7;S.O.Obare,N.R.Jana and C.J.Murphy,Preparation of polystyrene-and silica-coated goldnanorods and their use as templates for the synthesis of hollownanotubes.Nano Letters 1(2001),601-603页;C. Radloff and N.J.Halas,Enhancedthermal stability of silica-encapsulated metal nanoshells.Appl.Phys.Lett.79(2001),64-676页;L.Quaroni and G. Chumanov,Preparation of polymer-coatedfunctionalized silver nanoparticles.J. Am.Chem.Soc.121(1999),10642-10643页;F.Caruso,Nanoengineering of particle surfaces.Adv.Mater.13(2001),11-22页]。
已发现银表面在暴露于稀释的烷基硫醇乙醇溶液时显示受控的自组装 动力学。表面与烃类尾之间形成的倾斜角为0至15°。与金相比,银上还具 有更大的硫醇堆积密度[Burges,J.D.;Hawkridge,F.M.Langmuir 1997,13, 3781-6]。金/银纳米颗粒上形成自组装单层(SAM)之后,烷基硫醇可共价 偶联生物分子。用于共价固定生物分子的大多数合成方法利用多肽(酶、抗 体、抗原等)或者氨基标记DNA链的游离胺基与羧酸部分反应形成酰胺键。 通常,首先与羧酸部分形成更有活性的中间产物(不稳定的酯),后一阶段 与游离胺反应,增加了偶联产率。成功偶联的方法包括但不限于:
使用N-羟基琥珀酰亚胺(NHS)及其衍生物的结合方法
该偶联方法包括在温和条件下进行羧酸与不稳定基团(N-羟基琥珀酰亚 胺(NHS)衍生物)的酯化,以及与多肽(酶、抗体、抗原等)或胺基标记 DNA中游离氨基的进一步反应,产生稳定酰胺[Boncheva,M.;Scheibler,L.; Lincoln,P.;Vogel,H.;Akerman,B.Langmuir1999,15,4317-20]。NHS几乎 仅与伯胺基团反应。共价固定可在少至30分钟内实现。因为在涉及这些高 度不稳定酯的反应中H
使用马来酰亚胺的结合方法
马来酰亚胺可用于通过可用的-SH部分固定生物分子。使用马来酰亚胺 的偶联方案已证明可用于抗体、Fab片段、肽和SH修饰的DNA链的位点特 异性固定。用于蛋白质马来酰亚胺偶联的样品制备包括用弱还原剂(例如二 硫苏糖醇、2-巯基乙醇或三(2-羧乙基)膦盐酸化物)简单还原两个半胱氨酸残 基之间的二硫键。但是,二硫化物还原通常会导致蛋白质丧失其天然构象, 可能损害酶活性或抗体识别。用2-亚氨基硫烷盐酸化物(Traut试剂)对伯 胺基团进行修饰以引入巯基基团,这是针对缺乏它们的生物分子的替代方 案。游离巯基通过与不饱和碳-碳键的加成反应固定于马来酰亚胺表面 [Jordan,C.E.,等1997]。
使用碳二亚胺的结合方法
用巯基烷基二醇修饰的表面可用1,1′-羰二咪唑(CDI)活化,形成羰基 咪唑中间产物。具有可用胺基的生物分子替换咪唑,与连接到表面的烷基硫 醇形成氨基甲酸酯键[Potyrailo,R.A.,等,1998]。
将生物分子与金属(例如银、金)纳米颗粒缀合的其他实验方法。
在一个优选实施方案中,金属胶体水溶胶纳米颗粒通过将AgNO
在一个优选实施方案中,使用银纳米颗粒。在一个优选实施方案中,使 用涉及Ag表面的固定方案,其利用之前用烷基硫醇衍生化的表面,形成稳定 的连接。烷基硫醇易于以微摩尔浓度在银表面上形成自组装单层(SAM)。烷 基硫醇链的末端可直接用于结合生物分子,或者可容易地修饰成这样作。发 现烷基硫醇链的长度是重要的参数,其保持生物分子远离表面。此外,为了 避免表面上的直接非特异性DNA吸附,还使用烷基硫醇来封闭对表面的进一 步接近,允许通过接头进行共价固定。
已发现银/金表面在暴露于稀释的烷基硫醇乙醇溶液时显示受控的自组装 动力学。表面与烃类尾之间形成的倾斜角为0至15°。与金相比,银上还具有 更大的硫醇堆积密度
银纳米颗粒上形成SAM之后,烷基硫醇可共价偶联生物分子。共价固定 生物分子的大多数合成技术利用多肽(酶、抗体、抗原等)或者氨基标记DNA 链的游离胺基与羧酸部分反应,形成酰胺键。在一个实施方案中,首先与羧 酸部分形成更有活性的中间产物(不稳定的酯),后一阶段与游离胺反应,提 高了偶联产率。成功偶联的方法包括但不限于:
用于将DNA与银纳米颗粒结合的偶联方法包括在温和条件将羧酸与不稳 定基团N-羟基琥珀酰亚胺(NHS)衍生物进行酯化,以及与多肽(酶、抗体、 抗原等)或胺基标记DNA中游离氨基的进一步反应,产生稳定的酰胺[4]。NHS 几乎仅与伯胺基团反应。共价固定可在少至30分钟内实现。因为在涉及这些 高度不稳定酯的反应中H
用于PEPST的光的光谱范围
只要使用合适的纳米结构、纳米尺度尺寸、金属类型,等离子体增强效 应可在整个电磁区域中发生。因此,PEPST个概念对于整个无线电波谱都是 有效的,即从γ射线至X射线涵盖整个紫外线、可见光、红外线、微波和无 线电波频率能量的能量。但是,由于实用的原因,可见光和NIR光用于银和 金纳米颗粒,这是因为银和金的等离子体共振分别发生于可见光和NIR区 域。尤其对于金纳米颗粒,NIR区域非常适于非侵入性治疗。
组织治疗窗口中的光子激发
有数种使用光来非侵入性激发光活性化合物的方法。我们可使用波长在 所谓“治疗窗口”(700-1300nm)内的光。光穿透组织的能力取决于吸收。在 称为治疗窗口(或诊断窗口)的光谱范围内,大多数组织是足以允许光显著 穿透的弱吸收剂。该窗口从600至1300nm,从可见光谱的橙/红区域到NIR。 在短波端,窗口的边界是氧化和去氧化形式血红蛋白的吸收。在600nm附近 区域中,随着波长变短,氧合血红蛋白的吸收增加约两个数量级。在短波长 下,许多更强吸收的生物分子变得重要,包括DNA和色氨酸和酪氨酸。在 窗口的红外(IR)端,穿透受限于水的吸收特性。在治疗窗口内,散射比吸 收更显著,因此传播的光变得扩散,尽管不一定进入扩散限。图13显示了 组织治疗窗口图。以下部分讨论了单光子和多光子技术用于治疗的用途。
光激发方法:单光子和多光子激发
可使用两种方法,单光子或多光子激发。如果使用双光子技术,可用 700-1000nm的光激发PA分子,其可穿透到达组织内部深处,以激发在 350-500nm光谱范围吸收的分子。该方法可激发补骨脂素化合物,其在 290-350nm光谱范围中吸收并发射可见光。使用单光子方法,光活化剂(PA) 药物分子可直接吸收600-1300nm的激发光。在这种情况下,我们可设计补 骨脂素相关系统(例如具有额外芳香环或其他缀合以改变在不同波长下吸收 能力的补骨脂素)或者使用其他PA系统:光动力学治疗药物、ALA等。 使用X射线激发的光分离置换法的PEPST形式 X射线激发的需要
已经证明光分离置换法是针对许多疾病的有效治疗。但是,对于开发非 侵入性形式有很强的需求,其中激发光可直接辐照光活性化合物而不需要从 患者中取出血液并输回。针对此类治疗的改善的实用形式的一种方法描述于 2007年11月6日提交的US序列号No.11/935,655,其全部内容通过引用并 入本文。
尽管X射线可非侵入性地激发组织深处的化合物,但X射线不易于被 有机药物化合物所吸收。通过提供可吸收X射线能量并将该能量转化为可用 于活化药物分子的其他能量的分子系统,本发明提供了该问题的解决方案。 更具体地说,本发明中可吸收并转化X射线能量的分子系统是包含纳米颗粒 的PEPST探针。
在本实施方案中,本发明使用X射线用于激发。优点是能够非侵入地激 发分子,因为X射线可穿透组织深处。但是,局限性在于X射线不与大多 数分子相互作用。在本发明的一个实施方案中,药物分子(或PA)与称为″ 能量调节剂″的分子实体结合,其可与X射线相互作用,然后发射可被PA 药物分子吸收的光。(图14)
用于X射线激发的PEPST探针
在之前的章节中,已经讨论了金纳米颗粒作为等离子体活性系统的优 点。此外,金纳米颗粒也是优秀的能量调节剂系统,因为它们是生物相容的, 并且已显示是X射线造影剂的可能候选。[Hainfeld et al,The British Journal of radiology,79,248,2006]。使用高Z材料用于癌症放射线疗法中剂量增强的 构思已有20年之久。出于两个主要原因,金纳米颗粒用作剂量增强剂似乎 比早期使用微球体及其他材料的尝试更有希望。第一,金比碘(I,Z=53) 或钆(Gd,Z=64)有更高的Z数,同时在高达至少3%重量下对啮齿动物 或人肿瘤细胞显示几乎没有毒性。金纳米颗粒对小鼠是无毒的,主要通过肾 被机体清除。小的金纳米颗粒的这种新用途允许在肿瘤中实现显著高-Z放射 性增强所需的高金属含量[James F Hainfeld,Daniel N Slatkin and Henry M Smilowitz,The use of goldnanoparticles to enhance radiotherapy in mice,Phys. Med.Biol.49(2004)]
递送致死量的辐射到肿瘤而同时使得附近正常组织的放射性接触尽可 能小,这仍是放射疗法中最大的挑战。在基于光的放射疗法期间递送到肿瘤 的剂量可通过向肿瘤中加载高原子序数(Z)材料例如金(Au,Z=79)来提 高,导致肿瘤内与周围组织相比光电吸收更大。因此,金显然导致比碘或钆 更高的肿瘤剂量。第二,在递送高Z材料到肿瘤方面,纳米颗粒提供了比微 球更好的机制,克服了使用金微球的较早尝试中发现的一些困难[SangHyun Cho,Estimation of tumor dose enhancement due to gold nanoparticlesduring typical radiation treatments:a preliminary Monte Carlo study,Phys.Med.Biol.50(2005)]。
金(或金属)与PA配体的复合物:金(或金属)与PA的复合物可优 选用于本发明。金属可用作能量调节剂系统。例如,金与补骨脂素相关配体 的复合物可用作杂合能量调节剂-PA系统。金分子用作能量调节剂系统,配 体分子用作PA药物系统。之前的研究显示,金(I)与二膦和二吡啶配体的复 合物显示出X射线激发的发光[Ref.3:Kim et al,Inorg.Chem.,46,949, 2007]。
图15显示PEPST探针的多个实施方案,其可优选用于能量调节剂-PA 系统的X射线激发。这些探针包括:
(A)与能量调节剂和等离子体金属纳米颗粒结合的PA分子;
(B)具有用PA分子覆盖的能量调节剂纳米帽的等离子体金属纳米颗 粒;
(C)带有等离子体金属纳米颗粒的用PA覆盖的纳米颗粒;
(D)用PA分子和等离子体金属纳米帽覆盖的含有能量调节剂的纳米 颗粒;
(E)具有用PA分子覆盖的能量调节剂纳米壳的等离子体金属纳米颗 粒芯;和
(F)通过可分开生物化学连接与能量调节剂(附着至等离子体金属纳 米颗粒)纳米颗粒结合的PA分子。
基于能量调节剂-PA的PEPST系统的实例
为简化起见,下列讨论集中于金作为金属材料以及CdS作为能量调节剂 材料(其也可用作DNA稳定CdS,参见Ma等,Langmuir,23(26), 12783-12787(2007))以及补骨脂素作为PA分子。但是,应理解,在本发明 范围内,金属材料、能量调节剂和PA分子的许多其他实施方案是可能的, 下述讨论仅用于举例目的。可用于等离子体共振壳或其他等离子体共振结构 中的合适金属可包括但不限于:金、银、铂、钯、镍、钌、铼、铜和钴。
在图15的A的实施方案中,PEPST系统包括金纳米颗粒、与PA药物 分子(例如补骨脂素)相连的能量调节剂纳米颗粒(例如CdS)。X射线辐 照CdS,后者吸收X射线[Hua et al,Rev.Sci.Instrum.,,73,1379,2002]并 发射CdS XEOL光(350-400nm),其被金纳米颗粒等离子体增强。此增强 的XEOL光用于对补骨脂素(PA分子)进行光活化。在这种情况下,金纳米颗粒的纳米结构设计成增强350-400nm的XEOL光。
在图15的B的实施方案中,PEPST系统包括等离子体活性金属(金) 纳米颗粒,其具有PA分子(例如补骨脂素)覆盖的能量调节剂纳米帽(CdS)。 X射线辐照CdS,后者吸收X射线并发射XEOL光,其被金纳米颗粒等离 子体增强。此增强的XEOL光用于对补骨脂素(PA分子)进行光活化。
在图15的C的实施方案中,PEPST系统包括用PA(例如补骨脂素) 覆盖的CdS纳米颗粒,其具有较小的等离子体金属(金)纳米颗粒。X射线 辐照CdS,后者吸收X射线并发射XEOL光,其被金纳米颗粒等离子体增 强。此增强的XEOL光用于对补骨脂素(PA分子)进行光活化。
在图15的D的实施方案中,能量调节剂芯包括用金纳米帽覆盖的CdS 或CsCl纳米颗粒。X射线辐照CdS或CsCl,后者吸收X射线[[Jaegle et al, J.Appl.Phys.,81,2406,1997]并发射XEOL光,其被金纳米帽结构等离子体 增强。此增强的XEOL光用于对补骨脂素(PA分子)进行光活化。
类似地,图15的E中的实施方案包括用CdS或CsCl壳覆盖的球形金 芯。X射线辐照CdS或CsCl材料,后者吸收X射线[Jaegle et al,J.Appl.Phys., 81,2406,1997]并发射XEOL光,其被金纳米球等离子体增强。此增强的XEOL光用于对补骨脂素(PA分子)进行光活化。
在图15的F的实施方案中,PEPST系统包括金纳米颗粒、通过可被辐 射解离的连接与PA药物分子(例如补骨脂素)相连的能量调节剂纳米颗粒 (例如CdS)。X射线辐照CdS,后者吸收X射线并发射CdS XEOL光 (350-400nm),其被金纳米颗粒等离子体增强。此增强的XEOL光用于对 补骨脂素(PA分子)进行光活化。在这种情况下,金纳米颗粒的纳米结构 设计成增强350-400nm的XEOL光。
在替代实施方案中,金属纳米颗粒或单纳米壳被替换成多层纳米壳 [Kun Chen,Yang Liu,Guillermo Ameer,Vadim Backman,Optimal design of structurednanospheres for ultrasharp light-scattering resonances as molecular imagingmultilabels,Journal of Biomedical Optics,10(2),024005(March/April 2005)]。
在另一些替代实施方案中,金属纳米颗粒用介电材料(例如二氧化硅) 层(1-30nm)覆盖。介电层(或纳米壳)设计成防止能量调节剂(也称为 EEC)分子发射的光由于金属直接接触能量调节剂分子而猝灭。在另一些替 代实施方案中,能量调节剂分子或材料通过隔离物(接头)结合(或接近) 金属纳米颗粒。隔离物设计成防止能量调节剂分子或材料发射的发光猝灭。
其他可用材料
能量调节剂材料可包括任何可吸收X射线并发光从而激发PA分子的材 料。能量调节剂材料包括但不限于:
金属(金、银等);
量子点;
半导体材料;
闪烁和磷光材料;
显示出X射线激发发光(XEOL)的材料;
有机固体、金属络合物、无机固体、晶体、稀土材料(镧系元素)、聚 合物、闪烁体、磷光材料等;和
显示出激发特性的材料。
量子点、半导体纳米结构。涉及量子点、半导体材料等的多种材料可用 作能量调节剂系统。例如,CdS相关纳米结构已显示X射线激发的UV-可见 光谱区中的发光[Hua etal,Rev.Sci.Instrum.,73,1379,2002]。
作为能量调节剂系统的闪烁体材料。多种闪烁体材料可用作能量调节 剂,因为它们吸收X射线并发光,其可用于激发PA系统。例如,钼酸盐的 单晶体可被X射线激发并发射约400nm的光[Mirkhin et al,Nuclear Instrum. Meth.In Physics Res.A,486,295(2002]。
作为能量调节剂系统的固体材料:由于其X射线激发发光的特性,多种 固体材料可用作能量调节剂。例如CdS(或CsCl)在由软X射线激发时显 示出发光[Jaegle et al,J.Appl.Phys.,81,2406,1997]。
XEOL材料:镧系元素或稀土材料[L.Soderholm,G.K.Liu,Mark R. Antonioc,F.W.Lytle,X-ray excited optical luminescence.XEOL.detection of x-rayabsorption fine structure.XAFZ,J.Chem.Phys,109,6745,1998], Masashi Ishiia,Yoshihito Tanaka and Tetsuya Ishikawa,Shuji Komuro and Takitaro Morikawa,Yoshinobu Aoyagl,Site-selective x-ray absorption fine structure analysis ofan optically active center in Er-doped semiconductor thin film using x-ray-excited optical luminescence,Appl.Phys.Lett,78,183,2001]
可用作能量调节剂系统的显示XEOL的金属络合物的一些实例示于图 16和17。这些结构可通过将金属原子替换成金属纳米颗粒来改性,从而制 成等离子体增强的PEPST探针。在本发明中,包括纳米结构的大小、形状 和金属类型在内的实验参数可根据激发辐射(NIR或X射线激发)、光活化 辐射(UVB)和/或来自能量条制剂系统的发射过程(可见NIR)来选择。
美国专利No.7,008,559(其全部内容通过引用并入本文)描述了ZnS的 向上转换性能,其中767nm的激发产生可见光区的发射。美国专利No. 7,008,559中描述的材料(包括ZnS和掺有Er
其他适于作为能量调节剂的材料包括但不限于CdTe、CdSe、ZnO、CdS、 Y
一些纳米颗粒,例如ZnS:Tb
使用X射线激发的PEPST探针的等离子体增强效应的原理
基本PEPST探针实施方案的一个实施方案包括与能量调节剂结合并与 等离子体金属(金)纳米颗粒结合的PA分子。首先,金属纳米颗粒可用作 药物递送平台(参见上述讨论)。其次,金属纳米颗粒可起到两种作用:
(1)增强X射线电磁场
(2)增强能量调节剂系统发射的信号。
用于激发能量调节剂系统的X射线辐射被金属纳米颗粒通过等离子体 共振放大。因此,能量调节剂系统显示比用于光活化PA药物分子(例如补 骨脂素)更多的发射光,并使得它们具有光活性。在这种情况下,金属纳米 颗粒设计成在X射线波长或其附近显示强等离子体共振。表面等离子体共振 效应放大了纳米颗粒处的激发光,导致PA药物分子的光活化提高以及治疗 效力改善。等离子体增强机制也可用于如上所述其他PEPST探针。
图18举例说明了PEPST探针的等离子体增强作用。用于医学诊断成像 的X射线具有约10至150keV的光子能量,其等于1.2至0.0083埃的波长范 围。[λ(埃)=12.4/E(keV)]。软X射线可达10nm。等离子体活性纳米颗粒的 尺寸通常具有为所用辐射波长的级别或更小的尺寸。注意金的近似原子半径 为约0.15纳米。在这一限制下,对于金来说,最小的“纳米颗粒”尺寸是0.14nm (仅仅1个金原子)。数百nm尺寸的纳米颗粒将具有约10
金纳米颗粒还可增强能量调节剂发射的信号,其用于激发PA分子。对 于补骨脂素,该光谱范围处于UVB区域(320-400nm)。已制造了银或金纳 米颗粒、纳米壳和纳米帽,以显示该区域中的强等离子体共振。图19显示 补骨脂素化合物(8-甲氧基补骨脂素)的激发和发射荧光光谱。
具有可分离PA的PEPST能量调节剂-PA探针。
一些光活性药物需要PA分子进入细胞核。图20显示了PEPST探针的 一个实施方案,其中PA药物分子通过接头结合金属纳米颗粒(图20的A), 所述接头可被光子辐射切割(图20的B)。这类探针可用于PA分子不得不 进入细胞核的治疗形式,例如补骨脂素分子需要进入细胞的细胞核并插入到 DNA上(图20的C)。因为金属纳米颗粒比小分子更加难以进入细胞核,所 以优选使用具有可释放PA分子的PEPST探针。
用于连接PA药物分子和金属纳米颗粒的合适接头包括但不限于可被远 程能量激发(来自身体外部,例如MW、IR、光声能、超声能等)断裂的不 稳定化学键,可被细胞内化学环境断裂的不稳定化学键,抗体-抗原,核酸 接头,生物素-链霉亲和素等。
用于双等离子体效应的纳米颗粒链
如上所述,需要开发出可具有双(或多)等离子体共振模式的纳米颗粒 系统。图21举例说明了本发明PEPST探针的一个实施方案,其具有尺寸不 同且彼此相连的金属颗粒链,这可显示出此类基于双等离子体的增强。例如, 较大纳米颗粒(图21,左图)的参数(尺寸、金属类型、结构等)可调节至 NIR、VIS或UV光,而较小颗粒(图21,右图)可调节至X射线。这些颗 粒之间还有偶联效应。
这些纳米颗粒链可用于提供所用入射辐射的等离子体增强(例如,CdS 的X射线活化)以及随后将活化PA的发射辐射的等离子体增强。类似的纳 米颗粒系统已用作纳米透镜[Self-Similar Chain of Metal Nanospheres as an Efficient Nanolens,Kuiru Li,Mark I.Stockman,and David J.Bergman, Physical Review Letter,VOLUME 91,NUMBER22,227402-1,2003]。
药物递送平台
能量调节剂-PA系统的脂质体递送
基于颗粒的药物递送领域目前集中在两种在化学方面不同的胶体微粒, 即脂质体和可生物降解聚合物。两种递送系统都包裹活性药物。就脂质体来 说,随着颗粒的溶解,药物从颗粒中释放,或者对于可生物降解的聚合物, 如所述地崩解。本发明的一个实施方案使用脂质体递送能量调节剂-PA系统 (例如金纳米壳)进行治疗。下文描述了一个示例性实施方案,但是不旨在 限于所述具体脂类、纳米颗粒或其他组分,而是仅用于示例性目的:
药物系统的体内非侵入性切割
在药物系统递送到细胞内后,有时需要使PA系统(例如补骨脂素)处 于细胞核至,以与DNA相互作用。如果PA仍与能量调节剂相连,则两者都 必须被运送进细胞核内。对于金纳米颗粒作为能量调节剂系统的情况,有数 种体外孵育细胞的方法。对于体内应用,可使用化学连接将PA与金纳米颗 粒相连,所述化学连接可使用非侵入性方法例如红外线、微波或超声波释放 (或切断)。连接的实例有通过化学键,或通过生物受体例如抗体。在这种 情况下,PA是与具有靶向PA的抗体的能量调节剂系统结合的抗原分子。
当能量调节剂-Ab-PA进入细胞时,PA分子从能量调节剂Ab系统中释 放。为了将PA分子从抗体中释放,可使用化学试剂切割抗体和抗原之间的 结合,从而再生生物传感器[Vo-Dinh等,1988I。该化学方法简单但在细胞 内部不实用,因为化学物质可能导致细胞变性。在之前的研究中已经证明, 温和但有效的MHz范围的超声能够将抗原分子从抗体能量调节剂系统中释 放[Moreno-Bondi,M.,Mobley,J.,and Vo-Dinh,T.,“RegenerableAntibody-based Biosensor for Breast Cancer,”J.Biomedical Optics,5, 350-354(2000)]。因此,一个替代性实施方案是使用温和的超声辐射(非侵 入性)以将PA(抗原)从能量调节剂系统中的抗体上除去。
在一个优选实施方案中,PA分子通过化学性质不稳定的键与能量调节 剂结合[Jon A.Wolff,and David B.Rozema,Breaking the Bonds:Non-viral Vectors BecomeChemically Dynamic,Molecular Therapy(2007)16(1),8-15]。 改善此方案效力的一种有前途的方法是产生具有化学动态的合成载体 (synthetic vehicle,SV),使得通过在暴露于多种生理环境或外界刺激后切割 化学键来实现递送。该方法的一个实例是使用掩蔽的内体裂解试剂(masked endosomolytic agent,MEA),其改善核酸从内体中的释放,这是转运过程 中的关键步骤。当MEA进入内体的酸性环境时,pH不稳定的键断裂,释放 物质的内体裂解能力。
铁蛋白和去铁铁蛋白用作靶向药物递送的用途
递送能量调节剂-PA药物的另一个实施方案包括使用铁蛋白和去铁铁蛋 白化合物。由于配体-受体介导递送系统的非免疫原性和位点特异性靶向到配 体特异性生物位点的潜力,对它们的兴趣不断增加。已将铂抗癌药物包封在 去铁铁蛋白中[Zhen Yang,Xiaoyong Wang,Huajia Diao,Junfeng Zhang, Hongyan Li,Hongzhe Sun and ZijianGuo,Encapsulation of platinum anticancer drugs by apoferritin,Chem.Commun.33,2007,3453-3455]。铁 蛋白(多种生物体中的主要铁存储分子)也可用作靶向药物递送的载体。其 含有中空的蛋白质壳:去铁铁蛋白,其可含有多达其自身重量的微晶胶束形 式的含水三氧化二铁-磷酸铁(hydrous ferric oxide-phosphate)。铁蛋白的24 个亚基自动组装形成中空蛋白质笼,其内径和外径分别为8和12nm。在亚 基相交处形成约0.4nm的八个亲水通道穿透蛋白质壳并产生蛋白质腔。多种 物质例如钆(Gd
已经报道了用于合成由马脾去铁铁蛋白(horse spleen apoferritin, HSAF)稳定的金纳米颗粒的简单方法,其使用NaBH
铁蛋白和去铁铁蛋白用作增强靶向剂的用途
据报道,铁蛋白可被一些肿瘤组织内化,该内化与膜特异性受体有关[S.Fargion,P.Arosio,A.L.Fracanzoni,V.Cislaghi,S.Levi,A.Cozzi,A Piperno andA.G.Firelli,Blood,1988,71,753-757;P.C.Adams,L.W.Powell and J. W.Halliday,Hepatology,1988,8,719-721]。之前的研究显示,已经在赘生性 细胞中鉴定到铁蛋白结合位点和铁蛋白的胞吞作用[M.S.Bretscher and J. N.Thomson,EMBO J.,1983,2,599-603]。铁蛋白受体具有用于将抗癌药递送 进脑的潜力[S.W.Hulet,S.Powers andJ.R.Connor,J.Neurol.Sci.,1999, 165,48-55]。在一个实施方案中,本发明使用铁蛋白或去铁铁蛋白封装PA 和能量调节剂-PA系统,并且用其选择性靶向肿瘤细胞,用于增强药物递送 和随后的光照治疗。在这种情况下,不需要额外的生物反应器。
图22用示意图说明了封装的光活性剂(图22的A)用于递送进组织和 在封装系统进入细胞后随后释放光活性药物的用途。注意,封装的系统可具 有生物受体,用于选择性肿瘤靶向(图22的B)。一旦进入细胞内,可使用 非侵入性激发(例如超声、RF、微波、IR等)使得包膜的壳(例如脂质体、 去铁铁蛋白等)破裂(图22的C)以释放光活性分子,其可进入细胞核并 且结合DNA(图22的D)。
使用PEPST模式的非侵入性光疗法
图23举例说明了PEPST模式的基本工作原理。PEPST光活性药物分 子通过经口摄入、皮肤施加或通过静脉注射给予患者。PEPST药物在身体内 部经过血流达到被靶向的肿瘤(通过被动或主动靶向策略)。如果疾病的性 质是全身性的,则使用合适波长的光子辐射辐照患者的皮肤,光选择成穿透 到组织内深处(例如NIR或X射线)。对于实体瘤,辐射光源被引导至肿瘤。 随后,可通过将能量递送到肿瘤位点内来引发治疗过程。如上文章节所述,可使用一种或多种光源。治疗的一个实施方案包括使用NIR激光通过聚焦光 学器件发送NIR辐射。也可使用其他辐射类型的聚焦光束,包括但不限于X 射线、微波、无线电波等,这取决于所用的治疗模式。
激发子-等离子体增强光疗法(Exciton-Plasmon Enhanced Phototherapy,EPEP)
激发子诱导光疗法的基本原理
固体材料中的激发子
激发子常定义为固体材料内的“准粒子”。在固体材料(例如半导体、分 子晶体和缀合有机材料)中,合适波长的光激发(例如X射线、UV和可见 光辐射等)可激发电子从价带到导带。通过库仑相互作用,此新形成的导电 电子被吸引到价带中留下的带正电荷的空穴。因此,电子和空穴共同形成称 为激发子的结合状态。(应注意,此中性结合复合物是“准粒子”,其可表现 为玻色子一一具有整数自旋的例子,其服从玻色-爱因斯坦统计学;当玻色子 气体的温度降至某一值以下时,大量玻色子“凝聚”为单量子态—一这是一种 玻色-爱因斯坦凝聚物(BEC)。激发子产生涉及固体材料的X射线激发。在 闪烁体和磷光体的制备中,宽带隙的材料经常用于将X射线转化为紫外/可 见光子[Martin Nikl,Scintillationdetectors for x-rays,Meas.Sci.Technol.17 (2006)R37-R54]。激发子的理论在材料研究以及半导体和其他材料的制造和 应用中是公知的。但是,就本发明人所知,尚未有报道基于激发子可调谐性 用于光疗法的激发子使用和能量调节剂材料的设计。
在初始转化过程中,高能X射线光子与闪烁体材料晶格的多步骤相互作 用通过光电效应和康普顿散射效应发生;对于低于100keV光子能量的X射 线激发,光电效应是主要过程。产生许多激发子(即电子-空穴对)并热分配 在导带(电子)和价带(空穴)中。该第一过程在小于1ps内发生。在随后 的传送过程中,激发子通过材料迁移,其中在缺陷处可发生重复滞留,导致 由于非辐射复合等所致的能量损耗。最后一个阶段(发光)是发光中心处电子空穴对的连续滞留及其辐射复合。电子-空穴对可滞留在缺陷处并且再复 合,产生发光。发光掺杂剂也可用作激发子的陷阱。
激发子陷阱
可使用晶体基质中的杂质产生激发子陷阱。在具有偶极客体分子的含杂 质晶体中,电子陷阱状态可在电子位于杂质分子附近时出现。这些陷阱已在 掺杂咔唑的蒽中观察到。[Kadshchuk,A.K.,Ostapenko,N.I.,Skryshevskii,Yu. A.,Sugakov,V.I.andSusokolova,T.O.,Mol.Cryst.and Liq.Cryst.,201,167 (1991)]。这些陷阱的形成是由于杂质的偶极矩与载荷子的相互作用。当掺杂 物(或杂质)的浓度增加时,光谱由于载体在杂质分子簇上的滞留而显示额 外的光谱结构。有时,杂质和掺杂物是不需要的:电子或激发子也可由于与 被破坏晶体分子的转向偶极矩之间的静电相互作用而陷入这些晶体的结构缺陷中[S.V.Izvekov,Y.I.Sugakov,Exciton and Electron Traps on StructuralDefects in Molecular Crystals with Dipolar Molecules,Physica Scripta.Vol.T66,255-257,1996]。可设计用作激发子陷阱的分子晶体结构缺陷。 GaAs/AlGaAs纳米结构的开发和纳米制造技术的使用可设计出改造的激发 子陷阱,其在材料中具有新型量子机械特性。
EIP探针的设计、制造和操作
图25显示了可设计的EIP探针的多个实施方案:
(A)包含与能量调节剂颗粒结合(通过接头,其可以是固定的或可分 开的)的PA分子的探针,所述能量调节剂颗粒可在合适波长(例如X射线) 的辐射激发下产生激发子。在该优选实施方案中,能量调节剂材料具有用作 激发子陷阱的结构缺陷。
(B)包含与能量调节剂颗粒结合(通过接头,其可以是固定的或可分 开的)的PA分子的探针,所述能量调节剂颗粒可在合适波长(例如X射线) 的辐射激发下产生激发子。在该优选实施方案中,能量调节剂材料具有用作 激发子陷阱的杂质或掺杂物分子。
具有可调谐发射的EIP探针:
探针B的实施方案提供了调谐从X射线激发源到目的波长的能量转换以 激发PA分子的能力。在1976年,D′Silva等证明,冷冻正烷烃固体中掺杂 的多环芳香烃(PAH)分子可被X射线激发,产生发光光谱具有可见光波长 特征的发光。[A.P.D′Silva,G.J.Oestreich,and V.A.Fassel,X-ray excited optical luminescence of polynuclear aromatichydrocarbons,Anal.Chem.; 1976;48(6)pp 915-917]。可调谐EIP探针可设计成含有这些发光掺杂物, 例如高度发光的PAH,其显示适于活化补骨脂素的300-400nm范围内的光 发射。具有可调谐发射的EIP的一个优选实施方案包括掺杂有萘、菲、芘或 其他在300-400nm范围显示发光(荧光)的化合物的固体基材(半导体、玻 璃、石英、共轭聚合物等)。[T.Vo-Dinh,Multicomponent analysis by synchronous luminescence spectrometry,Anal.Chem.;1978;50(3)PP 396- 401]。参见图26。EEC基材可以是半导体材料,优选在目的光波长(激发和 发射)上是透明的。
其他掺杂物例如稀土材料也可用作掺杂物。图27显示掺杂于BaFBr基 材中铕的X射线激发光学发光(X ray excitation optical luminescence,XEOL),发射在370-420nm。美国专利申请公开No.2007/0063154(通过引 用并入本文)描述了这些及其他适于XEOL的纳米复合材料(及其制备方 法)。
图28显示了可设计的EIP探针的多个实施方案:
(A)包含结合在能量调节剂颗粒周围或者嵌入能量调节剂颗粒周围的 壳中的PA分子的探针,所述能量调节剂颗粒可在合适波长(例如X射线) 的辐射激发下产生激发子。在该优选实施方案中,能量调节剂材料具有用作 激发子陷阱的结构缺陷。
(B)包含结合在能量调节剂颗粒周围或者嵌入能量调节剂颗粒周围的 壳中的PA分子的探针,所述能量调节剂颗粒可在合适波长(例如X射线) 的辐射激发下产生激发子。在该优选实施方案中,能量调节剂材料具有用作 激发子陷阱的杂质或掺杂物分子。
激发子-等离子体增强光疗法(EPEP)的原理
近年来,对涉及电子态(激发子)、光子和增强电磁场(等离子体)之 间量子光耦合的先进光物理学概念十分关注。这些涉及激发子和等离子体之 间偶联的概念可用于增强光疗法模式,称为
光物理学中的基本关键概念是从强耦合态的混合物中形成新的准粒子。 这些混合态可具有任一原始颗粒都不具有的不寻常性能。激发子与等离子体 之间的偶联可以是弱的或强的。当光-物质相互作用不能被认为是扰动时,则 系统处于强耦合状态中。Bellesa等显示了表面等离子体(SP)模式与有机激 发子之间发生的强偶联;所用的有机半导体是沉积于银膜上的聚合物基材中 的浓缩花青染料[参考文献:J.Bellessa,*C.Bonnand,and J.C.Plenet,J. Mugnier,Strong Coupling between Surface Plasmonsand Excitons in an Organic Semiconductor,Phys.Rev.Lett,93(3),036404-1,2004]。Govorov等描 述了由半导体和金属纳米颗粒组成的杂合复合物中激发子的光物理特性。各个纳米颗粒之间的相互作用可产生发射的增强或抑制。增强的发射来自于被 等离子体共振放大的电场,而发射抑制是从半导体到金属纳米颗粒的能量传 递的结果。[AlexanderO.Govorov,*,
Fedutik等报道了有关金属-绝缘体-半导体纳米线复合系统的合成和光 学特性,其由湿法化学生长的银丝芯、其周围受控厚度的SiO
用J-聚集体涂覆的Ag纳米颗粒胶体溶液的实验证明,可以使用强散射 截面和增强场用于表面等离子体,从而以极低激发功率从J-聚集体激发子产 生受激发射。[GregoryA.Wurtz,*PaulR.Evans,William Hendren,Ronald Atkinson,Wayne Dickson,RobertJ.Pollard,and Anatoly V.Zayats,Molecular Plasmonics with Tunable Exciton-Plasmon Coupling Strength in J-Aggregate Hybridized Au Nanorod Assemblies,Nano Lett.,Vol.7,No.5,1297,2007]。因 此,它们与表面等离子体激发的结合为产生低功率光学装置提供了特别吸引 人的方法。该过程可导致用于光疗法的高效X射线耦合。另外,J-聚集体与 等离子体结构的偶联表现出对产生混合等离子体-激发子状态的天然内在意义。
EPEP探针的设计、制造和操作
图29显示了显示激发子-等离子体耦合的本发明EPEP探针的多个实施 方案:
(A)包含与能量调节剂颗粒结合(通过接头,其可以是固定的或可分 开的)的PA分子或PA分子组的探针,所述能量调节剂颗粒可在合适波长(例如X射线)的辐射激发下产生激发子。能量调节剂颗粒与涂覆有二氧化 硅纳米壳(或其他介电材料)的金属纳米颗粒结合(或相接近)。二氧化硅 层(或纳米壳)(参见图24的A和图24的B;能量调节剂与金属纳米结构 之间白色的层纳米壳)设计成防止能量调节剂颗粒被X射线激发而发射的光 发生猝灭。金属纳米颗粒(金、银等)设计成诱导等离子体,其增强X射线 激发,随后导致能量调节剂光发射增加,最终增强光活化(即,光疗法)的 效率。纳米颗粒的结构也可设计成使得等离子体效应也增强能量调节剂发射 光。这些过程是由于能量调节剂材料中的激发子与金属纳米颗粒中的等离子 体之间的强耦合;和
(B)包含与能量调节剂颗粒结合(通过接头,其可以是固定的或可分 开的)的PA分子或PA分子组的探针,所述能量调节剂颗粒可在合适波长 (例如X射线)的辐射激发下产生激发子。能量调节剂颗粒通过隔离物(接 头)与金属纳米颗粒结合(或接近)。隔离物设计成防止能量调节剂颗粒被X 射线激发而发射的光发生猝灭。
图30显示了本发明EPEP探针的其他一些实施方案:
(A)包含与能量调节剂颗粒结合(通过接头,其可以是固定的或可分 开的)的PA分子或PA分子组的探针,所述能量调节剂颗粒可在合适波长 (例如X射线)的辐射激发下产生激发子。能量调节剂颗粒覆盖有二氧化硅 (或其他介电材料)纳米壳,所述纳米壳覆盖有分离的金属(金、银)纳米 结构(纳米岛、纳米棒、纳米立方体等)层。二氧化硅层(或其他介电材料) 设计用于防止EEC(也称为能量调节剂)被X射线激发而发射的发光发生 猝灭。金属纳米结构(金、银等)设计用于诱导等离子体,其增强X射线激 发,随后导致能量调节EEC光发射增加,最终增强光活化(即,光疗法) 的效率。纳米颗粒的结构也可设计成使得等离子体效应也增强能量调节剂发 射光。这些过程是由于激发子(能量调节剂材料中的以及金属纳米颗粒中的 等离子体中)之间的强耦合。
(B)包含与能量调节剂颗粒结合(通过接头,其可以是固定的或可分 开的)的颗粒中的PA分子群的探针,所述能量调节剂颗粒可在合适波长(例 如X射线)的辐射激发下产生激发子。含PA的颗粒覆盖有金属纳米结构(金、 银)层。所述金属纳米结构(金、银等)设计用于诱导等离子体,其增强X 射线激发,随后导致能量调节剂光发射增加,最终增强光活化(即,光疗法) 的效率。
(C)包含与能量调节剂颗粒结合(通过接头,其可以是固定的或可分 开的)的PA分子或PA分子组的探针,所述能量调节剂颗粒可在合适波长 (例如X射线)的辐射激发下产生激发子。能量调节剂颗粒覆盖有二氧化硅 (或其他介电材料)纳米壳,所述纳米壳覆盖有金属(金、银)纳米结构层。 二氧化硅层(或其他介电材料)设计用于防止能量调节剂颗粒被X射线激发 而发射的发光发生猝灭。金属纳米结构(金、银等)设计成诱导等离子体, 其增强X射线激发,随后导致能量调节剂光发射增加,最终增强光活化(即, 光疗法)的效率。另外,含PA的颗粒覆盖有金属纳米结构(金、银)层。 金属纳米结构(金、银等)设计用于诱导等离子体,其增强EEC光发射, 最终增强光活化(即,光疗法)的效率。
杂合EPEP纳米超结构
EPEP探针也可包含杂合自组装超结构,其由生物和非生物纳米级组分 形成,其可提供具有多种用于光照治疗的独特电子、表面特性和光谱特性之 光谱的多用分子构建体。
生物聚合物和纳米颗粒可整合进超结构中,其提供了独特的功能,因为 可以利用无机纳米材料的物理特性和聚合物的化学灵活性/特异性。值得注意 的是,将纳米材料中的两种常用激发类型(例如激发子和等离子体)相组合 导致耦合激发的复杂系统。包含构建块的分子构建物可产生具有对于光疗法 领域来说非常重要的光子特性与增强相互作用之组合的EPEP探针,所述构 建块包括金属、半导体纳米颗粒(NP)、纳米棒(NR)或纳米线(NW)。 生物传感领域已有报道组装一些NW纳米结构和NP的一些实例。通过生物 缀合反应制备由CdTe纳米线(NW)和金属纳米颗粒(NP)构成的纳米尺 度的超结构。原型生物分子(例如D-生物素和链霉亲和素对)用于在溶液中 连接NP和NW。发现,金NP在CdTe NW周围形成致密的壳。该超结构显 示出异乎寻常的光学作用,其与半导体和贵金属纳米胶体的远程相互作用有 关。与非缀合NW相比,NW-NP复合物显示发光强度5倍增强以及发射峰 的蓝移。[Jaebeom Lee,
就本发明人所知,这些先进概念尚未应用于光疗法,包含来自NP、NR 和NW之超结构的EPEP探针仍是新的未研究的光疗法领域。
图31显示了包含NP、NW和NR超结构的本发明EPEP探针多个实施 方案。
(A)包含与能量调节剂颗粒结合(通过接头,其可以是固定的或可分 开的)的PA分子或PA分子组的探针,所述能量调节剂颗粒可在合适波长 (例如X射线)的辐射激发下产生激发子。能量调节剂颗粒与覆盖有二氧化 硅(或其他介电材料)纳米壳柱体的金属纳米线(或纳米棒)结合(或接近)。 二氧化硅纳米壳柱体设计用于防止能量调节剂颗粒被X射线激发而发射的 光发生猝灭。金属纳米颗粒(金、银等)设计成诱导等离子体,其增强X射 线激发,随后导致能量调节剂光发射增加,最终增强光活化(即,光疗法) 的效率。纳米颗粒的结构也可设计成使得等离子体效应和/或激发子-等离子 体耦合(EPC)效应也增强能量调节剂发射光。这些过程是由于能量调节剂 材料中的激发子与金属纳米颗粒中的等离子体之间的强耦合;和
(B)包含与能量调节剂颗粒结合(通过接头,其可以是固定的或可分 开的)的PA分子或PA分子组的探针,所述能量调节剂颗粒可在合适波长 (例如X射线)的辐射激发下产生激发子。能量调节剂颗粒通过隔离物(接 头)与金属纳米颗粒结合(或接近)。隔离物设计成防止能量调节剂颗粒被X 射线激发而发射的光发生猝灭。与上文(A)中作用相同。
图32显示本发明EPEP探针的另一组实施方案,其包含NP、NW和 NR的超结构以及生物受体(抗体、DNA、表面细胞受体等)。生物受体用于 靶向肿瘤细胞的用途已在上文针对PEPST探针进行了讨论。注意,在本实 施方案中,PA分子沿NW轴连接,以被来自NW的发射光激发。
图33显示了包含与多个NW连接的NP超结构的本发明EPEP探针的 另一个实施方案。
对于某些实施方案,通过加入设计用于与能量调节剂系统中激发子特异 性相互作用的金属纳米结构,使得产生显著改善:
(1)引入了从激发子到光子的转化的额外放射途径
(2)金属纳米结构可设计成用于放大(由于等离子体效应)激发辐射 (例如X射线)和/或发射辐射(例如UV或可见光),以激发光活性(PA) 分子,由此增强PA效力。
可用于本发明EPEP探针实施方案的多种金属纳米结构与图9中针对 PEPST探针所举例的那些相同。
具有微关振体的EPEP探针
在一个优选实施方案中,能量调节剂系统可设计成也用作具有微米或亚 微米尺寸的微共振体(microresonator)。Lipson等描述了共振微腔,更具体 地为产生光-物质强相互作用的共振微腔[M.Lipson;L.C.Kimerling;Lionel C,Resonant microcavities,USPATENT 6627923,2000]。共振微腔通常在基材 (例如硅)中形成,其具有微米级或分数微米级的尺寸。共振微腔含有光学 活性物质(即发光材料)以及反射体,其将光约束在光学活性物质中。受约 束的光与光学活性物质相互作用,产生光-物质相互作用。微腔中的光-物质相互作用可表征为强或弱。弱相互作用不改变物质的能级,而强相互作用改 变物质的能级。在强光-物质相互作用配置中,可使得受约束的光与这些能级 跃迁共振,从而改变微腔的特性。
纳米颗粒(Ag、Au)的制备
有许多制备用于EPEP或PEPST探针的金属纳米颗粒的方法。制备金 和银胶体的方法包括电爆炸、电沉积、气相凝聚、电化学方法以及溶液相化 学法。尽管制备直径为2-40nm顶多均质尺寸球形胶体金群体的方法是公知 的[N.R.Jana,L.Gearh eart andC.J.Murphy,Seeding growth for size control of 5-40nm diameter goldnanoparticles.Langmuir 17(2001),pp.6782-6786], 并且该尺寸的颗粒是市售的。制备银颗粒群(具有均匀的光散射性能)或金 颗粒群(具有改善的尺寸及形状单分散性控制)的有效化学还原方法是基于 使用小直径的均匀尺寸金颗粒作为进一步生长银或金层的成核中心。
广泛使用的方法包括金盐的柠檬酸还原,产生12-20nm尺寸的金颗粒, 其具有相对狭窄的粒径分布。产生更小金颗粒的常用方法由Brust等开发 [Brust,M.;Walker,M.;Bethell,D.;Schiffrin,D.J.;Whyman,R.Chem. Commun.1994,801]。该方法基于金盐在烷烃硫醇加帽剂存在下的硼氢化物 还原,产生1-3nm的颗粒。可通过改变硫醇浓度而将纳米颗粒尺寸控制在2 至5nm之间,[Hostetler,M.J.;Wingate,J.E.;Zhong,C.J.;Harris,J.E.; Vachet,R.W.;Clark,M.R.;Londono,J.D.;Green,S.J.;Stokes,J.J.;Wignall,G.D.;Glish,G.L.;Porter,M.D.;Evans,N.D.;Murray,R.W.Langmuir 1998, 14,17]。也已产生了膦稳定的金簇,随后通过配基交换转化为硫醇加帽簇, 从而改善了其稳定性[Schmid,G.;Pfeil,R.;Boese,R.;Bandrmann,F.;Meyer, S.;Calis,G.H.M.;van derVelden,J.W.A.Chem.Ber.1981,114,3634;Warner, M.G.;Reed,S.M.;Hutchison,J.E.Chem.Mater.2000,12,3316.],使用与 Brust方法相似的方案制备了膦稳定的单分散金颗粒[Weare,W.W.;Reed,S. M.;Warner,M.G.;Hutchison,J.E.J.Am.Chem.Soc.2000,122,12890]。另外 参见最近的综述:Ziyi Zhong,.Benoit
涂覆染料钠米壳的金属纳米颗粒的制造
涂覆有染料分子纳米壳的金属纳米颗粒的制造可以使用Masuhara等描 述的方法进行[AKITO MASUHARA_,SATOSHI OHHASHIy,HITOSHI KASAI;SHUJI OKADA,FABRICATIONAND OPTICAL PROPERTIES OF NANOCOMPLEXES COMPOSED OF METAL NANOPARTICLES ANDORGANIC DYES,Journal oNonlinear Optical Physics&Materials Vol.13, Nos.3&4(2004)587-592]。通过共沉淀方法制备由作为芯的Ag或Au和作 为壳的3-羧甲基-5-[2-(3-十八基-2-苯并硒唑啉亚基)亚乙基]罗丹宁(MCSe) 或酞菁铜(II)(CuPc)构成的纳米复合物。就Ag-MCSe纳米复合物来说, 将MCSe的0.5mM丙酮溶液注射到10ml Ag纳米颗粒水分散体系中,其通 过使用NaBH
本发明的治疗还可用于诱导对恶性细胞(包括实体肿瘤中的那些)的自 身疫苗作用。要达到全身性治疗可损伤任何快速分裂细胞或干细胞的程度, 则直接刺激直接针对所述肿瘤的能量可能是优选的,这通过避免所述可光活 化剂的光活化或共振能量转移来防止破坏大多数正常的健康细胞或干细胞。
或者,可施加治疗以减缓或暂停有丝分裂。此治疗能够在治疗过程中减 慢快速分裂的健康细胞或干细胞的分裂,而不暂停癌细胞的有丝分裂。或者, 在施用减缓有丝分裂的治疗之前,优先施用封闭剂到恶性细胞。
在一个实施方案中,侵略性细胞增殖病症具有高得多的有丝分裂速率, 这导致在即使是全身性施用治疗期间,恶性细胞也得到并非按比例分配的选 择性破坏。即使暴露于已光活化的药剂,干细胞和健康细胞也可免于大规模 程序化细胞死亡,只要这些已光活化的药剂在结合、有丝分裂或其它机制对 大比例的健康干细胞造成破坏之前从激发态降低至较低能级即可。这样,可 以不诱导自身免疫应答。
或者,可使用封闭剂来选择性地防止或减少对否则将受损的干细胞或健 康细胞的破坏。例如,选择或施用所述封闭剂以使得该封闭剂不会给予恶性 细胞类似的益处。
在一个实施方案中,特异性地靶向干细胞,以对其进行破坏,目的是将 干细胞替换成供体细胞系或之前保存的患者的健康细胞。在这种情况下,不 使用封闭剂。取而代之地,使用特异性靶向干细胞的载体或光敏剂。
光动力学治疗领域的工作表明,造成细胞溶解作用及因此造成细胞死亡 所需的单线态氧的量是0.32×10
在又一个实施方案中,根据本发明的方法还可包括加入添加剂来减轻治 疗副作用。示例性添加剂可包括但不限于:抗氧化剂、辅剂或其组合。在一 个示例性实施方案中,补骨脂素被用作所述可活化药剂,UV-A被用作活化 能,并且加入抗氧化剂来降低不希望的辐照副作用。
本发明方法的一个优点是特异性靶向受细胞增殖病症影响的细胞,例如 快速分裂的细胞,以及原位在这些细胞中触发细胞改变,例如凋亡,所述宿 主的免疫系统可受到刺激而具有针对所述患病细胞的免疫应答。一旦宿主自 身免疫系统被刺激而具有这些应答,其它的未经所述可活化药剂治疗的患病 细胞可被识别,并被宿主自身免疫系统所破坏。可以在例如使用补骨脂素和 UV-A的治疗中获得这些自身疫苗作用。
本发明方法可单独使用或与用于治疗细胞增殖病症的其它疗法联合使 用。另外,如果需要,本发明的方法可以与时间医学(chronomedicine)中 的新进展联合使用,例如Giacchetti等在Journal of Clinical Oncology,24 卷,22期(2006年8月1日):3562-3569页中所述的。在时间医学中已经 发现,患有某些类型病症(例如癌)的细胞在一天中的某些时间比其它时间 有更好的应答。因此,时间医学可与本发明联合使用,以增强本发明治疗的 效果。
在另一个方面中,本发明还提供了用于实施上述方法的系统和试剂盒。
在一个实施方案中,根据本发明的系统可包括:(1)初始能量源;(2) 一种或多种能量调节剂;和(3)一种或多种可活化药剂。
在另一个实施方案中,根据本发明的系统可包括初始能量源以及一种或 多种可活化药剂。
在一些优选实施方案中,所述初始能量源可以是配备有图像指导的计算 机控制能力的线性加速器,以递送精确校准的照射束到预先选择的坐标。这 些线性加速器的一个例子是SmartBeamTM IMRT(强度调节放射疗法)系 统,其来自Varian medical systems(Varian Medical Systems,Inc.,Palo Alto, California)。
在其它一些实施方案中,配备有合适初始能量发射器的内窥镜或腹腔镜 设备可用作初始能量源。在这些系统中,所述初始能量可航行并定位到预先 选择的坐标,以递送所需量的初始能量到该部位。
在另一些实施方案中,剂量计算和机器人控制设备也可包括在所述系统 中。
用于本发明方法和系统的试剂和化学品可包装成试剂盒,以便于实施本 发明。在一个示例性实施方案中,考虑包括补骨脂素和用于简单分级和分离 自身疫苗的分级容器的试剂盒。试剂盒的另一个实施方案将包括至少一种能 够导致预定细胞改变的可活化药剂、至少一种在有能量时能够活化所述至少 一种可活化药剂的能量调节剂、至少一种等离子体剂以及适于以稳定形式存 储所述试剂的容器,优选地还包括施用所述至少一种可活化药剂、至少一种 等离子体剂和至少一种能量调节剂到对象的说明,以及施加来自初始能量源 的初始能量以活化所述可活化药剂的说明。该说明可以是任何期望的形式, 包括但不限于:印刷到试剂盒插页上,印刷到一个或多个容器上,以及在电 子存储介质(例如计算机可读存储介质)上提供的电子化存储的说明。还任 选地包括计算机可读存储介质上的软件包,其允许用户整合信息并计算对照 剂量,从而计算和控制辐照源的强度。
对本发明进行一般性描述后,通过本文中提供的某些具体实施例可获得 进一步理解,所述实施例仅用来说明,并且除非另作说明否则不作为限制。
银纳米颗粒的制备
银(或金)胶体根据标准Lee-Meisel方法制备:在剧烈搅拌下将200ml 10
金属纳米帽的制造/制备
一种方法包括使用旋涂在固体支持物上的纳米球,从而产生和控制所需 粗糙度。随后用银层覆盖纳米结构支持物,银层提供了表面等离子体机制所 需的传导电子。在基于固体支持物的方法中,使用简单纳米材料例如特氟隆 或乳胶纳米球的方法似乎是最易于准备的。多种尺寸的特氟隆和乳胶纳米球 是市售的。这些材料的形状非常规则,它们的尺寸可针对最佳增强进行选择。 这些材料包含分离的介电纳米球(30-nm直径),其上涂覆有产生银的半纳 米壳系统,称为纳米帽。
图24显示300-nm直径聚合物纳米球的扫描电子显微照片(SEM),其 覆盖有100-nm厚的银纳米帽(半纳米壳)层。可以对纳米颗粒进行超声处 理,从而将它们从其下的基材上释放。可容易地研究球尺寸和金属层厚度对 SERS效应的影响。发现银涂覆的纳米球是所研究的最具等离子体活性的之 一。也可使用金代替银来涂覆包含PA药物分子的纳米颗粒。
金纳米壳的制造
金纳米壳已使用Hirsch等所述的方法制备[Hirsch LR,Stafford RJ, BanksonJA,Sershen SR,Price RE,Hazle JD,Halas NJ,West JL(2003) Nanoshell-mediatednear infrared thermal therapy of tumors under MR Guidance.Proc Natl Acad Sci100:13549-13554],其利用成核以及随后在二 氧化硅介电芯周围连续生长金纳米颗粒的机制。如上所述使用Frens方法制 备的种(金纳米颗粒)用于生长金壳。将用于纳米壳芯的二氧化硅纳米颗粒 (100nm)单分散于1%APTES的乙醇溶液中。使用Frens方法合成的的金“种”胶体通过胺基分子连接生长于二氧化硅纳米颗粒表面。“种”覆盖了胺化 二氧化硅纳米颗粒的表面,首先作为不连续的金金属层,逐渐生长形成连续 的金壳。使用光透射分光光度计(UV-Vis Spectrophotometer,Beckman Coulter,Fullerton,CA)和原子力显微镜(Atomic Force Microscope,Veeco Instruments,Woodbury,NY)对用作“种”的金纳米颗粒进行表征,而使用光 透射分光光度计和扫描电子显微镜(Scanning ElectronMicroscope,Hitachi S-4700,Hitachi High Technologies America,Inc.Pleasanton,NY)对金纳米壳 进行表征。
用于测量PDT药物ALA所产生凋亡的探针
已经开发了使用纳米传感器的方法,其可用于评价PEPST探针的有效 性。尽管可使用常规方法(不需要纳米传感器),我们将描述之前开发的纳 米传感器方法[P.M.Kasili,J.M.Song,and T.Vo-Dinh,“Optical Sensor for the Detection ofCaspase-9 Activity ia Single Cell”,
在经典凋亡模型中,根据其功能和活化顺序,胱天蛋白酶分为引发剂胱 天蛋白酶和效应剂胱天蛋白酶。引发剂胱天蛋白酶包括胱天蛋白酶-8、-9, 而效应剂胱天蛋白酶包括胱天蛋白酶-3、-6和-7。胱天蛋白酶活化是凋亡最 早的生物标志物之一,使得胱天蛋白酶是测量凋亡的早期且理想的靶标。凋 亡或者程序化细胞死亡是一种细胞死亡模式,其特征为特定的形态学和生物 化学特征。这些实验所得的结果可用于评价诱导凋亡的光治疗药物(例如 PDT药物)的效力。因为胱天蛋白酶在诱导凋亡中起到重要作用,所以使用 基于四肽的光学纳米传感器来确定其在充分表征的人乳腺癌细胞系MCF-7 中应答于光动力学治疗(Photodynamic Therapy,PDT)剂δd-氨基乙酰丙 酸(ALA)的作用。使MCF-7细胞暴露于光敏剂ALA,从而通过监测胱天 蛋白酶-9和胱天蛋白酶-7活性来研究ALA-PDT诱导的凋亡。在单个活 MCF-7细胞中,使用已知的胱天蛋白酶-9及胱天蛋白酶-7底物亮氨酸-天冬 氨酸-组氨酸-谷氨酸7-氨基-4-甲基香豆素(LEHD-AMC)和天冬氨酸-谷氨 酸-缬氨酸-天冬氨酸7-氨基-4-甲基香豆素(DEVD-AMC)分别评估胱天蛋 白酶-9和胱天蛋白酶-7蛋白酶活性,所述底物共价固定于光学纳米传感器的 纳米尖端。诱导凋亡后,活化的靶胱天蛋白酶识别四肽序列并进行特异性切 割。胱天蛋白酶识别底物之后立即进行切割反应,产生荧光AMC,其可被 氦-镉(HeCd)激光激发产生可测量的荧光信号。通过比较AMC在具有活 化胱天蛋白酶的细胞中以及具有非活化胱天蛋白酶的细胞中所产生的荧光 信号,我们能够成功检测单个活MCF-7细胞内胱天蛋白酶活性。
化学品和试剂
δ-氨基乙酰丙酸(ALA)、磷酸盐缓冲盐水(PBS)、盐酸(HCl)、硝酸 (HNO
细胞系
人乳腺癌细胞系MCF-7获得自美国典型培养物保藏中心(Rockville,MD, USA,Cat-no.HTB22)。MCF-7细胞培养于添加了1mM L-谷氨酰胺(Gibco, Grand Island,NY)和10%胎牛血清(Gibco,Grand Island,NY)的 Dulbecco改良的Eagle培养基((DMEM)(Mediatech,Inc.,Herndon,VA))中。 细胞培养在标准T25组织培养瓶(Corning,Corning,NY)中的生长培养基(如 上所述)中建立。培养瓶在加湿孵箱中37℃、5%CO
基于酶底物的光学纳米感受器的制备
简言之,该过程包括切割和打磨塑料涂覆的二氧化硅(PCS)纤维,其 具有600-pm尺寸的芯(Fiberguide Industries,Stirling,New Jersey)。将纤 维拉至最终尖头直径50nm,然后用~100nm银金属(99.999%纯)使用热 蒸发沉积系统(Cooke VacuumProducts,South Norwalk,CT)涂覆,获得 150nm的最终直径。用酸清洗(HNO
测量系统和方法
用于本工作的实验设置的简图在之前的工作中有述[[P.M.Kasili,J.M. Song,and T.Vo-Dinh,“Optical Sensor for the Detection of Caspase-9 Activity in aSingle Cell”,
胱天蛋白酶活性的体外测定
使用以下处理组孵育后(组(I)-[+]ALA[+]PDT、组(II)-[+]ALA[-]PDT、 组(III)-[-]ALA[+]PDT和组IV-[-]ALA[-]PDT),用PBS溶液pH7.4清洗 MCF-7细胞,然后重悬于裂解缓冲液(100mM HEPES,pH 7.4,10%蔗糖,0.1%3-[(3-胆酰胺丙基)-二甲基氨]-1-丙磺酸(CHAPS),1mM EDTA,10mM 二硫苏糖醇(DTT),1mM苯甲基磺酰氟(PMSF),10mg/ml胃抑素,10mg/ml亮肽素)在冰上放置45分钟。然后,使细胞重复通过带有25号针头 的注射器,直至大部分细胞膜被破坏,以1500rpm离心10分钟。使用荧光 底物肽测定胱天蛋白酶活性;LEHD-AMC用于胱天蛋白酶-9以及 DEVD-AMC用于胱天蛋白酶-7。在将光学纳米传感器在含有来自多个处理 组的细胞裂解物的picofuge离心管中孵育后测量AMC的释放,使用HeCd 激光器(激发325nm)激发AMC。胱天蛋白酶活性表示为分别作为等纳摩 尔LEHD-AMC和DEVD-AMC的函数的AMC荧光强度。
对胱天蛋白酶-9和胱天蛋白酶-7活性的体外测量结果作图。对每个 AMC荧光测量的曲线分别作为AMC浓度函数作图。如下测定胱天蛋白酶-9 活性:将光学纳米传感器与底物LEHD-7-氨基-4-甲基香豆素(AMC)在得 自下列处理组的细胞裂解物中(~10
在本实验中,我们测量了两组细胞I和II:(1)I组用药物ALA处理, 和(2)II组用上文章节所述缀合了PEPST探针的药物ALA处理。通过比 较结果(所检测到的胱天蛋白酶的量),可评价PEPST-ALA药物与单独ALA 相比的效力。
根据上述教导对本发明进行另外的修改和改变是可能的。因此,应理解, 在所附权利要求的范围内,可在本文具体描述之外实施本发明。
以下内容对应于本申请母案的原始权利要求书。
1.用于修饰介导生物活性或与其相关的靶结构的方法,包括:
向需要治疗的对象中的靶结构施加来自至少一个源的初始能量,其中 所述初始能量接触该靶结构,并原位诱导所述靶结构的预定改变,
其中所述预定改变修饰所述靶结构并调节该靶结构的生物活性。
2.根据实施方案1的方法,其中所述初始能量能够完全穿透所述对 象。
3.根据实施方案1的方法,其中所述初始能量由单个源施加。
4.根据实施方案1的方法,其中所述初始能量由超过一个源施加。
5.根据实施方案1的方法,其中所述初始能量产生光,其在有或没 有能量调节剂或光活性剂的情况下诱导靶结构的预定改变。
6.根据实施方案1的方法,其中所述初始能量产生等离子体和/或激 发子耦合增强的光产生,其在有或没有能量调节剂和/或光活性剂的情况 下诱导靶结构的预定改变。
7.根据实施方案1的方法,其还包括向所述对象施用至少一种能量 调节剂,所述能量调节剂将所述初始能量吸收、加强或改变成实现所述靶 结构中预定改变的能量。
8.根据实施方案7的方法,其中所述能量调节剂特异性定位于所述 靶结构周围、所述靶结构上或所述靶结构中。
9.根据实施方案7的方法,其中所述能量调节剂将初始电磁能转化 成光能或引起所述靶结构中预定改变的其他电磁能。
10.根据实施方案9的方法,其中所述能量调节剂降低初始能量的波 长。
11.根据实施方案9的方法,其中所述能量调节剂提高初始能量的波 长。
12.根据实施方案1的方法,其中所述预定改变导致靶结构的破坏、 裂解或失活。
13.根据实施方案1的方法,其中所述预定改变不导致靶结构的破坏 或失活。
14.根据实施方案1的方法,其中所述预定改变增强靶结构的活性。
15.根据实施方案14的方法,其中所增强的活性是来自该靶标的能 量发射,其随后介导、引发或增强第二靶结构或者对象中其他靶结构的生 物活性。
16.根据实施方案1的方法,其中所述靶结构是真核细胞。
17.根据实施方案1的方法,其中所述靶结构是原核细胞。
18.根据实施方案1的方法,其中所述靶结构是亚细胞结构。
19.根据实施方案18的方法,其中所述亚细胞结构是细胞膜、核膜、 细胞核、核酸、线粒体、核糖体或者其他细胞器或组分。
20.根据实施方案1的方法,其中所述靶结构是胞外结构。
21.根据实施方案1的方法,其中所述靶结构是病毒或朊病毒。
22.根据实施方案1的方法,其中所述靶结构是细胞组织。
23.根据实施方案1的方法,其中所述预定改变导致所述对象中状态、 病症或疾病的治疗。
24.根据实施方案23的方法,其中所述状态、病症或疾病是癌症。
25.根据实施方案23的方法,其中所述状态、病症或疾病发生在软 组织和/或软骨中。
26.根据实施方案23的方法,其中所述状态、病症或疾病发生在骨 组织中。
27.根据实施方案23的方法,其中所述状态、病症或疾病是慢性疼 痛。
28.根据实施方案23的方法,其中所述状态、病症或疾病是至少一 种自身免疫病。
29.根据实施方案1的方法,其中所述预定改变包括伤口愈合。
30.根据实施方案1的方法,其中所述预定改变包括组织生长、神经 再生或者感觉再生/恢复的增强。
31.根据实施方案23的方法,其中所述状态、病症或疾病是朊病毒、 病毒、细菌、真菌或寄生虫感染。
32.根据实施方案1的方法,其中所述预定改变包括脂肪沉积的减少 或除去(吸脂术)。
33.根据实施方案23的方法,其中所述状态、病症或疾病的特征在 于静脉曲张。
34.根据实施方案23的方法,其中所述状态、病症或疾病的特征在 于前列腺增大。
35.根据实施方案23的方法,其中所述状态、病症或疾病的特征在 于视网膜损伤及其他眼部疾病。
36.根据实施方案23的方法,其中所述状态、病症或疾病是帕金森 病。
37.根据实施方案23的方法,其中所述状态、病症或疾病的特征在 于行为、知觉和/或认知病症。
38.根据实施方案1的方法,其中所述预定改变包括神经(脑)成像 以及用光对脑细胞活动进行刺激或直接控制。
39.根据实施方案1的方法,其中所述预定改变包括对细胞死亡(凋 亡)的调节。
40.根据实施方案1的方法,其中所述预定改变包括调节细胞生长和 分裂。
41.根据实施方案1的方法,其中所述预定改变包括调节细胞中胞内 组分的活性、量或数目。
42.根据实施方案1的方法,其中所述预定改变包括调节细胞产生的、 细胞分泌的或与细胞相关的胞外组分的活性、量或数目。
43.根据实施方案1的方法,其中所述初始能量是UV辐射、可见光、 IR辐射、X射线、γ射线、电子束、微波或无线电波。
44.根据实施方案7的方法,其中所述初始能量是UV-A、可见光能 或近红外能、X射线、γ射线、电子束、微波或无线电波。
45.根据实施方案1的方法,其中所述初始能量在对象中原位产生。
46.根据实施方案1的方法,其还包括向靶结构施加产热能量源,从 而在靶结构中产生热并增强对预定改变的诱导。
47.根据实施方案46的方法,其中所述产热能量源与初始能量源是 相同的。
48.根据实施方案46的方法,其中所述产热能量源与初始能量源是 彼此不同的。
49.根据实施方案1的方法,其中所述初始能量在到达对象中的靶结 构之前通过原子的纳米颗粒或纳米簇进行加强。
50.根据实施方案7的方法,其中实施初始能量通过原子的纳米颗粒 或纳米簇进行加强并进一步被能量调节剂吸收。
51.根据实施方案1的方法,其中还施加等离子体活性剂,其增强或 调节所施加的初始能量,使得所增强的初始能量在有或没有能量调节剂的 情况下通过该等离子体活性剂导致所述靶结构中的预定改变。
52.根据实施方案7的方法,其中还施加等离子体活性剂,其增强或 调节所施加的初始能量,使得所增强的初始能量被所述能量调节剂吸收、 加强或改变成实现所述靶结构中预定改变的能量。
53.根据实施方案7的方法,其中所述至少一种能量调节剂是选自下 列的一项或多项:生物相容性荧光金属纳米颗粒、荧光金属氧化物纳米颗 粒、用荧光金属涂覆的金属氧化物纳米颗粒、荧光染料分子、金纳米颗粒、 银纳米颗粒、用金涂覆的银纳米颗粒、用聚酰胺-胺树枝状聚合物包封的 水溶性量子点、萤光素酶、生物相容性磷光分子、联合电磁能收获分子以 及显示出强发光的镧系元素螯合物。
54.根据实施方案51的方法,其中所述等离子体活性剂是具有多等 离子体共振模式的PEPST探针。
55.根据实施方案51的方法,其中所述等离子体活性剂是包含等离 子体活性金属纳米结构的PEPST探针。
56.根据实施方案55的方法,其中所述金属纳米结构是纳米球、纳 米棒、纳米立方体、纳米金字塔、纳米壳、多层纳米壳及其组合。
57.根据实施方案51的方法,其中所述等离子体活性剂是具有用于 不同等离子体活化方案之多种结构的PEPST探针。
58.根据实施方案57的方法,其中所述等离子体活化方案是NIR和/ 或X射线。
59.根据实施方案51的方法,其中所述等离子体活性剂是具有激发 子特性的激发子诱导光疗法(EIP)探针。
60.根据实施方案1的方法,其中所述预定改变修饰靶结构并调节靶 结构的生物活性,由此治疗影响靶结构的状态、病症或疾病。
61.根据实施方案7的方法,其中所述至少一种能量调节剂在向对象 施用之前和之后活化,所活化的能量调节剂被触发而发射诱导预定改变的 能量。
62.根据实施方案61的方法,其中所述至少一种能量调节剂是红外 触发的磷光体。
63.用于修饰介导生物活性或与其相关的靶结构的方法,包括:
(1)将所述靶结构与至少一种能够在活化后实现靶结构中预定改变 的可活化药剂(PA)相接触,这任选地在至少一个选自下列的成员存在 下进行:能量调节剂、等离子体活性剂以及其组合;和
(2)从初始能量源向所述靶结构施加初始能量,
-其中如果存在所述能量调节剂,则其使得初始能量升级或降级至能 活化所述至少一种可活化药剂的活化能;
-其中如果存在等离子体活性剂,则其增强或改变所施加的初始能量 或者由能量调节剂产生的活化能,或者以上两者;和
-由此导致靶结构发生预定改变,其中所述预定改变修饰该靶结构并 调节该靶结构的生物活性。
64.根据实施方案63的方法,其中施用步骤包括施用(a)至少一种 可活化药剂和(b)至少一种能量调节剂。
65.根据实施方案64的方法,其中组分(a)和(b)彼此偶联。
66.根据实施方案63的方法,其中施用步骤包括施用(a)至少一种 可活化药剂和(c)至少一种等离子体活性剂。
67.根据实施方案66的方法,其中组分(a)和(c)彼此偶联。
68.根据实施方案63的方法,其中施用步骤包括施用(a)至少一种 可活化药剂,(b)至少一种能量调节剂和(c)至少一种等离子体活性剂, 其中所述至少一种等离子体活性剂包含至少一种金属纳米颗粒。
69.根据实施方案68的方法,其中组分(a)-(c)中至少两种彼此 偶联。
70.根据实施方案68的方法,其中组分(a)-(c)全部彼此偶联。
71.根据实施方案66的方法,其中所述等离子体活性剂是具有多等 离子体共振模式的PEPST探针。
72.根据实施方案66的方法,其中所述等离子体活性剂是包括等离 子体活性金属纳米结构的PEPST探针。
73.根据实施方案72的方法,其中所述金属纳米结构是纳米球、纳 米棒、纳米立方体、纳米金字塔、纳米壳、多层纳米壳及其组合。
74.根据实施方案66的方法,其中所述等离子体活性剂是具有用于 不同等离子体活化方案之多种结构的PEPST探针。
75.根据实施方案74的方法,其中所述等离子体活化方案是NIR和/ 或X射线。
76.根据实施方案66的方法,其中所述等离子体活性剂是PEPST探 针,并且该方法使用具有PA的金属纳米系统。
77.根据实施方案66的方法,其中所述等离子体活性剂是PEPST探 针,并且该方法使用半导体系统与PA的组合。
78.根据实施方案66的方法,其中所述等离子体活性剂是PEPST探 针,并且该方法使用具有PA的XEOL系统。
79.根据实施方案68的方法,其中所述等离子体活性剂是PEPST探 针,并且该方法使用具有能量调节剂和PA的金属纳米系统。
80.根据实施方案68的方法,其中所述等离子体活性剂是PEPST探 针,并且该方法使用半导体系统与能量调节剂和PA的组合。
81.根据实施方案68的方法,其中所述等离子体活性剂是PEPST探 针,并且该方法使用具有能量调节剂和PA的XEOL系统。
82.根据实施方案68的方法,其中所述等离子体活性剂是PEPST探 针,并且该方法使用X射线。
83.根据实施方案68的方法,其中所述等离子体活性剂是PEPST探 针,并且该方法使用X射线。
84.根据实施方案66的方法,其中所述等离子体活性剂是包含等离 子体活性金属纳米结构的PEPST探针,并且该方法使用X射线来激发等 离子体活性金属纳米结构中金属纳米颗粒或亚纳米颗粒的表面等离子体。
85.根据实施方案66的方法,其中所述等离子体活性剂是PEPST探 针,并且该方法使用生物受体。
86.根据实施方案68的方法,其中所述等离子体活性剂是PEPST探 针,并且该方法使用生物受体。
87.根据实施方案68的方法,其中所述等离子体活性剂是PEPST探 针,并且该方法使用具有能量调节剂-PA系统的靶向递送系统。
88.根据实施方案66的方法,其中所述等离子体活性剂是PEPST探 针,并且该方法将等离子体光谱特性、生物相容性、改善的药物有效负荷 递送和金属纳米颗粒的被动靶向相组合。
89.根据实施方案66的方法,其中所述等离子体活性剂是PEPST探 针,并且该方法使用药物递送和光子辐射或超声将PA分子从抗体系统中 释放。
90.根据实施方案66的方法,其中所述等离子体活性剂是PEPST探 针,并且该方法使用脂质体。
91.根据实施方案68的方法,其中所述等离子体活性剂是PEPST探 针,并且该方法使用脂质体。
92.根据实施方案66的方法,其中所述等离子体活性剂是PEPST探 针,并且该方法使用具有PA或者具有能量调节剂和PA的铁蛋白和/或去 铁铁蛋白。
93.根据实施方案68的方法,其中所述等离子体活性剂是PEPST探 针,并且该方法使用具有能量调节剂和PA的铁蛋白和/或去铁铁蛋白。
94.根据实施方案66的方法,其中所述等离子体活性剂是PEPST探 针,并且该方法将超声用于PA释放以及PA的光激发。
95.根据实施方案68的方法,其中所述等离子体活性剂是PEPST探 针,并且该方法将超声用于PA释放以及PA或能量调节剂的光激发。
96.根据实施方案66的方法,其中所述等离子体活性剂是PEPST探 针,并且该方法使用多光子激发来活化所述至少一种可活化药剂。
97.根据实施方案63的方法,其中所述所述至少一种可活化药剂被 多光子激发所活化。
98.根据实施方案66的方法,其中所述等离子体活性剂是PEPST探 针,并且该方法使用药物递送、肿瘤靶向或者药物释放方法。
99.根据实施方案66的方法,其中所述等离子体活性剂是PEPST探 针,所述PEPST探针的组分使用缀合而结合在一起,使金属与有机和无 机化合物和/或生物分子结合。
100.根据实施方案68的方法,其中所述等离子体活性剂是具有激发 子特性的激发子诱导光疗法(EIP)探针。
101.根据实施方案68的方法,其中所述等离子体活性剂是激发子- 等离子体增强光疗法(EPEP)探针,其包含等离子体活性金属纳米结构、 产生激发子的能量调节剂材料、PA组分,所述结构和所述材料产生激发 子-等离子体耦合(EPC)。
102.根据实施方案66的方法,其中所述等离子体活性剂是激发子- 等离子体增强光疗法(EPEP)探针,并且该方法使用半导体系统与PA 的组合。
103.根据实施方案68的方法,其中所述等离子体活性剂是激发子- 等离子体增强光疗法(EPEP)探针,并且该方法使用半导体系统与能量 调节剂和PA的组合。
104.根据实施方案66的方法,其中所述等离子体活性剂是激发子- 等离子体增强光疗法(EPEP)探针,并且该方法使用具有PA的XEOL 系统。
105.根据实施方案68的方法,其中所述等离子体活性剂是激发子- 等离子体增强光疗法(EPEP)探针,并且该方法使用具有能量调节剂和 PA的XEOL系统。
106.根据实施方案66的方法,其中所述等离子体活性剂是激发子- 等离子体增强光疗法(EPEP)探针,并且该方法使用X射线。
107.根据实施方案68的方法,其中所述等离子体活性剂是激发子- 等离子体增强光疗法(EPEP)探针,并且该方法使用X射线。
108.根据实施方案66的方法,其中所述等离子体活性剂是激发子- 等离子体增强光疗法(EPEP)探针,并且该方法使用生物受体。
109.根据实施方案68的方法,其中所述等离子体活性剂是激发子- 等离子体增强光疗法(EPEP)探针,并且该方法使用生物受体。
110.根据实施方案68的方法,其中所述等离子体活性剂是激发子- 等离子体增强光疗法(EPEP)探针,并且该方法使用递送系统以及能量 调节剂和PA。
111.根据实施方案66的方法,其中所述等离子体活性剂是激发子- 等离子体增强光疗法(EPEP)探针,并且该方法将EPC特性、生物相容 性、改善的药物有效负荷递送和金属纳米颗粒的被动靶向组合在一起。
112.根据实施方案66的方法,其中所述等离子体活性剂是激发子- 等离子体增强光疗法(EPEP)探针,并且该方法使用药物递送和光子辐 射或超声将PA分子从抗体系统中释放。
113.根据实施方案68的方法,其中所述等离子体活性剂是激发子- 等离子体增强光疗法(EPEP)探针,并且该方法将EPC特性、生物相容 性、改善的药物有效负荷递送和金属纳米颗粒的被动靶向组合在一起。
114.根据实施方案68的方法,其中所述等离子体活性剂是激发子- 等离子体增强光疗法(EPEP)探针,并且该方法使用药物递送和光子辐 射或超声将PA分子从抗体系统中释放。
115.根据实施方案66的方法,其中所述等离子体活性剂是激发子- 等离子体增强光疗法(EPEP)探针,并且该方法使用脂质体。
116.根据实施方案68的方法,其中所述等离子体活性剂是激发子- 等离子体增强光疗法(EPEP)探针,并且该方法使用脂质体。
117.根据实施方案66的方法,其中所述等离子体活性剂是激发子- 等离子体增强光疗法(EPEP)探针,并且该方法使用具有PA的铁蛋白 和/或去铁铁蛋白。
118.根据实施方案68的方法,其中所述等离子体活性剂是激发子- 等离子体增强光疗法(EPEP)探针,并且该方法使用具有能量调节剂和/ 或PA的铁蛋白和/或去铁铁蛋白。
119.根据实施方案66的方法,其中所述等离子体活性剂是激发子- 等离子体增强光疗法(EPEP)探针,并且该方法将超声用于PA的释放 和光激发。
120.根据实施方案68的方法,其中所述等离子体活性剂是激发子- 等离子体增强光疗法(EPEP)探针,并且该方法将超声用于能量调节剂 和/或PA的释放和光激发。
121.根据实施方案66的方法,其中所述等离子体活性剂是激发子- 等离子体增强光疗法(EPEP)探针,并且该方法将化学不稳定接头用于 PA的释放和光激发。
122.根据实施方案68的方法,其中所述等离子体活性剂是激发子- 等离子体增强光疗法(EPEP)探针,并且该方法将化学不稳定接头用于 能量调节剂和/或PA的释放和光激发。
123.根据实施方案63的方法,其中所述预定改变修饰所述靶结构并 调节该靶结构的生物活性,由此治疗影响靶结构的状态、病症或疾病。
124.根据实施方案123的方法,其中所述状态、病症或疾病由异常 细胞增殖介导,并且所述预定改变可缓解该异常细胞增殖。
125.根据实施方案124的方法,其中所述异常细胞增殖高于不具有 所述状态、病症或疾病的对象中细胞的增殖。
126.根据实施方案124的方法,其中所述所述异常细胞增殖低于不 具有所述状态、病症或疾病的对象中细胞的增殖。
127.根据实施方案123的方法,其中所述状态、病症或疾病不是显 著地由异常细胞增殖介导,所述预定改变不显著改变细胞增殖。
128.根据实施方案63的方法,其中所述初始能量是电磁能、声能或 热能之一。
129.根据实施方案63的方法,其中所述初始能量为X射线、γ射线、 电子束、UV辐射、可见光、红外辐射、微波或无线电波。
130.根据实施方案63的方法,其中所述初始能量能够具有完全穿透 所述对象。
131.根据实施方案63的方法,其中所述初始能量源选自磷光化合物、 化学发光化合物、生物发光化合物和发光的酶。
132.根据实施方案123的方法,其中所述状态、病症或疾病是细胞 增殖病症,其为选自下列的至少一项:癌症、细菌感染、病毒感染、寄生 虫感染、朊病毒感染、真菌感染、免疫排斥应答、自身免疫病、再生障碍 病症及其组合。
133.根据实施方案123的方法,其中所述状态、病症或疾病选自: 心脏消融、光血管成形术状态、内膜增生、动静脉瘘、黄斑变性、银屑病、 粉刺、斑秃、葡萄酒色斑、脱发、自身免疫病、类风湿和炎性关节炎、行 为和认知疾病/病症、关节疾病、帕金森病、视网膜损伤及其他眼部疾病、 前列腺增大、静脉曲张、脂肪沉积物的减少或去除(吸脂术)、神经再生、感觉再生/恢复、伤口愈合、慢性疼痛、骨组织中发生的病症、软组织和/ 或软骨中发生的病症以及淋巴结病症。
134.根据实施方案63的方法,其中所述至少一种可活化药剂是可光 活化药剂。
135.根据实施方案63的方法,其中所述至少一种可活化药剂选自: 补骨脂素类、芘胆甾醇油酸酯、吖啶、卟啉、荧光素、罗丹明、16- diazorcortisone、乙锭、博来霉素的过渡金属络合物、去糖基博来霉素的 过渡金属络合物、有机铂络合物、咯嗪、维生素K类、维生素L、维生 素代谢物、维生素前体、萘醌、萘、萘酚及其具有平面分子构象的衍生物、porphorinporphyrins、染料和吩噻嗪衍生物、香豆素类、喹诺酮类、醌 和蒽醌。
136.根据实施方案135的方法,其中所述至少一种可活化药剂是补 骨脂素、香豆素、卟啉或其衍生物。
137.根据实施方案135的方法,其中所述至少一种可活化药剂是 8-MOP或AMT。
138.根据实施方案63的方法,其中所述至少一种可活化药剂是以下 的一种:7,8-二甲基-10-核糖醇基异咯嗪、7,8,10-三甲基异咯嗪、7,8-二甲 基咯嗪、异咯嗪-腺嘌呤二核苷酸、咯嗪单核苷酸、四磺酸酞菁铝(III)、 血卟啉和酞菁。
139.根据实施方案63的方法,其中所述至少一种可活化药剂与能与 靶结构上或其附近的受体部位结合的载体相偶联。
140.根据实施方案139的方法,其中所述载体是以下的一种胰岛素、 白介素、胸腺生成素或转铁蛋白。
141.根据实施方案139的方法,其中所述至少一种可活化药剂通过 共价键与所述载体相偶联。
142.根据实施方案139的方法,其中所述至少一种可活化药剂通过 非共价键与所述载体相偶联。
143.根据实施方案139的方法,其中所述受体部位选自有核细胞的 核酸、有核细胞的抗原性位点、或表位。
144.根据实施方案63的方法,其中所述至少一种可活化药剂对所述 靶结构具有亲和力。
145.根据实施方案63的方法,其中所述靶结构是靶细胞,并且所述 至少一种可活化药剂能够优先被该靶细胞吸收。
146.根据实施方案63的方法,其中所述靶结构是靶细胞,并且所述 预定改变是该靶细胞的凋亡。
147.根据实施方案63的方法,其中所述至少一种可活化药剂在活化 后在所述对象中造成与所述靶结构反应的自身疫苗作用。
148.根据实施方案63的方法,其中所述至少一种可活化药剂是DNA 插入剂或其卤代衍生物。
149.根据实施方案64的方法,其中所述至少一种能量调节剂是单种 能量调节剂。
150.根据实施方案65的方法,其中所述至少一种能量调节剂是单种 能量调节剂。
151.根据实施方案64的方法,其中所述至少一种能量调节剂是多种 能量调节剂,其中初始能量通过所述多种能量调节剂之间的级联能量传递 被转化成活化所述至少一种可活化药剂的能量。
152.根据实施方案63的方法,其中所述至少一种可活化药剂含有包 含在光笼内的活性剂,其中在暴露于所述初始能量源后,所述光笼与所述 活性剂解离,使得所述活性剂可用。
153.根据实施方案64的方法,其中所述至少一种可活化药剂含有包 含在光笼内的活性剂,其中在暴露于所述至少一种能量调节剂重新发射的 作为所述至少一种可活化药剂之活化能的能量后,所述光笼与所述活性剂 解离,使得所述活性剂可用。
154.根据实施方案63的方法,其中靶结构的所述预定细胞改变通过 导致靶细胞中细胞增殖速率提高或降低来治疗所述细胞增殖病症。
155.根据实施方案64的方法,其中所述初始能量源是除红外能以外 比UV-A、可见光能或近红外能更低的能量源,所述至少一种能量调节剂 将该初始能量转化成UV-A、可见光或近红外能。
156.根据实施方案64的方法,其中如果初始能量是红外能,则活化 所述可活化药剂的能量不是UV或可见光能。
157.根据实施方案64的方法,其中所述至少一种能量调节剂是选自 下列的一项或多项:生物相容性荧光金属纳米颗粒、荧光金属氧化物纳米 颗粒、用荧光金属涂覆的金属氧化物纳米颗粒、荧光染料分子、金纳米颗 粒、银纳米颗粒、用金涂覆的银纳米颗粒、用聚酰胺-胺树枝状聚合物包 封的水溶性量子点、萤光素酶、生物相容性磷光分子、联合电磁能收获分 子以及显示出强发光的镧系元素螯合物。
158.根据实施方案63的方法,其中所述初始能量通过细光纤施加。
159.根据实施方案63的方法,其还包括封闭剂,其中所述封闭剂能 够封闭所述至少一种可活化药剂在其活化之前的吸收。
160.根据实施方案159的方法,其中所述靶结构是靶细胞,并且其 中所述封闭剂减慢非靶标细胞中的有丝分裂,同时允许靶细胞保持异常的 有丝分裂速率。
161.根据实施方案63的方法,其中所施加的初始能量和至少一种可 活化药剂在活化后在对象中产生不足以产生细胞裂解的单线态氧水平。
162.根据实施方案161的方法,其中单线态氧产生的量小于10
163.根据实施方案162的方法,其中单线态氧产生的量小于0.32×10
164.根据实施方案64的方法,其中所述能量调节剂特异性定位于所 述靶结构周围、所述靶结构上或所述靶结构中。
165.根据实施方案63的方法,其中所述预定改变导致所述靶结构的 破坏或失活。
166.根据实施方案63的方法,其中所述预定改变不导致所述靶结构 的破坏或失活。
167.根据实施方案63的方法,其中所述靶结构是真核细胞。
168.根据实施方案63的方法,其中所述靶结构是原核细胞。
169.根据实施方案63的方法,其中所述靶结构是亚细胞结构,例如 细胞膜、线粒体、细胞核或其他细胞器。
170.根据实施方案63的方法,其中所述靶结构是胞外结构。
171.根据实施方案63的方法,其中所述靶结构是病毒或朊病毒。
172.根据实施方案63的方法,其中所述可活化药剂包含光敏蛋白质, 其在暴露于所述初始能量源后调节脑中的信号转导事件。
173.根据实施方案64的方法,其中所述能量调节剂将所施加的初始 能量转化成UV-A或可见光能,其之后原位活化所述可活化药剂。
174.根据实施方案173的方法,其中所述初始能量源是具有比所得 UV-A或可见光能更高之能量的能量源。
175.根据实施方案173的方法,其中所述初始能量源是具有比所得 UV-A或可见光能量更低之能量的能量源。
176.根据实施方案63的方法,其中所述预定改变增强所述靶结构的 表达、促进其生长或者增加其量。
177.根据实施方案63的方法,其中与相似的未处理靶结构相比,所 述预定改变增强、抑制或稳定所述靶结构的通常生物活性。
178.根据实施方案63的方法,其中所述预定改变使所述靶结构的免 疫学或化学特性发生改变。
179.根据实施方案178的方法,其中所述靶结构是化合物,其被所 述预定改变修饰为具有更高或更低的抗原性或免疫原性。
180.根据实施方案68的方法,包括将初始能量施加到所述至少一种 能量调节剂和/或产生激发子的能量调节剂,其将初始能量改变成被至少 一种等离子体活性剂增强的能量。
181.根据实施方案68的方法,其中所述至少一种能量调节剂和/或产 生激发子的能量调节剂改变被等离子体活性剂增强的能量,使得所改变的 能量活化所述可活化药剂。
182.根据实施方案69的方法,包括将初始能量施加到所述至少一种 能量调节剂和/或产生激发子的能量调节剂,其将初始能量改变成被至少 一种等离子体活性剂增强的能量。
183.根据实施方案69的方法,其中所述至少一种能量调节剂和/或产 生激发子的能量调节剂改变被等离子体活性剂增强的能量,使得所改变的 能量活化所述可活化药剂。
184.根据实施方案63的方法,其中所述初始能量源是化学能量源。
185.根据实施方案64的方法,其还包括向对象施用设置成接收和发 送无线电波的纳米管,其中所述初始能量是无线电波,并且其中所述无线 电波被所述至少一种能量调节剂接受并转变成活化所述至少一种可活化 药剂的能量。
186.治疗对象中由靶结构所介导的状态、病症或疾病的方法,其包 括:
a.修饰一个或多个细胞以掺入发射光子的修饰或物质;
b.将经修饰的细胞插入所述对象的靶部位;和
c.施用至少一种可活化药剂,其能够被从所述经修饰细胞发出的光 子所活化,以导致靶结构的预定改变。
187.根据实施方案186的方法,其中所述一个或多个细胞是在所述 修饰前取出的所述对象的自身细胞。
188.根据实施方案186的方法,其中所述发射光子的修饰或物质选 自:发光基因;磷光化合物、化学发光化合物、生物发光化合物和发光的 酶。
189.根据实施方案186的方法,其中所述靶部位是肿瘤。
190.根据实施方案186的方法,其中所述至少一种可活化药剂在活 化后在所述对象中造成与所述靶细胞反应的自身疫苗作用。
191.根据实施方案186的方法,其中所述靶结构的预定改变诱导该 靶细胞的凋亡。
192.一种计算机实施的系统,其包括:
在其上提供有存储介质的中央处理器(CPU);
可激发化合物的数据库;
用于鉴定和设计能够与靶细胞结构或组分结合的可激发化合物的第 一计算模块;和
预测所述可激发化合物的共振吸收能的第二计算模块,
其中,所述系统在选择好靶细胞结构或组分之后计算出能够与所述靶 结构结合的可激发化合物,然后进行计算以预测所述可激发化合物的共振 吸收能。
193.根据实施方案192的计算机实施的系统,其还包括与CPU相连 的能量初始源,其中在计算所述可激发化合物的共振吸收能之后,所述系 统指导所述能量初始源向所述可激发化合物提供所计算的共振吸收能。
194.用于修饰介导生物活性或与其相关的靶结构的试剂盒,包括:
至少一种选自下列的试剂:能量调节剂、等离子体活性剂及其组合;
-其中如果存在所述能量调节剂,则其将初始能量升级或降级成能够 直接或间接地导致靶结构中预定改变的活化能;
-其中如果存在所述表面等离子体活性剂,则其增强或改变所施加的 初始能量或者由能量调节剂所产生的活化能,或者以上两者;和
一个或多个适于以稳定形式存储所述试剂的容器。
195.根据实施方案194的试剂盒,其还包含向对象施用所述至少一 种试剂的说明。
196.根据实施方案194的试剂盒,其中所述至少一种试剂包含至少 一种能量调节剂,其中所述至少一种能量调节剂是选自下列的一项或多 项:生物相容性荧光金属纳米颗粒、荧光金属氧化物纳米颗粒、用荧光金 属涂覆的金属氧化物纳米颗粒、荧光染料分子、金纳米颗粒、银纳米颗粒、 用金涂覆的银纳米颗粒、用聚酰胺-胺树枝状聚合物包封的水溶性量子点、 萤光素酶、生物相容性磷光分子、联合电磁能收获分子以及显示出强发光 的镧系元素螯合物。
197.根据实施方案194的试剂盒,其还包括至少一种可活化药剂。
198.根据实施方案197的试剂盒,其还包括用于向对象施用所述至 少一种可活化药剂和至少一种试剂的说明以及通过施加初始能量来活化 所述至少一种可活化药剂的说明,所述至少一种试剂选自能量调节剂、等 离子体活性剂及其组合。
199.根据实施方案197的试剂盒,其中所述至少一种可活化药剂是 可光活化药剂。
200.根据实施方案197的试剂盒,其中所述至少一种可活化药剂选 自:补骨脂素类、芘胆甾醇油酸酯、吖啶、卟啉、荧光素、罗丹明、16- diazorcortisone、乙锭、博来霉素的过渡金属络合物、去糖基博来霉素的 过渡金属络合物、有机铂络合物、咯嗪、维生素K类、维生素L、维生 素代谢物、维生素前体、萘醌、萘、萘酚及其具有平面分子构象的衍生物、porphorinporphyrins、染料和吩噻嗪衍生物、香豆素类、喹诺酮类、醌 和蒽醌。
201.根据实施方案197的试剂盒,其中所述至少一种可活化药剂是 补骨脂素、香豆素、卟啉或其衍生物。
202.根据实施方案197的试剂盒,其中所述至少一种可活化药剂是 8-MOP或AMT。
203.根据实施方案197的试剂盒,其中所述至少一种可活化药剂是 以下的一种:7,8-二甲基-10-核糖醇基异咯嗪、7,8,10-三甲基异咯嗪、7,8- 二甲基咯嗪、异咯嗪-腺嘌呤二核苷酸、咯嗪单核苷酸、四磺酸酞菁铝(III)、 血卟啉和酞菁。
204.根据实施方案197的试剂盒,其中所述至少一种可活化药剂与 能够与靶结构上或靶结构附近的受体部位结合的载体相偶联。
205.根据实施方案204的试剂盒,其中所述载体是以下的一种:胰 岛素、白介素、胸腺生成素或转铁蛋白。
206.根据实施方案204的试剂盒,其中所述至少一种可活化药剂通 过共价键与所述载体相偶联。
207.根据实施方案204的试剂盒,其中所述至少一种可活化药剂通 过非共价键与所述载体相偶联。
208.根据实施方案204的试剂盒,其中所述受体部位是以下的一种: 有核细胞的核酸、有核细胞的抗原位点或表位。
209.根据实施方案197的试剂盒,其中所述至少一种可活化药剂对 所述靶结构具有亲和力。
210.根据实施方案197的试剂盒,其中所述靶结构是靶细胞,并且 所述至少一种可活化药剂能够优先被该靶细胞吸收。
211.根据实施方案194的试剂盒,其中靶结构是靶细胞,并且所述 预定改变是该靶细胞的凋亡。
212.根据实施方案197的试剂盒,其中所述至少一种可活化药剂在 活化后在所述对象中造成与所述靶结构反应的自身疫苗作用。
213.根据实施方案197的试剂盒,其中所述至少一种可活化药剂是 DNA插入剂或其卤代衍生物。
214.根据实施方案194的试剂盒,其中所述至少一种试剂是至少一 种能量调节剂。
215.根据实施方案214的试剂盒,其中所述至少一种能量调节剂是 单种能量调节剂。
216.根据实施方案214的试剂盒,其中所述至少一种能量调节剂是 多种能量调节剂,其中初始能量通过所述多种能量调节剂之间的级联能量 传递被转化为活化能。
217.根据实施方案197的试剂盒,其中所述至少一种可活化药剂含 有包含在光笼内的活性剂,其中在暴露于初始能量源后,所述光笼与活性 剂解离,使得活性剂可用。
218.根据实施方案197的试剂盒,其中所述至少一种可活化药剂含 有包含在光笼内的活性剂,其中在暴露于所述至少一种能量调节剂再发射 的作为至少一种可活化药剂之活化能的能量之后,所述光笼与活性剂分 离,使得活性剂可用。
219.根据实施方案214的试剂盒,其中所述至少一种能量调节剂是 单种能量调节剂,并与至少一种可活化药剂相偶联。
220.根据实施方案214的试剂盒,其包含多种能量调节剂,其能够 通过所述多种能量调节剂之间的级联能量传递将初始能量转化为活化所 述至少一种可活化药剂的活化能。
221.根据实施方案194的试剂盒,其中所述至少一种试剂是至少一 种等离子体活性剂。
222.根据实施方案194的试剂盒,其中所述至少一种试剂是至少一 种能量调节剂与至少一种等离子体活性剂的组合。
223.根据实施方案221的试剂盒,其中所述至少一种等离子体活性 剂是具有多等离子体共振模式的PEPST探针。
224.根据实施方案221的试剂盒,其中所述等离子体活性剂是包含 等离子体活性金属纳米结构的PEPST探针。
225.根据实施方案224的试剂盒,其中所述金属纳米结构是纳米球、 纳米棒、纳米立方体、纳米金字塔、纳米壳、多层纳米壳及其组合。
226.根据实施方案221的试剂盒,其中所述等离子体活性剂是具有 用于不同等离子体活化方案之多种结构的PEPST探针。
227.根据实施方案226的试剂盒,其中所述等离子体活化方案是NIR 和/或X射线。
228.根据实施方案221的试剂盒,其中所述等离子体活性剂是具有 激发子特性的激发子诱导光疗法(EIP)探针。
229.根据实施方案222的试剂盒,其中所述至少一种等离子体活性 剂是具有多等离子体共振模式的PEPST探针。
230.根据实施方案222的试剂盒,其中所述等离子体活性剂是包含 等离子体活性金属纳米结构的PEPST探针。
231.根据实施方案230的试剂盒,其中所述金属纳米结构是纳米球、 纳米棒、纳米立方体、纳米金字塔、纳米壳、多层纳米壳及其组合。
232.根据实施方案222的试剂盒,其中所述等离子体活性剂是具有 用于不同等离子体活化方案之多种结构的PEPST探针。
233.根据实施方案232的试剂盒,其中所述等离子体活化方案是NIR 和/或X射线。
234.根据实施方案222的试剂盒,其中所述等离子体活性剂是具有 激发子特性的激发子诱导光疗法(EIP)探针。
235.根据实施方案221的试剂盒,其还包含至少一种可活化药剂。
236.根据实施方案222的试剂盒,其还包含至少一种可活化药剂。
237.用于修饰介导生物活性或与其相关的靶结构的药物组合物,其 包含:
选自能量调节剂、等离子体活性剂及其组合的至少一种试剂;和
可药用载体。
238.根据实施方案237的药物组合物,其还包含化学能量源。
239.根据实施方案238的药物组合物,其中所述化学能量源选自磷 光化合物、化学发光化合物、生物发光化合物和发光酶。
240.根据实施方案237的药物组合物,其中所述至少一种试剂包含 至少一种能量调节剂,其中所述至少一种能量调节剂是选自以下的一项或 多项:生物相容性荧光金属纳米颗粒、荧光金属氧化物纳米颗粒、用荧光 金属涂覆的金属氧化物纳米颗粒、荧光染料分子、金纳米颗粒、银纳米颗 粒、用金涂覆的银纳米颗粒、用聚酰胺-胺树枝状聚合物包封的水溶性量 子点、萤光素酶、生物相容性磷光分子、联合电磁能收获分子以及显示出 强发光的镧系元素螯合物。
241.根据实施方案237的药物组合物,其还包含至少一种可活化药 剂。
242.根据实施方案241的药物组合物,其中所述至少一种可活化药 剂是可光活化药剂。
243.根据实施方案241的药物组合物,其中所述至少一种可活化药 剂选自:补骨脂素类、芘胆甾醇油酸酯、吖啶、卟啉、荧光素、罗丹明、 16-diazorcortisone、乙锭、博来霉素的过渡金属络合物、去糖基博来霉 素的过渡金属络合物、有机铂络合物、咯嗪、维生素K类、维生素L、 维生素代谢物、维生素前体、萘醌、萘、萘酚及其具有平面分子构象的衍 生物、porphorinporphyrins、染料和吩噻嗪衍生物、香豆素类、喹诺酮 类、醌和蒽醌。
244.根据实施方案241的药物组合物,其中所述至少一种可活化药 剂是补骨脂素、香豆素、卟啉或其衍生物。
245.根据实施方案241的药物组合物,其中所述至少一种可活化药 剂是8-MOP或AMT。
246.根据实施方案241的药物组合物,其中所述至少一种可活化药 剂是以下的一种:7,8-二甲基-10-核糖醇异咯嗪、7,8,10-三甲基异咯嗪、7,8- 二甲基咯嗪、异咯嗪-腺嘌呤二核苷酸、咯嗪单核苷酸、四磺酸酞菁铝(III)、 血卟啉和酞菁。
247.根据实施方案241的药物组合物,其中所述至少一种可活化药 剂与能够与靶结构上或靶结构附近的受体部位结合的载体相偶联。
248.根据实施方案247的药物组合物,其中所述载体是以下的一种: 胰岛素、白介素、胸腺生成素或转铁蛋白。
249.根据实施方案247的药物组合物,其中所述至少一种可活化药 剂通过共价键与所述载体相偶联。
250.根据实施方案247的药物组合物,其中所述至少一种可活化药 剂通过非共价键与所述载体偶联。
251.根据实施方案247的药物组合物,其中所述受体部位是以下的 一种:有核细胞的核酸、有核细胞的抗原位点或表位。
252.根据实施方案247的药物组合物,其中所述至少一种可活化药 剂对所述靶结构具有亲和力。
253.根据实施方案252的药物组合物,其中所述靶结构是靶细胞, 并且所述至少一种可活化药剂能够优先被该靶细胞所吸收。
254.根据实施方案241的药物组合物,其中所述靶结构是靶细胞, 并且所述预定改变是该靶细胞的凋亡。
255.根据实施方案252的药物组合物,其中所述至少一种可活化药 剂在活化后在所述对象中造成与所述靶结构反应的自身疫苗作用。
256.根据实施方案241的药物组合物,其中所述至少一种可活化药 剂是DNA插入剂或其卤代衍生物。
257.根据实施方案237的药物组合物,其中所述至少一种试剂是至 少一种能量调节剂。
258.根据实施方案257的药物组合物,其中所述至少一种试剂是单 种能量调节剂。
259.根据实施方案257的药物组合物,其中所述至少一种能量调节 剂是多种能量调节剂,其中初始能量通过所述多种能量调节剂之间的级联 能量传递转化为实现靶结构修饰的活化能。
260.根据实施方案241的药物组合物,其中所述至少一种可活化药 剂含有包含在光笼内的活性剂,其中在暴露于初始能量源之后,所述光笼 与活性剂解离,使得活性剂可用。
261.根据实施方案241的药物组合物,其中所述至少一种可活化药 剂含有包含在光笼内的活性剂,其中在暴露于所述至少一种能量调节剂再 发射的作为至少一种可活化药剂之活化能的能量之后,所述光笼与活性剂 解离,使得活性剂可用。
262.根据实施方案257的药物组合物,其中所述至少一种能量调节 剂是单种能量调节剂,并与至少一种可活化药剂相偶联。
263.根据实施方案257的药物组合物,其中所述至少一种能量调节 剂是多种能量调节剂,其能够通过所述多种能量调节剂之间的级联能量传 递将初始能量转化成活化至少一种可活化药剂的活化能。
264.根据实施方案237的药物组合物,其中所述至少一种试剂是等 离子体活性剂。
265.根据实施方案237的药物组合物,其中所述至少一种试剂是至 少一种能量调节剂与至少一种等离子体活性剂的组合。
266.根据实施方案264的药物组合物,其中所述至少一种等离子体 活性剂是具有多等离子体共振模式的PEPST探针。
267.根据实施方案264的药物组合物,其中所述等离子体活性剂是 包括等离子体活性金属纳米结构的PEPST探针。
268.根据实施方案267的药物组合物,其中所述金属纳米结构是纳 米球、纳米棒、纳米立方体、纳米金字塔、纳米壳、多层纳米壳及其组合。
269.根据实施方案264的药物组合物,其中所述等离子体活性剂是 具有用于不同等离子体活化方案之多种结构的PEPST探针。
270.根据实施方案269的药物组合物,其中所述等离子体活化方案 是NIR和/或X射线。
271.根据实施方案264的药物组合物,其中所述等离子体活性剂是 具有激发子特性的激发子诱导光疗法(EIP)探针。
272.根据实施方案265的药物组合物,其中所述至少一种等离子体 活性剂是具有多等离子体共振模式的PEPST探针。
273.根据实施方案265的药物组合物,其中等离子体活性剂是包括 等离子体活性金属纳米结构的PEPST探针。
274.根据实施方案273的药物组合物,其中所述金属纳米结构是纳 米球、纳米棒、纳米立方体、纳米金字塔、纳米壳、多层纳米壳及其组合。
275.根据实施方案265的药物组合物,其中所述等离子体活性剂是 具有用于不同等离子体活化方案之多种结构的PEPST探针。
276.根据实施方案275的药物组合物,其中所述等离子体活化方案 是NIR和/或X射线。
277.根据实施方案265的药物组合物,其中所述等离子体活性剂是 具有激发子特性的激发子诱导光疗法(EIP)探针。
278.根据实施方案264的药物组合物,其还包含至少一种可活化药 剂。
279.根据实施方案237的药物组合物,其还包含至少一种可活化药 剂。
280.根据实施方案279的药物组合物,其中所述至少一种可活化药 剂是可光活化药剂。
281.根据实施方案279的药物组合物,其中所述至少一种可活化药 剂选自:补骨脂素类、芘胆甾醇油酸酯、吖啶、卟啉、荧光素、罗丹明、 16-diazorcortisone、乙锭、博来霉素的过渡金属络合物、去糖基博来霉 素的过渡金属络合物、有机铂络合物、咯嗪、维生素K类、维生素L、 维生素代谢物、维生素前体、萘醌、萘、萘酚及其具有平面分子构象的衍 生物、porphorinporphyrins、染料和吩噻嗪衍生物、香豆素类、喹诺酮 类、醌和蒽醌。
282.根据实施方案279的药物组合物,其中所述至少一种可活化药 剂是补骨脂素、香豆素、卟啉或其衍生物。
283.根据实施方案279的药物组合物,其中所述至少一种可活化药 剂是8-MOP或AMT。
284.根据实施方案279的药物组合物,其中所述至少一种可活化药 剂是以下的一种:7,8-二甲基-10-核糖醇异咯嗪、7,8,10-三甲基异咯嗪、7,8- 二甲基咯嗪、异咯嗪-腺嘌呤二核苷酸、咯嗪单核苷酸、四磺酸酞菁铝(III)、 血卟啉和酞菁。
285.根据实施方案279的药物组合物,其中所述至少一种可活化药 剂与能够与靶结构上或靶结构附近的受体部位结合的载体相偶联。
286.根据实施方案285的药物组合物,其中所述载体是以下的一种: 胰岛素、白介素、胸腺生成素或转铁蛋白。
287.根据实施方案285的药物组合物,其中所述至少一种可活化药 剂通过共价键与所述载体相偶联。
288.根据实施方案285的药物组合物,其中所述至少一种可活化药 剂通过非共价键与所述载体相偶联。
289.根据实施方案285的药物组合物,其中所述受体部位是以下的 一种:有核细胞的核酸、有核细胞的抗原位点或表位。
290.根据实施方案279的药物组合物,其中所述至少一种可活化药 剂对所述靶结构具有亲和力。
291.根据实施方案290的药物组合物,其中所述靶结构是靶细胞, 并且所述至少一种可活化药剂能够优先被该靶细胞吸收。
292.根据实施方案279的药物组合物,其中所述靶结构是靶细胞, 并且所述预定改变是该靶细胞的凋亡。
293.根据实施方案279的药物组合物,其中所述至少一种可活化药 剂在活化后在所述对象中造成与所述靶结构反应的自身疫苗作用。
294.根据实施方案279的药物组合物,其中所述至少一种可活化药 剂是DNA插入剂或其卤代衍生物。
295.根据实施方案279的药物组合物,其中所述至少一种可活化药 剂含有包含在光笼内的活性剂,其中暴露于初始能量源后,所述光笼与活 性剂解离,使得活性剂可用。
296.根据实施方案279的药物组合物,其中所述至少一种可活化药 剂含有包含在光笼内的活性剂,其中在暴露于所述至少一种能量调节剂发 射的作为所述至少一种可活化药剂之活化能的能量之后,所述光笼与活性 剂解离,使得活性剂可用。
297.根据实施方案237的药物组合物,其还包含至少一种具有补充性 治疗或诊断效果的添加剂,其中所述添加剂是选自以下的至少一种:抗氧化 剂、辅剂、化学能量源及其组合。
- 用于原位光生物调节的非侵入性系统和方法
- 用于原位光生物调节的非侵入性系统和方法
