一种具有靶向性的CpG核酸药物递送系统及其制备方法
文献发布时间:2023-06-19 12:22:51
技术领域
本发明涉及一种具有靶向性的CpG核酸药物递送系统及其制备方法,属于生物医药领域。
背景技术
CpG寡核苷酸(以下简称CpG ODN)是一种富含未甲基化胞嘧啶-鸟嘌呤二核苷酸的DNA。未甲基化的CpG基序广泛存在于细菌或病毒的基因组DNA中,且出现频率远远高于脊椎动物,而且脊椎动物中80%的胞嘧啶第5位碳原子是甲基化的,这种显著差异使CpG ODN可以被哺乳动物免疫系统视作“危险信号”而发起免疫应答。CpG ODN能够被免疫细胞的Toll样受体9(以下称TLR9)识别促使细胞分泌各种细胞因子,诱导先天的或者适应性的免疫应答,可作为有效的免疫治疗工具,在抗感染免疫、癌症治疗、过敏性疾病以及免疫佐剂等领域具有重要的应用价值。
由于CpG ODN本质是脱氧核苷酸,具有磷酸二酯键骨架结构,在血液中极易被核酸酶降解,稳定性低;并且在生理环境下寡核苷酸分子所带的负电荷导致细胞摄取的效率低。因此为了提高CpG ODN的稳定性和摄取率,构建药物递送载体将其负载,形成CpG ODN的药物递送系统。近年来,纳米技术的发展为解决核酸药物的递送问题提供了新的工具,已有大量研究报道显示,纳米材料负载的CpG核酸药物表现出高活性、低毒性、生物相容性好等特点不仅能够提高CpG ODN在血清中的稳定性还能提高免疫细胞对CpG ODN药物递送系统的摄取率,有望作为新型免疫治疗制剂应用于相关疾病的预防和治疗中。
酵母β-葡聚糖(Yeastβ-glucan)是以β-1,3-D-葡聚糖为主链,以β-1,6-D-葡聚糖为支链的高分子多糖,主要存在于酵母细胞壁的内层。酵母β-葡聚糖能够通过与其特异性受体Dectin-1结合,刺激免疫细胞,引起一系列免疫反应,刺激免疫系统分泌细胞因子(TNF-α、IL-6、IL-1)等,因此酵母β-葡聚糖酵母是一种具有生物活性的免疫增强剂,具有很强的免疫刺激活性及抗肿瘤活性。基于酵母β-葡聚糖与Dectin-1之间的识别作用,酵母β-葡聚糖可以作为靶向免疫细胞的特殊材料用于构建靶向载药系统,尤其是CpG ODN等具有免疫刺激的核酸药物。酵母β-葡聚糖是天然的多糖纳米载体具有无毒、良好的生物相容性和免疫活性的优点。经过氨基化修饰后,得到氨基化酵母β-葡聚糖作为CpG ODN的靶向载药系统,能显著提高转染效率。
发明内容
本发明通过新奇的合成方法得到较好取代度的氨基化修饰酵母β-葡聚糖,表面富有正电荷的葡聚糖衍生物,载体能够与CpG ODN紧密结合形成50~300nm的复合物。被巨噬细胞膜表面的Dectin-1识别,在RAW264.7细胞中,复合物的细胞摄取率明显提高且几乎超过PEI,并且该材料制备工艺简单、无毒,且具有良好的生物相容性。因此,氨基化葡聚糖衍生物有望成为一种具有靶向性的CpG ODN递送载体,应用于相关疾病的预防和治疗。
本发明的第一个目的是提供一种制备CpG ODN递送系统的方法,所述方法包括如下过程:
(1)通过羟基活化剂活化β-葡聚糖纳米粒子上的羟基,再与含双伯胺的化合物进行反应,得到氨基化β-葡聚糖纳米粒子(NH
(2)利用所得氨基化β-葡聚糖纳米粒子作为载体,配制成分散液,然后与含有CpGODN的溶液混匀,通过静电作用将CpG ODN装载在载体中,获得CpG ODN递送系统。
在本发明的一种实施方式中,所述NaH与β-葡聚糖的质量比为1:5-30。具体可选1:5、1:10、1:20、1:30。
在本发明的一种实施方式中,步骤(1)中所述活化的过程包括:先使用NaH处理β-葡聚糖纳米粒子,然后加入CDI进行活化。
在本发明的一种实施方式中,步骤(1)中所述NaH处理的时间为0.5~1h;温度是室温(20-30℃)。
在本发明的一种实施方式中,步骤(1)中所述CDI进行活化的时间为1~4h;温度是室温(20-30℃)。CDI与β-葡聚糖的质量比为1-5:1。
在本发明的一种实施方式中,步骤(1)中,活化结束后,加入无水乙醇,析出沉淀,离心分离,收集固体,洗涤,干燥。
在本发明的一种实施方式中,步骤(1)中,与含双伯胺的化合物进行反应时的温度为室温(20-30℃);时间为6~12h。
在本发明的一种实施方式中,步骤(1)中,与含双伯胺的化合物进行反应时,含双伯胺的化合物与β-葡聚糖的质量比为20:1~60:1。
在本发明的一种实施方式中,步骤(1)中,反应结束后,进行透析,出去有机溶剂,得到水溶液,然后冻藏、冷冻干燥,得到氨基化葡聚糖纳米粒子载体。
在本发明的一种实施方式中,步骤(2)中,NH
在本发明的一种实施方式中,主要是通过羟基活化剂活化β-葡聚糖上的羟基,再与含双伯胺的化合物反应,得到氨基化β-葡聚糖。与一般方法不同的是,本方法进行羟基活化时先用NaH对β-葡聚糖上的羟基进行拔氢处理,增加了羟基上氧的电负性,生成的氧负离子更易进攻活化剂的羰基碳原子,活化更多β-葡聚糖羟基。
在本发明的一种实施方式中,制备具有靶向性的CpG核酸药物递送系统的方法具体包括:
(1)将溶剂加入CaH
(2)取一定质量的氨基化β-葡聚糖纳米粒子将其溶解于缓冲溶液中,室温条件下,1000~3000rmp搅拌使其充分溶解,可以辅助超声清洗溶解,功率为90W,超声清洗0.5~1h。得到相应浓度的NH
在本发明的一种实施方式中,制备载体所用酵母β-葡聚糖的分子量为5×10
本发明第二个目的是利用上述方法制备提供了一种CpG ODN递送系统。
在本发明的一种实施方式中,所述CpG ODN递送系统中,载体为氨基化酵母β-葡聚糖;载体涉及的酵母β-葡聚糖为天然的多糖纳米结构材料,其纳米粒子直径为20~200nm,具有免疫活性,能够靶向巨噬细胞表面的Detin-1受体。
在本发明的一种实施方式中,所述载体通过创新的合成方法氨基化修饰制得,提高了β-葡聚糖表面的胺基取代度,使其表面带有强正电荷,﹢10~﹢40mV。
基于上述技术方案,本发明具有以下发明作用与效果:
本发明通过新颖的合成方法氨基化修饰酵母β-葡聚糖,得到表面富有正电荷的葡聚糖衍生物,诉述载体可通过静电组装高效负载CpG ODN,与CpG ODN紧密结合形成50~300nm的复合物,更容易被免疫细胞摄取。巨噬细胞表面具有特异性识别葡聚糖的Dectin-1受体,递送系统能靶向巨噬细胞,由Dectin-1受体介导摄取,提高细胞转染效率。该载体能保护CpG ODN不被核酸酶所降解,递送系统的转染效率显著提高,几乎超过PEI,并且该材料制备工艺简单、无毒,且具有良好的生物相容性。因此,氨基葡聚糖有望成为一种新的CpGODN递送载体,用于未来的免疫治疗。
本发明高细胞转染效率、具有靶向性的CpG ODN递送系统,该CpG ODN递送载体低毒、高效且生物相容性好。用于克服CpG ODN易被核酸酶降解的缺点及细胞转染效率低的问题,为实现安全、高效的CpG ODN递送提供新的策略。
附图说明
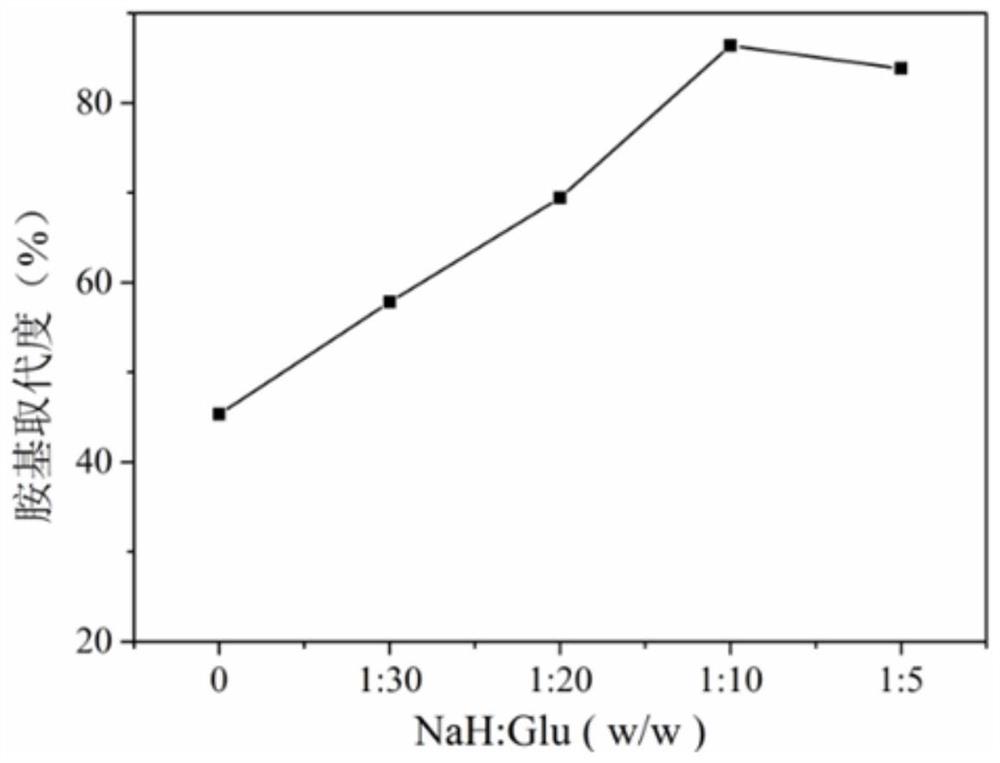
图1为实施例1中按照不同NaH和酵母β-葡聚糖投料比所得氨基化酵母β-葡聚糖胺基取代度图;
图2为实施例1中所得氨基化酵母β-葡聚糖纳米载体在氨基化修饰前后傅里叶红外图;
图3为实施例1中所得氨基酵母β-葡聚糖纳米载体在氨基化修饰前后的电位图以及氨基化后的粒径分布图;
图4为实施例1中所得载体体外细胞毒性实验结果图;
图5为实施例2制备的所诉载体负载CpG ODN的琼脂糖凝胶电泳的滞留效果评价图;
图6为流式细胞术分析由实施例3制得NH
图7为共聚焦观察实施例4制备NH
图8为流式细胞术分析由实施例5制备的NH
具体实施方式
实施例1具有靶向性的CpG核酸药物递送载体的制备:
将二甲基亚砜加入CaH
将取12mLβ-葡聚糖溶液在氮气下室温搅拌,氮气保护下加入纯度为60%的NaH固体,按照NaH:β-葡聚糖的质量比为1:5、1:10、1:20、1:30分别加入NaH,反应0.5~1h。再加入配制好的CDI溶液10mL,在氮气保护下,室温搅拌1~4h后,滴加到120ml的无水乙醇中,析出沉淀,离心分离,再用无水乙醇洗涤6~8次,洗涤完成后自然干燥,再用二甲基亚砜溶解,将溶液滴加到含有10mL的二乙烯三胺和0.5mL三乙胺的混合溶液中,滴加时间不少于1h,继续在室温下反应6~12h,然后透析3~5天,去除有机溶剂,得到纳米载体水溶液,随即-80℃冷藏预冻,再进行冷冻干燥,得到氨基化葡聚糖纳米粒子(NH
用pH滴定法测定取代度(Ds):将20mg NH
式中:Ds:氨基取代度,%;M:酵母β-葡聚糖的摩尔质量,g/mol;C——NaOH溶液的浓度,mol/L;W——NH
表1为实施例1中不同NaH和酵母β-葡聚糖投料比所得氨基化酵母β-葡聚糖胺基取代度
图1为实施例1中按照不同NaH和酵母β-葡聚糖投料比所得氨基化酵母β-葡聚糖胺基取代度图;根据图1所示,加入NaH后能明显增加酵母β-葡聚糖的胺基取代度,且按照NaH:β-葡聚糖投料比为1:10时胺基取代度最高。
图2为实施例1中所得氨基化酵母β-葡聚糖纳米载体在氨基化修饰前后傅里叶红外图;如图2所示,将本实施例中按照NaH:β-葡聚糖投料比为1:10制备的氨基化酵母β-葡聚糖(NH
图3为实施例1中按照NaH:β-葡聚糖投料比为1:10所得氨基化葡聚糖纳米载体在氨基化修饰前后的Zeta电位和粒径图;由图3所示,根据本实施提供的方法制备得到的的氨基化葡聚糖纳米粒径均一,为50~180nm,电位由β-葡聚糖的4~8mV升高至60~80mV,而对比不用NaH拔氢所制得的氨基化β-葡聚糖电位只能达到20~30mV。
图4为实施例1中所得氨基化葡聚糖载体体外细胞毒性实验结果;取实施例1中按照NaH:β-葡聚糖投料比为1:10所得生物氨基化β-葡聚糖纳米载体采用标准的CellCounting Kit-8方法(CCK-8法)测定细胞毒性。本实施例中采用巨噬细胞(RAW264.7)进行细胞毒性检测。用PBS将酵母β-葡聚糖(β-Glucan)、氨基化酵母β-葡聚糖(NH
在96孔板中加入RAW264.7细胞混悬液100μL(1×10
24h后,吸出原来不含样品的培养基向培养板中分别加入100μL不同浓度的待测样品(β-Glucan、NH
实施例2载体负载CpG核酸药物的制备:
取7mg的NH
图5为实施例2制备的所诉载体负载CpG ODN的琼脂糖凝胶电泳的滞留实验
将载体与CpG ODN按照上述不同质量比混合,其中浓度为0.7mg/mL载体溶液的恒定体积为100μL。混合后12000rpm/min高速离心25min,去除上清液游离的CpG ODN,下层即为所得到的NH
由图5所示,根据实施2提供的方法制备的一种具有靶向性的CpG核酸药物的递送系统,利用琼脂糖阻滞实验可知所述载体对CpG ODN具有一定的负载能力,使其被滞留于泳道起始处,从而为实现高效递送CpG核酸药物提供基础。
实施例3
本实施例采用RAW264.7作为宿主细胞评价实施例1中载体的细胞摄取效率,对根据实施例2提供的方法按照质量比为1:10得到NH
按照实施例2中方式分别制备NH
图6为流式细胞术分析由实施例3制得NH
由图6所示,在4h后NH
实施例4
本实施例通过激光共聚焦扫描显微镜观察RAW264.7细胞对制备的NH
按照实施例2中方式制备NH
图7为共聚焦观察实施例四制备细胞对NH
由图7所示,细胞对NH
实施例5
本实施例为本发明提供的具有靶向性的CpG核酸药物递送系统的靶向性验证实验。用具有靶向性的CpG核酸药物的递送系统转染含Dectin-1受体的RAW264.7细胞和不含Dectin-1受体的3T3细胞,用流式检测其平均荧光强度,比较细胞摄取率。
按照实施例2中方式制备NH
图8为流式细胞术分析由实施例四制得NH
由图8所示,在4h后,两种细胞对NH
综上所述,可以归因于以下几点:首先,探索得到β-葡聚糖氨基化程度高的新颖合成方法与反应条件,且该氨基化酵母β-葡聚糖衍生物对于细胞无出现明显的细胞毒性现象,具有较好的生物相容性;其二,通过氨基化修饰后酵母β-葡聚糖纳米粒子表明富有正电荷,可与CpG ODN通过静电组装紧密结合形成50~300nm的复合物,易于细胞摄取。其三,由于葡聚糖受体Dectin-1介导作用巨噬细胞对该递送系统的摄取明显提高。其四,本发明提供的CpG核酸药物递送系统具有靶向巨噬细胞的能力。氨基化酵母β-葡聚糖衍生物由于制备工艺简单、无毒,具有良好的生物相容性,且能够靶向巨噬细胞,有望成为一种新型的靶向递送载体,用于CpG等核酸药物的高效递送,在免疫治疗方面有重要的应用前景。
- 一种具有靶向性的CpG核酸药物递送系统及其制备方法
- 一种脑靶向性的纳米药物递送系统及其制备方法
