针对共生病毒的T细胞导向的抗癌疫苗
文献发布时间:2023-06-19 12:25:57
优先权要求
本申请要求2018年11月28日提交的美国专利申请序列号62/772,443;2019年4月9日提交的序列号62/831,691;以及2019年10月2日提交的序列号62/909,698的权益。前述的全部内容通过引用并入本文。
联邦资助的研究或开发
本发明是由美国国立卫生研究院(National Institutes of Health)授予的授权号OD021353在政府支持下完成的。美国政府享有本发明的某些权利。
技术领域
通过加强针对存在于皮肤上的共生HPV的T细胞免疫来治疗和预防皮肤癌的基于免疫的方法。
背景技术
非黑色素瘤皮肤癌,包括鳞状细胞癌(SCC)和基底细胞癌(BCC),是最常见的癌症类型。
发明内容
免疫抑制增加病毒病因学的癌症的风险。
因此,本文提供了组合物,其包含:(i)多种抗原肽,其各自包含源自来自共生人乳头状瘤病毒的蛋白的9-30个氨基酸的序列,(ii)多种活的或减毒活的共生人乳头状瘤病毒,(iii)来自共生人乳头状瘤病毒的多种抗原蛋白,优选在病毒样颗粒中的,和/或(iv)编码以下的多种核酸:(a)多种抗原肽,其各自包含源自来自共生人乳头状瘤病毒的蛋白的9-30个氨基酸的序列或(b)来自共生人乳头状瘤病毒的多种抗原蛋白;和任选地,增加对抗原肽的T细胞应答的T细胞佐剂。在一些实施方案中,共生人乳头状瘤病毒是低危型α-HPV、β-HPV、γ-HPV、和/或μ-HPV株,例如,共生人乳头状瘤病毒是表A中列出的低危型α-HPV、β-HPV、γ-HPV、和/或μ-HPV株。
在一些实施方案中,多种抗原肽包括源自一种或多种的E1、E2、E4、E5、E6或E7蛋白的肽。
在一些实施方案中,多种抗原肽包括源自来自多种共生人乳头状瘤病毒的蛋白质的肽。
在一些实施方案中,组合物包含至少200种肽,其各自具有独特的序列,例如,包含对于各个独特序列的多种肽。
在一些实施方案中,组合物包含一种或多种工程化以表达多种蛋白或抗原肽的病毒载体,例如,选自由重组逆转录病毒、腺病毒、腺相关病毒、甲病毒和慢病毒组成的组的病毒载体。
在一些实施方案中,T细胞佐剂包含一种或多种的:增强T细胞应答的纳米颗粒;聚-ICLC(羧甲基纤维素、聚肌苷-聚胞苷酸、和聚-L-赖氨酸双链RNA)、咪喹莫特、CpG寡脱氧核苷酸和制剂(IC31、QB10)、AS04(用3-O-脱酰-4′-单磷酰脂质A(MPL)配制的铝盐)、AS01(MPL和皂素QS-21)、MPLA、STING激动剂、其它TLR激动剂、白色念珠菌皮试抗原(Candin)、GM-CSF、Fms样酪氨酸激酶3配体(Flt3L)、和/或IFA(不完全弗氏佐剂)。在一些实施方案中,T细胞佐剂包含局部雷西莫特和/或咪喹莫特和/或局部5-氟尿嘧啶和/或局部卡泊三烯(钙泊三醇),例如,与5-氟尿嘧啶组合。
本文还提供了治疗受试者中皮肤癌或降低皮肤癌的发展风险的方法,所述方法包括向受试者施用有效量的如本文所描述的组合物。另外地,提供了本文所描述的组合物用于治疗受试者的皮肤癌或降低皮肤癌的发展风险的方法的用途。
在一些实施方案中,受试者具有增加的皮肤癌的发展风险或为免疫妥协的,例如,作为衰老或获得性免疫缺陷、原发性免疫缺陷或器官移植的结果。
除非另有定义,本文使用的所有技术和科学术语具有与本发明所属领域的普通技术人员通常所理解的相同的含义。本文描述了用于本发明的方法和材料;也可以使用本领域已知的其它合适的方法和材料。材料、方法和实例仅是说明性的而不旨在进行限制。本文提及的所有出版物、专利申请、专利、序列、数据库条目、和其它参考文献均通过引用整体并入。在有冲突的情况下,以本说明书,包括定义,将占主导。
本发明的其它特征和优点将从以下详细描述和附图、以及从权利要求中显而易见。
附图说明
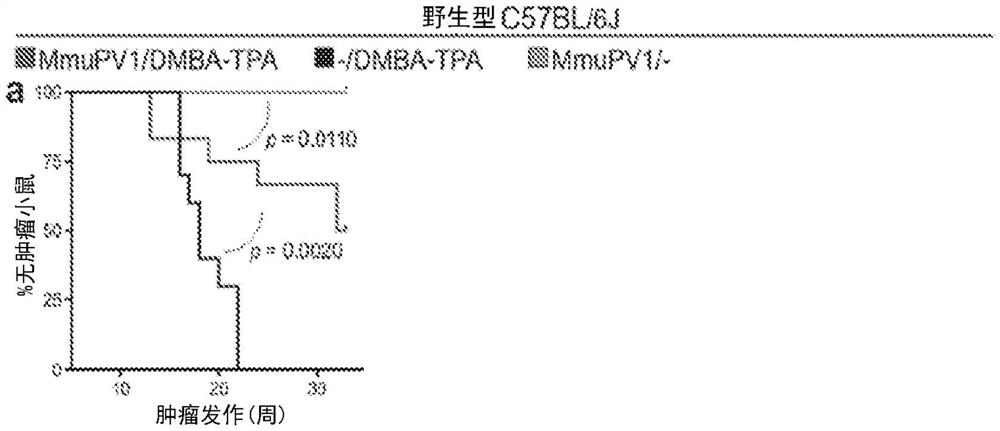
图1A-J:MmuPV1皮肤定植保护动物免于化学皮肤致癌作用。A-C,DMBA-TPA处理的MmuPV1定植野生型(Wt)C57BL/6J小鼠(MmuPV1/DMBA-TPA,n=12)、DMBA-TPA处理的假感染(-/DMBA-TPA,n=10)和MmuPV1定植小鼠(MmuPV1/-,n=10)的皮肤肿瘤结果通过(A)肿瘤潜伏期、(B)每只小鼠随时间的肿瘤计数、和(C)致癌作用方案完成时的肿瘤负荷进行评估。D,显示在MmuPV1感染后立即在其背部皮肤上发展疣的Wt FVB小鼠和具有顽固性疣的亚组的百分比。E,来自MmuPV1定植免疫小鼠的皮肤引流淋巴结的T细胞(试验T细胞)被转移至那些患有顽固性疣的小鼠身上。在过继性T细胞转移后2周记录皮肤疣负荷的变化。对照T细胞代表幼稚T细胞,如未感染的Wt FVB小鼠的脾中所发现的。F-I,将DMBA-TPA处理的MmuPV1定植Wt FVB小鼠(MmuPV1/DMBA-TPA,n=10)中的皮肤肿瘤发展与DMBA-TPA处理的假感染(-/DMBA-TPA,n=10)和MmuPV1定植小鼠(MmuPV1/-,n=10)进行比较。显示(F)肿瘤发作时间、(G)随时间的皮肤肿瘤的数量、(H)研究完成时的肿瘤负荷、以及(I)DMBA-TPA处理的群中小鼠的代表性图像。(J)将在接受来自MmuPV1定植的免疫小鼠的T细胞(e中的试验T细胞;n=3)后排斥它们的皮肤疣的小鼠与由DMBA-TPA处理后的荷疣(wart-bearing)非免疫小鼠(n=3)相比较。注意,非免疫小鼠在DMBA-TPA处理后8周(小鼠4)、15周(小鼠5)和20周(小鼠6)发展浸润性皮肤癌(红色圆圈)。给小鼠剃毛以更好地观察皮肤肿瘤。比例尺:1cm,误差线代表平均值+SD;*p<0.05,**p<0.01,***p<0.0001。
图2A-G:MmuPV1皮肤定植保护免疫活性SKH-1小鼠免于UV致癌作用。A-C,对在其背部皮肤上定植有MmuPV1并且不具有疣(即,免疫)的SKH-1小鼠进行DMBA-UV致癌作用方案。在DMBA-UV处理的MmuPV1定植小鼠(MmuPV1/DMBA-UV,n=10)、DMBA-TPA处理的假感染小鼠(-/DMBA-UV,n=10)和MmuPV1定植小鼠(MmuPV1/-,n=10)之间比较(A)肿瘤发作时间、(B)每只小鼠随时间的肿瘤计数、以及(C)在致癌作用方案的过程中各个小鼠中发展的肿瘤数量。D,显示DMBA-UV处理组中的小鼠的代表性图像(比例尺:1cm)。注意,DMBA-UV诱导的皮肤肿瘤,特别是在-/DMBA-UV群中,与人类的光化性角化病和SCC的相似之处。E,显示致癌作用方案完成时的MmuPV1/DMBA-UV和-/DMBA-UV小鼠皮肤中CD8
图3A-D:β-HPV活性从正常皮肤至皮肤癌的显著下降,并且正常人皮肤中存在β-HPV特异性细胞毒性T细胞表明抗病毒免疫对具有活性HPV的恶性细胞的强大选择压力。A,使用对25种β-HPV类型特异的探针池的β-HPV RNA原位杂交(RNAish)用于检测人皮肤癌中的β-HPV转录本(红点)(表2)。疣作为阳性对照并表现出最大量的β-HPV活性。与疣相关的肥厚性光化性角化病(肉赘中的HAK)是在免疫抑制患者皮肤上发现的β-HPV活性病变的另一实例。显示来自免疫抑制和免疫活性患者的SCC的代表性RNAish染色切片。插图突出了癌症/疣的代表性区域及其邻近的正常皮肤(比例尺:100μm)。B,在收集自免疫抑制患者(n=38)和免疫活性患者(n=32,皮肤癌特征列于表3)的皮肤癌试样中的皮肤癌和邻近正常皮肤的成对样品中量化RNAish信号。C和D,显示分离自人面部皮肤并用于肽刺激检验的激活的CD69
图4A-B.在免疫抑制和免疫活性患者中疣对皮肤癌的不同解剖学分布。A,绘制来自免疫抑制患者的疣和来自免疫抑制和免疫活性患者的皮肤癌的图。注意,免疫活性和免疫抑制患者的皮肤癌定位彼此密切匹配,几乎完全限于皮肤的慢性阳光损伤(CSD)>间歇性阳光损伤(ISD)区域。疣显示远离阳光照射的解剖学偏好。B,显示解剖学分布的图。
图5A-B.背部皮肤上感染有MmuPV1的T细胞缺陷型小鼠表现出融合的疣发展模式。A,在背部/后背皮肤的MmuPV1感染后(感染后10周,比例尺:1cm),将CD4
图6A-C.在MmuPV1感染后,在经活检的Wt动物的背部皮肤的所有皮肤样品中检测到MmuPV1 DNA,表明病毒定植。A,显示在MmuPV1感染当天和感染后21天的C57BL/6J小鼠背部皮肤的代表性图像。显示皮肤所有相应部分中的阳性PCR条带。还显示感染后5周没有皮肤疣迹象的典型C57BL/6J小鼠。B,代表性图像表明感染当天和感染后31天的FVB小鼠的背部皮肤。显示皮肤所有相应部分中的阳性条带。MmuPV1 PCR条带由箭头标记(PCR扩增子大小:339bp)。C,左图,MmuPV1感染当天和感染后21天的野生型C57BL/6J小鼠背部皮肤的代表性图像。中图,背部皮肤的20个区段上的MmuPV1 L1 PCR。MmuPV1 L1 PCR条带由箭头标记;PCR扩增子大小,339bp。PCR引物,正向:GAGCTCTTTGTTACTGTTGTC(SEQ ID NO:1);反向:ATCCTCTCTTTCCTTGGGC(SEQ ID NO:2)。M,分子量大小标记;N,阴性对照;P1-P3,阳性对照。右图,感染后五周的典型野生型C57BL/6J小鼠,强调不存在疣,100%的小鼠都是这种情况。比例尺:1cm。
图7A-C.从Wt MmuPV1定植小鼠转移至T细胞缺陷型小鼠的记忆T细胞减少MmuPV1感染下的疣负荷,但对T细胞受体动物中的SCC细胞系生长没有影响。A,T细胞转移实验示意图。B,显示MmuPV1感染后3周的小鼠背部皮肤上的疣的代表性图像。流式细胞术显示受体小鼠的外周血中存在CD4
图8A-J.在化学致癌作用方案完成后,发现病毒定植和T细胞归巢至MmuPV1感染小鼠的上皮细胞的证据。A和B,MmuPV1 L1 PCR用于检测分离自感染后>6个月的(A)C57BL/6J(B6)和(B)FVB小鼠的皮肤的病毒DNA。C和D,在(C)C57BL/6J和(D)FVB小鼠的DMBA-TPA处理群中评价抗MmuPV1血清转化。(E),在化学致癌作用方案完成时,将来自MmuPV1/DMBA-TPAFVB小鼠的CD3/CD45染色皮肤与假/DMBA-TPA对照比较的代表性图像。箭头表示表皮中的T细胞;虚线强调表皮基底膜。(F),在每小鼠的10张随机选择的正常皮肤的HPF图像中、在MmuPV1/DMBA-TPA和假/DMBA-TPA FVB小鼠皮肤切片中定量CD45+白细胞,并对各组中的小鼠取平均值(双尾未配对t-检验;n=8只每组)。各个点代表一个高倍图像中的白细胞计数。g,h,与野生型FVB小鼠的假/DMBA-TPA对照皮肤相比,T细胞归巢至MmuPV1/DMBA-TPA皮肤中的表皮。(G),CD8/CD3和CD4/CD3染色皮肤切片的代表性图像。箭头表示表皮CD8
图9.在缺乏疣中所见的病毒活性的小鼠中致癌物质诱导的皮肤肿瘤。显示来自MumPV1感染CD4
图S7A-B.MmuPV1感染小鼠的MmuPV1 RNAish在免疫和非免疫小鼠二者中均显示出活性病毒。A,显示感染(免疫)后没有疾病证据的SKH-1小鼠和背部皮肤感染(非免疫)后具有可见疣的小鼠的代表性图像(比例尺:1cm)。B,在MmuPV1感染后3周收获的免疫小鼠和非免疫小鼠皮肤的病毒L2蛋白RNAish在正常皮肤和MmuPV1驱动的疣中显示出丰富的病毒活性。插图强调免疫小鼠正常皮肤和非免疫小鼠疣中的活性病毒的区域(比例尺:100μm)。
图10A-M.由MmuPV1疫苗的MmuPV1感染SKH-1小鼠的免疫保护免受UV驱动的致癌作用。A,上部,感染(免疫)后没有疾病证据的SKH-1小鼠和MmuPV1背部皮肤感染(非免疫)后具有可见疣的小鼠的代表性图像。下部,在感染MmuPV1后三周收集来自免疫小鼠和非免疫小鼠皮肤的MmuPV1 L2RNA ISH以检测正常皮肤和MmuPV1驱动的疣中的病毒活性。插图强调免疫小鼠的正常皮肤和非免疫小鼠的疣中的活性病毒。B,在MmuPV1背部皮肤感染后三个月SKH-1小鼠的宏观图像。用免疫抑制剂量的UVB(300mJ cm-2)处理一次具有对病毒自发免疫(无疣)的SKH-1小鼠;显示UV处理三周后小鼠的图像。箭头指向UV处理的皮肤上新长出的疣。C,疣的组织学图像(圆圈),由H&E和MmuPV1 RNA ISH染色。放大的插图强调H&E图像中MmuPV1诱导的细胞病变变化和疣中汇合的阳性MmuPV1 RNAish信号。D,在MmuPV1疫苗接种前、疫苗接种后4周和UV致癌作用方案完成时持续有疣的MmuPV1感染的SKH-1小鼠的宏观图像(箭头)。在两周内用MmuPV1活病毒颗粒腹膜内处理9只荷疣小鼠三次。四周后,小鼠经受UV致癌作用方案。将具有获得性抗病毒免疫的小鼠(n=5)与具有顽固性疣的非免疫小鼠(n=4)进行比较。E,UV致癌作用方案处理的接种疫苗的免疫(n=5)和非免疫(n=4)小鼠的皮肤肿瘤负荷。在具有融合模式的皮肤肿瘤的小鼠中,计数代表它们合并之前的单个病变。双尾Mann-Whitney U检验;数据是平均值±标准差。F,UV致癌作用方案完成时,来自MmuPV1/DMBA–UV SKH-1小鼠的CD3/CD45染色皮肤与假/DMBA-UV对照比较的代表性图像。箭头指示表皮中的T细胞;虚线强调表皮基底膜。G–I,在每皮肤样本的10张随机选择的HPF图像中、在MmuPV1/DMBA–UV(n=10)和假/DMBA–UV(n=9)SKH-1小鼠的CD3/CD45染色皮肤切片中定量皮肤浸润总CD45+白细胞(G)、CD3+CD45+T细胞(H)和CD3CD45+白细胞,并对各组中的小鼠取平均值。各个点代表一个高倍图像。注意,与假/DMBA-UV对照相比,MmuPV1/DMBA-UV皮肤中T细胞增加和CD3-炎性细胞减少的趋势。J,UV致癌作用方案完成时,MmuPV1/DMBA–UV SKH-1小鼠的皮肤肿瘤中的CD3/CD45染色细胞与假/DMBA-UV对照比较的代表性图像。放大的插图强调肿瘤实质中的免疫细胞。K–M,在各肿瘤的HPF图像中、在MmuPV1/DMBA–UV和假/DMBA–UVSKH-1皮肤肿瘤的CD3/CD45染色切片中定量肿瘤浸润总CD45+白细胞(K)、CD3+CD45+T细胞(L)和CD3-CD45+白细胞(M),并对各组中的小鼠取平均值(n=12个早期皮肤肿瘤每组)。各个点代表一个高倍图像。盲法计数染色细胞。双尾未配对t检验;数据是平均值+s.d.(G–I,K–M)。比例尺,小鼠,1cm(A,B,D);组织,100μm(A,C,F,J)。
图11A-N.需要CD8+T细胞免疫保护MmuPV1定植小鼠免于UV致癌作用,并且MmuPV1定植保护Xpc-/-小鼠免于UV致癌作用。A,UV致癌作用方案完成时,MmuPV1/DMBA–UV SKH-1小鼠的皮肤肿瘤中的CD8+T细胞与假/DMBA–UV对照比较的代表性图像。放大的插图强调肿瘤实质中的T细胞。B-D,在各肿瘤的HPF图像中、在MmuPV1/DMBA–UV和假/DMBA–UV SKH-1小鼠的CD8/CD3和CD4/CD3染色肿瘤切片中定量肿瘤浸润CD3+(B)、CD8+(C)和CD4+(D)T细胞,并对各组中的小鼠取平均值(n=12个早期皮肤肿瘤每组)。各个点代表一个高倍图像。e、f,MmuPV1/DMBA–UV和假/DMBA–UV SKH-1皮肤中的CD4+T细胞浸润物。E,CD4/CD3染色皮肤切片的代表性图像。箭头表示表皮CD4+TRM细胞;虚线强调表皮基底膜,F,每皮肤的高倍图像的CD4+T细胞的定量。包括各组中每小鼠的10张随机选择的皮肤HPF图像。各个点代表一个高倍图像。n=10(MmuPV1/DMBA–UV);n=9(假/DMBA–UV)。双尾未配对t检验;数据是平均值+s.d.(B–D,F)。G,UV致癌作用方案组合的抗CD8或IgG抗体处理结合的示意图。MmuPV1或假(VLP)感染后4周,小鼠开始由抗CD8或IgG同种型对照抗体(箭头)处理。抗体的第一次处理后一天,用50μg DMBA处理一次SKH-1小鼠的背部皮肤(深灰色三角形)。7天后,小鼠开始每周3次UVB治疗(100mJ cm-2)(浅灰色三角形)。H,由抗CD8或IgG抗体处理的MmuPV1/DMBA-UV小鼠的脾和皮肤的流式细胞术分析,以评价由DMBA处理后六周时CD8+T细胞耗竭的效率。在各图上显示CD8+T细胞的百分比。I,用IgG对照(MmuPV1+IgG;n=10)或抗CD8抗体(MmuPV1+抗CD8;n=10)处理的MmuPV1定植小鼠中的皮肤肿瘤负荷,以及DMBA-UV处理后用IgG对照(假(VLP)+IgG;n=7)或抗CD8抗体(假(VLP)+抗CD8;n=7)处理的假(VLP)感染小鼠。双尾Mann-Whitney U检验;*P<0.05,NS,不显著。数据是平均值±s.d.。J,四个处理组中小鼠的代表性图像。由于MmuPV1定植的CD8+T细胞耗竭小鼠中大的皮肤肿瘤,UV致癌作用研究在DMBA处理后18周终止。K、L,在Xpc-/-(XPCKO)小鼠背部皮肤上感染MmuPV1(n=15)或假感染(n=13)并进行UV致癌作用方案。皮肤肿瘤结果显示为第一个皮肤肿瘤的发展时间(K)和第一个浸润性皮肤癌的发展时间(L)(对数秩检验)。注意,研究中的所有Xpc-/-
图S9A-E.未感染的SKH-1小鼠中的DMBA-UV诱导的表皮发育不良在MmuPV1定植动物中被阻断。A,显示MBA-UV致癌作用方案完成后,MmuPV1定植的和未感染的SKH-1皮肤的代表性低和高放大率图像。注意,未感染的SKH-1皮肤中的显著增生和角化不良,这不存在于MmuPV1定植的皮肤中。B,在来自MmuPV1/DMBA-UV和-/DMBA-UV群中的SKH-1小鼠的皮肤的10张随机选择的皮肤图像中定量表皮厚度。C和D,对MmuPV1定植的和未感染的SKH-1皮肤中的CD4
图13.显示人类研究中RNAish和DNAish探针的一般结合位点,使用HPV9基因组作为实例。
图14A-B.经由阳性对照(疣)和对RNAish阳性和阴性人样品进行定量实时PCR(qRT-PCR)验证β-HPV RNAish。A,显示来自63岁免疫抑制女性的疣的H&E和RNAish染色。注意整个疣中丰富的阳性信号(红点)。B,显示来自87岁免疫抑制女性的皮肤癌的β-HPVRNAish,包括阳性和阴性对照探针染色。由RNAish的β-HPV检验与对同一皮肤癌中HPV5和9种E6蛋白转录本的qRT-PCR阳性相关。用β-HPV RNAish探针染色18岁免疫活性的非裔美国女性的正常皮肤。该样品中的RNAish信号(红色)的缺失与在同一样本的qRT-PCR上检测不到的HPV5、9种或15种E6蛋白转录本相关。比例尺:100μm。
图15A-C.与免疫活性患者相比,免疫抑制患者在其皮肤病变中具有更高的β-HPV病毒活性。A,在免疫抑制(n=38)和免疫活性(n=32)患者的皮肤癌细胞之间比较β-HPVRNAish信号计数。B,皮肤癌手术部位的临床图像显示皮肤癌(红色箭头)、邻近的正常皮肤(绿色箭头)和远离癌症部位的正常皮肤(蓝色箭头)。C,图中显示在免疫抑制病变、免疫活性病变和远离癌症部位的正常面部皮肤的高倍图像中的β-HPV RNAish信号的定量。皮肤病变包括来自皮肤癌和邻近正常皮肤图像的β-HPV RNAish信号计数(与癌症图像对应的点以褐红色着色,邻近正常皮肤图像的点为绿色)。本研究包括来自免疫活性患者的30个正常面部皮肤样本(蓝点)(18名男性和12名女性,平均年龄:71,范围:39-94)。*p<0.05,**p<0.005,ns:不显著。
图16A-B.β-HPV病毒活性在免疫抑制患者的基底角质形成细胞中显著增加。A,显示来自免疫抑制和免疫活性患者的β-HPV RNAish染色的正常皮肤样品的代表性低和高放大率图像。注意,免疫抑制患者基底层角质形成细胞中明显的RNAish信号的密度和大小。B,在38个免疫抑制和32个免疫活性皮肤样本中定量基底层角质形成细胞中β-HPV RNAish信号的密度。比例尺:50μm,*p<0.05。
图17.β-HPV DNA原位杂交(DNAish)用于检测皮肤中的β-HPV病毒载量。与标记病毒转录本的β-HPV RNAish相比,β-HPV DNAish是一种以亚细胞分辨率检测皮肤角质形成细胞中病毒载量的新工具。
图18A-C.与免疫活性的患者中的邻近正常皮肤相比,皮肤癌细胞中的β-HPV病毒载量显著下降。A,显示疣、与疣相关的肥厚性光化性角化病(肉赘中的HAK)、和免疫抑制患者的SCC和免疫活性患者的SCC的代表性DNAish。B和C,将来自(B)免疫抑制患者(n=10)和(C)免疫活性患者(n=10)的皮肤癌和邻近正常皮肤的配对样本中的β-HPV DNAish信号的定量显示为图。比例尺:100μm,*p<0.05,**p<0.01。
图19A-D.与免疫活性患者相比,免疫抑制患者中显著更少T和TRM细胞浸润皮肤癌和邻近正常皮肤。A,来自免疫抑制和免疫活性患者的CD3/CD103染色SCC的代表性图像(图3A和图18A中,β-HPV RNA ISH和DNA ISH染色显示相同的癌症)。放大插图强调癌症和邻近正常皮肤中的CD103+TRM细胞。比例尺,100μm。B,C,皮肤癌的CD3/CD8/CD103染色切片用于定量肿瘤浸润CD3+T、CD103+CD3+TRM、CD8+T和CD103+CD8+TRM细胞浸润皮肤癌实质(b)和在免疫抑制(S)对免疫活性(C)患者的邻近正常皮肤中的CD3+T、CD103+CD3+TRM、CD8+T和CD103+CD8+TRM细胞。注意,正常皮肤中的大多数T细胞位于真皮中。在来自各组织试样的10张随机选择的皮肤癌和邻近正常皮肤的HPF图像中的盲法计数染色细胞,并对各组的样品取平均值;包括37个免疫抑制和32个免疫活性皮肤癌样本(皮肤癌特征列于表3)。各个点代表来自各样本的高倍图像中的T细胞计数的平均值。双尾未配对t检验;数据是平均值+s.d.。D,暴露于β-HPV肽后,CD8+T淋巴细胞的细胞毒性脱颗粒。分离自成人的正常面部皮肤的T细胞暴露于β-HPV E7肽(最左)、HPV16 E7肽(左中)、PMA/离子霉素(阳性对照;中右)和培养基(阴性对照;最右)。显示代表性的流式细胞术图。在各图上显示CD107a+CD8+T细胞的百分比。数据表示具有相似结果的两组独立实验。
图20A-F.DAMP分子在疣和皮肤癌的发展过程中上调。A,对获得自MmuPV1诱导的疣(n=4;蓝色三角形)、MmuPV1感染皮肤(n=4;粉红色方块)或假感染皮肤(n=4;灰色圆圈)、和MmuPV1感染肿瘤(n=4;红色方块)或SKH-1小鼠的假感染肿瘤(n=4;黑色圆圈)的基因表达谱进行主成分分析(PCA)。注意,来自MmuPV1感染小鼠的DMBA-UV诱导的皮肤肿瘤与来自假感染小鼠的皮肤肿瘤无法区分,而与MmuPV1驱动的疣相比,两者都具有非常不同的转录谱。B、C,在MmuPV1感染皮肤对假感染皮肤(b;n=4每组)、以及皮肤肿瘤和疣(n=12)对MmuPV1感染皮肤和假感染皮肤(c;n=8)中差异表达基因的火山图。Gm5416也称为Csta3。使用DESeq2 R包(v.2 1.6.3)计算P值,并使用Benjamini-Hochberg方法调整所得P值以控制错误发现率。与MmuPV1和假感染皮肤相比,在皮肤肿瘤和疣中上调的20种基因显示在左表中。D-F,基于小鼠RNA-seq数据分析人类皮肤病变中免疫基因的表达。D,SCC、疣、脂溢性角化病(SK)和未受影响的人类皮肤的代表性宏观和H&E染色组织学图像。比例尺,500μm。E,与正常皮肤(n=8)相比,SCC(n=7)和疣(n=5)中的相对基因表达。F,与几种DAMP基因相比,SCC(n=7)、疣(n=5)和脂溢性角化病(n=5)中的归一化相对基因表达。正常皮肤中的平均相对基因表达用于归一化。GAPDH用作参考基因。双尾Mann-Whitney U检验;**P<0.01,NS,不显著;数据为平均值+s.d.(e,f)。
具体实施方式
在OTR中在超过80%的SCC中发现了人乳头状瘤病毒(HPV),尤其是低危型β(β)属。
本文报告的发现揭示共生HPV在非黑色素瘤皮肤癌发展中的新作用。临床研究表明,免疫抑制对皮肤癌的解剖分布没有影响,其与最大阳光损伤区域密切相关。皮肤癌的明显定位远离间歇性阳光损伤和防晒皮肤,其中包含大部分的HPV驱动的疣,表明共生HPV在免疫抑制患者中不单独引发皮肤癌、也不与UV联合引发皮肤癌。MmuPV1定植模型使得在完整免疫系统的背景下的乳头状瘤病毒与皮肤癌之间的关系的机理研究变得可能。使用该模型,我们显示与其未感染的对应物相比,MmuPV1定植的免疫活性小鼠被保护免于化学和UV诱导的皮肤癌。此外,我们证明针对MmuPV1的T细胞免疫使MmuPV1定植的小鼠被保护免于致癌物诱导的皮肤肿瘤。最后,我们对具有亚细胞分辨率的组织切片上的病毒RNA和DNA检测的创新方法揭示针对β-HPV病毒活性和恶性角质形成细胞中的载量的负选择,因为它们逃脱皮肤中的抗病毒T细胞免疫从而形成癌症。
目前的研究结果支持对低危型共生HPV在皮肤癌发展中的作用的新解释。疣在免疫活性成年人中的极低患病率
皮肤癌和疣的不同解剖分布表明,UV暴露作为免疫抑制患者中皮肤癌风险的主要决定因素。该发现得到了SCC转录组分析的支持,其表明免疫抑制患者和免疫活性患者的SCC中的突变基因的无法区分的模式。
对Wt小鼠中MmuPV1的实验研究证明共生乳头状瘤病毒在免疫活性宿主中针对皮肤癌的保护作用。MmuPV1诱导的疣的抑制已显示是T细胞介导的。
CD8
总之,我们证明了共生HPV通过警报针对皮肤中的任何增殖性病变的细胞毒性免疫来保护皮肤免于癌症的新的有益作用。考虑到皮肤中病毒组的新多样性,
针对β-HPV的基于T细胞的疫苗
当前针对致癌病毒如高危型α型人乳头状瘤病毒(α-HPV)的疫苗被设计成激活B细胞导致抗病毒抗体的产生,从而首先防止靶组织(例如,子宫颈)的病毒感染。然而,我们最近发现共生病毒,其在所有个体出生后不久定植靶组织(例如,皮肤的低危型β型HPV定植)通过诱导能够消除任何含有HPV病毒的增殖性病变的抗病毒T细胞免疫来对致癌物驱动的癌症(例如皮肤癌)起到保护作用。换句话说,在对疣(皮肤上HPV驱动的病变)免疫的成年个体中,HPV感染在皮肤细胞上起到标签的作用,在HPV驱动的疣或致癌物驱动的皮肤癌的背景中,一旦细胞开始异常增殖,它就会警告T细胞。因此,通过T细胞定向疫苗加强T细胞免疫将增强共生病毒的保护作用,而不会消除它们对靶组织的休眠定植。本文描述了可用于诱导针对β-HPV的基于T细胞的免疫应答的组合物,从而降低受试者的皮肤癌的发展风险。疫苗诱导针对已感染组织的共生病毒的T细胞免疫,其目标不是预防或消除感染,而是利用所有细胞中存在的病毒来促进早期癌性克隆的检测和其通过T细胞的消除。当前用于预防宫颈癌和头颈癌的高危型HPV疫苗旨在首先预防感染,并且对已经感染该病毒的个体的疗效微乎其微。
抗原肽
在一些实施方案中,本组合物包含多种抗原肽,其源自来自例如诸如表A中列出的那些株等低危型亲皮肤性α-HPV、β-HPV、γ-HPV和/或μ-HPV株的共生人乳头状瘤病毒的蛋白(即,包含所述蛋白的片段,即来自所述蛋白的连续氨基酸),例如E1、E2、E6或E7蛋白。在一些实施方案中,组合物不包括源自与癌症相关的HPV类型的肽,例如高危型HPV,例如HPV16或18。参见,例如,Ma等人,J Virol.2014年5月;88(9):4786–4797;Doorbar等人,RevMed Virol.2015年3月;25(增刊增刊1):2–23;Doorbar等人,The biology and life-cycleof human papillomaviruses.Vaccine 2012;30(增刊5):F55–F70;de Villiers,Virology2013;445(1–2):2–10;和US8652482,通过引入结合在此。可以使用非“高危型”α-HPV的其它共生HPV类型;表A是示例性但并非详尽的列表。
表A
这些肽可以源自病毒中的任何抗原蛋白;在一些实施方案中,肽源自E1、E2、E4、E5、E6或E7蛋白。提供了许多共生株中这些蛋白的序列。在一些实施方案中,组合物中包括至少50种以上、100、150、200、250、300、350、400、450、500种以上不同的肽(即,具有不同序列的肽)。在一些实施方案中,组合物中包括来自各病毒株的至少50种以上、100、150、200、250、300、350、400、450、500种以上不同的肽,并且包括来自两种以上病毒株的肽。
在一些实施方案中,肽具有针对MHCI/MHCII呈递优化的长度,例如9-30个氨基酸,例如12-25、12-18、12-16、13-16、14-16或15个氨基酸。肽的序列可以是合成的长重叠肽,例如经鉴定的,例如通过生物信息学预测抗原性和/或使用重叠肽的移动窗口覆盖整个蛋白而产生,例如具有10个氨基酸重叠的15个氨基酸肽(类似于用于鉴定最佳反义寡核苷酸的“基因步行(gene walk)”方法)。在一些实施方案中,使用重叠合成长肽(SLP)(Zom等人,Cancer Immunol Res.2014年8月;2(8):756-64)。组合物可包括源自一种以上(例如,多种)不同病毒株的多种肽。肽优选是合成肽;合成肽的方法是本领域已知的,包括溶液-相技术和固相肽合成(SPPS)。参见,例如,Petrou和Sarigiannis,Ch.1-Peptide synthesis:Methods,trends,and challenges,In:Editor(s):Sotirios Koutsopoulos,PeptideApplications in Biomedicine,Biotechnology and Bioengineering,WoodheadPublishing,2018,第1-21页;和Chandrudu等人,Molecules 2013,18,4373-4388。
抗原蛋白
在一些实施方案中,本组合物可包括多种蛋白,例如含有来自例如诸如表A中列出的那些等低危型α-HPV、β-HPV、γ-HPV和/或μ-HPV株等共生人乳头状瘤病毒的E1、E2、E6或E7蛋白的病毒样颗粒(参见,例如,Yang等人,Virus Res 231,148-165(2017);Hancock等人,Therapeutic HPV vaccines.Best Pract Res Clin Obstet Gynaecol 47,59-72(2018年2月);Joh等人,Exp Mol Pathol.;93(3):416-21(2012))。
基于核酸的疫苗
在一些实施方案中,本组合物可包括多种DNA质粒和/或RNA复制子,所述DNA质粒和/或RNA复制子含有表达源自来自例如诸如表A中列出的那些等低危型α-HPV、β-HPV、γ-HPV和/或μ-HPV株等共生人乳头状瘤病毒的例如E1、E2、E6、或E7蛋白等蛋白的蛋白或抗原肽(即,包含所述蛋白的片段,即来自所述蛋白的连续氨基酸)(参见,例如,Yang等人,VirusRes 231,148-165(2017);Hancock等人,Therapeutic HPV vaccines.Best Pract ResClin Obstet Gynaecol 47,59-72(2018))。
基于活载体的疫苗
在一些实施方案中,本组合物可包括多种病毒载体,其被工程化以表达源自来自例如诸如表A中列出的那些等低危型α-HPV、β-HPV、γ-HPV和/或μ-HPV株等共生人乳头状瘤病毒的例如E1、E2、E6或E7蛋白等蛋白的蛋白或抗原肽(即,包含所述蛋白的片段,即来自所述蛋白的连续氨基酸)(参见,例如,Yang等人,Virus Res 231,148-165(2017);Hancock等人,Therapeutic HPV vaccines.Best Pract Res Clin Obstet Gynaecol 47,59-72(2018))。
用于本方法和组合物的病毒载体包括重组逆转录病毒、腺病毒、腺相关病毒、甲病毒、和慢病毒。
用于在本方法中递送核酸的优选病毒载体系统是腺相关病毒(AAV)。AAV是一种具有25nm的衣壳的微小的无包膜病毒。没有疾病是已知的或已被证明与野生型病毒相关。AAV具有单链DNA(ssDNA)基因组。AAV已显示出长期游离型转基因表达,并且AAV已在包括脑的许多组织中,尤其是在神经元中表现出优异的转基因表达。包含仅300个AAV碱基对的载体可被包装并可整合。对于外源DNA的空间被限制在约4.7kb。例如Tratschin等人,Mol.Cell.Biol.5:3251-3260(1985)中描述的AAV载体可用于将DNA引入细胞。已使用AAV载体将多种核酸引入至不同的细胞类型(参见,例如,Hermonat等人,Proc.Natl.Acad.Sci.USA 81:6466-6470(1984);Tratschin等人,Mol.Cell.Biol.4:2072-2081(1985);Wondisford等人,Mol.Endocrinol.2:32-39(1988);Tratschin等人,J.Virol.51:611-619(1984);和Flotte等人,J.Biol.Chem.268:3781-3790(1993)。有许多替代的AAV变体(已克隆超过100种),并且已经基于所需的特征鉴定AAV变体。例如,AAV9已显示可以有效地穿过血脑屏障。此外,AAV衣壳可被基因工程化以提高转导效率和选择性,例如生物素化AAV载体、定向分子进化、自我互补AAV基因组等。在一些实施方案中,使用AAV1。
可选地,逆转录病毒载体和腺相关病毒载体可用作重组基因递送系统,用于体内转移外源基因,特别是转移至人。这些载体提供基因至细胞的有效递送,并且转移的核酸稳定整合至宿主的染色体DNA中。仅产生复制缺陷型逆转录病毒的特化细胞系(称为“包装细胞”)的发展已增加了逆转录病毒在基因治疗中的应用,并且缺陷型逆转录病毒表征为用于基因治疗目的的基因转移(综述参见Miller,Blood 76:271(1990))。复制缺陷型逆转录病毒可被包装至病毒颗粒,通过由标准技术使用辅助病毒,病毒颗粒可用于感染靶细胞。产生重组逆转录病毒和用此类病毒体外或体内感染细胞的方案可见于Ausubel,等人,编辑,Current Protocols in Molecular Biology,Greene Publishing Associates,(1989),第9.10-9.14节和其它标准实验室手册。合适的逆转录病毒的实例包括本领域技术人员已知的pLJ、pZIP、pWE和pEM。用于制备单嗜性(ecotropic)和双嗜性(amphotropic)逆转录病毒系统的合适的包装病毒系的实例包括ΨCrip、ΨCre、Ψ2和ΨAm。逆转录病毒已用于将多种基因体外和/或体内引入包括上皮细胞的许多不同的细胞类型(参见,例如,Eglitis,等人(1985)Science 230:1395-1398;Danos和Mulligan(1988)Proc.Natl.Acad.Sci.USA 85:6460-6464;Wilson等人(1988)Proc.Natl.Acad.Sci.USA 85:3014-3018;Armentano等人(1990)Proc.Natl.Acad.Sci.USA 87:6141-6145;Huber等人(1991)Proc.Natl.Acad.Sci.USA 88:8039-8043;Ferry等人(1991)Proc.Natl.Acad.Sci.USA 88:8377-8381;Chowdhury等人(1991)Science 254:1802-1805;van Beusechem等人(1992)Proc.Natl.Acad.Sci.USA 89:7640-7644;Kay等人(1992)Human Gene Therapy 3:641-647;Dai等人(1992)Proc.Natl.Acad.Sci.USA 89:10892-10895;Hwu等人(1993)J.Immunol.150:4104-4115;美国专利No.4,868,116;美国专利No.4,980,286;PCT申请WO89/07136;PCT申请WO 89/02468;PCT申请WO 89/05345;和PCT申请WO 92/07573)。
用于本方法的另一病毒基因递送系统利用源自腺病毒的载体。可操纵腺病毒的基因组,使其编码和表达感兴趣的基因产物,但就其在正常裂解病毒生命周期中复制的能力而言是失活的。参见,例如,Berkner等人,BioTechniques 6:616(1988);Rosenfeld等人,Science 252:431-434(1991);和Rosenfeld等人,Cell 68:143-155(1992)。源自腺病毒株Ad 5型dl324或其它腺病毒的株(例如Ad2、Ad3或Ad7等)的合适的腺病毒载体是本领域技术人员已知的。重组腺病毒在某些情况下可以是有利的,因为它们不能感染非分裂细胞并且可用于感染包括上皮细胞的多种细胞类型(Rosenfeld等人,(1992)同上)。此外,病毒颗粒相对稳定,易于纯化和浓缩,并且如上所述,可被修饰以影响感染谱(spectrum ofinfectivity)。此外,引入的腺病毒DNA(以及其中包含的外源DNA)不整合至宿主细胞的基因组中,而是保持游离状态,从而避免由于原位插入诱变而发生的潜在问题,其中引入的DNA变得整合至宿主中基因组(例如,逆转录病毒DNA)中。此外,相对于其它基因递送载体,腺病毒基因组对外来DNA的承载能力大(高达8千碱基)(Berkner等人.,同上;Haj-Ahmandand Graham,J.Virol.57:267(1986)。
也可以使用甲病毒。甲病毒是具有广泛的宿主范围的包膜的单链RNA病毒,当用于基因治疗方案时,甲病毒可以提供高水平的瞬时基因表达。示例性甲病毒包括塞姆利基森林病毒(SFV)、辛德毕斯病毒(SIN)和委内瑞拉马脑炎(VEE)病毒,所有这些病毒都已被基因工程化以提供有效的复制缺陷型和具有复制能力型表达载体。甲病毒表现出显著的向神经性,因此可用于治疗CNS相关疾病。参见,例如,Lundstrom,Viruses.2009年6月;1(1):13–25;Lundstrom,Viruses.2014年6月;6(6):2392–2415;Lundstrom,Curr GeneTher.2001May;1(1):19-29;Rayner等人,Rev Med Virol.2002年9月-10月;12(5):279-96。
活共生HPV疫苗策略
活共生HPV疫苗策略可用于优化加强皮肤中的抗病毒T细胞免疫,以防止癌症发展并治疗带有活性病毒的早期SCC,包括光化性角化病、原位SCC和早期浸润性SCC。本文描述了在培养物中产生和扩增活低危型HPV以产生用于患者的活和减毒活HPV疫苗的平台。
目前的预防性癌症疫苗利用由“好”病毒的皮肤广泛定植来预防和治疗皮肤癌。唯一经证实功效的基于T细胞的疫苗策略是用于预防带状疱疹的减毒活水痘带状疱疹病毒疫苗:Zostavax(Sullivan等人,Current opinion in immunology.2019;59:25-30.Epub2019/04/11)。就Zostavax而言,所靶向的病毒,水痘带状疱疹,是水痘和带状疱疹的病因;因此,为了疫苗接种的安全性,必须开发减毒病毒。针对共生HPV的基于T细胞的疫苗策略靶向作为人类正常菌群的低危型乳头状瘤病毒。就此,除了良性皮肤疣外,没有证据表明这些病毒会在成年个体中引起任何严重疾病,并且仅在高度免疫抑制的患者中引起。因此,活共生乳头状瘤病毒疫苗是皮肤癌预防的理想平台,因为它可以有效感染细胞,并且病毒抗原肽可以有效呈递给主要组织相容性复合体(MHC)中的T细胞,同时避免中和抗体。
活HPV疫苗:
体外培养系统可用于扩增亲皮肤性HPV。共生HPV可以使用已知方法获得,例如分离自成年免疫抑制患者的疣。接下来,将纯化的病毒(Kreider等人,Virology.1990;177(1):415-7)转移至使用人原代角质形成细胞(低传代人包皮角质形成细胞(HFK)而不是永生化细胞系(Bienkowska-Haba等人,PLoS Pathog.2018;14(3):e1006846.Epub 2018/03/02;Ozbun等人,Curr Protoc Microbiol.2014;34:14B 3 1-8.Epub 2014/08/02;Anacker等人,Journal of visualized experiments:JoVE.2012(60).Epub 2012/03/08))的器官型筏式培养模型中。通过使用细胞外基质(ECM)-至-细胞感染法解决了将HPV基因组转染至角质形成细胞的困难,因为HPV优先体内和体外结合至基底膜和角质形成细胞分泌的ECM(Richards等人,Viruses.2014;6(12):4856-79)。这涉及将细胞接种至胶原凝胶的表面,然后将该凝胶转移至具有培养基的不锈钢网格上,以产生空气-培养基界面。在培养中扩增共生HPV的可能性使在我们的预防性癌症疫苗中使用活共生HPV变为可能。
减毒活HPV疫苗:
也可以使用减毒活HPV疫苗。低危型共生HPV E6蛋白已显示干扰Notch信号,其驱动角质形成细胞分化和细胞周期停滞(Tan等人,Proceedings of the National Academyof Sciences of the United States of America.2012;109(23):E1473-80.Epub 2012/05/024)。具体地,E6结合至作为Notch转录复合物(Id.)的成员的Mastermind样(MAML1)蛋白的C末端结构域。这允许抑制角质形成细胞的分化并为低危型HPV复制维持有利的细胞环境,从而导致疣的发展。因此,编码共生HPV的E6蛋白的基因在其与MAML-1的LXXLL结构域的结合位点处的突变允许开发安全用于疫苗的减毒活病毒。蛋白E6包含四个锌结合结构域,各个结构域包含两个C-x-x-C基序(Nomine等人,Mol Cell.2006;21(5):665-78.Epub2006/03/02)。具体地,已建议N末端结构域是E6蛋白的结合位点(Id.)。在一些实施方案中,病毒在E6蛋白的氨基末端结构域中包括一个或多个C-x-x-C基序至S-x-x-S基序的突变,以防止结合至MAML-1并抑制人类组织中突变病毒感染后的疣发展。事实上,这些特定的半胱氨酸至丝氨酸的突变抑制了锌离子至锌结合结构域的结合,从而阻碍蛋白的结合能力。
还显示HPV结合如MAML-1等靶蛋白的LXXLL共有序列(Tungteakkhun等人,ArchVirol.2008;153(3):397-408.Epub 2008/01/04)。在一些实施方案中,病毒包括LXXLL结合基序中的突变(参见,例如,Brimer等人,PLoS Pathog.2017Dec;13(12):e1006781),例如,在氨基末端E6锌结合结构域和羧基末端锌结合结构域中(Vande Pol和Klingelhutz,Virology,2013,445(1–2):115-137),或在8S9A10T、I128T、或Δ146–151的一者或多者中(White等人,J Virol.2012年12月;86(24):13174–13186)。
共生HPV临床分离株将按上述方式减毒,使得它们能够完成其整个生命周期,而不会保留其导致疣发展的致病能力。在将HPV临床分离株引入至体外培养系统之前,使用寡核苷酸定向的定点诱变产生减毒突变体。将携带所需突变的寡核苷酸引入克隆到质粒或细菌人工染色体(BAC)中的HPV基因组中,该方法先前已描述过并使用器官型筏式培养模型产生感染性病毒颗粒(Meyers等人,Journal of virology.2002;76(10):4723-33.Epub 2002/04/23)。将重组病毒基因组引入人原代角质形成细胞。转染后,使用支持完整HPV生命周期的器官型培养模型使细胞分化和生长。
T细胞佐剂
组合物还可包括增加T细胞应答的佐剂。例如,可以包括增强T细胞应答的纳米颗粒,例如,如Stano等人,Vaccine(2012)30:7541–6和Swaminathan等人,Vaccine(2016)34:110–9中所述。另见Panagioti等人,Front.Immunol.,2018年2月16日;doi.org/10.3389/fimmu.2018.00276。可选地或另外地,也可以使用包含聚-ICLC(羧甲基纤维素、聚肌苷-聚胞苷酸和聚-L-赖氨酸双链RNA)、咪喹莫特、雷西莫特(R-848)、CpG寡脱氧核苷酸和制剂(IC31、QB10)、AS04(由3-O-脱酰-4′-单磷酰脂质A(MPL)配制的铝盐)、AS01(MPL和皂素QS-21)、MPLA、STING激动剂、其它TLR激动剂、白色念珠菌皮试抗原(Candin)、GM-CSF、Fms样酪氨酸激酶3配体(Flt3L)、和/或IFA(不完全弗氏佐剂)的佐剂。在一些实施方案中,局部咪喹莫特和/或局部5-氟尿嘧啶和/或局部卡泊三烯(钙泊三醇)与5-氟尿嘧啶组合(例如,如Cunningham et al.,J Clin Invest.2017;127(1):106–116中所述)可以作为疫苗的佐剂(这将特别适用于通常用这些局部药物治疗的癌前皮肤病变的受试者)。参见,例如,Khong和Willem,Journal for ImmunoTherapy of Cancer 4:56(2016);Coffman等人,Immunity.2010Oct 29;33(4):492–503;Martins等人,EBioMedicine 3:67-78,2016;和DelGiudice,Seminars in Immunology,2018,doi.org/10.1016/j.smim.2018.05.001。
组合物
药物组合物通常包括药学上可接受的载体。如本文所用,语言“药学上可接受的载体”包括与药物施用相容的盐水、溶剂、分散介质、包衣、抗菌剂和抗真菌剂、等渗剂和吸收延迟剂等。
药物组合物通常被配制成与其预期的施用途径相容。施用途径的实例包括肠胃外给药,例如静脉内、皮内、皮下、瘤内、肌肉内或皮下施用。
配制合适的药物组合物的方法是本领域已知的,参见例如,Remington:TheScience and Practice of Pharmacy,21st ed.,2005;以及Drugs and thePharmaceutical Sciences:a Series of Textbooks and Monographs系列丛书(Dekker,NY)。例如,用于肠胃外、皮内、肌内或皮下应用的溶液或悬浮液可包括以下组分:无菌稀释剂,例如注射用水、盐水溶液、固定油(fixed oil)、聚乙二醇、甘油、丙二醇或其它合成溶剂;抗菌剂,例如苯甲醇或对羟基苯甲酸甲酯;抗氧化剂,例如抗坏血酸或亚硫酸氢钠;螯合剂,例如乙二胺四乙酸;缓冲剂,例如乙酸盐、柠檬酸盐或磷酸盐,以及用于调节张力的试剂,例如氯化钠或D-葡萄糖。pH可以用例如盐酸或氢氧化钠等酸或碱来调节。肠胃外制剂可以封装在安瓿、一次性注射器或由玻璃或塑料制成的多剂量小瓶中。
适用于注射用途的药物组合物可包括无菌水溶液(其为水溶性)或分散液和用于临时制备无菌注射溶液或分散液的无菌粉末。对于静脉内施用,合适的载体包括生理盐水、抑菌水、Cremophor EL
根据需要,无菌可注射溶液可以通过将适当溶剂中的所需量的活性化合物混入有上文列举的一种成分或成分的组合、然后过滤除菌来制备。通常,分散液是通过将活性化合物混入无菌运载体中来制备的,所述运载体包含基本分散介质和来自上文列举的那些的所需的其它成分。在用于制备无菌可注射溶液的无菌粉末的情况下,优选的制备方法是真空干燥和冷冻干燥,其产生活性成分加上来自任何另外期望的成分的先前无菌过滤的溶液的任何另外期望的成分的粉末。
在一个实施方案中,治疗性化合物与载体一起制备,所述载体将保护治疗性化合物免于从体内快速消除,例如控释制剂,包括植入物和微囊化递送系统。可以使用可生物降解的生物相容性聚合物,例如乙烯乙酸乙烯酯、聚酐、聚乙醇酸、胶原、聚原酸酯和聚乳酸。此类制剂可使用标准技术制备、或从商业上获得,例如从Alza Corporation和NovaPharmaceuticals,Inc.获得。脂质体悬浮液(包括具有针对细胞抗原的单克隆抗体的靶向选定细胞的脂质体)也可用作药学上可接受的载体。这些可以根据本领域技术人员已知的方法来制备,例如,如美国专利No.4,522,811中所述。
药物组合物可与施用说明书一起包含在容器、包装或分配器中。
受试者
本文所描述的疫苗组合物可用于加强针对免疫活性受试者、以及免疫抑制或免疫妥协患者中皮肤癌的免疫,这些患者针对β-HPV具有降低的T细胞免疫并易于发展为多发性皮肤疣和具有不良预后的癌症(携带病毒)。在一些实施方案中,受试者不患有癌症(例如,不患有皮肤癌)。在一些实施方案中,受试者处于发展皮肤癌的高风险(即,具有高于一般人群的风险)中,例如非黑素瘤,例如皮肤鳞状细胞癌。例如,受试者可能有皮肤癌的家族史、过度日晒/晒伤的个人史、白皙皮肤、居住在阳光充足或高海拔气候、暴露于辐射或致癌物质如砷、痣、癌前病变皮肤病变,或皮肤癌的家族史或个人史。
在一些实施方案中,受试者可以是免疫抑制的,例如,由于器官移植、获得性免疫缺陷,例如,HIV/AIDS,或原发性人类免疫缺陷。在一些实施方案中,受试者由于衰老而为免疫抑制的。本方法和组合物有助于衰老个体,因为衰老与免疫老化相关;因此,即使是那些正常衰老的人也将从疫苗中受益,以加强他们的抗病毒免疫。因此,在一些实施方案中,受试者是老年人,例如,为至少50、55、60、65、70、75、80、85或90岁。
可以使用本方法治疗的受试者包括哺乳动物,例如,人和非人兽医受试者。
诱导抗癌免疫的方法
本组合物可用于诱导抗癌免疫,以降低发展皮肤癌、例如非黑色素瘤、例如皮肤鳞状细胞癌的风险。所述方法包括向例如有需要的受试者等受试者施用一个或多个剂量的本文所述的疫苗组合物。
组合物以有效量施用。“有效量”是足以实现有益或期望结果的量。例如,有效量是实现所需治疗效果的量,例如治疗疾病、或降低疾病或疾病症状的发展风险所必需的量(也分别称为治疗有效量或预防有效量)。有效量可以以一次或多次施用、应用或剂量施用。治疗化合物的治疗有效量(即,有效剂量)取决于所选择的治疗化合物。组合物可以每天一次或多次至每周一次或多次施用;包括每隔一天一次。本领域技术人员将理解,某些因素可影响有效治疗受试者所需的剂量和时间,包括但不限于疾病或病症的严重程度、先前的治疗、受试者的总体健康状况和/或年龄,以及其它存在的疾病。此外,由治疗有效量的本文所述的治疗化合物的受试者的治疗可包括单次治疗或一系列的治疗。例如,所述方法可以包括施用第一剂量,其后在稍后的时间,例如,在1、2、4、6、8、12、18、24、或52周后施用第二剂量(例如,“加强”剂量)。
治疗组合物的剂量、毒性和治疗功效可以通过细胞培养物或实验动物中的标准制药程序来确定,例如,用于确定LD50(对群体的50%致死的剂量)和ED50(在群体的50%中治疗有效的剂量)。毒性和治疗效果之间的剂量比是治疗指数,它可以表示为LD50/ED50比。优选表现高治疗指数的组合物。虽然可以使用表现毒副作用的组合物,但应注意尽量最小化和减少副作用。
从细胞培养试验和动物研究中获得的数据可用于配制一系列用于人的剂量。此类化合物的剂量优选在包括ED50且毒性很小或没有毒性的循环浓度范围内。取决于所采用的剂型和所采用的施用途径,剂量可在此范围内变化。对于本文描述的方法中使用的任何组合物,治疗有效剂量可以最初从细胞培养试验中估计。可以在动物模型中配制剂量。此类信息可用于更准确地确定人中的有用剂量。
所述方法还可以包括施用用于皮肤癌的本领域已知的一种或多种其它治疗,例如,在患有皮肤癌的受试者中的,或降低皮肤癌的发展风险的治疗。例如,本文所述的组合物的组合治疗加上对于光化性角化病的实地治疗(以降低皮肤癌的发展风险),例如局部5-氟尿嘧啶、局部咪喹莫特、局部卡泊三烯加5-氟尿嘧啶、巨大戟醇甲基丁烯酸酯(Ingenolmebutate)和光动力疗法。在一些实施方案中,这些药剂加强抗原呈递(先天信号),而本组合物加强由T细胞的抗原识别。在患有皮肤癌的受试者中,手术治疗(例如,莫氏手术、切除手术、刮除术和电离术(电外科)、冷冻手术或激光手术);放射治疗;光动力疗法;局部药物(例如局部5-氟尿嘧啶、局部咪喹莫特、局部卡泊三烯加5-氟尿嘧啶、或巨大戟醇甲基丁烯酸酯);或全身性药物(例如,西米普利单抗注射溶液(cemiplimab-rwlc),例如,用于患有皮肤的转移性鳞状细胞癌的受试者),可以与本方法组合使用。
实施例
在以下实施例中进一步描述本发明,这些实施例不限制权利要求中描述的本发明的范围。
方法
下文的实施例中使用了以下材料和方法。
人类研究
临床研究的参与者同意审查他们的医疗记录、访问他们存档的皮肤癌以及疣活检样本对马萨诸塞州总医院高危皮肤癌诊所的研究(High Risk Skin Cancer Clinics atMassachusetts General Hospital)的贡献。通过马萨诸塞州总医院的莫氏外科诊所(Mohssurgery clinics)获得丢弃的去标识的正常人体皮肤样品。皮肤病变和正常皮肤样品被(a)处理以用于免疫细胞或RNA分离和(b)固定在福尔马林中并包埋在石蜡中以用于组织学检验。
动物研究
根据动物护理规定,所有小鼠在马萨诸塞州总医院和路易斯维尔大学(University of Louisville)的动物设施中在无病原体条件下饲养。6-8周龄雌性C57BL/6J(The Jackson Laboratory,Bar Harbor,ME,株代码:000664)、FVB(Charles River,Wilmington,MA,株代码:207)和SKH-1Elite(Charles River,株代码:477)用于本研究的免疫活性臂。FVB背景中的CD4
统计分析
双尾费舍尔精确检验用作皮肤癌和疣解剖分布结果的显著性检验。皮尔森χ2检验用于其它分类变量。双尾Mann-Whitney U检验用于肿瘤计数和T细胞活化检验。双尾配对t检验用于比较皮肤癌与其邻近正常皮肤之间的RNAish和DNAish信号计数。双尾未配对t检验用于比较皮肤病变与正常人皮肤的表皮厚度、免疫染色的T细胞计数、RNAish信号计数、以及其它连续变量。对数秩检验用作对肿瘤发作结果时间的显著性检验。小于0.05的P值被认为是显著的。所有条形图均显示平均值+标准偏差。
MmuPV1接种
根据之前描述的方案从B6.Cg-Foxn1
小鼠皮肤中MmuPV1的PCR检测
为了确认MmuPV1背部皮肤感染后和致癌作用方案完成时的皮肤定植,使用DNeasyBlood&Tissue Kit(Qiagen,Hilden,Germany,目录号.69506)从皮肤活检组织中分离DNA。根据先前描述的方法进行MmuPV1 L1蛋白的PCR扩增(引物列于下表)。
疣发展
在病毒感染或假感染后10周,监测小鼠的疣的发展。如前所述,
T细胞分离和转移
将在感染后10周从未发展疣或表现出疣的自发消退的MumPV1定植的FVB小鼠(免疫小鼠)用作T细胞供体。使用EasySep
表5.用于组织分析的抗体和引物
流式细胞术抗体
小鼠
人
化学致癌作用方案
在感染和MmuPV1免疫的证据后,C57BL/6J和FVB小鼠经受皮肤化学致癌作用方案。所有动物被剃毛,7天后在背部皮肤上接受单剂量的200μl丙酮中的100μg 7,12-二甲基苯并(a)蒽(DMBA)(Sigma Aldrich,目录号.D3254)。一周后,开始使用溶解在200μl丙酮中的12-O-十四烷酰佛波醇-13-乙酸酯(TPA)(Sigma Aldrich,目录号.P1585)进行处理(在C57BL/6J中每周3次,持续30周,在FVB群中每周2次,持续20周)。在整个致癌作用方案中,每周对肿瘤进行计数并每隔一周收集图片。基于在动物背部皮肤上发展的明显皮肤病变的总数确定最终肿瘤负荷。
UV致癌作用方案
在感染和MmuPV1免疫的证据后,SKH-1小鼠经受皮肤致癌作用方案(图11G)。小鼠在背部皮肤上接受单剂量的200μl丙酮中的50ug DMBA。一周后,SKH-1小鼠通过UVP
组织学和免疫荧光染色
收获背部皮肤样本并在4%多聚甲醛(PFA,Sigma Aldrich,目录号.P6148)中固定,4℃下过夜。然后,组织在乙醇中脱水、加工并石蜡包埋。切割5μm的石蜡包埋组织切片,脱蜡,并用苏木精和伊红(H&E)染色。对于免疫荧光染色,将再水化的组织切片由补充有0.2%v/v Triton X-100(Thermo Fisher Scientific,Waltham,MA,目录号.BP151)的1XPBS渗透5分钟。使用Cuisinart压力锅在抗原暴露溶液(Vector Laboratories,Burlingame,CA,目录号.H-3300)在高压下进行抗原修复20分钟。在补充有0.1%v/v Tween20(Sigma-Aldrich,目录号.P1379)的1X PBS中洗涤载玻片3次,共3分钟。由5%m/v牛血清白蛋白(Fisher Scientific,Hampton,NH,目录号.BP1600)和5%v/v山羊血清(Sigma-Aldrich,目录号.G9023)封闭切片。在4℃下由1:500大鼠抗CD3和1:500兔抗CD4或1:400兔抗CD8a染色载玻片过夜(表5)。第二天,如上所述洗涤载玻片并在室温下由1:200山羊抗大鼠-PE和1:500山羊抗兔-FITC培养2小时(表5)。如上所述洗涤后,在室温下由1:4000DAPI(Invitrogen,Carlsbad,CA,目录号.D3571)培养载玻片5分钟,然后如上所述洗涤。用Prolong Gold Antifade Reagent(Invitrogen,目录号.P36930)固定载玻片。一旦染色,对各切片获得200x总放大率下的10张随机选择的形态正常皮肤图像。使用ZEN Blue‘事件’工具(Zeiss,Oberkochen,Germany)对CD3
血清学
使用先前描述的方法,
RNA和DNA原位杂交
使用
qRT-PCR
从在4℃下储存在Allprotect(Qiagen,目录号.76405)的人体组织中提取RNA样品,并且速冻样品储存在在-80℃。使用无菌1x PBS洗涤一块组织(~50-100mg)并置于含有5mm TissueLyser珠的管中。之后,将600μl的RLT和βΜΕ添加至样品和珠。通过机械操作均质化组织5分钟。将液体转移至其中添加有1ml的TRIzol的新管中。使用用于TRIzol的标准Thermo Fisher方案,混合溶液并在4℃下离心10分钟。收集澄清上清液并添加0.2ml的氯仿/1mL的TRIzol。离心混合物并回收澄清上清液。对于RNA的提取,我们使用Allprep DNA/RNA mini试剂盒(Qiagen,目录号.80284)。然后将澄清上清液添加至Allprep DNA纯化柱中,将流出液与1体积的70%乙醇混合。将该溶液混合并施加至RNAeasy纯化柱,在那里遵循包括DNase消化的标准纯化方法。使用nanodrop定量RNA,并使用SuperScript III RT试剂盒(ThermoFisher,目录号.18080044)将1μg的RNA用于逆转录酶反应。1μg的RNA与0.25mg/ml随机引物、10mM dNTP混合物和无核酸酶H
人T细胞分离和肽刺激
如前所述从人皮肤分离T细胞。
实施例1.对共生乳头状瘤病毒的免疫使免受皮肤癌
为了研究亲皮肤性HPV是否有助于皮肤癌的发展,我们进行了临床研究,其中绘制了来自83名免疫抑制参与者的皮肤癌和疣的解剖定位。尽管86%的HPV驱动的疣在阳光保护(SP)和间歇性阳光损伤(ISD)皮肤上发展,但74例皮肤癌中的41例(55%)在头颈的慢性阳光损伤的皮肤上发展(表1A-B和图4A-B)。相反地,免疫抑制患者中皮肤癌的解剖分布与免疫活性患者的那些相匹配(表1A-B和图4A-B)。具有高病毒活性和疣发展的解剖部位上的皮肤癌倾向的没有增加表明UV是免疫抑制患者的主要皮肤癌引发因素。
表1A.人口统计学和皮肤病变分布。注意,研究中的免疫抑制和免疫活性患者是基于他们的皮肤癌类型进行匹配的。
*:由于例如溃疡性结肠炎等炎性疾病而正在使用全身免疫抑制药物的患者。
**:在单个解剖部位上的疣簇计为一个。
CSD:慢性阳光损伤皮肤,ISD:间歇性阳光损伤皮肤,SP:阳光保护皮肤。
表1B.来自表1B的患者群中的皮肤癌和疣的解剖分布。该表定义了表1中称为慢性阳光损伤皮肤(CSD)、间歇性阳光损伤皮肤(ISD)和阳光保护皮肤(SP)的解剖区域。提供了各个区域中疣和皮肤癌的发病率。
为了确定乳头状瘤病毒对致癌物质驱动的皮肤癌的影响,我们利用最近成为研究HPV相关皮肤病的有力工具的小鼠乳头状瘤病毒(MmuPV1)。
为了研究乳头状瘤病毒在更容易发生化学皮肤致癌作用的小鼠的FVB株中对皮肤癌的影响,
将具有针对MmuPV1的天然或获得性免疫的MmuPV1定植Wt FVB小鼠用DMBA处理一次,一周后用TPA每周处理两次,持续20周。类似于C57BL/6J动物,MmuPV1定植的Wt FVB小鼠被保护免于化学致癌作用,并显示出显著延迟的皮肤肿瘤发作(p<0.0001;图1f)。MmuPV1定植小鼠随着时间的推移发展较少的肿瘤(在DMBA后第7周开始p<0.05;图1g),并且在研究完成时它们的肿瘤负荷明显减少p<0.01;图1h和i)。因此,与假感染小鼠相比,接受7,12-二甲基苯并[a]蒽(DMBA)和12-O-十四烷酰佛波醇-13-乙酸酯(TPA)20周的MmuPV1定植的免疫FVB小鼠被保护免于化学致癌作用。此外,在T细胞转移后具有获得性免疫的小鼠也被保护免于化学致癌作用(图1J)。在DMBA-TPA方案完成时,我们检测MmuPV1定植Wt C57BL/6J和FVB小鼠的正常皮肤中的MmuPV1病毒DNA(图8A和B)和血液中的抗MmuPV1 L1、E6和E7抗体(图8C和D)。重要的是,如CD8
为了确定乳头状瘤病毒定植对UV致癌作用的影响,我们研究了无毛SKH-1小鼠,这些小鼠为免疫活性的并应答于UV辐射而发展皮肤肿瘤。
为了确定CD8+T细胞在介导由乳头状瘤病毒皮肤定植诱导的抗肿瘤免疫中的作用,SKH-1小鼠由MmuPV1感染或由MmuPV1病毒样颗粒假感染(假(VLP))。MmuPV1感染和假(VLP)感染小鼠经受由抗CD8抗体介导的CD8+ T细胞耗竭以及UV致癌作用方案(图11G-H)。值得注意的是,与经受T细胞耗竭的MmuPV1定植小鼠相比,由IgG对照处理的MmuPV1定植的SKH-1小鼠发展显著较少的肿瘤,并与由假(VLP)感染的IgG和抗CD8抗体处理对照组二者相比较(图11I-J)。与我们在小鼠的其它免疫活性株中的发现一致,MmuPV1定植的Xpc-/-小鼠—它们缺乏修复UV诱导的DNA突变的能力(Sands等人,Nature 377,162–165(1995))—与它们的假感染对照相比,它们被保护免于皮肤癌(图11K-N)。
为避免高免疫抑制性UV剂量,
小鼠中针对致癌物驱动的皮肤癌的抗MmuPV1免疫的保护作用表明免疫活性个体的皮肤中的β-HPV可发挥类似的保护作用。为了检验这一点,我们使用β-HPV RNAish探针池,其检测组织切片上的25种β-HPV类型的E6/7转录本,提供了对病毒在皮肤中的亚细胞定位的新见解(图13和表2)。
表2.用于RNAish的β-HPV和MmuPV1探针。结合所有β-HPV探针以产生单个泛β-HPV探针。DNAish探针是RNA探针结合的相同位点处的病毒DNA的有义链。
接下来,我们对来自我们免疫抑制和免疫活性患者的皮肤癌进行β-HPV RNAish(表3)。
表3.用于β-HPV RNAish检验的皮肤癌的人口统计数据。基于宿主的免疫状态对肿瘤进行分级,然后基于癌症类型(BCC或SCC)进行匹配。
*:大多数免疫抑制皮肤癌样品来自器官移植接受者。
**:双尾Fisher精确检验用作皮肤癌解剖分布结果的显著性检验。皮尔森χ2检验用于其它分类变量。
***:本研究包括分化良好的早期浸润性SCC和SCC原位(SCCIS)样品。
在来自免疫抑制患者的与疣和SCC相关的疣、肥厚性光化性角化病中可检测到β-HPV RNA(图3a)。与免疫抑制患者的邻近正常皮肤细胞相比,癌细胞中的β-HPV RNA表达降低(图3a)。β-HPV RNA表达在来自免疫活性患者的SCC的癌细胞中基本不存在,而低水平的β-HPV RNA表达存在于邻近的正常皮肤中(图3a)。皮肤癌中的β-HPV RNAish信号计数揭露了:与免疫活性和免疫抑制患者中的邻近正常皮肤角质形成细胞相比,癌细胞中的β-HPVRNA表达显著降低(p<0.001,图3b)。与免疫活性患者的皮肤癌细胞相比,免疫抑制患者中的皮肤癌细胞具有显著更多的病毒转录本(图15A)。此外,与来自免疫活性患者的皮肤病变和正常面部皮肤样本相比,免疫抑制患者的皮肤病变在组织中具有显著更高的β-HPV RNA表达(图15B-C)。与免疫活性患者相比,在免疫抑制患者的正常皮肤中在显著更多数量的基底角质形成细胞中可检测到β-HPV RNA表达(图16A-B)。为了在组织切片上检测亚细胞水平的β-HPV病毒载量,我们使用β-HPV DNA池原位杂交(DNAish)探针来检测来自25种β-HPV类型的E6/7基因的有义链。β-HPV DNAish揭露了β-HPV病毒DNA在人类皮肤中的亚细胞定位(图17)。β-HPV DNAish在与来自免疫抑制患者的疣和SCC相关的疣、肥厚性光化性角化病中显示出高病毒载量(图18A)。与免疫抑制患者的邻近正常皮肤相比,癌细胞中的β-HPV病毒载量降低(p<0.05,图18B)。当与邻近正常角质形成细胞相比,癌细胞中的β-HPV病毒载量的降低在免疫活性患者的病变中更为明显(p<0.01,图18C)。与来自免疫活性患者的样品相比,免疫抑制患者的皮肤癌中的较高的病毒活性和载量与其皮肤癌中显著较少的肿瘤浸润和皮肤浸润的CD8+T和CD103+CD8+TRM细胞相关(图19A-C)。
最后,我们检验了来自阳光损伤部位的正常皮肤是否含有对β-HPV特异性的T细胞。将分离自免疫活性的成年人的正常面部皮肤的T细胞暴露于来自β属HPV5、8、9、20和38型的E7蛋白的肽(表4)。暴露于β-HPV肽(试验)或佛波醇肉豆蔻酸酯乙酸酯和离子霉素(PMA/Ion;阳性对照)的皮肤来源的CD8
表4.用于体外T细胞刺激检验的β-HPV和HPV16 E7肽的氨基酸序列。*HPV16 E7肽用作阴性对照,产品代码:PM-HPV16-E7。
为了进一步开发疫苗策略,我们使用来自MmuPV1 E1、E2、E6和E7蛋白的长重叠肽与聚ICLC佐剂一起,在由MmuPV1定植后对Wt小鼠进行疫苗接种。接下来,我们确定该疫苗接种在暴露于致癌物后是否会降低皮肤癌风险。此外,我们在IRB批准方案下通过在高危患者的早期鳞状细胞癌部位皮下注射来研究β-HPV多肽疫苗(来自HPV 5、8、9、17、20、38、50、75、80和151的E1、E2、E4、E6和E7蛋白的肽)诱导针对皮肤癌的免疫应答的功效。该研究使检验疫苗在高危患者中用于癌症预防的应用的试验成为可能,例如在实体器官移植接受者接受移植前使用疫苗。
为了识别在角质形成细胞异常增殖后导致乳头状瘤病毒抗原呈递给T细胞的信号,我们对皮肤疣、MmuPV1感染的DMBA-UV处理的皮肤和肿瘤、以及假感染的DMBA-UV处理的SKH-1小鼠的皮肤和肿瘤进行RNA测序(RNA-seq)(图20a–C)。在MmuPV1诱导的疣和DMBA–UV诱导的肿瘤(来自MmuPV1感染组和假感染组二者)中上调的20个基因中,与皮肤(也来自两组)相比,存在几个免疫相关基因—包括损伤相关分子模式(DAMP)基因S100a8和S100a9(图20C)。在人类SCC和疣中,我们确证了与正常皮肤和与脂溢性角化病(一种良性皮肤生长)相比S100基因的诱导,其中S100A8和S100A9基因与正常皮肤相比下调(图20D-F)。
实施例2.活HPV疫苗和减毒活HPV疫苗
体外培养系统用于扩增亲皮肤性HPV。从例如成年免疫抑制患者的疣等中分离共生HPV。接下来,将纯化的病毒转移至使用人原代角质形成细胞(低传代而不是永生化细胞系(Bienkowska-Haba等人,PLoS Pathog.2018;14(3):e1006846))的器官型筏式培养模型中。通过使用细胞外基质(ECM)-至-细胞感染方法解决了将HPV基因组转染至角质形成细胞中的困难,因为HPV优先体内和体外结合至基底膜和角质形成细胞分泌的ECM(Richards等人,Viruses.2014;6(12):4856-79.Epub 2014/12/1)。这涉及将细胞接种至胶原凝胶的表面,然后将该凝胶转移至带有培养基的不锈钢网格上以产生空气-培养基界面。
编码共生HPV的E6蛋白的基因在其与MAML-1LXXLL结构域的结合位点处的突变,允许开发出可安全用于疫苗的减毒活病毒。将完整的HPV基因组插入至细菌人工染色体(BAC)中,以稳定维持大肠杆菌(Escherichia coli)内的HPV基因组并将突变引入E6与MAML-1的结合位点处。BAC序列的两侧是loxP位点,以允许在转移至人细胞之前通过Cre重组从病毒基因组中去除细菌序列。E6蛋白的逐步突变形成(正如Tan等人,Proceedings of theNational Academy of Sciences of the United States of America.2012;109(23):E1473-80.Epub 2012/05/024中对MAML1所做的那样)。然后将重组病毒基因组引入至人原代角质形成细胞。转染后,使用支持完整HPV生命周期的器官型培养模型使细胞分化和生长,并确定各个突变对E6蛋白与MAML1结合的影响。
参考文献:
1Grulich,A.E.,van Leeuwen,M.T.,Falster,M.O.&Vajdic,C.M.Incidence ofcancers in people with HIV/AIDS compared with immunosuppressed transplantrecipients:a meta-analysis.Lancet 370,59-67,doi:10.1016/S0140-6736(07)61050-2(2007)。
2Wang,J.,Aldabagh,B.,Yu,J.&Arron,S.T.Role of human papillomavirus incutaneous squamous cell carcinoma:a meta-analysis.Journal of the AmericanAcademy of Dermatology 70,621-629,doi:10.1016/j.jaad.2014.01.857(2014)。
3Forslund,O.et al.Cutaneous human papillomaviruses found in sun-exposed skin:Beta-papillomavirus species 2predominates in squamous cellcarcinoma.The Journal of infectious diseases 196,876-883,doi:10.1086/521031(2007)。
4Arron,S.T.,Ruby,J.G.,Dybbro,E.,Ganem,D.&Derisi,J.L.Transcriptomesequencing demonstrates that human papillomavirus is not active in cutaneoussquamous cell carcinoma.The Journal of investigative dermatology131,1745-1753,doi:10.1038/jid.2011.91(2011)。
5Chockalingam,R.,Downing,C.&Tyring,S.K.Cutaneous Squamous CellCarcinomas in Organ Transplant Recipients.Journal of clinical medicine 4,1229-1239,doi:10.3390/jcm4061229(2015)。
6 Ingle,A.et al.Novel laboratory mouse papillomavirus(MusPV)infection.Veterinary pathology 48,500-505,doi:10.1177/0300985810377186(2011)。
7 Handisurya,A.et al.Strain-specific properties and T cells regulatethe susceptibility to papilloma induction by Mus musculus papillomavirus1.PLoS Pathog 10,e1004314,doi:10.1371/journal.ppat.1004314(2014)。
8 Cakir,B.O.,Adamson,P.&Cingi,C.Epidemiology and economic burden ofnonmelanoma skin cancer.Facial Plast Surg Clin North Am 20,419-422,doi:10.1016/j.fsc.2012.07.004(2012)。
9 Rogers,H.W.,Weinstock,M.A.,Feldman,S.R.&Coldiron,B.M.IncidenceEstimate of Nonmelanoma Skin Cancer(Keratinocyte Carcinomas)in theU.S.Population,2012.JAMAdermatology 151,1081-1086,doi:10.1001/jamadermatol.2015.1187(2015)。
10 Eigentler,T.K.et al.Survival of Patients with Cutaneous SquamousCell Carcinoma:Results of a Prospective Cohort Study.The Journal ofinvestigative dermatology 137,2309-2315,doi:10.1016/j.jid.2017.06.025(2017)。
11 Clayman,G.L.et al.Mortality risk from squamous cell skin cancer.JClin Oncol 23,759-765,doi:10.1200/JCO.2005.02.155(2005)。
12 Nehal,K.S.&Bichakjian,C.K.Update on Keratinocyte Carcinomas.TheNew England journal of medicine 379,363-374,doi:10.1056/NEJMra1708701(2018)。
13 Guy,G.P.,Jr.,Machlin,S.R.,Ekwueme,D.U.&Yabroff,K.R.Prevalence andcosts of skin cancer treatment in the U.S.,2002-2006 and 2007-2011.Am J PrevMed 48,183-187,doi:10.1016/j.amepre.2014.08.036(2015)。
14 Howley,P.M.&Pfister,H.J.Beta genus papillomaviruses and skincancer.Virology 479-480,290-296,doi:10.1016/j.virol.2015.02.004(2015)。
15 de Koning,M.N.et al.Betapapillomaviruses frequently persist in theskin of healthy individuals.J Gen Virol 88,1489-1495,doi:10.1099/vir.0.82732-0(2007)。
16 Asgari,M.M.et al.Detection of human papillomavirus DNA incutaneous squamous cell carcinoma among immunocompetentindividuals.TheJournal of investigative dermatology 128,1409-1417,doi:10.1038/sj.jid.5701227(2008)。
17 Weissenborn,S.J.et al.Human papillomavirus-DNA loads in actinickeratoses exceed those in non-melanoma skin cancers.The Journal ofinvestigative dermatology 125,93-97,doi:10.1111/j.0022-202X.2005.23733.x(2005)。
18 Forslund,O.et al.High prevalence of cutaneous human papillomavirusDNA on the top of skin tumors but not in"Stripped"biopsies from the sametumors.The Journal of investigative dermatology 123,388-394,doi:10.1111/j.0022-202X.2004.23205.x(2004)。
19 Hufbauer,M.&Akgul,B.Molecular Mechanisms of Human PapillomavirusInduced Skin Carcinogenesis.Viruses 9,doi:10.3390/v9070187(2017)。
20 Abel,E.L.,Angel,J.M.,Kiguchi,K.&DiGiovanni,J.Multi-stage chemicalcarcinogenesis in mouse skin:fundamentals and applications.Nature protocols4,1350-1362(2009)。
21 Brouxhon,S.et al.Deletion of prostaglandin E2 EP2 receptorprotects against ultraviolet-induced carcinogenesis,but increases tumoraggressiveness.The Journal of investigative dermatology 127,439-446,doi:10.1038/sj.jid.5700547(2007)。
22 Wang,J.W.et al.Immunologic Control of Mus musculus PapillomavirusType 1.PLoS Pathog 11,e1005243,doi:10.1371/journal.ppat.1005243(2015)。
23 Uberoi,A.,Yoshida,S.,Frazer,I.H.,Pitot,H.C.&Lambert,P.F.Role ofUltraviolet Radiation in Papillomavirus-Induced Disease.PLoS Pathog 12,e1005664,doi:10.1371/journal.ppat.1005664(2016)。
24 Johnson,M.T.&Roberts,J.Skin conditions and related need formedical care among persons 1-74 years.United States,1971-1974.Vital HealthStat 11,i-v,1-72(1978)。
25 Inman,G.J.et al.The genomic landscape of cutaneous SCC revealsdrivers and a novel azathioprine associated mutational signature.Naturecommunications 9,3667,doi:10.1038/s41467-018-06027-1(2018)。
26 Goh,G.et al.Mutational landscape of MCPyV-positive and MCPyV-negative Merkel cell carcinomas with implications forimmunotherapy.Oncotarget 7,3403-3415,doi:10.18632/oncotarget.6494(2016)。
27 Nghiem,P.T.et al.PD-1 Blockade with Pembrolizumab in AdvancedMerkel-Cell Carcinoma.The New England journal of medicine 374,2542-2552,doi:10.1056/NEJMoa1603702(2016)。
28 Joh,J.et al.T cell-mediated antitumor immune response eliminatesskin tumors induced by mouse papillomavirus,MmuPV1.Exp Mol Pathol 103,181-190,doi:10.1016/j.yexmp.2017.09.003(2017)。
29 Martincorena,I.et al.Tumor evolution.High burden and pervasivepositive selection of somatic mutations in normal human skin.Science(NewYork,N.Y 348,880-886,doi:10.1126/science.aaa6806(2015)。
30 Meyers,J.M.,Uberoi,A.,Grace,M.,Lambert,P.F.&Munger,K.CutaneousHPV8 and MmuPV1 E6 Proteins Target the NOTCH and TGF-beta Tumor Suppressorsto Inhibit Differentiation and Sustain Keratinocyte Proliferation.PLoS Pathog13,e1006171,doi:10.1371/journal.ppat.1006171(2017)。
31 Viarisio,D.et al.Beta HPV38 oncoproteins act with a hit-and-runmechanism in ultraviolet radiation-induced skin carcinogenesis in mice.PLoSPathog 14,e1006783,doi:10.1371/journal.ppat.1006783(2018)。
32 Hasche,D.et al.The interplay of UV and cutaneous papillomavirusinfection in skin cancer development.PLoS Pathog 13,e1006723,doi:10.1371/journal.ppat.1006723(2017)。
33 Viarisio,D.et al.E6 and E7 from beta HPV38 cooperate withultraviolet light in the development of actinic keratosis-like lesions andsquamous cell carcinoma in mice.PLoS Pathog 7,e1002125,doi:10.1371/journal.ppat.1002125(2011)。
34 Herrero,R.Human papillomavirus(HPV)vaccines:limited cross-protection against additional HPV types.The Journal of infectious diseases199,919-922,doi:10.1086/597308(2009)。
35 Tirosh,O.et al.Expanded skin virome in DOCK8-deficientpatients.Nature medicine,doi:10.1038/s41591-018-0211-7(2018)。
36 Joh,J.et al.Molecular diagnosis of a laboratory mousepapillomavirus(MusPV).Exp Mol Pathol 93,416-421,doi:10.1016/j.yexmp.2012.07.001(2012)。
37 Jiang,R.T.et al.Spontaneous and Vaccine-Induced Clearance of MusMusculus Papillomavirus 1 Infection.Journal of virology 91,doi:10.1128/JVI.00699-17(2017)。
38 Chen,B.J.,Cui,X.,Sempowski,G.D.,Liu,C.&Chao,N.J.Transfer ofallogeneic CD62L-memory T cells without graft-versus-host disease.Blood 103,1534-1541,doi:10.1182/blood-2003-08-2987(2004)。
39 D'Orazio,J.A.et al.Topical drug rescue strategy and skinprotection based on the role of Mc1r in UV-induced tanning.Nature 443,340-344,doi:10.1038/nature05098(2006)。
40 Technology Planning and Management Corporation.Report onCarcinogens Background Document for Broad-Spectrum Ultraviolet(UV)Radiationand UVA,and UVB,and UVC.(Technology Planning and Management Corporation2000)。
41 Joh,J.,Jenson,A.B.,Ingle,A.,Sundberg,J.P.&Ghim,S.J.Searching forthe initiating site of the major capsid protein to generate virus-likeparticles for a novel laboratory mouse papillomavirus.Exp Mol Pathol 96,155-161,doi:10.1016/j.yexmp.2013.12.009(2014)。
42 Wang,F.et al.RNAscope:a novel in situ RNAanalysis platform forformalin-fixed,paraffin-embedded tissues.The Journal of moleculardiagnostics:JMD 14,22-29,doi:10.1016/j.jmoldx.2011.08.002(2012)。
43 Dang,C.et al.E6/E7 expression of human papillomavirus types incutaneous squamous cell dysplasia and carcinoma in immunosuppressed organtransplant recipients.The British journal of dermatology 155,129-136,doi:10.1111/j.1365-2133.2006.07378.x(2006)。
44 Watanabe,R.et al.Human skin is protected by four functionally andphenotypically discrete populations of resident and recirculating memory Tcells.Science translational medicine 7,279ra239,doi:10.1126/scitranslmed.3010302(2015)。
其它实施方案
应理解,虽然已经结合本发明的详细描述描述了本发明,但前述描述旨在说明而非限制本发明的范围,本发明的范围由所附权利要求的范围限定。其它方面、优点和修改在所附权利要求的范围内。
- 针对共生病毒的T细胞导向的抗癌疫苗
- 用于预防和治疗带状疱疹的DNA疫苗组合物,以及使用其激活针对VZV抗原的T细胞的方法
