酶法制备同质的抗体-药物缀合物
文献发布时间:2023-06-19 12:29:04
本申请是申请日为2015年6月11日的中国专利申请201580031364.9 “酶法制备同质的抗体-药物缀合物”的分案申请。
相关申请的交叉引用
本申请要求2014年6月12日提交的第62/011,534号美国临时申请的优先权权益,所述美国临时申请以其全部内容通过引用并入本文。
技术领域
本发明涉及包含与缀合物部分进行缀合的含Fc多肽的含Fc多肽缀合物,其中所述含Fc多肽包含含有侧接N-糖基化位点的受体谷氨酰胺残基的N-糖基化的Fc区,且其中所述缀合物部分经由受体谷氨酰胺残基与含Fc多肽缀合。还涉及通过使用野生型或工程改造的转谷氨酰胺酶制备此类含Fc多肽缀合物的方法。进一步涉及专门设计用于实施此类反应的工程改造的转谷氨酰胺酶。
背景技术
基于抗体的疗法已在各种病症(如癌症和免疫疾病)的靶向疗法中发挥了重要的作用。近年来,抗体-药物缀合物(ADC)已经被广泛地研究用于向靶位点有效递送药物。例如,化学修饰方法已广泛地用于将药物缀合至抗体,其通过赖氨酸侧链胺或通过半胱氨酸巯基实现。但是,这些缀合方法经常会导致产生具有不同药物与抗体的摩尔比、非特定缀合位点以及不同效力、安全性和药代动力学的不均一的缀合物混合物,参见Tanaka 等人,FEBS Letters 579:2092-2096(2005)。在抗体的特定位点构建反应性半胱氨酸残基从而实现缀合具有确定的化学计量学的特定药物的技术也已公开,参见Junutula 等人,NatureBiotechnology,26:925-932(2008)。然而,此类半胱氨酸工程改造的抗体和抗体-药物缀合物的表达和缀合需要冗长且复杂的反应步骤,例如参见Gomez 等人,Biotechnology andBioengineering,105(4):748-760(2009)。且在制备半胱氨酸工程改造的抗体和抗体-药物缀合物的过程中还可能会产生抗体聚集体。现有技术也已经公开了将非天然氨基酸残基整合入抗体中的方案,其中该非天然氨基酸残基作为位点特异性缀合的化学柄(chemicalhandles),参见Axupa 等人,PNAS,109:16101-16106(2012)。该方案首先需要在表达宿主中整合入琥珀抑制子tRNA和氨酰-tRNA合成酶的正交对(orthogonal pair)。然后,突变体抗体可以在这种专门宿主中表达,该宿主需要在补充非天然氨基酸的培养基上培养。这种方法不仅耗费时间,而且抗体表达产量也很低。
近期,利用转谷氨酰胺酶制备ADC的酶促方法已被公开。转谷氨酰胺酶(TGase)通过转谷氨酰胺作用将含有胺供体基团的部分转移到受体谷氨酰胺残基上。人同种型的全长IgG抗体在其重链的295位含有一个保守的谷氨酰胺残基(Q295)。因为该谷氨酰胺残基紧密靠近N-糖基化位点(N297),通常认为当全长抗体是N-糖基化时会导致抗体上的Q295无法接近TGase。为了使TGase作用于全长抗体,通常在TGase介导的缀合之前,将抗体的Fc区去糖基化或者突变以去除N-糖基化位点,参见WO2013/092998。另一可选的方案是将含谷氨酰胺的序列“标签”插入到抗体的轻链或重链以获得受体谷氨酰胺位点,参见WO2012059882。因此,所有目前的位点特异性ADC技术都依赖于工程改造的抗体突变体,这可能会导致潜在的免疫原性和体内不稳定性。迫切需要一种有效的位点特异性的抗体缀合技术,其可直接使用完整抗体。
本文中引用的所有公开出版物、专利和专利申请以其整体通过引用并入本文。
发明内容
本发明在一个方面提供含Fc多肽缀合物,其中含Fc多肽与缀合部分位点特异性缀合,其中所述含Fc多肽包含N-糖基化的Fc区,其中所述N-糖基化的Fc区包含侧接N-糖基化位点的受体谷氨酰胺残基,且其中所述缀合部分通过该受体谷氨酰胺残基与含Fc多肽缀合。
在一些实施方案中,所述受体谷氨酰胺残基在其+2位置侧接N-糖基化位点。在一些实施方案中,N-糖基化的Fc区包含免疫球蛋白重链的氨基酸290至300,其中编号是根据Kabat索引确定。在一些实施方案中,N-糖基化的Fc区是天然存在的免疫球蛋白重链的Fc区。
在上述的一些实施方案中,所述免疫球蛋白选自IgG1、IgG2、IgG3和IgG4。在一些实施方案中,所述含Fc多肽是免疫球蛋白重链。在一些实施方案中,所述含Fc多肽是全长抗体。在一些实施方案中,所述抗体是人或人源化抗体。在一些实施方案中,所述抗体的两条重链均与缀合部分缀合。在一些实施方案中,所述受体谷氨酰胺残基在位置295,且所述N-糖基化位点在位置297,其中编号是根据Kabat索引确定。
在上述的一些实施方案中,所述缀合部分包含选自以下的活性部分:改善含Fc多肽的药代动力学特性的部分、治疗部分和诊断部分。在一些实施方案中,所述活性部分是毒素。
在上述的一些实施方案中,所述含Fc多肽和缀合部分通过接头(诸如可切割接头或不可切割接头)缀合。
在一些实施方案中,提供包含上述任一种含Fc多肽缀合物的组合物,其中所述组合物中至少约50%(例如至少约60%、70%、80%、90%或95%中任一种)的含Fc多肽缀合物的 Fc区是糖基化的。在一些实施方案中,至少约50%(例如至少约60%、70%、80%、90%或95%中任一种)的所述含Fc多肽缀合物中,含Fc多肽与缀合部分的摩尔比率为1:1或1:2。
在一个方面,提供抗体-药物缀合物,其中抗体通过其上的内源性受体谷氨酰胺残基与缀合部分缀合,其中所述抗体-药物缀合物的Fc区是糖基化的。在一些实施方案中,所述抗体-药物缀合物的Fc区是N-糖基化的。在一些实施方案中,所述抗体是人抗体。在一些实施方案中,所述抗体是人源化抗体。
在上述的一些实施方案中,所述抗体的两条重链均与缀合部分缀合。
在上述的一些实施方案中,所述缀合部分包含选自以下的活性部分:改善抗体的药代动力学特性的部分、治疗部分和诊断部分。在一些实施方案中,所述活性部分是毒素。
在上述的一些实施方案中,所述抗体和缀合部分通过接头缀合。在一些实施方案中,所述接头是可切割接头。在一些实施方案中,所述接头是不可切割接头。
在一些实施方案中,提供包含上述任一种抗体-药物缀合物的组合物,其中所述组合物中至少约50%(例如,至少约60%、70%、80%、90%或95%中任一种)的抗体-药物缀合物的 Fc区是糖基化的。在一些实施方案中,所述组合物中至少80%的抗体-药物缀合物中,抗体与缀合部分的摩尔比率为1:1或1:2。
在另一个方面,提供制备含Fc多肽缀合物的方法,其中含Fc多肽与缀合部分特异性缀合,其包括:在转谷氨酰胺酶存在的情况下,在足以生成含Fc多肽缀合物的条件下,使含Fc多肽与缀合部分反应,其中所述含Fc多肽包含N-糖基化的Fc区,其中所述N-糖基化的Fc区包含侧接N-糖基化位点的受体谷氨酰胺残基,且其中所述缀合部分通过该受体谷氨酰胺残基与含Fc多肽缀合。
在一些实施方案中,提供制备含Fc多肽缀合物的方法,所述含Fc多肽与缀合部分特异性缀合,所述缀合部分包含一个小分子柄和一个活性部分,所述方法包括:a)在转谷氨酰胺酶存在的情况下,在足以生成含Fc多肽-小分子柄的中间体缀合物的条件下,使含Fc多肽与小分子柄反应,其中,含Fc多肽与小分子柄特异性缀合,和b)将所述中间体缀合物与活性部分偶联,由此获得含Fc多肽缀合物,其中所述含Fc多肽包含N-糖基化的Fc区,其中所述N-糖基化的Fc区包含侧接N-糖基化位点的受体谷氨酰胺残基,且其中所述缀合部分通过该受体谷氨酰胺残基与含Fc多肽缀合。在一些实施方案中,所述转谷氨酰胺酶是具有SEQ IDNO:16的氨基酸序列的野生型转谷氨酰胺酶。在一些实施方案中,所述转谷氨酰胺酶是工程改造的转谷氨酰胺酶,诸如工程改造的转谷氨酰胺酶,其包含与SEQ ID NO:16具有至少约80%(例如,至少约85%、90%、95%或99%)同一性的氨基酸序列。在一些实施方案中,所述转谷氨酰胺酶和含Fc多肽的摩尔比率为约10:1至约1:100。在一些实施方案中,将所述转谷氨酰胺酶固定在固体支持物上。在其他实施方案中,将所述含Fc多肽固定在固体支持物上。
在上述的一些实施方案中,所述受体谷氨酰胺残基在其+2位置侧接N-糖基化位点。在一些实施方案中,N-糖基化的Fc区包含免疫球蛋白重链的氨基酸290至300,其中编号是根据Kabat索引确定。在一些实施方案中,N-糖基化的Fc区是野生型免疫球蛋白重链的Fc区。在一些实施方案中,所述免疫球蛋白选自IgG1、IgG2、IgG3和IgG4。在一些实施方案中,所述含Fc多肽是免疫球蛋白(诸如全长抗体,例如人抗体或人源化抗体)重链。在一些实施方案中,所述抗体的两条重链均与缀合部分缀合。在一些实施方案中,所述受体谷氨酰胺残基在位置295,且所述N-糖基化位点在位置297,其中编号是根据Kabat编号确定。
在上述的一些制备方法中,所述缀合部分包含选自以下的活性部分:改善含Fc多肽的药代动力学特性的部分、治疗部分和诊断部分。在一些实施方案中,所述活性部分是毒素。
在另一个方面,提供制备抗体-药物缀合物的方法,其包括:在转谷氨酰胺酶存在的情况下,在足以生成抗体-药物缀合物的条件下,使含抗体组合物与缀合部分反应,其中所述组合物中至少约50%(例如,至少约60%、70%、80%、90%或95%中任一种)的抗体的Fc区是糖基化的,且其中所述缀合部分与抗体上的内源性受体谷氨酰胺残基缀合。
在另一个方面,提供制备抗体-药物缀合物的方法,其中抗体与缀合部分特异性缀合,所述缀合部分包含一个小分子柄和一个活性成分,所述方法包括:a)在转谷氨酰胺酶存在的情况下,在足以生成抗体-小分子柄中间体缀合物的条件下,使含抗体组合物与小分子柄反应,其中,抗体与小分子柄特异性缀合,和b)使所述中间体缀合物与活性部分反应,由此获得抗体-药物缀合物,其中所述组合物中至少约50%(例如,至少约60%、70%、80%、90%或95%中任一种)的抗体的 Fc区是糖基化的,且其中所述缀合部分与抗体上的内源性受体谷氨酰胺残基缀合。
在上述制备抗体-药物缀合物的一些方法中,所述转谷氨酰胺酶是野生型转谷氨酰胺酶。在一些实施方案中,所述野生型转谷氨酰胺酶具有SEQ ID NO:16的氨基酸序列。
在上述制备抗体-药物缀合物的一些方法中,所述转谷氨酰胺酶是工程改造的转谷氨酰胺酶。在一些实施方案中,所述工程改造的转谷氨酰胺酶包含与SEQ ID NO:16具有至少约80%(例如,至少约85%、90%、95%或99%)同一性的氨基酸序列。
在上述制备抗体-药物缀合物的一些方法中,所述转谷氨酰胺酶具有至少约90%(例如,至少约95%、98%或99%中任一种)的纯度。
在上述制备抗体-药物缀合物的一些方法中,所述转谷氨酰胺酶和含抗体组合物的摩尔比率为约10:1至约1:10。
在上述制备抗体-药物缀合物的一些方法中,将所述转谷氨酰胺酶固定在固体支持物上。
在上述制备抗体-药物缀合物的一些方法中,将所述抗体固定在固体支持物上。
在上述制备抗体-药物缀合物的一些方法中,所述抗体是人或人源化抗体。
在上述制备抗体-药物缀合物的一些方法中,所述缀合部分包含选自以下的活性部分:改善含抗体组合物的药代动力学特性的部分、治疗部分和诊断部分。在一些实施方案中,所述活性部分是毒素。
在另一个方面,提供工程改造的转谷氨酰胺酶。在一些实施方案中,提供能够将含Fc多肽(诸如抗体)与缀合部分进行缀合的工程改造的转谷氨酰胺酶,其中所述含Fc多肽(诸如抗体)包含N-糖基化的Fc区,其中所述N-糖基化的Fc区包含侧接N-糖基化位点的受体谷氨酰胺残基,反应后,所述缀合部分通过该受体谷氨酰胺残基与含Fc多肽(诸如抗体)缀合,且在相同反应条件下,所述工程改造的转谷氨酰胺酶对缀合反应的催化活性比野生型转谷氨酰胺酶高至少约10%(例如,至少约20%、30%、40%、50%或更高比例)。在一些实施方案中,提供工程改造的转谷氨酰胺酶,其包含与SEQ ID NO:16具有至少约80%(例如,至少约85%、90%、95%或99%)同一性的氨基酸序列,其中所述转谷氨酰胺酶包含选自以下的缺失突变:D1-E4、P244-P247和N282-L285。
进一步提供使用本文所述的工程改造的转谷氨酰胺酶制备含Fc多肽缀合物(诸如抗体-药物缀合物)的方法。
在一些实施方案中,提供制备抗体-药物缀合物的方法,其中抗体与缀合部分特异性缀合,所述方法包括:在上述任一种工程改造的转谷氨酰胺酶存在的情况下,在足以生成抗体-药物缀合物的条件下,使含抗体组合物与缀合部分反应,其中所述缀合部分与抗体上的内源性受体谷氨酰胺残基缀合。
在一些实施方案中,提供制备抗体-药物缀合物的方法,其中抗体与缀合部分特异性缀合,所述缀合部分包含一个小分子柄和一个活性中心,所述方法包括:a)在上述任一种工程改造的转谷氨酰胺酶存在的情况下,在足以生成抗体-小分子柄中间体缀合物的条件下,使含抗体组合物与小分子柄反应,其中,抗体与小分子柄特异性缀合,和b)使所述中间体缀合物与活性部分反应,由此获得抗体-药物缀合物,其中所述缀合部分与抗体上的内源性受体谷氨酰胺残基缀合。
应当理解,可以组合本文所述的各种实施方案的一种、多种或所有特征以形成本发明的其他实施方案。本发明的各种实施方案和组合形成的其他实施方案对于本领域技术人员而言是显而易见的。
附图说明
图1提供各种类型的人、小鼠和大鼠IgG的CH2结构域序列的序列比对。用于TGase介导的反应的内源性谷氨酰胺(Q295)和N-糖基化位点(N297)加方框。
图2提供来自拉达卡链霉菌(
图3提供来自拉达卡链霉菌的TGase的缺失突变体的序列,并提供重组野生型TG_SL的序列(SEQ ID NO:17)。使用NdeI和XhoI位点将野生型SL mTgase克隆至pET39+载体中,其具有额外的脯氨酸。基于IgG1和TG_SM晶体结构对接将靠近活性位点入口的三个区域靶向缺失或突变以扩大底物结合口袋。缺失区域加灰色、加下划线(unlined)或加删除线。下面说明活性突变体。
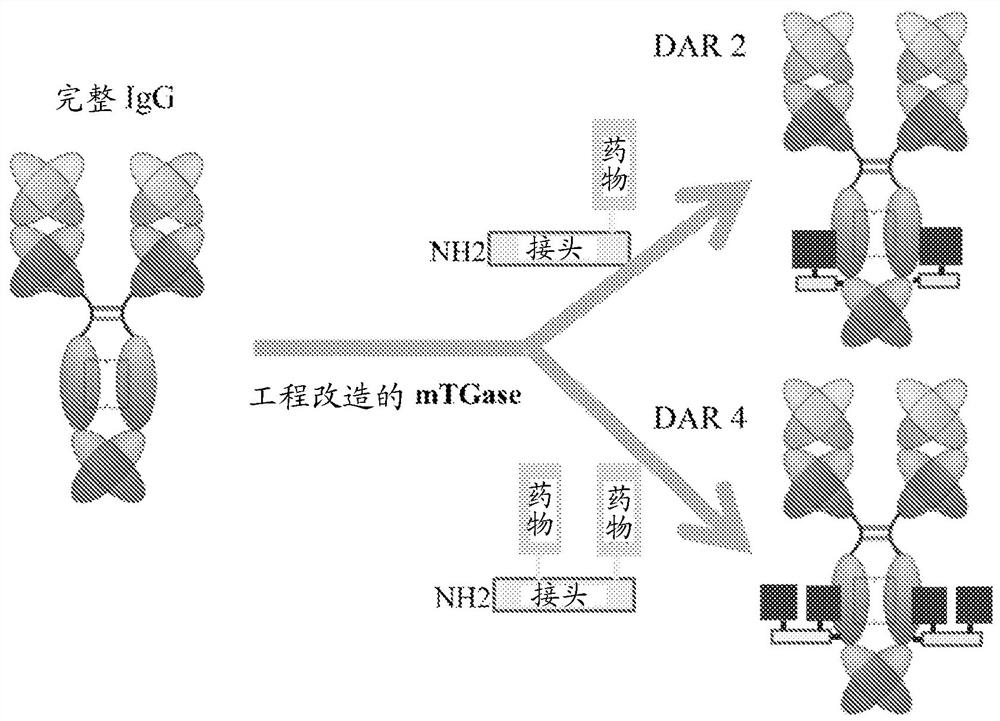
图4提供一步法制备抗体-药物缀合物的图。
图5提供两步法制备抗体-药物缀合物的图。
图6提供与MDC缀合的IgG1、2和4的HPLC色谱图。图6A显示仅IgG1的重链与MDC缀合。8小时反应混合物还原后过C4柱(与IgG1重叠图)。图6B显示IgG1与MDC以1:1和1:2的摩尔比率缀合。在反应开始时,1:1缀合物(修饰一条H链)是唯一的产物。8小时之后,1:2缀合物(修饰两条H链)达到80%。图6C显示IgG2(左)和IgG4(右)与MDC的位点特异性缀合。左图显示苯基柱上的IgG2-MDC反应混合物。右图显示C4柱上的IgG4-MDC反应混合物.
图7提供IgG1-MDC缀合物的SDS PAGE分析。其中显示工程改造的mTGase催化单丹磺酰尸胺与IgG1的缀合。
图8提供分子量为896.42Da的美登素衍生物,其含有延伸的、不可切割的直链PEG接头与伯胺基,本文称为MAY-PEG4。
图9提供分子量为1224.58 Da的美登素衍生物,其含有可切割接头,所述可切割接头具有自降解间隔基(self-immolative spacer)和末端赖氨酸,本文称为MAY-PVCL。
图10提供IgG1-MAY-PEG4的DAR 0(即,裸IgG1,上小图)、DAR 1(中小图)和DAR 2(下小图)的MALDI-TOF图谱。
图11提供裸IgG1(左小图)和与MAY-PVCL缀合的IgG1(右小图)的MALDI-TOF图谱。
图12提供含有不可切割接头的一甲基澳瑞他汀E(MMAE)衍生物(上图)(本文称为PEGx-MMAE,其中x为2、4、6、8、10、12、16、20或24),其具有不同数目的聚乙二醇(PEG)单元;和含有可切割接头的MMAE衍生物(下图)(本文称为PEG3c-MMAE)。
图13提供通过TGase制备的曲妥珠单抗-PEGx-MMAE缀合物在BT474异种移植小鼠中的体内效力。BT474异种移植小鼠(N=4),以10mg/kg 静脉推注)
图14提供通过TGase制备的曲妥珠单抗-PEG12-MMAE缀合物在NCI N87异种移植小鼠中的体内稳定性。NCI N87异种移植小鼠(N=4)平均肿瘤95 mm3,以5 mg/kg静脉推注。
图15提供曲妥珠单抗-PEG3c-MMAE缀合物(DAR2,本文称为TP3cE)和TDM-1(Genentech)缀合物在NCI N87异种移植小鼠中的体内效力的比较。NCI N87异种移植小鼠(N=6)静脉推注。
图16提供曲妥珠单抗-PEG3c-MMAE缀合物(DAR2,本文称为TP3cE)和TDM-1(Genentech)缀合物在NCI N87异种移植小鼠中的体内稳定性的比较。NCI N87异种移植小鼠(N=4)平均肿瘤95 mm3,以5mg/kg静脉推注。
图17提供曲妥珠单抗-PEG3c-MMAE缀合物(DAR2,本文称为TP3cE)和TDM-1(Genentech)缀合物在SK_Ov3异种移植小鼠中的体内效力的比较。图中的箭头表示施用各剂量的抗体-药物缀合物的时间点。SK_OV3异种移植小鼠(N=8)如所示3次静脉注射。
图18提供DAR4 ADC制备中使用的3-臂PEG接头(上图;1至5kDa,其中n=7-38)(每个接头具有一个胺基和两个叠氮基)和炔烃-PEG4c-MMAE(下图)。
具体实施方式
本申请首次提供一种将缀合部分(诸如药物)连接至完整、未修饰的(例如,不改变糖基化构型)抗体的方法,是一种位点特异的和可进行化学计量的方法。这通过在特定反应条件下,利用野生型TGase和/或工程改造的TGase来实现,所述工程改造的TGase是专门设计的用于催化Fc区的内源性谷氨酰胺残基处的位点特异性缀合反应的TGase。本申请的方法产生的是同质(homogeneous)的位点特异性和可化学计量的抗体-药物缀合物,其具有优异的PK特性、宽治疗指数和最佳效力。所述方法允许药物与完整抗体缀合,而无需引入突变和/或使抗体去糖基化,因此可尽可能降低由此类额外的操作步骤引入的免疫原性。完整抗体上的聚糖(当存在时)可保护抗体免于降解,稳定产生的抗体-药物缀合物。由于不必在转谷氨酰胺反应前处理抗体,因此本文所述的基于TGase的抗体缀合方法比先前报道的那些方法更有效。
因此,本申请在一个方面提供含Fc多肽缀合物(诸如抗体-药物缀合物),其中含Fc多肽(如抗体)与缀合部分缀合,其中所述含Fc多肽(诸如抗体)包含N-糖基化的Fc区,其含有侧接N-糖基化位点的受体谷氨酰胺残基,且其中所述缀合部分通过该受体谷氨酰胺残基与含Fc多肽(诸如抗体)缀合。
在另一个方面,提供使用野生型或工程改造的转谷氨酰胺酶制备含Fc多肽缀合物(诸如抗体-药物缀合物)的方法。
进一步提供了专门设计用于催化此类反应的工程改造的转谷氨酰胺酶。
定义
“转谷氨酰胺酶”在本文中与“TGase”可互换使用,是指能够催化转谷氨酰胺反应的酶。如本文所使用的术语“转谷氨酰胺反应”是指这样的反应,其中来自蛋白/肽的受体谷氨酰胺残基的γ-谷氨酰胺酰基被转移至胺基团,诸如伯胺或赖氨酸的ε-氨基。
术语“受体谷氨酰胺残基”,当指多肽或蛋白的氨基酸残基时,是指这样的谷氨酰胺残基,其在合适的条件下,被TGase识别并且在TGase的作用下与包含供体胺基的缀合部分交联,上述过程是通过谷氨酰胺和供体胺基(诸如赖氨酸或含有伯胺的基团诸如氨基戊基)之间的反应实现的。
如本文所使用,“抗体上的内源性受体谷氨酰胺残基”是指天然存在的抗体Fc区中的受体谷氨酰胺残基。此类内源性受体谷氨酰胺残基通常是Q275(根据Kabat编号确定),且侧接Asn297位置处的N-糖基化位点。
本文所使用的“含Fc多肽”是指包含免疫球蛋白重链的Fc区的多肽(例如,抗体或Fc融合蛋白)。本文所使用的术语“多肽”包括单一多肽链和多单元多肽(multiplepolypeptides)。例如,含Fc多肽可以是全长抗体(诸如完整抗体),或其可以是全长抗体的单链。
如本文所使用,“Fc区”是指包含抗体重链的恒定区中除第一恒定区免疫球蛋白结构域的多肽。对于IgG,所述Fc区可以包含免疫球蛋白结构域CH2和CH3以及CH1和CH2之间的铰链。
如本文所使用,“全长抗体”是指构成抗体的天然生物形式的分子,包括可变区和恒定区。例如,在大多数哺乳动物(包括人和小鼠)中,IgG同种型的全长抗体是四聚体,且由两个相同的免疫球蛋白双链组成,每个双链具有一条轻链和一条重链,每条轻链包含免疫球蛋白结构域VL和CL,且每条重链包含免疫球蛋白结构域VH、CH1、CH2和CH3。在一些哺乳动物中,例如在骆驼和美洲驼中,IgG抗体仅由两条重链组成,每条重链包含与Fc区连接的可变结构域。
本文中的“氨基酸修饰”意指多肽序列中的氨基酸取代、插入和/或缺失。本文中的“氨基酸取代”或“取代”意指蛋白序列中给定位置处的氨基酸被另一个氨基酸替代。多肽的“变体”是指具有与参考多肽(通常是天然或“亲本”多肽)实质上相同的氨基酸序列的多肽。所述多肽变体可以在天然氨基酸序列的某些位置处具有一个或多个氨基酸取代、缺失和/或插入。
“保守”氨基酸取代是具有相似物理化学性质的侧链的氨基酸残基之间的取代。具有相似侧链的氨基酸残基的家族是本领域已知的,并且包括具有碱性侧链(例如,赖氨酸、精氨酸、组氨酸)、酸性侧链(例如,天冬氨酸、谷氨酸)、不带电荷极性侧链(例如,甘氨酸、天冬酰胺、受体谷氨酰胺、丝氨酸、苏氨酸、酪氨酸、半胱氨酸、色氨酸)、非极性侧链(例如,丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸)、β-分支侧链(例如,苏氨酸、缬氨酸、异亮氨酸)和芳香族侧链(例如,酪氨酸、苯丙氨酸、色氨酸、组氨酸)的氨基酸家族。
术语“保护基团”是指这样的基团,其在第一分子转变为第二分子过程中,临时起保护或阻断作用,即阻止官能团例如氨基、羟基或羧基反应。
短语“改善药代动力学特性的部分”是指可改变所连接分子的药代动力学特性的部分,从而可以获得更好的治疗或诊断效果。所述改善药代动力学特性的部分例如可以增加水溶性、增加循环时间或降低免疫原性。
短语“接头”是指这样一种化合物结构元件,其可通过所述化合物的一个结构元件与所述相同化合物的一个或多个其他结构元件实现两种化合物的连接。
如本文所使用,“治疗(treating)”或“治疗(treatment)”是旨在获得有益或预期的结果(包括临床结果)的方法。在本发明中,有益或预期的临床结果包括但不限于以下中的一种或多种:减轻由疾病导致的一种或多种症状,缩小病变范围,稳定疾病(例如,预防或延迟疾病的恶化),预防或延迟疾病的复发,延迟或减缓疾病的进展,改善疾病状态,缓解疾病 (部分或全部),减少治疗疾病所需的一种或多种其他药物的剂量,延迟疾病的进展和/或提高生存质量。
术语“个体”是指哺乳动物,包括但不限于人、牛科动物、马、猫科动物、犬科动物、啮齿动物或灵长类动物。在一些实施方案中,所述个体是人。
应当理解,本文所述的本发明的特征和实施方案包括与其相同或实质相同的特征和实施方案。
本文中提及“约”值或参数包括该值或参数本身。例如,涉及“约X”的描述包括“X”本身。本文所使用的术语“约X-Y”具有与“约X至约Y”相同的含义。
如本文和所附权利要求书中所使用,单数形式“一个/种(a)”、“或(or)”和“该(the)”包括复数形式,除非上下文另有明确说明。
含Fc多肽缀合物
本申请在一个方面提供含Fc多肽缀合物(诸如抗体-药物缀合物),其中含Fc多肽与缀合部分位点特异性缀合。所述含Fc多肽(诸如抗体)包含N-糖基化的Fc区。所述N-糖基化的Fc区包含侧接N-糖基化位点的受体谷氨酰胺残基,且所述缀合部分通过该受体谷氨酰胺残基与含Fc多肽(诸如抗体)缀合。
在一些实施方案中,免疫球蛋白的Fc区包含部分或全部的铰链区。在一些实施方案中,所述含Fc多肽包含天然存在的免疫球蛋白的Fc区。在一些实施方案中,所述含Fc多肽包含IgG1、IgG2、IgG3、IgG4亚型的Fc区,或来自IgA、IgE、IgD或IgM的Fc区。在一些实施方案中,所述Fc区来自人IgG,且所述Fc区是从位置Glu216或Ala231的氨基酸残基至其羧基末端的一段氨基酸,根据Kabat编号系统确定氨基酸位置。
在一些实施方案中,所述含Fc多肽是含Fc融合多肽,其中一个或多个功能多肽与Fc区融合。此类功能多肽包括但不限于受体的靶向结合区、粘附分子、配体、酶、细胞因子和趋化因子。
本文所述的Fc区可以是N-糖基化的。例如,在一些实施方案中,连接到N-糖基化位点处的多糖链至少约1、10、20、30、40、50、60、70、80、90或100个单元。
所述N-糖基化位点侧接偶联了缀合部分的受体谷氨酰胺残基。本发明人首次证明,通过本文描述的方法,可将缀合部分连接至Fc区中侧接N-糖基化位点的受体谷氨酰胺残基。在一些实施方案中,所述N-糖基化位点和所述受体谷氨酰胺残基相隔5个或5个以下氨基酸残基。在一些实施方案中,所述N-糖基化位点和所述受体谷氨酰胺相隔5、4、3、2或1个氨基酸。在一些实施方案中,所述N-糖基化位点和所述受体谷氨酰胺彼此相邻。在一些实施方案中,所述受体谷氨酰胺残基在其+2位置侧接N-糖基化位点。在一些实施方案中,所述受体谷氨酰胺残基在其+1、+2、+3、+4或+5位置侧接N-糖基化位点。在一些实施方案中,所述受体谷氨酰胺残基在其-1、-2、-3、-4或-5位置侧接N-糖基化位点。
因此,在一些实施方案中,提供含Fc多肽缀合物,其中含Fc多肽与缀合部分位点特异性缀合,其中所述含Fc多肽包含N-糖基化的Fc区,其中所述N-糖基化的Fc区包含侧接N-糖基化位点的受体谷氨酰胺残基,且其中所述缀合部分通过该受体谷氨酰胺残基与含Fc多肽缀合。
在一些实施方案中,提供含Fc多肽缀合物,其中含Fc多肽与缀合部分位点特异性缀合,其中所述含Fc多肽包含N-糖基化的Fc区,其中所述N-糖基化的Fc区包含与N-糖基化位点相隔5个或5个以下氨基酸(包括例如相隔4、3、2或1个氨基酸)的受体谷氨酰胺残基,且其中所述缀合部分通过该受体谷氨酰胺残基与含Fc多肽缀合。
在一些实施方案中,提供含Fc多肽缀合物,其中含Fc多肽与缀合部分位点特异性缀合,其中所述含Fc多肽包含N-糖基化的Fc区,其中所述受体谷氨酰胺残基在其+2位置侧接N-糖基化位点,且其中所述缀合部分通过该受体谷氨酰胺残基与含Fc多肽缀合。
在一些实施方案中,提供含Fc多肽缀合物,其中含Fc多肽与缀合部分位点特异性缀合,其中所述含Fc多肽包含N-糖基化的Fc区,其中所述N-糖基化的Fc区包含SEQ ID NO:1(KPREEQX
在一些实施方案中,提供含Fc多肽缀合物,其中含Fc多肽与缀合部分位点特异性缀合,其中所述含Fc多肽包含N-糖基化的Fc区,其中所述N-糖基化的Fc区包含SEQ ID NO:3的氨基酸序列(人IgG1的CH2序列,参见图1),且其中所述缀合部分通过SEQ ID NO:3的位置65的受体谷氨酰胺残基与含Fc多肽缀合,且其中所述N-糖基化位点在SEQ ID NO:3的位置67(参见图1中显示的框中的残基)。
在一些实施方案中,提供含Fc多肽缀合物,其中含Fc多肽与缀合部分特异性缀合,其中所述含Fc多肽包含N-糖基化的Fc区,其中所述N-糖基化的Fc区包含SEQ ID NO:4的氨基酸序列(人IgG2的CH2序列,参见图1),且其中所述缀合部分通过SEQ ID NO:4的位置64的受体谷氨酰胺残基与含Fc多肽缀合,且其中所述N-糖基化位点在SEQ ID NO:4的位置66(参见图1中显示的框中的残基)。
在一些实施方案中,提供含Fc多肽缀合物,其中含Fc多肽与缀合部分特异性缀合,其中所述含Fc多肽包含N-糖基化的Fc区,其中所述N-糖基化的Fc区包含SEQ ID NO:5的氨基酸序列(人IgG3的CH2序列,参见图1),且其中所述缀合部分通过SEQ ID NO:5的位置65的受体谷氨酰胺残基与含Fc多肽缀合,且其中所述N-糖基化位点在SEQ ID NO:5的位置67(参见图1中显示的框中的残基)。
在一些实施方案中,提供含Fc多肽缀合物,其中含Fc多肽与缀合部分特异性缀合,其中所述含Fc多肽包含N-糖基化的Fc区,其中所述N-糖基化的Fc区包含SEQ ID NO:6的氨基酸序列(人IgG4的CH2序列,参见图1),且其中所述缀合部分通过SEQ ID NO:6的位置65的受体谷氨酰胺残基与含Fc多肽缀合,且其中所述N-糖基化位点在SEQ ID NO:6的位置67(参见图1中显示的框中的残基)。
在一些实施方案中,提供抗体-药物缀合物,其中抗体与缀合部分特异性缀合,其中所述抗体包含N-糖基化的Fc区,其中所述N-糖基化的Fc区包含侧接N-糖基化位点的受体谷氨酰胺残基,且其中所述缀合部分通过该受体谷氨酰胺残基与抗体缀合。在一些实施方案中,所述抗体是人抗体。在一些实施方案中,所述抗体是人源化抗体。在一些实施方案中,所述抗体是嵌合抗体。在一些实施方案中,所述抗体是双特异性或多特异性抗体。在一些实施方案中,所述抗体是曲妥珠单抗。
在一些实施方案中,提供与缀合部分缀合的全长抗体,其中所述全长抗体包含N-糖基化的Fc区,且其中所述缀合部分通过抗体的重链的位置295的受体谷氨酰胺残基与全长抗体缀合,其中所述编号根据如Kabat中的EU索引确定。在一些实施方案中,提供与缀合部分缀合的抗体,其中所述抗体包含N-糖基化的Fc区,其中所述缀合部分通过抗体的重链的位置295的受体谷氨酰胺残基与抗体缀合,且其中所述N-糖基化位点在重链的位置297,其中所述编号根据如Kabat中的EU索引确定。
在一些实施方案中,提供抗体-药物缀合物,其中抗体通过其上的内源性受体谷氨酰胺残基与缀合部分缀合,其中所述抗体-药物缀合物的Fc区是糖基化(例如N-糖基化)的。在一些实施方案中,所述抗体是人抗体。在一些实施方案中,所述抗体是人源化抗体。在一些实施方案中,所述抗体是嵌合抗体。在一些实施方案中,所述抗体是双特异性或多特异性抗体。在一些实施方案中,所述抗体是曲妥珠单抗。
在一些实施方案中,提供曲妥珠单抗-药物缀合物,其中曲妥珠单抗的Fc区是N-糖基化的,其中所述曲妥珠单抗通过侧接N-糖基化位点的内源性受体谷氨酰胺残基与缀合部分缀合。在一些实施方案中,提供曲妥珠单抗-药物缀合物,其中曲妥珠单抗位置297是 N-糖基化的,其中所述曲妥珠单抗通过位置295的内源性受体谷氨酰胺残基与缀合部分缀合,其中所述编号根据如Kabat中的EU索引确定。
在一些实施方案中,提供包含本文所述的含Fc融合多肽的组合物,其中所述组合物中至少部分(不一定是全部)含Fc融合多肽的 Fc区是糖基化(例如N-糖基化)的。例如,在一些实施方案中,提供包含抗体-药物缀合物的组合物,其中所述抗体-药物缀合物中,抗体通过其上的内源性受体谷氨酰胺残基与缀合部分缀合,且其中所述组合物中至少部分(例如至少约50%、60%、70%、80%、90%或95%中的任一种)的抗体-药物缀合物的 Fc区是糖基化(例如N-糖基化)的。在一些实施方案中,所述抗体是人抗体。在一些实施方案中,所述抗体是人源化抗体。在一些实施方案中,所述抗体是嵌合抗体。在一些实施方案中,所述抗体是双特异性或多特异性抗体。在一些实施方案中,所述抗体是曲妥珠单抗。
本文所述的缀合方法可制备含Fc多肽缀合物(诸如抗体-药物缀合物),其中含Fc多肽与缀合部分以一种特异的、可化学计量的方式缀合。如本文所使用,术语“特异性缀合”是指含Fc多肽(诸如抗体)与缀合部分在特定位点(即在Fc区侧接N-糖基化位点的受体谷氨酰胺残基)处的特异性缀合或交联。位点特异性可以通过各种技术(包括但不限于肽作图和蛋白测序)来确证。在一些实施方案中,含Fc多肽缀合物(诸如抗体-药物缀合物)上的缀合部分与含Fc多肽(诸如抗体)的摩尔比率为约1:1。在一些实施方案中,含Fc多肽缀合物(诸如抗体-药物缀合物)上的缀合部分与含Fc多肽(诸如抗体)的摩尔比率为约2:1。在一些实施方案中,所述组合物中至少约80%(诸如至少约85%、90%、95%或更高比例中任一种)的含Fc多肽缀合物(诸如抗体-药物缀合物)中,含Fc多肽(诸如抗体)与缀合部分的摩尔比率为约1:1。在一些实施方案中,所述组合物中至少约80%(诸如至少约85%、90%、95%或更高比例中任一种)的含Fc多肽缀合物(诸如抗体-药物缀合物)中,含Fc多肽(诸如抗体)与缀合部分的摩尔比率为约1:2。在一些实施方案中,所述组合物中至少约80%(诸如至少约85%、90%、95%或更高比例中任一种)的含Fc多肽缀合物(诸如抗体-药物缀合物)中,含Fc多肽(诸如抗体)与缀合部分的摩尔比率为约1:1或1:2。
本文所述的缀合部分可以是任何或直接或借助本文进一步描述的小分子柄与受体谷氨酰胺残基缀合的部分。所述缀合部分和所述受体谷氨酰胺残基之间的缀合是通过将缀合部分或小分子柄的胺供体基团与受体谷氨酰胺残基进行缀合来实现的。因此,含有胺供体基团的任何缀合部分均可以与含Fc多肽直接缀合。不含胺供体基团的任何缀合部分均可以通过含有胺供体基团的小分子柄与含Fc多肽间接缀合。
本文所使用的术语“胺供体基团”是指含有一个或多个反应性胺(例如,伯胺)的反应基。例如,所述缀合部分可以包含胺供体基团(例如,伯胺-NH2)、任选的接头和活性部分(例如,小分子)。所述缀合部分还可以是含有反应性Lys(例如,内源性Lys)的多肽或生物相容性聚合物。在一些实施方案中,所述胺供体基团是伯胺(-NH2),其提供转谷氨酰胺酶的底物,在受体谷氨酰胺处实现缀合部分与含Fc多肽的缀合。因此,所述供体谷氨酰胺和胺供体基团之间的连接可以是式―CH
在一些实施方案中,所述含Fc多肽和所述缀合部分通过接头连接。在一些实施方案中,所述接头是不可切割接头(non-cleavable linker)。合适的不可切割接头包括,但不限于,NH
在一些实施方案中,所述含Fc多肽和所述缀合部分通过可切割接头连接。合适的可切割接头包括,但不限于Lys―Phe―X、 Lys―Val―Cit―PABC―X、NH
其他示例性胺供体基团-接头包括,但不限于Ac-Lys-Gly、氨基己酸、Ac-Lys-β-Ala、氨基-PEG2(聚乙二醇)-C2、氨基-PEG3-C2、氨基-PEG6-C2、Ac-Lys-Val(缬氨酸)-Cit(瓜氨酸)-PABC (对氨基苄氧基羰基)、氨基己酰基-Val-Cit-PABC、腐胺和Ac-Lys-腐胺。
在一些实施方案中,所述缀合部分通过―NH―(C)
在一些实施方案中,所述接头是支链的。在一些实施方案中,所述接头是直链的。在一些实施方案中,所述接头具有多于一个(诸如2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20或更多个)用于连接活性部分的位点。这些活性部分可以是彼此相同或不同的。例如,所述缀合部分可以包含与多个活性部分(诸如药物分子)连接的基于聚缩醛的或基于聚缩醛衍生物的聚合物。
在一些实施方案中,所述缀合部分选自Alexa 488尸胺、5-FITC尸胺、Alexa 647尸胺、Alexa 350尸胺、5-TAMRA尸胺、5-FAM尸胺、SR101尸胺、5,6-TAMRA尸胺、5-FAM赖氨酸、Ac(乙酰基)-LysGly-MMAD (一甲基澳瑞他汀D)、氨基-PEG3 (聚乙二醇)-C2-MMAD、氨基-PEG6C2-MMAD、氨基-PEG3-C2-氨基-壬酰基-MMAD、氨基己酰基-Val(缬氨酸)-Cit(瓜氨酸)-PABC(对氨基苄氧基羰基)-MMAD、Ac-Lys-Val-Cit-PABC-MMAD、氨基己酰基-MMAD、Ac-Lys-β-Ala-MMAD、氨基-PEG2-C2-MMAE (一甲基澳瑞他汀E)、氨基己酰基-MMAE、氨基-PEG3-C2-MMAE、氨基己酰基-MMAF (一甲基澳瑞他汀F)、氨基己酰基-Val-Cit-PABC-MMAE、氨基己酰基-Val-Cit-PABC-MMAF、腐胺基(putrescinyl)-格尔德霉素和Ac-Lys-腐胺基-格尔德霉素。MMAE是指一甲基澳瑞他汀E或其衍生物。
在一些实施方案中,所述缀合部分是包含二胺的化合物。在一些实施方案中,所述化合物选自腐胺(丁烷-1,4-二胺)、乙二胺、尸胺(戊烷-1,5-二胺)、亚精胺、精胺、肼、1,3-二氨基丙烷、六亚甲基二胺、苯二胺、二甲苯二胺、二苯基乙二胺、1,8-二氨基萘及其立体异构体、等排物、类似物或衍生物。
在一些实施方案中,所述缀合部分是美登素衍生物,诸如图8中显示的MAY-PEG4或图9中显示的MAY-PVCL。
在一些实施方案中,所述缀合部分是MMAE衍生物,其包含不可切割的接头(诸如氨基-(CH
在一些实施方案中,提供曲妥珠单抗-药物缀合物,其中曲妥珠单抗的Fc区是N-糖基化的,其中所述曲妥珠单抗通过侧接N-糖基化位点的受体谷氨酰胺残基与包含至少一个MMAE(诸如1、2或更多个)的缀合部分缀合。在一些实施方案中,所述缀合部分是如图12中显示的PEGx-MMAE,其中x是选自2、4、6、8、10、12、16、20和24的整数。在一些实施方案中,所述缀合部分是如图12中显示的PEG3c-MMAE。在一些实施方案中,所述缀合部分包含两个MMAE和一个3-臂PEG接头。
在一些实施方案中,提供包含上述任何一种抗体-药物缀合物(其包含曲妥珠单抗-药物缀合物)的组合物。在一些实施方案中,所述组合物中,所述缀合部分中的活性部分(诸如药物,例如MMAE)与曲妥珠单抗之间的平均摩尔比率为约1:1、2:1或4:1中的任一种。在一些实施方案中,所述组合物中至少约80%(诸如至少约85%、90%、95%或更高比例中任一种)的曲妥珠单抗-药物缀合物中,缀合部分中的活性部分(诸如药物,例如MMAE)与曲妥珠单抗之间的摩尔比率为约2:1。在一些实施方案中,所述组合物中至少约80%(诸如至少约85%、90%、95%或更高比例中任一种)的曲妥珠单抗-药物缀合物中,缀合部分中的活性部分(诸如药物,例如MMAE)与曲妥珠单抗之间的摩尔比率为约4:1。
在一些实施方案中,所述含Fc多肽缀合物在体内施用至少约1天之后以约50%或更高比例存在于个体(例如,哺乳动物)中。在一些实施方案中,所述含Fc多肽缀合物在体内施用至少约2小时、2-6小时、6-12小时、12-18小时、18-24小时、1天、2天、3天、4天、5天、6天、1周或2周中任一种之后以约20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%或95%或更高比例中任一种存在于个体(例如,哺乳动物)中。
活性部分
在一些实施方案中,本文所述的缀合部分包含活性部分。在一些实施方案中,所述缀合部分中的活性部分为肽或多肽。在一些实施方案中,所述缀合部分中的活性部分为生物相容性聚合物。
在一些实施方案中,所述缀合部分中的活性部分为细胞毒性剂、免疫抑制剂或成像剂(例如,荧光团)。在一些实施方案中,所述细胞毒性剂是化疗剂。在一些实施方案中,所述活性部分是以下中任一种:改善含Fc多肽的药代动力学特性的部分、治疗部分和诊断部分。在一些实施方案中,所述活性部分是小分子。
在一些实施方案中,所述缀合部分中的活性部分为细胞毒性剂。细胞毒性剂的实例包括,但不限于蒽环霉素、澳瑞他汀、多拉司他汀、CC-1065、多卡霉素、烯二炔、格尔德霉素、美登素、嘌呤霉素、紫杉烷、长春花生物碱、SN-38、tubulysin、hemiasterlin及其立体异构体、等排物、类似物或衍生物。在一些实施方案中,所述缀合物部分包含单丹磺酰尸胺(MDC)。在一些实施方案中,所述缀合部分包含TAM1。在一些实施方案中,所述缀合部分包含一甲基澳瑞他汀E(MMAE)。
蒽环霉素类源自细菌链霉菌,并且已经广泛用于治疗各种癌症,诸如白血病、淋巴瘤、乳腺癌、子宫癌、卵巢癌和肺癌。示例性蒽环霉素类包括,但不限于柔红霉素、多柔比星(即,阿霉素)、表柔比星、伊达比星、戊柔比星和米托蒽醌。
多拉司他汀类及其肽类似物和衍生物奥瑞他汀类是已经显示具有抗癌和抗真菌活性的高度有效的抗有丝分裂剂。参见,例如,美国专利5,663,149和Pettit等人,Antimicrob. Agents Chemother. 42:2961-2965 (1998)。示例性多拉司他汀类和澳瑞他汀类包括,但不限于澳瑞他汀E、澳瑞他汀EB (AEB)、澳瑞他汀EFP (AEFP)、MMAD、MMAF、MMAE和5-苯甲酰戊酸-AE酯 (AEVB)。
多卡霉素和CC-1065是具有细胞毒性的DNA烷化剂。参见Boger和Johnson, PNAS92:3642-3649 (1995)。示例性多拉司他汀类和澳瑞他汀类包括,但不限于(+)-多卡霉素A和(+)-多卡霉素SA以及(+)-CC-1065。
烯二炔类是一类抗肿瘤细菌产品,其特征在于其具有九元和十元环或存在缀合的三-双-三键的环状系统。示例性烯二炔类包括,但不限于卡里奇霉素(calicheamicin)、埃斯培拉霉素(esperamicin)和dynemicin。
格尔德霉素类是结合Hsp90(热休克蛋白90)的苯醌安莎霉素抗生素,并且已经用作抗肿瘤药物。示例性格尔德霉素类包括但不限于17-AAG (17-N-烯丙基氨基-17-去甲氧基格尔德霉素)和17-DMAG (17-二甲基氨基乙基氨基-17-去甲氧基格尔德霉素)。
美登素类或其衍生物美登木素生物碱类通过在有丝分裂期间抑制微管蛋白聚合来抑制微管形成从而抑制细胞增殖。参见Remillard等人, Science 189:1002-1005(1975)。示例性美登素类和美登木素生物碱类包括但不限于mertansine(DM1)及其衍生物以及安丝菌素。
紫杉烷类是用作抗微管蛋白剂或有丝分裂抑制剂的二萜类。示例性紫杉烷类包括但不限于紫杉醇(例如,TAXOL®)和多西他赛(TAXOTERE®)。
长春花生物碱类也是抗微管蛋白剂。示例性长春花生物碱类包括但不限于长春新碱、长春碱、长春地辛和长春瑞滨。
在一些实施方案中,所述缀合部分中的活性部分为免疫抑制剂。免疫抑制剂的实例包括,但不限于gancyclovier、依那西普、他克莫司、西罗莫司、voclosporin、环孢菌素、雷帕霉素、环磷酰胺、硫唑嘌呤、霉酚酸酯(mycophenolgate mofetil)、甲氨蝶呤和糖皮质激素及其类似物。
在一些实施方案中,所述缀合部分中的活性部分为成像剂(例如,荧光团),诸如荧光素、罗丹明、镧系元素磷光体及其衍生物。荧光团类的实例包括,但不限于异硫氰酸荧光素(FITC)(例如,5-FITC)、amidite荧光素(FAM)(例如,5-FAM)、曙红、羧基荧光素、赤藓红、Alexa Fluor
在一些实施方案中,所述缀合部分中的活性部分为多肽。在一些实施方案中,所述多肽是抗体,诸如人源化、人、嵌合或鼠单克隆抗体。
在一些实施方案中,所述缀合部分中的活性部分为毒素多肽(或毒素蛋白)。毒素多肽的实例包括,但不限于白喉毒素(diphtheria) A链、白喉毒素的非结合活性片段、外毒素A链、蓖麻毒素A链、相思豆毒素A链、蒴莲根毒素A链、α-帚曲毒蛋白、油桐蛋白类(Aleurites fordii proteins)、石竹素蛋白类、美洲商陆(Phytolaca americana)蛋白类(PAPI、PAPII和PAP-S)、苦瓜(momordica charantia)抑制剂、麻风树毒蛋白、巴豆毒素、肥皂草(sapaonaria officinalis)抑制剂、白树毒素、mitogellin、局限曲菌素、酚霉素(phenomycin)、伊诺霉素(enomycin)、单端孢霉烯族毒素(tricothecene)、抑制剂胱氨酸结(ICK)肽类(例如,ceratotoxins)和芋螺毒素(例如,KIIIA或SmIIIa)。
在一些实施方案中,所述缀合部分包含标记物,诸如放射性同位素。放射性同位素或其他标记物的实例包括,但不限于3H、14C、15N、35S、18F、32P、33P、64Cu、68Ga、89Zr、90Y、99Tc、123I、124I、125I、131I、111In、131In、153Sm、186Re、188Re、211At、212Bi和153Pb。
在一些实施方案中,所述缀合部分包含选自以下的活性部分:Alexa 488尸胺、5-FITC尸胺、Alexa 647尸胺、Alexa 350尸胺、5-TAMRA尸胺、5-FAM尸胺、SR101尸胺、5,6-TAMRA尸胺、5-FAM赖氨酸、Ac-Lys-Gly-MMAD、氨基-PEG3-C2-MMAD、氨基-PEG6-C2-MMAD、氨基-PEG3-C2-氨基-壬酰基-MMAD]、氨基己酰基-Val-Cit-PABC-MMAD、Ac-Lys-β-Ala-MMAD、氨基己酰基-MMAD、Ac-Lys-Val-Cit-PABC-MMAD、氨基己酰基-MMAE、氨基-PEG3-C2-MMAE、氨基-PEG2-C2-MMAE、氨基己酰基-MMAF、氨基己酰基-Val-Cit-PABC-MMAE、氨基己酰基-Val-Cit-PABC-MMAF、氨基-PEG2-C2-MMAF、氨基-PEG3-C2-MMAF、腐胺基-格尔德霉素和Ac-Lys-腐胺基-格尔德霉素。在一些实施方案中,所述胺供体剂是氨基己酰基-Val-Cit-PABC-MMAE、氨基己酰基-Val-Cit-PABC-MMAF、Ac-Lys-腐胺基-格尔德霉素、Ac-Lys-β-Ala-MMAD、Ac-Lys-Val-Cit-PABC-MMAD、氨基己酰基-Val-Cit-PABC-MMAD和氨基-PEG6-C2-MMAD。
在一些实施方案中,所述缀合部分中的活性部分为生物相容性聚合物。所述含Fc多肽可以与生物相容性聚合物缀合以改善含Fc多肽的生物学性质,例如增加血清半衰期和提高生物活性,和/或延长体内半衰期。生物相容性聚合物的实例包括水溶性聚合物,诸如聚乙二醇(PEG)或其衍生物和含有两性离子的生物相容性聚合物(例如,含有磷酸胆碱的聚合物)。
制备含Fc多肽缀合物的方法
在另一个方面,本申请提供使用野生型或工程改造的转谷氨酰胺酶制备含Fc多肽缀合物(诸如抗体-药物缀合物)的方法。
本发明人设计的工程改造的TGase,用于催化缀合部分与含Fc多肽(诸如抗体)在其Fc区的受体谷氨酰胺残基处的特异性缀合反应,所述受体谷氨酰胺残基侧接Fc区的N-糖基化位点。现有技术认为Fc区上侧接N-糖基化位点的谷氨酰胺残基无法被TGase识别并与之结合,与该观点相反,本发明人惊奇地发现,在特定反应条件(例如特定浓度的酶)下,野生型TGase也可催化缀合部分与Fc区上侧接N-糖基化位点的受体谷氨酰胺残基之间的缀合反应,该反应是特异的和可化学计量的。
在一些实施方案中,本文所述的方法涉及一步缀合步骤。此类方法特别适用于,例如,当缀合产率为20-98%之间,足以产生大量含Fc多肽缀合物时的情形。一步缀合法同样适用于下列情形:需要尽可能减小接头的大小,含Fc多肽的供应充足,药物溶解度适中(例如约100 mg/L),更多地关注节省时间而非获得高产率。
在一些实施方案中,所述方法涉及两个步骤。首先,在TGase的作用下,将小分子柄与含Fc多肽缀合以生成中间体缀合物。随后,将活性部分共价或非共价地偶联至中间体缀合物的小分子柄上。可以根据所要偶联的活性部分定制相应的小分子柄,因此任何种类的活性部分均可与含Fc多肽缀合。两步缀合法尤其适用于下列情形:含Fc多肽和/或活性部分的量有限,活性部分(诸如毒素)具有低水溶性和/或易诱导多肽聚集。通过使用小分子柄,第一步的酶促偶联步骤中可以产生高产量的缀合物。第二步的化学选择性偶联步骤仅需活性部分:含Fc多肽的反应比为1.2至1.5。这使得两步法的总缀合效率比一步法更高。
因此,在一些实施方案中,提供制备含Fc多肽缀合物的方法,其中含Fc多肽与缀合部分特异性缀合,其包括:在转谷氨酰胺酶存在的情况下,在足以生成含Fc多肽缀合物的条件下,使含Fc多肽与缀合部分反应,其中所述含Fc多肽包含N-糖基化的Fc区,其中所述N-糖基化的Fc区包含侧接N-糖基化位点的受体谷氨酰胺残基,且其中所述缀合部分通过该受体谷氨酰胺残基与含Fc多肽缀合。在一些实施方案中,提供制备含Fc多肽缀合物的方法,其中含Fc多肽与缀合部分特异性缀合,其包括:在转谷氨酰胺酶存在的情况下,在足以生成含Fc多肽缀合物的条件下,使含Fc多肽的组合物与缀合部分反应,其中至少部分(例如,至少约50%、60%、70%、80%、90%或更高比例)含Fc多肽包含N-糖基化的Fc区,其中所述Fc区包含侧接N-糖基化位点的受体谷氨酰胺残基,且其中所述缀合部分通过该受体谷氨酰胺残基与含Fc多肽缀合。
在一些实施方案中,提供制备抗体-药物缀合物的方法,所述抗体-药物缀合物中,抗体与缀合部分特异性缀合,所述方法包括:在转谷氨酰胺酶存在的情况下,在足以生成抗体-药物缀合物的条件下,使抗体与缀合部分反应,其中所述抗体的Fc区是糖基化(例如,N-糖基化)的,且其中所述缀合部分与抗体上的内源性受体谷氨酰胺残基缀合。在一些实施方案中,提供制备抗体-药物缀合物的方法,所述抗体-药物缀合物中,抗体与缀合部分特异性缀合,所述方法包括:在转谷氨酰胺酶存在的情况下,在足以生成抗体-药物缀合物的条件下,使含抗体组合物与缀合部分反应,其中所述组合物中至少部分 (例如,至少约50%、60%、70%、80%、90%或更高比例)抗体的 Fc区是糖基化的,且其中所述缀合部分与抗体上的内源性受体谷氨酰胺残基缀合。
在一些实施方案中,提供制备含Fc多肽缀合物的方法,其中含Fc多肽与缀合部分特异性缀合,所述缀合部分包含一个小分子柄和一个活性中心,所述方法包括:a)在转谷氨酰胺酶存在的情况下,在足以生成含Fc多肽-小分子柄中间体缀合物的条件下,使含Fc多肽与小分子柄反应,其中含Fc多肽与小分子柄特异性缀合,和b)将所述中间体缀合物与活性部分反应,由此获得含Fc多肽缀合物,其中所述含Fc多肽包含N-糖基化的Fc区,其中所述N-糖基化的Fc区包含侧接N-糖基化位点的受体谷氨酰胺残基,且其中所述缀合部分通过该受体谷氨酰胺残基与含Fc多肽缀合。在一些实施方案中,提供制备含Fc多肽缀合物的方法,其中含Fc多肽与缀合部分特异性缀合,所述缀合部分包含一个小分子柄和一个活性中心,所述方法包括:a)在转谷氨酰胺酶存在的情况下,在足以生成含Fc多肽-小分子柄中间体缀合物的条件下,使含Fc多肽的组合物与小分子柄反应,其中含Fc多肽与小分子柄特异性缀合,和b)将所述中间体缀合物与活性部分反应,由此获得含Fc多肽缀合物,其中至少部分(例如,50%、60%、70%、80%、90%或更多)含Fc多肽包含N-糖基化的Fc区,其中所述Fc区包含侧接N-糖基化位点的受体谷氨酰胺残基,且其中所述缀合部分通过该受体谷氨酰胺残基与含Fc多肽缀合。
在一些实施方案中,提供制备抗体-药物缀合物的方法,所述抗体-药物缀合物中,抗体与缀合部分特异性缀合,所述缀合部分包含一个小分子柄和一个活性中心,所述方法包括:a)在转谷氨酰胺酶存在的情况下,在足以抗体-小分子柄中间体缀合物的条件下,使抗体与小分子柄反应,其中抗体与小分子柄特异性缀合,和b)使所述中间体缀合物与活性部分反应,由此获得抗体-药物缀合物,其中所述抗体的Fc区是糖基化(例如,N-糖基化)的,且其中所述缀合部分与抗体上的内源性受体谷氨酰胺残基缀合。在一些实施方案中,提供制备抗体-药物缀合物的方法,所述抗体-药物缀合物中,抗体与缀合部分特异性缀合,所述缀合部分包含一个小分子柄和一个活性中心,所述方法包括:a)在转谷氨酰胺酶存在的情况下,在足以生成抗体-小分子柄中间体缀合物的条件下,使含抗体组合物与小分子柄反应,其中抗体与小分子柄特异性缀合,和b)使所述中间体缀合物与活性部分反应,由此获得抗体-药物缀合物,其中所述组合物中至少部分(例如,至少约50%、60%、70%、80%、90%或更高比例中任一种)抗体的 Fc区是糖基化(例如,N-糖基化)的,且其中所述缀合部分与抗体上的内源性受体谷氨酰胺残基缀合。
本文所述的小分子柄通常具有-NH
本文所述的其他合适的小分子柄包括,但不限于NH
TGase催化的反应可以持续几小时至一天(例如过夜)。当缀合部分或小分子柄的配体浓度为400至600 μmol/L时,其可与含Fc多肽(例如,1 mg/mL)反应,其中配体60-90倍过量于含Fc的多肽,或任选地较低倍数过量于含Fc的多肽,例如, 1至20倍,或10-20倍。所述反应可以在37℃下不含钾的磷酸盐缓冲盐水(PBS;pH 8)中进行。4小时至几天之后,达到稳态。然后使用离心-透析(VIVASPIN® MWCO 50 kDa, Vivascience, Winkel,Switzerland)或渗滤(PELLICON® MWMCO 50kDa, Millipore)去除过量的配体和酶。可以通过HPLC监测反应。
可以使用任何合适的方法分析所得的含Fc多肽缀合物。例如,可以使用液相色谱质谱法(LC/MS),采用上-下方法表征缀合多肽的化学计量,以确定与抗体缀合的缀合部分或小分子柄的数目,特别是组合物的同质性。可以在LC/MS分析之前还原缀合物,然后分别测量轻链和重链。
在一个实施方案中,可分析所述产物的载药量(例如每个含Fc多肽缀合物中活性部分的数目)。此类方法可用于确定每个含Fc多肽对应的缀合物或活性部分(诸如药物)的平均数目以及组合物中每个抗体对应的缀合物或活性部分(诸如药物)的数目的分布,即具有任何给定水平的载药量或DAR的总抗体所占百分比。上述方法也可以测定具有一定数目(n)的缀合了其他部分的受体谷氨酰胺(例如,n=1、2、3、4、5、6等)的抗体。适于此类测定,更通常适用于载药量测定的一种技术是疏水相互作用色谱法(HIC),HIC的操作步骤可以参考例如Hamblett等人(2004) Cancer Res.10:7063-7070;Wakankar等人(2011) mAbs 3(2):161-172;和Lyon等人(2012) Methods in Enzymology, Vol. 502:123-138(其公开内容通过引用并入本文)。
可以通过控制缀合反应中的转谷氨酰胺酶和含Fc多肽之间的摩尔比率,以保证有效的转谷氨酰胺反应。例如,在一些实施方案中,所述转谷氨酰胺酶和所述含Fc多肽(诸如,抗体或含抗体组合物)的摩尔比率为约10:1至约1:100,包括约10:1至约9:1、约9:1至约8:1、约8:1至约7:1、约7:1至约6:1、约6:1至约5:1、约5:1至约4:1、约4:1至约3:1、约3:1至约2:1、约2:1至约1:1、约1:1至约1:2、约1:2至约1:3、约1:3至约1:4、约1:4至约1:5、约1:5至约1:6、约1:6至约1:7、约1:7至约1:8、约1:8至约1:9、约1:9至约1:10、约1:10至约1:20、约1:20至约1:30、约1:30至约1:40、约1:40至约1:50、约1:50至约1:60、约1:60至约1:70、约1:70至约1:80、约1:80至约1:90或约1:90至约1:100中任一种。
可以通过控制所述反应混合物中的转谷氨酰胺酶的量以保证有效的转谷氨酰胺酶反应。例如,在一些实施方案中,所述反应混合物中的转谷氨酰胺酶的浓度为约0.01 mg/ml至约5 mg/ml中任一种,包括例如约0.01 mg/ml至约0.02 mg/ml、约0.02 mg/ml至约0.03mg/ml、约0.03 mg/ml至约0.04 mg/ml、约0.04 mg/ml至约0.05 mg/ml、约0.05 mg/ml至约0.06 mg/ml、约0.06 mg/ml至约0.07 mg/ml、约0.07 mg/ml至约0.08 mg/ml、约0.08 mg/ml至约0.09 mg/ml、约0.09 mg/ml至约0.1 mg/ml、约0.1 mg/ml至约0.2 mg/ml、约0.2 mg/ml至约0.3 mg/ml、约0.3 mg/ml至约0.4 mg/ml、约0.4 mg/ml至约0.5 mg/ml、约0.5 mg/ml至约0.6 mg/ml、约0.6 mg/ml至约0.7 mg/ml、约0.7 mg/ml至约0.8 mg/ml、约0.8 mg/ml至约0.9 mg/ml、约0.9 mg/ml至约1 mg/ml、约1 mg/ml至约2 mg/ml、约2 mg/ml至约3 mg/ml、约3 mg/ml至约4 mg/ml、约4 mg/ml至约5 mg/ml中任一种。在一些实施方案中,所述反应混合物中的转谷氨酰胺酶的浓度为约0.05 mg/ml至约1 mg/m1,诸如约0.2 mg/ml至约1 mg/ml。
在一些实施方案中,转谷氨酰胺反应在固体支持物上进行。例如,所述含Fc多肽(诸如抗体)可以连接至固体支持物。然后使缀合反应的其余组分与固体支持物上的含Fc多肽反应,随后去除。或者,所述转谷氨酰胺酶可以连接至固体支持物。然后使缀合反应的其余组分与固体支持物上的转谷氨酰胺酶反应,随后与固体支持物上的转谷氨酰胺酶分离。
可用于本文所述的方法的固体支持物包括,例如,板、管、瓶、烧瓶、磁珠、磁性片材、多孔基质或任何固体表面等。可用于将TGase或含Fc多肽连接至固体支持物的试剂或分子包括,但不限于凝集素、抗生物素蛋白/生物素、无机或有机连接分子。物理分离可以通过,例如过滤、分离、磁场、离心、洗涤等来实现。
在一些实施方案中,所述固体支持物是珠粒、膜、滤筒、过滤器、微量滴定板、试管、固体粉末、铸造或挤压模制模块、网眼(mesh)、纤维、磁性颗粒复合材料或任何其他固体材料。所述固体支持物可以用物质诸如聚乙烯、聚丙烯、聚(4-甲基丁烯)、聚苯乙烯、聚丙烯酸酯、聚对苯二甲酸乙二酯、人造丝、尼龙、聚(丁酸乙烯酯)、聚偏氟乙烯(PCDF)、聚硅氧烷类、多聚甲醛、纤维素、醋酸纤维素、硝酸纤维素等包被。在一些实施方案中,所述固体支持物可以用配体包被或用配体浸渍。
在一些实施方案中,所述固体支持物是磁珠。在一些实施方案中,所述磁珠的平均大小约为1-200微米、诸如约1-2微米、2-10微米、10-30微米、30-50微米、50-100微米和10-200微米中任一种。在一些实施方案中,所述磁珠是单分散的。在一些实施方案中,所述磁珠是被包被的,例如用蛋白A包被。
可用于本文所述方法中的其他固体支持物包括,但不限于明胶、玻璃、琼脂糖(sepharose)大珠、葡聚糖微载体诸如CYTODES® (Pharmacia, Uppsala, Sweden)。还可考虑多糖诸如琼脂糖、藻酸盐、角叉菜胶、壳多糖、纤维素、葡聚糖或淀粉、聚丙烯酰胺、聚苯乙烯、聚丙烯醛、聚乙烯醇、聚甲基丙烯酸酯、全氟化碳、无机化合物诸如二氧化硅、玻璃、硅藻土(kieselquhr)、氧化铝、氧化铁或其他金属氧化物或由任何两种或更多种天然存在的聚合物、合成聚合物或无机化合物组合而成的共聚物。
可以通过控制反应混合物中的转谷氨酰胺酶的量(即,当树脂用作固体支持物时每ml树脂中含有的量)以确保有效的转谷氨酰胺酶反应。例如,在一些实施方案中,反应混合物中的转谷氨酰胺酶的浓度(每ml树脂中含有的量)为约0.01 mg/ml至约1 mg/ml中任一种,包括例如约0.01 mg/ml至约0.02 mg/ml、约0.02 mg/ml至约0.03 mg/ml、约0.03 mg/ml至约0.04 mg/ml、约0.04 mg/ml至约0.05 mg/ml、约0.05 mg/ml至约0.06 mg/ml、约0.06mg/ml至约0.07 mg/ml、约0.07 mg/ml至约0.08 mg/ml、约0.08 mg.ml至约0.09 mg/ml、约0.09 mg/ml至约0.1 mg/ml、约0.1 mg/ml至约0.2 mg/ml、约0.2 mg/ml至约0.3 mg/ml、约0.3 mg/ml至约0.4 mg/ml、约0.4 mg/ml至约0.5 mg/ml、约0.5 mg/ml至约0.6 mg/ml、约0.6 mg/ml至约0.7 mg/ml、约0.7 mg/ml至约0.8 mg/ml、约0.8 mg/ml至约0.9 mg/ml、约0.9 mg/ml至约1 mg/ml中任一种。
在一些实施方案中,所述缀合部分和所述含Fc多肽(诸如抗体)之间的浓度比率为约2:1至约800:1,包括但不限于约2:1、3:1、4:1、5:1、6:1、7:1、8:1、9:1、10:1、15:1、20:1、25:1、30:1、35:1、40:1、45:1、50:1、60:1、70:1、80:1、90:1、100:1、200:1、300:1、400:1、500:1、600:1、700:1和800:1中任一种。
在一些实施方案中,所述含Fc多肽(诸如抗体)和所述缀合部分的缀合效率至少约为30%。如本文所使用,术语“缀合效率”或“交联效率”是工程改造的多肽缀合物的实验测定值除以最大预估值得到的比率。缀合效率或交联效率可以通过本领域技术人员众所周知的各种技术(诸如疏水相互作用色谱法)测定。缀合效率还可以在不同温度诸如室温或37℃下测定。在一些实施方案中,所述含Fc多肽和所述缀合部分的缀合效率至少约为30%-35%、35%-40%、45%-50%、50%-55%、56%-60%、61%-65%、66%-70%、71%-75%、76%-80%、81%-85%、86%-90%、91%-95%或96%-99%中任一种。在一些实施方案中,所述含Fc多肽和所述缀合部分的缀合效率至少约为32%、34%、36%、38%、40%、42%、44%、46%、48%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或99%中任一种。
TGase通过催化一种蛋白的供体赖氨酸残基和另一种蛋白的受体谷氨酰胺残基之间形成蛋白酶抗性的异肽键来实现蛋白的共价交联,并伴随着氨的释放。转谷氨酰胺酶的催化机理如下所述。在含有谷氨酰胺的第一底物(受体或Q底物)结合酶之后,其与TGase的活性中心中的半胱氨酸残基形成γ-谷氨酰硫酯,称为酰基酶中间体,伴随着氨的释放。然后第二底物(供体或K-底物)结合酰基酶中间体并攻击硫酯键,形成并释放产物(通过Nε(γ-谷氨酰基)赖氨酸异肽桥(isopetide bridge)交联的两个蛋白)。这重新建立了初始形式的酶的活性中心的Cys残基,并可参与另一个催化循环。现有技术认为共价酰基酶中间体的形成是这些反应的限速步骤。许多转谷氨酰胺酶的催化三联体是木瓜蛋白酶样的,其含有Cys-His-Asp(其中His是组氨酸,且Asp是天冬氨酸)和至关重要的一个与活性中心Cys相距36个残基的色氨酸(Trp)残基。相反,从链轮丝菌属种(
现有技术已经公开了来自各种活生物体(包括微生物)的几种类型的转谷氨酰胺酶,如来自豚鼠肝脏(GTGase)、鱼肝(FTGase)和微生物(mTGase)的TGase和任何重组的TGase(rTGase)。本发明也可以使用除了此处列出的TGase以外的其他TGase。有价值的TGase的实例包括微生物转谷氨酰胺酶,例如来自美国专利5,156,956中公开的茂原链霉菌(
拉达卡链霉菌(
用于本文所述的方法中的转谷氨酰胺酶可以从多种途径获得或制备。在一些实施方案中,所述转谷氨酰胺酶是钙依赖性转谷氨酰胺酶,其需要钙诱导酶构象变化并激活酶活性。例如,源自豚鼠肝脏,并通过商业途径(例如,Sigma-Aldrich (St Louis, Mo.)和MPBiomedicals (Irvine, Calif.))获得的GTase。在一些实施方案中,所述转谷氨酰胺酶是非钙依赖性转谷氨酰胺酶,其不需要钙诱导酶构象变化并激活酶活性。在一些实施方案中,所述转谷氨酰胺酶是源自微生物基因组的微生物转谷氨酰胺酶,诸如来自链轮丝菌属或链霉菌属(
合适的TGase包括,但不限于细菌转谷氨酰胺酶(BTG),诸如EC索引号为EC2.3.2.13的酶(蛋白-谷氨酰胺-γ-谷氨酰转移酶)。在一些实施方案中,TGase来自拉达卡链霉菌(TG_SL,SEQ ID NO:16,参见图2)。在一些实施方案中,TGase来自茂原链霉菌(TG-SM,SEQ ID NO:18,参见图2)。在一些实施方案中,TGase是来自拉达卡链霉菌的的重组TGase (TG_SL,SEQ ID NO:17,参见图3)。
在一些实施方案中,本文所述的方法中使用的转谷氨酰胺酶是使用重组技术制备的重组蛋白。
在一些实施方案中,所述转谷氨酰胺酶是野生型,例如具有SEQ ID NO:16的序列的TGase。在一些实施方案中,所述转谷氨酰胺酶是重组野生型TGase,其包含SEQ ID NO:16的序列,其中所述重组野生型TGase进一步包含N-末端的一个额外的脯氨酸和一个任选的纯化标签(诸如多组氨酸标签)。在一些实施方案中,所述转谷氨酰胺酶是具有SEQ ID NO:17的序列的重组野生型TGase,如图3中所示。与本领域的一般理解(野生型转谷氨酰胺酶不能催化侧接N-糖基化位点的受体谷氨酰胺处的转谷氨酰胺反应)相反,本发明人惊奇地发现,此类反应可以在本文所述的某些条件下高效和特异地进行。
在一些实施方案中,所述转谷氨酰胺酶是工程改造的。在一些实施方案中,所述转谷氨酰胺酶是工程改造的转谷氨酰胺酶,其专门设计用于催化靠近N-糖基化位点的受体谷氨酰胺处的转谷氨酰胺反应。下面进一步详细描述此类工程改造的转谷氨酰胺酶。
在一些实施方案中,所述转谷氨酰胺酶是纯化的蛋白。例如,在一些实施方案中,所述转谷氨酰胺酶纯度至少约为50%。如本文所使用,“纯的(pure)”或“纯化的(purified)”蛋白是指不含其他杂质蛋白的蛋白(例如,转谷氨酰胺酶)。在一些实施方案中,所述转谷氨酰胺酶的纯度为至少约55%-60%、60%-65%、65%-70%、70%-75%、75%-80%、80%-85%、85%-90%、90%-95%、95%-98%或99%中任一种。在一些实施方案中,所述转谷氨酰胺酶的纯度为至少约50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%中任一种。
工程改造的转谷氨酰胺酶
本申请在另一个方面提供工程改造的转谷氨酰胺酶,其专门设计用于催化靠近N-糖基化位点的受体谷氨酰胺处的转谷氨酰胺反应。我们通过改造TGase的底物结合口袋,增加了Fc区上的谷氨酰胺残基(具体地,Q295)对TGase的催化残基Cys64的可及性(图3),并获得特异性催化Q295处的转谷氨酰胺反应的工程改造的TGase。
在一些实施方案中,所述工程改造的TGase基于来自拉达卡链霉菌的野生型TGase(SEQ ID NO:16或SEQ ID NO:17)。在一些实施方案中,所述工程改造的TGase基于来自茂原链霉菌的野生型TGase(SEQ ID NO:18)。从拉达卡链霉菌分离的TGase的序列与来自茂原链霉菌的TGase序列除22个氨基酸的差异外,其余序列相同(Yi-Sin Lin等人, ProcessBiochemistry 39(5), 591-598 (2004)。
在一些实施方案中,所述工程改造的转谷氨酰胺酶催化N-糖基化的Fc区的受体谷氨酰胺位点处的特异性转谷氨酰胺反应。在本文中使用的术语“特异性”是指与含Fc多肽(诸如抗体)上的其他特定谷氨酰胺残基相比,TGase与N-糖基化的Fc区处的一个或多个特定谷氨酰胺残基反应的优先性。
因此,例如,在一些实施方案中,提供能够催化含Fc多肽(诸如抗体)与缀合部分进行缀合的工程改造的转谷氨酰胺酶,其中所述含Fc多肽(诸如抗体)包含N-糖基化的Fc区,其中所述N-糖基化的Fc区包含侧接N-糖基化位点的受体谷氨酰胺残基,反应后,所述缀合部分通过该受体谷氨酰胺残基与含Fc多肽(诸如抗体)缀合,且在相同反应条件下,所述工程改造的GTase比野生型转谷氨酰胺酶的催化活性高至少约10%。在一些实施方案中,所述工程改造的TGase与SEQ ID NO:16具有至少约80%同一性,且进一步包含至少一个突变(诸如取代、缺失或插入)。
在一些实施方案中,提供工程改造的转谷氨酰胺酶,其包含与SEQ ID NO:16具有至少约80%(包括,例如,至少约85%、90%、95%或95%中任一种)同一性的氨基酸序列,其中所述转谷氨酰胺酶包含选自以下的缺失突变:D1-E4、P244-P247和H279-H289。在一些实施方案中,提供工程改造的转谷氨酰胺酶,其包含一个或多个选自以下的缺失突变:D1-E4、P244-P247和H279-H289,其余序列与SEQ ID NO:16 的序列100%相同。
在一些实施方案中,提供工程改造的转谷氨酰胺酶,其包含与SEQ ID NO:17具有至少约80%(包括,例如,至少约85%、90%、95%或95%中任一种)同一性的氨基酸序列,其中所述转谷氨酰胺酶包含选自以下的缺失突变:P1-E5、P245-P248和H280-H290。在一些实施方案中,提供工程改造的转谷氨酰胺酶,其包含一个或多个选自以下的缺失突变:P1-E5、P245-P248和H280-H290,其余序列与SEQ ID NO:17 的序列100%相同。
在一些实施方案中,提供工程改造的转谷氨酰胺酶,其包含与SEQ ID NO:16具有至少约80%(包括,例如,至少约85%、90%、95%或95%中任一种)同一性的氨基酸序列,其中所述转谷氨酰胺酶包含选自以下的突变:D1-E4的缺失突变、P244-P247的缺失突变、N282-L285的缺失突变、用G取代H279-A287和用G取代A280-H289。在一些实施方案中,提供工程改造的转谷氨酰胺酶,其包含一个或多个选自以下的突变:D1-E4的缺失突变、P244-P247的缺失突变、N282-L285的缺失突变、用G取代H279-A287和用G取代A280-H289,其余序列与SEQ ID NO:16 的序列100%相同。
在一些实施方案中,提供工程改造的转谷氨酰胺酶,其包含与SEQ ID NO:17具有至少约80%(包括,例如,至少约85%、90%、95%或95%中任一种)同一性的氨基酸序列,其中所述转谷氨酰胺酶包含选自以下的突变:P1-E5的缺失突变、P245-P248的缺失突变、N283-L286的缺失突变、用G取代H280-A288和用G取代A281-H290。在一些实施方案中,提供工程改造的转谷氨酰胺酶,其包含一个或多个选自以下的突变:P1-E5的缺失突变、P245-P248的缺失突变、N283-L286的缺失突变、用G取代H280-A288和用G取代A281-H290,其余序列与SEQ ID NO:17的序列 100%相同。
在一些实施方案中,提供工程改造的转谷氨酰胺酶,其包含D1-E4的缺失突变,其他序列与SEQ ID NO:16 的序列100%相同。在一些实施方案中,提供工程改造的转谷氨酰胺酶,其包含P244-P247的缺失突变,其余序列与SEQ ID NO:16 的序列100%相同。在一些实施方案中,提供工程改造的转谷氨酰胺酶,其包含H279-H289的缺失突变,其余序列与SEQID NO:16 的序列100%相同。在一些实施方案中,提供工程改造的转谷氨酰胺酶,其包含N282-L285的缺失突变,其余序列与SEQ ID NO:16的序列 100%相同。在一些实施方案中,提供工程改造的转谷氨酰胺酶,其包含D1-E4的缺失突变和N282-L285的缺失突变,其余序列与SEQ ID NO:16的序列 100%相同。在一些实施方案中,提供工程改造的转谷氨酰胺酶,其包含D1-E4的缺失突变、P244-P247的缺失突变和N282-L285的缺失突变,其余序列与SEQID NO:16的序列 100%相同。在一些实施方案中,提供工程改造的转谷氨酰胺酶,其包含D1-E4的缺失突变和用G取代H280-A288的突变,其余序列与SEQ ID NO:16的序列 100%相同。在一些实施方案中,提供工程改造的转谷氨酰胺酶,其包含D1-E4的缺失突变和用G取代A280-H289的突变,其余序列与SEQ ID NO:16的序列 100%相同。
在一些实施方案中,提供工程改造的转谷氨酰胺酶,其包含P1-E5的缺失突变,其余序列与SEQ ID NO:17的序列 100%相同。在一些实施方案中,提供工程改造的转谷氨酰胺酶,其包含P245-P248的缺失突变,其余序列与SEQ ID NO:17的序列 100%相同。在一些实施方案中,提供工程改造的转谷氨酰胺酶,其包含H280-H290的缺失突变,其余序列与SEQID NO:17 的序列100%相同。在一些实施方案中,提供工程改造的转谷氨酰胺酶,其包含N283-N286的缺失突变,其余序列与SEQ ID NO:17的序列 100%相同。在一些实施方案中,提供工程改造的转谷氨酰胺酶,其包含P1-E5的缺失突变和N283-N286的缺失突变,其余序列与SEQ ID NO:17的序列 100%相同。在一些实施方案中,提供工程改造的转谷氨酰胺酶,其包含P1-E5的缺失突变、P245-P248的缺失突变和N283-N286的缺失突变,其余序列与SEQID NO:17的序列 100%相同。在一些实施方案中,提供工程改造的转谷氨酰胺酶,其包含P1-E5的缺失突变和用G取代H280-A288突变,其余序列与SEQ ID NO:17的序列 100%相同。在一些实施方案中,提供工程改造的转谷氨酰胺酶,其包含P1-E5的缺失突变和用G取代A281-H290突变,其余序列与SEQ ID NO:17 100%相同。
本文可互换使用的术语“序列同一性”或“同一性”是指肽之间的序列相关性程度,如可通过比较两个或更多个氨基酸残基串之间的氨基酸匹配数目来确定。序列同一性可以例如通过比较两个或更多个序列中较小序列之间的相同匹配数所占百分比来测定,其是借助特定数学模型或计算机程序(即“算法”)进行缺口比对(如果有的话)来实现的。一些设计的确定同一性的方法给出的是待测试序列之间的最大匹配值。测定同一性的方法已记载于可公开获得的计算机程序中。测定两个序列之间的同一性的示例性计算机程序方法包括GCG程序包,包括GAP(Devereux等人, Nucl. Acid. Res. 12, 387 (1984);GeneticsComputer Group, University of Wisconsin, Madison, Wis.)、BLASTP、BLASTN和FASTA(Altschul等人, J. Mol. Biol. 215, 403-410 (1990))。国家生物技术信息中心(National Center for Biotechnology Information, NCBI)和其他资源(BLAST Manual,Altschul等人 NCB/NLM/NIH Bethesda, Md. 20894;Altschul等人,同上) 已公开BLASTX程序。众所周知的Smith Waterman算法也可以用于测定同一性。
在一些实施方案中,所述工程改造的转谷氨酰胺酶比SEQ ID NO:16或SEQ ID NO:18编码的TGase具有更高的转谷氨酰胺酶活性。在一些实施方案中,所述工程改造的转谷氨酰胺酶比野生型TGase(诸如SEQ ID NO:16或SEQ ID NO:17编码的TGase)的特异性活性高至少约1.25倍、1.5倍、2.0倍、2.5倍、3.0倍、3.5倍、4.0倍、4.5倍、5.0倍、5.5倍、6.0倍、6.5倍、7.0倍、7.5倍、8.0倍、8.5倍、9.0倍、9.5倍或10.5倍。
可以使用本领域已知的测定法分析本文所述的工程改造的TGase的活性。例如,US5,156,956公开了一种测定给定肽的活性的方法:在无Ca
本文还提供编码本文所述的任一种工程改造的TGase的核酸(诸如分离的核酸)。如本文所使用,术语“核酸”指cDNA、基因组DNA、合成DNA或RNA来源的任何核酸分子。所述核酸可以是单链或双链的,并且其可具有编码目标蛋白的天然核苷酸序列的全部或部分核苷酸序列。所述核酸任选地可含有其他核酸区段。
本文还提供包含编码本文所述的工程改造的TGase的核酸的重组载体(诸如扩增载体和/或表达载体)。在一些实施方案中,提供包含所述重组载体的宿主细胞。
包含编码工程改造的TGase的核酸的重组载体可以是便于通过重组DNA技术制备的任何载体,且所述载体的选择可以取决于其进入的宿主细胞。因此,所述载体可以是自主复制载体,即存在于染色体外的载体,其复制不依赖于染色体的复制,例如,质粒。或者,所述载体可以是这样的载体,当进入宿主细胞时,其整合入宿主细胞基因组中并随着其整合的染色体复制而复制。在一些实施方案中,所述载体是表达载体,其中编码工程改造的TGase的DNA序列可操作地连接至DNA转录所需的其他片段。术语“可操作连接”(operablylinked)是指,插入所述片段,使其发挥预期的功能,例如,转录在启动子中起始,并且沿着编码蛋白的DNA序列进行。所述启动子可以是在所选宿主细胞中显示转录活性的任何DNA序列,并且可以源自编码与宿主细胞同源或异源的蛋白的基因。如果必要,编码工程改造的TGase的DNA序列也能可操作连接至合适的终止子。
在一些实施方案中,所述重组载体进一步包含能够使载体在所述的宿主细胞中复制的DNA序列,和/或可选择标记,例如编码可弥补宿主细胞缺陷的产物的基因,诸如编码二氢叶酸还原酶(DHFR)的基因或粟酒裂殖酵母(
包含编码工程改造的TGase的核酸的载体进入的宿主细胞可以是任何能够表达工程改造的TGase的细胞,包括细菌、酵母、真菌和高等真核细胞。然后将上述转化或转染的宿主细胞在适合所述肽表达的条件下,在合适的营养培养基中培养,其后从培养物中回收所得蛋白。在一些实施方案中,所述宿主细胞是原核细胞。在一些实施方案中,所述宿主细胞是拉达卡链霉菌。在一些实施方案中,所述宿主细胞是茂原链霉菌。在一些实施方案中,所述宿主细胞是大肠杆菌。
本文进一步提供制备本文所述的工程改造的TGase的方法。本文所述的工程改造的TGase可以以不同的方法制备。例如,在一些实施方案中,所述工程改造的TGase通过如下步骤制备:培养宿主细胞,其中转化或转染了含有编码工程改造的TGase的核酸的载体,并从细胞分离工程改造的TGase。
为了使本发明的蛋白直接进入至宿主细胞的分泌途径中,可以在重组载体中引入分泌信号序列(也称为前导序列、前原序列或前序列)。分泌信号序列插入编码蛋白的DNA序列后,仍具有正确的阅读框。分泌信号序列通常位于编码蛋白的DNA序列的5'端。所述分泌信号序列可以是通常与蛋白连接的序列,或者可以来自编码另一种分泌蛋白的基因。或者,所述蛋白可以在包涵体中表达,并且随后通过变性/复性获得。
用于培养细胞的培养基可以是任何适于宿主细胞生长的常规培养基,诸如基础培养基或含有适当补充剂的复合培养基。然后可以使用常规方法从培养基回收由细胞产生的蛋白,所述常规方法包括通过离心或过滤从培养基分离宿主细胞,借助盐(例如硫酸铵)沉淀上清液或滤液中的蛋白组分,通过各种色谱方法(例如,离子交换色谱法、凝胶过滤色谱法、亲和色谱法等,这取决于目标蛋白的类型)纯化。
在一些实施方案中,提供纯化TGase(诸如本文所述的任一种TGase)的方法。在一些实施方案中,所述方法包括(a)提供表达TGase的宿主细胞;(b)培养所述宿主细胞(诸如原核细胞),其中TGase表达为包涵体;(c)裂解所述宿主细胞以产生具有可溶性和不溶性组分的细胞裂解物;和(d)将所述可溶性与不溶性组分分离,其中所述不溶性组分包含TGase。在一些实施方案中,所述方法进一步包括在变性剂(诸如尿素)中加入包含TGase的不溶性组分。在一些实施方案中,所述方法进一步包括将变性TGase溶于复性缓冲液(诸如包含DTT的缓冲液)中。在一些实施方案中,所述方法进一步包括通过色谱法(诸如通过亲和色谱法或离子交换色谱法)纯化TGase。在一些实施方案中,在TGase上插入标签(诸如his标签)以便于纯化。
在一些实施方案中,提供纯化TGase的方法,其包括(a)培养宿主细胞(诸如原核细胞),其中转化或转染了包含编码TGase酶原(pro-enzyme)的核酸的载体,和(b)通过切割酶原的原序列(pro-sequence)(例如通过内激酶(endokinase)轻链)获得成熟TGase。
本文所述的突变体TGase可用于制备含Fc多肽缀合物(诸如抗体-药物缀合物)。例如,在一些实施方案中,提供制备抗体-药物缀合物的方法,所述抗体-药物缀合物中,抗体与缀合部分特异性缀合,所述方法包括:在突变体转谷氨酰胺酶(诸如本文所述的任一种突变体转谷氨酰胺酶)存在的情况下,在足以生成抗体-药物缀合物的条件下,使抗体与缀合部分反应,其中所述缀合部分与抗体上的受体谷氨酰胺残基缀合。在一些实施方案中,提供制备抗体-药物缀合物的方法,所述抗体-药物缀合物中,抗体与缀合部分特异性缀合,所述方法包括:在突变体转谷氨酰胺酶(诸如本文所述的任一种突变体转谷氨酰胺酶)存在的情况下,在足以生成抗体-药物缀合物的条件下,使抗体与缀合部分反应,其中所述抗体的Fc区是糖基化(例如,N-糖基化)的,且其中所述缀合部分与抗体上的内源性受体谷氨酰胺残基缀合。在一些实施方案中,提供制备抗体-药物缀合物的方法,所述抗体-药物缀合物中,抗体与缀合部分特异性缀合,所述方法包括:在突变体转谷氨酰胺酶(诸如本文所述的任一种突变体转谷氨酰胺酶)存在的情况下,在足以生成含Fc多肽缀合物的条件下,使包含抗体的组合物与缀合部分反应,其中所述组合物中至少部分(例如,50%、60%、70%、80%、90%或更高比例)抗体的Fc区是糖基化(例如,N-糖基化)的,且其中所述缀合部分与抗体上的内源性受体谷氨酰胺残基缀合。
在一些实施方案中,提供制备抗体-药物缀合物的方法,其中抗体与缀合部分特异性缀合,所述缀合部分包含一个小分子柄和一个活性中心,所述方法包括:a)在转谷氨酰胺酶(诸如本文所述的任一种突变体转谷氨酰胺酶)存在的情况下,在足以生成抗体-小分子柄中间体缀合物的条件下,使抗体与小分子柄反应,其中抗体与小分子柄特异性缀合,和b)使所述中间体缀合物与活性部分反应,由此获得抗体-药物缀合物,其中所述缀合部分与抗体上的受体谷氨酰胺残基缀合。在一些实施方案中,提供制备抗体-药物缀合物的方法,其中抗体与缀合部分特异性缀合,所述缀合部分包含一个小分子柄和一个活性中心,所述方法包括:a)在转谷氨酰胺酶(诸如本文所述的任一种突变体转谷氨酰胺酶)存在的情况下,在足以生成抗体-小分子柄中间体缀合物的条件下,使抗体与小分子柄反应,其中抗体与小分子柄特异性缀合,和b)使所述中间体缀合物与活性部分反应,由此获得抗体-药物缀合物,其中所述抗体的Fc区是糖基化(例如,N-糖基化)的,且其中所述缀合部分与抗体上的内源性受体谷氨酰胺残基缀合。在一些实施方案中,提供制备抗体-药物缀合物的方法,其中抗体与缀合部分特异性缀合,所述缀合部分包含一个小分子柄和一个活性中心,所述方法包括:a)在转谷氨酰胺酶(诸如本文所述的任一种突变体转谷氨酰胺酶)存在的情况下,在足以生成抗体-小分子柄中间体缀合物的条件下,使包含抗体的组合物与小分子柄反应,其中抗体与小分子柄特异性缀合,和b)使所述中间体缀合物与活性部分反应,由此获得抗体-药物缀合物,其中所述组合物中至少部分(例如,50%、60%、70%、80%、90%或更高比例)抗体的Fc区是糖基化(例如,N-糖基化)的,且其中所述缀合部分与抗体上的内源性受体谷氨酰胺残基缀合。
药物组合物、单位剂量和试剂盒
还提供包含本文所述的含Fc多肽缀合物(诸如抗体-药物缀合物)的药物组合物。在一些实施方案中,所述药物组合物进一步包含药学上可接受的载体。在一些实施方案中,所述药物组合物中至少约50%(诸如至少约60%、70%、80%、90%、95%或99%中任一种)的含Fc多肽缀合物(诸如抗体-药物缀合物)中,含Fc多肽(诸如抗体) 连接了一个缀合部分。在一些实施方案中,所述药物组合物中至少约50%(诸如至少约60%、70%、80%、90%、95%或99%中任一种)的含Fc多肽缀合物(诸如抗体药物缀合物)中,含Fc多肽(诸如抗体)连接了两个缀合部分。在一些实施方案中,所述药物组合物中至少约50%(诸如至少约60%、70%、80%、90%、95%或99%中任一种)的含Fc多肽缀合物(诸如抗体药物缀合物)中,含Fc多肽(诸如抗体) 连接了一个或两个缀合部分。
术语“药学上可接受的载体”在本文中是指除了本发明的化合物以外的任何成分。赋形剂的选择在很大程度上取决于诸如具体给药方式、赋形剂对溶解度和稳定性的影响以及剂型的性质等因素。如本文所使用,“药学上可接受的载体”包括任何溶剂、分散介质、包衣、抗细菌剂和抗真菌剂、等渗剂和吸收延迟剂等类似的生理相容性物质。药学上可接受的赋形剂的一些实例是水、盐水、磷酸盐缓冲盐水、葡萄糖、甘油、乙醇等,以及其组合而成的混合物。在一些实施方案中,在所述药物组合物中包括等渗剂,其包括但不限于糖类、多元醇类(例如,甘露醇、山梨醇)或氯化钠。药学上可接受的载体的其他实例包括,但不限于润湿剂或少量辅助物质,诸如润湿剂或乳化剂,防腐剂或缓冲剂,其可延长抗体的保质期或提高其有效性。
在一些实施方案中,可以使用已知技术例如PCT公开文本WO98/52976和WO00/34317中所记载的技术,对本文所述的含Fc多肽缀合物(诸如抗体-药物缀合物)进行去免疫原化(deimmunized)处理,以降低施用于个体后所可能产生的免疫原性。
本文所述的药物组合物可以单个单位剂量或多个单位剂量制备、包装或批量出售。如本文所使用,“单位剂量”是包含预定量的活性成分的药物组合物的离散量(discreteamount)。其中活性成分的量通常等于施用于个体的活性成分的剂量或便于施用的此类剂量的分剂量,例如此类剂量的一半或三分之一。本领域接受的施用肽、蛋白或抗体的任何方法也适用于本文公开的含Fc多肽缀合物。
在一些实施方案中,本文所述的药物组合物适合于肠胃外给药。药物组合物的肠胃外给药适用于需要物理破坏个体的组织给药和任何通过组织的创口给药的途径,因此药物通常直接进入血液循环、肌肉或内部器官。例如,肠胃外给药包括,但不限于注射组合物、经手术切口应用组合物、经组织穿透性非手术创口应用组合物等。具体而言,一般认为肠胃外给药包括,但不限于皮下、腹膜内、肌内、胸骨内、静脉内、动脉内、鞘内、心室内、尿道内、颅内、滑膜内注射或输注给药和肾透析输注技术。在一些实施方案中,肠胃外给药是静脉内或皮下途径给药。
适合于肠胃外给药的药物组合物的制剂可以以适合于大剂量给药或连续给药的形式制备、包装或销售。注射型制剂可以以单位剂量(诸如在安瓿或含有防腐剂的多剂量容器中)制备、包装或销售。适用于肠胃外给药的制剂包括,但不限于悬浮液、溶液、油性或水性媒介物中的乳液、糊剂等。此类制剂可以进一步包含一种或多种其他成分,包括,但不限于悬浮剂、稳定剂或分散剂。在适用于肠胃外给药的制剂的一个实施方案中,所述活性成分是干燥(即粉末或颗粒)形式的,在肠胃外给药前需用合适的媒介物(例如,无菌无热原水)溶解。肠胃外给药制剂还可以包括含有赋形剂诸如盐、碳水化合物和缓冲剂(优选pH为3-9 )的水溶液,但,对于某些肠胃外给药制剂,它们更适于配制成无菌非水溶液或需与合适的媒介物诸如无菌、无热原的水结合使用的干燥形式。示例性肠胃外给药形式包括无菌水溶液中的溶液或悬浮液,例如丙二醇或右旋糖水溶液。如果需要,可以对此类剂型进行适当地缓冲。可用于肠胃外给药的其他制剂包括微晶或脂质体形式的活性成分。用于肠胃外给药的制剂可以配制成速释和/或可控的释放(engineered release)。可控的释放制剂包括控释、缓释、持续释放、脉冲释放、靶向释放和程序性释放制剂。例如,在一个方面,可以将所需量的含Fc多肽缀合物(例如抗体-药物缀合物或双特异性抗体-药物缀合物)与上面列举的一种几种成分 (根据需要)溶于适当的溶剂中,随后进行过滤灭菌以制备无菌注射型溶液。通常,可通过将活性化合物溶于无菌媒介物中来制备分散体,所述无菌媒介物包含基础分散介质和上文列举的其他所需成分。制备用于无菌注射型溶液的无菌粉末的示例性方法是真空干燥和冷冻干燥,产物为活性成分和来自先前无菌过滤溶液的任何其他所需成分的粉末。可以通过例如使用包衣诸如卵磷脂、维持分散体所需的粒径和使用表面活性剂来维持溶液的适当的流动性。可以通过在组合物中加入延迟吸收的试剂(例如,单硬脂酸盐和明胶)来实现注射型组合物的延长吸收。
含Fc多肽缀合物(诸如抗体-药物缀合物)的示例性、非限制性药物组合物是一种无菌水溶液制剂,其pH范围为约5.0至约6.5,并且包含约1 mg/mL至约200 mg/mL本文公开的工程改造的多肽缀合物,约1毫摩尔至约100毫摩尔组氨酸缓冲剂,约0.01 mg/mL至约10mg/mL聚山梨醇酯80,约100毫摩尔至约400毫摩尔海藻糖和约0.01毫摩尔至约1.0毫摩尔EDTA二钠脱水物(disodium EDTA dehydrate)。
可以通过调节剂量方案以获得最佳的预期效果。例如,可以单次大剂量给药,可以随时间施用一些分剂量,或者可以根据治疗的紧急性程度按比例减少或增加剂量。特别有优势的是,把肠胃外组合物配制成单位剂型便于给药并可保证剂量的一致性。本文所使用的单位剂型是指适合作为单位剂量施用于待治疗的患者/个体的物理不连续单位;每个单位含有预定量的活性化合物,其与所需药物载体结合产生预期的治疗效果。用于本发明的单位剂型的规格通常由以下因素决定并直接取决于:(a)药剂部分(例如,小分子诸如细胞毒剂)的独特性质和预期要获得的特定治疗或预防效果,以及(b)本领域中混合此类活性化合物的技术所固有的对个体治疗敏感性的限制。
技术人员理解,可基于本文公开的内容,根据治疗领域中众所周知的方法调节剂量和给药方案。也就是说,易于获得最大可耐受剂量,并且还可以确定可为患者提供可检测的治疗益处的有效量,如同确定可为向患者提供可检测的治疗益处的每种药剂施用的时间要求一样。因此,尽管本文例举了某些剂量和给药方案,但这些实例决不限制在实施本发明时可以提供给患者的剂量和给药方案。
应当注意,剂量值可以随待缓解的疾病症状的类型和严重程度变化而变化,并且可以包括单剂量或多剂量。应当进一步理解,对于任何特定个体,应当根据个体需要和给药医师或药师的专业判断随时间调整具体剂量方案,并且本文记载的剂量范围仅仅是示例性的并且不限制请求保护的组合物的剂量范围或实践中应用的剂量范围。此外,本发明的组合物的给药方案可以基于多种因素,包括疾病类型,患者的年龄、体重、性别、医疗条件,疾病的严重程度,给药途径,和使用的具体抗体。因此,剂量方案可以在大范围内变化,但通常可以使用标准方法测定。例如,可以基于药代动力学或药效动力学参数(其可以包括临床效应,诸如毒性作用和/或实验值)调整剂量。因此,本发明涵盖技术人员确定的患者内剂量递增试验。适当的剂量和方案的确定在相关领域中是众所周知的,并且技术人员理解,上述确定的剂量和方案是涵盖在本发明中的。
本发明还提供用于治疗上述病症的试剂盒(或制品)。本发明的试剂盒包括一个或多个容器,其包含用于疾病治疗的含Fc多肽缀合物(诸如抗体-药物缀合物)。例如,说明书包含如何使用工程改造的含Fc多肽缀合物(诸如抗体-药物缀合物)以治疗疾病诸如癌症(例如,胰腺癌、卵巢癌、结肠癌、乳腺癌、前列腺癌或肺癌)的说明。所述试剂盒可以进一步包含如何选择合适的治疗对象的说明,其基于判断该个体是否患有疾病和其疾病分期。涉及工程改造的含Fc多肽缀合物(诸如抗体-药物缀合物)的使用的说明书通常包括关于治疗的剂量、给药方案和给药途径的信息。所述容器可以是单位剂量、大包装(例如,多剂量包装)或亚单位剂量。本发明的试剂盒中提供的说明书通常是标签或包装插页上的书面说明书(例如,试剂盒中包括的纸质说明书),但机器可读说明书(例如,在磁性或光学存储盘上刻录的说明书)也是可接受的。本发明的试剂盒以合适的包装形式包装。合适的包装包括,但不限于小瓶、瓶、罐、软包装(例如,密封的Mylar或塑料袋)等。与特定装置(诸如吸入器、鼻腔粘膜给药装置(例如,喷雾器)或输注装置诸如微型泵)组合使用的包装也是可接受的。试剂盒可以具有无菌入口(例如,所述容器可以是静脉输液袋或具有可用皮下注射针头刺穿的塞子的小瓶)。所述容器也可以具有无菌入口 (例如,所述容器可以是静脉输液袋或具有可用皮下注射针头刺穿的塞子的小瓶)。所述组合物中的至少一种活性剂是本文所述的工程改造的多肽。所述容器可以进一步包含第二种药物活性剂。所述试剂盒任选地可以提供其他组分,诸如缓冲液和一些解释性信息。通常,所述试剂盒包含一个容器和一个标签或药品说明书,其贴于容器上或与容器一起包含在试剂盒内。
在一些实施方案中,提供包含TGase(诸如工程改造的TGase,诸如本文所述的任一种工程改造的TGase)的试剂盒。在一些实施方案中,所述试剂盒进一步包含用于进行转谷氨酰胺反应所需的其他试剂。在一些实施方案中,所述试剂盒进一步包含描述本文所述的任一种缀合方法的说明书。在一些实施方案中,所述试剂盒进一步包含用于固定TGase(诸如工程改造的TGase)或含Fc多肽(诸如抗体)的固体支持物。在一些实施方案中,所述试剂盒中的TGase(诸如工程改造的TGase)固定在固体支持物上。
实施例
以下实施例可帮助进一步理解本发明,所述实施例通过举例说明的方式用于解释本发明,并不用来限制本发明。
实施例1. TGase突变体的制备
本实施例描述TGase突变体的制备。参考图3,将靠近活性位点入口的三个区域缺失或突变以扩大底物结合口袋。使用NdeI和XhoI将野生型TG_SL克隆至pET39+载体中,其具有额外的脯氨酸(SEQ ID NO:17)。基于IgG1和TG_SM晶体结构对接 (docking)制备以下缺失突变体:突变体1: 缺失P1-E5;突变体2:缺失P245-P248;突变体3:缺失N283-L286;突变体4:缺失P1-E5和N283-L286;突变体5:缺失突变体1、2和3指定的所有三个区域;突变体6:缺失P1-E5并用G替代H280-A288;突变体7:缺失P1-E5并用G替代A281-H290。缺失区域加灰色、加下划线或加删除线,如图3中所示。这些突变体对IgG1的结合活性更高。
以从拉达卡链霉菌(
实施例2.由mTGase催化的IgG1与单丹磺酰尸胺(MDC)的缀合
之所以选择MDC用于该实验,是因为其具有伯胺并且其荧光易于监测。此处使用MDC以证明其与mAB的缀合。向纯化的IgG1 (1-10 mg/ml)的Tris-缓冲液(pH 6.5-8.5)中加入溶于DMSO中的MDC (Sigma-Aldrich)使其终浓度为1-5 mM (最终DMSO含量 2-10%)。加入纯化的野生型TG_SL或其突变体使其终浓度为0.05-1.0 mg/ml,在37℃下孵育反应。反应随后用HPLC(苯基疏水相互作用柱(PHIC, Tosoh Bioscience LLC))进行监测。在反应开始时,产物以DAR1为主,其中IgG1仅有一条重链与MDC偶联。随着反应进行,DAR2(其中IgG1的两条重链均与MDC偶联)变成主要产物。到反应结束时(8小时后,mTGase的浓度为0.2 mg/ml,pH 为7),缀合物中80%为DAR2,而DAR1仅剩余20%。或当样品用10mM TCEP还原后且在C4-1000A柱(Vydac)上分析时,90%为修饰的重链(HC)(参见图6)。在SDS PAGE反应也可观察到MDC与HC的选择性缀合(图7)。本申请人还用其他mTGase进行了试验,诸如来自茂原链霉菌(
实施例3.mTGase催化的1 kDa mPEG-NH2与IgG1的聚乙二醇化反应
试验过程实质上与实施例2中所述相同。用1 kDa甲氧基-PEG-胺(JenKem, USA)替换酰基受体MDC,调节pH为7.0,使其终浓度为1至2 mM,最终获得聚乙二醇化的IgG1。用TCEP还原之后在C4柱上对37℃下的过夜反应物进行分析,结果显示90%的重链被修饰。
实施例4.由固定的mTGase催化的IgG1与单丹磺酰尸胺(MDC)的缀合
为了简化mTGase去除并可重复使用酶,在缀合反应中我们使用固定的mTGase。在制备固定化的mTGase柱时,按照制造商的给出的步骤,将1 ml的15mg/ml mTGase的碳酸盐缓冲液(pH 8.3)加入到1.0 ml的NHS活化的HITRAP
实施例5.由mTGase催化的IgG1、2和4与细胞毒素的缀合
具有胺接头的毒素可以如MDC一样一步偶联至IgG1上 (图4)。简单如–(CH2)
图8显示的是一个含有延伸的、不可切割的直链PEG接头与一个伯胺基的美登素衍生物,其分子量为896.42Da。将溶于DMSO中的MAY-PEG4加入至IgG1溶液(pH 8.0 Tris缓冲液,浓度为1-10 mg/ml)中,使其终浓度为1-2 mM。加入mTGase使其终浓度为0.2-1.0mg/ml,并将反应物在37℃下孵育。如实施例2中所述通过HPLC分析监测反应的进行。过夜之后,60%的重链被修饰。DAR1和DAR2产物均可检测到(图10)。
图9显示的是一个分子量为1224.58Da的美登素衍生物,其含有一个可切割接头,该接头具有一个自降解间隔基和一个末端赖氨酸。缀合反应如上所述,只是用MAY-PVCL(1.0 mg/ml)替代MAY-PEG4。在37℃下孵育8小时之后,40%的重链被修饰(图11)。低产率是由于药物的低溶解度导致的。
实施例6. 药物与抗体比率(DAR)测定和对IgG1的缀合位点作图
由于聚糖链的异质性,IgG1的质谱图上呈现多个峰。为了简化质量分析,在使用PNGaseF (Promega, Madison, WI)进行质谱分析之前,将所有mAB缀合物去糖基化,因此对于带相同电荷的每种物质会观察到单一峰。这样处理后,初始聚糖连接的天冬酰胺(N)被转变为天冬氨酸(D)。
确定DAR1和DAR2的质量。在苯基HIC上纯化实施例5制备的DAR1和DAR2的IgG1-MAY-PEG4 。去糖基化后,将样品点在196孔钢板上,并在MALDI-TOF(ABI 4700, AppliedBiosystems, Redwood City, CA)上分析。使用裸IgG1(DAR0) 作为对照。以正高质量线性模式获得质谱,并使用带多电荷物质(二价和三价)来计算分子量。MAY-PEG4药物的分子量为896 Da。因此,一个分子的MAY-PEG4与IgG1的缀合(DAR1)将导致预期的879 Da的质量差异(896-17(反应释放一个NH3)= 879Da),而两个分子与IgG1的缀合(DAR2)将导致1758 Da的质量差异。图10中的MALDI-TOF谱确证了DAR1和DAR2。
仅在重链上进行缀合的确证。为了证实药物分子与IgG1的重链(HC)而非轻链(LC)进行缀合,将实施例5得到的纯化的DAR2的IgG1-MAY-PVCL 去糖基化,并在37℃下用20 mMDTT进行还原反应30分钟。使用ABI4700以正高质量线性模式获得质谱。MAY-PVCL药物的分子量为1224 Da。因此,一个MAY-PVCL与重链的缀合将导致1207 Da (1224 – 17 = 1207Da)的预期质量差异,而轻链的分子量没有发生变化(图11)。另一方面,DAR1的IgG1-MAY-PVCL在其质谱上显示裸HC和HC-MAY-PVCL的峰,表明DAR1的IgG1-MAY-PVCL仅缀合了一个HC。
肽作图以验证Q295处的位点特异性缀合。将实施例2得到的纯化DAR2(IgG1的两条重链均缀合了MDC)和裸IgG1去糖基化,还原,烷基化处理后,使用胰蛋白酶和/或胰凝乳蛋白酶(Promega, Madison, WI)消化成肽并且通过反相色谱法(C18)分离,然后进行质谱分析。在HPLC上检测消化后得到的肽在328nm处的UV吸光度(MDC的λmax)。在DAR2样品中仅检测到328nm处的一个峰,而在对照抗体中未检测到峰。MALDI-TOF分析确定该峰为带单电荷的肽,当用胰蛋白酶消化时,其为EEQYDSTYR或当用胰凝乳蛋白酶消化时,其为NAKTKPREEY,二者均含有谷氨酰胺298(即Kabat编号系统的Q295)与一个MDC(1508.7(观察值)-1190.5(肽)+335(MDC)-17(NH3)= 318 Da;1681.9(观察值)-1363.6(肽)=318)(表1中的灰色行)。为了排除其他谷氨酰胺(除Q298之外)也可作为额外的缀合位点,对未修饰的IgG1和IgG1-MDC缀合物进行全肽作图实验。直接分析未纯化的消化后的样品以确定重链上的所有含谷氨酰胺的肽。在所有16个谷氨酰胺中,Q298是MDC的唯一缀合位点(表1),而所有含其他谷氨酰胺的肽保持不变。
*注:序列Q298即为Kabat编号系统的Q295。N300(或Kabat N297)去糖基化后变为D300。
为了证实Q298为细胞毒素与IgG1的特异性缀合位点,将MAY-PEG4和TAM1(具有胺接头的tubulysin A衍生物)的IgG1缀合物去糖基化,还原,烷基化,使用胰蛋白酶消化成肽,并通过反相色谱法分离后进行质谱分析。在IgG1-TAM1和IgG1-MAY-PEG4缀合物(连接一个药物分子后的质量分别为:2134.0 (1190.5 + 960.5 - 17)和2069.8 (1190.5 + 895.5- 17))中都检测到了含有Q298的相同肽EEQYNSTYR(表2)。
实施例7.由mTGase催化的IgG其他亚类的缀合反应
在添加0.1-1 mg/mL纯化的mTGase后,使溶于Tris缓冲液(pH 7.0-8.0)中的1-10mg/ml的纯化的人IgG2或IgG4与2-5 mM MDC反应。将混合物在37℃下孵育8-16小时,然后在苯基疏水相互作用柱上分析或在C4柱上用10 mM TCEP还原后分析。类似于IgG1,IgG2和IgG4与MDC缀合过程中, 可检测到DAR1和DAR2随时间而累积(图6)。
实施例8.使用mTGase两步法制备抗体-药物缀合物
尽管一步法缀合反应简单、直接,但产率受药物的溶解度的影响。当药物浓度低时,脱酰胺产生的副产物较多。为了抑制脱酰胺作用,在由mTGase催化的第一步缀合步骤中过量(化学柄:mAB的摩尔比>10)使用高度可溶的含胺化学柄。然后,在第二步中通过化学选择性连接反应将药物分子与mAB交联(图5)。可以使用许多化学选择性对:
氨基-氧基-/醛或酮
巯基/马来酰亚胺
叠氮化物/炔烃。
mTGase催化的通过氨基丙基缩醛介导的PEG 与IgG1的缀合。向溶于pH 7.0-8.0Tris缓冲液中的1-10mg/ml IgG1中添加3-氨基丙醛二乙缩醛(CAS# 41365-75-7),至其终浓度为2-50 mM,且添加mTGase至其终浓度为0.05至0.5 mg/ml。将反应混合物在37℃下孵育2-16小时,直到反应完全。在渗滤以去除过量缩醛之后,在室温下用甲酸或HCl将pH调节至2-4持续2-10小时以再生醛基。用碳酸钠将IgG1-醛的pH调节至5-8。添加3至4倍(摩尔比)IgG1量的氨基-氧基-PEG(20 kDa),同时加入50至100 mM苯胺或10 mM 5-甲氧基邻氨基苯甲酸作为催化剂。在室温下孵育过夜之后,IgG1-(PEG20k)
mTGase催化的通过胺-叠氮化物介导的药物与IgG1的缀合。向溶于pH 7.0-8.0Tris缓冲液中的1-10mg/ml IgG1中添加3-叠氮基-1-丙胺(CAS# 88192-19-2)至其终浓度为2-50 mM,且添加mTGase至其终浓度为0.05至0.5 mg/ml。将反应混合物在37℃下孵育2-16小时,产率达到100%。渗滤以去除过量叠氮基丙胺之后,将3倍(以摩尔计)于IgG的DBCO-美登素添加至IgG中。IgG1-(美登素)
实施例9.测定由mTgase制备的ADC效力的体外细胞试验法
将SK-BR-3细胞以10000个细胞/孔接种到96孔黑色透明底板中并培养24小时。加入2倍系列稀释的抗体-药物缀合物,与细胞培养96小时,一个稀释度做3个平行。通过CELLTITER
实施例10.具有稳定的不可切割接头的由mTGase制备的位点特异性ADC在异种移植小鼠中高度稳定和有效
如实施例5中所述将曲妥珠单抗(10mg/ml)和一甲基澳瑞他汀E (MMAE)分别与每一种不可切割的PEG接头(CH
对六种曲妥珠单抗-MMAE缀合物进行BT474异种移植小鼠体内试验。在注射细胞前2-3天,向每只雌性无胸腺裸鼠(4周龄,18-22 g;Harlan)移植一个3 mm雌激素 (60天缓慢释放,Innovative Research of America)片剂。将BT474细胞重悬至最终浓度为50-60百万个细胞/ml,并与基质胶1:1混合,然后皮下注射200μl至每只小鼠的侧腹。当肿瘤体积(1/2× L ×W × H)在3周之后达到约200 mm
所有6种ADC都是有效的,我们仅测试一种具有PEG12接头的ADC在血液中的稳定性。以与BT474异种移植小鼠相似的方式, 注射~5百万个细胞/小鼠到NCI N87异种移植小鼠,但不使用雌激素片剂。在施用ADC之后,每1-2天(直至21天)通过戳刺小鼠尾部采集20μl的血液样品,并与120μl储存缓冲液(含有10 mM EDTA和0.1 M NH4Cl的PBS)混合。然后通过夹心ELISA法分析曲妥珠单抗和ADC总量。黑色NUNC® Maxisorp 96孔板用Her2蛋白包被,100 ng/孔。根据需要,用PBS进一步稀释样品以与曲妥珠单抗或ADC的10 pg至2 ng的线性检测范围相适应。在加入样品(新鲜ADC稀释液用作总mAb和ADC标准品)和洗涤之后,应用兔多克隆抗曲妥珠单抗(用于总mAb检测)或抗MMAE(用于总ADC检测)作为二抗,使用山羊抗兔IgG-HRP (Life-technologies)作为检测抗体。使用AMPLEX® Red (Cayman Chemical)/4-碘苯酚(Sigma)/ H
实施例11.具有可切割接头的由mTGase制备的DAR2位点特异性ADC在异种移植模型中比商业化的TDM-1更稳定和有效
如实施例10中所述,缀合并纯化具有可切割的PEG3c接头的曲妥珠单抗(10 mg/ml)-MMAE(图12)。该ADC(被称为TP3cE)具有1.9的DAR和高体外效力(表4)。在NCI N87 和SK_Ov3异种移植模型中研究比较其与TDM-1 (Genentech)的体内活性。在NCI N87模型中,用单次静脉内注射,TP3cE的效力是TDM-1的4倍(图15)。血液样品分析显示,TP3cE在血液中可完全稳定地保存21天,而TDM-1在5天内其毒素就丧失了50%(图16)。在SK_Ov3异种移植物中,每周3次,每次剂量为15或8 mg/kg的TP3cE可导致肿瘤完全缓解,而TDM-1仅在15mg/kg剂量下显示效力(图17)。
实施例12.由mTGase催化的两步法制备DAR4位点特异性ADC
如实施例10中所述分别缀合曲妥珠单抗(10 mg/ml)和任一种具有一个胺基和两个叠氮基团的3-臂PEG接头(1-5kDa) (图18,上图;Conju-探针和Jenkem)(4-8 mg/ml) 并进行纯化。使用HPLC(C4柱)还原分析,抗体-接头缀合反应的转化率达到>90%。
然后,在0.1-1mM CuSO
- 酶法制备同质的抗体-药物缀合物
- 酶法制备同质的抗体‑药物缀合物
