一种用于阪崎克罗诺杆菌检测的新靶标、引物组及其检测方法
文献发布时间:2023-06-19 13:27:45
技术领域
本发明属于食品安全技术领域,具体涉及一种用于阪崎克罗诺杆菌检测的新靶标、引物组及其检测方法。
背景技术
阪崎克罗诺杆菌作为克罗诺杆菌属的一种,容易引发新生儿一系列疾病且致死率较高,是一种非常重要的食源性致病菌。阪崎克罗诺杆菌可污染各种乳制品、肉制品、蛋类及水果蔬菜,其中婴儿配方奶粉(PIF)是其主要的污染途径之一,这使该菌成为乳粉加工行业重点防范和监测的对象。目前可用于检测食品中阪崎克罗诺杆菌的方法主要有传统微生物培养法,免疫学检测法和分子生物学检测法。传统检测方法基于平板计数法,检测周期一般为5~7天,劳动量较大,而且特异性不高,容易导致检测的假阳性。免疫学检测法通常需要较为昂贵的设备和较长的检测时间,无法满足快速检测的要求。相比于传统培养法,基于核酸技术发展起来的检测方法正成为快速检测该菌的热点,而寻找到阪崎克罗诺杆菌特异性核酸靶点是相关检测技术开发的核心。
目前研究较多的主要是针对克罗诺杆菌属的特异性核酸靶点,包括:16S rRNA基因、23S rDNA基因、转运tRNA-Glu基因、高分子合成操纵子内部的dnaG基因、α-葡萄糖苷酶(gluA)基因、外膜蛋白A(ompA)基因、含锌金属蛋白酶(zpx)基因、16S-23S rDNA内部转录间隔区域(ITS)基因序列、wehC基因和wzx基因等。而针对于阪崎克罗诺杆菌核酸检测的相关基因数量少且特异性不强,不能有效的将其与克罗诺属的其他菌种及亲缘关系较近的一些肠杆菌区分开,且检测灵敏度有待提高。因此,筛选到具有高特异性、高稳定性和广泛适用性的新核酸靶点,以及建立一种快速、高效、特异性强的检测阪崎克罗诺杆菌的方法,对保障婴儿配方食品的安全性具有非常重要的意义。
研究表明,来自于母乳或PIF中的唾液酸可作为营养源定植在人体肠道中,在进化过程中,阪崎克罗诺杆菌是克罗诺属唯一一个具有利用唾液酸的nanAKT基因簇编码的克罗诺菌,这种代谢功能可能为其感染新生儿提供便捷。
近年来,环介导等温扩增(LAMP)技术由于其简单、快速、检测限低等特点,应用范围逐渐拓宽,具有较大的发展前景,LAMP技术结合可视化检测方法已逐渐成为快速检测食源性致病菌的有效手段之一。而羟基萘酚蓝(HNB)染料法是根据溶液pH值的改变而产生颜色变化,从而用肉眼即可对扩增结果进行观察判断。整个过程避免了开盖检测,因此不会产生假阳性结果,也不需要专门的检测设备,经济实用并适合于现场快速检测,与LAMP技术的结合在近年内被广泛关注和应用。
发明内容
本发明为解决阪崎克罗诺杆菌传统检测方法步骤繁琐、耗时长、检测效率低,核酸检测的相关基因数量少且特异性不强的问题,提供了一段核苷酸序列在检测阪崎克罗诺杆菌中的应用,所述核苷酸序列如SEQ ID No.1所示。
本发明还提供了用于检测阪崎克罗诺杆菌的引物组,所述引物组根据上述核苷酸序列设计得到,具体包含以下引物:
外引物F3:5’-ATCTCGCTGCCCGCTATC-3’;
外引物B3:5’-GTATGCTCCCAGTACGTGTC-3’;
内引物FIP:5’-ACTGATGCGATTTACGACGGGTCACGGTGAATGATGCCCA-3’;
内引物BIP:5’-GGCGCTTCGGTATGTCCTGGTCTCCCGGTTCCCTGATC-3’。
本发明还提供了一种可视化检测阪崎克罗诺杆菌的方法,其特征在于,包括如下步骤:
S1、利用DNA提取液提取待检测样本的DNA;
S2、以S1获得的样本DNA为模板,建立阪崎克罗诺杆菌的LAMP体系,再加入HNB染料进行扩增;
S3、观察颜色变化,若扩增产物由紫罗兰色变为天蓝色,则表明待检测样本中含有阪崎克罗诺杆菌,若扩增产物呈现紫罗兰色,不发生变化,则表明待检测样本中不含有阪崎克罗诺杆菌。
进一步地限定,S1所述DNA提取液的组成为珠状Chelex-1005g,NP 401mL和TE溶液19mL,pH为8.0~9.0;所述TE溶液由10mM Tris-HCl和1mM EDTA配制获得。
进一步地限定,S1所述的DNA提取方法如下:取300μL~1mL待检测样本于2mL EP管中,4℃、12000rpm离心2min,弃去上清液,向沉淀中加入300μLDNA提取液,混匀后于56℃孵育30min,再于90℃~100℃下水浴8min~10min,然后4℃、12000rpm离心2min,取上清液即为DNA。
进一步地限定,S2所述阪崎克罗诺杆菌的LAMP体系总体积为25μL,包括如下成分:上述引物组、dNTP、Mg
进一步地限定,S2所述HNB染料的终浓度为120μM~180μM。
进一步地限定,S2所述扩增反应的温度为62℃~64℃。
进一步地限定,S2所述扩增反应的时间为30~60min。
进一步地限定,S1所述样本为乳粉时,样本前处理方法如下:取10g乳粉溶于90mL无菌的蛋白胨水溶液中并混合均匀,4℃、5000rpm离心5min,弃去上清液;将沉淀复溶于的蛋白胨水溶液中进行二次离心,加入BPW复溶并用于DNA的提取。
本发明所述检测方法原理:LAMP技术利用4条引物在Bst DNA聚合酶的作用下,通过自动循环链置换反应,在65℃左右产生具有特殊茎环结构的产物,并在1h之内可产生109拷贝数的目的基因序列,最后产生分子大小不等的DNA片段即为LAMP产物,从而达到快速扩增目标核酸片段的目的。HNB是一种金属离子指示剂,与镁离子结合使反应体系初始颜色为紫罗兰色,随着反应的进行,Mg
本发明的有益效果:
1)本发明首次利用阪崎克罗诺杆菌特异性核酸靶点nanC作为目标片段设计高度匹配的LAMP引物,实现了在分子水平上有效区分阪崎克罗诺杆菌与亲缘关系相近的其他菌种,对基于核酸技术区分克罗诺杆菌属内各菌种的分子检测方法提供了理论基础。同时对PIF乃至其他食品中该菌的特异性和灵敏性检测奠定基础。
2)本发明将LAMP技术和可视化方法结合,操作简便,通过HNB染料颜色的变化,肉眼即可观察结果,同时对扩增产物的判断不用开盖检测,避免了空气中气溶胶产物对结果的影响,有效提高了检测的便捷性和精准度。
3)本发明在保证灵敏度的前提下,大大降低了总检测时间。DNA提取过程约50min,检测过程仅需LAMP扩增步骤,最短30min即可观察结果,并且可同时进行多个样品的检测,为阪崎克罗诺杆菌快速检测试剂盒和基于核酸技术的多重检测技术的开发奠定基础,同时,本发明建立的可视化方法可以应用到更多的食品样品或其他致病菌的检测中。
附图说明
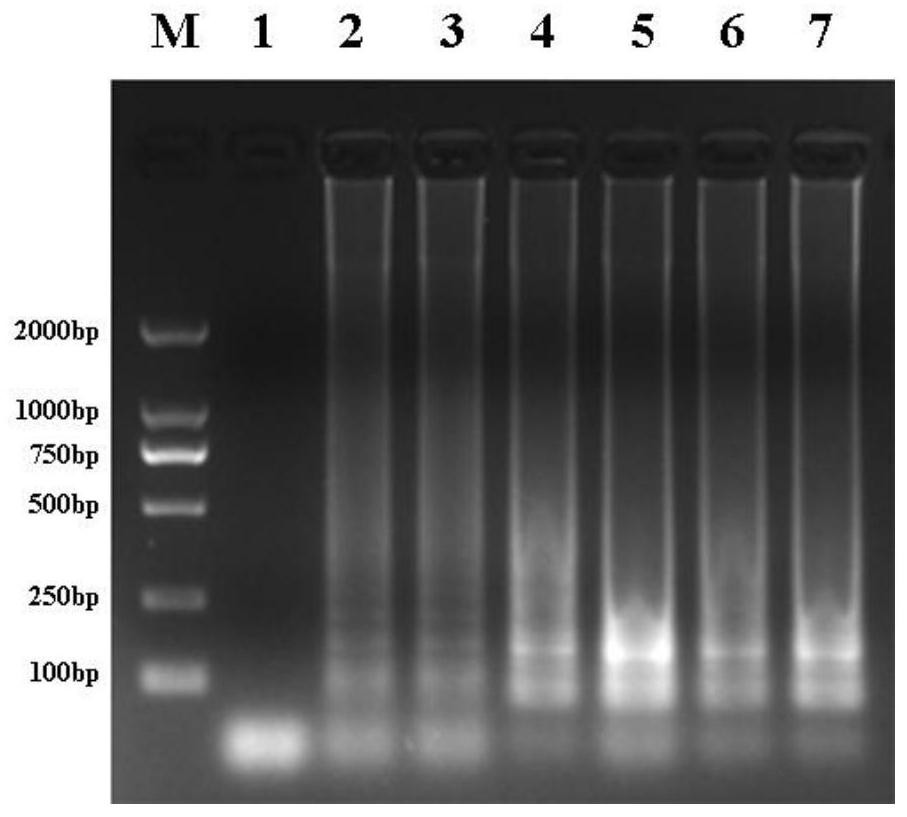
图1为外引物与内引物浓度比对LAMP反应的影响结果图;图中M为DNAMarker,1为阴性对照,2-7分别为外引物与内引物的终浓度比例为1:2、1:4、1:6、1:8、1:10和1:12时对应的紫外光下电泳条带;
图2为dNTP浓度对LAMP反应的影响结果图;图中M为DNAMarker,1为阴性对照,2-8分别为dNTP终浓度为1.2、1.4、1.6、1.8、2.0、2.2、2.4mM时对应的紫外光下电泳条带;
图3为镁离子浓度对LAMP反应的影响结果图;图中M为DNAMarker,1为阴性对照,2-7分别为Mg
图4为Bst 2.0DNA聚合酶添加量对LAMP反应的影响结果图;图中M为DNA Marker,1为阴性对照,2-7分别为酶的添加量为0.6、0.7、0.8、0.9、1.0、1.1μL时对应的紫外光下电泳条带;
图5为反应温度对LAMP反应的影响结果图;图中M为DNAMarker,1为阴性对照,2-8为反应温度分别为60、61、62、63、64、65、66℃时对应的紫外光下电泳条带;
图6为扩增时间对LAMP反应的影响结果图;图中M为DNAMarker,1为阴性对照,2-6分别为65℃条件下扩增30、45、60、75、90min时对应的紫外光下电泳条带;
图7为LAMP体系中HNB添加量的优化结果图;图中M为DNAMarker,1为阴性对照,2-5为HNB染料母液的添加量使其终浓度分别为90、120、150、180μM时对应的紫外光下电泳条带;
图8为LAMP-HNB法对阪崎克罗诺杆菌纯培养物的检测灵敏度结果图;图中M为DNAMarker,1为阴性对照,2-9分别为阪崎克罗诺杆菌纯培养物的浓度为4.5×10
图9为LAMP-HNB法对婴儿配方奶粉中阪崎克罗诺杆菌的检测灵敏度结果图;图中M为DNAMarker,1为阴性对照,2-9分别为婴幼儿配方奶粉中污染的阪崎克罗诺杆菌的浓度为5.7×10
具体实施方式
以下结合具体实施例和附图,对本发明作进一步的详细说明,本发明所用试剂及设备等均可通过商业化途径购买获得。
以下实施例中使用的菌株名称及来源如表1所示。
表1实施例中使用的菌株名称及来源
实施例1:阪崎克罗诺杆菌新靶标的筛选及引物组的设计
利用BLAST方法对全部的阪崎克罗诺杆菌进行全基因组序列比对(https://blast.ncbi.nlm.nih.gov/Blast.cgi),寻找其共有的基因组序列,同时这些核酸片段在NCBI的BLAST比对中不存在于其他6种克罗诺杆菌和非克罗诺杆菌中。阪崎克罗诺杆菌是克罗诺杆菌属中唯一能够利用外源唾液酸作为碳源进行生长的菌种,这是由于其是唯一具有利用唾液酸的nanAKT基因簇编码的克罗诺杆菌,在筛选出的特异性核酸片段中,nanC基因属于nanAKT基因簇,因此,选择nanC基因作为阪崎克罗诺杆菌的新靶标
通过在线软件PrimerExplorer V5(http://primerexplorer.jp/lampv5e/index.html),对筛选的特异性核酸基因nanC进行LAMP引物设计,并对其进行BLAST比对,筛选出最佳的特异性引物进行LAMP扩增,并将扩增效率最好的一套用于后续实验。
实施例2:一种可视化检测阪崎克罗诺杆菌的方法
S1、利用DNA提取液提取待检测样本的DNA
1)配置DNA提取液:称取5g珠状Chelex-100于锥形瓶中,向其中加入1mL NP 40和19mL TE溶液,配置成20mL的DNA提取液,pH为8.0~9.0。TE配制方法为:10mM Tris-HCl,1mMEDTA。
2)DNA提取:取300μL~1mL待检测样本于2mL EP管中,4℃、12000rpm离心2min,弃去上清液,向沉淀中加入300μLDNA提取液,混匀后于56℃孵育30min,再于90℃~100℃下水浴8min~10min,然后4℃、12000rpm离心2min,取上清液即为DNA。
当样本为乳粉时,样本前处理方法如下:取10g乳粉溶于90mL无菌的蛋白胨水溶液(BPW)中并混合均匀,4℃、5000rpm离心5min,弃去上清液,用灭菌的棉签擦拭上层及管壁上残留的乳脂肪;将沉淀复溶于的蛋白胨水溶液中进行二次离心,重复上述操作,加入BPW复溶并用于DNA的提取。
S2、以S1获得的样本DNA为模板,建立阪崎克罗诺杆菌的LAMP体系,再加入HNB染料进行扩增
阪崎克罗诺杆菌的LAMP体系总体积为25μL,包括如下成分:实施例1所述的引物组、dNTP、Mg
向上述LAMP体系中加入HNB染料,使其终浓度为120μM~180μM,进行等温扩增。扩增反应温度为62℃~64℃,反应时间为30~60min。
S3、观察颜色变化,若扩增产物由紫罗兰色变为天蓝色,则表明待检测样本中含有阪崎克罗诺杆菌,若扩增产物呈现紫罗兰色,不发生变化,则表明待检测样本中不含有阪崎克罗诺杆菌。
(1)LAMP反应体系及反应条件的优化
①外引物与内引物的浓度比优化
调节内引物的添加量使外引物与内引物的终浓度比例分别为1:2、1:4、1:6、1:8、1:10和1:12。根据上述比例配制相应的LAMP体系,在65℃条件下扩增1h,然后在80℃条件下加热5min以达到终止反应的目的。利用2%AGE对5μL的反应产物进行检测,在紫外光下电泳条带最亮的条件为反应的最优引物浓度比。
结果如图1所示,外引物与内引物浓度比在1:2~1:12之间时均可发生LAMP扩增反应,试验中固定外引物的浓度,随着内引物浓度的增大,电泳条带先变亮再变暗,在浓度比为1:8时电泳条带达到最亮且清晰,说明扩增效果最好,最终确定外引物与内引物的浓度比为1:8。
②dNTP浓度的优化
调节dNTP的添加量使其终浓度分别为1.2、1.4、1.6、1.8、2.0、2.2、2.4mM。根据上述比例配制相应的LAMP体系,在65℃条件下扩增1h,然后在80℃条件下加热5min终止反应。利用2%AGE对5μL的反应产物进行检测,在紫外光下电泳条带最亮的条件为反应的最优dNTP浓度。
结果如图2所示,在dNTP浓度为1.2mM时不能进行有效扩增,随着dNTP浓度的增大,电泳条带均先变亮再变暗,最终确定dNTP的终浓度为1.8mM~2.2mM。
③镁离子浓度的优化
调节Mg
结果如图3所示,Mg
④Bst 2.0WarmStart DNA聚合酶添加量的优化
调整酶的添加量分别为0.6、0.7、0.8、0.9、1.0、1.1μL。根据上述比例配制相应的LAMP体系,在65℃条件下扩增1h,然后在80℃条件下加热5min终止反应。利用2%AGE对5μL的反应产物进行检测,在紫外光下电泳条带最亮的条件为酶的最适添加量。
结果如图4所示,DNA聚合酶的添加量为0.6μL~1.1μL之间时均可发生LAMP扩增反应,随着酶添加量的增大,电泳条带均先变亮再变暗,酶浓度为0.8μL时电泳条带达到最亮且清晰,说明扩增效果最好,最终确定Bst 2.0DNA聚合酶的添加量为0.8μL。
⑤反应温度的优化
调整反应温度分别为60、61、62、63、64、65、66℃,扩增时间为1h,然后在80℃条件下加热5min终止反应。利用2%AGE对5μL的反应产物进行检测,在紫外光下电泳条带最亮的条件为最佳反应温度。
结果如图5所示,反应温度为60~66℃之间时均可发生LAMP扩增反应,随着反应温度的升高,电泳条带均先变亮再变暗,最终确定反应温度为62℃~64℃。
⑥扩增时间的优化
在65℃条件下分别扩增30、45、60、75、90min,然后在80℃条件下加热5min终止反应。利用2%AGE对5μL的反应产物进行检测,选择在紫外光下电泳条带亮度稳定且最短的扩增时间。
结果如图6所示,扩增时间在30min以上时均可发生LAMP扩增反应,随着反应温度的升高,电泳条带均先变亮再变暗,最终确定反应时间为30~60min。
LAMP体系的确定
通过对LAMP体系中各组分及反应条件的优化,建立了最佳的扩增体系如表2所示。
表2检测阪崎克罗诺杆菌的最优LAMP扩增体系
优选地,在63℃恒温下扩增1h,然后在80℃处理5min使酶失活以终止反应。
(2)HNB染料添加量的优化
将HNB粉末用去离子水稀释为1.5mM的浓度作为母液进行分装,-20℃避光保存备用。随后优化LAMP体系中HNB染料的浓度,调整HNB染料母液的添加量使其终浓度分别为90、120、150、180μM,并进行LAMP扩增反应,以2μL ddH2O代替DNA作为阴性对照。根据阳性结果显示天蓝色,阴性结果显示紫罗蓝色的情况选择HNB的最佳浓度。
结果如图7所示,当HNB的浓度不低于120μM时,阳性反应体系呈现天蓝色,阴性显示紫色,最终确定体系中HNB的终浓度为120μM~180μM。
(3)LAMP-HNB检测法灵敏度测定
菌株的活化与培养
在20mLTSB液体培养基中,以2~3%的比例加入冻存菌液,于37℃、200r/min的条件下培养8h,并重复一次对菌液进行二次活化。之后在TSA固体培养基上进行三区划线,37℃下培养14~16h进行纯化,挑取纯化后TSA固体培养基中的单菌落于20mL TSB液体培养基中,在37℃、200r/min的摇床中培养8h,以获得对数生长期末期的菌种,取部分菌液进行DNA的提取,用于后续试验。
菌落计数方法
采用涂布平板法进行计数。利用经过灭菌的0.85%的生理盐水进行稀释,对细菌培养液进行连续10倍梯度稀释。然后分别取稀释倍数为10
DNA的扩增
按照建立好的LAMP-HNB体系对提取的DNA进行扩增,根据表3所示的PCR反应体系扩增阪崎克罗诺杆菌的DNA。
表3PCR反应体系
通过系统的优化试验,得到最佳的反应条件为:94℃预变性3min,94℃变性30s,56℃退火45s,72℃延伸30s,共进行30个循环,72℃终延伸5min。利用1%的琼脂糖凝胶电泳法(AGE)对5μL的反应产物进行检测,并利用紫外凝胶成像仪观察电泳条带。
①纯培养物的检测灵敏度
选取阪崎克罗诺杆菌ATCC 29544作为标准菌株进行培养,在20mL TSB培养基中37℃、200r/min条件下培养8h以达到生长对数期,用0.85%的生理盐水将菌液进行10倍梯度稀释并涂布计数,确定其活菌浓度,使目标菌浓度范围在10
检测结果如下:
灵敏度的检测结果如图8所示,通过平板计数以确定阪崎克罗诺杆菌的浓度范围为4.5×10
②婴儿配方奶粉中阪崎克罗诺杆菌的检测灵敏度
将购买的PIF按照FDA建议和推荐的常规检验法进行检测,以确定奶粉中完全不含有阪崎克罗诺杆菌。然后将阪崎克罗诺杆菌ATCC 29544人工污染到无菌的PIF中:取10g奶粉溶于90mL无菌的蛋白胨水溶液(BPW)中并混合均匀,经离心、重悬等前处理步骤后,分别加入不同稀释度的纯培养菌液,以获得阪崎克罗诺杆菌的终浓度范围在10
检测结果如下:
PIF中阪崎克罗诺杆菌灵敏度的检测结果如图9所示,通过平板计数以确定人工污染乳中阪崎克罗诺杆菌的浓度范围为5.7×10
(4)LAMP-HNB检测法的特异性
应用构建好的LAMP-HNB可视化检测方法,针对8株阪崎克罗诺杆菌和14株非阪崎克罗诺杆菌进行特异性验证,观察LAMP-HNB体系的颜色变化,判断检测方法的特异性。每个菌株均做三组平行试验。
结果如表4所示,所有8株阪崎克罗诺杆菌的可视化检测结果均为阳性,而对14株非阪崎克罗诺杆菌的扩增结果均为阴性。因此证明了基于新核酸靶点的LAMP-HNB可视化检测方法对阪崎克罗诺杆菌具有特异性。
注:“+”代表阳性;“–”代表阴性
(5)LAMP-HNB可视化检测方法的实用性评估
从全国的零售市场购买50份PIF,并按照国家标准的微生物检验法(GB4789.40-2016)确定其中不含有阪崎克罗诺杆菌。随后选取30份乳粉进行人工污染阪崎克罗诺杆菌并作为阳性样品,菌液浓度控制在101CFU/mL,另20份乳粉作为阴性样品,利用构建的LAMP体系分别进行扩增,并采用LAMP-HNB可视化方法进行检测,根据结果判定其符合率和实用性。
实用性评估结果:
应用本发明构建的可视化检测方法对30份人工污染乳进行检测,扩增结果均为阳性;对20份正常无污染的乳粉进行检测,扩增结果均为阴性。因此,本研究建立的检测阪崎克罗诺杆菌的LAMP-HNB可视化方法检测乳粉的符合率为100%,具有较高的实用性。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
SEQUENCE LISTING
<110> 东北农业大学
<120> 一种用于阪崎克罗诺杆菌检测的新靶标、引物组及其检测方法
<160> 5
<170> PatentIn version 3.5
<210> 1
<211> 211
<212> DNA
<213> 1
<400> 1
atctcgctgc ccgctatcgc tataacacgg tgaatgatgc ccatagcgac agaaagctcg 60
acagcgatga gtatacccgt cgtaaatcgc atcagtttga tatctggatt gcctataata 120
tcgggcgctt cggtatgtcc tggaaccctc gcttccgtta ccaggatggc gtcgatcagg 180
gaaccgggag agacacgtac tgggagcata c 211
<210> 2
<211> 18
<212> DNA
<213> 2
<400> 2
atctcgctgc ccgctatc 18
<210> 3
<211> 20
<212> DNA
<213> 3
<400> 3
gtatgctccc agtacgtgtc 20
<210> 4
<211> 40
<212> DNA
<213> 4
<400> 4
actgatgcga tttacgacgg gtcacggtga atgatgccca 40
<210> 5
<211> 38
<212> DNA
<213> 5
<400> 5
ggcgcttcgg tatgtcctgg tctcccggtt ccctgatc 38
- 一种用于阪崎克罗诺杆菌检测的新靶标、引物组及其检测方法
- 阪崎克罗诺杆菌的快速恒温检测方法、引物组及应用
