3D肿瘤全抗原诱导激活的CTL细胞体外扩增培养方法
文献发布时间:2023-06-19 13:27:45
技术领域
本发明涉及T细胞体外诱导培养及扩增技术领域,特别涉及一种3D肿瘤全抗原诱导激活的CTL细胞体外扩增培养方法。
背景技术
随着免疫学和肿瘤生物学的发展,免疫治疗作为肿瘤治疗的一种新策略,越来越受到人们的关注。其中过继性免疫细胞治疗为癌症的治疗带来了新的希望,过继性免疫细胞治疗是指通过输入自身或同种异体的肿瘤杀伤细胞来治疗肿瘤的方法。它一方面可以纠正细胞免疫功能的低下,促进宿主抗肿瘤免疫的功能,另一方面还可以直接发挥抗肿瘤的作用。
其中细胞毒性T细胞(CTL)的过继治疗有着特殊的优越性。即易获得、可操作性强、靶向性好、安全性高等特点,是实体肿瘤治疗应用研究的热点。细胞毒性T淋巴细胞(CTL)通常称为CD8
虽然CTL细胞具有以上诸多功能优点,但在应用方面还存在一些障碍及困难,其中最突出的一个是特异性CTL细胞的数量不足。
发明内容
为解决以上现有技术的不足,本发明提供了3D肿瘤全抗原诱导激活的CTL细胞体外扩增培养方法。
为了实现上述目的,本发明采用的技术方案为:
3D肿瘤全抗原诱导激活的CTL细胞体外扩增培养方法,包括如下步骤:
步骤一:第1天,外周血单个核细胞置于含有IL-2、淋巴母细胞激活因子、自体血清的培养基中进行培养。
可选地,步骤一中采用Ficoll密度梯度离心法从采集的外周血中分离获取外周血单个核细胞。
可选地,步骤一中所述的IL-2的浓度为100U/ml-2000U/ml;优选地,步骤一中所述的IL-2的浓度为1000U/ml。
可选地,步骤一中所述的淋巴母细胞激活因子为植物凝集素、刀豆凝集素、菜豆凝集素等的一种或任意组合,其浓度为0.1μg/ml-5μg/ml;优选地,步骤一中所述的淋巴母细胞激活因子组合为植物凝集素,浓度为2μg/ml。
可选地,步骤一中所述的自体血清浓度为1%-5%;优选地,步骤一中所述的自体血清浓度为5%。
可选地,步骤一中所述的培养基为X-Vivo15培养基、RPMI1640培养基、DMEM/F12培养基等的任意一种;优选地,步骤一中所述的培养基为X-Vivo15培养基。
步骤二:第3天,加入含有IL-2、3D肿瘤全抗原、自体血清的培养基中进行诱导激活培养。
可选地,步骤二中所述的IL-2的浓度为100U/ml-2000U/ml;优选地,步骤二中所述的IL-2的浓度为1000U/ml。
可选地,步骤二中所述的3D肿瘤全抗原为负载肿瘤全裂解物抗原的PLGA、明胶、海藻酸钠微球,其(3D肿瘤全抗原)直径为0.1μm-10μm,浓度为0.1ml/L-0.3ml/L;优选地,步骤二中所述的3D肿瘤全抗原为负载肿瘤全裂解物抗原的PLGA微球,其直径为0.1μm-4.5μm,浓度为0.2ml/L。
可选地,步骤二中所述的3D肿瘤全抗原为自体原代微肿瘤抗原、异体原代微肿瘤抗原中的任意一种;优选地,步骤二中所述的3D肿瘤全抗原为自体原代微肿瘤抗原。
可选地,步骤二中所述的自体血清浓度为1%-5%;优选地,步骤二中所述的自体血清浓度为5%。
步骤三:第5天,加入含有IL-2、T细胞双信号激活因子、自体血清的培养基中进行活化增殖培养。
可选地,步骤三中所述的IL-2的浓度为100U/ml-2000U/ml;优选地,步骤三中所述的IL-2的浓度为1000U/ml。
可选地,步骤三中所述的T细胞双信号激活因子为OKT-3、IL-12、IFNγ等的一种或任意组合,其中OKT-3的浓度为5ng/ml-50ng/ml,IL-12的浓度为5ng/ml-50ng/ml,IFNγ的浓度为5ng/ml-50ng/ml;优选地,步骤三中所述的T细胞双信号激活因子为OKT-3、IL-12、IFNγ,其中OKT-3的浓度为20ng/ml,IL-12的浓度为10ng/ml,IFNγ的浓度为20ng/ml。
可选地,步骤三中所述的自体血清浓度为1%-5%;优选地,步骤三中所述的自体血清浓度为5%。
步骤四:第7-15天,每2天定量加入含有IL-2、OKT-3、灭活胎牛血清的培养基进行细胞毒性T细胞扩增培养。
可选地,步骤四中所述的IL-2的浓度为100U/ml-2000U/ml;优选地,步骤四中所述的IL-2的浓度为1000U/ml。
可选地,步骤四中所述的OKT-3的浓度为5ng/ml-50ng/ml;优选地,步骤四中所述的OKT-3的浓度为20ng/ml。
可选地,步骤四中所述的灭活胎牛血清的浓度为0.1%-1%。优选地,步骤四中所述的灭活胎牛血清的浓度为0.5%。
本发明的有益效果如下:
(1)使用从外周血中提取的外周血单个核细胞作为初始细胞,通过淋巴母细胞、3D肿瘤全抗原、T细胞双信号的三步信号诱导激活,经过15天的扩增培养可获得扩增60-120倍的CTL细胞,使得患者外周血可作为肿瘤患者过继免疫治疗的所需CTL细胞的来源。
(2)该方法获得的CTL细胞为肿瘤特异性CTL细胞,体外杀伤实验表明经过3D肿瘤全抗原诱导激活的CTL细胞,相比于未诱导的外周血PBMC具有更强的肿瘤杀伤作用,其细胞杀伤活性均在90%以上。
附图说明
图1:本发明实施例1中负载有肿瘤细胞裂解物全抗原的PLGA微球,10x。
图2:本发明实施例1中CTL细胞扩增培养的连续观察,10x。
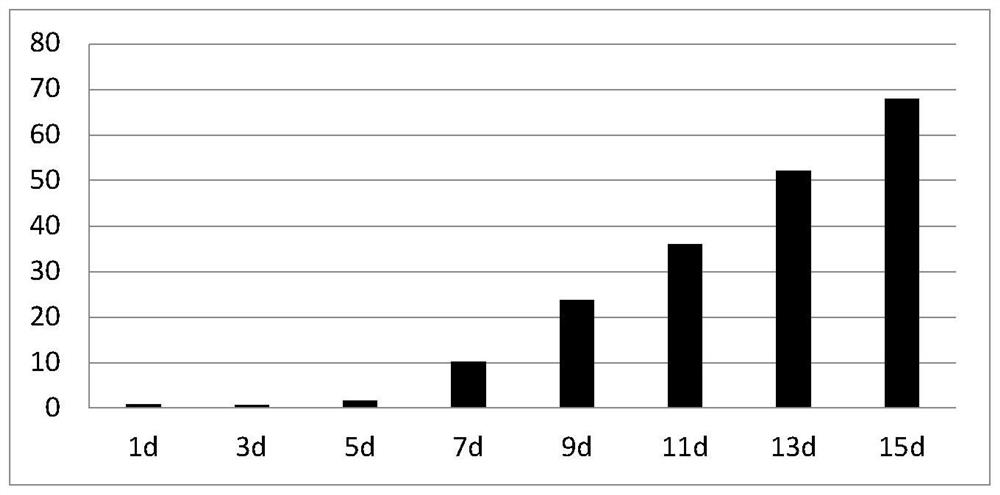
图3:本发明实施例1中细胞毒性T细胞扩增培养的连续扩增计数柱状图。
图4:3D肿瘤全抗原诱导激活的CTL细胞比例变化。
具体实施方式
为了更清楚地说明本发明的技术方案,通过以下实施例对本发明作进一步的描述,以便本领域的技术人员进一步本发明,但以下实施例不对本发明构成任何形式限制。
实施例1:肾癌患者3D肿瘤全抗原诱导激活的细胞毒性T细胞的扩增培养
(1)外周血取自知情同意的肾癌患者,用含有枸橼酸钠抗凝剂的采血管收集,24h内实验,外周血采用Ficoll淋巴细胞分离液分离,用密度梯度离心法分离得到外周血单个核细胞(PBMC),计数待培养。
(2)第1天,取计数完成的外周血单个核细胞,加入含有1000U/ml的IL-2、2μg/ml的植物凝集素、5%的自体血清的X-Vivo15培养基,调整细胞浓度为1x10
(3)第3天,加入含有1000U/ml的IL-2、0.2ml/L的3D肿瘤全抗原、5%的自体血清的X-Vivo15培养基,调整细胞浓度为1x10
3D肿瘤全抗原的制备方法具体如下:
取5*10
称取5mg无菌PLGA微球,装于10ml的离心管中,加入5ml的PBS,混匀,置于37℃的恒温水浴锅中孵育10min,16000rpm/min,离心10min,收集沉淀,加入肿瘤细胞裂解物全抗原,充分旋涡后,置于4℃孵育2h,即为3D肿瘤全抗原,如图1所示,从图中可知,在0.5mg/ml的无菌PLGA微球中加入肿瘤抗原经充分旋涡后,在倒置显微镜下观察发现,新形成的负载有肿瘤细胞裂解物全抗原的PLGA微球形态稳定,大小多数分布在0.1-4.5μm之间。
(4)第5天,加入含有1000U/ml的IL-2、20ng/ml的OKT-3、10ng/ml的IL-12、20ng/ml的IFNγ、5%的自体血清的X-Vivo15培养基,调整细胞浓度为1x10
(5)第7-15天,每2天定量加入含有1000U/ml的IL-2、20ng/ml的OKT-3、0.5%的灭活胎牛血清的X-Vivo15培养基,调整细胞浓度为1x10
整个培养过程中的生长状态如图2所示。从图中可知,CTL细胞在Day1时,细胞呈单个悬浮分布;Day2时,经IL-2、植物凝集素激活后,出现小的细胞团,表明淋巴母细胞已激活;Day3时,加入IL-2、3D肿瘤全抗原后,CTL细胞开始呈现克隆样生长;Day5时,CTL细胞在IL-2、OKT-3、IL-12、IFNγ的存在下呈现克隆样增殖。Day7-15时,CTL细胞在IL-2、OKT-3的存在下呈现快速扩增。
对应的计数柱状图见图3。通过定时统计细胞数量可知,在培养Day3时,CTL细胞数比培养Day1时少,表明随着淋巴母细胞激活,同时在IL-2,3D肿瘤全抗原完全特异性激活下,会有部分细胞发生凋亡,存活的细胞为信号激活的CTL细胞;在Day5后被OKT-3、IL-12、IFNγ激活,进入活化激活生长阶段,细胞数量开始增加。在Day7后,CTL细胞进入快速扩增培养阶段,细胞数量逐步增加。
实施例2:肺癌患者3D肿瘤全抗原诱导激活的细胞毒性T细胞的扩增培养
(1)外周血取自知情同意的肺癌患者,用含有枸橼酸钠抗凝剂的采血管收集,24h内实验,外周血采用Ficoll淋巴细胞分离液分离,用密度梯度离心法分离得到外周血单个核细胞(PBMC),计数待培养。
(2)第1天,取计数完成的外周血单个核细胞,加入含有1000U/ml的IL-2、2μg/ml的植物凝集素、5%的自体血清的X-Vivo15培养基,调整细胞浓度为1x10
(3)第3天,加入含有1000U/ml的IL-2、0.2ml/L的3D肿瘤全抗原、5%的自体血清的X-Vivo15培养基,调整细胞浓度为1x10
3D肿瘤全抗原的制备方法具体如下:
取5*10
称取5mg无菌PLGA微球,装于10ml的离心管中,加入5ml的PBS,混匀,置于37℃的恒温水浴锅中孵育10min,16000rpm/min,离心10min,收集沉淀,加入肿瘤细胞裂解物全抗原,充分旋涡后,置于4℃孵育2h,即为3D肿瘤全抗原,其直径也在0.1-4.5μm之间。
(4)第5天,加入含有1000U/ml的IL-2、20ng/ml的OKT-3、10ng/ml的IL-12、20ng/ml的IFNγ、5%的自体血清的X-Vivo15培养基,调整细胞浓度为1x10
(5)第7-15天,每2天定量加入含有1000U/ml的IL-2、20ng/ml的OKT-3、0.5%的灭活胎牛血清的X-Vivo15培养基,调整细胞浓度为1x10
测试例1:3D肿瘤全抗原诱导激活的细胞毒性T细胞的免疫表型鉴定
(1)取CD3、CD4、CD8荧光标记的单克隆抗体各20μl,分别加入100μl的实施例1和2中培养15天后的CTL细胞,室温暗处反应15min;
(2)PBS洗细胞一次,流式细胞仪测定CTL细胞中CD3+CD8+,在直方图中框出淋巴细胞群,再分别计数5000个淋巴细胞中的各标记细胞在淋巴细胞中的百分比。统计结果如图4所示。从图中可知,在2个实施例中,经3D肿瘤全抗原诱导激活的CTL细胞明显比未激活的外周血中的CTL细胞比例高。
测试例2:3D肿瘤全抗原诱导激活的细胞毒性T细胞的肿瘤细胞杀伤活性检测
(1)收集实施例中患者的对数期生长的肿瘤原代细胞为靶细胞,并调整密度为1x10
(2)将经过3D肿瘤全抗原诱导激活培养收获的CTL细胞作为实验组,以直接分离的外周血单个核细胞作为对照组;
(3)调整CTL细胞密度为5x10
(4)37℃,5%CO
细胞杀伤活性的计算方法:
细胞杀伤活性=(1-(效靶细胞作用孔OD值-效应细胞孔OD值)/靶细胞孔OD值)x100%
结果如表1所示。
表1:实施例1和2的细胞杀伤活性检测结果
结果显示,经过3D肿瘤全抗原诱导激活的CTL细胞,相比于未诱导的外周血单个核细胞具有更强的肿瘤杀伤作用,其细胞杀伤活性均在90%以上。
显然,本发明的上述实施例仅仅是为更清楚地说明本发明所作的举例,而并非是对本发明的实施方式的限定,对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其他不同形式的变化或变动,这里无法对所有的实施方法予以穷举,凡是属于本发明的技术方案所引申出的显而易见的变化或变动仍处于本发明的保护范围之列。
- 3D肿瘤全抗原诱导激活的CTL细胞体外扩增培养方法
- 一种肿瘤抗原复合物体外致敏DC、T细胞获得肿瘤特异性杀伤细胞CTL及其制备方法
