一种产丝氨酸乙酰转移酶的基因工程菌及其构建方法
文献发布时间:2023-06-19 13:48:08
技术领域
本发明属于基因工程技术领域,具体涉及一种产丝氨酸乙酰转移酶的基因工程菌及其构建方法。
背景技术
L-半胱氨酸可用于药物领域、化妆品工业以及食物领域,并且它还是构成谷胱甘肽、甲硫氨酸和生物素合成中的重要中间产物,具有十分重要的经济价值。L-半胱氨酸主要通过从含角蛋白物质(如头发、鬃毛、角、蹄以及羽毛)抽提或前体的酶促转化获得,收率低,能耗高, 水解过程会产生难闻气体及大量废酸,严重污染环境。目前,国际上制备L-半胱氨酸的热点研究方向主要集中于微生物法上,但微生物体内的L-半胱氨酸合成过程复杂,其中L-半胱氨酸的反馈抑制作用、硫源控制等是需要重点处理的问题。
在微生物中,大肠杆菌以L-丝氨酸和乙酰辅酶A为底物,通过由cysE基因编码的丝氨酸乙酰转移酶(SAT)催化,反应生成O-乙酰丝氨酸,然后被O-乙酰丝氨酸硫醇裂解酶(OASTL)催化生成L-半胱氨酸。而在大肠杆菌中高浓度的L-半胱氨酸对细胞有毒害性,所以当L-半胱氨酸积累浓度过大时,自身会通过反馈抑制作用降低丝氨酸乙酰转移酶的活性,从而减少中间产物O-乙酰丝氨酸的合成,以调节L-半胱氨酸浓度。
目前,根据微生物体内的代谢途径,通过两步法生产L-半胱氨酸比较普遍,但其首要问题是降低L-半胱氨酸反馈抑制丝氨酸乙酰转移酶的敏感性。目前实现的方法主要包括筛选L-半胱氨酸营养缺陷型菌株,以提高反馈抗性;定点突变使丝氨酸乙酰转移酶的蛋白质序列中的氨基酸改变或缺失,降低敏感性;比较多个异源的cysE基因,寻找最优的候选者等。通过这些方法,在一定程度上提高了L-半胱氨酸的产量。
在实际工业生产中,两步法还面临着诸多问题。在对基因的改造上就包括上述的降低乙酰丝氨酸转移酶的敏感度、转运基因的改造、前体基因的过量表达改造和敲除分解L-半胱氨酸和L-丝氨酸的基因等,其研发难度大,投入资金高,而产量提升效果有限。除此之外,在发酵运行中,对菌体生长情况的掌控直接影响投料比例,特别是在第二步加入硫源,易对设备产生腐蚀性,这就对发酵和探测设备提出较高的精度和质量要求,加大了生产成本,而且由于硫源物质的存在,影响周边生态环境,后续需要专业设备处理废水、废气,进一步增加了生产成本。鉴于这些研发困难和实际生产问题,寻找更佳的生产方法显得十分必要。
发明内容
本发明所要解决的技术问题为:如何构建一种高效表达丝氨酸乙酰转移酶的工程菌,以实现体外高效催化L-丝氨酸生成O-乙酰丝氨酸。
本发明的技术方案为:一株产丝氨酸乙酰转移酶的基因工程大肠杆菌(Escherichia coli) cysE-30,于2021年08月13日保藏在武汉的中国典型培养物保藏中心,保藏号为CCTCC NO:M 20211026。
本发明的基因工程大肠杆菌(Escherichia coli)cysE-30在催化L-丝氨酸生成O-乙酰丝氨酸上的应用。
一种产丝氨酸乙酰转移酶的基因工程菌,所述基因工程菌为大肠杆菌,导入了SEQID No.1所示丝氨酸乙酰转移酶基因。
进一步地,所述基因工程菌为大肠杆菌BL21(DE3)。
一种构建上述产丝氨酸乙酰转移酶的基因工程菌的方法,包括以下步骤:
(1)以非脱羧勒克氏菌(Leckerciaadecarboxylata)YZ30的总DNA为模板,扩增出cysE基因,所述cysE基因序列如SEQ ID No.1所示;所述非脱羧勒克氏菌(Leckerciaadecarboxylata)YZ30,于2021年08月13日保藏在武汉的中国典型培养物保藏中心,保藏号为CCTCC NO:M20211025;
(2)将步骤(1)克隆得到的cysE基因与质粒载体连接,得到表达载体;
(3)将步骤(2)得到的表达载体转入大肠杆菌中,筛选阳性克隆,即得。
进一步地,所述质粒载体为pCold TF。
进一步地,所述大肠杆菌为BL21(DE3)。
本发明构建具有高效胞外可溶性表达的丝氨酸乙酰转移酶的菌株,利用酶法在体外催化生成中间产物O-乙酰丝氨酸,进而再催化生成L-半胱氨酸,既能避免L-半胱氨酸反馈抑制作用,发挥酶的最大活性,又能比较精确的控制硫源,减少环境污染问题,节约生产成本。
与现有技术相比,本发明具有以下有益效果:
(1)本发明的基因cysE来源于自选野生型菌种非脱羧勒克氏菌株YZ30。YZ30筛选自中国大蒜之乡金乡县的大蒜根际土壤,具有两千多年的种植历史,而大蒜中的有效物质为蒜氨酸(S-烯丙基-L-半胱氨酸亚砜),具有较强的抗菌杀毒作用,其根际分泌物对土壤中的其它菌株具有杀灭作用。非脱羧勒克氏菌株能在两千多年的驯化中得以生存,依赖于该菌在特殊环境下可以利用以S-烯丙基-L-半胱氨酸亚砜为碳源进行增殖(已实验证明),说明菌体内存在着很强的硫代谢途径,而代谢的起点正是L-丝氨酸经丝氨酸乙酰转移酶催化形成O-乙酰丝氨酸,这也是cysE基因能够高效表达的关键所在,并且目前对于该基因的克隆表达,集中于运用PET系列载体进行构建和胞内表达,无法运用到工业生产上。而在胞外可溶性表达上,已有用分枝杆菌丝氨酸乙酰转移酶的克隆表达,其酶的比活度达到0.0773U/mg,本发明酶的比活度达到0.1445U/mg,较大的提高了酶活性。
(2)载体中包含大肠杆菌伴侣蛋白,与其它生物来源标签相比,在大肠杆菌中表达效率高,而宝生物工程(大连)有限公司出产的E.coli BL21菌株对于外源蛋白的表达具有良好的稳定性,配合使用,表达效率和可溶性效果更好。
(3)载体使用冷休克蛋白A作为启动子,使得菌体在低温环境培养时,能够抑制其它蛋白质的表达,从而使目的蛋白的产量和纯度提高。
保藏信息:
基因工程大肠杆菌(Escherichia coli)cysE-30,于2021年08月13日保藏在武汉的中国典型培养物保藏中心,保藏号为CCTCC NO:M 20211026。
非脱羧勒克氏菌(Leckercia adecarboxylata)YZ30,于2021年08月13日保藏在武汉的中国典型培养物保藏中心,保藏号为CCTCC NO:M20211025。
附图说明
图1总DNA中扩增出的cysE基因的电泳图;
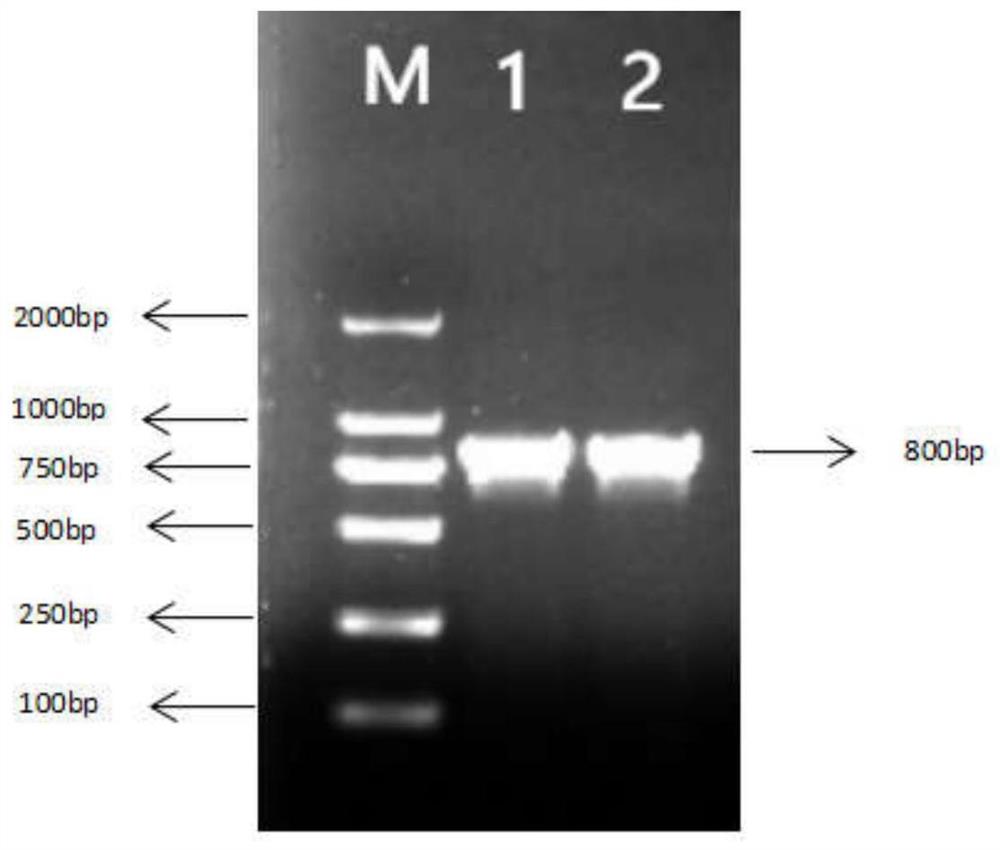
图2cysE基因插入成功电泳验证图;
图3蛋白质电泳检测丝氨酸乙酰转移酶的表达情况;
图4丝氨酸乙酰转移酶催化活性随时间变化图。
具体实施方式
下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为从商业渠道购买得到的。
实施例1携带丝氨酸乙酰转移酶的大肠杆菌菌株的构建
1、利用设计的引物,以非脱羧勒克氏菌株(Leckercia adecarboxylata)YZ30总DNA 为模版经过普通PCR扩增得到cysE基因片段。
其中,在此普通PCR的反应体系中,采用的cysE基因片段的引物序列为:
cysE-F:ATGCCGTGTGAAGAACTGGATATCG(SEQ ID No.2)
cysE-R:TTAAATCCCGTCGCCATACTCAAAG(SEQ ID No.3)
采用的普通PCR反应体系组成为:模版(总DNA)0.5ul、上下游引物各0.5ul、2X PCRMix 12.5ul和ddH2O 11ul,总体系:25ul;采用的普通PCR反应条件为:95℃3min; 95℃30s;55℃30s;72℃60s;循环数34;72℃5min。
以1%琼脂糖凝胶电泳验证并回收PCR扩增产物,结果扩增得到的片段与全基因组测序注释的基因长度基本一致(图1),并将回收后的基因片段寄至北京擎科生物有限公司进行测序。
将测序返回结果与GeneBank数据库中的数据进行BLAST比对,结果表明与cysE基因相似度≥98%,可以确定克隆的基因为cysE基因(SEQ ID No.1)。
2、运用primer 5分析软件分析cysE基因片段,并对照pCold TF质粒的多克隆位点,确定cysE基因两端为BamHI和HindIII两个酶切位点,加上酶切位点序列后引物序列为:
cysE-1’:CCCAAGCTTATGCCGTGTGAAGAACTGGATATCG(SEQ ID No.4)
cysE-2’:CGGGATCCTTAAATCCCGTCGCCATACTCAAAG(SEQ ID No.5)
随后进行PCR扩增,体系如(1)中所示,并进行1%琼脂糖凝胶电泳验证和PCR扩增产物回收。
3、采用BamHI、HindIII限制性内切酶对目的基因片段进行双酶切,得到831bp的cysE片段,并进行核酸电泳和产物回收831bp的cysE片段。其中,酶切体系:水6ul、目的基因片段10ul、10×Kbuffer 2ul、BamHI 1ul、HindIII 1ul;酶切条件:温度30℃,时间4 小时。BamHI、HindIII为DNA限制性内切酶,10×Kbuffer为配套的限制性内切酶缓冲液。 BamHI、HindIII以及10×Kbuffer均购自宝生物工程(大连)有限公司。产物回收采用北京擎科生物有限公司生产的PCR产物纯化及胶回收试剂盒进行回收。
同时,采用BamHI、HindIII限制性内切酶对质粒pCold TF进行双酶切,得到5757bp线性质粒片段,并进行核酸电泳和产物回收5757bp的质粒片段。其中,酶切体系为水11ul、pCold TF 5ul、10×Kbuffer 2ul、BamHI 1ul、HindIII 1ul,酶切条件为温度30℃、时间4h。
pCold TF质粒为购自湖南丰晖生物科技有限公司的商业质粒。产物回收采用北京擎科生物科技有限公司生产的PCR产物纯化及胶回收试剂盒进行回收。
4、将831bp的cysE片段和5757bp的线性质粒片段经DNA连接酶连接,得到表达载体pCold TF-cysE DNA连接。其中,连接体系为pCold TF双酶切回收产物(即5757bp的线性质粒片段)1.5ul,831bpcysE片段7ul、10×T4 DNA ligase buffer1ul、 T4DNAligase0.5ul;连接条件为温度16℃、时间12h。
T4 DNA ligase为商用的DNA连接酶,10×T4 DNA ligase buffer为配套的连接酶缓冲液。T4 DNA ligase以及10×T4 DNA ligase buffer均购自宝生物工程(大连) 有限公司。
5、将表达载体pCold TF-cysE转入大肠杆菌感受态细胞BL21中,具体步骤为:取一支100μL大肠杆菌感受态细胞BL21与连接产物(即表达载体pCold TF-cysE)混合,冰上吸附30min;将离心管放到42℃循环水浴中热激60s;快速将离心管转移到冰浴中,使细胞冷却2min;每管加900μL SOC培养基,37℃,200r/min培养1h;取100μL涂LB氨苄青霉素抗性平板,用无菌的涂布棒将菌液均匀涂满整个平板表面;平板37℃培养,正置 30min后倒置培养12-16h,可出现菌落。
随机挑取3株转化子,分别命名为PcysE 1~PcysE 3。并对此三株菌株进行鉴定。
上述鉴定3株转化子的步骤为:抽提菌株中的质粒,利用引物
cysE-F:ATGCCGTGTGAAGAACTGGATATCG、
cysE-R:TTAAATCCCGTCGCCATACTCAAAG;
进行PCR扩增验证,扩增cysE的PCR反应条件和步骤(1)中条件一致;随后,对扩增产物进行琼脂糖凝胶电泳。在图2中,泳道1-3分别为转化子PE1~PE3的菌落PCR验证条带;泳道4为DNA Mark(即标准DNA混合物),泳道4从下至上条带所对应的相对分子量依次为:100、250、500、750、1000、2000;泳道5为pCold TF-cysE质粒为模板的阳性对照,泳道6为宿主菌菌落为模板的阴性对照。由图2可看出,转化子PE1~PE3(即泳道 1~3)均能成功扩增出cysE基因条带,大小约为800bp,与以pCold TF-cysE质粒为模板(即阳性对照,泳道5)扩增的产物条带一致,说明转化子PE1~PE3成功转化pCold TF-cysE质粒。从成功转化pColdTF-cysE质粒的转化子中随机选取(如选取PcysE 2菌株),命名为基因工程大肠杆菌(Escherichia coli)cysE-30,于2021年08月13日保藏在武汉的中国典型培养物保藏中心,保藏号为CCTCC NO:M 20211026。
大肠杆菌感受态细胞BL21购自宝生物工程(大连)有限公司。
6、将筛选出来的PcysE菌株和大肠杆菌BL21-pCold TF菌株分别接种至于装有5mlLB 培养基的PA瓶中,200rpm,37℃培养10~14h。将PA瓶中发酵的种子按1%接种量接种至发酵培养基中,标记为PcysE和PTF。发酵培养基配方为(g/L):酵母粉3~7、蛋白胨8~12、NaCl 9~13、CaCO
取出PcysE和PTF菌液,分别装入离心管中,12000r/min离心10分钟,收集上清细胞培养液和菌体,菌体加入蒸馏水重悬,并用超声波细胞破碎仪进行破碎,再进行12000r/min离心10分钟,取少量上清细胞破碎液和细胞培养液进行蛋白质染色,并放入100℃水浴锅中煮沸变性10分钟。制备(SDS-PAGE)蛋白电泳凝胶。凝胶配方为:①12.5%分离胶分离胶缓冲液4mL、Acr/Bis 6.7mL、H
将低分子量蛋白Mark和处理后的PcysE和PTF的细胞破碎液和细胞培养液进行蛋白电泳,电泳结果如图3,M泳道为蛋白Mark,1、2泳道为PcysE细胞培养液,能看到一条比较清晰的分子量大小约32kDa的蛋白条带,3、4泳道为对照空白载体PTF细胞培养液,没有任何蛋白条带出现,对比说明插入的cysE基因在胞外得到了较高的表达;5、6泳道为 PcysE破碎后的全细胞蛋白电泳图,对比1、2泳道,在对应的位置32kDa处并没有出现黑色条带,说明插入的cysE基因并没有在胞内表达,而是全部在胞外进行可溶性表达;7、8 泳道为对照空白载体PTF破碎后的全细胞蛋白电泳,在对应的位置32kDa处并没有出现黑色条带,说明空白载体PTF的细胞本身并不表达cysE基因。
7、将PcysE上清液放入15mL、滤孔大小为大于分子量30kDa的超滤管中进行浓缩,得到含有粗酶的浓缩液1.5mL,并进行活性检测,活性检测方法采用Kredich的方法测定丝氨酸乙酰转移酶的酶活性。其反应原理为:L-丝氨酸和乙酰辅酶A在丝氨酸乙酰转移酶的催化下生成O-乙酰丝氨酸和辅酶A,辅酶A与DTNB(5,5-二硫代-双-2-硝基苯甲酸)之间的二硫键进行交换,断裂DTNB的二硫键产生2-硝基-5-硫代苯甲酸(NTB
测试数据:1ml的总反应体系,酶液50μl(11mg),在2min内吸光度变化为0.045,NTB
根据光度法酶活测定计算公式:
ΔA:溶液吸光度变化量,无单位
ε:发光物质的摩尔吸光系数,单位L(mol·cm)
b:光程,既光线穿过溶液的距离,通常为比色杯透光面宽度,单位cm
t:反应时间,单位min
V
代入上述数据可得:酶活力=1.59μmol/min。即1.59U/50μl,换算后为31.80U/ml,比活度为0.1445U/mg,具有较高的酶活。
序列表
<110> 绵阳师范学院
<120> 一种产丝氨酸乙酰转移酶的基因工程菌及其构建方法
<160> 5
<170> SIPOSequenceListing 1.0
<210> 1
<211> 822
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 1
atgccgtgtg aagaactgga tatcgtctgg aacaatatta aagccgaagc ccgggctctg 60
gctgactgtg agcccatgct ggccagcttc taccacgcga cgctactcaa gcacgaaaat 120
ctcggcagcg ccctgagcta tatgctcgcc aataaactgg cttcaccgat catgccggca 180
atcgccatcc gtgaagtggt ggaagaggcc tatgcggctg acccggagat gatcgcctcc 240
gccgcctgcg atattcaggc ggtacgcaac cgcgacccgg cggtggacaa atactccacg 300
ccattactct atctgaaagg tttccacgcc ctgcagtcct accgtatcgg ccactggctg 360
tggaacgaag gtcgccgcgc gctggccatc ttcttgcaga atcaggtctc ggtgagcttc 420
caggtggata ttcacccggc ggcgaagatt ggccgcggca tcatgctcga ccacgcaacg 480
ggtattgtgg tgggtgaaac ggcggtgatt gaaaacgacg tctcaatcct gcagtccgtt 540
accctgggcg ggaccgggaa aaccagcggt gaccgtcacc cgaaaatccg tgaaggggtg 600
atgattggcg caggcgcgaa gatcctcggc aacatcgaag tcgggcgcgg cgcgaagatt 660
ggcgccggtt cggtggtgct gcaacctgtc ccgccgcata ccaccgccgc aggcgtcccg 720
gcacgtatcg tcggcaagcc agacagcgac aagccagcga tggatatgga tcagttcttc 780
aacggcatcc accatacctt tgagtatggc gacgggattt aa 822
<210> 2
<211> 25
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 2
atgccgtgtg aagaactgga tatcg 25
<210> 3
<211> 25
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 3
ttaaatcccg tcgccatact caaag 25
<210> 4
<211> 34
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 4
cccaagctta tgccgtgtga agaactggat atcg 34
<210> 5
<211> 33
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 5
cgggatcctt aaatcccgtc gccatactca aag 33
- 一种产丝氨酸乙酰转移酶的基因工程菌及其构建方法
- 一种携带丝氨酸乙酰转移酶基因的地衣芽孢杆菌菌株及其构建方法与应用
