大黄素在制备治疗偏头痛药物中的应用
文献发布时间:2023-06-19 13:48:08
技术领域:
本发明属于医药领域,具体涉及大黄素在制备治疗偏头痛药物中的应用。
背景技术:
偏头痛(Migraine)是单侧或双侧搏动性头痛的原发性中枢神经系统功能紊乱性疾病,其病因较为复杂,目前主流学说为三叉神经血管学说,该学说认为脑血管周围的三叉神经末梢受到刺激后,释放P物质(SP)、神经激肽A(NKA)、降钙素基因相关肽(CGRP)等神经肽,使相邻颅内血管的血管壁过度扩张,产生波动性头痛。
目前治疗偏头痛的药物有:钙离子拮抗剂,5-HT1B/1D受体激动剂,α肾上腺素受体阻断剂,CGRP受体拮抗剂,非甾体类消炎药等,但是它们均存在一定的毒副作用。目前偏头痛不同类型的治疗药物由于疗效不充分、不良反应明显、依从性欠佳以及药物可及性等问题,不能满足治疗需求。因此,迫切需要寻找新的偏头痛疗法。越来越多临床和临床前证据表明,植物药物或植物性药物制剂在治疗偏头痛疾病方面具有广阔的前景,许多患者也转向以中药和植物药来代替当前的常规药物疗法治疗偏头痛。
大黄素是一种植物来源的羟基蒽醌,是从大黄属、蓼属、鼠李属和番泻叶等中药中分离得到的活性成分,具有潜在的治疗心血管疾病和多种神经系统疾病的活性。近年来,对大黄素药理作用机制进行的大量深入研究发现,大黄素具有广泛的药理作用,主要集中在抑制细胞增殖、抗炎、收缩平滑肌等方面。此外,大黄素可减少三叉神经节CGRP的释放,抑制口面部疼痛,但尚未有关大黄素治疗偏头痛的研究。
发明内容
本发明的目的在于提供大黄素基于cGMP-PKG通路在制备治疗偏头痛的药物中的应用。
本发明的目的可以通过以下技术方案实现:
大黄素在制备治疗偏头痛药物中的应用。大黄素结构式如下:
所述的药物是基于cGMP-PKG通路治疗偏头痛的药物。研究表明,大黄素通过cGMP-PKG通路,减弱脑组织中PKG蛋白的表达,减弱C-fos的活化,并调节血管活性物质,如NO,CGRP,P物质,TNF-α和cGMP,从而缓解偏头痛症状。
所述的药物是能够抗炎和抑制血管扩张的治疗偏头痛的药物。
所述的药物是以大黄素作为活性成分与药学上可接受的载体或辅料制备成的药物组合物。所述药物的剂型包括但不限于口服剂型或适用于鼻腔给药的剂型。
本发明的有益效果:
本发明研究结果表明,可以将大黄素作为具有低副作用的潜在偏头痛治疗化合物。此研究对抗偏头痛药物的研发具有重要意义。
附图说明
图1为大黄素对硝酸甘油诱导的偏头痛大鼠的疼痛反应的影响;
其中,(A)大黄素对爬笼次数的影响,(B)大黄素对挠头次数的影响。在硝酸甘油注射后2h内,以30min为单位分别记录爬笼、挠头次数。数据以平均值±SD(n=12)表示;
图2为大黄素对硝酸甘油诱导的偏头痛大鼠血浆中血管活性物质的影响;
其中,(A)一氧化氮(NO),(B)降钙素基因相关肽(CGRP),(C)P物质(SP),(D)肿瘤坏死因子-α(TNF-α)和(E)环磷酸鸟苷(cGMP)。数据以平均值±SD表示(n=6);
图3为大黄素对硝酸甘油注射后脑皮层中C-fos神经元的影响;
其中,免疫组织化照片:(A)空白组,(B)模型组,(C)布洛芬组,(D)大黄素组;柱形图:(E)C-fos阳性细胞的数量;(F)积分光密度值(IOD);在显微镜下以200×的放大率拍摄照片:比例尺=20μm;数据平均值±SD以表示(n=6);
图4为大黄素对硝酸甘油注射后脑干中C-fos神经元的影响;
其中,免疫组织化照片:(A)空白组,(B)模型组,(C)布洛芬组,(D)大黄素组;柱形图:(E)C-fos阳性细胞的数量;(F)积分光密度值(IOD);在显微镜下以200×的放大率拍摄照片:比例尺=20μm;数据平均值±SD以表示(n=6);
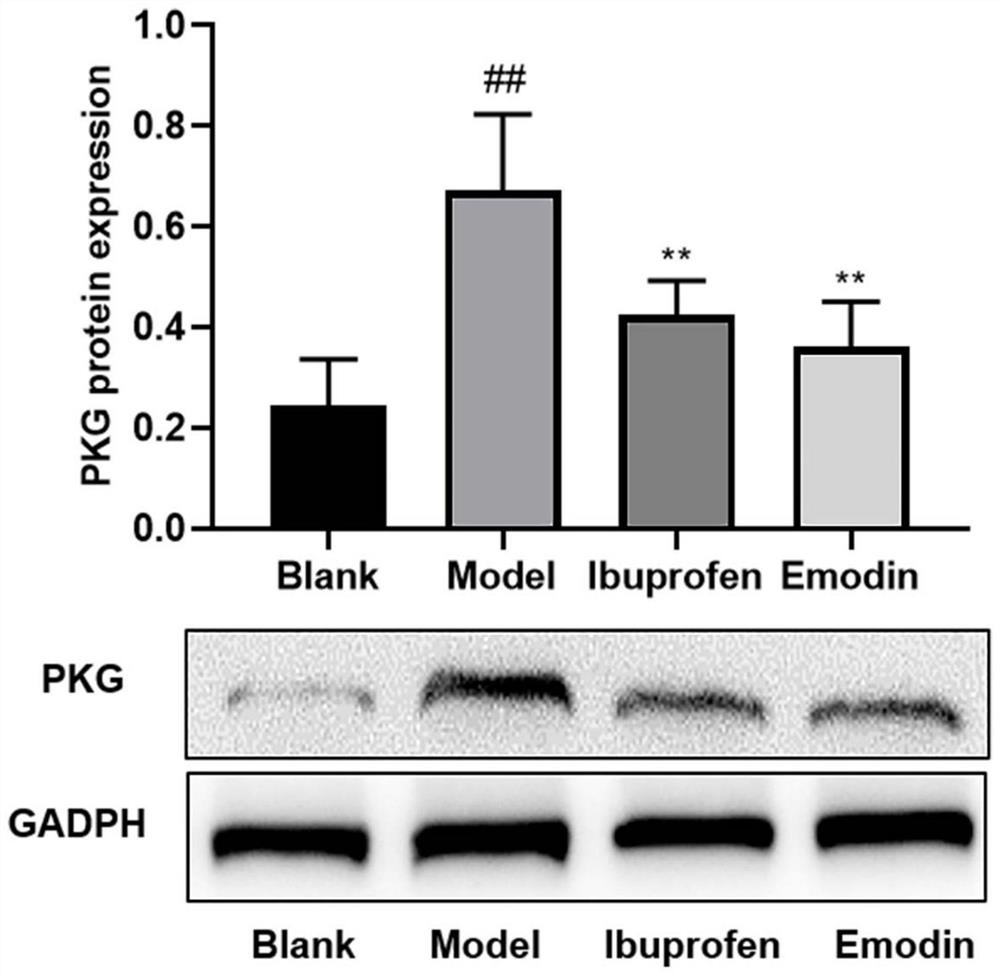
图5为大黄素对硝酸甘油诱导的脑组织中PKG蛋白水平的影响;
其中,
具体实施方式
以下结合具体实施例来进一步描述本发明,本发明的优点和特点将会随着描述而更为清楚。但这些实施例仅是范例性的,并不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。
本发明提供大黄素基于cGMP-PKG通路在制备治疗偏头痛药物中的应用,所述大黄素为治疗偏头痛药物中的单一活性成分。在本发明中,所述大黄素来源于常规市售。
实施例1
一、材料与方法
1.试验材料
大黄素纯度98%,购买于北京迈瑞达科技有限公司(批号M026282);布洛芬颗粒购买于石药集团有限公司(批号363200601);羧甲基纤维素钠购买于安徽山河药用辅料股份有限公司(批号160511);乌拉坦购买于国药集团化学试剂有限公司(批号20190419);硝酸甘油注射液购买于北京益民药业有限公司(批号20200310);大黄素和布洛芬颗粒分别用0.5%的羧甲基纤维素钠进行溶解给药。SD大鼠(180-220g)48只,雌雄各半,购买于南京青龙山动物厂(合格证编号:20210105Aazz0100000962,生产许可证号:SCXK(浙)2019-0002)。参照文献方法,于温度(19–21℃)、湿度(40–70%)、光照时间为8:00到20:00环境下进行饲养,自由摄食、饮水,适应环境7天。动物涉及的所有操作和饲养均按照美国国立卫生研究院的实验动物护理和使用指南进行。
2.动物分组及给药
经过一周的适应性饲养,不同性别的大鼠随机分为四组(6只雌+6只雄/组,雌雄分笼):空白组,模型组,布洛芬组和大黄素组。空白组和模型组用相应的0.5%(w/w,质量分数)CMC-Na处理7天,布洛芬组和大黄素组用固定剂量的相应药物溶液预处理7天。分别给药最后一天,提前12h禁食,灌胃给药(布洛芬:36mg/kg;大黄素:27.3mg/kg),除了空白组,其他各组皮下注射硝酸甘油(Nitroglycerin,NTG)。
3.动物行为学研究
在最后一次给药后30min,除空白组外,模型组,布洛芬组和大黄素组以10mg/kg的剂量皮下注射硝酸甘油溶液进行偏头痛造模。约3-5min后,动物出现烦躁不安的症状,并伴有许多典型症状,例如红耳朵,爬笼,身体晃动和抓头。这些症状可持续约2h。挠头和爬笼比其他疼痛症状反应更明显,因此将挠头、爬笼视为阳性反应。记录2h内每一只大鼠的疼痛反应次数(n=12),记录人对动物的分组处理不知情。
4.生化检测
行为学观察2h后,每组大鼠组内进行随机编号继而腹膜内注射20%乌拉坦进行麻醉(5mL/kg),仰卧固定在大鼠板上,进行腹主动脉采血,血液自然凝固30min,3000转离心10min,取上清,即得血清。根据一氧化氮生化试剂盒说明书(南京建成生物工程研究所),使用比色法测定血浆中的一氧化氮水平,同时使用Elisa试剂盒(商品名:CGRP、SP、TNF-α和cGMP试剂盒,南京卡米洛生物工程有限公司),测量血清中NO、CGRP、P物质、TNF-α和cGMP的水平。
5.免疫组化
大鼠采血后,打开胸腔,心脏灌注含肝素钠的生理盐水(0.9%(w/w,质量分数)氯化钠+20U/mL肝素钠)300mL/只,迅速断头,冰上取脑,质量分数4%多聚甲醛溶液固定24h,然后用20%(w/w,质量分数)蔗糖溶液使脑脱水,包埋在组织冷冻培养基(OTC)培养基中,切成40μm的切片(含海马组织冠状切与含延髓部位矢状切)。将脑切片用PBS冲洗3次,在3%过氧化氢溶液中孵育30min,然后再次冲洗干净。然后,将切片用含0.3%(v/v)Triton X-100的5%(v/v)正常山羊血清(25℃)预处理30min。所有组的切片均与兔抗大鼠C-fos抗体一起孵育(37℃,2-4h),空白组在相同条件下用PBS预处理。清洗干净后,将切片分别与生物素化的山羊抗兔抗体和辣根过氧化物化合物孵育1h。使用3,3'-二氨基联苯胺底物溶液显色,并用苏木素复染,最后脱水封片。Leica显微镜进行拍照,以200x的放大倍观察染色的切片。阳性C-fos-ir神经元呈棕黄色,阴性神经元呈蓝紫色。最后,使用Image-Pro Plus记录阳性细胞的数量、阳性染色的积分光密度值IOD。每只大鼠三次计数,将平均值作为测量值(n=6)。
6.蛋白免疫印迹
大鼠腹腔注射20%乌拉坦麻醉后,心脏灌流(同上),快速断头,冰上采脑,快速置于液氮中,-80℃冰箱中保存,待用。将脑组织置于陶瓷研钵中,加液氮进行研磨,取约100mg破碎的脑组织,根据试剂盒说明,加蛋白裂解液进行总蛋白的提取,根据BCA试剂盒的说明,计算样品的蛋白浓度,RAPI对蛋白浓度进行均一调节,对蛋白样进行变性,-20℃保存备用。用SDS-PAGE进行电泳,随后将蛋白转移到硝酸纤维素膜上。使用5%脱脂牛奶封闭印迹,分别与相应浓度的一抗PKG1(1:1000;Proteintech;catalog number:21646-1-AP)、GAPDH(1:1000;cell signaling technology;catalog number;2118)和二抗(1:4000,HangzhouFude Biological Technology Co.,LTD,catalog number:3256751)孵育。使用ECL增强型发光液,Tanon-5200凝胶成像仪,进行显影拍照。
7.统计分析
数据均采用Graph Pad Prism 6.0软件进行统计学处理,所得结果以均数±标准差(Mean±SD)表示。各组间均数比较采用IBM SPSS Statistics 19.0软件进行单因素方差分析(One-way ANOVA),以p<0.05认为有统计学差异。
二、结果
1.动物行为学研究
造模3-5min后,大鼠出现耳红、挠头、爬笼等疼痛症状。从图1(B)可以看出,与空白大鼠相比,皮下注射硝酸甘油可极显著增加大鼠的挠头次数(p<0.01),模型大鼠在注射后90min内表现出更长的挠头时间(p<0.01)。与模型组相比,布洛芬颗粒可从0到90min内极显著缓解大鼠的挠头的疼痛反应(p<0.01);此外,大黄素的使用在注射后60min内极显著减少了挠头次数(p<0.01);从60到90min,极显著减弱了大鼠的挠头次数(p<0.01),且空白组、布洛芬组、大黄素组,三者之间无统计学差异。此后,所有大鼠最后都显得疲倦且烦躁不安现象。同样,如图1(A)所示,在0-30min内爬笼次数达到峰值,并持续约90min。与模型组相比,从0到90min内布洛芬和大黄素的预处理极显著减少了爬笼次数(p<0.01)。布洛芬颗粒和大黄素大鼠在0到30min内都出现了爬笼的高峰,并且在60min时似乎感到疲倦。
2.大黄素抑制硝酸甘油诱导的偏头痛大鼠的NO水平升高
如图2(A)所示,与空白组比较,模型组大鼠体内的NO水平极显著增加(p<0.01);与模型组比较,布洛芬颗粒和大黄素可极显著降低NO的水平(p<0.01),布洛芬组抑制效果强于大黄素组。与行为学研究结果一致。
3.大黄素抑制硝酸甘油诱导的偏头痛大鼠的CGRP水平升高
从图2(B)可以看出,与空白组比较,模型组大鼠的CGRP水平显著高于空白大鼠(p<0.01)。布洛芬和大黄素预处理可极显著抑制CGRP水平的升高(p<0.01),且布洛芬组和大黄素组之间无显著差异(p>0.05)。
4.大黄素抑制硝酸甘油诱导的偏头痛大鼠的P物质水平升高
如图2(C)所示,与空白组比较,模型组大鼠的P物质水平显著高于空白组大鼠(p<0.01),布洛芬组和大黄素组的P物质均无统计学差异(p>0.05);与模型组比较,布洛芬组和大黄素组可以极显著抑制P物质含量的增高(p<0.01);布洛芬组与大黄素组之间无统计学差异(p>0.05)。
5.大黄素抑制硝酸甘油诱导的偏头痛大鼠的TNF-α水平升高
从图2(D)可以得到,与空白组比较,模型组大鼠体内的TNF-α水平明显高于空白组(p<0.01),布洛芬组和大黄素组体内的TNF-α均无统计学差异(p>0.05);与模型组比较,布洛芬组和大黄素组可以显著抑制TNF-α含量的增高(p<0.05);布洛芬组与大黄素组之间无统计学差异(p>0.05)。
6.大黄素抑制硝酸甘油诱导的偏头痛大鼠的cGMP水平升高
从图2(E)可以得到,与空白组比较,模型组大鼠体内的cGMP水平明显高于空白组(p<0.01),布洛芬组和大黄素组体内的cGMP均无统计学差异(p>0.05);与模型组比较,布洛芬组和大黄素组可以显著抑制cGMP含量的增高(p<0.01),布洛芬组抑制效果稍强于大黄素组(p<0.05)。
7.大黄素减弱硝酸甘油诱导的C-fos免疫反应神经元活化
对不同脑组织区域(皮层、海马、小脑、脑干)c-Fos免疫活性细胞数目和积分光密度进行分析,发现不同组之间C-fos表达差异主要体现在皮层与脑干区,结果分见图3和图4。
从图3(E)可以看出,模型大鼠中C-fos阳性细胞的数量比空白大鼠要大(p<0.01),而通过布洛芬和大黄素的预处理可以逆转这种增加(p<0.01),布洛芬颗粒和大黄素在减弱硝酸甘油诱发的C-fos神经元的激活中起着作用,两者之间无显着差异(p>0.05)。由图3(F)所示,与空白组比较,模型组的积分光密度要大得多(p<0.01),而布洛芬和大黄素则显着减少了C-fos阳性细胞的积分光密度(p<0.01)。结果与图3(A–D)所示一致。NTG激活的C-fos免疫反应阳性神经元呈棕黄色,而阴性细胞则呈蓝紫色。在图3(B)中存在大量的棕黄色阳性细胞区域,而在图3(A)中空白组的染色切片存在少量棕黄色阳性细胞区域。图3(C和D)中的棕黄色区域比图3(B)中的棕黄色区域小得多,这表明布洛芬和大黄素预处理可减轻皮层中C-fos神经元的过度表达。
从图4(E)可以看出,模型大鼠中C-fos阳性细胞的数量比空白大鼠要大(p<0.01),而通过布洛芬和大黄素的预处理可以逆转这种增加(p<0.01),布洛芬颗粒和大黄素在减弱硝酸甘油诱发的C-fos神经元的激活中起着作用,两者之间无显着差异(p>0.05)。由图4(F)可知,与空白组相比,模型组染色区域的IOD更大(p<0.01),但在布洛芬和大黄素预处理后,染色区域的IOD显着降低(p<0.01),布洛芬组和大黄素组的IOD之间无显着统计学差异(p>0.05)。结果与图4(A–D)所示一致。NTG激活的C-fos免疫反应阳性神经元呈棕黄色,而阴性细胞则呈蓝紫色。在图4(B)中存在一个大量的棕黄色阳性细胞区域,而在图4(A)中空白组的染色切片存在少量棕黄色阳性细胞区域。图4(C和D)中的棕黄色区域比图4(B)中的棕黄色区域小得多,这表明布洛芬和大黄素预处理可减轻脑干中C-fos神经元的过度表达。
8.大黄素对硝酸甘油诱导的PKG蛋白的影响
为了研究大黄素对硝酸甘油诱导的PKG蛋白的影响,对脑组织蛋白进行了蛋白印迹分析。如图5所示,与空白组比较,模型组PKG蛋白的表达极显著的增加(p<0.01);与模型组比较,布洛芬和大黄素可显著抑制PKG蛋白的增加(p<0.01),且两者之间的抑制强度比较无统计学意义(p>0.05)。
研究结果表明:大黄素通过cGMP-PKG通路,减弱硝酸甘油诱导大鼠脑组织中PKG蛋白的表达,减弱C-fos的活化,并调节血管活性物质,如NO、CGRP、P物质、TNF-α和cGMP,从而缓解偏头痛症状。
实施例2治疗偏头痛药物制备例
一、材料与方法
1.试验材料
肉豆蔻酸异丙酯(IPM,临沂绿森),棕榈酸异丙酯(IPP,临沂绿森),蓖麻油聚氧乙烯(EL-40,阿拉丁),聚丙烯酸钠700(NP700,美国国际特品公司),卡波姆(CP-934,廊坊聚通化工有限公司),聚氧乙烯氢化蓖麻油(RH-40,BASF公司),泊洛沙姆407(P407)、泊洛沙姆188(P188)均购自山东优索化工科技有限公司,大黄素纯度98%,购买于北京迈瑞达科技有限公司,乙腈(色谱纯,上海星可高纯溶剂有限公司),甲酸(色谱纯,阿拉丁试剂有限公司),羟丙基甲基纤维(上海源叶生物科技有限公司),乳糖(镇江市康富生物工程有限公司),无水乙醇(分析级,上海泰坦化学有限公司)。
2.大黄素纳米乳凝胶滴鼻剂的制备
首先,对油相Lauroglycol FCC、Labrafac PG、肉豆蔻酸异丙酯,乳化剂吐温80、聚氧乙烯氢化蓖麻油(RH-40)、蓖麻油聚氧乙烯(EL-40),助乳化剂无水乙醇、1,2-丙二醇、1,3-丁二醇进行选择。然后通过绘制伪三元相图及正交设计试验法优选纳米乳处方,继而制备大黄素纳米乳,如下:
称取1mg大黄素置于烧杯中,加入棕榈酸异丙酯1g充分溶解混合油相,在搅拌状态下加入聚氧乙烯氢化蓖麻油(RH-40)2.8g、1,2-丙二醇1.4g,25℃恒温磁力搅拌状态中缓慢滴入常温蒸馏水(约7.8g)至体系澄明,即得大黄素纳米乳。制得的大黄素纳米乳呈淡黄色、澄清透明,光照后有丁达尔现象,离心(3 000r﹒min,30min)后稳定。
其次,精密称取P407、P188各1.677g、0.252g,置于烧杯中,加入10mL冰水搅拌分散后,静置溶解制备成泊洛沙姆凝胶基质,于冰箱中冷藏保存备用,4℃下将前面制备的大黄素纳米乳与其搅拌均匀,即制得大黄素纳米乳凝胶滴鼻剂(大黄素含量约38μg/mL)。
3.大黄素片的制备
采用湿法制粒压片工艺制备大黄素片。首先制备大黄素颗粒,以羟丙基甲基纤维为载体材料,通过单因素考察法对处方进行优化,评价指标为软材性状、制粒情况、颗粒外观;继而以压片过程中的黏冲及片剂硬度为综合评价指标,优化填充剂和黏合剂等片剂的处方,最后进行压片。采用量热差示扫描和X-射线衍射法对片剂中大黄素的存在形式进行鉴定。
取大黄素1.8g和羟丙基甲基纤维素6.0g,50%(v/v)乙醇室温下搅拌溶解,备用;另称取9g乳糖、0.5g微晶纤维素和0.2g羧甲基淀粉钠混合均匀,95%(v/v)含水乙醇作为粘合剂,制备软材,过20目筛制粒,45℃鼓风干燥60min,加0.5g硬脂酸镁混匀;压片即得(片重100mg,大黄素含量为10mg/片,硬度4~6kg)。
二、结果
1.大黄素纳米乳凝胶的参数测定及评价
使用透射电子显微镜对制得的大黄素纳米乳和大黄素纳米乳凝胶进行形态考察,发现大黄素纳米乳和大黄素纳米乳凝胶为外观圆整、均匀的球体。采用马尔文动态光散射粒径仪测定大黄素纳米乳和大黄素纳米乳凝胶的粒径小于100nm及多分散系数小于0.3。采用HR10流变仪(美国TA仪器沃特斯公司)对大黄素纳米乳和大黄素纳米乳凝胶进行黏度考察,结果表明所制备大黄素纳米乳的黏度不随剪切速率变化而变化,属于牛顿流体,而大黄素纳米乳凝胶的黏度随剪切速率的增大而减小,为非牛顿流体。
因此,本研究所建立的大黄素纳米乳和大黄素纳米乳凝胶制备工艺简单,黏度适中,可为大黄素滴鼻给药制剂选择提供参考。
2.大黄素片的评价
通过量热差示扫描和X-射线衍射分析,大黄素片中大黄素以无定形或分子状态存在。本研究制得的大黄素片处方组成合理,制备工艺简单,可为大黄素片剂的制备提供参考。
- 大黄素在制备治疗偏头痛药物中的应用
- 对金散中抗偏头痛有效部位的制备方法及其在制备防治偏头痛药物中的应用
