一种缓释制剂组合物
文献发布时间:2023-06-19 13:51:08
技术领域
本发明属于药物制剂领域,具体涉及一种缓释制剂组合物及其制备方法和用途。
背景技术
手术后疼痛是手术后即刻发生的急性疼痛,通常持续不超过3~7天,如果不能在初始状态下被充分控制,则可能发展为慢性疼痛。目前常用的临床治疗手段是采用镇痛泵进行治疗,但是镇痛泵里含有的药物多为阿片类镇痛药和一些辅助镇痛药如曲马多等,尽管疗效较好,但也伴随着一系列副作用如呼吸抑制、恶心呕吐、低血压及潜在成瘾性等。
采用局麻药治疗术后疼痛可以避免上述不良反应,但是局麻药通常作用时间较短,单次给药后药效仅维持数小时,无法满足术后疼痛的治疗周期。因此开发长效局麻药制剂是目前的研究热点。
迄今位为止,上市的长效局麻药制剂仅有PACIRA开发的布比卡因多囊脂质体混悬注射液,商品名为
油缓释体系是开发长效制剂最简单的手段之一,目前已上市多种药用油制剂,缓释作用从1至2天到2至4周不等。专利CN103142458公开了一种无成瘾性麻醉镇痛缓释递药系统,主要由镇痛剂、药物溶媒、药物缓释剂组成。其中镇痛剂为罗哌卡因,药物溶媒为苯甲醇、乙醇、苯甲酸苄酯中的一种或两种,药物缓释剂为大豆油和蓖麻油中的一种或两种,镇痛持续时间至少为24小时。另外,Min-Quan Hui等制备了以大豆油为缓释体系的罗哌卡因长效制剂,并进行了犬药动学研究,与罗哌卡因溶液剂相比,罗哌卡因长效制剂在体内血药浓度可维持48小时。此外,油缓释体系在室温下一般为液体,只能进行注射给药,给药方式存在局限性,在特定部位释药存在不确定性。
聚合物缓释体系也是开发长效制剂的手段之一,常用的聚合物缓释体系包括聚乳酸聚乙醇酸共聚物(PLGA)和聚原酸酯(POE)体系等。其中2002年FDA批准的
此外,DURECT公司开发了一种以小分子酯作为缓释载体的长效布比卡因制剂
发明内容
为改善现有技术中存在的问题,本发明提供一种药物组合物,包括如下组分:
a.液体油
b.至少一种药学上可接受的凝胶因子,所述凝胶因子选自:
脂肪酸,其结构式为C
脂肪醇,其结构式为C
脂肪酸甘油酯,其结构式为(C
甾醇,其结构式为
山梨醇脂肪酸酯,其结构式为
泊洛沙姆,其结构式为HO(C
聚氧乙烯烷基醚,其结构式为CH
聚氧乙烯蓖麻油衍生物;
聚山梨酸酯,其结构式为
硬脂酸聚氧乙烯酯,其结构式为RCO(OCH
c.至少一种药学上的活性成分
根据本发明的实施方案,所述脂肪酸和脂肪醇的结构式中n=12~22;脂肪酸甘油酯的结构式中n=8~22,m=8~22,且n+m>20;甾醇结构式中取代基为R=C
根据本发明的实施方案,所述药物组合物还包含d.至少一种药学上可接受的溶剂。
根据本发明的实施方案,所述药物组合物可以进一步包含药学上可接受的释放调节剂。
根据本发明的实施方案,所述液体油选自蓖麻油、芝麻油、玉米油、大豆油、橄榄油、红花油、棉籽油、花生油、鱼油、茶油、杏仁油、巴巴苏油、黑醋栗种子油、琉璃苣油、卡诺拉油、棕榈油、棕榈仁油、向日葵油、中链甘油三酯、二油酸甘油酯、单油酸甘油酯中的一种或多种组合。
根据本发明的实施方案,所述凝胶因子选自所述脂肪醇、脂肪酸、脂肪酸甘油酯、甾醇、山梨醇脂肪酸酯、泊洛沙姆、聚氧乙烯烷基醚、聚氧乙烯蓖麻油衍生物、聚山梨酸酯、硬脂酸聚氧乙烯酯中的一种或多种组合,在一些实施方式中,所述凝胶因子选自月桂酸、棕榈酸、花生酸、十四醇、十六醇、二十二醇、月桂酸甘油酯、棕榈酸甘油酯、单硬脂酸甘油酯,双硬脂酸甘油酯、三硬脂酸甘油酯、C8-C18的混合脂肪酸甘油酯、山梨醇棕榈酸酯、山梨醇硬脂酸酯、山嵛酸甘油酯、棕榈酸硬脂酸甘油酯、椰油酸甘油酯、胆固醇、泊洛沙姆124、泊洛沙姆188、泊洛沙姆237、泊洛沙姆338、泊洛沙姆407、聚氧乙烯5蓖麻油、聚氧乙烯9蓖麻油、聚氧乙烯15蓖麻油、聚氧乙烯35蓖麻油、聚氧乙烯40蓖麻油、聚氧乙烯40氢化蓖麻油、聚氧乙烯60氢化蓖麻油、聚氧乙烯20十六烷基硬脂酰醚、聚氧乙烯2鲸蜡基醚、聚氧乙烯10鲸蜡基醚、聚氧乙烯20鲸蜡基醚、聚氧乙烯4月桂基醚、聚氧乙烯9月桂基醚、聚氧乙烯23月桂基醚、聚氧乙烯2肉豆蔻基醚、聚氧乙烯10肉豆蔻基醚、聚氧乙烯20肉豆蔻基醚、聚氧乙烯2硬脂基醚、聚氧乙烯10硬脂基醚、聚氧乙烯20硬脂基醚、聚氧乙烯100硬脂基醚、聚山梨酯20、聚山梨酯21、聚山梨酯40、聚山梨酯60、聚山梨酯61、聚山梨酯65、聚山梨酯80、聚山梨酯81、聚山梨酯85、聚山梨酯120、硬脂酸聚氧乙烯二酯、硬脂酸聚氧乙烯四酯、硬脂酸聚氧乙烯六酯、硬脂酸聚氧乙烯八酯、硬脂酸聚氧乙烯十二酯、硬脂酸聚氧乙烯二十酯、硬脂酸聚氧乙烯三十酯、硬脂酸聚氧乙烯四十酯、硬脂酸聚氧乙烯五十酯、硬脂酸聚氧乙烯一百酯、硬脂酸聚氧乙烯一百五十酯、二硬脂酸聚氧乙烯四酯、二硬脂酸聚氧乙烯八酯、二硬脂酸聚氧乙烯十二酯、二硬脂酸聚氧乙烯三十二酯、二硬脂酸聚氧乙烯一百五十酯中的一种或多种组合。
根据本发明的实施方案,所述至少一种药学活性成分不限于治疗类型,并可为抗炎药、局麻药、镇痛药、抗精神失常药、抗焦虑药、镇静催眠药、抗抑郁药、抗高血压药、类固醇激素、抗癫痫药、杀菌剂、抗惊厥药、抗帕金森病药、中枢神经兴奋药、抗精神病药、抗心律失常药、抗心绞痛药、抗甲状腺药、解毒药、止吐药、降糖药、抗结核病药、抗艾滋病药、抗乙肝药、抗肿瘤药、抗排斥药及其混合物。
根据本发明的实施方案,合适的药学活性成分可选自下述化合物中的一种或多种的组合:阿司匹林,对乙酰氨基酚,贝诺酯,吲哚美辛,舒林酸,双氯芬酸,双氯芬酸钾,双氯芬酸钠,布洛芬,萘普生,氟比洛芬,氟比洛芬酯、洛索洛芬,萘丁美酮,酮咯酸,保泰松,丁苯羟酸,非诺洛芬,塞来昔布,罗非昔布,Polmacoxib,尼美舒利,美洛昔康,氯诺昔康,吡罗昔康,依托度酸,伐地考昔,帕瑞昔布,艾瑞昔布,卢米昔布。布比卡因,左旋布比卡因,罗哌卡因,甲哌卡因,利多卡因,普鲁卡因,苯佐卡因,丁卡因,达克罗宁。脑啡肽,强啡肽,β-内啡肽,纳曲酮,丁丙诺啡,吗啡,二甲基吗啡,可待因,双氢可待因,羟考酮、氢可酮、纳布啡,芬太尼,舒芬太尼,瑞芬太尼,曲马多,去甲曲马多,他喷他多,地佐辛,喷他佐辛,美沙酮,哌替啶,氯胺酮,地西泮,氯甲西泮,赖右苯丙胺,右丙氧芬,Difelikefalin,Oliceridine。氯丙嗪,三氟丙嗪,美索哒嗪,哌西他嗪,硫利达嗪,氯普噻吨。地西泮,阿普唑仑,氯硝西泮,奥沙西泮,丙咪嗪,阿密曲替林,多虑平,去甲替林,阿莫沙平,反苯环丙胺,苯乙肼。普鲁卡因胺,亚硝酸异戊酯,硝酸甘油,心得安,美托洛尔,哌唑嗪,酚妥拉明,咪噻吩,卡托普利,依那普利。可乐定,右美托咪定,肾上腺素,去甲肾上腺素,替扎尼定,α-甲基多巴,格隆溴铵。可的松,氢化可的松,倍他米松,曲安奈德,地塞米松,地塞米松酯,泼尼松,泼尼松龙,甲泼尼龙,倍氯米松,氯倍他索,黄体酮,睾酮,庚酸睾酮,十一烷酸睾酮,环戊丙酸睾酮,孕酮,氟维司群,别孕烯醇酮,Ganaxolone,苯妥英,乙妥英。苯扎氯铵,苄索氯铵,醋酸磺胺米隆,甲苄索氯铵,呋喃西林,硝甲酚汞。苯巴比妥、异戊巴比妥、戊巴比妥、司可巴比妥。卡比多巴,左旋多巴,阿尼西坦,奥拉西坦,吡拉西坦,多沙普仑,阿立哌唑,奥氮平,氟哌啶醇,喹硫平,利培酮,氯氮平,帕利哌酮,阿替洛尔,比索洛尔,美托洛尔。阿替洛尔,氨氯地平,尼莫地平,单硝酸异山梨酸酯,依前列醇,曲前列尼尔,伊洛前列素,贝前列素。甲巯咪唑,丙巯氧嘧啶,普萘洛尔,纳洛酮,洛非西定,氟马西尼,苯丙胺。格拉司琼,昂丹司琼,托烷司琼,多拉司琼,帕洛诺司琼,东莨菪碱,多潘立酮,格列吡嗪,格列本脲,格列美脲,优降糖,格列齐特,甲苯磺丁脲,利拉鲁肽,艾塞拉肽,度拉鲁肽,索马鲁肽。达芦那韦,多替拉韦钠,恩曲他滨,拉替拉韦,利托那韦,司他夫定,奈韦拉平,齐多夫定,司他夫定,依曲韦林,阿德福韦酯,恩替卡韦,替比夫定,拉米夫定,替诺福韦二吡呋酯,磷丙替诺福韦,氨硫脲,吡嗪酰胺,丙硫异烟胺,环磷酰胺,5-氟尿嘧啶,卡莫司汀,洛莫司汀,马法兰,苯丁酸氮芥,甲氨蝶呤,长春新碱,博来霉素,阿霉素,他莫昔芬,环孢素,他克莫司,依维莫司,西罗莫司以及所述化合物的药学可接受的盐,立体异构体,衍生物。
根据本发明的实施方案,所述药学活性成分选自酰胺类局麻药,例如选自布比卡因、罗哌卡因、左旋布比卡因、甲哌卡因、利多卡因及其盐。所述酰胺类局麻药的盐可以选自其脂肪酸盐和水溶性盐,形成盐的酸包括月桂酸、肉豆蔻酸、硬脂酸、棕榈酸、山嵛酸、花生酸、盐酸、磺酸、磷酸、醋酸、枸橼酸等。
根据本发明的实施方案,所述药学活性成分除了包含酰胺类局麻药,还进一步包含第二种活性成分,所述药学活性成分可选自COX受体抑制药、肾上腺素受体激动药和糖皮质激素类药中的一种。所述COX受体抑制药包括非选择性COX抑制药和选择性COX-2抑制药。这些类别中代表的非甾体抗炎药包括,但不限于,下列非选择性COX抑制药:阿司匹林,对乙酰氨基酚,贝诺酯,吲哚美辛,舒林酸,双氯芬酸,双氯芬酸钾,双氯芬酸钠,布洛芬,萘普生,氟比洛芬,洛索洛芬,萘丁美酮,吡罗昔康,酮咯酸,保泰松,丁苯羟酸,非诺洛芬;下列选择性COX-2抑制药:塞来昔布,罗非昔布,尼美舒利,美洛昔康,氯诺昔康,依托度酸,伐地考昔,帕瑞昔布,艾瑞昔布,卢米昔布。以及所述化合物的药学可接受的盐,立体异构体,衍生物。所述的肾上腺素受体激动药主要是α2-肾上腺素受体激动药,包括但不限于可乐定,右美托咪定,肾上腺素,去甲肾上腺素,替扎尼定,α-甲基多巴。所述的糖皮质激素类药包括,但不限于可的松,氢化可的松,倍他米松,曲安奈德,地塞米松,泼尼松,泼尼松龙,甲泼尼龙,倍氯米松,氯倍他索。
在一些实施方式中,所述药学活性成分选自罗哌卡因、布比卡因、左旋布比卡因、美洛昔康、塞来昔布、酮洛芬、曲安奈德中的一种或几种的组合。
在一些实施方式中,所述药学活性成分选自酰胺类局麻药与非甾体抗炎药的组合,例如罗哌卡因和美洛昔康组合物、左旋布比卡因和美洛昔康组合物、布比卡因和美洛昔康组合物、罗哌卡因和塞来昔布组合物、左旋布比卡因和塞来昔布组合物、布比卡因和塞来昔布组合物等。
根据本发明的实施方案,所述药学上可接受的释放调节剂选自小分子酯类和表面活性剂。所述小分子酯类为三醋酸甘油酯、硬脂酸异丙酯、月桂酸异丙酯、棕榈酸异丙酯、肉豆蔻酸异丙酯、苯甲酸苄酯。
在一些实施方式中,所述表面活性剂为非离子型表面活性剂。
在一些实施方式中,所述表面活性剂包括大豆磷脂、蛋黄磷脂、二芥酰基卵磷脂、二油酸酰基卵磷脂、硬脂酸聚烃氧40酯、辛酸癸酸聚乙二醇甘油酯、月桂酰聚氧乙烯甘油酯、硬脂酰聚氧乙烯甘油酯、油酰聚氧乙烯甘油酯、维生素E聚乙二醇琥珀酸酯、蛋黄卵磷脂、大豆磷脂、氢化大豆磷脂,泊洛沙姆,聚山梨酯,聚乙二醇-12-羟基硬脂酸酯、丙二醇单辛酸酯等。所述泊洛沙姆可选自例如泊洛沙姆407、泊洛沙姆188,所述聚山梨酯可选自例如聚山梨酯80。
根据本发明的实施方案,所述组合物还可以进一步包括一种或多种抗氧化剂。抗氧化剂可用于防止或减少本发明中所述缓释递药系统中磷脂或液体油的氧化。本发明提供的抗氧化剂包括但不限于维生素C(抗坏血酸),半胱氨酸或其盐酸盐,维生素E(生育酚),抗坏血酸棕榈酸酯,谷胱甘肽,α硫辛酸,硫代甘油。
根据本发明的实施方案,所述组合物还可以进一步包括其他药学领域常规的赋形剂,合适的药物赋形剂的实例在Excipients and their use in injectableproducts.PDA J Pharm Sci Technol.第51卷,1997年7-8月,第166-171页和ExcipientSelection In Parenteral Formulation Development,Pharma Times,第45卷,第3期,2013年3月,第65-77页中描述,他们通过引用整体并入本发明中。
根据本发明的实施方案,所述液体油占组合物总量的约20%至约90%(w/w),例如约21%、22%、23%、24%、25%、26%、27%、28%、29%、30%、31%、32%、33%、34%、35%、36%、37%、38%、39%、40%、41%、42%、43%、44%、45%、46%、47%、48%、49%、50%、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%。在一些实施方案中,所述液体油比例约为30至90%(w/w)。在一些实施方案中,所述液体油比例约为40%至85%(w/w)。
根据本发明的实施方案,所述凝胶因子占组合物总量的2%至50%(w/w),例如2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%、25%、26%、27%、28%、29%、30%、31%、32%、33%、34%、35%、36%、37%、38%、39%、40%、41%、42%、43%、44%、45%、46%、47%、48%、49%、50%。在一些实施方案中,所述凝胶因子占组合物总量2%至30%(w/w)。
根据本发明的实施方案,所述药学活性成分占组合物总量的0.1%至50.0%(w/w)。根据一些实施方案,药学活性成分占组合物总量的0.1%至15%(w/w),例如0.1%、0.5%、1.0%、1.5%、2.0%、2.5%、3.0%、3.5%、4.0%、4.5%、5.0%、5.5%、6.0%、6.5%、7.0%、7.5%、8.0%、8.5%、9.0%、9.5%、10.0%、10.5%、11.0%、11.5%、12.0%、12.5%、13.0%、13.5%、14.0%、14.5%、15.0%。根据一些实施方式,药学活性成分以3%(w/w)至10%(w/w)的量存在。根据一些实施方式,当药学活性成分选自两种以上时,每种药学活性成分可以占组合物总量的0.1%至10%(w/w),例如0.1%、0.5%、1.0%、1.5%、2.0%、2.5%、3.0%、3.5%、4.0%、4.5%、5.0%、5.5%、6.0%、6.5%、7.0%、7.5%、8.0%、8.5%、9.0%、9.5%、10.0%。
根据本发明的实施方案,所述溶剂总量占组合物总量的0%至50%(w/w),在一些实施方案中,所述药物组合物中不含有溶剂(溶剂总量占组合物总量的0%),在一些实施方案中,所述溶剂总量可以占组合物总量的0.1%、0.5%、1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%、25%、26%、27%、28%、29%、30%、31%、32%、33%、34%、35%、36%、37%、38%、39%、40%、41%、42%、43%、44%、45%、46%、47%、48%、49%、50%。在一些实施方案中,所述溶剂总量占组合物总量的10%-50%(w/w),在一些实施方案中,所述溶剂总量占组合物总量的10%-30%(w/w)。
根据本发明的实施方案,所述溶剂为非水溶剂,所述非水溶剂选自醇类、N-甲基吡咯烷酮、苯甲酸苄酯、二甲亚砜中的一种或多种组合。所述醇类选自甲醇、乙醇、正丙醇,异丙醇,正丁醇,异丁醇、叔丁醇、乙二醇、丙二醇、甘油、苯甲醇、苯乙醇、聚乙二醇。
根据本发明的实施方案,所述释放调节剂占组合物总量的0%至40%(w/w),优选的,为0.1%至40%(w/w),在一些实施方式中,所述释放调节剂可以占组合物总量的0.1%、0.2%、0.3%、0.4%、0.5%、0.6%、0.7%、0.8%、0.9%、1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%、25%、26%、27%、28%、29%、30%、31%、32%、33%、34%、35%、36%、37%、38%、39%、40%,在一些实施方式中,当所述释放调节剂选自小分子酯类时,所述释放调节剂用量为1~35%;在一些实施方式中,当所述释放调节剂选自表面活性剂时,所述释放调节剂用量为0.1%至5%(w/w)。
本发明提供的药物组合物为半固体制剂。在本发明的药物组合物中,所述药学上可接受的溶剂和释放调节剂可以作为粘度调节剂,使所述组合物适于注射。在一些实施方式中,在30℃时,所述组合物的粘度小于20000cP。在一些实施方式中,在30℃时所述组合物的粘度在5000至10000cP的范围内。在一些实施方式中,在30℃时,所述组合物的粘度在3000至5000cP的范围内。在一些实施方式中,在30℃时,所述组合物的粘度在1000至3000cP的范围内。在一些实施方式中,在30℃时,所述组合物的粘度在100至1000cP的范围内。
本发明提供了一种所述药物组合物的制备方法,包括如下步骤:
(a1)将液体油、药学上可接受的凝胶因子混合,在加热条件下搅拌至澄清均一的混合溶液;
(a2)将至少一种药学上的活性成分添加到所述混合溶液中,搅拌至形成均一混合物;
(a3)将(a2)形成的均一混合物冷却至室温。
根据本发明的实施方案,所述步骤(a1)的混合还包括加入至少一种药学上可接受的溶剂和释放调节剂,例如,所述步骤(a1)可以为将液体油、凝胶因子、至少一种药学上的活性成分与至少一种药学上可接受的溶剂混合;所述步骤(a1)可以为将液体油、凝胶因子、至少一种药学上的活性成分、释放调节剂与至少一种药学上可接受的溶剂混合。
在一些实施方式中,所述方法包括:
1.在50~70℃下将液体油、凝胶因子和药学上的活性分子混合,直至得到澄清透明溶液。
2.将热溶液过0.22μm滤膜除菌。
3.将所述过滤后的混合溶液冷却至室温。
在一些实施方式中,所述方法包括:
1.在50~70℃下将液体油、凝胶因子、药学上的活性分子和药学上的溶剂混合,直至得到澄清透明溶液。
2.将热溶液过0.22μm滤膜除菌。
3.将所述过滤后的混合溶液冷却至室温。
在一些实施方式中,所述方法包括:
1.在50~70℃下将液体油、凝胶因子、药学上的活性分子、药学上的溶剂和释放调节剂混合,直至得到澄清透明溶液。
2.将热溶液过0.22μm滤膜除菌。
3.将所述过滤后的混合溶液冷却至室温。
在一些实施方式中,可以根据不同药学活性分子的性质,将较难溶解的活性分子先溶于部分溶剂,再加入由液体油、凝胶因子、剩余部分溶剂加热混合形成的溶液中而制备所需的药物组合物。
在一些实施方式中,所述方法包括:
1.在50~70℃下将液体油、凝胶因子和部分溶剂混合,直至得到澄清透明溶液。
2.将药学上的活性分子加入部分溶剂中,直至完全溶解。
3.将药物溶液与1中的溶液混合均匀。
4.将热溶液过0.22μm滤膜除菌。
5.将所述过滤后的混合溶液冷却至室温。
在一些实施方式中,可以根据不同药学活性分子的性质,将较难溶解的活性分子先溶于部分溶剂,再加入由液体油、凝胶因子、部分溶剂、释放调节剂加热混合形成的溶液中而制备所需的药物组合物。
在一些实施方式中,所述方法包括:
1.在50~70℃下将液体油、凝胶因子,部分溶剂和释放调节剂混合,直至得到澄清透明溶液。
2.将药学上的活性分子加入部分溶剂中,直至完全溶解。
3.将药物溶液与1中的溶液混合均匀。
4.将热溶液过0.22μm滤膜除菌。
5.将所述过滤后的混合溶液冷却至室温。
本发明所述的药物组合物的制备方法,在一些实施方式中,混合溶液自然冷却至室温;在一些实施方式中,混合溶液迅速冷却凝固后于室温放置;在一些实施方式中,混合溶液迅速冷却凝固后于特定温度保温一定时间后于室温放置;在一些实施方式中,混合溶液在体系熔融温度下保温凝固后于室温放置;在一些实施方式中,混合溶液在体系熔融温度下保温凝固后于特定温度保温一定时间后于室温放置。
本发明提供一种包含所述药物组合物的缓释制剂,所述制剂作为储库制剂施用,一方面,所述制剂为可注射的。另一方面,所述制剂可以局部给药。
另一方面,所述制剂可皮下注射,周围神经注射,肌内注射或向伤口直接施用。
另一方面,所述制剂适合在皮肤或粘膜给药。
本发明提供的制剂以单次剂量施用,所含药量可以达到止痛、神经阻滞的效果,可用于防止或减轻局部疼痛。
根据一些实施方式,本发明提供的制剂可在给药部位形成形态稳定的储库,可缓慢持续地释放药物,延长局麻药释放时间,提高治疗效果。
在一些实施方式中,所述制剂施用后可持续有效治疗至少24小时。在一些实施方式中,所述制剂施用后可持续有效治疗至少24至48小时。在一些实施方式中,所述制剂施用后可持续有效治疗至少48至72小时。在一些实施方式中,所述制剂施用后可持续有效治疗至少72小时。根据本发明的实施方案,所述制剂进一步包括填充了所述制剂的包材,所述包材选自以下一种或多种:西林瓶、预灌封注射器、卡式瓶。
术语与缩写
除非另有说明,本申请说明书和权利要求书中记载的基团和术语定义,包括其作为实例的定义、示例性的定义、优选的定义、表格中记载的定义、实施例中具体化合物的定义等,可以彼此之间任意组合和结合。这样的组合和结合后的基团定义及化合物结构,应当属于本申请说明书记载的范围内。
本申请说明书和权利要求书记载的数值范围,当该数值范围被定义或其仅可为“整数”时,应当理解为记载了该范围的两个端点以及该范围内的每一个整数。例如,“0~10的整数”应当理解为记载了0、1、2、3、4、5、6、7、8、9和10的每一个整数。
当该数值范围被定义为“数”或可以包括“整数”或“非整数”时·,应当理解为记载了该范围的两个端点、该范围内的每一个整数以及该范围内的每一个小数。例如,“0~10的数”应当理解为不仅记载了0、1、2、3、4、5、6、7、8、9和10的每一个整数,还至少记载了其中每一个整数分别与0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9的和。
术语“生物相容性”是指组合物成分与机体之间的相互作用。
术语“活性成分”是指用于治疗疾病的药物。因此,活性成分、药物可替换使用。此处使用的术语“活性成分”或“药物”包括但不限于局部或全身作用的药物活性物质,其可以通过局部给药或通过注射,如皮下、皮内、肌内及关节内注射进行施用。至少一种活性成分存在于本发明的缓释递药系统中。
术语“油凝胶”是指在液态油中添加凝胶因子而得到的一种热可逆、半固体状且具有一定粘弹性的分散体系。
术语“凝胶因子”是指分子中具有亲脂结构和可相互作用位点,并且具有一定表面活性以及热可逆性的一类物质。
术语“半固体”是指在一定压力下可流动的形态。更具体地,半固体通常在30℃下粘度在100至50000cP之间的粘度,特别是在30℃下100至20000cP的之间粘度。
术语“小分子酯类”是指分子量小于500的酯类,室温下为液体。
本发明所用的术语“酰胺型”是指酰胺或卡因类局部麻醉剂,如布比卡因,左旋布比卡因,罗哌卡因,甲哌卡因,利多卡因等。酰胺类局麻药一般由亲脂部分和亲水部分组成,亲脂性部分,可为芳烃或芳杂环,而以苯环作用最强。苯环上引入给电子基团例如氨基等可使活性增强。亲水部分一般为仲胺、叔胺或吡咯烷、哌啶、吗啉等,以叔胺最为常见。pKa一般在7.5~7.9之间,生理条件下为离子型。
有益效果
1)本发明提供了一种缓释制剂组合物,该组合物制剂在常温下呈现半固体,在给药部位可直接作为药物储库。本发明所选用的凝胶因子,与制剂其他成分具有良好的生物相容性,在液体油中可通过自组装形成反向双层纳米结构,反向双层结构随后生长、组织形成片状微结构,最终形成连续、稳定的三维网络结构,且所述网络结构具有良好的持油性。整个体系的机械强度与性能能够支撑与满足活性成分的释放性能。2)本发明还进一步发现,在制剂体系中加入合适的释放调节剂,可以进一步改良活性成分的释放性能,减少油凝胶粘度等;
3)本发明的缓释递药液体组合物具有合适的粘度,易于给药;本发明的缓释递药半固体组合物可直接施用于给药部位,便于临床给药。
4)本发明组合物刺激性小,具有良好的用药安全性及耐受性。
5)本发明提供的缓释制剂系统,能够使得活性药物成分实现良好的释放性能,降低突释的可能性。
6)本发明的组合物尤其适用于具有麻醉、镇痛活性的药物制剂开发,相对于其他缓释镇痛药体系具有更多的优势,例如对于镇痛活性成分的释放持续稳定,不仅可以注射给药,而且适用于稳定便捷的局部给药,患者耐受性好,副作用少。
附图说明
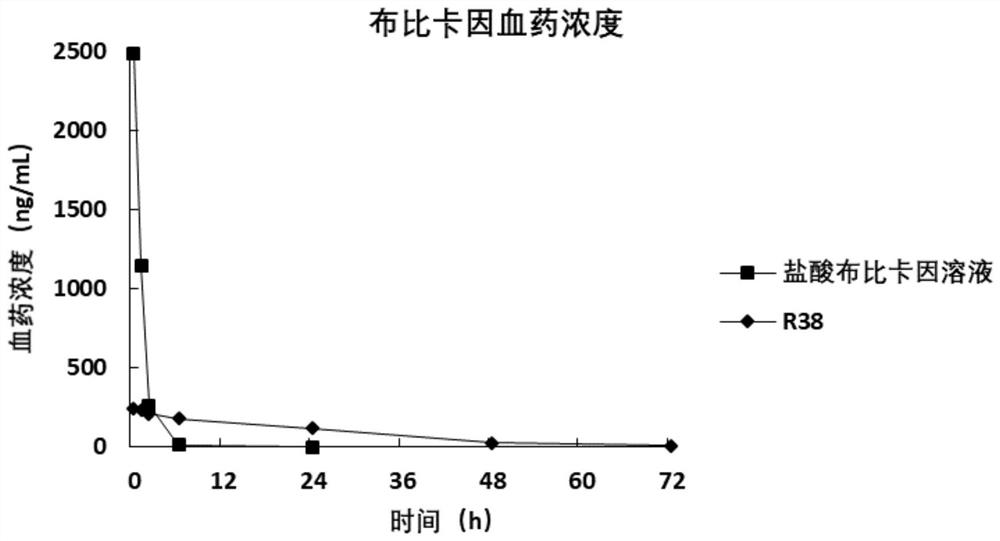
图1-1是溶液剂和油凝胶组合物(R38,详见信息表19-1)在大鼠体内的药代动力学研究,图1-1是布比卡因血药浓度-时间曲线。
图2-1和2-2是不同液体油种类和凝胶因子用量(组合物R36、R38和R39,详细信息见表20-1)制备的药物组合物在大鼠体内的药代动力学研究。其中图2-1是布比卡因血药浓度-时间曲线,图2-2是美洛昔康血药浓度-时间曲线。
图3-1和3-2是油制剂和油凝胶组合物(组合物R73、R74,详细信息见表21-1)在大鼠体内的药代动力学差异。其中图3-1是布比卡因血药浓度-时间曲线,图3-2是美洛昔康血药浓度-时间曲线。
图4-1和4-2是布比卡因和罗哌卡因组合物(组合物R71、R73、R74,详细信息见表22-1)在犬体内的药代动力学差异。其中图4-1是布比卡因血药浓度-时间曲线,图4-2是美洛昔康血药浓度-时间曲线。
图5-1是罗哌卡因溶液、罗哌卡因单方组合物和罗哌卡因/塞来昔布复方组合物在大鼠手术后疼痛研究的药效差异。
图6-1是罗哌卡因/罗哌卡因复方组合物和罗哌卡因/塞来昔布复方组合物在大鼠手术后疼痛研究的药效差异。
具体实施方式
下文将结合具体实施例对本发明的技术方案做更进一步的详细说明。应当理解,下列实施例仅为示例性地说明和解释本发明,而不应被解释为对本发明保护范围的限制。凡基于本发明上述内容所实现的技术均涵盖在本发明旨在保护的范围内。
除非另有说明,以下实施例中使用的原料和试剂均为市售商品,或者可以通过已知方法制备。
实验动物来源:
比格犬:江苏亚东实验动物研究院有限公司
大鼠:南通大学动物实验中心
实施例1
几种凝胶因子的临界凝胶浓度
分别配制含有不同比例凝胶因子的处方,在室温下静置12h,将西林瓶倒置,观察西林瓶中制剂的流动情况,筛选成胶的临界凝胶浓度,结果见表1-1、表1-2和表1-3。所测试的凝胶因子包括脂肪酸、脂肪醇、单一的脂肪酸甘油酯和混合脂肪酸甘油酯以及甾醇,其中,单一脂肪酸甘油酯是相同的脂肪酸与甘油酯化而成,而混合脂肪酸则由不同的脂肪酸与甘油酯化形成。本发明在实施过程中意外的发现,当脂肪酸碳链小于12个碳原子时,凝胶因子相互聚集的能力较弱,无法形成三维网络结构使液体油固化,但是当凝胶因子的脂肪酸碳链部分大于12个碳原子时,则可以形成三维网络结构使液体油凝胶化。如下表1-1所示,当选用含有10个碳原子的癸酸作为凝胶因子时,增加癸酸用量至40%(w/w),仍无法形成油凝胶,又如下表1-2和1-3所示,当选用辛酸甘油酯和辛酸癸酸单双甘油酯作为凝胶因子时,用量为30%(w/w)时,无法形成油凝胶,而当选用的凝胶因子为含有18个碳原子的硬脂酸作为凝胶因子时,在小于10%(w/w)的用量下可以使液体油凝胶化;此外,发明人还意外的发现,当选用混合脂肪酸甘油酯(碳链一般为C8~C18脂肪酸),在10%(w/w)的用量下可以使液体油凝胶化。
表1-1脂肪酸类临界凝胶浓度
√:倒置流动;×:倒置不流动
表1-2脂肪醇类临界凝胶浓度
√:倒置流动;×:倒置不流动
表1-3脂肪酸甘油酯类临界凝胶浓度
√:倒置流动;×:倒置不流动
表1-4混合脂肪酸甘油酯类临界凝胶浓度
表1-5山梨醇脂肪酸酯类临界凝胶浓度
√:倒置流动;×:倒置不流动
表1-6甾醇类临界凝胶浓度
√:倒置流动;×:倒置不流动
实施例2
含有不同比例凝胶因子的油凝胶组合物
按照下表2-1中所示的每种成分制备含有不同比例凝胶因子的药物组合物。首先将美洛昔康溶于N-甲基吡咯烷酮中,配制成50mg/g的美洛昔康浓溶液,在70℃下将罗哌卡因、凝胶因子加入液体油、苯甲醇、美洛昔康溶液中,边加热边搅拌直至形成透明均一的溶液,冷却至室温形成固态凝胶状物质。
表2-1
实施例3
油凝胶的持油性研究
称取一定量来自实施例2的药物组合物,置于离心管中,以转速9000rpm进行离心,时间为15min,离心后将离心管倒置约40min,沥干离心出来的油,按照以下公式计算油凝胶的持油性,结果显示于表3-1中。
m
m
m
x为甘油酯占油凝胶的质量分数。
表3-1
持油性是评价油凝胶结构稳定性的指标之一,为了保证凝胶因子对液体油的固化能力,防止在长期放置过程中液体油析出的现象,需对制剂的持油性进行研究,考察油凝胶中最大载油能力。实施例2和实施例3以单硬脂酸甘油酯为例,对比了不同比例甘油酯形成的油凝胶的载油能力。结果见表3-1,当凝胶因子所占比例增大,离心时油凝胶三维网络结构的持油能力也增强,当凝胶因子为单硬脂酸甘油酯时,单硬脂酸甘油酯比例为12%以上时,油凝胶的持油性维持在98%以上。
实施例4
含有不同液体油的油凝胶组合物
按照下表4-1中所示的每种成分制备含有不同液体油药物组合物。首先将美洛昔康溶于N-甲基吡咯烷酮中,配制成50mg/g的美洛昔康浓溶液,在70℃下将液体油、凝胶因子、罗哌卡因、美洛昔康浓溶液、苯甲醇混合,边加热边搅拌直至形成透明均一的溶液,冷却至室温形成固态凝胶状物质。该实施例选用不同天然植物油和合成油中链甘油三酯进行了处方研究,实验表明所有液体油和凝胶因子在加热条件下能得到澄清透明的溶液,室温冷却后均呈固态化,倒置不流动。
表4-1
实施例5
罗哌卡因和美洛昔康从油凝胶中的体外释放
将100mg来自实施例4的油凝胶组合物加入透析袋中,置于装有200mL的磷酸盐缓冲液的管中来测定罗哌卡因从实施例4组合物中的释放。在37℃下振摇,分别于24h、48h、72h从管中取1mL磷酸盐缓冲液。通过HPLC检测每份样品中罗哌卡因和美洛昔康的浓度。结果显示于下表5-1中。本发明在实施过程中意外的发现,与其他液体油相比,药物在采用蓖麻油制备的油凝胶中释放更加缓慢,缓释效果最好,而选用中链甘油三酯制备的油凝胶制剂缓释效果较弱。
表5-1罗哌卡因和美洛昔康在不同油凝胶中的体外释放
实施例6
含有不同非水溶剂的油凝胶组合物
按照下表6-1中所示的每种成分制备含有不同不同非水溶剂的油凝胶组合物。首先将美洛昔康溶于N-甲基吡咯烷酮中,配制成50mg/g的美洛昔康浓溶液,在70℃下将液体油、凝胶因子、罗哌卡因、美洛昔康浓溶液、非水溶剂混合,边加热边搅拌直至形成透明均一的溶液,冷却至室温形成固态凝胶状物质。。
表6-1
实施例7
罗哌卡因和美洛昔康从油凝胶中的体外释放
将100mg来自实施例6的油凝胶组合物加入透析袋中,置于装有200mL的磷酸盐缓冲液的管中来测定罗哌卡因从实施例6组合物中的释放。在37℃下振摇,分别于24h、48h、72h从管中取1mL磷酸盐缓冲液。通过HPLC检测每份样品中罗哌卡因和美洛昔康的浓度。结果显示于下表7-1中。
表7-1罗哌卡因和美洛昔康在不同油凝胶中的体外释放
实施例8
含有不同释放调节剂的油凝胶组合物
按照下表8-1中所示的每种成分制备含有不同释放调节剂的油凝胶组合物。首先将美洛昔康溶于N-甲基吡咯烷酮中,配制成50mg/g的美洛昔康浓溶液,在70℃下将液体油、凝胶因子、罗哌卡因、美洛昔康浓溶液、苯甲醇、释放调节剂混合,边加热边搅拌直至形成透明均一的溶液,冷却至室温形成固态凝胶状物质。
表8-1
实施例9
罗哌卡因和美洛昔康从油凝胶中的体外释放
将50mg来自实施例8的药物组合物加入透析袋中,置于装有200mL的磷酸盐缓冲液的管中来测定罗哌卡因从实施例8组合物中的释放。在37℃下振摇,分别于24h、48h、72h从管中取1mL磷酸盐缓冲液。通过HPLC检测每份样品中罗哌卡因和美洛昔康的浓度。结果显示于下表9-1中。结果证明,与苯甲酸苄酯相比,三醋酸甘油酯对油凝胶整体特性的影响更大,加入少量的三醋酸甘油酯会明显增加药物的释放。相比之下,用苯甲酸苄酯作为释放调节剂,可以更好的控制药物的释放,并降低组合物的粘度。
表9-1罗哌卡因和美洛昔康在不同油凝胶中的体外释放
实施例10
含有不同浓度的释放调节剂的油凝胶组合物
按照下表10-1中所示的每种成分制备含有不同浓度的释放调节剂的油凝胶组合物。首先将美洛昔康溶于N-甲基吡咯烷酮中,配制成50mg/g的美洛昔康浓溶液,在70℃下将液体油、凝胶因子、罗哌卡因、美洛昔康浓溶液、苯甲醇、释放调节剂混合,边加热边搅拌直至形成透明均一的溶液,冷却至室温形成固态凝胶状物质。
表10-1
实施例11
罗哌卡因和美洛昔康从油凝胶中的体外释放
将100mg来自实施例10的油凝胶组合物加入透析袋中,置于装有200mL的磷酸盐缓冲液的管中来测定罗哌卡因从实施例10组合物中的释放。在37℃下振摇,分别于24h、48h、72h从管中取1mL磷酸盐缓冲液。通过HPLC检测每份样品中罗哌卡因和美洛昔康的浓度。结果显示于下表11-1中。
表11-1罗哌卡因和美洛昔康在不同油凝胶中的体外释放
实施例10的组合物采用泊洛沙姆188作为释放调节剂,泊洛沙姆188的HLB值为29,实施例11考察了0.1%(w/w)至5%(w/w)的添加量对药物释放的影响。根据表11-1的体外释放结果可以得知,加入5%(w/w)的泊洛沙姆188,24h罗哌卡因释放接近100%,说明高HLB值的表面活性剂可显著影响油凝胶的亲水性,加快油凝胶在释放介质中的溶解速率,进而加快药物的释放。
实施例12
含有不同释放调节剂的油凝胶组合物
按照下表12-1中所示的每种成分制备含有不同释放调节剂的油凝胶组合物。首先将美洛昔康溶于N-甲基吡咯烷酮中,配制成50mg/g的美洛昔康浓溶液,在70℃下将液体油、凝胶因子、罗哌卡因、美洛昔康浓溶液、苯甲醇、表面活性剂混合,边加热边搅拌直至形成透明均一的溶液,冷却至室温形成固态凝胶状物质。
表12-1
实施例13
罗哌卡因和美洛昔康从油凝胶中的体外释放
将100mg来自实施例12的药物组合物加入透析袋中,置于装有200mL的磷酸盐缓冲液的管中来测定罗哌卡因从实施例12组合物中的释放。在37℃下振摇,分别于24h、48h、72h从管中取1mL磷酸盐缓冲液。通过HPLC检测每份样品中罗哌卡因和美洛昔康的浓度。结果显示于下表13-1中。
表13-1罗哌卡因和美洛昔康在不同油凝胶中的体外释放
实施例12中选择了一系列具有不同HLB值的表面活性剂作为释放调节剂进行药物组合物的制备,结果表明通过选择不同HLB值的表面活性剂、不同的加入量,可以调节油凝胶的亲水性,达到期望的药物释放效果。
实施例14
含有不同主要活性成分的油凝胶组合物。
按照下表14-1中所示的每种成分制备含有不同主要活性成分的油凝胶组合物。首先将美洛昔康溶于N-甲基吡咯烷酮中,配制成50mg/g的美洛昔康浓溶液,在70℃下将液体油、凝胶因子、罗哌卡因或罗哌卡因硬脂酸盐、美洛昔康浓溶液、苯甲醇混合,边加热边搅拌直至形成透明均一的溶液,冷却至室温形成固态凝胶状物质。
表14-1
实施例15
药物从油凝胶中的体外释放
将100mg来自实施例14的药物组合物加入透析袋中,置于装有200mL的磷酸盐缓冲液的管中来测定罗哌卡因从实施例14组合物中的释放。在37℃下振摇,分别于24h、48h、72h从管中取1mL磷酸盐缓冲液。通过HPLC检测每份样品中罗哌卡因和美洛昔康的浓度。结果显示于下表15-1中。
表15-1药物在不同油凝胶中的体外释放
实施例16
含有不同主要活性成分的油凝胶组合物。
按照下表16-1中所示的每种成分制备含有不同主要活性成分的油凝胶组合物。首先将美洛昔康溶于N-甲基吡咯烷酮中,配制成50mg/g的美洛昔康浓溶液,在70℃下将液体油、凝胶因子、不同酰胺类局麻药、美洛昔康浓溶液、苯甲醇混合,边加热边搅拌直至形成透明均一的溶液,冷却至室温形成固态凝胶状物质。
表16-1
实施例17
药物从油凝胶中的体外释放
将50mg来自实施例16的药物组合物加入透析袋中,置于装有200mL的磷酸盐缓冲液的管中来测定罗哌卡因从实施例16组合物中的释放。在37℃下振摇,分别于24h、48h、72h从管中取1mL磷酸盐缓冲液。通过HPLC检测每份样品中罗哌卡因和美洛昔康的浓度。结果显示于下表17-1中。
表17-1药物在不同油凝胶中的体外释放
实施例18
油凝胶组合物的粘度测量
按表18-1制备含有10%至22.2%(w/w)凝胶因子,0%至20%(w/w)释放调节剂,2.5%至5%(w/w)罗哌卡因,0.19%美洛昔康的药物组合物。在在70℃下将液体油、凝胶因子、不同酰胺类局麻药、美洛昔康浓溶液、非水溶剂混合,边加热边搅拌直至形成透明均一的溶液,冷却至室温形成固态凝胶状物质。随后使用配备64号转子的粘度计(博勒飞DVⅢ)通过轴方法测量药物组合物的粘度,检测温度为30℃转速为40rpm,粘度检测结果见下表18-1。
表18-1
实施例19
油凝胶组合物的体内施用。
大鼠体内药代动力学如下。重量约200g的SD大鼠整个实验过程自由饮水、给食。各组按皮下注射进行给药,样品信息见表19-1。每只SD大鼠按8mg/kg给予盐酸布比卡因溶液剂,按40mg/kg剂量给予油凝胶组合物,各组动物于给药前取0小时、于给药后给药后30min、1、2、6、24、48和72小时各采集血样约0.3mL至EDTA-2K+抗凝的采血管中,全血经8000rpm离心5min后收集血浆,随后通过LC-MS/MS检测血浆样品中的药物浓度。
表19-1组合物处方信息
组合物给药后72小时内的布比卡因的血药浓度-时间曲线见图1-1。
实施例20
油凝胶组合物的体内施用。
大鼠体内药代动力学如下。重量约200g的SD大鼠整个实验过程自由饮水、给食。各组按皮下注射进行给药,样品信息见表20-1。每只SD大鼠按40mg/kg剂量进行给药,各组动物于给药前取0小时、于给药后给药后30min、1、2、6、24、48和72小时各采集血样约0.3mL至EDTA-2K+抗凝的采血管中,全血经8000rpm离心5min后收集血浆,随后通过LC-MS/MS检测血浆样品中的药物浓度。
表20-1各组组合物处方信息
组合物给药后72小时内的布比卡因和美洛昔康的血药浓度-时间曲线见图2-1和图2-2。
罗哌卡因在蓖麻油中的溶解度仅为24.7mg/mL,若仅使用纯蓖麻油体系,罗哌卡因72小时的血药浓度仅为5ng/mL,96小时在血液中已检测不到罗哌卡因。因此,单纯使用油体系无法满足罗哌卡因的72h缓释要求。本发明提供的油凝胶组合物可以解决罗哌卡因释放过快的问题。实施例19和实施例20分别进行了罗哌卡因纯油组合物和罗哌卡因油凝胶组合物在大鼠和犬体内的药代动力学研究,实验结果表明油凝胶组合物可以明显降低罗哌卡因的释放速度,达到72小时以上的缓释效果。
实施例21
油凝胶组合物的体内施用。
大鼠体内药代动力学如下。重量约200g的SD大鼠整个实验过程自由饮水、给食。各组按皮下注射进行给药,样品信息见表21-1。每只SD大鼠按30mg/kg剂量进行给药,各组动物于给药前取0小时、于给药后给药后30min、1、2、4、6、24、48和72小时各采集血样约0.3mL至EDTA-2K+抗凝的采血管中,全血经8000rpm离心5min后收集血浆,随后通过LC-MS/MS检测血浆样品中的药物浓度。
表21-1各组组合物处方信息
组合物给药后72小时内的罗哌卡因和美洛昔康的血药浓度-时间曲线见图3-1和图3-2。
实施例22
油凝胶组合物的体内施用。
犬体内药代动力学研究如下。重量约10kg的比格犬实验前禁食12小时(取下喂食的食盒)以上,自由饮水,给药后4小时给食。各组按皮下注射进行给药,样品信息见表22-1。每只比格犬分两次接受注射,每次0.5mL,各组动物于给药前取0小时、于给药后0.5、1、2、3、6、8、12、24、36、48、60、72和96小时各采集血样约0.5mL至EDTA-2K+抗凝的采血管中,全血经8000rpm离心5min后收集血浆,随后通过LC-MS/MS检测血浆样品中的药物浓度。
表22-1各组组合物处方信息
组合物给药96小时后的药代动力学参数见表22-2和表22-3。
表22-2布比卡因或罗哌卡因的药代动力学参数
表22-3美洛昔康的药代动力学参数
组合物给药后96小时内的布比卡因(或罗哌卡因)和美洛昔康的血药浓度-时间曲线见图4-1和图4-2中。
实施例23
油凝胶组合物的体内施用
所有大鼠先用3.5~4%异氟烷氧气进行诱导麻醉,然后以1.5~2%异氟烷维持麻醉。手术后在大鼠颈部皮下注射0.5cc的40万单位青霉素溶液预防感染。在无菌条件下,将每只大鼠距跖后0.5cm处向前用11号手术刀片作1cm长的纵向切口,分离筋膜和肌肉,沿肌肉纵向切口。轻压止血后,闭合创口,用5号尼龙线在切口部位不连续缝合两针,缝合皮肤。然后围绕切口周围皮下注射罗哌卡因溶液以及油凝胶组合物(见表23-1),给药体积均为0.1mL,在给药后不同时间点用Von Frey单丝刺激大鼠后肢足底中部,测试其机械性缩爪阈值(paw withdrawal threshold,PWT)作为疼痛阈值。检测时间分别为给药后10min、30min、1h、1.5h、2h、4h、6h、8h、10h、12h、24h、48h、72h。实验结束,打开给药部位观察药物吸收情况及给药部位组织炎症情况。
表23-1
每个测试组中的动物Von Frey反应显示于图5-1中。
实施例24
油凝胶组合物的体内施用
所有大鼠先用3.5~4%异氟烷氧气进行诱导麻醉,然后以1.5~2%异氟烷维持麻醉。手术后在大鼠颈部皮下注射0.5cc的40万单位青霉素溶液预防感染。在无菌条件下,将每只大鼠距跖后0.5cm处向前用11号手术刀片作1cm长的纵向切口,分离筋膜和肌肉,沿肌肉纵向切口。轻压止血后,闭合创口,用5号尼龙线在切口部位不连续缝合两针,缝合皮肤。然后围绕切口周围皮下注射油凝胶组合物复方(见表24-1),给药体积均为0.1mL,在给药后不同时间点用Von Frey单丝刺激大鼠后肢足底中部,测试其机械性缩爪阈值(pawwithdrawal threshold,PWT)作为疼痛阈值。检测时间分别为给药后10min、30min、1h、1.5h、2h、4h、6h、8h、10h、12h、24h、48h、72h。实验结束,打开给药部位观察药物吸收情况及给药部位组织炎症情况。
表24-1
每个测试组中的动物Von Frey反应显示于图6-1中。
以上,对本发明示例性的实施方式进行了说明。但是,本发明的保护范围不限定于上述实施方式。凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 缓释制剂载药材料及其组合物、缓释制剂及其制备方法
- GLP‑1类似物及GC‑C受体激动剂组合物缓释制剂及其制备方法
