一种微流控芯片及其制备方法和细胞选择性捕获方法
文献发布时间:2023-06-19 18:29:06
技术领域
本发明涉及细胞生物学技术领域,尤其涉及一种微流控芯片及其制备方法和细胞选择性捕获方法。
背景技术
微流控芯片分析是随着微机电系统(microelectromechanical Systems MEMS)加工技术的进步而快速发展起来的一项前沿课题,是将多个功能化单元,如样品制备、分离、浓缩和检测等,集中到一块面积仅为几平方厘米级的芯片上,用以完成不同生化分析。微流控是一个涉及了工程学、物理学、化学、微加工和生物工程等领域的交叉学科,其目标是通过对芯片微通道网络内样本的操纵和控制,完成化学实验室中取样、预处理、反应、分离和检测等分析功能,实现分析装备的微型化、集成化和自动化,最终实现芯片化,即所谓“芯片实验室”(Lab-on-a-chip)。从复杂的生物样品中实现对特定生物微粒(如酵母菌、血液细胞等)的高效和精确分选是许多临床诊断和治疗过程中的第一步,在医学、生物研究以及环境检测等领域具有广泛的应用。
目前,微流控微粒分选方法主要有主动方法和被动方法。被动分选具有高通量、不需要外加场等优势,但是其依赖于精确的流体动力控制或者复杂的通道内部结构,因而极大地限制了其应用范围。主动方法指引入外部场调控样本的运动,如磁场、光场、声场和电场等。对于磁微流控,主要局限于对磁性或磁珠标记的微粒进行操纵,其应用场景受限。光微流控具有准确度高、非侵入等优点,但光镊系统需要庞大的光路系统,且其成本也较高,这也限制了系统的小型化和便携性发展。声控微流体是利用声波在微流体中诱导的流-固耦合效应进行对样本的操纵,具有非接触、无损伤、穿透性较好等优点,但压电基片材料单一,且芯片加工相对复杂。电控微流体是利用电动力学现象对样品进行操纵,常见的电控操纵方法主要是介电泳、交流电渗、电泳等。其中,交流电渗要在极低溶液电导率和电场频率条件下进行,容易对样本造成损伤;而电泳技术主要用来操纵带电颗粒,且需要很高的直流电压,从而极大地限制了这两种电动机制的应用范围。
综上所述,以上几种微粒操纵方式均需要相应的外部驱动设备和复杂庞大的管路,成本高,且不利于手持式便携式设备的开发。
发明内容
针对现有技术不足,本发明的目的在于提供一种微流控芯片及其制备方法和细胞选择性捕获方法。
为了实现上述目的,本发明一实施例提供的技术方案如下:
一种微流控芯片,包括:
PDMS通道,内部中空且上下侧开口;
ITO导电玻璃基底,键合于所述PDMS通道的下开口侧;
ITO导电玻璃盖板,键合于所述PDMS通道的上开口侧,所述ITO导电玻璃盖板上分别开设有入口和出口;
三明治型微电极,设于所述PDMS通道内,所述三明治型微电极包括磁性材料、分别设于所述磁性材料相对两侧的两个导电材料。
作为本发明的进一步改进,所述ITO导电玻璃基底与ITO导电玻璃盖板的尺寸相同,所述ITO导电玻璃盖板的长为45-55mm、宽为32-40mm、高为1.0-1.2mm,所述ITO导电玻璃盖板的ITO涂层厚度为0.4-0.6μm。
作为本发明的进一步改进,所述PDMS通道的内部宽度为21-31mm、内部长度为36-44mm,高度为0.9-1.1mm。
作为本发明的进一步改进,所述三明治型微电极的直径为200-400μm。
一种微流控芯片的制备方法,包括以下步骤:
(1)制备微流控芯片本体;
(2)制备三明治型微电极;
(3)将三明治型微电极注入到微流控芯片本体内,得到微流控芯片。
作为本发明的进一步改进,所述步骤(1)包括以下步骤:
(1.1)加工通道模具,将通道模具固定在第一玻璃表面;
(1.2)取PDMS与固化剂以10:1的比例混合,并浇筑在第二玻璃表面上,固化后形成PDMS压板,在PDMS压板表面贴PVA薄膜;
(1.3)另取PDMS与固化剂以10:1的比例混合,并浇筑在第一玻璃表面上,接着用PDMS压板压在第一玻璃表面的PDMS上,固化后得到PDMS通道;
(1.4)将PDMS通道1与第一玻璃52分离;
(1.5)提供一ITO导电玻璃基底,将PDMS通道的下开口侧与ITO导电玻璃基底带有ITO涂层的一侧进行等离子处理后键合在一起,形成半成品芯片;
(1.6)将半成品芯片放入水中,溶解掉PDMS通道上的PVA薄膜,并去掉PDMS压板;
(1.7)提供一ITO导电玻璃盖板,在ITO导电玻璃盖板上开设入口和出口,将ITO导电玻璃盖板带有ITO涂层的一侧与PDMS通道的上开口侧进行等离子处理后键合在一起,得到微流控芯片本体。
作为本发明的进一步改进,所述步骤(2)包括以下步骤:
(2.1)提供导电粉、磁性粉和ETPTA,将导电粉与ETPTA混合形成第一混合物,将磁性粉与ETPTA混合形成第二混合物;
(2.2)将第一混合物分别通入液滴微流控芯片的两个侧通道内,将第二混合物通入液滴微流控芯片位于两个侧通道之间的中间通道内,两个侧通道、中间通道均与主通道相连通,将油分别通过液滴微流控芯片的两个注入孔通入主通道,形成三明治型液滴;
(2.3)在液滴微流控芯片尾端对三明治型液滴进行固化处理得到三明治型颗粒,再收集三明治型颗粒进行加热处理,得到三明治型微电极。
作为本发明的进一步改进,所述步骤(2.2)中,通过控制油的流速来改变三明治型颗粒的形状。
一种微流控芯片的细胞捕获方法,其特征在于,包括以下步骤:
(1)制备细胞悬浮液,细胞悬浮液中含有目标细胞和其它细胞;
(2)将细胞悬浮液注入到微流控芯片的PDMS通道内;
(3)利用磁铁牵引三明治型微电极在PDMS通道内游动,在显微镜下寻找到并靠近目标细胞,使三明治型微电极接触目标细胞;
(4)通过调节电压幅值和电信号频率,使得目标细胞被捕获在三明治型微电极上;
(5)按照预定义的路径调节磁铁方位,进一步寻找其它的目标细胞,将目标细胞全部捕获,实现目标细胞与其它细胞的分选。
作为本发明的进一步改进,所述步骤(1)包括以下步骤:
(1.1)分别提供人乳腺癌细胞和人白血病T淋巴细胞培养瓶,并将它们分别在含有1%青链霉素和10%胎牛血清的细胞培养基中培养,培养温度37℃,CO
(1.2)所有细胞每2~3天进行一次传代培养,使细胞浓度保持在1.0×10
(1.3)使用0.25%的胰蛋白酶-EDTA消化液从各自的培养瓶中分离人乳腺癌细胞和人白血病T淋巴细胞,然后分别在离心管中离心制粒,并在5.0mL的Tris缓冲液中重悬制得细胞悬浮液。
本发明的有益效果是:
本发明利用磁性材料-导电材料-磁性材料的三夹板式结构的三明治型游动微电极和“槽形”结构的芯片结构,将生成的三明治型微电极和细胞悬浮于结构的PDMS通道内,路径规划后通过外部磁铁牵引三明治型微电极在PDMS通道内游动,再通过调节外部电压和电信号频率,在细胞或微粒附近任意位置制造一强局部电场,基于介电泳效应对该位置的微粒或细胞进行捕获,能够实现混合细胞或微粒的动态分选;本发明在癌症早期诊断、细胞培养等细胞生物学领域具有重要的应用。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明中记载的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1为本发明的优选实施例一的微流控芯片的整体结构图;
图2为本发明的优选实施例一的微流控芯片的分解结构示意图;
图3为本发明的优选实施例一的微流控芯片的俯视图;
图4为图3的A-A向剖视图;
图5为本发明的优选实施例一的三明治型微电极的结构图;
图6为本发明的优选实施例二的微流控芯片本体的加工流程图;
图7为本发明的优选实施例二的三明治型微电极的加工流程图;
图8为本发明的优选实施例三的分选示意图。
具体实施方式
为了使本技术领域的人员更好地理解本发明中的技术方案,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都应当属于本发明保护的范围。
实施例一
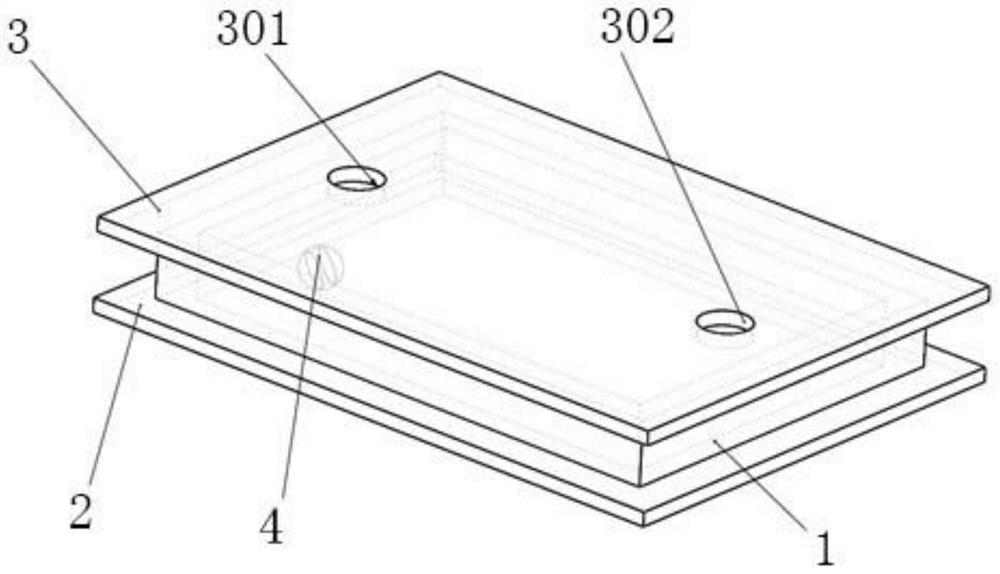
请参阅图1,本申请实施例公开了一种微流控芯片,包括PDMS通道1、ITO导电玻璃基底2、ITO导电玻璃盖板3和三明治型微电极4。
请参阅图2,PDMS通道1内部中空且上下侧开口。
请参阅图3、图4,PDMS通道1的内部宽度W1为21-31mm、内部长度L1为36-44mm,高度H1为0.9-1.1mm。具体地,PDMS通道1的内部宽度W1为26mm、内部长度L1为40mm,高度H1为1.0mm。
ITO导电玻璃基底2包含有ITO涂层,ITO涂层也就是氧化铟锡涂层,ITO导电玻璃基底2设有ITO涂层的一侧键合于PDMS通道1的下开口侧101。ITO导电玻璃盖板3包含有ITO涂层,ITO导电玻璃盖板3设有ITO涂层的一侧键合于PDMS通道1的上开口侧102,ITO导电玻璃盖板3上分别开设有入口301和出口302。
在本实施例中,ITO导电玻璃基底2与ITO导电玻璃盖板3的尺寸相同,ITO导电玻璃盖板3的长L2为45-55mm、宽W2为32-40mm、高H2为1.0-1.2mm,ITO导电玻璃盖板3的ITO涂层厚度为0.4-0.6μm。具体地,ITO导电玻璃盖板3的长L2为50mm、宽W2为36mm、高H2为1.1mm,ITO导电玻璃盖板3的ITO涂层厚度为0.5μm。
三明治型微电极4设于PDMS通道1内,三明治型微电极4包括磁性材料401、分别设于磁性材料401相对两侧的两个导电材料402,如图5所示。
磁性材料401可以为Fe
优选三明治型微电极4呈圆形,在捕获细胞后运动所受的流体动力剪切作用较小,运动速度快,提高效率。但三明治”型微电极4并不局限于圆形,也可以呈棒形。优选三明治型微电极4的直径为200-400μm。具体地,三明治型微电极4的直径为300μm。具体地,磁性材料401的宽度d1、导电材料402的宽度d2均为100μm。
三明治型微电极4因为提供了不对称性,从而可以在单个粒子中赋予截然不同的化学或物理性质和方向性。在外加电场作用下,三明治型粒子的金属半球发生电极化现象而产生一诱导电势,从而三明治型粒子可以作为一种微电极的特殊形式。由于三明治型微电极成分的不均匀性,会在其附近产生较强的三维局部电场梯度,会发生一系列的交流电动现象,主要涉及介电泳(DEP),使得非均匀电场与待捕获的细胞或者微粒上的场诱导电荷相互作用,引起细胞或微粒的运动,从而将细胞或微粒捕获在三明治型微电极4上。
实施例二
本申请实施例公开了一种微流控芯片的制备方法,其特征在于,包括以下步骤:
(1)制备微流控芯片本体;
(2)制备三明治型微电极;
(3)将三明治型微电极注入到微流控芯片本体内,得到微流控芯片。
请参阅图6,其中步骤(1)包括以下步骤:
(1.1)加工通道模具51,将通道模具51固定在第一玻璃52表面;
(1.2)取PDMS与固化剂以10:1的比例混合,并浇筑在第二玻璃53表面上,固化后形成PDMS压板54,在PDMS压板54表面贴PVA薄膜55;
(1.3)另取PDMS与固化剂以10:1的比例混合,并浇筑在第一玻璃52表面上,接着用PDMS压板54压在第一玻璃52表面的PDMS上,固化后得到PDMS通道1;
(1.4)将PDMS通道1与第一玻璃52分离;
(1.5)提供一ITO导电玻璃基底2,将PDMS通道1的下开口侧与ITO导电玻璃基底2带有ITO涂层的一侧进行等离子处理后键合在一起,形成半成品芯片;
(1.6)将半成品芯片放入水中,溶解掉PDMS通道1上的PVA薄膜55,并去掉PDMS压板54;
(1.7)提供一ITO导电玻璃盖板3,在ITO导电玻璃盖板3上开设入口301和出口302,将ITO导电玻璃盖板3带有ITO涂层的一侧与PDMS通道1的上开口侧进行等离子处理后键合在一起,得到微流控芯片本体。
其中,通道模具51为PMMA通道模具,通过数控机床进行加工,加工简便。但并不局限于PMMA材质,也可以采用采用光刻工艺制作通道模具51。利用无影胶将PMMA材质的通道模具51粘贴在清洗干净的第一玻璃52表面实现通道模具51的固定。
通过设置PVA薄膜55以便隔离PDMS压板54与PDMS通道1,便于后续将PDMS压板54与PDMS通道1分离。
其中步骤(1.3)中,还包括抽真空以排除未固化PDMS内部的气泡。
其中步骤(1.2)、步骤(1.3)中的固化可以采用放入烤箱中进行固化。
请参阅图7,步骤(2)也就是制备三明治型微电极4包括以下步骤:
(2.1)提供导电粉、磁性粉和ETPTA,将导电粉与ETPTA混合形成第一混合物,将磁性粉与ETPTA混合形成第二混合物;ETPTA为乙氧基化三羟甲基丙烷三丙烯酸酯,呈液态;
(2.2)将第一混合物分别通入液滴微流控芯片6的两个侧通道61内,将第二混合物通入液滴微流控芯片6位于两个侧通道61之间的中间通道62内,两个侧通道61、中间通道62均与主通道63相连通,将油分别通过液滴微流控芯片6的两个注入孔64通入主通道63,形成三明治型液滴;
(2.3)在液滴微流控芯片6尾端对三明治型液滴进行固化处理得到三明治型颗粒,再收集三明治型颗粒进行加热处理,得到三明治型微电极4。
具体地,选取导电粉为银粉,磁性粉为四氧化三铁粉。具体地,第一混合物、第二混合物通过注射泵通入侧通道61和中间通道62内。
通过混合ETPTA,采用辐射固化或者光固化将液态的三明治型液滴固化为三明治型颗粒。在本实施例中,通过在液滴微流控芯片6尾端利用UV光对三明治型液滴进行光固化处理得到三明治型颗粒。收集到的三明治型颗粒进行130-180℃加热处理,去除水分等杂质,从而使银粉之间没有间隙,成分更均匀,银粉之间搭接更紧密,导电性更好,提高其作为微电极时的灵敏度,由此获得所需要的Ag-Fe
其中步骤(2.2)中,通过控制油的流速来改变三明治型颗粒的形状。优选形状为圆形,但并不局限于圆形,也可以为棒形。
具体地,通过将三明治型微电极4从入口301注入到微流控芯片本体内。
实施例三
本申请实施例公开了一种微流控芯片的细胞选择性捕获方法,包括以下步骤:
(1)制备细胞悬浮液,细胞悬浮液中含有目标细胞和其它细胞;
(2)将细胞悬浮液注入到微流控芯片的PDMS通道内;
(3)利用磁铁牵引三明治型微电极在PDMS通道内游动,在显微镜下寻找到并靠近目标细胞,使三明治型微电极接触目标细胞;
(4)通过调节电压幅值和电信号频率,使得目标细胞被捕获在三明治型微电极上;
(5)按照预定义的路径调节磁铁方位,进一步寻找其它的目标细胞,将目标细胞全部捕获,实现目标细胞与其它细胞的分选。
请参阅图8,为了更好地说明一种微流控芯片的细胞选择性捕获方法,包括以下步骤:
S1:先用等离子机处理微流控芯片,使PDMS通道内表面变成亲水表面,防止三明治型微电极粘附在ITO涂层。
S2:分别提供人乳腺癌细胞和人白血病T淋巴细胞培养瓶,并将它们分别在含有1%青链霉素和10%胎牛血清的细胞培养基中培养,培养温度37℃,CO
S3:对微流控芯片进行接电配置以提供电场,将信号发生器的输出端与信号放大器的输入端相连,ITO导电玻璃基底2作为接地电极,ITO导电玻璃盖板3接信号放大器的输出端正极。
S4:使用0.25%的胰蛋白酶-EDTA消化液从各自的培养瓶中分离人乳腺癌细胞和人白血病T淋巴细胞,然后分别在离心管中离心制粒,并在5.0mL的Tris缓冲液也就是三羟甲基氨基甲烷缓冲液中重悬制得细胞悬浮液,细胞悬浮液中有人乳腺癌细胞和人白血病T淋巴细胞。优选地,离心转速1100rpm,离心时间为5min。
S5:将细胞悬浮液通过入口注入到微流控芯片的PDMS通道内。
S6:利用磁铁牵引三明治型微电极在PDMS通道内游动,在显微镜下寻找到并靠近人乳腺癌细胞,使三明治型微电极接触人乳腺癌细胞。
S7:通过调节合适的电压幅值和电信号频率产生一局部强电场,使得人乳腺癌细胞被捕获在三明治型微电极上。
S8:按照预定义的路径调节磁铁方位,进一步寻找其它的人乳腺癌细胞,将人乳腺癌细胞全部捕获到预定区域,利用磁力从出口回收三明治型微电极。预定区域可以与出口相对应处或者靠近出口处。
对于本领域技术人员而言,显然本发明不限于上述示范性实施例的细节,而且在不背离本发明的精神或基本特征的情况下,能够以其他的具体形式实现本发明。因此,无论从哪一点来看,均应将实施例看作是示范性的,而且是非限制性的,本发明的范围由所附权利要求而不是上述说明限定,因此旨在将落在权利要求的等同要件的含义和范围内的所有变化囊括在本发明内。不应将权利要求中的任何附图标记视为限制所涉及的权利要求。
此外,应当理解,虽然本说明书按照实施方式加以描述,但并非每个实施方式仅包含一个独立的技术方案,说明书的这种叙述方式仅仅是为清楚起见,本领域技术人员应当将说明书作为一个整体,各实施例中的技术方案也可以经适当组合,形成本领域技术人员可以理解的其他实施方式。
- 微流控芯片、干细胞分离方法及微流控芯片的制备方法
- 一种微流控组件、微流控芯片及其制备方法
- 一种基于核酸适体的可捕获癌细胞的微流控芯片及其制备和癌细胞的分离方法
- 一种基于核酸适体的可捕获癌细胞的微流控芯片及其制备和癌细胞的分离方法
