一种连有吩噻嗪和三苯胺的吡喃腈化合物及其制备与应用
文献发布时间:2023-06-19 18:30:43
技术领域
本发明属于功能材料技术领域,具体涉及一种连有吩噻嗪和三苯胺的吡喃腈化合物及其制备与应用。
背景技术
脂滴是一类由磷脂单分子层及中性脂质组成的疏水核心构成,其表面分布大量蛋白,被认为是储存能量的细胞器。近几年来,研究人员发现,脂滴除了负责细胞内脂类代谢与存储外,还参与了膜转运、蛋白降解以及信号传导等生理过程。多种脂质代谢疾病,如肥胖、脂肪肝、心血管疾病和糖尿病,都表现出脂滴大量生成。另外,由于肿瘤组织的快速增殖特性,其能量依赖度较高,因此肿瘤细胞中脂滴数量也较正常细胞中更过。因此,对脂滴进行高灵敏性的成像分析显得愈发重要。
近几年来,虽然报道了一些荧光探针利用脂滴中低极性、高黏度微环境检测细胞中的脂滴,但是目前大部分脂滴探针发射波长较短(<600nm),不利于活体原位成像;且探针的稳定性和特异性也存在不足,易与活性物质发生反应,且光谱容易受黏度微环境影响。例如,脂滴探针TPA-SO
发明内容
本发明的目的是提供一种连有吩噻嗪和三苯胺的吡喃腈化合物及其制备与应用,解决了现有脂滴探针发射波长较短,不利于活体原位成像以及探针的稳定性和特异性不足的问题,该探针是一种新的检测脂滴的长波荧光探针,具有稳定性和特异性。
为了达到上述目的,本发明提供了一种连有吩噻嗪和三苯胺的吡喃腈化合物,该化合物具有如式(A)所示的结构;
其中,R为C
优选地,所述的R为C
更优选地,所述的R为乙基。
本发明提供了一种如所述的连有吩噻嗪和三苯胺的吡喃腈化合物的制备方法,该方法包含:
(1)将4-二苯胺基苯甲醛、2,6-二甲基-4-吡喃亚基丙二腈和有机碱溶于无水极性有机溶剂中,在50~90℃下反应,制备得到中间体Ⅰ;
(2)将步骤(1)制得的中间体Ⅰ与中间体Ⅱ和有机碱溶于无水极性有机溶剂中,在70~90℃下反应,制备得到如所述的连有吩噻嗪和三苯胺的吡喃腈化合物,即化合物Ⅲ。
步骤(1)、(2)中的反应温度根据具体所选择的溶剂沸点来确定。若选用乙腈作溶剂,反应温度设置成其沸点温度80℃;若选用甲醇会设置为65℃;若温度过高或过低会降低反应产率。
优选地,所述的4-二苯胺基苯甲醛、2,6-二甲基-4-吡喃亚基丙二腈和有机碱的物质的量比为(0.8~1.0):1:(1.1~1.5)。物质的量比过大造成浪费,过少会增加副产物的生成,极大的降低产率。所述的2,6-二甲基-4-吡喃亚基丙二腈与无水极性有机溶剂的摩尔体积比为1mmol:(10~20)mL。无水极性有机溶剂的体积过多造成浪费,过少会导致溶解不充分降低反应产率。
优选地,所述的步骤(1)制得的中间体Ⅰ、中间体Ⅱ和有机碱的物质的量比为1:(1.2~1.5):(1.2~1.5)。中间体Ⅱ投入过多造成浪费,投入过少会降低产率。所述的中间体Ⅰ与无水极性有机溶剂的摩尔体积比为1mmol:(10~20)mL。无水极性有机溶剂的体积过多造成浪费,过少会导致溶解不充分降低反应产率。
优选地,在步骤(1)中,在50~90℃下反应的时间为4~12小时。
优选地,在步骤(2)中,在70~90℃下反应的时间为4~12小时。
步骤(1)、(2)中的反应时间过短未完全进行,产率降低;时间过长产率没有明显提升。
优选地,在制备中间体Ⅰ、化合物Ⅲ中,所述的无水极性有机溶剂均选自无水乙腈、无水甲醇、无水乙醇、丙酮、四氢呋喃、二氯甲烷、二甲基甲酰胺和二甲基亚砜中的任意一种或两种以上。
优选地,在制备中间体Ⅰ、化合物Ⅲ中,所述的有机碱均为氮杂环己烷、1,4-氧氮杂环己烷、乙醇钾、丁基锂和二异丙基胺基锂中的任意一种或两种以上。
本发明提供了一种如所述的连有吩噻嗪和三苯胺的吡喃腈化合物作为脂滴荧光探针的应用。
本发明的一种连有吩噻嗪和三苯胺的吡喃腈化合物及其制备与应用,解决了现有脂滴探针发射波长较短,不利于活体原位成像以及探针的稳定性和特异性不足的问题,具有以下优点:
1、本发明将吩噻嗪和三苯胺分别连在吡喃腈单元的2位和6位,且分布于吡喃腈两侧,可以弱化激发态分子电荷分离,增加稳定性;
2、本发明提供了一种新的检测脂滴的长波荧光探针,该探针结构稳定,合成简单,Stokes位移大(为176nm),特异性强(探针对极性、低极性微环境均有特异性响应,脂滴作为细胞中低极性细胞器,探针可以对其进行成像),能够对外部刺激下细胞内脂滴数量的变化进行灵敏检测。
附图说明
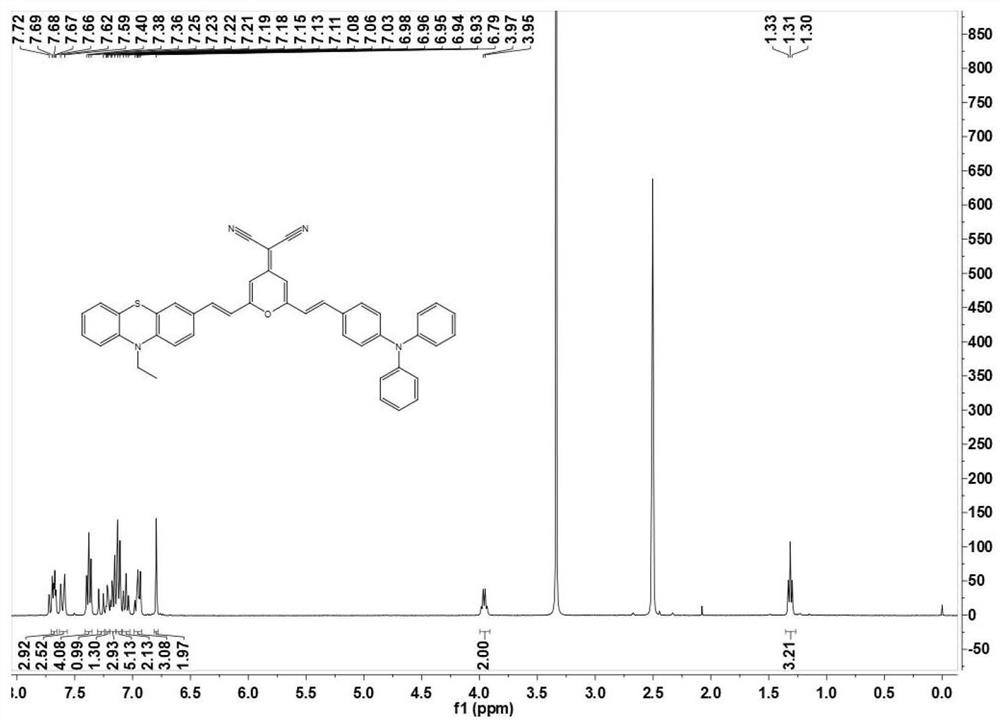
图1为本发明实施例1制备的化合物Ⅲ的氢谱图。
图2为本发明实施例1制备的化合物Ⅲ的碳谱图。
图3为本发明实施例1制备的化合物Ⅲ在不同活性物质存在下的荧光光谱图,其中,横坐标为波长,纵坐标为荧光强度。
图4为本发明实施例1制备的化合物Ⅲ在不同溶剂中的吸收光谱图,其中,横坐标为波长,纵坐标为吸光度。
图5为本发明实施例1制备的化合物Ⅲ在不同溶剂中的荧光光谱图,其中,横坐标为波长,纵坐标为相对荧光强。
图6为本发明实施例1制备的化合物Ⅲ在不同溶剂中的荧光强度对比图,其中,横坐标为溶剂,纵坐标为相对荧光强度。
图7为本发明实施例1制备的化合物Ⅲ在不同体积比的1,4-二氧六环-水的混合体系中的荧光光谱图,其中,横坐标为波长,纵坐标为荧光强度。
图8为本发明实施例1制备的化合物Ⅲ在不同细胞中的探针成像图,其中,RAW为小鼠巨噬细胞;A549为人肺癌细胞;HeLa为宫颈癌细胞。
图9为本发明实施例1制备的化合物Ⅲ与用油酸刺激后的HeLa细胞的荧光成像图,其中,(a)为对照组,只孵育探针;(b)为实验组,用油酸刺激之后再孵育探针。
图10为本发明实施例1制备的化合物Ⅲ与HeLa细胞中BODIPY493/503共同培养后的荧光成像图,其中,BODIPY493/503为市售脂滴染料(绿色通道),探针为化合物Ⅲ(红色通道),合并为两通道的叠加,共定位为共定位系数的计算。
具体实施方式
下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
以下实施例、实验例中使用的试剂及制备或型号等如下:
1、中间体Ⅱ,按照Observation of peroxynitrite overproduction in cellsduring 5-fluorouracil treatment via a ratiometric fluorescent probe.Scheme S1(Chem.Commun.,2020,56(18),2759-2762)的方法制得的。
2、培养基的型号、规格和厂商:
Dulbecco’s modified Eagle’s medium(DMEM、500mL、Gibco);
Fetal bovine serum(FBS、500mL、Gibco)。
实施例1
一种连有吩噻嗪和三苯胺的吡喃腈化合物的制备方法,该方法包含:
(1)将物质的量比为0.8:1:1.1的4-二苯胺基苯甲醛、2,6-二甲基-4-吡喃亚基丙二腈和氮杂环己烷(哌啶)溶于无水乙腈(2,6-二甲基-4-吡喃亚基丙二腈与无水乙腈的摩尔体积比为1mmol:10mL)中,在90℃下反应12小时,制备得到中间体Ⅰ;
(2)中间体Ⅱ按照文献(Chem.Commun.,2020,56,2759-2762)的方法合成的;将物质的量比为1:1.2:1.2的步骤(1)制得的中间体Ⅰ、中间体Ⅱ和氮杂环己烷(哌啶)溶于无水乙腈(中间体Ⅰ与无水乙腈的摩尔体积比为1mmol:10mL)中,在90℃下反应12小时,制备得到一种连有吩噻嗪和三苯胺的吡喃腈化合物(化合物Ⅲ),产率为65%。
实施例2
一种连有吩噻嗪和三苯胺的吡喃腈化合物的制备方法与实施例5基本相同,区别在于:
将步骤(1)、(2)中的无水乙腈替分别换为无水甲醇(MeOH)、无水乙醇(EtOH);化合物Ⅲ的产率有所下降。
实施例3
一种连有吩噻嗪和三苯胺的吡喃腈化合物的制备方法与实施例5基本相同,区别在于:
将步骤(1)、(2)中的氮杂环己烷(哌啶)均替换为1,4-氧氮杂环己烷(吗啉);化合物Ⅲ的产率几乎不变。
实验例1本发明实施例1~3制备的化合物Ⅲ微观表征
如图1所示,本发明实施例1制备的化合物Ⅲ的氢谱图。如图2所示,本发明实施例1制备的化合物Ⅲ的碳谱图。本发明实施例2~3制备的化合物Ⅲ的核磁表征与实施例1制备的化合物Ⅳ相同,实施例1制备的化合物Ⅲ的核磁表征数据如下:
实验例2本发明实施例1制备的化合物Ⅲ在不同活性物质存在下的荧光探针
在30℃下,将实施例1制备的化合物Ⅲ(2,6位分别连有吩噻嗪和三苯胺的吡喃腈化合物)溶于二甲亚砜,配成5mmol/L母液;取10份6微升母液分别加入至3毫升水中,配成10份探针浓度为10μmol/L的测试液,分别加入100μmol/L不同活性物质记为实验组;空白组(blank)不添加不同活性物质,其余与实验组一样。激发波长为470nm,通过荧光仪测试荧光光谱。上述活性物质包括:次氯酸根(ClO
如图3所示,本发明实施例1~3制备的化合物Ⅲ在不同活性物质存在下的荧光光谱图,其中,横坐标为波长,纵坐标为荧光强度。由图3可以看出,与空白组(blank)相比,实验组中化合物Ⅲ在不同活性物质存在下,并未发生明显的荧光光谱变化,说明化合物Ⅲ具有良好的化学稳定性(这里的ClO
实验例3本发明实施例1制备的化合物Ⅲ在不同溶剂中的荧光探针
分别取实验例1配置的母液6微升加至3毫升的水、二甲亚砜、乙腈、二甲基甲酰胺、甲醇、乙醇、1,4-二氧六环(1,4-Dioxane)、四氢呋喃(THF)、二氯甲烷(DCM)或甘油(Glycerol)中,配成探针浓度为10μmol/L的测试液,通过分光光度计测试吸收光谱;激发波长为470nm,通过荧光仪测试荧光光谱。
如图4所示,本发明实施例1制备的化合物Ⅲ在不同溶剂中的吸收光谱图,横坐标为波长,纵坐标为吸光度。由图4可以看出,化合物Ⅲ在不同溶剂中的最大吸收波长范围470~548nm,其中,在1,4-二氧六环(1,4-Dioxane)中最大吸收波长为470nm。
如图5所示,本发明实施例1~3制备的化合物Ⅲ在不同溶剂中的荧光光谱图,横坐标为波长,纵坐标为相对荧光强。由图5可以看出,化合物Ⅲ在1,4-二氧六环(1,4-Dioxane)中具有最强的荧光发射强度,发射波长为646nm,Stokes位移为176nm。在极性稍大的四氢呋喃和二氯甲烷溶剂中,探针具有中等强度荧光;而在其他极性较大的溶剂中,探针几乎不发射荧光。值得注意的是,在高黏度溶剂甘油中,探针的荧光非常弱,说明探针荧光受黏度影响很小。
如图6所示,本发明实施例1制备的化合物Ⅲ在不同溶剂中的荧光强度对比图,其中,横坐标为溶剂,纵坐标为相对荧光强度。由图6可以看出,化合物Ⅲ对1,4-二氧六环(1,4-Dioxane)具有良好的特异性,即对低极性环境有特异性响应。
实验例4本发明实施例1制备的化合物Ⅲ在不同体积比的1,4-二氧六环-水体系中的荧光探针
在30℃下,分别取实验例1配置的母液6微升依次加至10个3mL的1,4-二氧六环-水的混合体系(1,4-二氧六环-水的混合体系总体积均为3mL,其中1,4-二氧六环的体积百分数分别为0、10%、20%、30%、40%、50%、60%、70%、80%、90%)中;激发波长为480nm,探针浓度为10μmol/L,通过荧光仪可检测到荧光信号变化。
如图7所示,本发明实施例1制备的化合物Ⅲ在不同体积比的1,4-二氧六环-水的混合体系中的荧光光谱图,其中,横坐标为波长,纵坐标为荧光强度。由图7可以得出从上到下随着极性的增大(1,4-二氧六环溶液比例的减小),荧光强度逐渐减弱,证明探针对低极性环境具有较高的灵敏度。
实验例5本发明实施例1制备的化合物Ⅲ在不同细胞中的荧光探针
分别取实验例1配置的母液1μL用培养基稀释至1mL,分别加在小鼠巨噬细胞(RAW264.7细胞)、宫颈癌细胞(HeLa细胞)和人肺癌细胞(A549细胞)中(四种细胞的数量均控制在20~25万),于37℃孵化20分钟;探针浓度为5μmol/L,激发波长为488nm,发射波长为570~620nm,室温通过激光共聚荧光显微镜观察荧光信号。
如图8所示,本发明实施例1制备的化合物Ⅲ在不同细胞中的探针成像图,其中,RAW264.7为小鼠巨噬细胞(正常细胞);A549为人肺癌细胞;HeLa为宫颈癌细胞;第一行(A、D、H)为荧光图;第二行(B、E、I)为明场图,第三行(C、F、G)为前两行叠加图。由于癌细胞中的极性要低于正常细胞,由图8中的荧光图可见化合物Ⅲ可以对癌细胞进行选择性成像,因此根据化合物Ⅲ对不同类型细胞表达出不同程度的荧光信号来区分正常细胞和癌细胞。另外,从图8癌细胞中荧光分布分析,化合物Ⅲ主要分布在脂滴中。
实验例6本发明实施例1制备的化合物Ⅲ与用制霉菌素刺激后的HeLa细胞的荧光探针
实验组的具体操作:在37℃下,向宫颈癌细胞(HeLa细胞,均控制在20~25万)中加入油酸(300μmol/L)孵化4小时,然后取实验例1配置的母液1μL用培养基稀释至1mL加入至宫颈癌细胞与油酸的混合液中,孵化30分钟;激发波长为488nm,发射波长为570~620nm,探针浓度为5μmol/L,通过激光共聚荧光显微镜观察荧光信号。
如图9所示,本发明实施例1制备的化合物Ⅲ与用油酸刺激后的HeLa细胞的荧光成像图,其中,A为对照组,只孵育探针;B为实验组,用油酸刺激之后再孵育探针;第一行(A、B)为荧光图,第二行(C、D)为明场图,第三行(E、F)为叠加图。由图9可见实验组的荧光强度明显高于对照组,这是由于在油酸刺激下,HeLa细胞中脂滴数量增多,因此荧光强度升高。
实验例7本发明实施例1制备的化合物Ⅲ与HeLa细胞中BODIPY493/503共同培养后的荧光探针
在37℃下,向宫颈癌细胞(HeLa细胞)中加入商业化脂滴染料BODIPY493/503(1μmol/L)和实验例1配置的母液1μL,孵化30分钟;BODIPY493/503:浓度为1μmol/L,激发波长为488nm,发射波长为500~550nm;化合物Ⅲ:浓度为5μmol/L,激发波长为488nm,发射波长为570~620nm;通过激光共聚荧光显微镜观察荧光信号。
如图10所示,本发明实施例1制备的化合物Ⅲ与HeLa细胞中BODIPY493/503共同培养后的荧光成像图,其中,BODIPY493/503为市售脂滴染料(绿色通道),探针为化合物Ⅲ(红色通道),合并为两通道的叠加,共定位为共定位系数的计算。由图10可知BODIPY493/503市售染料为绿色通道,化合物Ⅲ为红色通道,两通道合并后荧光重合度较高,说明化合物Ⅲ能很好的定位到脂滴。
由上述实验例得出,在低极性微环境下,化合物Ⅲ的荧光特异性显著增强,且该荧光响应不受黏度及活性物质的影响。因此,脂滴作为细胞中低极性细胞器,探针可以对其进行成像。
尽管本发明的内容已经通过上述优选实施例作了详细介绍,但应当认识到上述的描述不应被认为是对本发明的限制。在本领域技术人员阅读了上述内容后,对于本发明的多种修改和替代都将是显而易见的。因此,本发明的保护范围应由所附的权利要求来限定。
- 一种苯并吡喃鎓-吩噻嗪衍生物及其制备方法和应用
- 一种苯并吡喃鎓-吩噻嗪衍生物及其制备方法和应用
