加巴喷丁、酮洛芬和赖氨酸的共晶、药物组合物及其医药用途
文献发布时间:2023-06-19 18:32:25
技术领域
本发明涉及一种加巴喷丁(Gabapentin)、酮洛芬(Ketoprofen)和赖氨酸(Lysine)的共晶,涉及一种制备其的方法,涉及一种包含所述共晶的药物组合物,并且涉及所述共晶或药物组合物在治疗急性或慢性疼痛中的用途,特别是在治疗神经性或炎性疼痛中的用途。
背景技术
疼痛是一种感觉和情感体验,通常由实际或潜在的组织损伤引起。
疼痛病症可以分为急性和慢性。
急性疼痛是一种持续时间较短的疼痛,典型地少于3个月,通常与组织损伤、炎症、外科手术、分娩或短暂的疾病过程有关。
慢性疼痛被认为是一种持续超过正常愈合时间的疼痛,因此缺乏生理伤害感受的急性警告功能。通常,当疼痛持续或复发超过3个月时,该疼痛被归类为慢性。
慢性疼痛可能有不同的病因,包括神经性疼痛、慢性炎性疼痛(例如关节炎),或来源不明的疼痛(如纤维肌痛和不宁腿综合征)。
慢性神经性疼痛是由躯体感觉神经系统的病变或疾病引起的,所述系统提供有关身体(包括皮肤、肌肉骨骼和内脏器官)的信息。许多疾病或病理状况可以导致感觉神经元损伤,其导致痛觉过敏或异常性疼痛,例如腰骶部痛(lower back pain)、坐骨神经痛、术后疼痛、癌症疼痛、幻肢痛、HIV疼痛、糖尿病神经病变疼痛、带状疱疹疼痛或三叉神经痛。
慢性炎性疼痛与感染性、自身免疫性或代谢性病因的强烈炎症(例如类风湿性关节炎)以及影响骨骼、关节、肌腱或肌肉的结构变化(例如骨关节病(osteoarthrosis))有关。
这种类型的疼痛的治疗通常包括使用非甾体抗炎药、对乙酰氨基酚和其他疾病缓解剂。
由于其复杂的病因,神经性疼痛的药物治疗不同于非神经性疼痛的治疗。指南推荐使用血清素和去甲肾上腺素再摄取抑制剂、三环类抗抑郁药、抗惊厥药或局部利多卡因治疗作为管理神经性疼痛的一线和二线药物,通常推荐使用阿片类作为二线或三线疗法(Deng等人BMC Anesthesiology(2016)16:12)。对乙酰氨基酚和非甾体抗炎药对神经性疼痛基本上无效。
神经炎症是一种生理/病理病症,其特征在于免疫细胞浸润、神经胶质细胞活化以及外周和中枢神经系统中炎性介质的产生。
最近的进展表明,周围神经系统(PNS)和中枢神经系统(CNS)内组织的神经炎症的发展是产生和维持导致慢性疼痛的伤害性神经元的敏化性的原因。神经炎症发生在PNS(即,周围神经和神经节)和CNS(即,脊髓和脑)中,其特征在于白细胞浸润和这些部位炎症介质的产生增加。PNS和CNS中不同类型白细胞的运输以不同的时间分布发生。神经炎症表现为神经胶质细胞的激活,如神经中的施万(Schwann)细胞,神经节和小胶质细胞中的卫星神经胶质细胞,和脊髓和大脑中的星形胶质细胞和少突胶质细胞。神经胶质细胞的激活导致产生可以调节疼痛敏感性的神经胶质介质。
神经炎症是一种局部炎症,这意味着它比全身炎症更有效地引发和维持疼痛,但在临床上难以检测到。例如,纤维肌痛是一种慢性肌肉疼痛病症,以前被认为是一种非典型疼痛,因为在受影响的患者中无法检测到明显的病理和炎症。然而,最近的研究确定了纤维肌痛患者的小神经纤维神经病变,这可能是慢性神经炎症的结果也是原因。神经炎症在患有慢性疼痛的患者中似乎是永久性的,但也发生在非慢性病症中,例如手术后疼痛。
目前可用的疗法在管理神经炎性病症方面缺乏疗效,因此需要鉴定新的特异性和安全药物,用于治疗与急性或慢性神经炎性过程相关的仍未满足的医疗需求(Ru-RongJil.Nat.Rev.Drug Discov.2014年七月;13(7):533-548)。
加巴喷丁为式(I)的神经递质γ-氨基丁酸(GABA)的抗惊厥合成类似物
尽管其确切的作用机制尚不清楚,但加巴喷丁似乎可以抑制兴奋性神经元的活动。该分子最初是作为γ-氨基丁酸的化学类似物开发的,以减少用于治疗痉挛的脊髓反射,但其被发现对GABA能系统没有活性。其作用机制包括与中枢神经系统和脊髓的数个区域中的钙通道结合,在所述区域中表达这些通道。钙通道位于突触前末端,在此处它们控制神经递质的释放。
加巴喷丁于1993年被批准用作成人和儿童的部分性癫痫发作的辅助治疗。最近,加巴喷丁也被批准用于治疗慢性疼痛,特别是神经性疼痛综合征。它还被声称对其他数种临床疾病有益,如焦虑症、双相情感障碍和潮热。加巴喷丁也被证明在高剂量治疗纤维肌痛方面有效(Moore等人,Cochrane Database Syst Rev.2014 Apr 27;(4):CD007938;Deng等人,BMC Anesthesiology(2016)16:12)。
然而,许多研究表明,当加巴喷丁单独用于疼痛治疗时,其药理学和药代动力学特征并不令人满意,例如在对特定类型的疼痛、副作用或反应延迟发作方面疗效不佳。事实上,加巴喷丁口服施用后吸收缓慢,在3至4小时内达到血浆中的最高水平(Quintero,Journal of Experimental Pharmacology 2017:9 13-21)。
如果增加剂量,加巴喷丁的血浆水平不会按比例增加,因此需要在治疗开始时根据个体情况仔细滴定;加巴喷丁不与血浆蛋白结合。
加巴喷丁既不被肝酶抑制也不被肝酶代谢;此外,加巴喷丁可以经肾系统排出,其排泄半衰期约为6小时。加巴喷丁最常见的副作用为嗜睡(20%)、头晕(18%)、共济失调(13%)和疲劳(11%)。
由于半衰期短,口服剂量的加巴喷丁每天施用3次(tds)。在第一天每天一次300mg的剂量(通常在睡前以尽量减少镇静作用),然后在第二天300mg每天两次,在第三天300mgtds,可以实现快速滴定。如果在这个剂量没有达到疗效,可以进一步增加剂量。
治疗神经性疼痛的推荐起始剂量为300mg,每天3次,必要时可滴定至最大3600mg.天-1,但据报道,当观察到疗效有限或未观察到疗效时,剂量可达4200mg(M.A.Rose,Anaesthesia,2002,57,451-462页)。
例如,不建议将加巴喷丁用于治疗腰骶部痛,因为它的疗效甚微,而且副作用风险增加(Low back pain and sciatica in over 16s:assessment and management,National Institute for Health and Care Excellence NICE Guidelines 2016)。
此外,加巴喷丁对炎性疼痛几乎没有活性,这在角叉菜胶炎症大鼠模型的本实验部分中也证实了这一点。
还表明,加巴喷丁治疗骨关节炎(osteoarthritis)的治疗效果只有在延长施用3个月后才开始(Enteshari-Moghaddam等人,Clinical Rheumatology 2019:38,2873-2880)。
申请人已经进行研究以改善加巴喷丁的性质,目的在于改善分子对疼痛病症的活性,将功效扩展到其他疼痛综合征,并可能减少与剂量相关的副作用。
特别地,申请人已经对加巴喷丁与酮洛芬的组合,尤其是与酮洛芬赖氨酸的组合进行了研究。
式II的酮洛芬:(RS)-2-(3-苯甲酰基苯基)-丙酸为一种成熟的非甾体抗炎药(NSAID),具有镇痛和解热作用
由于其高耐受性,酮洛芬是临床上广泛使用的非甾体抗炎药之一,既可用于治疗严重的炎性病症,也可通过抑制身体产生前列腺素而用于镇痛和解热。
目前使用的含有酮洛芬的药物组合物具有作为活性成分的外消旋体,其中两种对映异构体S(+)和R(-)以等分子比存在。
目前用于口服使用的酮洛芬药物组合物可以含有游离酸形式的活性成分,然而,所述活性成分在水中的溶解度非常低,因此生物利用度低。
为了改善活性成分的溶出曲线和生物利用度,还有利地使用酮洛芬的盐。
这些盐例如用于通过口服施用治疗类风湿和慢性类型的那些病理症状(这些病理症状需要以高剂量、连续和长时间施用药物),和用于需要立即镇痛作用的疼痛表现。
特别地,尽管与游离酸相比,酮洛芬与氨基酸赖氨酸的盐呈现出平行的药学特征和相似的抗炎-镇痛效力,但其具有在水中相当高的溶解度的优点,使化合物能够快速且几乎完全吸收,确保快速起效和更高的胃耐受性。
酮洛芬通常用于关节炎相关的炎性疼痛、严重的牙痛、肌肉骨骼疼痛、神经性疼痛(如坐骨神经痛)、带状疱疹后神经痛和神经根病的牵涉痛的治疗。
酮洛芬的作用机制主要是基于抑制前列腺素、前列环素和血栓素的生物合成。
根据工艺条件,酮洛芬和赖氨酸可以结合形成盐或具有不同晶型的共晶(多晶型物),如欧洲专利申请号EP18215336.1和EP19219293.8以及国际专利申请PCT/EP2019/025464中所描述。
发明内容
申请人在这些研究中意外地发现,加巴喷丁与酮洛芬和赖氨酸形成稳定的共晶。
此外,申请人还发现新的共晶显示出令人惊讶的生物学作用。
在这方面,申请人已经观察到当加巴喷丁与酮洛芬和赖氨酸在共晶中组合时对炎症和疼痛的协同作用。
事实上,当这些活性成分在本发明的共晶中结合时,它们显示出比与酮洛芬赖氨酸组合施用的加巴喷丁更强的抗炎和镇痛活性。
此外,与单独的加巴喷丁相比,观察到疗效随时间延长。
最后,共晶提高了酮洛芬的溶解速率,尤其是如果溶解在水性生理环境中,并且提高了两种活性分子的吸收和/或生物利用度。
药物的溶解度和溶解速率是与施用后吸收速度和程度有关的决定性因素。
当与分开的活性物质加巴喷丁和酮洛芬赖氨酸的共同施用相比时,本发明的共晶酮洛芬-赖氨酸-加巴喷丁的更高功效能够允许使用较低治疗剂量的加巴喷丁或酮洛芬或两者,并且使副作用最小化。
因此,本发明的一个目的在于加巴喷丁、酮洛芬和赖氨酸的共晶,其中组分的摩尔比为1:1:1。
共晶进一步通过以下XRPD衍射峰表征:3.6、9.5、9.6、18.5和20.0度2θ±0.2度2θ,优选进一步通过以下XRPD衍射峰表征:15.4、17.8、21.0、21.8和24.2度2θ±0.2度2θ。
本发明的另一个目的在于一种用于制备本发明的共晶的方法,其包括:
a)将加巴喷丁、酮洛芬和赖氨酸混悬在合适的溶剂中,
b)将加巴喷丁、酮洛芬和赖氨酸溶解,任选地通过加热混悬液,任选地在搅拌下,直到获得澄清溶液,
c)然后冷却溶液,和
d)任选地加入反溶剂。
本发明的另一个目的在于一种药物组合物,其包含本发明的共晶和至少一种药学上可接受的赋形剂。
本发明的另一个目的在于一种药物组合物,其包含本发明的共晶和至少另一种药物活性成分。
本发明的另一个目的在于本发明的共晶,其作为药物的用途。
本发明的另一个目的在于本发明的共晶,其用于治疗疼痛和/或炎症的用途。
本发明的另一个目的在于一种用于治疗疼痛和/或炎症的方法,其包括向患者施用有效量的本发明的共晶。
定义
对于本发明的目的,术语“药学上可接受的赋形剂”是指本身没有任何药理作用并且在施用于哺乳动物(优选人)时不会产生不良反应的物质。
对于本发明的目的,术语“室温”是指18至25℃的温度范围。
对于本发明的目的,术语“共晶(co-crystal)”是指多组分系统,其中所有组分在其纯形式时在环境条件下为固体。这些组分在单晶内以分子水平共存。至少一些组分通过非共价、非离子相互作用连接。
对于本发明的目的,术语“疼痛”是指由不同性质和起源的障碍引起的疼痛,例如:头疼或头痛:原发性的,因此与其他因素或疾病无关,和继发性的,因此取决于创伤、损伤和不同的疾病;牙痛:脓肿或龋齿引起牙髓(其中血管和神经众多)疼痛;月经痛:由月经期间典型的荷尔蒙变化引起的腹部和下腹部疼痛和头疼;由于劳损、创伤和感染引起的神经痛或剧烈的神经疼痛;肌肉疼痛或肌痛:由于突然收缩或创伤,在使用或触摸肌肉时位于肌肉水平的疼痛;骨关节疼痛,如创伤、老年、劳损和损伤后的关节炎症(骨骼、软骨、韧带和肌腱部位的)。
对于本发明的目的,术语“炎症”是指有机体对细胞损伤的局部反应,其特征在于毛细血管扩张、白细胞浸润、发红、发热和疼痛,其作为启动消除有害物质和受损组织的机制。
对于本发明的目的,术语“反溶剂”是指化合物在其中不溶或几乎不溶的溶剂。
本文中的术语“约”和“大约”是指在测量中可能出现的实验误差的范围。
附图说明
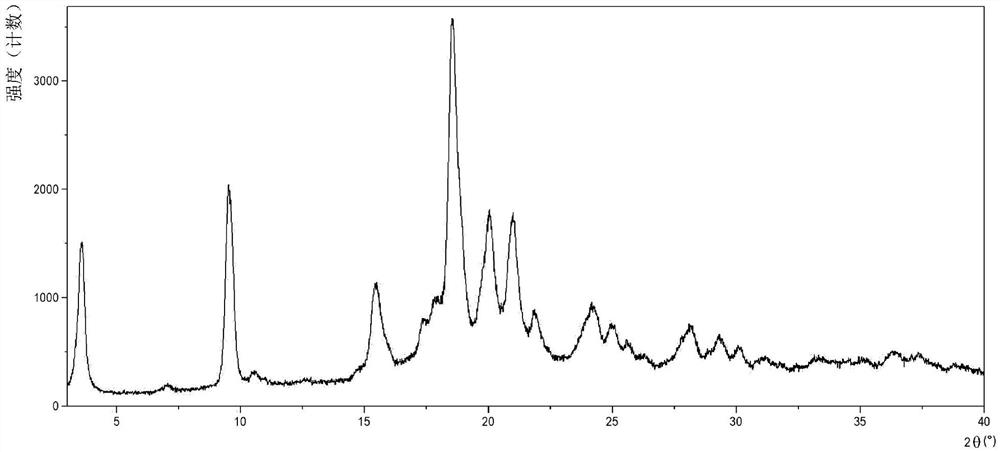
图1:酮洛芬-赖氨酸-加巴喷丁1:1:1共晶的粉末X射线衍射图。
图2:酮洛芬-赖氨酸-加巴喷丁1:1:1共晶的DSC热谱图。
图3:酮洛芬赖氨酸共晶型I(co-crystal Form I)的DSC热谱图。
图4:加巴喷丁的DSC热谱图。
图5:酮洛芬-赖氨酸-加巴喷丁1:1:1共晶的TG(实线)和dTG(虚线)热谱图。
图6:酮洛芬赖氨酸共晶型I的TG(实线)和dTG(虚线)热谱图。
图7:加巴喷丁的TG热谱图。
图8:酮洛芬-赖氨酸-加巴喷丁1:1:1共晶的
图9:酮洛芬-赖氨酸-加巴喷丁1:1:1共晶、酮洛芬、赖氨酸和加巴喷丁的
图10:图9的
图11:酮洛芬-赖氨酸-加巴喷丁1:1:1共晶、酮洛芬赖氨酸盐和酮洛芬赖氨酸共晶型I的
图12:酮洛芬-赖氨酸-加巴喷丁1:1:1共晶和酮洛芬赖氨酸共晶型I在不同pH下的溶解度。
图13:在足底内注射1%角叉菜胶然后施用酮洛芬-赖氨酸-加巴喷丁1:1:1共晶、酮洛芬赖氨酸共晶型I和加巴喷丁的1:1混合物、酮洛芬赖氨酸共晶型I、加巴喷丁、吲哚美辛或载体后,角叉菜胶诱导的大鼠爪水肿模型中爪体积(ml)相对于时间(小时)的图。每个时间点或条形(bar)表示6只(载体)/8只(药物)大鼠的平均值±SEM。P<0.05被认为具有统计学意义,通过使用双因素ANOVA和其后的Bonferroni事后检验来计算。*相对于载体,°相对于吲哚美辛,§相对于酮洛芬赖氨酸共晶型I和加巴喷丁的1:1混合物。
图14:在角叉菜胶注射后3、4和5小时,由酮洛芬-赖氨酸-加巴喷丁1:1:1共晶、酮洛芬赖氨酸共晶型I和加巴喷丁的1:1混合物、酮洛芬赖氨酸共晶型I、加巴喷丁、吲哚美辛或载体诱导的角叉菜胶诱导的大鼠爪水肿模型中爪体积抑制%的条形图(bar chart)。每个时间点或条形表示6只(载体)/8只(药物)大鼠的平均值±SEM。P<0.05被认为具有统计学意义,通过使用双因素ANOVA和其后的Bonferroni事后检验来计算。*相对于载体,°相对于吲哚美辛,§相对于酮洛芬赖氨酸共晶型I和加巴喷丁的1:1混合物。
图15:在足底内注射1%角叉菜胶后,酮洛芬-赖氨酸-加巴喷丁1:1:1共晶或酮洛芬赖氨酸共晶型I和GABA混合物相比于酮洛芬赖氨酸共晶型I、加巴喷丁、吲哚美辛或载体对大鼠缩爪应答(g)的抗炎性疼痛作用的时程图。每个时间点或条形表示6只(载体)/8只(药物)大鼠的平均值±SEM。P<0.05被认为具有统计学意义,通过使用双因素ANOVA和其后的Tukey多重比较事后检验来计算。*相对于载体,§相对于酮洛芬赖氨酸共晶型I和加巴喷丁的1:1混合物,&相对于酮洛芬赖氨酸共晶型I,°相对于吲哚美辛。
图16:在施用后1、2、3和6小时,不同剂量的本发明的酮洛芬-赖氨酸-加巴喷丁1:1:1共晶和加巴喷丁相比于载体对机械异常性疼痛的治疗作用的条形图,测量为50%缩爪阈值(g)。所有值表示各组中平均值±平均值的标准误差(SEM)。采用单因素ANOVA和其后的Dunnett检验进行组间比较。对于酮洛芬-赖氨酸-加巴喷丁1:1:1共晶,相对于加巴喷丁和相对于载体组在p<0.05水平考虑显著性。对于加巴喷丁组,相对于载体组在p<0.05水平考虑显著性。通过GraphPad Prism 5.0进行统计分析。
图17:当单独口服施用和作为酮洛芬-赖氨酸-加巴喷丁1:1:1共晶施用时,加巴喷丁的脑渗透率(脑/血浆%)。
图18:当作为加巴喷丁和酮洛芬赖氨酸共晶型I的物理混合物(MIX)或作为酮洛芬-赖氨酸-加巴喷丁1:1:1共晶施用时,脑和血浆中的加巴喷丁浓度。
图19:当作为加巴喷丁和酮洛芬赖氨酸共晶型I的物理混合物(MIX)或作为酮洛芬-赖氨酸-加巴喷丁1:1:1共晶施用时,脑和血浆中的酮洛芬浓度。
附图中的关键点:GAB加巴喷丁;KL酮洛芬赖氨酸;Co-xx共晶;MIX混合物;KL Co-xx酮洛芬赖氨酸共晶;K-L-GAB Co-xx酮洛芬赖氨酸加巴喷丁共晶;KL Co-xx-GAB MIX酮洛芬赖氨酸共晶和加巴喷丁的混合物。
具体实施方式
本发明的一个目的在于加巴喷丁、酮洛芬和赖氨酸的共晶,其中组分的摩尔比为1:1:1。
与实验部分报道的固态
本发明的共晶进一步通过以下XRPD衍射峰表征:3.6、9.5、9.6、18.5和20.0度2θ,每个峰值指示的值的误差范围为±0.2度2θ,优选进一步通过以下XRPD衍射峰表征:15.4、17.8、21.0、21.8和24.2度2θ±0.2度2θ,如图1和表2所示。
本发明的共晶的这种晶型在本文中称为晶型I。
本发明的共晶的其他多晶型物也在本发明的范围内。
本发明的共晶进一步通过图2的DSC热谱图(其中共晶的吸热尖峰对应于141.4℃的熔点和136.9℃的起始)、图5的TGA热谱图、表6和7中报告的具有典型吸收带的FT拉曼和FT-IR光谱、图8的液态
在本发明的共晶中,酮洛芬可以为外消旋的(S,R)酮洛芬、(S)-酮洛芬或(R)-酮洛芬或其任何混合物。
在一个实施方案中,酮洛芬为(S)-酮洛芬(也称为DexKetoprofen)。
在另一个实施方案中,酮洛芬为(R)-酮洛芬。
在本发明的共晶中,赖氨酸可以为外消旋的(S,R)赖氨酸、(S)赖氨酸或(R)赖氨酸,或其任意混合物,优选为天然氨基酸(S)-赖氨酸,也称为L-赖氨酸。
在一个实施方案中,本发明的共晶包含(S)-酮洛芬。
在一个实施方案中,本发明的共晶包含(S)-赖氨酸。
在一个实施方案中,本发明的共晶包含(S)-酮洛芬和(S)-赖氨酸。
本发明的共晶可以以非溶剂化形式和溶剂化形式存在,包括水合形式。
本发明的共晶容易获得且稳定。
本发明的共晶显示出改善的药物特性、药代动力学和在疼痛病症中的功效,尤其是与单独的加巴喷丁或酮洛芬相比,令人惊讶甚至与它们的混合物相比,如后面实验部分所描述。
本发明的另一个目的在于一种用于制备本发明的共晶的方法,其包括:
a)将加巴喷丁、酮洛芬和赖氨酸混悬在合适的溶剂中,
b)将加巴喷丁、酮洛芬和赖氨酸溶解,任选地通过加热混悬液,任选地在搅拌下,直到获得澄清溶液,
c)然后冷却溶液,和
d)任选地加入反溶剂。
在本方法中,酮洛芬的原料可以为酮洛芬游离酸或酮洛芬盐,优选酮洛芬赖氨酸盐,或任何酮洛芬赖氨酸共晶。在酮洛芬游离酸或不同于赖氨酸盐的酮洛芬盐的情况下,加入赖氨酸,优选以中性形式。赖氨酸优选以与酮洛芬相同的摩尔量使用。
在本方法的步骤a)中,加巴喷丁与酮洛芬的摩尔比优选为1:1至1.5:1,更优选1:1至1.2:1,甚至更优选约1:1。
在一个实施方案中,步骤a)中加巴喷丁:酮洛芬:赖氨酸的摩尔比为约1:1:1。
在本方法中,合适的溶剂为醇(优选甲醇和乙醇)、酯(优选乙酸乙酯)、醚(优选四氢呋喃和叔丁基甲基醚)或芳族溶剂(优选甲苯)。
优选地,步骤b)在溶剂回流温度下加热来进行。
优选地,将来自步骤b)的溶液在室温冷却。
优选地,将来自步骤b)的溶液在室温冷却并过滤。
优选地,通过加入反溶剂来利于共晶的沉淀。
本方法以高产率提供本发明的共晶。其简单且易于在工业水平上放大。
根据一个实施方案,在根据本发明的方法的步骤a)中,酮洛芬和赖氨酸可以作为预形成的盐或共晶以任何多晶型形式存在。
可以根据先前公开的且普通技术的有机化学家熟知的合成方法,来制备用于制造本发明的共晶的起始材料加巴喷丁、酮洛芬和酮洛芬赖氨酸盐或共晶。
例如,可以如GB1497044A和BE882889中所描述来制备酮洛芬赖氨酸盐。
例如,可以如欧洲专利申请号EP18215336.1或国际专利申请PCT/EP2019/025464中所描述来制备酮洛芬赖氨酸共晶型I。
例如,可以如EP19219293.8中所描述来制备酮洛芬赖氨酸共晶型IV。
根据替代实施方案,所述酮洛芬为游离酸和/或所述赖氨酸为中性形式。
在本制备方法中,加巴喷丁优选以其中性形式(两性离子内盐)或任何酸或碱盐形式使用,例如作为加巴喷丁盐酸盐或加巴喷丁钠盐使用。
优选地,加巴喷丁以其中性形式使用。
加巴喷丁可以为任何多晶型形式。
本发明进一步涉及一种药物组合物,其包含根据本发明的酮洛芬-赖氨酸-加巴喷丁的共晶,特别是如上定义的酮洛芬-赖氨酸-加巴喷丁的共晶和至少一种药学上可接受的赋形剂。
例如,根据本发明的组合物可以包含以重量计0.5至60%的如本文所定义的共晶和以重量计40至99.5%的一种或多种药学上可接受的赋形剂。
赋形剂的选择在很大程度上取决于以下因素,如特定的施用方式、对溶解度和稳定性的影响以及剂型的性质。
根据本发明的药物组合物可以为适合于应用至人类和/或动物,优选人类,包括婴儿、儿童和成人的任何形式,并且可以通过本领域技术人员已知的标准程序生产。
本发明的药物组合物优选为口服固体组合物,例如胶囊、丸剂、片剂、扁囊剂、咀嚼剂型、粉剂、锭剂、颗粒剂、口服可溶性颗粒、混悬剂、乳剂、喷雾剂,或用液体介质重构的干粉形式。
药物组合物可以另外包含一种或多种药学上可接受的赋形剂,如填充剂、粘合剂、助流剂、崩解剂、流动调节剂和脱模剂。
合适的赋形剂例如在"Handbook of Pharmaceutical Excipients",第3版,A.H.Kibbe出版,American Pharmaceutical Association,华盛顿,美国,和Pharmaceutical Press,伦敦中所公开。
合适的填充剂为例如乳糖(一水合物、喷雾干燥的一水合物、无水的等)、甘露糖醇、木糖醇、右旋糖、蔗糖、山梨糖醇、微晶纤维素、淀粉、磷酸氢钙二水合物和磷酸氢钙。
填充剂的量可以为相对于组合物的总重量以重量计0至80%,优选以重量计10至60%。
合适的粘合剂为例如聚乙烯吡咯烷酮、微晶纤维素、羟丙基纤维素、羟丙基甲基纤维素、甲基纤维素、羟乙基纤维素、糖、葡聚糖、玉米淀粉、明胶、聚乙二醇、天然的和合成的树胶、预胶化淀粉。
粘合剂的量可以为相对于组合物的总重量以重量计0至80%,优选以重量计10至60%。
粘合剂通常用于为片剂制剂赋予粘性。
合适的助流剂为例如脂肪酸(如硬脂酸)的碱土金属盐,如硬脂酸镁、硬脂酸钙、硬脂酸锌、硬脂富马酸钠,以及硬脂酸镁与月桂基硫酸钠的混合物。
助流剂的量可以为例如相对于组合物的总重量以重量计0至2%,优选以重量计0.5至1.5%。
合适的崩解剂为例如交联羧甲基纤维素钠、羧甲基淀粉钠、交联聚乙烯吡咯烷酮(交联聚维酮)、羧甲基乙醇酸钠、淀粉乙醇酸钠、羧甲基纤维素钠、羧甲基纤维素钙、聚乙烯吡咯烷酮、甲基纤维素、微晶纤维素、低级烷基取代的羟丙基纤维素、淀粉、预胶化淀粉、海藻酸钠和碳酸氢钠。
崩解剂的量可以为相对于组合物的总重量以重量计0至20%,优选以重量计1至15%。
合适的流动调节剂为例如胶态二氧化硅。流动调节剂的量可以为相对于组合物的总重量以重量计0至8%,优选以重量计0.1至3%。
合适的脱模剂为例如滑石。脱模剂的量可以为相对于组合物的总重量以重量计0至5%,优选以重量计0.5至3%。
可以对固体组合物进行包衣,优选薄膜包衣。
合适的包衣剂为例如纤维素衍生物、聚(甲基)丙烯酸酯、聚乙烯吡咯烷酮、聚乙酸邻苯二甲酸乙烯酯和/或虫胶或天然橡胶如角叉菜胶。
在许多情况下,将本发明的共晶作为固体递送是有利的或甚至是必要的,例如通过将固体植入物组合物装入到合适的身体组织或腔体中。
植入物可以包含生物相容性和生物可侵蚀性材料的基质,其中分散有本发明的共晶的颗粒,或者其中可能包埋本共晶的液体混合物的小球或分离的晶胞。理想地,基质将被身体分解并完全吸收。还优选选择基质的组分,以提供本发明的共晶在延长的时间内的受控释放、持续释放和/或延迟释放。
可替代地,可以将本发明的共晶配制成固体、半固体或触变液体,以作为植入的贮库施用,提供活性化合物的调节释放。这种制剂的示例包括
本发明的组合物可以局部施用于皮肤或粘膜,即皮肤、表皮、表皮下或经皮施用。
本发明的组合物可以舌下施用或经由栓剂施用。
用于此目的的典型制剂包括浇泼剂(pour-on)、点涂剂(spot-on)、浸涂剂(dip)、喷雾、摩丝、洗发剂、粉末制剂、凝胶、水凝胶、洗液、霜剂、软膏、撒粉、敷料、泡沫、薄膜、皮肤贴片、晶片、植入物、贮库、海绵、纤维、绷带、微乳剂或可溶性颗粒。还可以使用脂质体。
本发明的药物组合物可以是用于临时制备口服或肠胃外施用的溶液的固体组合物,例如通过肌肉内、腹膜内或静脉内注射施用。
可以通过本领域技术人员熟知的方法制备本发明的药物组合物。
本发明的组合物可以为立即释放、延迟释放、改良释放、持续释放、脉冲释放或控制释放类型的组合物。
根据另一个实施方案,本发明的药物组合物可以包含本发明的共晶和至少另一种药物活性成分。
其他药物活性成分将根据本发明的治疗剂的施用环境来确定。
本发明的另一个目的在于本发明的共晶,其作为药物的用途。
该医疗用途可以是治疗性的、预防性的或姑息性的。
两种活性成分在同一晶体中的结合对于本医疗用途表现出数个优点。
首先,加巴喷丁和酮洛芬赖氨酸在共晶中连接,通常表现为单一化学实体,从而有助于治疗、制剂、剂量等。
此外,两种活性成分在治疗尤其是疼痛的治疗中相互补充,也可能在各种其他疾病或症状的治疗中相互补充。
另一个优点在于将两种活性成分结合到一个独特的物种中,可以实现更好的药代动力学/药效学(PKPD),包括更好地穿透血脑屏障,这有助于治疗疼痛。
如本疼痛和炎症预测试验所示,本发明的共晶和组合物显示活性成分加巴喷丁和酮洛芬赖氨酸的协同活性。
与单独施用时共晶的各个组分相比,这种预料不到的协同作用提供了增强的临床功效,或减少了每种化合物的所需剂量,导致副作用减少,同时保持或增强化合物和治疗的临床有效性。
例如,患者可以感受到疼痛和/或炎症的频率和严重性的改善降低。此外,与用加巴喷丁或酮洛芬赖氨酸或它们的组合的治疗相比,患者可以受益于共晶治疗的更长的作用持续时间。
对于熟练的技术人员,如医生或兽医,不仅有必要确定优选的施用途径和相应的剂型和量,而且所述技术人员还必须确定给药方案。
人类和动物的日剂量可以根据各自物种的基础因素或其他因素(如年龄、性别、体重或疾病程度等)而变化。
根据本发明的共晶用于人的日剂量优选提供25至200mg,优选50至150mg,更优选50mg的量的酮洛芬酸形式,每天1至8次,优选每天1至4次,导致与单独的加巴喷丁的正常剂量相比,加巴喷丁的总量非常低。
本发明的另一个目的在于本发明的共晶,其用于治疗疼痛和/或炎症的用途。
本发明的共晶和组合物优选用于治疗疼痛,优选治疗急性或慢性疼痛和炎症,优选神经炎症。
优选地,所述疼痛选自头痛、牙痛、月经痛、肌肉痛、神经性疼痛、糖尿病、神经病变、与神经炎症相关的疼痛、癌症疼痛、骨关节炎、腰痛(low back pain)、坐骨神经痛、纤维肌痛、三叉神经痛、外科后(post-surgical)和手术后(post-operative)疼痛、带状疱疹后神经痛、类风湿性关节炎、强直性脊柱炎、肩周炎、幻肢痛或HIV疼痛。
本发明的另一个目的在于一种用于治疗疼痛和/或炎症的方法,其包括向患者施用有效量的本发明的共晶。
在下文中,描述了加巴喷丁、酮洛芬和赖氨酸的共晶的制备,其分析和生物学表征。
将如欧洲专利申请号EP18215336.1或国际专利申请PCT/EP2019/025464中所述制备的酮洛芬赖氨酸共晶型I(3.028g,1.05eq.)和加巴喷丁(1.233g,1.0eq.)溶解在60ml沸腾的甲醇中。使澄清溶液在室温冷却,精滤(0.45μm HPLC过滤器),然后在搅拌下加入到240ml的THF中。固体沉淀在约30分钟发生,将混悬液在25℃搅拌5小时(300rpm)。通过在滤纸上真空过滤来分离固体产物,用甲醇(2×3ml)洗涤,然后在氮气流下挤压约10分钟。将固体轻轻研磨,然后在40℃和30mbar干燥过夜,获得3.57克白色固体状的期望产物(产率:87%)。
使用以下仪器并在下表1中报告的条件下进行XRPD分析:
表1
图1报告了酮洛芬-赖氨酸-加巴喷丁1:1:1共晶的粉末X射线衍射图。
下表2报告了酮洛芬-赖氨酸-加巴喷丁共晶的XRPD峰列表:
表2.酮洛芬-赖氨酸-加巴喷丁共晶的XRPD峰列表
使用仪器DSC Mettler Toledo DSC1进行分析。
在用铝盖密封的铝盘中称量样品。在下表3所示的条件下,通过以10K/min的速度将样品从25℃加热到320℃来进行分析:
表3
对酮洛芬-赖氨酸-加巴喷丁共晶(图2)、酮洛芬赖氨酸共晶型I(图3)和加巴喷丁(图4)的样品进行了分析。
使用仪器Mettler Toledo TGA/DSC1进行分析。
在用铝穿孔盖密封的铝盘中称量样品。在下表4所示的条件下,通过以10°/min的速度将样品从25℃加热到320℃来进行分析:
表4
对酮洛芬-赖氨酸-加巴喷丁共晶(图5,样品10.33mg,左限113.90℃,右限211.31℃)、酮洛芬赖氨酸共晶型I(图6,样品12.32mg,左限144.51℃,右限207.29℃)和加巴喷丁(图7,样品16.67mg,左限160.49℃,右限198.27℃)的样品进行了TG分析。图5和图6显示了由样品获得的TG(实线)和dTG(虚线)热谱图。
根据本发明的酮洛芬-赖氨酸-加巴喷丁共晶1:1:1的TG分析未显示在低于熔点的温度的重量损失(参见图4)。
对酮洛芬-赖氨酸-加巴喷丁共晶样品进行了EGA分析。
图2的DSC热谱图显示了在141.4℃(起始136.9℃)时的单一吸热事件,与样品熔化和降解有关。该峰明显不同于图3中显示的加巴喷丁和酮洛芬赖氨酸共晶型I的热谱图的吸热峰。
1:1:1酮洛芬-赖氨酸-加巴喷丁共晶的TG分析证实了无水化合物的存在(图5)。
EG分析显示在逸出的气体中存在加巴喷丁和酮洛芬赖氨酸共晶型I的特征降解产物(图未显示)。
用Nicolet iS50 FT-IR光谱仪记录拉曼光谱。激发源为反向散射(180°)配置的Nd-YAG激光器(1064nm)。聚焦激光束直径为约50mm,光谱分辨率为4cm
使用配备有Smart Performer Diamond、DTGS KBr检测器、IR源、KBr分束器的Thermo Nicolet iS50-ATR模块光谱仪在下表5所示条件下进行分析:
表5
下表6报告了酮洛芬-赖氨酸-加巴喷丁共晶的拉曼光谱的峰列表:
表6:酮洛芬-赖氨酸-加巴喷丁共晶的拉曼峰列表
下表7报告了酮洛芬-赖氨酸-加巴喷丁共晶的FT-IR光谱的峰列表:
表7:酮洛芬-赖氨酸-加巴喷丁共晶的FT-IR峰列表
在Bruker Avance3 400MHz仪器上,以四甲基硅烷(TMS)作为内标,在指定溶剂中记录
用Jeol ECZR 600仪器获得酮洛芬-赖氨酸-加巴喷丁和纯加巴喷丁的固态
酮洛芬-赖氨酸-加巴喷丁共晶的
与方案1中所示的原子编号一致的信号的多重性(multiplicity)和分配在下表8中报告:
方案1
酮洛芬
赖氨酸
表8:
酮洛芬-赖氨酸-加巴喷丁共晶的
通过
酮洛芬羧基被去质子化,通过离子键与质子化赖氨酸ε-NH
在下表9中总结了特征性固态
表9:固态
图7显示酮洛芬-赖氨酸-加巴喷丁共晶和单独的起始材料,即,酮洛芬(KET)、赖氨酸(LYS)和加巴喷丁(GAB)的
酮洛芬-赖氨酸-加巴喷丁共晶的图谱中的所有信号都被相似的
在该放大的区域中,观察到三个不同的羧基/羧酸根基团(carboxylic/carboxylate group)共振,提示酮洛芬-赖氨酸-加巴喷丁系统的化学计量比为1:1:1,其中每种化合物都有一个独立的分子。
加巴喷丁在其纯II型多晶型中为两性离子:它的羧酸根基团在酮洛芬-赖氨酸-加巴喷丁中保持去质子化,向更高频率的位移极小,这表明加巴喷丁的COO
赖氨酸的两性离子羧酸根经历了从纯赖氨酸中的176.7ppm到酮洛芬-赖氨酸-加巴喷丁中的178.2ppm的位移,这可能是由于羧酸根基团参与了比起始材料中更强的氢键。赖氨酸应该是两性离子形式。
最后,以纯形式参与同型二聚体合成子的酮洛芬羧基在酮洛芬-赖氨酸-加巴喷丁中落在181.2ppm,其化学位移降低约3ppm。这强烈提示发生了从酮洛芬的COOH部分(其转变为羧酸根部分)向唯一可能的受体赖氨酸的ε-NH2的质子转移。
图11显示了本发明的酮洛芬-赖氨酸-加巴喷丁共晶、酮洛芬赖氨酸共晶(I型)和酮洛芬赖氨酸盐的羧基区域的比较。
图11的信号的比较证实了酮洛芬-赖氨酸-加巴喷丁中酮洛芬羧基部分的去质子化状态。事实上,其相应峰的化学位移与酮洛芬-赖氨酸盐中酮洛芬的羧酸根基团之一明显更相似,而不是与共晶酮洛芬-赖氨酸中酮洛芬的中性氢键合的COOH基团的信号更相似。
使用配备有Ag/AgCl双结参比pH电极、Sirius D-PAS光谱仪和浊度传感装置的SiriusT3设备(Pion Inc.Ltd.,东萨塞克斯,英国)使用自动电位滴定仪进行溶解度测定。将pH电极在pH范围1.8至12.2中通过滴定法校准。使用顶置式搅拌器,温度探针在测定过程中监测温度。在1.5ml的0.15M KCl溶液(ISA水)中在氮气氛下于25±1℃的温度进行溶解度实验。使用标准化的0.5M KOH和0.5M HCl作为滴定试剂进行所有测试。通过称量15至20mg粉末样品,以800rpm搅拌样品并自动从pH 11滴定至pH 1.5,来进行溶解度测定。
在pH 1.2(胃)、pH 4.5(十二指肠)、pH 6.5(空肠/回肠)、pH 7.4(血液)和pH 8.0(结肠)中测量酮洛芬赖氨酸共晶型I和酮洛芬-赖氨酸-加巴喷丁共晶的溶解度。样品在所有pH值中都显示出显著的溶解度差异。在高于pH 5(酮洛芬的pKa为4.08)时,溶解度显著增加,因此需要两个不同比例的图(参见图12)。1:1:1酮洛芬-赖氨酸-加巴喷丁共晶的溶解度通常比酮洛芬赖氨酸共晶型I高2.5倍。
酮洛芬赖氨酸共晶型I在pH 1.2时显示的溶解度值为0.1624±0.0016mg/ml,而酮洛芬-赖氨酸-加巴喷丁的溶解度值为0.4171±0.0312mg/ml。
下表10显示了在最具代表性的胃肠道pH值下获得的溶解度数据。
表10:不同pH下的溶解度(mg/ml)
将酮洛芬-赖氨酸-加巴喷丁的样品(约75mg)置于用PTFE/硅胶隔膜卷边的玻璃小瓶中,并在期望的温度和湿度下储存所需的时间。
通过使用盐的饱和溶液来实现受控的湿度:对于40℃和75% RH,使用NaCl,对于25℃和60% RH,使用NaBr。
储存后,通过XRPD分析对固体样品进行分析。每个稳定性测试一式两份进行。
3个月后检查样品的稳定性。
在受控的温度和湿度条件下(密封小瓶)储存三个月后,测试了酮洛芬-赖氨酸-加巴喷丁共晶的稳定性。结果,该化合物在25℃和65% RH以及40℃和75%RH的两种测试条件下都是稳定的。
将稳定性测试后收集的固体样品的XRPD图与未处理的样品的衍射图进行比较,来评估样品稳定性。
在25℃和60% RH在密封小瓶中储存3个月的酮洛芬-赖氨酸-加巴喷丁样品的衍射图表明,与未处理的起始材料相比,经储存的样品的XRPD图没有显著差异。XRPD分析的结果证实,共晶的固体状态在加速条件下储存期间保持不变。
在40℃和75% RH在密封小瓶中储存3个月的酮洛芬-赖氨酸-加巴喷丁样品的衍射图表明,与未处理的起始材料相比,经储存的样品的XRPD图没有显著差异。XRPD分析的结果证实,共晶的固体状态在加速条件下储存期间保持不变。
将雄性Wistar大鼠(270至280g)(Envigo,意大利)每笼2至3只在受控照明(12:12小时光照:黑暗周期;06:00点开灯)和标准环境条件(室温22±1℃,湿度60±10%)饲养至少1周,然后用于实验。大鼠食物和自来水可随意获得。该程序得到坎帕尼亚大学“LuigiVanvitelli”动物伦理委员会的批准。动物护理符合意大利立法法令(D.L.116/92)和欧盟委员会关于保护实验动物的指令(O.J.of E.C.L358/1,18/12/86)规定。尽一切努力使动物的痛苦和使用的动物数量最小化。
通过单次足底内注射1%λ-角叉菜胶(每只大鼠100μl,在0.9% NaCl中的溶液)在每只动物的左后爪中诱导外周炎性疼痛。
在角叉菜胶注射前1小时,口服施用载体(2粒胶囊Avicel PH101.)、吲哚美辛(10mg/kg,100μl)、酮洛芬赖氨酸共晶型I(47.1mg/kg,1粒胶囊)、加巴喷丁(20.4mg/kg,2ps)、加巴喷丁和酮洛芬赖氨酸共晶型I的混合物(47.1mg/Kg+20.4mg/Kg,2粒胶囊)和酮洛芬-赖氨酸-加巴喷丁共晶(67.5mg/Kg,2粒胶囊)。在注射角叉菜胶之前(0小时)和注射角叉菜胶之后不同的时间间隔(注射角叉菜胶后1、2、3、4、5和6小时),通过器官充满度测量器(Ugo Basile,Varese,意大利)测量动物的爪体积。水肿表示为爪体积(ml)相对于对照动物的平均增加。水肿的抑制百分比由下公式计算:
水肿的抑制%=(Vc-Vt/Vc)x100,
其中Vc为对照组的水肿体积,Vt为处理组的水肿体积。
由上述测试获得的水肿的抑制百分比显示在下表11中:
表11:水肿的抑制%
t=时间(小时)
测试化合物对角叉菜胶诱导的大鼠爪水肿的作用如图13至图15所示。
在图13中,报告了在足底内注射1%角叉菜胶后,1:1:1酮洛芬-赖氨酸-加巴喷丁共晶以及加巴喷丁和酮洛芬赖氨酸共晶型I的1:1混合物相比于酮洛芬赖氨酸共晶型I、加巴喷丁、吲哚美辛和载体对大鼠爪肿胀(以ml为单位的爪体积)的抗炎作用的时间过程。
在图14中,报告了在角叉菜胶注射后3、4和5小时,由1:1:1酮洛芬-赖氨酸-加巴喷丁共晶以及加巴喷丁和酮洛芬赖氨酸共晶型I的混合物相比于酮洛芬赖氨酸共晶型I、加巴喷丁、吲哚美辛和载体诱导的爪体积的抑制%。在图中,载体的抑制%的值为零。
图15显示了在足底内注射1%角叉菜胶后,酮洛芬-赖氨酸-加巴喷丁1:1:1共晶或酮洛芬赖氨酸共晶型I和GABA混合物相比于酮洛芬赖氨酸共晶型I、加巴喷丁、吲哚美辛或载体对大鼠缩爪应答(g)的抗炎性疼痛作用的时间过程。
在图13至图15中,每个时间点或条形代表每种载体六只大鼠和每种药物八只大鼠的平均值±SEM。P<0.05被认为具有统计学意义,通过使用双因素ANOVA和其后的Bonferroni事后检验来计算。关键点:*相对于载体,§相对于KL Co-xx-GAB MIX,&相对于酮洛芬赖氨酸共晶型I(KL Co-xx Form I),°相对于吲哚美辛。
图13至图15显示,酮洛芬赖氨酸共晶型I、加巴喷丁和酮洛芬赖氨酸共晶型I的混合物以及1:1:1酮洛芬-赖氨酸-加巴喷丁共晶均减轻角叉菜胶诱导的水肿,而加巴喷丁效果不佳。
此外,结果很明显,本发明的1:1:1酮洛芬-赖氨酸-加巴喷丁共晶的抗炎作用不仅比单一活性物质加巴喷丁和酮洛芬赖氨酸的作用更高,而出乎意料地,甚至比两种活性物质一起施用时的作用更高(协同作用)。与加巴喷丁和酮洛芬赖氨酸的混合物相比或与单独的加巴喷丁或酮洛芬赖氨酸相比,本发明的1:1:1酮洛芬-赖氨酸-加巴喷丁共晶清楚地显示出协同作用和生物利用度的增加。
还观察到本发明的酮洛芬-赖氨酸-加巴喷丁共晶在该试验中比吲哚美辛显著更有效。
最后,图13中显示本发明的酮洛芬-赖氨酸-加巴喷丁共晶的曲线更下湾,可以预测在延长的时间段内的效力,比单独给予或甚至以混合物给予的单个活性物质的效力更长。
在该项目中,受试物质由东佩制药股份公司(Dompé Farmaceutici S.p.A.)提供,加巴喷丁购买自Spectrum(Cat#G1092),载体对照组所用的大米淀粉获得自Sigma(Cat#S7260)。经由
由BioLasco Taiwan(在Charles River Laboratories Licensee下)提供重180±20g的雄性Sprague Dawley大鼠。2至3只动物的空间分配为45x25x21cm。所有动物都保持在受控的温度(20至24℃)和湿度(30%至70%)的环境中,明/暗循环为12小时。允许自由获取标准实验室饮食[MFG(Oriental Yeast Co.,Ltd.,日本)]和高压灭菌水。通常按照“Guidefor the Care and Use of Laboratory Animals:Eighth Edition”(National AcademiesPress,华盛顿特区,2011年)在我们的AAALAC认可的实验动物设施中进行这项工作的所有方面,包括饲养、实验和动物处置。此外,动物护理和使用协议在Pharmacology DiscoveryServices Taiwan,Ltd.通过IACUC审查和批准。
在第0天,在戊巴比妥钠[50mg/kg,腹膜内(IP)]麻醉下,在大腿中部水平暴露左侧坐骨神经。四条铬肠线松散地绑在神经周围,相距约1mm。然后将动物在有软垫材的笼子中集体圈养13天,之后评估机械异常性疼痛。
将大鼠置于金属丝网架上的倒置有机玻璃笼下,并使其适应20至30分钟。使用Chaplan上/下方法通过手动von Frey测试评估机械异常性疼痛阈值。在行为测试之前,给予动物20至30分钟以适应各个隔间中的金属丝网架。用一系列8根手动von Frey单丝接触爪子,所述单丝的刚度呈对数递增[3.61(0.4g)、3.84(0.6g)、4.08(1.0g)、4.31(2.0g)、4.56(4.0g)、4.74(6.0g)、4.93(8.0g)和5.18(15.0g)]。将手动von Frey单丝从网状地板下方垂直施加到中央足底表面,力度足够使其轻微弯曲抵住爪子,并保持约6至8秒。如果爪子急剧缩回,则记录为阳性反应;走动被认为是一种模棱两可的反应,在这种情况下,将重新施加刺激。按照Chaplan(1994)描述的程序,使用上/下方法评估机械阈值[50%缩爪阈值(g)]。
使用惯例(X=缩爪,O=不缩爪)将所得的阳性和阴性反应模式制成表格,使用以下公式对50%反应阈值进行插值:机械阈值=(10[Xf+kδ])/10,000,其中Xf=最后使用的von Frey丝的值(以对数为单位);k=阳性/阴性反应模式的表格的值;δ=刺激之间的平均差值(以对数单位)(在此处为0.224)。
在第-1天(手术前基线)评估所有大鼠的机械异常性疼痛的术前异常性疼痛阈值。仅当神经结扎后第13天(处理前)的疼痛阈值相对于神经结扎前(手术前)单个爪子的反应减少10g的力时,即,明显存在异常性疼痛时,才预选择大鼠用于实验。基于给药前机械异常性疼痛评分将大鼠随机分配到平衡的治疗组。通过9号明胶胶囊或在建议的制剂中口服(PO)施用化合物。在手术后第14天施用测试品、载体或参比化合物后的1、3和6小时再次评估机械异常性疼痛。
结果如图16所示。
所有值表示各组中平均值±平均值的标准误差(SEM)。应用单因素ANOVA和其后的Dunnett检验来比较载体对照组和化合物处理组。在p<0.05水平上考虑显著性。通过GraphPad Prism 5.0进行统计分析。
图16清楚地显示了本发明的共晶在给药后2和3小时的协同作用。
该研究的目的在于测定以胶囊施用至大鼠后,在KLS-加巴喷丁共晶中相比于KLS和加巴喷丁的物理混合物以及单独的加巴喷丁的加巴喷丁脑渗透。
在本研究中使用雄性Sprague Dawley大鼠(在处理时体重为310克)。这些动物最初由Harlan,意大利提供。当从供应商处收到时,使动物接受健康检查和验收。将动物三只一组饲养在适合该物种的笼子中,并常规饲养在以下环境中,除了在实验程序另有规定的短时间内。使动物适应当地饲养条件约5天。
将动物饲养在单独的、专用的房间里,通过空调提供至少15次换气/小时。环境控制设置为将温度保持在22℃,相对湿度保持在50%至60%范围内,自动控制约12小时光照和12小时黑暗循环。在整个研究过程中,食物(Mucedola Standard GLP饮食)和水可随意获得。在每次处理当天对所有动物称重。在整个研究过程中按规律间隔监测临床体征,以评估对处理的任何反应。在实验之前,每只动物都用彩色喷雾在背部进行唯一标识。
在研究结束时,在麻醉下通过放血处死动物。
按照意大利法律D.L.vo 4marzo 2014,n.26进行实验。
实验方案包括根据下表12和13对动物进行血液和脑组织采样以及如下所述的样品分析。
表12:血液采样
表13:脑组织采样
以1mg/mL在MeOH中制备酮洛芬和加巴喷丁的储备溶液,通过稀释前述两种溶液以达到每种分析物的最终浓度为100μg/mL来制备混合储备溶液。分别以2mg/mL和1mg/mL在MeOH中制备DF1681Y和加巴喷丁杂质A的储备溶液。在ACN中制备两者的混合物,最终浓度分别为5000和500ng/mL(mix IS)。
通过将2μL每种储备溶液加入到18μL血浆中,在大鼠空白血浆中制备校准曲线和QC样品。将加标血浆样品加入到200μL的mix_IS中,并在5℃以9000g离心5分钟。制备来自口服处理的样品并在空白血浆中1:10稀释,如上所述处理20μL稀释血浆。然后,将100μL提取的样品用120μL流动相A稀释。
将采集的脑在甲酸铵10mM缓冲液1g/5mL中均质化。通过将20μL脑匀浆加入到200μL的mix_IS中并在5℃以9000g离心5分钟来制备样品以及校准物和QC样品。然后,将100μL提取的样品用120μL流动相A稀释。
在施用共晶KLS-加巴喷丁和两种分析物的物理混合物的两种胶囊后,测量大鼠中酮洛芬和加巴喷丁的血浆水平。图17至图19报告了血浆和脑中的浓度。
在2小时后评估两种化合物的脑和血浆浓度,结果显示,当单独施用时,加巴喷丁的脑/血浆渗透率为37.8%,而当作为KLS-加巴喷丁共晶施用时,为56.1%(图17)。在p<0.05水平上考虑显著性。令人感兴趣的是,与KLS+加巴喷丁混合物相比,在KLS-加巴喷丁共晶中观察到的加巴喷丁和酮洛芬的脑和血浆水平在统计学上显著更高(p<0.05)(图18和图19)。
图18和图19清楚地显示了与加巴喷丁和酮洛芬赖氨酸的混合物相比,本发明的共晶的酮洛芬在脑和血浆中的浓度增加,原因在于更好的生物利用度。
