平车前、车前及混合基原车前草中药药材的指纹图谱的构建方法及其应用
文献发布时间:2023-06-19 18:34:06
技术领域
本发明涉及中药检测技术领域,特别涉及平车前、车前及混合基原车前草中药药材的指纹图谱的构建方法及其应用,具体涉及平车前中药药材的指纹图谱的构建方法,车前中药药材的指纹图谱的构建方法,混合基原车前草中药药材的指纹图谱的构建方法,平车前中药药材的不同部位的鉴别方法,车前中药药材的不同部位的鉴别方法,平车前中药药材、车前中药药材及混合基原车前草中药药材的鉴别方法,平车前中药药材、车前中药药材及混合基原车前草中药药材的质量评价方法。
背景技术
车前草为车前科植物车前Plantago asiatica L.或平车前Plantago depressaWilld.的干燥全草,其性寒,味甘,具有清热利尿通淋、祛痰、凉血、解毒等功效。车前草中主要含有大车前苷、毛蕊花糖苷、异毛蕊花糖苷、车前草苷D等苯乙醇苷类成分,含有木犀草苷、木犀草素、芹菜素等黄酮及其苷类成分,以及京尼平苷酸、桃叶珊瑚苷等环烯醚萜及其苷类成分,这些化学成分具有抗病毒、肿瘤和增强免疫力、抗氧化、神经保护等药理作用。但2020年版《中国药典》车前草含量测定项下仅对大车前苷的限度进行了规定,这个单一指标成分显然难以全面反映车前草药材的整体质量。
此外,市面上流通的车前草药材常出现车前与平车前基源混用的情况,单纯从性状上难以区分。中药特征图谱/指纹图谱是中药整体性的化学表征,在中药质量评价方面应用广泛。因此,可通过分别构建车前、平车前以及市售混用基原车前草药材的指纹图谱的共有峰模式,解决市面上车前与平车前基源混用的情况,解决其质量参差不齐的问题。然而目前所构建的车前药材的特征图谱/指纹图谱共有峰的标定和指认较少,难以区分车前、平车前以及市售混用基原车前草药材。
发明内容
基于此,本发明第一方面提供一种平车前中药药材的指纹图谱的构建方法。其技术方案如下:
一种平车前中药药材的指纹图谱的构建方法,包括以下步骤:
取平车前中药药材的全草或预设部位,粉碎后加提取溶剂进行提取处理,收集提取液,制备供试品溶液,所述预设部位为根茎、叶或穗;
取所述供试品溶液进行超高效液相色谱测定;
所述超高效液相色谱的色谱条件包括:
流动相包括流动相A和流动相B,所述流动相A包括乙腈,所述流动相B包括磷酸水溶液,梯度洗脱;
所述梯度洗脱包括以下程序:
0~2min,所述流动相A的体积分数保持10%,所述流动相B的体积分数保持90%;
2min~4min,所述流动相A的体积分数由10%升高至13%,所述流动相B的体积分数由90%降低至87%;
4min~14min,所述流动相A的体积分数保持13%,所述流动相B的体积分数保持87%;
14min~24min,所述流动相A的体积分数由13%升高至15%,所述流动相B的体积分数由87%降低至85%;
24min~25min,所述流动相A的体积分数由15%升高至17%,所述流动相B的体积分数由85%降低至83%;
25min~31min,所述流动相A的体积分数由17%升高至22%,所述流动相B的体积分数由83%降低至78%;
31min~41min,所述流动相A的体积分数由22%升高至40%,所述流动相B的体积分数由78%降低至60%;
41min~50min,所述流动相A的体积分数由40%升高至68%,所述流动相B的体积分数由60%降低至32%;
50min~53min,所述流动相A的体积分数由68%升高至88%,所述流动相B的体积分数由32%降低至12%;
53min~54min,所述流动相A的体积分数由88%降低至10%,所述流动相B的体积分数由12%升高至90%;
54min~60min,所述流动相A的体积分数保持10%,所述流动相B的体积分数保持90%。
在其中一个实施例中,所述超高效液相色谱的色谱条件还包括:
0~3min,检测波长为240nm~250nm;3min~48min,检测波长为320nm~340nm,48min~60min,检测波长为240nm~250nm。
在其中一个实施例中,所述超高效液相色谱的色谱条件还包括:柱温为28℃~32℃。
在其中一个实施例中,所述超高效液相色谱的色谱条件还包括:流速为0.25mL/min~0.35mL/min。
在其中一个实施例中,所述超高效液相色谱的色谱条件还包括:进样量为1μL~2μL。
在其中一个实施例中,所述超高效液相色谱的色谱条件还包括:以十八烷基硅烷键合硅胶为填充剂。
在其中一个实施例中,所述超高效液相色谱的色谱条件还包括:所述磷酸水溶液中磷酸的体积分数为0.05%~0.2%。
在其中一个实施例中,所述提取溶剂为甲醇水溶液。
在其中一个实施例中,每1g所述平车前中药药材的全草或预设部位对应加入40mL~60mL的所述提取溶剂。
在其中一个实施例中,所述提取处理的方法为超声处理。
在其中一个实施例中,所述甲醇水溶液中甲醇的体积分数为40%~80%。
在其中一个实施例中,所述超声处理的时间为20min~40min。
本发明第二方面提供一种车前中药药材的指纹图谱的构建方法。其技术方案如下:
一种车前中药药材的指纹图谱的构建方法,包括以下步骤:
取车前中药药材的全草或预设部位,粉碎后加提取溶剂进行提取处理,收集提取液,制备供试品溶液,所述预设部位为根茎、叶或穗;
取所述供试品溶液进行超高效液相色谱测定;
所述超高效液相色谱的色谱条件包括:
流动相包括流动相A和流动相B,所述流动相A包括乙腈,所述流动相B包括磷酸水溶液,梯度洗脱;
所述梯度洗脱包括以下程序:
0~2min,所述流动相A的体积分数保持10%,所述流动相B的体积分数保持90%;
2min~4min,所述流动相A的体积分数由10%升高至13%,所述流动相B的体积分数由90%降低至87%;
4min~14min,所述流动相A的体积分数保持13%,所述流动相B的体积分数保持87%;
14min~24min,所述流动相A的体积分数由13%升高至15%,所述流动相B的体积分数由87%降低至85%;
24min~25min,所述流动相A的体积分数由15%升高至17%,所述流动相B的体积分数由85%降低至83%;
25min~31min,所述流动相A的体积分数由17%升高至22%,所述流动相B的体积分数由83%降低至78%;
31min~41min,所述流动相A的体积分数由22%升高至40%,所述流动相B的体积分数由78%降低至60%;
41min~50min,所述流动相A的体积分数由40%升高至68%,所述流动相B的体积分数由60%降低至32%;
50min~53min,所述流动相A的体积分数由68%升高至88%,所述流动相B的体积分数由32%降低至12%;
53min~54min,所述流动相A的体积分数由88%降低至10%,所述流动相B的体积分数由12%升高至90%;
54min~60min,所述流动相A的体积分数保持10%,所述流动相B的体积分数保持90%。
在其中一个实施例中,所述超高效液相色谱的色谱条件还包括:
0~3min,检测波长为240nm~250nm;3min~48min,检测波长为320nm~340nm,48min~60min,检测波长为240nm~250nm。
在其中一个实施例中,所述超高效液相色谱的色谱条件还包括:柱温为28℃~32℃。
在其中一个实施例中,所述超高效液相色谱的色谱条件还包括:流速为0.25mL/min~0.35mL/min。
在其中一个实施例中,所述超高效液相色谱的色谱条件还包括:进样量为1μL~2μL。
在其中一个实施例中,所述超高效液相色谱的色谱条件还包括:以十八烷基硅烷键合硅胶为填充剂。
在其中一个实施例中,所述超高效液相色谱的色谱条件还包括:所述磷酸水溶液中磷酸的体积分数为0.05%~0.2%。
在其中一个实施例中,所述提取溶剂为甲醇水溶液。
在其中一个实施例中,每1g所述车前中药药材的全草或预设部位对应加入40mL~60mL的所述提取溶剂。
在其中一个实施例中,所述提取处理的方法为超声处理。
在其中一个实施例中,所述甲醇水溶液中甲醇的体积分数为40%~80%。
在其中一个实施例中,所述超声处理的时间为20min~40min。
本发明第三方面提供一种混合基原车前草中药药材的指纹图谱的构建方法,其技术方案如下:
一种混合基原车前草中药药材的指纹图谱的构建方法,包括以下步骤:
取混合基原车前草中药药材,粉碎后加提取溶剂进行提取处理,收集提取液,制备供试品溶液;
取所述供试品溶液进行超高效液相色谱测定;
所述超高效液相色谱的色谱条件包括:
流动相包括流动相A和流动相B,所述流动相A包括乙腈,所述流动相B包括磷酸水溶液,梯度洗脱;
所述梯度洗脱包括以下程序:
0~2min,所述流动相A的体积分数保持10%,所述流动相B的体积分数保持90%;
2min~4min,所述流动相A的体积分数由10%升高至13%,所述流动相B的体积分数由90%降低至87%;
4min~14min,所述流动相A的体积分数保持13%,所述流动相B的体积分数保持87%;
14min~24min,所述流动相A的体积分数由13%升高至15%,所述流动相B的体积分数由87%降低至85%;
24min~25min,所述流动相A的体积分数由15%升高至17%,所述流动相B的体积分数由85%降低至83%;
25min~31min,所述流动相A的体积分数由17%升高至22%,所述流动相B的体积分数由83%降低至78%;
31min~41min,所述流动相A的体积分数由22%升高至40%,所述流动相B的体积分数由78%降低至60%;
41min~50min,所述流动相A的体积分数由40%升高至68%,所述流动相B的体积分数由60%降低至32%;
50min~53min,所述流动相A的体积分数由68%升高至88%,所述流动相B的体积分数由32%降低至12%;
53min~54min,所述流动相A的体积分数由88%降低至10%,所述流动相B的体积分数由12%升高至90%;
54min~60min,所述流动相A的体积分数保持10%,所述流动相B的体积分数保持90%。
在其中一个实施例中,所述超高效液相色谱的色谱条件还包括:
0~3min,检测波长为240nm~250nm;3min~48min,检测波长为320nm~340nm,48min~60min,检测波长为240nm~250nm。
在其中一个实施例中,所述超高效液相色谱的色谱条件还包括:柱温为28℃~32℃。
在其中一个实施例中,所述超高效液相色谱的色谱条件还包括:流速为0.25mL/min~0.35mL/min。
在其中一个实施例中,所述超高效液相色谱的色谱条件还包括:进样量为1μL~2μL。
在其中一个实施例中,所述超高效液相色谱的色谱条件还包括:以十八烷基硅烷键合硅胶为填充剂。
在其中一个实施例中,所述超高效液相色谱的色谱条件还包括:所述磷酸水溶液中磷酸的体积分数为0.05%~0.2%。
在其中一个实施例中,所述提取溶剂为甲醇水溶液。
在其中一个实施例中,每1g所述混合基原车前草中药药材对应加入40mL~60mL的所述提取溶剂。
在其中一个实施例中,所述提取处理的方法为超声处理。
在其中一个实施例中,所述甲醇水溶液中甲醇的体积分数为40%~80%。
在其中一个实施例中,所述超声处理的时间为20min~40min。
本发明第四方面提供一种平车前中药药材的不同部位的鉴别方法,其技术方案如下:
一种平车前中药药材的不同部位的鉴别方法,包括以下步骤:
取平车前中药药材的待测部位,粉碎后加提取溶剂进行提取处理,收集提取液,制备待测样品溶液;
按照上述的色谱条件,对所述待测样品溶液进行超高效液相色谱测定,将所得色谱图与上述的预设部位的指纹图谱对应,记录相对应的特征峰以及所述特征峰的峰面积,确定所述待测部位的归属。
在其中一个实施例中,鉴别标准包括:
记毛蕊花糖苷的特征峰为峰17,以其作为参照峰,与峰17的保留时间的比值为0.943~0.950的特征峰记为峰16,与峰17的保留时间的比值为1.350~1.360的特征峰记为峰21;
若平车前中药药材的待测部位的色谱图出现与上述的根茎的指纹图谱保留时间一致的特征峰,且同时满足以下条件:a)峰16与峰17的峰面积的比值为0.006~0.029;b)峰21与峰17的峰面积的比值为0~0.009,则确定所述待测部位为根茎;
若平车前中药药材的待测部位的色谱图出现与上述的穗的指纹图谱保留时间一致的特征峰,且同时满足以下条件:a)峰16与峰17的峰面积的比值为0.001~0.004;b)峰21与峰17的峰面积的比值为0.002~0.011,则确定所述待测部位为穗;
若平车前中药药材的待测部位的色谱图出现与上述的叶的指纹图谱保留时间一致的特征峰,且同时满足以下条件:a)峰16与峰17的峰面积的比值为0.002~0.005;b)峰21与峰17的峰面积的比值为0.012~0.024,则确定所述待测部位为叶。
在其中一个实施例中,所述提取溶剂为甲醇水溶液。
在其中一个实施例中,每1g所述平车前中药药材的待测部位对应加入40mL~60mL的所述提取溶剂。
在其中一个实施例中,所述提取处理的方法为超声处理。
在其中一个实施例中,所述甲醇水溶液中甲醇的体积分数为40%~80%。
在其中一个实施例中,所述超声处理的时间为20min~40min。
本发明第五方面提供一种车前中药药材的不同部位的鉴别方法,其技术方案如下:
一种车前中药药材的不同部位的鉴别方法,包括以下步骤:
取车前中药药材的待测部位,粉碎后加提取溶剂进行提取处理,收集提取液,制备待测样品溶液;
按照上述的色谱条件,对所述待测样品溶液进行超高效液相色谱测定,将所得色谱图与上述的预设部位的指纹图谱对应,记录相对应的特征峰以及所述特征峰的峰面积,确定所述待测部位。
在其中一个实施例中,鉴别标准包括:
记车前草苷D的特征峰为峰18,以其为参照峰,与峰18的保留时间的比值为0.944~0.966的特征峰记为峰17(毛蕊花糖苷),与峰18的保留时间的比值为1.272~1.286的特征峰记为峰21;
若车前中药药材的待测部位的色谱图出现与上述的根茎的指纹图谱保留时间一致的特征峰,且同时满足以下条件:a)峰17与峰18的峰面积的比值为0~0.392;b)峰21与峰18的峰面积的比值为0.226~0.655,则确定所述待测部位为根茎;
若车前中药药材的待测部位的色谱图出现与上述的穗的指纹图谱保留时间一致的特征峰,且同时满足以下条件:a)峰17与峰18的峰面积的比值为1.119~3.312;b)峰21与峰18的峰面积的比值为0.228~1.076,则确定所述待测部位为穗;
若车前中药药材的待测部位的色谱图出现与上述的叶的指纹图谱保留时间一致的特征峰,且同时满足以下条件:a)峰17与峰18的峰面积的比值为0.091~0.671;b)峰21与峰18的峰面积的比值为0.676~5.169,则确定所述待测部位为叶。
在其中一些实施例中,所述提取溶剂为甲醇水溶液。
在其中一些实施例中,每1g所述车前中药药材的待测部位对应加入40mL~60mL的所述提取溶剂。
在其中一些实施例中,所述提取处理的方法为超声处理。
在其中一些实施例中,所述甲醇水溶液中甲醇的体积分数为40%~80%。
在其中一些实施例中,所述超声处理的时间为20min~40min。
本发明第六方面提供一种平车前中药药材、车前中药药材及混合基原车前草中药药材的鉴别方法,其技术方案如下:
一种平车前中药药材、车前中药药材及混合基原车前草中药药材的鉴别方法,包括以下步骤:
取待测中药药材,粉碎后加提取溶剂进行提取处理,收集提取液,制备待测样品溶液;
按照上述的色谱条件、或上述的色谱条件、或上述的色谱条件对所述待测样品溶液进行超高效液相色谱测定,将所得色谱图与上述的平车前中药药材的全草的指纹图谱、上述的车前中药药材的全草的指纹图谱和上述的混合基原车前草中药药材的指纹图谱对应,记录相对应的特征峰以及所述特征峰的峰面积,确定所述待测中药药材的种类。
在其中一些实施例中,鉴别标准包括:
记大车前苷的特征峰为峰11,以其为参照峰,与峰11的保留时间的比值为1.346~1.372的特征峰记为峰17(毛蕊花糖苷);
若待测中药药材的色谱图出现与上述的平车前中药药材的全草的指纹图谱保留时间一致的特征峰,且峰17与峰11的峰面积的比值为48.799~152.931,则确定所述待测中药药材为平车前中药药材的全草;
若待测中药药材的色谱图出现与上述的车前中药药材的全草的指纹图谱保留时间一致的特征峰,且峰17与峰11的峰面积的比值为0.013~0.055,则确定所述待测中药药材为车前中药药材的全草;
若待测中药药材的色谱图出现与上述的混合基原车前草中药药材的指纹图谱保留时间一致的特征峰,且峰17与峰11的峰面积的比值为0.148~2.326,则确定所述待测中药药材为混合基原车前草中药药材。
在其中一些实施例中,所述提取溶剂为甲醇水溶液。
在其中一些实施例中,每1g所述待测中药药材对应加入40mL~60mL的所述提取溶剂。
在其中一些实施例中,所述提取处理的方法为超声处理。
在其中一些实施例中,所述甲醇水溶液中甲醇的体积分数为40%~80%。
在其中一些实施例中,所述超声处理的时间为20min~40min。
本发明第七方面提供一种平车前中药药材、车前中药药材及混合基原车前草中药药材的质量评价方法,其技术方案如下:
一种平车前中药药材、车前中药药材及混合基原车前草中药药材的质量评价方法,包括以下步骤:
取一组待测中药药材,分别粉碎后加提取溶剂进行提取处理,收集提取液,制备一组待测样品溶液,一组所述待测中药药材包括待测平车前中药药材、待测车前中药药材和待测混合基原车前草中药药材中的一种或几种;
按照上述的色谱条件、或上述的色谱条件、或上述的色谱条件分别对一组所述待测样品溶液进行超高效液相色谱测定,将所得色谱图与上述的平车前中药药材的全草的指纹图谱、上述的车前中药药材的全草的指纹图谱、上述的混合基原车前草中药药材的指纹图谱对应,记录相对应的特征峰以及所述特征峰的峰面积;
根据式(1)对特征峰的峰面积数值x
C
其中,i表示车前草批次,j表示色谱峰,r表示皮尔逊相关系数,ρ为0.5;
r
在其中一些实施例中,所述提取溶剂为甲醇水溶液。
在其中一些实施例中,每1g所述待测中药药材对应加入40mL~60mL的所述提取溶剂。
在其中一些实施例中,所述提取处理的方法为超声处理。
在其中一些实施例中,所述甲醇水溶液中甲醇的体积分数为40%~80%。
在其中一些实施例中,所述超声处理的时间为20min~40min。
与传统方案相比,本发明具有以下有益效果:
本发明根据车前草不同来源所含成分差异的特点,合理控制超高效液相色谱的色谱条件,分别构建了平车前不同部位、车前不同部位及混合基原车前草药材的指纹图谱。所构建的指纹图谱,既可以用于解决车前、平车前以及市售混用基原车前草药材的区分鉴别问题,还可以用于分析车前草的质量,还可以用于明确车前草的来源。针对性更强、分析方法更客观、更全面,对全面反映车前草药材的整体质量具有指导价值。
附图说明
为了更清楚地说明本申请实施例中的技术方案、更完整地理解本申请及其有益效果,下面将对实施例描述中所需要使用的附图作简单的介绍。显而易见地,下面描述中的附图仅仅是本申请的一些实施例,对本领域技术人员来说,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1为6批平车前药材(全草)的色谱叠加图;
图2为6批平车前药材(根茎)的色谱叠加图;
图3为6批平车前药材(叶)的色谱叠加图;
图4为6批平车前药材(穗)的色谱叠加图;
图5为平车前药材的全草、根茎、叶、穗的对照指纹图谱;
图6为7批车前药材(全草)的色谱叠加图;
图7为7批车前药材(根茎)的色谱叠加图;
图8为7批车前药材(叶)的色谱叠加图;
图9为7批车前药材(穗)的色谱叠加图;
图10为车前药材的全草、根茎、叶、穗的对照指纹图谱;
图11为8批混合基原的车前草的色谱叠加图;
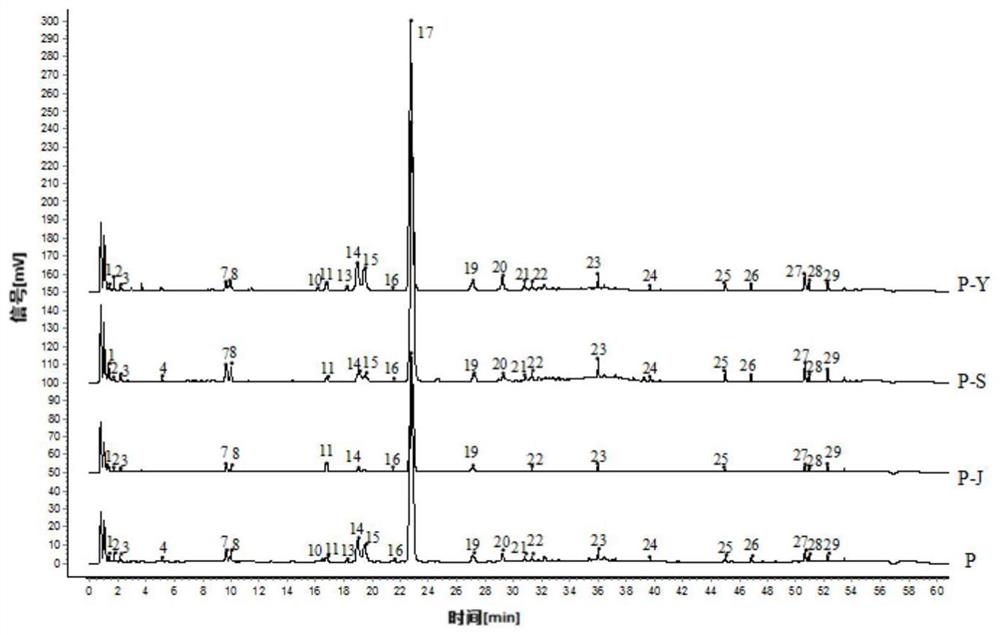
图12为平车前药材(全草)、车前药材(全草)与混合基原的车前草的对照指纹图谱;
图13为混合对照品色谱图(峰1:京尼平苷酸,峰2:1-咖啡酰奎宁酸,峰11:大车前苷,峰13:木犀草苷,峰17:毛蕊花糖苷;峰18:车前草苷D;峰19:异毛蕊花糖苷;峰20:芹菜素-7-O-葡萄糖醛酸苷;峰24:木犀草素;峰25:芹菜素);
图14为平车前药材(全草)、车前药材(全草)与混合基原的车前草PCA得分图;
图15为平车前药材(全草)、车前药材(全草)与混合基原的车前草HCA图;
图16为平车前药材(全草)、车前药材(全草)与混合基原的车前草PLS-DA图;
图17为平车前药材(全草)、车前药材(全草)与混合基原的车前草VIP值图。
具体实施方式
以下结合具体实施例对本发明作进一步详细的说明。本发明可以以许多不同的形式来实现,并不限于本文所描述的实施方式。相反地,提供这些实施方式的目的是使对本发明公开内容理解更加透彻全面。
除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。
1仪器与材料
1.1仪器
赛默飞超高效液相色谱仪(美国Waters公司);KQ-700DE型数控超声波清洗器(昆山市超声仪器有限公司);Milli-QDirect超纯水系统(默克股份有限公司);ME204E型万分之一天平(METTLERTOLEDO公司);DHG-9147A型电热恒温干燥箱(上海精宏实验设备有限公司)。
1.2材料
对照品:京尼平苷酸(批号111828-201805,质量分数,98.1%);大车前苷(批号111914-202105,质量分数≥96.0%);木犀草苷(批号111720-202111,质量分数≥96.6%);毛蕊花糖苷(批号11530-201914,质量分数≥95.2%);木犀草素(批号111520-202006,质量分数≥94.4%);芹菜素(批号111901-202004,质量分数≥99.4%)均购自中国食品药品检验研究所;1-咖啡酰奎宁酸(批号DST202101质量分数≥98%)购自乐天美医药公司;车前草苷D(批号CFS202101,质量分数≥98.0%)购自武汉天植生物技术有限公司;异毛蕊花糖苷(批号19092702,质量分数≥92.6%)购自成都格利普生物科技有限公司;芹菜素-7-O-葡萄糖醛酸苷(批号21062901,质量分数≥98.3%)购自成都普菲德生物科技有限公司。
甲醇(分析纯,天津富宇精细化工有限公司),乙腈(色谱纯,默克股份有限公司),磷酸(色谱纯,佛山西陇化学有限公司),水为超纯水(取自实验室Milli-Q超纯水系统)。
车前草药材共21批,车前草药材经广东一方制药有限公司魏梅主任药师鉴定均为车前科植物车前Plantago asiatica L.或平车前Plantago depressa Willd.的干燥全草。所收集的药材分别为6批平车前、7批车前以及8批混合基原车前草,其中车前与平车前药材继续按照根茎、穗和叶3个部位分离,得到全草、根茎、穗和叶共4个部位的样品。具体药材信息表如表1所示。
表1
2方法与结果
2.1平车前中药药材的不同部位的指纹图谱的构建方法、车前中药药材不同部位的指纹图谱的构建方法、混合基原车前草中药药材的指纹图谱的构建方法
2.1.1色谱条件
色谱柱Aglient SB C18色谱柱(2.1×100mm,1.6μm);流动相:乙腈(流动相A)-体积分数为0.1%的磷酸水溶液(流动相B),梯度洗脱:0~2min,10%(A);2~4min,10%~13%(A);4~14min,13%(A);14~24min,13%~15%(A);24~25min,15%~17%(A);25~31min,17%~22%(A);31~41min,22%~40%(A);41~50min,40%~68%(A);50~53min,68%~88%(A);53~54min,88%~10%(A);54~60min,10%(A);检测波长:0~3min,245nm;3~48min,330nm;48~60min,245nm;柱温30℃;流速0.3mL/min;进样量1μL。
2.1.2对照品溶液的制备
取京尼平苷酸、1-咖啡酰奎宁酸、大车前苷、木犀草苷、毛蕊花糖苷、车前草苷D、异毛蕊花糖苷、芹菜素-7-O-葡萄糖醛酸苷、木犀草素、芹菜素对照品适量,精密称定,加体积分数为60%的甲醇水溶液制成每1mL含京尼平苷酸24.66μg、1-咖啡酰奎宁酸17.93μg、大车前苷48.91μg、木犀草苷30.64μg、毛蕊花糖苷62.60μg、车前草苷D64.97μg、异毛蕊花糖苷41.01μg、芹菜素-7-O-葡萄糖醛酸苷43.06μg、木犀草素18.52μg、芹菜素14.23μg的混合对照品溶液,经0.22μm微孔滤膜滤过,取续滤液,即得对照品溶液。
2.1.3供试品溶液的制备
取本品粉碎成细粉(过二号筛),取1.0g,精密称定,加体积分数为60%的甲醇水溶液50mL,称定质量,超声30分钟,取出,放至室温,用体积分数为60%的甲醇水溶液补足减失质量,摇匀,滤过,取续滤液,即得供试品溶液。
2.1.4方法学考察
按“2.1.3”项下的方法制备供试品溶液,按“2.1.1”项下的色谱条件进样测定,分别考察精密度、重复性和稳定性。
结果表明,各项试验下,各特征峰的相对保留时间的RSD值<1%,各特征峰的相对峰面积RSD值<5%,表明该方法客观、准确可靠。
2.1.5指纹图谱的标定
取P1~P6批次的平车前的全草、叶、根茎、穗,按“2.1.3”项下的方法制备供试品溶液,按“2.1.1”项下的色谱条件进样测定,得到24份样品的色谱图,其中,6批平车前药材(全草)的色谱叠加图如图1所示,共标记有24个共有峰;6批平车前药材(根茎)的色谱叠加图如图2所示,共标记有16个共有峰;6批平车前药材(叶)的色谱叠加图如图3所示,共标记有23个共有峰;6批平车前药材(穗)的色谱叠加图如图4所示,共标记有22个共有峰。
平车前药材的全草、根茎、叶、穗的对照指纹图谱见图5。
取C1~C7批次的车前的全草、叶、根茎、穗,按“2.1.3”项下的方法制备供试品溶液,按“2.1.1”项下的色谱条件进样测定,得到28份样品的色谱图,其中,7批车前药材(全草)的色谱叠加图如图6所示,共标记有22个共有峰;7批车前药材(根茎)的色谱叠加图如图7所示,共标记有10个共有峰;7批车前药材(叶)的色谱叠加图如图8所示,共标记有22个共有峰;7批车前药材(穗)的色谱叠加图如图9所示,共标记有16个共有峰。
平车前药材的全草、根茎、叶、穗的对照指纹图谱见图10。
取H1~H8批次的混合基原的车前草的全草,按“2.1.3”项下的方法制备供试品溶液,按“2.1.1”项下的色谱条件进样测定,得到8份样品的色谱图,其中,8批混合基原的车前草的色谱叠加图如图11所示,共标记有23个共有峰。
平车前药材(全草)、车前药材(全草)与混合基原的车前草的对照指纹图谱见图12。
混合对照品色谱图见图13,共指认10个色谱峰,分别为峰1:京尼平苷酸,峰2:1-咖啡酰奎宁酸,峰11:大车前苷,峰13:木犀草苷,峰17:毛蕊花糖苷;峰18:车前草苷D;峰19:异毛蕊花糖苷;峰20:芹菜素-7-O-葡萄糖醛酸苷;峰24:木犀草素;峰25:芹菜素。
6批平车前(全草)相似度依次为1.000,0.995,0.997,0.989,0.992,0.998;6批平车前(根茎)相似度依次为1.000,0.990,0.990,0.985,0.993,0.991;6批平车前(叶)相似度依次为1.000,0.993,0.996,0.995,0.994,0.995;6批平车前(穗)相似度依次为1.000,0.985,0.997,0.996,0.996,0.998。7批车前(全草)相似度依次为1.000,0.993,0.997,0.991,0.972,0.965,0.968;7批车前(根茎)相似度依次为1.000,0.982,0.998,0.995,0.977,0.986,0.978;7批车前(叶)相似度依次为1.000,0.998,0.994,0.993,0.918,0.913,0.988;7批车前(穗)相似度依次为1.000,0.906,0.980,0.963,0.922,0.998,0.915。8批混批基原的车前草(全草)的相似度依次为1.000,0.867,0.941,0.961,0.910,0.859,0.926,0.930。其中不同基原不同药用部位批次间的相似度结果均>0.91,表明6批平车前、7批车前药材各药用部位批次间的各化学成分稳定,而混批基原车前草药材批次间有两批的相似度为0.867、0.859,为<0.9,表明混批基原车前草各批次间存在一定的差异,推测可能与药材的来源比例有关。
2.2平车前中药药材的不同部位的鉴别方法、车前中药药材的不同部位的鉴别方法
2.2.1平车前不同部位峰面积方差分析
将“2.1.5”项下P1~P6批次的平车前的全草、叶、根茎、穗的24份样品的色谱图的峰面积经数据处理后分别导入SPSS25.0进行单因素ANOVA方差分析,根据方差齐性检验的结果,大部分色谱峰峰面积方差齐性,将这部分方差齐性的色谱峰峰面积采用Bonferroni进行多重比较显著性分析,少数方差不齐的采用Tamhane T2进行非参数的多重比较分析。6批平车前不同部位指纹图谱峰面积方差分析(单位:mAU*min)的结果如表2所示,由表2可知,6批平车前药材中峰4、峰5、峰11(大车前苷)、峰16、峰18(车前草苷D)主要来源于根茎部位,峰1(京尼平苷酸)、峰3、峰7、峰8、峰9、峰22、峰23、峰25(芹菜素)、峰26、峰27、峰29主要来源于穗部位,峰2(1-咖啡酰奎宁酸)、峰10、峰13(木犀草苷)、峰14、峰15、峰17(毛蕊花糖苷)、峰19(异毛蕊花糖苷)、峰20(芹菜素-7-O-葡萄糖醛酸苷)、峰21、峰24(木犀草素)、峰28主要来源于叶部位,峰6、峰12在平车前各部位中基本无检出。各部位峰面积显著性结果表明,以下色谱峰峰面积在不同部位中的差异具有统计学意义(P<0.05),其中峰1穗>茎,峰2叶、全草>茎>穗,峰3穗>茎,峰7穗>全草>茎>叶,峰8穗>全草>茎,峰9穗>茎,峰14叶、全草>穗>茎,峰23穗>茎。
表2
注:不同部位间的显著性用a代表全草,b代表茎,c代表穗,d代表叶
2.2.2车前不同部位峰面积方差分析
将“2.1.5”项下C1~C7批次的车前的全草、叶、根茎、穗的28份样品的色谱图的峰面积经数据处理后分别导入SPSS25.0进行单因素ANOVA方差分析,根据方差齐性检验的结果,大部分色谱峰峰面积方差齐性,将这部分方差齐性的色谱峰峰面积采用Bonferroni进行多重比较显著性分析,少数方差不齐的采用Tamhane T2进行非参数的多重比较分析。7批车前不同部位指纹图谱峰面积方差分析(单位:mAU*min)的结果如表3所示,由表3可知,7批车前药材中峰7、峰13(木犀草苷)主要来源于茎部位,峰1(京尼平苷酸)、峰8、峰17(毛蕊花糖苷)、峰22、峰26、峰29主要来源于穗部位,峰2(1-咖啡酰奎宁酸)、峰3、峰4、峰5、峰6、峰9、峰10、峰11(大车前苷)、峰12、峰14、峰15、峰16、峰18(车前草苷D)、峰19(异毛蕊花糖苷)、峰20(芹菜素-7-O-葡萄糖醛酸苷)、峰21、峰23、峰24(木犀草素)、峰25(芹菜素)、峰27、峰28主要来源于叶部位。各部位峰面积显著性结果表明,以下色谱峰峰面积在不同部位中的差异具有统计学意义(P<0.05),其中峰2叶>穗>茎,峰3叶>茎(茎中检测不到),峰5、峰6叶、穗、全草>茎,峰7叶、全草>茎,峰11、峰16叶>穗、茎,峰17穗>叶>茎,峰23穗>茎。
表3
注:不同部位间的显著性用a代表全草,b代表茎,c代表穗,d代表叶
2.2.3平车前与车前不同部位的峰面积独立样本t检验
将“2.1.5”项下P1~P6批次的平车前的全草、叶、根茎、穗的24份样品的色谱图的峰面积和“2.1.5”项下C1~C7批次的车前的全草、叶、根茎、穗的28份样品的色谱图的峰面积经数据处理后分别导入SPSS25.0进行独立样本t检验,经正态性检验后,计算得到显著性的结果。平车前与车前不同部位的峰面积独立样本t检验(单位:mAU*min)的结果如表4所示,由表4可知,峰1(京尼平苷酸)的峰面积在平车前与车前中无统计学差异(P>0.05);峰2(1-咖啡酰奎宁酸)的峰面积在平车前茎、穗中均低于车前(P<0.05);峰3的峰面积在平车前全草、茎、穗、叶中均高于车前(P<0.05);峰4的峰面积在平车前穗中高于车前(P<0.05);峰5的峰面积在平车前全草、茎、穗、叶中均低于车前(P<0.05);峰7、峰8的峰面积在平车前全草、茎、穗、叶中均高于车前(P<0.05);峰9的峰面积在平车前全草、茎、叶中均低于车前(P<0.05);峰11(大车前苷)的峰面积在平车前全草、茎、穗、叶中均低于车前(P<0.05);峰14的峰面积在平车前全草、茎、叶中均高于车前(P<0.05);峰15的峰面积在平车前全草、茎中均高于车前(P<0.05);峰16、峰18(车前草苷D)的峰面积在平车前全草、穗、茎中均低于车前(P<0.05);峰17(毛蕊花糖苷)的峰面积在平车前全草、茎、叶中均高于车前(P<0.05);峰19(异毛蕊花糖苷)的峰面积在平车前茎、穗、叶中均高于车前(P<0.05);峰21的峰面积在平车前茎、叶中均低于车前(P<0.05);峰22的峰面积在平车前全草、穗、叶中均高于车前(P<0.05);峰23、峰29的峰面积在平车前全草、茎、穗、叶中均高于车前(P<0.05)。其中,峰6、峰12平车前中基本测不出,主要存在于车前中。
表4
注:车前与平车前不同部位间的显著性“*”,其中“*”表示显著性P<0.01,“**”表示显著性P<0.001
2.2.4鉴别标准
结合平车前中药药材的不同部位的指纹图谱,结合上述平车前中药药材的不同部位的峰面积的方差分析和独立样品t检验,结合平车前中药药材的不同部位的相对峰面积,得出:
平车前中药药材的不同部位的鉴别标准可以为:
记毛蕊花糖苷的特征峰为峰17,以其作为参照峰,与峰17的保留时间的比值为0.943~0.950的特征峰记为峰16,与峰17的保留时间的比值为1.350~1.360的特征峰记为峰21;
若平车前中药药材的待测部位的色谱图出现与上述的根茎的指纹图谱保留时间一致的特征峰,且同时满足以下条件:a)峰16与峰17的峰面积的比值为0.006~0.029;b)峰21与峰17的峰面积的比值为0~0.009,则确定所述待测部位为根茎;
若平车前中药药材的待测部位的色谱图出现与上述的穗的指纹图谱保留时间一致的特征峰,且同时满足以下条件:a)峰16与峰17的峰面积的比值为0.001~0.004;b)峰21与峰17的峰面积的比值为0.002~0.011,则确定所述待测部位为穗;
若平车前中药药材的待测部位的色谱图出现与上述的叶的指纹图谱保留时间一致的特征峰,且同时满足以下条件:a)峰16与峰17的峰面积的比值为0.002~0.005;b)峰21与峰17的峰面积的比值为0.012~0.024,则确定所述待测部位为叶。
结合车前中药药材的不同部位的指纹图谱,结合上述车前中药药材的不同部位的峰面积的方差分析和独立样品t检验,结合车前中药药材的不同部位的相对峰面积,得出:
车前中药药材的不同部位的鉴别标准可以为:
记车前草苷D的特征峰为峰18,以其为参照峰,与峰18的保留时间的比值为0.944~0.966的特征峰记为峰17(毛蕊花糖苷),与峰18的保留时间的比值为1.272~1.286的特征峰记为峰21;
若车前中药药材的待测部位的色谱图出现与上述的根茎的指纹图谱保留时间一致的特征峰,且同时满足以下条件:a)峰17与峰18的峰面积的比值为0~0.392;b)峰21与峰18的峰面积的比值为0.226~0.655,则确定所述待测部位为根茎;
若车前中药药材的待测部位的色谱图出现与上述的穗的指纹图谱保留时间一致的特征峰,且同时满足以下条件:a)峰17与峰18的峰面积的比值为1.119~3.312;b)峰21与峰18的峰面积的比值为0.228~1.076,则确定所述待测部位为穗;
若车前中药药材的待测部位的色谱图出现与上述的叶的指纹图谱保留时间一致的特征峰,且同时满足以下条件:a)峰17与峰18的峰面积的比值为0.091~0.671;b)峰21与峰18的峰面积的比值为0.676~5.169,则确定所述待测部位为叶。
2.3平车前中药药材、车前中药药材及混合基原车前草中药药材的鉴别方法
2.3.1平车前、车前、混合基原车前草峰面积方差分析
将“2.1.5”项下P1~P6批次的平车前的全草的6份样品的色谱图的峰面积、C1~C7批次的车前的全草的7份样品的色谱图的峰面积、H1~H8批次的混合基原的车前草的全草的8份样品的色谱图的峰面积经数据处理后分别导入SPSS25.0进行单因素ANOVA方差分析,根据方差齐性检验的结果,大部分色谱峰峰面积方差齐性,将这部分方差齐性的色谱峰峰面积采用Bonferroni进行多重比较显著性分析,少数方差不齐的采用Tamhane T2进行非参数的多重比较分析。6批平车前的全草、7批车前的全草和8混合基原的车前草的全草的指纹图谱峰面积方差分析(单位:mAU*min)的结果如表5所示,由表5可知,按照峰面积值差异具有统计学意义的色谱峰对不同来源的车前草药材进行排序,主要分为以下四类:第一类,峰5、峰9、峰11(大车前苷)、峰16,车前>基原混用车前草>平车前;第二类,峰7、峰14、峰17(毛蕊花糖苷)、峰19(异毛蕊花糖苷)、峰22、峰23、峰27,平车前>混批>车前;第三类,峰6、峰12,车前>混批>平车前(未检出);第四类,峰8,平车前>混批>车前(未检出)。此外,峰3为平车前与车前的显著性差异峰,因次以上15个峰可作为车前、平车前与混批使用药材的重要鉴别特征峰。
表5
注:不同药材的显著性用e代表平车前,f代表车前,g代表混批
2.3.2平车前中药药材、车前中药药材及混合基原车前草中药药材的指纹图谱化学模式识别研究
2.3.2.1平车前、车前与混批基原车前草主成分分析(PCA)
将“2.1.5”项下P1~P6批次的平车前的全草的6份样品的色谱图的峰面积、C1~C7批次的车前的全草的7份样品的色谱图的峰面积、H1~H8批次的混合基原的车前草的全草的8份样品的色谱图的峰面积数据经标准化处理后导入SIMCA14.0,进行主成分分析,得到的主成分得分图如图14所示,以特征值>1共提取了5个主成分,累计方差贡献率为84.9%,可反映出21批次车前草中整体的信息。
2.3.2.2平车前、车前与混批基原车前草聚类分析(HCA)
“2.1.5”项下P1~P6批次的平车前的全草的6份样品、C1~C7批次的车前的全草的7份样品、H1~H8批次的混合基原的车前草的全草的8份样品的聚类分析图如图15所示,显示:6批次的平车前明显聚为一类,有4批次的车前明显聚为一类,其余的车前与混批基原的车前草聚为一类,由此可知混批基原的车前草药材的整体质量与车前较相近。
2.3.2.3平车前、车前与混批基原车前草偏最小二乘回归分析(PLS-DA)
将“2.1.5”项下P1~P6批次的平车前的全草的6份样品的色谱图的峰面积、C1~C7批次的车前的全草的7份样品的色谱图的峰面积、H1~H8批次的混合基原的车前草的全草的8份样品的色谱图的峰面积经数据处理后分别导入SIMCA进行PLS-DA分析,对21批样品按已知的类别进行主观的分类,见图16,由图可知,样品可明显地分为3类。其中R2Y达到0.924,表示模型拟合程度好,Q2达到0.72,表示该模型预测能力较强。进一步对模型中29个变量的投影重要度(VIP)进行分析,结果见图17。选择VIP值大于1的变量作为平车前、车前与混批车前草样品分类的重要质量指标,共提取了15个重要的特征性指标,与三者的方差分析结果一致,重要程度排名依次为峰3、峰8、峰28、峰12、峰14、峰7、峰5、峰17、峰6、峰19、峰23、峰11、峰22、峰27、峰9、峰16。
2.3.3鉴别标准
结合平车前、车前和混合基原车前草中药药材的指纹图谱,结合上述平车前、车前和混合基原车前草中药药材的峰面积的方差分析、化学模式识别研究,结合平车前、车前和混合基原车前草中药药材的相对峰面积,得出:
不同来源的车前草药材的鉴别标准可以为:
记大车前苷的特征峰为峰11,以其为参照峰,与峰11的保留时间的比值为1.346~1.372的特征峰记为峰17(毛蕊花糖苷);
若待测中药药材的色谱图出现与上述的平车前中药药材的全草的指纹图谱保留时间一致的特征峰,且峰17与峰11的峰面积的比值为48.799~152.931,则确定所述待测中药药材为平车前中药药材的全草;
若待测中药药材的色谱图出现与上述的车前中药药材的全草的指纹图谱保留时间一致的特征峰,且峰17与峰11的峰面积的比值为0.013~0.055,则确定所述待测中药药材为车前中药药材的全草;
若待测中药药材的色谱图出现与上述的混合基原车前草中药药材的指纹图谱保留时间一致的特征峰,且峰17与峰11的峰面积的比值为0.148~2.326,则确定所述待测中药药材为混合基原车前草中药药材。
2.4平车前中药药材、车前中药药材及混合基原车前草中药药材的质量评价方法
2.4.1 CRITIC法
CRITIC法是一种客观赋权法,依据层间相关性的重要性准则来计算权重。适用于所分析的指标间有关联性的数据。结合了数据波动性与数据间相关性对权重的影响,以波动性(为数据标准差)与指标间冲突性为基础,确定指标权重,其中,波动性取数据标准差,指标间冲突性则以指标间的相关性来阐述,若两个指标间为较强的正相关,则说明两个指标冲突性较低,其权重步骤如下:
2.4.1.1数据同向化
获得“2.1.5”项下P1~P6批次、C1~C7批次、H1~H8批次共21批次(代表m个评价对象)车前草中29个色谱峰(代表n个评价指标)的峰面积数值x
正向指标
负向指标
2.5.1.2计算波动性与冲突性
对数值矩阵R
将特征峰的峰面积数值x
2.5.1.3计算信息量与权重
通过公式(4)得到两者相关联后的信息量C
通过公式(5)得到21批次车前草药材29个指标的权重系数W
C
表6
2.5.2基于CRITIC法灰色关联度综合评价药材质量
2.5.2.1最优序列选择
由于21批次车前草的评价指标(29个色谱峰)之间的量纲不一致,对评价指标进行原始特征峰的峰面积数值的均值化处理,即得无量纲化后的单元序列x’
2.5.2.2计算关联系数
参考公式(7),计算关联系数,结果见表7。其中ρ为分辨系数,ρ越小,则分辨力越大,一般ρ的取值区间为[0,1],当ρ≤0.5463时,分辨力最好,通常取ρ=0.5。
参考公式(8),计算关联度,可知29个指标峰对应的关联度为0.41、0.68、0.63、0.73、0.74、0.72、0.61、0.47、0.51、0.46、0.24、0.34、0.49、0.44、0.39、0.58、0.24、0.58、0.43、0.49、0.57、0.46、0.47、0.43、0.55、0.48、0.65、0.51、0.64。
表7(%)
2.5.2.3基于CRITIC法灰色关联度综合评价
由CRITIC法计算所得的各指标的权重系数W
表8
本发明构建了车前草药材不同基原的指纹图谱,根据车前草不同来源所含成分存在差异的特点,可用于对车前草药材的来源组成进行真伪鉴别。
本发明通过进行了方差分析和独立样本T检验的比较分析,以及进行化学识别模式(PCA、HCA以及PLS-DA)分析,针对平车前的不同部位的鉴别、车前的不同部位的鉴别以及平车前、车前及混合基原车前草的鉴别,分别筛选出了各自鉴别模型的鉴别指标及重要程度排序,可以用于这些中情况的分析鉴别工作。
本发明采用CRITIC法进行指纹图谱中各指标成分的客观赋权,确定各分析样品的指标权重值,并结合灰色关联度进行三种来源车前草药材的整体的质量评价。所建立的基于CRITIC法与灰色关联度的质量方法,可用于多批次不同来源车前草药材的质量差异的排序与评估。
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 车前草药材UPLC特征图谱的构建方法和检测方法
- 车前草药材UPLC特征图谱的构建方法和检测方法
