用于防治动脉粥样硬化及斑块不稳定性的化合物及其应用
文献发布时间:2023-06-19 18:34:06
技术领域
本发明涉及一种化合物的用途,尤其是涉及一种化合物,其具有预防和治疗动脉粥样硬化的作用,及其在制药和含药医疗器械中的应用。
背景技术
动脉粥样硬化(atherosclerosis,AS)是指动脉内膜有脂质等血液成分的沉积、平滑肌细胞增生和胶原纤维增多,形成粥糜样含脂坏死病灶和血管壁硬化。动脉粥样硬化的形成过程包括3个步骤:1.单核/巨噬细胞、平滑肌细胞的增生;2.平滑肌细胞合成和分泌结缔组织成分,包括弹性纤维蛋白、胶原纤维蛋白和蛋白多糖;3.单核/巨噬细胞吞噬脂质(主要是游离胆固醇和胆固醇酯)并积聚于纤维膜下形成脂质核心(Circulationresearch.2018;123:1118-1120)。
其中单核/巨噬细胞在动脉粥样硬化的形成、发展及脂质核心的扩大、导致斑块纤维膜薄弱并增加斑块不稳定性等机制上具有举足轻重的影响作用。金属蛋白酶fmatrixmetalloproteinase,MMPs)是巨噬细胞所释放,在动脉粥样硬化初期介导动脉内皮损伤,导致脂质沉积,平滑肌细胞增生;在病变过程中,巨噬细胞所释放MMPs导致动脉粥样斑块纤维帽薄弱,进而在血流及外力冲击下破裂,导致急性血栓形成发生脏器梗死。MMPs基本结构至少包括:前肽、信号肽和催化区这三个结构。在锌离子主要在催化区结构域,是区别其他蛋白酶的重要结构域。根据结构和底物特异性的不同可将MMPs分为5类:间质胶原酶(主要为MMP1、MMP8和MMP13等),明胶酶(主要为MMP2和MMP9),基质分解素(主要为MMP3、MMP7和MMP10),膜性金属蛋白酶类(主要为MT-MMPs)以及未分类。其中明胶酶MMP9在动脉粥样硬化的病理变化中的作用最为显著(Advances in pharmacology(San Diego,Calif).2018;81:241-330)
MMP9在动脉粥样硬化疾病的进展中的作用主要包括以下2方面:MMP9可降解细胞外基质、损伤血管内皮、使血管通透性增加进而导致低密度脂蛋白样颗粒沉积在内皮下间隙生成氧化型低密度脂蛋白,被巨噬细胞吞噬从而形成泡沫细胞,而且MMP9引起血管舒缩反应异常和单核淋巴细胞迁入动脉内膜,单核细胞进入血管内膜成为巨噬细胞有利于AS的形成。此外,近来认为动脉硬化斑块不稳定性与MMP9的增加,炎症反应和免疫机制密切相关。不稳定斑块的特征主要是纤维帽较薄、平滑肌细胞较少、炎性细胞多、脂类核心较大、斑块内细胞凋亡增加、钙化和基质重塑等。当外力作用于粥样斑块时,主要由斑块的纤维帽承担,而纤维帽的完整性及稳定性则由细胞外基质来维持,细胞外基质包括胶原纤维、糖多蛋白、弹性蛋白等组成,其中最主要的成分是胶原纤维,其主要由平滑肌细胞分泌合成、MMPs降解,维持动态平衡(Postepy higieny i medycyny doswiadczalnej(Online).2011;65:16-27)。而当MMPs功能亢进,则纤维帽出现易损性,在外部压力冲击下容易破裂进而产生急性冠脉综合症(acute coronary syndrome,ACS)。大量研究发现,不稳定斑块中MMPs活性及含量显著升高,其中以MMP9阳性表达最显著,而相反在稳定斑块中,MMP9的表达则较低,而正常血管内皮中无MMP9的表达(Heart,lung&circulation.2013;22:399-411;Currentmolecular medicine.2013;13:1299-313;Stroke.2006;37:1923-32)
针对巨噬细胞分泌MMP9加重动脉粥样硬化及斑块不稳定性的病理过程的调控,目前越来越多的研究把焦点聚集在了半乳糖凝集素3(Galectin-3,Gal-3)上。Gal-3是β-半乳糖凝集素超家族的成员,含有一个连接到富含脯氨酸和甘氨酸的糖基识别结构域,参与细胞黏附、增殖、凋亡、免疫反应等多种病理生理过程。目前研究表明,ACS较稳定性冠心病患者伴随有Gal-3及MMP9表达水平升高,在ACS患者中,若接受PCI或药物有效治疗后,相关指标将显著改善。Manohar C.Dange等的研究则发现在机体中,Gal-3通过溶酶体相关膜蛋白1激活MAPK通路,进而发挥转录活性促进MMP9表达。目前普遍认为,在AS的过程中,Gal-3是参与MAPK-MMP9途径调控巨噬细胞功能及施放MMP9的关键分子。然而目前Gal-3如何参与MAPK-MMP9途径调控巨噬细胞功能及MMP9施放,即参与AS发生发展及影响AS斑块稳定性的机制研究仍处于起始阶段(Journal of the American College of Cardiology.2019;73:795-806;Molecular and cellular biochemistry.2020;464:143-152;BMCcardiovascular disorders.2013;13:91;Molecular and cellular biochemistry.2015;404:79-86)。而在AS病理条件为背景下的针对Gal-3相关生物活性靶点设计筛选的高选择性、高特异性的干预药物、抑制剂仍无相关报道。因此,本发明将以抑制Gal-3功能为基准,研制针对Gal-3生物活性区域设计的高选择性小分子抑制剂,以达到抑制AS病情发展,稳定AS斑块的生物学目的。
发明内容
本发明的一个目的在于提供一种化合物,作为抑制剂在结合半乳糖凝集素-3(Gal-3)的功能基团进而阻断其所介导的Gal-3-MAPK-MMP9通路中的应用。
本发明的另一个目的在于提供一种化合物,作为抑制剂抑制巨噬细胞迁移和趋化作用。
本发明的再一个目的在于提供一种化合物,用于改善动脉粥样硬化及斑块不稳定性,在制备治疗动脉粥样硬化的药物中的应用。
本发明的又一个目的在于提供一种化合物在制备含药医疗器械中的应用。
一种如下式所示的化合物,其作为化学试剂,与半乳糖凝集素-3(Gal-3)的功能基团结合,以研究阻断Gal-3-MAPK-MMP9通路所产生的生物学效应。
一种实验用抑制剂,包括如下式所示的化合物:
本发明所示的化合物,具有改善动脉粥样硬化及斑块不稳定性的作用,并具有高度特异性,不干涉非相关通路,可用于预防和治疗动脉粥样硬化。
将本发明所示的化合物与其它辅料相混合,制成预防和治疗动脉粥样硬化的药物。
这些药用辅料既可以是各种制剂中常规使用的,如:但不仅限于等渗剂、缓冲液、矫味剂、赋形剂、填充剂、粘合剂、崩解剂和润滑剂等;也可以是为了与所述物质相适应而选择使用的,如:乳化剂、增溶剂、抑菌剂、止痛剂和抗氧剂等,这类辅料能有效提高组合物所含化合物的稳定性和溶解性或改变化合物的释放速率和吸收速率等,从而改善各种化合物在生物体内的代谢,进而增强组合物的给药效果。
在水溶液注射剂中,辅料一般包括等渗剂和缓冲液,以及必要的乳化剂(如:Tweeen-80、Pluronic和Poloxamer等)、增溶剂和抑菌剂等。此外,还包括含有药学上可接受的其它药用辅料,如:抗氧剂、pH调节剂和止痛剂等。
用于制取口服液体制剂的辅料一般包括溶剂,以及必要的矫味剂、抑菌剂、乳化剂和着色剂等。
用于制取片剂的辅料一般包括填充剂(如:淀粉、糖粉、糊精、乳糖、可压性淀粉、微晶纤维素、硫酸钙、磷酸氢钙和甘露醇等)、粘合剂(如:乙醇、淀粉浆、羧甲基纤维素钠、羟丙基纤维素、甲基纤维素、乙基纤维素、羟丙基甲基纤维素、明胶溶液、蔗糖溶液和聚乙烯吡咯烷酮的水溶液或醇溶液等)、崩解剂(如:干淀粉、羧甲基淀粉钠、低取代羟丙基纤维素、交联聚乙烯吡咯烷酮和交联羧甲基纤维素钠)和润滑剂(如:硬脂酸镁、微粉硅胶、滑石粉、氢化植物油、聚乙二醇4,000、聚乙二醇6,000和月桂醇硫酸镁等)等。
用于制取乳剂的辅料一般为水、油(如:脂肪酸)、乳化剂,以及必要的防腐剂和矫味剂等。
用于制取颗粒剂的辅料与片剂类似,但造粒过程不同。根据需要,将制得的颗粒剂与助流剂混合后装入胶囊即得胶囊剂。
各种辅料与化合物制成有利于给药(drug delivery)的剂型,如:但不仅限于水溶液注射剂、粉针剂、丸剂、散剂、片剂、贴剂、栓剂、乳剂、霜剂、凝胶剂、颗粒剂、胶囊剂、气雾剂、喷雾剂、粉雾剂、缓释剂和控释剂等。此外,还可以为实现特定的给药目的或方式,如:缓释给药、控释给药和脉冲给药等,而使用的辅料,如:但不仅限于明胶、白蛋白、壳聚糖、聚醚和聚酯类高分子材料,如:但不仅限于,聚乙二醇、聚氨酯、聚碳酸酯及其共聚物等。所称的“有利于给药”的主要表现有:但不仅限于提高治疗效果、提高生物利用度、降低毒副作用和提高患者顺应性等。
将本发明所示的化合物与其它辅料相结合,比如:化学偶联,以进一步改善化合物的药效,降低毒作用和延长给药周期等。这些辅料通常是聚合物,比如:聚酯、聚醚和聚酰胺等。
将药物和医疗器械相结合制成的含药医疗器械也已经较为常见,比如:含止血剂的敷料。本申请的化合物还作为活性成分装载或涂覆于支架材料上,用于制成预防和治疗动脉粥样硬化的医疗器械。常见的支架材料如:PLA、PLGA和金属等。
在动脉粥样硬化疾病模型小鼠中,巨噬细胞MAPK通路显著激活,斑块局部及外周血MMP9水平显著升高,而该通路的激活趋势可通过本发明的化合物(y041-2662)通过阻断内源性及外源性Gal-3生物学作用来得到抑制,同样动脉粥样斑块中巨噬细胞的标志物CD68的表达在y041-2662的作用下得到有效调控,即说明动脉粥样斑块中,巨噬细胞的趋化作用显著减弱。这说明y041-2662能直接通过结合过程中核心分子半乳糖凝集素-3(Gal-3)的功能基团进而阻断其所介导的核心通路Gal-3-MAPK-MMP9激活达到改善动脉粥样硬化。
因此,本发明的化合物能特异性地减轻动脉粥样硬化病情的发生及发展并稳定动脉粥样板块纤维帽,具有更强的、高特异性的针对Gal-3的调控作用,并且不干涉非相关通路,较传统药物的适用性更为广泛,同时填补了目前对于动脉粥样硬化斑块纤维帽不稳定的对因治疗仍然是空白的现状。
附图说明
图1为主动脉大体标本经油红染色评估动脉粥样硬化病变严重程度结果图;
图2为以油红染色评估主动脉粥样硬化病变严重程度结果统计图,其中,“***”表示p<0.001;
图3为升主动脉瓣膜区域标本经油红染色评估动脉粥样硬化病变严重结果图;
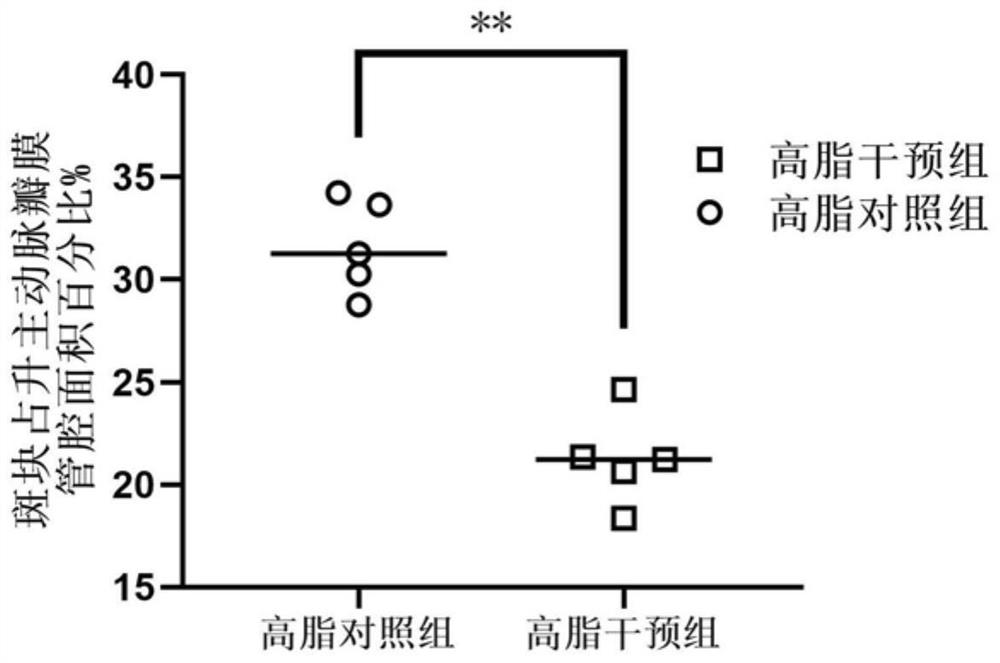
图4为升主动脉瓣膜区域标本经油红染色评估动脉粥样硬化范围统计图,其中,“**”表示p<0.01;
图5为免疫荧光对巨噬细胞侵润动脉组织区域的程度结果图;
图6为体外水平上通过transwell实验评估评估y041-2662对巨噬细胞趋化功能的影响染色结果图
图7为对transwell实验评估评估y041-2662对巨噬细胞趋化功能的影响结果的统计图,其中,“***”表示p<0.001;
图8为体外水平上通过Elisa实验评估评估y041-2662对巨噬细胞释放MMP9功能的调控作用的结果统计图,其中,“****”表示p<0.0001;
图9为免疫蛋白电泳评估y041-2662对巨噬细胞Gal-3介导的MAPK通路激活的作用的结果图;
图10为免疫蛋白电泳评估y041-2662对巨噬细胞Gal-3介导的MAPK通路激活的作用的结果统计图,其中,“**”表示p<0.01,“***”表示p<0.001。
具体实施方式
以下结合附图详细描述本发明的技术方案。本发明实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围,其均应涵盖在本发明的权利要求范围中。
本发明实施例其它所用的试剂若未经说明,均购自西格玛-奥德里奇(Sigma-Aldrich)公司。
实施例1:确定候选化合物
通过计算机模拟筛选的具体方案如下:
通过参考既往相关文献:Journal of medicinal chemistry,2016;59:8141-7,及蛋白质数据库资料:Protein Data Bank at the Research Collaboratory forStructural Bioinformatics(RCSB),能确定半乳糖凝集素-3(Galectin-3,Gal-3)的糖基识别域(carbohydrate recognition domain,CRD)的结构特征(Protein Data Bank编号-PDB ID:5EXO)。
首先,将5EXO的复合物数据(原始配体分子:methyl2-O-acetyl-3-O-(2H-chromene-3-yl-methyl)-a-D-glucopyranoside)用于分子对接位点分析。再用Schrodinger-2018软件的Protein preparation wizard模块对Gal-3蛋白结构进行优化,包括:修正化学键序、加氢、处理二硫键、金属离子、除去晶体结构中水分子和杂原子等预处理。使用“Interactive Optimizer”选项进行添加氢原子和电荷。使用OPLS_2005力场对蛋白结构进行能量最小化,当均方根偏差(RMSD)达到最大值
在Chemdiv及Enamine两个化合物库中通过对550万种化合物进行筛选,利用Schrodinger软件的Ligprep模块对化合物的3D结构进行优化。采用Ligand Docking模块进行虚拟对接,将格点文件导入Receptor grid file中,对所有化合物进行分子对接,其他参数为默认值。由于受体-配体对接的打分值docking score综合了配体能量、受体能量及两者间的结合能等参数,分值绝对值越大说明受体亲和力越强,两者结合越牢固,因此以打分值小于原配体分子作为初步筛选条件。进而得出153种模拟条件下具有与Gal-3糖基识别域存在结合的候选化合物。
实施例2对候选化合物实施生物体体外筛选
以THP-1单核细胞系(该细胞为来源于人血液单核细胞所衍生的研究性细胞)对153种化合物的IC50进行初筛。
如下方法确定刺激物最佳实验浓度(EC80):
将THP-1细胞系在RPMI1640+10%血清+1%双抗中培养(有血清),至细胞对数生长期,加入PMA(佛波酯-主要作用为诱导THP-1单核细胞分化为巨噬细胞工作浓度100nM)后,立刻计数1500/孔铺于96孔板(悬浮状态下计数铺板,在96孔板内诱导贴壁),诱导24~48h(以细胞全部贴壁成为巨噬细胞)后开始实验。将重组Gal-3溶于RPMI溶液中配制成浓度0μg/ml、5μg/ml、10μg/ml、25μg/ml、50μg/ml、100μg/ml、150μg/ml和200μg/ml的Gal-3溶液。将THP-1孵育于不同浓度Gal-3中,每组三个复孔,孵育48h后吸取上清,Elisa(试剂盒品牌:Biovision;货号:E4618-100)检测MMP9,当刺激物效应达到最大值的80%时的刺激物浓度,确定为本研究的实验刺激物浓度,即25μg/ml。
Gal-3和小分子抑制物溶液的配置方法如下:
将Gal-3(浓度为25μg/ml)及小分子化合物(小分子化合物浓度30μM)溶于RPMI-1640无血清培养基(不要包被),即事先将细胞培养液中的Gal-3和小分子抑制剂在同一溶剂中调整好浓度(Gal-3浓度25μg/ml,小分子抑制剂30μM)。
干预THP-1细胞方法如下:
将细胞铺板后,将上清液换成RPMI-1640无血清培养基(含候选化合物+Gal-3),37℃,5%CO
实验分组方案如下:
干预组(细胞培养环境为153种化合物分别加入含有Gal-3的RPMI-1640无血清培养基中。每组三个复孔);
阴性对照组(细胞培养环境为RPMI-1640无血清培养基);
空白组(无细胞,含有Gal-3的RPMI-1640无血清培养基);
阳性对照组(细胞培养环境为Gal-3的RPMI-1640无血清培养基)。
在48小时分别收集细胞上清液,稀释10倍后。统一行ELISA测试检测MMP9含量。
将结果中MMP9浓度低于阳性对照组50%水平(即抑制效果>50%)的实验组小分子化合物作为后续研究候选分子(共9种)。
将上述9种小分子化合物选取5个浓度进行进一步测试,确定各自IC50值,评估找出化合物作用的强弱关系。
在体外验证阶段具有最显著抑制THP-1细胞分泌MMP9的作用的候选化合物为C
实施例3化合物y041-2662体内验证
y041-2662在小鼠动脉粥样硬化的实验设计
予以6周APOE(-/-)小鼠高脂饮食3月(脂肪含量30%),高脂饮食第三月起开始予以腹腔注射y041-2662(5μg/体重(g)/隔天,溶于玉米油)。实验分2组:高脂对照组、高脂干预组。待高脂饮食3月后,通过组织病理切片、分子生物学技术、免疫组化、荧光等技术综合评估y041-2662对小鼠动脉粥样硬化的发生及发展的调控作用;
油红染色评估y041-2662对动脉粥样硬化的调控作用
提取小鼠主动脉(主动脉瓣至髂动脉水平)。行油红染色评估2组动脉粥样硬化病变情况。
如图1及图2所示,高脂对照组油红染色阳性区域较高脂干预组显著增多(p=0.0008),表明小分子化合物能通过抑制Gal-3活性,进而抑制动脉粥样硬化病变的发展。
对于高脂喂养小鼠行升主动脉瓣膜区油红染色,如图3和图4所示,高脂对照组油红染色阳性区域较高脂干预组显著增多(p=0.012),表明小分子化合物能通过抑制Gal-3活性,进而抑制动脉粥样硬化病变的发展。
实施例4化合物对巨噬细胞功能的作用
免疫荧光体内评估巨噬细胞功能如下:
提取小鼠主动脉。行免疫荧光评估斑块处巨噬细胞趋化(CD68绿色)。如图5所示,高脂干预组动脉粥样硬化病变水平在y041-2662干预后较高脂对照组显著改善;斑块局部巨噬细胞趋化水平显著降低。高脂对照组可见存在不稳定斑块破裂现象(图中白色箭头)。
实施例5y041-2662对巨噬细胞趋化功能的调控作用评估
将THP-1细胞系在RPMI1640+10%血清+1%双抗中培养(有血清),至细胞对数生长期,加入PMA(工作浓度100nM)后,立即计数,10000/孔铺于6孔板内,诱导24-48h(以细胞全部贴壁成为巨噬细胞)后开始实验。将重组Gal-3溶于RPMI溶液中配制成25μg/ml的Gal-3溶液,更换THP-1细胞上清液为Gal-3溶液,干预组为Gal-3(25μg/ml)及y041-2662(30μM),实验共分四组:阴性对照组(NC)、NC+y041-2662、Gal-3组和Gal-3+y041-2662。孵育24h后,吸取上清并保留,通过胰酶将细胞消化后再次铺于0.4μM PVDF膜小室中(上侧),培养溶液同前。继续孵育6h后收取PVDF膜,使用PBS轻轻冲洗PVDF膜两侧后,将PVDF膜下侧置于1%结晶紫溶液中染色10mins,染色完成后再次通过PBS轻轻洗去残余染液后,置于倒置显微镜下计数穿过PVDF下方的巨噬细胞数量。如图6和图7所示,干预组巨噬细胞计数较对照组显著减少(p=0.0004),表明y041-2662能抑制Gal-3介导的巨噬细胞趋化作用。
将本实施例上述上清液进行Elisa检测(Elisa试剂盒品牌:Biovision;货号:E4618-100),检测MMP9的含量。如图8所示,Gal-3能显著促进巨噬细胞MMP9释放,y041-2662能抑制Gal-3所介导的巨噬细胞MMP9释放。
实施例6通过Gal-3抑制MMP9释放的机制通路验证
将THP-1细胞系在RPMI1640+10%血清+1%双抗中培养(有血清),至细胞对数生长期,加入PMA(工作浓度100nM),加入PMA后,立即计数,10000/孔铺于6孔板内,诱导24-48h(以细胞全部贴壁成为巨噬细胞)后开始实验。将重组Gal-3溶于RPMI溶液中配制成25μg/ml的Gal-3溶液,更换THP-1细胞上清液为Gal-3溶液,干预组为Gal-3(25μg/ml)及y041-2662(30μM),实验共分四组:阴性对照组(NC)、NC+y041-2662、Gal-3组和Gal-3+y041-2662组。孵育24h后,通过RIPA消化细胞,提取细胞蛋白,并行免疫蛋白电泳,评估y041-2662相关机制通路蛋白的表达变化。结果如图9和图10所示,表明y041-2662可抑制Gal-3介导的MAPK(主要通过抑制MAPK通路中的ERK1/2及AKT磷酸化激活产生的转录激活作用)通路激活进而抑制巨噬细胞MMP9的合成。
- 一种防治颈动脉粥样硬化斑块的中药组合物及其制备方法和应用
- 一种防治动脉粥样硬化斑块的药物及其制备方法
