一种MSC-exo促进巧囊纤维化机制的研究方法
文献发布时间:2023-06-19 18:34:06
技术领域
本发明涉及子宫内膜异位症研究技术领域,特别地涉及了一种MSC-exo促进巧囊纤维化机制的研究方法。
背景技术
子宫内膜异位症(endometriosis,EMT,简称内异症)的异位内膜侵犯卵巢皮质并在其内生长、反复周期性出血,形成单个或多个囊肿型典型病变,即卵巢子宫内膜异位囊肿,因囊液似巧克力液,又称卵巢巧克力囊肿,简称巧囊。巧囊纤维化是造成手术难于剥离、易丢失部分正常卵巢组织的主要原因,探寻其纤维化形成机制及作用靶点,对临床诊疗有积极的指导意义。
外泌体(exosome)是间充质干细胞(MSC)旁分泌作用的主要物质,异位子宫内膜间充质干细胞来源外泌体(MSC-exo)可促进EMT发生发展,但其在巧囊纤维化中的作用尚未明确。Yes相关蛋白-1(YAP1)、转录共激活因子PDZ结合基序(TAZ)是经典Hippo通路的主要效应分子,YAP1/TAZ可调节成纤维活化与基质形成,从而介导组织器官纤维化。MSC-exo促进巧囊纤维化的分子机制可能与调控YAP1/TAZ通路有关。
基于此,本发明设计了一种MSC-exo促进巧囊纤维化机制的研究方法,以解决上述提到的问题。
发明内容
本发明的目的在于提供一种MSC-exo促进巧囊纤维化机制的研究方法,以解决上述背景技术中提出的技术问题。
本发明的技术方案为:一种MSC-exo促进巧囊纤维化机制的研究方法,所述研究方法包括阶段一和阶段二:
阶段一为检测卵巢异位子宫内膜间质细胞和正常子宫内膜间质细胞中YAP1和TAZ的含量变化,分析YAP1和TAZ对巧囊纤维化的影响;
阶段二为分析异位子宫内膜MSC-exo通过调控YAP1/TAZ通路对子宫内膜间质细胞纤维化的影响。
作为更进一步的优选方案,阶段一具体包括以下步骤:
S11、采集人卵巢异位子宫内膜组织与正常子宫内膜组织,通过PCR及免疫组化法检测组织中YAP1和TAZ的表达差异;
S12、分离培养原代卵巢异位内膜间质细胞与原代正常子宫内膜间质细胞,检测细胞的增殖活性、细胞凋亡、细胞迁移及侵袭能力、纤维化相关指标以及YAP1/TAZ通路活化情况;
S13、构建内异症大鼠模型,观察大鼠异位病灶组织的病理学变化,通过Sirius-red染色和Masson染色观察病灶纤维化程度,通过PCR和western blot法检测纤维化相关指标以及YAP1/TAZ通路活化情况。
作为更进一步的优选方案,所述步骤S11的具体步骤如下:
S111、样本采集,收集巢异位子宫内膜标本和正常子宫内膜标本;
S112、YAP1和TAZ检测,利用PCR和免疫组化法检测卵巢异位子宫内膜组织与正常子宫内膜组织中YAP1和TAZ表达水平的差异;
S113、数据分析,分析YAP1和TAZ在不同类型组织中表达水平的差异与子宫内膜异位症病理特征的关系。
作为更进一步的优选方案,所述步骤S12的具体步骤如下:
S121、细胞培养,从卵巢异位子宫内膜组织与正常子宫内膜组织中分别分离出原代卵巢子宫异位内膜间质细胞和原代正常子宫内膜间质细胞,对细胞进行培养;
S122、实验分组,按照以下条件将步骤S121培养好的原代卵巢子宫异位内膜间质细胞和原代正常子宫内膜间质细胞各分为五组实验:①正常对照组,仅给予PBS溶液培养子宫内膜间质细胞;②模型组,加入10ng/ml TGF-β1培养子宫内膜间质细胞;③阴性对照组,加入TGF-β1+空白质粒培养子宫内膜间质细胞;④YAP1过表达组,加入TGF-β1+YAP1质粒至培养子宫内膜间质细胞;⑤YAP1沉默组,加入TGF-β1+si-YAP1质粒培养子宫内膜间质细胞;培养48h后用于后续的实验;
S123、细胞增殖检测,利用CCK8法检测不同时间点下实验组的细胞增殖活性;
S124、细胞凋亡检测,利用凋亡试剂盒对每组实验进行处理;
S125、细胞迁移检测,利用划痕实验检测每组实验的细胞迁移能力;
S126、细胞侵袭检测,利用Transwell实验检测每组实验的细胞侵袭能力;
S127、纤维化指标检测,利用PCR和western blot法检测每组实验的纤维化相关指标,所述纤维化相关指标包括α-SMA、Col-I、Col-III和FN;
S128、YAP1/TAZ检测,利用PCR和western blot法检测每组实验的YAP1/TAZ表达情况。
作为更进一步的优选方案,步骤S13的具体步骤如下:
S131、建立动物模型,选取饲养程度大致相同的SD大鼠,采用同种异体子宫内膜移植法对SD大鼠进行处理,得到大鼠模型;
S132、实验分组,将步骤S131中建立的子宫内膜异位症模型分为五组实验:①正常对照组,只进行术部切开的子宫内膜异位症模型,不做其他处理;②模型组,建立子宫内膜组织细胞的EMT模型;③阴性对照组,建立EMT模型并注射空白质粒至尾静脉;④YAP1过表达组,建立EMT模型并注射YAP1质粒至尾静脉;⑤YAP1沉默组,建立EMT模型并注射EMT+si-YAP1至尾静脉;
S133、组织病理学变化检测,利用HE染色对每组实验进行处理,观察异位病灶组织的病理学变化;
S134、病灶纤维化检测,利用Sirius-red染色和Masson染色对每组实验进行处理,观察病灶纤维化程度;
S135、纤维化指标检测,利用PCR和免疫组化法检测每组实验的纤维化相关指标,所述纤维化相关指标包括α-SMA、Col-I、Col-III和FN;
S136、YAP1/TAZ通路检测,利用PCR和免疫组化法检测每组实验的YAP1和TAZ的表达情况。
作为更进一步的优选方案,阶段二具体包括以下步骤:
S21、分离异位子宫内膜MSC,并用流式细胞术鉴定;分离浓缩MSC-exo,并用流式细胞术鉴定;
S22、分离并分组培养原代细胞,分组加入MSC-exo,检测细胞的增殖活性、细胞凋亡、细胞迁移及侵袭能力、纤维化相关指标以及YAP1/TAZ通路活化情况;
S23、构建内异症大鼠模型,观察大鼠异位病灶组织的病理学变化,通过Sirius-red染色和Masson染色观察病灶纤维化程度,通过PCR和western blot法检测纤维化相关指标以及YAP1/TAZ通路活化情况。
作为更进一步的优选方案,步骤S21的具体步骤如下:
S211、MSC分离及鉴定,利用Percoll密度梯度离心法从异位子宫内膜组织中分离出异位子宫内膜MSC,并且使用流式细胞术进行鉴定;
S212、MSC-exo分离及鉴定,选取生长良好的MSC并对其培养,采用exosome分离试剂进行MSC-exo的分离和浓缩,并且使用流式细胞术进行鉴定。
作为更进一步的优选方案,步骤S22的具体步骤如下:
S221、细胞培养,从卵巢异位子宫内膜组织与正常子宫内膜组织中分别分离出原代卵巢子宫异位内膜间质细胞和原代正常子宫内膜间质细胞,对细胞进行培养;
S222、实验分组,按照以下条件将步骤S221培养好的原代卵巢子宫异位内膜间质细胞和原代正常子宫内膜间质细胞各分为五组实验:①正常对照组,仅给予等量PBS培养子宫内膜间质细胞;②模型组,加入10ng/ml TGF-β1培养子宫内膜间质细胞;③低浓度MSC-exo组,加入TGF-β1+低浓度MSC-exo培养子宫内膜间质细胞;④中浓度MSC-exo组,加入TGF-β1+中浓度MSC-exo培养子宫内膜间质细胞;⑤高浓度MSC-exo组,加入TGF-β1+高浓度MSC-exo培养子宫内膜间质细胞;培养48h后用于后续实验;
S223、细胞增殖检测,利用CCK8法检测细胞增殖活性;
S224、细胞凋亡检测,利用凋亡试剂盒对每组实验进行处理,并通过流式细胞仪检每组实验的细胞凋亡情况;
S225、细胞迁移检测,利用划痕实验检测每组实验的细胞迁移能力;
S226、细胞侵袭检测,利用Transwell实验检测每组实验的细胞侵袭能力;
S227、纤维化指标检测,利用PCR和western blot法检测每组实验的纤维化相关指标,所述纤维化相关指标包括α-SMA、Col-I、Col-III和FN;
S228、YAP1/TAZ检测,利用PCR和western blot法检测每组实验的YAP1/TAZ表达情况。
作为更进一步的优选方案,步骤S23的具体步骤如下:
S231、建立动物模型,选取饲养程度大致相同的SD大鼠,采用同种异体子宫内膜移植法对SD大鼠进行处理,得到大鼠模型;
S232、实验分组,将步骤S231建立的子宫内膜异位症模型分为五组:①正常对照组,仅注射PBS;②模型组,注射10ng/ml TGF-β1至尾静脉;③低浓度MSC-exo组,注射TGF-β1+低浓度MSC-exo至尾静脉;④中浓度MSC-exo组,注射TGF-β1+中浓度MSC-exo至尾静脉;⑤高浓度MSC-exo组,注射TGF-β1+高浓度MSC-exo至尾静脉;
S233、组织病理学变化检测,利用HE染色对每组实验进行处理,观察异位病灶组织的病理学变化;
S234、病灶纤维化检测,利用Sirius-red染色和Masson染色对每组实验进行处理,观察病灶纤维化程度;
S235、纤维化指标检测,利用PCR和免疫组化法检测每组实验的纤维化相关指标,所述纤维化相关指标包括α-SMA、Col-I、Col-III和FN;
S236、YAP1/TAZ通路检测,利用PCR和免疫组化法检测每组实验的YAP1和TAZ的表达情况。
本发明具有如下优点:
1、本发明创新性地将干细胞外泌体机制这一研究新视角与巧囊纤维化机制锲合起来研究,以揭示巧囊纤维化形成中异位子宫内膜间质干细胞外泌体通过YAP1/TAZ通路调控巧囊纤维化这一新机制。
2、本发明将干细胞、外泌体、巧囊纤维化三者研究热点有机结合起来探索,拟构建巧囊纤维化形成中子宫内膜间质细胞、外泌体、YAP1/TAZ通路三者之间的调控网络新模式,为寻求高效的子宫内膜异位症的特异靶点提供理论依据。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图示出的结构获得其他的附图。
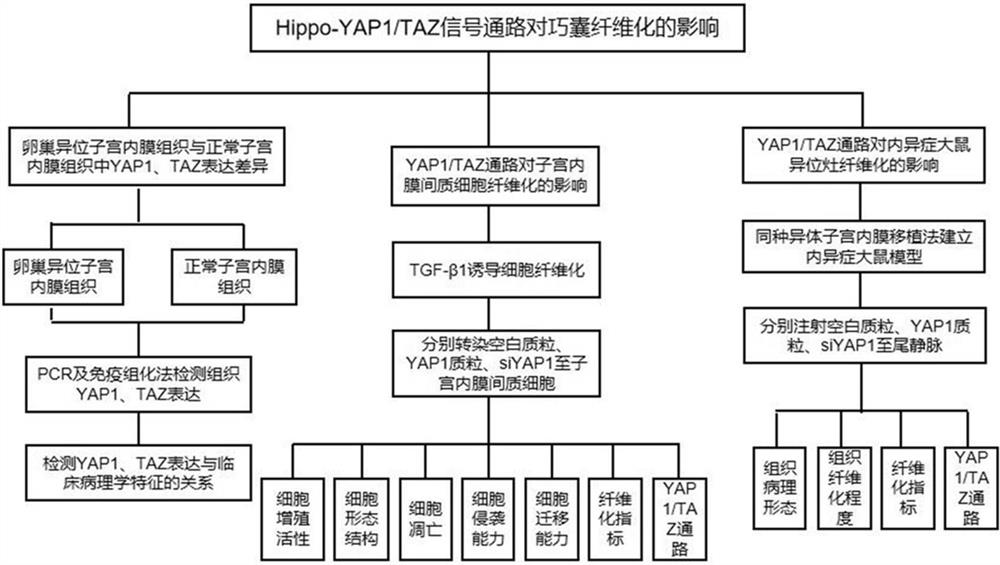
图1为本发明实施例提供的Hippo-YAP1/TAZ信号通路对巧囊纤维化的影响的研究方法框架图。
图2为本发明实施例提供的异位子宫内膜MSC-exo通过调控Hippo-YAP1/TA通路对子宫内膜间质细胞纤维化的影响的研究方法框架图。
具体实施方式
为了更好的理解本发明的技术方案,下面结合附图对本发明实施例进行详细描述。
应当明确,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其它实施例,都属于本发明保护的范围。
取决于语境,如在此所使用的词语“如果”可以被解释成为“在……时”或“当……时”或“响应于确定”或“响应于检测”。类似地,取决于语境,短语“如果确定”或“如果检测(陈述的条件或事件)”可以被解释成为“当确定时”或“响应于确定”或“当检测(陈述的条件或事件)时”或“响应于检测(陈述的条件或事件)”。
此外,若出现术语“第一”、“第二”等仅用于区分描述,而不能理解为指示或暗示相对重要性。
实施例1
参见图1和图2,本发明实施例提供的一种MSC-exo促进巧囊纤维化机制的研究方法,主要包括阶段一和阶段二两个研究阶段:
阶段一、检测卵巢异位子宫内膜间质细胞和正常子宫内膜间质细胞中YAP1和TAZ的含量变化,分析YAP1和TAZ对巧囊纤维化的影响;
阶段二、分析异位子宫内膜MSC-exo通过调控Hippo-YAP1/TA通路对子宫内膜间质细胞纤维化的影响。
本实施例中,对于阶段一,具体包括以下步骤:
S11、采集人卵巢异位子宫内膜组织与正常子宫内膜组织,通过PCR及免疫组化法检测组织中YAP1和TAZ的表达差异;
S12、分离培养原代卵巢异位内膜间质细胞与原代正常子宫内膜间质细胞,采用合适的方法检测细胞的增殖活性、细胞凋亡、细胞迁移及侵袭能力、纤维化相关指标以及YAP1/TAZ通路活化情况;
S13、构建内异症大鼠模型,观察大鼠异位病灶组织的病理学变化,通过Sirius-red染色和Masson染色观察病灶纤维化程度,通过PCR和western blot法检测纤维化相关指标以及YAP1/TAZ通路活化情况。
其中,步骤S11的具体步骤为:
S111、样本采集,收集卵巢异位子宫内膜剥除患者的新鲜手术标本50例,同期收集原发性不孕患者在宫腔镜检查术中的增殖期子宫内膜标本50例;
S112、YAP1和TAZ检测,利用PCR和免疫组化法检测卵巢异位子宫内膜组织与正常子宫内膜组织中YAP1和TAZ表达水平的差异;
S113、数据分析,分析YAP1和TAZ在不同类型组织中表达水平的差异与子宫内膜异位症病理特征的关系,统计手术标本对应患者的年龄、囊肿大小和时期等信息,分析患者的年龄、囊肿大小和病情所处的时期变化对组织中的YAP1和TAZ含量的影响,绘制不同影响因素下组织中的YAP1和TAZ含量的对比图。
步骤S12的具体步骤为:
S121、细胞培养,从卵巢异位子宫内膜组织与正常子宫内膜组织中分别分离出原代卵巢子宫异位内膜间质细胞和原代正常子宫内膜间质细胞,对细胞进行培养,培养液包含10%的FBS、100U/ml青霉素和100μg/ml链霉素的DMEM/F12,培养的条件为温度37℃,CO2浓度5%,培养期间培养液一天更换一次;
S122、实验分组,按照以下条件将步骤S121培养好的原代卵巢子宫异位内膜间质细胞和原代正常子宫内膜间质细胞各分为五组实验:①正常对照组,仅给予PBS溶液培养子宫内膜间质细胞;②模型组,加入10ng/ml TGF-β1培养子宫内膜间质细胞;③阴性对照组,加入TGF-β1+空白质粒培养子宫内膜间质细胞;④YAP1过表达组,加入TGF-β1+YAP1质粒至培养子宫内膜间质细胞;⑤YAP1沉默组,加入TGF-β1+si-YAP1质粒培养子宫内膜间质细胞,培养48h后用于后续的实验;
S123、细胞增殖检测,利用CCK8法检测不同时间点下实验组的细胞增殖活性,具体为在第24h、48h和72h下进行检测,通过CCK8试剂对细胞进行处理,然后用酶标仪测定450nm处的吸光值(OD),并且根据时间变化描绘细胞生长曲线,比对不同实验组中细胞的增殖速度;
S124、细胞凋亡检测,利用凋亡试剂盒对每组实验进行处理,并通过流式细胞仪检每组实验的细胞凋亡情况,绘制不同实验组的细胞凋亡对比图;
S125、细胞迁移检测,利用划痕实验检测每组实验的细胞迁移能力:子先用丝裂霉素C(MMC)(1μg/ml)试剂对细胞进行处理,再使用6孔板铺设细胞,通过无菌牙签进行划痕处理,培养6h-24h,本实施例中优选为12h,通过显微镜观察并测量划痕的宽度,以及拍照记录,绘制不同实验组的划痕宽度对比图;
S126、细胞侵袭检测,利用Transwell实验检测每组实验的细胞侵袭能力:细胞培养板选择24孔板,将细胞接种在Transwell小室上,培养结束后通过MMT试剂进行处理,并利用酶标仪测量吸光值(OD),绘制不同实验组的吸光值(OD)对比图;
S127、纤维化指标检测,利用PCR和western blot法检测每组实验的纤维化相关指标,得到不同实验组的纤维化程度信息,纤维化相关指标包括α-SMA、Col-I、Col-III和FN等,绘制不同实验组的纤维化相关指标对比图;
S128、YAP1/TAZ检测,利用PCR和western blot法检测每组实验的YAP1/TAZ表达情况,根据每组实验中YAP1/TAZ含量数据绘制对比图。
步骤S13的具体步骤为:
S131、建立动物模型,选取饲养程度大致相同的SD大鼠,采用同种异体子宫内膜移植法对SD大鼠进行处理,得到大鼠模型;
具体包括以下操作过程:采用同种异体子宫内膜移植法对SD大鼠进行处理之前,先用戊酸雌二醇1mg/kg对SD大鼠进行灌胃处理,使SD大鼠处于同一动情周期,而后将SD大鼠麻醉,然后切除供体SD大鼠的子宫,将子宫减成3mm×4mm大小的子宫碎片,将碎片缝于受体SD大鼠两侧腹壁及卵巢周围肠系膜血管丰富处,手术结束后用戊酸雌二醇1mg/kg灌胃5d,以促进异位病灶生长,同时设立假手术组,仅进行术部切开。一周之后,随机选取2只受体SD大鼠,利用肉眼检验及HE染色检验子宫内膜异位症模型是否成功;
S132、实验分组,将步骤S131中建立的子宫内膜异位症模型分为五组实验:①正常对照组,只进行假手术的子宫内膜异位症模型,不做其他处理;②模型组,建立子宫内膜组织细胞的EMT模型;③阴性对照组,建立EMT模型并注射空白质粒至尾静脉;④YAP1过表达组,建立EMT模型并注射YAP1质粒至尾静脉;⑤YAP1沉默组,建立EMT模型并注射EMT+si-YAP1至尾静脉;
S133、组织病理学变化检测,利用HE染色对每组实验进行处理,观察异位病灶组织的病理学变化;
S134、病灶纤维化检测,利用Sirius-red染色和Masson染色对每组实验进行处理,观察病灶纤维化程度;
S135、纤维化指标检测,利用PCR和免疫组化法检测每组实验的纤维化相关指标,纤维化相关指标包括α-SMA、Col-I、Col-III和FN等,绘制不同实验组的纤维化相关指标对比图;
S136、YAP1/TAZ通路检测,利用PCR和免疫组化法检测每组实验的YAP1和TAZ的表达情况,根据每组实验中YAP1/TAZ含量数据绘制对比图。
本实施例中,对于阶段二,具体包括以下步骤:
S21、分离异位子宫内膜MSC,并用流式细胞术鉴定;分离浓缩MSC-exo,并用流式细胞术鉴定;
S22、分离并分组培养原代细胞,分组加入MSC-exo,采用合适的方法检测细胞的增殖活性、细胞凋亡、细胞迁移及侵袭能力、纤维化相关指标以及YAP1/TAZ通路活化情况;
S23、构建内异症大鼠模型,观察大鼠异位病灶组织的病理学变化,通过Sirius-red染色和Masson染色观察病灶纤维化程度,通过PCR和western blot法检测纤维化相关指标以及YAP1/TAZ通路活化情况。
其中,步骤S21的具体步骤为:
S211、MSC分离及鉴定,利用Percoll密度梯度离心法从异位子宫内膜组织中分离出异位子宫内膜MSC,并且使用流式细胞术进行鉴定,具体为检测MSC表面的CD34、CD44、CD29、CD109和HLA-DR的含量;
S212、MSC-exo分离及鉴定,选取生长良好的MSC并对其培养,培养基为含有10%Exo-free FBS的α-MEM完全培养基,培养一段时间后,采用exosome分离试剂进行MSC-exo的分离和浓缩,并且使用流式细胞术进行鉴定,具体为检测MSC-exo表面CD63的表达。
步骤S22的具体步骤为:
S221、细胞培养,从卵巢异位子宫内膜组织与正常子宫内膜组织中分别分离出原代卵巢子宫异位内膜间质细胞和原代正常子宫内膜间质细胞,对细胞进行培养,培养液包含10%的FBS、100U/ml青霉素和100μg/ml链霉素的DMEM/F12,培养的条件为温度37℃,CO2浓度5%,培养期间培养液一天更换一次;
S222、实验分组,按照以下条件将步骤S221培养好的原代卵巢子宫异位内膜间质细胞和原代正常子宫内膜间质细胞各分为五组实验:①正常对照组,仅给予等量PBS培养子宫内膜间质细胞;②模型组,加入10ng/ml TGF-β1培养子宫内膜间质细胞;③低浓度MSC-exo组,加入TGF-β1+低浓度MSC-exo培养子宫内膜间质细胞;④中浓度MSC-exo组,加入TGF-β1+中浓度MSC-exo培养子宫内膜间质细胞;⑤高浓度MSC-exo组,加入TGF-β1+高浓度MSC-exo培养子宫内膜间质细胞;培养48h后用于后续实验;
S223、细胞增殖检测,利用CCK8法检测不同时间点下的细胞增殖活性,并且将检测坚果绘制为细胞生长曲线,不同的时间点为24h、48h、72h;
S224、细胞凋亡检测,利用凋亡试剂盒对每组实验进行处理,并通过流式细胞仪检每组实验的细胞凋亡情况,绘制不同实验组的细胞凋亡对比图;
S225、细胞迁移检测,利用划痕实验检测每组实验的细胞迁移能力:子先用丝裂霉素C(MMC)(1μg/ml)试剂对细胞进行处理,再使用6孔板铺设细胞,通过无菌牙签进行划痕处理,培养6h-24h,本实施例中优选为12h,通过显微镜观察并测量划痕的宽度,以及拍照记录,绘制不同实验组的划痕宽度对比图;
S226、细胞侵袭检测,利用Transwell实验检测每组实验的细胞侵袭能力:细胞培养板选择24孔板,将细胞接种在Transwell小室上,培养结束后通过MMT试剂进行处理,并利用酶标仪测量吸光值(OD),绘制不同实验组的吸光值(OD)对比图;
S227、纤维化指标检测,利用PCR和western blot法检测每组实验的纤维化相关指标,得到不同实验组的纤维化程度信息,纤维化相关指标包括α-SMA、Col-I、Col-III和FN等,绘制不同实验组的纤维化相关指标对比图;
S228、YAP1/TAZ检测,利用PCR和western blot法检测每组实验的YAP1/TAZ表达情况,根据每组实验中YAP1/TAZ含量数据绘制对比图。
步骤S23的具体步骤为:
S231、建立动物模型,选取饲养程度大致相同的SD大鼠,采用同种异体子宫内膜移植法对SD大鼠进行处理,得到大鼠模型;
具体包括以下操作过程:采用同种异体子宫内膜移植法对SD大鼠进行处理之前,先用戊酸雌二醇1mg/kg对SD大鼠进行灌胃处理,使SD大鼠处于同一动情周期,而后将SD大鼠麻醉,然后切除供体SD大鼠的子宫,将子宫减成3mm×4mm大小的子宫碎片,将碎片缝于受体SD大鼠两侧腹壁及卵巢周围肠系膜血管丰富处,手术结束后用戊酸雌二醇1mg/kg灌胃5d,以促进异位病灶生长,同时设立假手术组,仅进行术部切开。一周之后,随机选取2只受体SD大鼠,利用肉眼检验及HE染色检验子宫内膜异位症模型是否成功;
S232、实验分组,将步骤S231建立的子宫内膜异位症模型分为五组:①正常对照组,仅注射PBS;②模型组,注射10ng/ml TGF-β1至尾静脉;③低浓度MSC-exo组,注射TGF-β1+低浓度MSC-exo至尾静脉;④中浓度MSC-exo组,注射TGF-β1+中浓度MSC-exo至尾静脉;⑤高浓度MSC-exo组,注射TGF-β1+高浓度MSC-exo至尾静脉;
S233、组织病理学变化检测,利用HE染色对每组实验进行处理,观察异位病灶组织的病理学变化;
S234、病灶纤维化检测,利用Sirius-red染色和Masson染色对每组实验进行处理,观察病灶纤维化程度;
S235、纤维化指标检测,利用PCR和免疫组化法检测每组实验的纤维化相关指标,绘制数据对比图,纤维化相关指标包括α-SMA、Col-I、Col-III和FN等,绘制不同实验组的纤维化相关指标对比图;
S236、YAP1/TAZ通路检测,利用PCR和免疫组化法检测每组实验的YAP1和TAZ的表达情况,根据每组实验中YAP1/TAZ含量数据绘制对比图。
本发明实施例提供的一种MSC-exo促进巧囊纤维化机制的研究方法,创新性地将干细胞外泌体机制这一研究新视角与巧囊纤维化机制契合起来研究,以揭示巧囊纤维化形成中异位子宫内膜间质干细胞外泌体通过YAP1/TAZ通路调控巧囊纤维化这一新机制;将干细胞、外泌体、巧囊纤维化三者研究热点有机结合起来探索,拟构建巧囊纤维化形成中子宫内膜间质细胞、外泌体、YAP1/TAZ通路三者之间的调控网络新模式,为寻求高效的子宫内膜异位症的特异靶点提供理论依据。
尽管已经参照本公开的特定示例性实施例示出并描述了本公开,但是本领域技术人员应该理解,在不背离所附权利要求及其等同物限定的本公开的精神和范围的情况下,可以对本公开进行形式和细节上的多种改变。因此,本公开的范围不应该限于上述实施例,而是应该不仅由所附权利要求来进行确定,还由所附权利要求的等同物来进行限定。
- 一种蒺藜皂苷D抗肺纤维化作用机制的研究方法
- 通过JNK/SAPK、ERK信号通路促进胃黏膜修复治疗胃溃疡的作用机制的研究方法
