久制黄精多糖、制备方法及其在抑制MH7A细胞活性评价中的应用
文献发布时间:2023-06-19 18:35:48
技术领域
本发明属于黄精技术领域,特别涉及一种久制黄精多糖、制备方法及其在抑制MH7A细胞活性评价中的应用。
背景技术
药用黄精有着悠久的炮制历史,历代文献载有多种炮制方法,其中以蒸制法为主,在辅料的选择上主要以酒、蜜、黑豆等为主。通过溯源其从古到今的炮制历史沿革,可知药用黄精的古今炮制方法既存在着一脉相承的相似性,亦有发展及认知局限导致的差异性。
黄精的成分和作用具有复杂性,不同炮制工艺下化合物的生物活性和药理作用均有较大的变化。生黄精中含有较多的黏液质,在一定程度上会刺激咽喉,通过反复的蒸晒,黏液质会发生分解,消除生黄精的刺激性和不良反应,达到减毒目的。黄精炮制时的蒸制次数古书记载不祥,有九蒸和四蒸之说。
黄精炮制的主要目的在于消除或减少生黄精的不良反应,并提髙疗效。但“九蒸九曝”法由于其制法工艺复杂,耗时长,成本高等特点,目前在临床使用上较为少见。现有技术中研究了黄精九蒸九制后的化学成分,从样品中分离出七种新化合物,通过光谱分析确定了化合物的结构;并对所有化合物进行二肽基肽酶-4(DPP-4)抑制、葡萄糖转运和抗炎活性测定。与生黄精相比,九蒸九制熟黄精可显著降低溶血率,减少刺激性,九蒸九制熟黄精甲醇提取物对NO的抑制作用显著强于生黄精(p<0.01),可以有效降低生黄精的炎症刺激性。此外,九蒸九制熟黄精可以显著提高环磷酰胺损伤小鼠的外周血WBC、RBC、HGB、PLT含量及脾指数,而生黄精没有明显改善作用。还有部分研究发现炮制后引起黄精刺激性的物质会显著减少。有研究表明黄精随着酒炖的时间加长,其二氯甲烷组分的DPPH自由基清除活性亦增强,至酒炖16h后达到最高而后趋于稳定。
尽管多数报道中均指出炮制后药材符合质量要求,但针对不同炮制方法所得药材的质量和临床疗效的系统研究相对缺乏,其科学性有待继续论证,并且其化学成分及药理作用的改变对临床疗效亦会产生不同的影响。
本方法通过制备一种久制黄精,并通过抑制MH7A细胞活性评价用于筛选久制黄精多糖,提供一种具有抗类风湿关节炎作用的久制黄精多糖的制备方法。
发明内容
针对上述问题,一方面本发明提出了一种久制黄精多糖的制备方法,利用MH7A细胞对久制黄精粗多糖进行筛选,并将筛选后的久制黄精粗多糖进行纯化分离后得到久制黄精多糖。
进一步地,久制黄精粗多糖按照以下步骤制备:
取干燥后的黄精根茎加水蒸制,蒸制后取出进行烘干并粉碎,此步骤重复多次或不蒸制直接粉碎后得不同蒸制次数的得久制黄精根茎粉末;
将所述久制黄精根茎粉末用水煎煮后过滤,得滤液;
将所述滤液使用80%乙醇进行醇沉,醇沉后离心、收集沉淀并冻干后得到久制黄精粗多糖。
进一步地,蒸制过程中水和黄精根茎的质量比为1:4,蒸制时间为12h;烘干条件为50℃烘干12h;
所述久制黄精根茎粉末与水的体积比为1g:4mL;煎煮条件为:100℃,煎煮1h;
所述滤液与80%乙醇体积比为1:4,醇沉温度为室温25-30℃,醇沉时间为1h;
离心条件为5000rpm/min下离心10min。
进一步地,利用MH7A细胞对久制黄精粗多糖进行筛选包括以下步骤:
培养MH7A细胞并采用久制黄精粗多糖对所述MH7A细胞进行处理;
对处理后的MH7A细胞的性能进行评估;
根据评估结果筛选久制黄精粗多糖。
进一步地,培养MH7A细胞的条件为:选用含10%胎牛血清和1%青霉素和链霉素的DMEM细胞培养基,在37℃、5%CO
进一步地,对处理后的MH7A细胞的性能进行评估包括:
MH7A细胞增殖能力、久制黄精粗多糖对MH7A细胞的诱导凋亡作用、久制黄精粗多糖对MH7A细胞迁移能力的影响、久制黄精粗多糖对MH7A细胞侵袭能力的影响和MH7A细胞中的免疫调节活性。
进一步地,评估所述MH7A细胞增殖能力包括以下步骤:
取对数期正常生长的MH7A细胞,消化、离心收集细胞,计数板下计数,制成1×10
待MH7A细胞贴壁生长24h后,用TNF-α刺激细胞,并用不同浓度的久制黄精粗多糖处理24h,每孔加入10μL CCK-8溶液,放入37℃培养箱继续孵育1h;
酶标仪测定450nm处的各孔吸光度值计算细胞存活率。
进一步地,评估久制黄精粗多糖对MH7A细胞的诱导凋亡作用采用流式细胞仪测定凋亡率或者利用荧光显微镜观察荧光强度;
采用划痕实验评估久制黄精粗多糖对MH7A细胞迁移能力的影响,判断MH7A细胞的迁移活性;
采用Transwell法评估久制黄精粗多糖对MH7A细胞的侵袭能力;
评估MH7A细胞中的免疫调节活性通过测定MH7A细胞中的IL-10,IL-6和IL-1β的产生水平完成。
进一步地,所述久制黄精粗多糖进行纯化分离包括以下步骤:
将筛选后的久制黄精粗多糖配制成浓度为10mg/mL的久制黄精粗多糖溶液;
以不同浓度的NaCl溶液为洗脱液利用阴离子交换柱洗脱久制黄精粗多糖溶液,得久制黄精多糖精提液;
以纯水为洗脱液利用葡聚糖凝胶色谱柱对所述久制黄精多糖精提液进行纯化,收集含黄精多糖洗脱液,真空冷冻干燥后得久制黄精多糖。
本发明还提出了一种利用上述制备方法制备的久制黄精多糖。
进一步地,所述久制黄精多糖由摩尔比为46.67:5.03:19.32:1.25:7.73的葡萄糖、甘露糖、半乳糖、鼠李糖和半乳糖醛酸组成;
所述久制黄精多糖的相对分子质量为37.46kDa。
进一步地,所述久制黄精多糖中糖残基构型为α和β型;
一级结构单元含有→2)-α-D-GalAp(3,4→,→3)-α-D-Glcp,→3)-α-L-Rhap(4→,→2)-β-D-Galp(4→,→2)-α-D-Glcp(3→,→2)-α-D-Glcp(6→,→1)-β-D-Glcp(2→,→2,4)-α-D-Manp(6→,→1)-β-D-Manp(3→9种糖残基。
进一步地,所述9种糖残基的连接方式如下:
所述久制黄精多糖可以在抑制MH7A细胞活性评价中的应用。
本发明的有益效果:
本发明通过抑制MH7A细胞活性作用筛选的久制黄精粗多糖,具有明确的化学结构,为黄精多糖在抗类风湿性关节炎作用的构效关系研究及抗类风湿性关节炎药物的研发奠定了可靠的基础。
本发明将水提醇沉法与DEAE-52阴离子交换柱层析和葡聚糖凝胶色谱柱的工艺相结合制备的久制黄精多糖,工艺条件温和、操作简单、环境友好,获得的多糖纯度高、结构稳定,具有良好的治疗类风湿性关节炎效果,能够显著抑制MH7A细胞的生长与增殖,同时没有毒副作用,在抗类风湿性关节炎新药研发和应用方面有巨大的前景。
本发明的其它特征和优点将在随后的说明书中阐述,并且,部分地从说明书中变得显而易见,或者通过实施本发明而了解。本发明的目的和其他优点可通过在说明书、权利要求书以及附图中所指出的结构来实现和获得。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作一简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
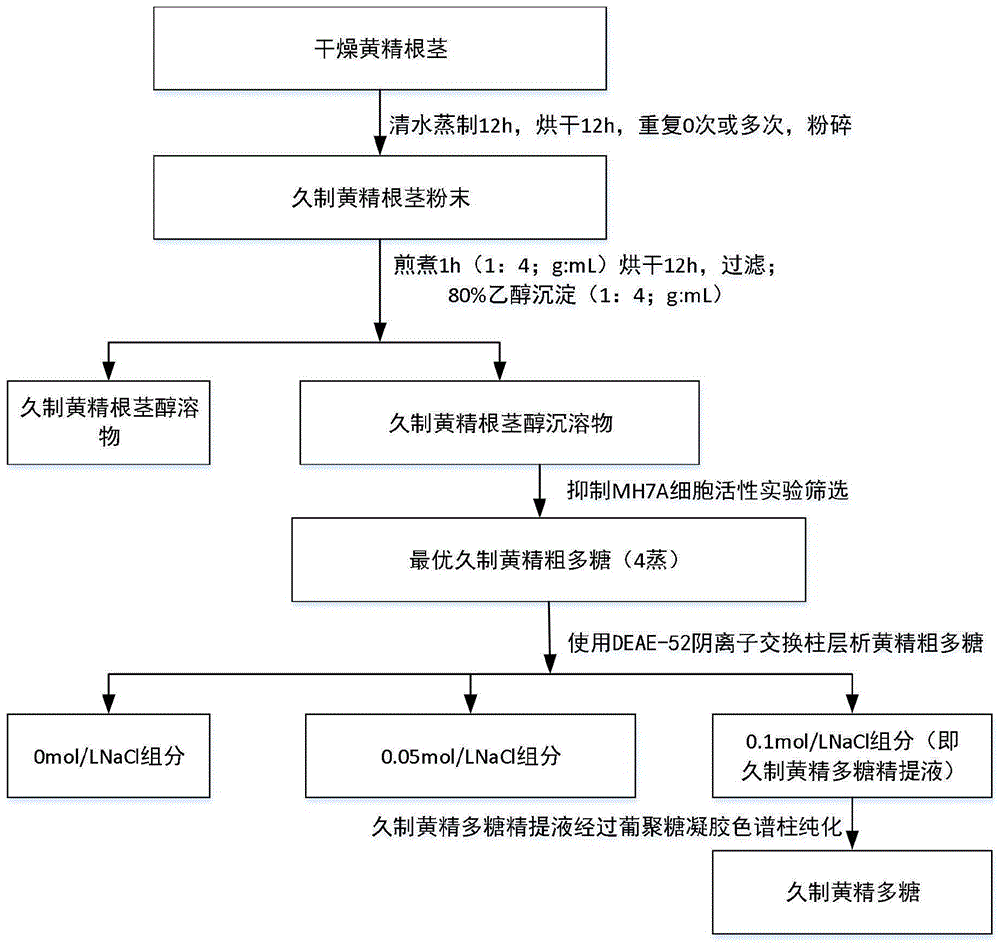
图1示出了本发明实施例中久制黄精多糖的制备工艺流程图;
图2A示出了本发明实施例中久制黄精粗多糖对MH7A细胞增殖的体外细胞存活率影响的对比图;
图2BⅠ示出了本发明实施例中久制黄精粗多糖通过DAPI染色检测对MH7A细胞的凋亡诱导作用的结果示意图;
图2BⅡ示出了本发明实施例中久制黄精粗多糖通过流式细胞仪检测MH7A细胞的凋亡诱导作用的结果示意图;
图2C示出了示出了本发明实施例中久制黄精粗多糖对MH7A细胞细胞周期的影响结果示意图;
图2DⅠ示出了本发明实施例中久制黄精粗多糖对MH7A细胞迁移的影响结果示意图;
图2DⅡ示出了本发明实施例中久制黄精粗多糖对MH7A细胞迁移的影响统计结果示意图;
图2E示出了本发明实施例中利用Transwell小室检测久制黄精粗多糖对MH7A细胞侵袭能力的影响结果示意图;
图2FⅠ示出了本发明实施例中久制黄精粗多糖对TNF-α刺激的MH7A细胞释放IL-6的结果示意图;
图2FⅡ示出了本发明实施例中久制黄精粗多糖对TNF-α刺激的MH7A细胞释放IL-10的结果示意图;
图2FⅢ示出了本发明实施例中久制黄精粗多糖对TNF-α刺激的MH7A细胞释放IL-1β的结果示意图;
图3A示出了本发明实施例中久制黄精多糖的DEAE-52阴离子交换柱层析洗脱图;
图3B示出了本发明实施例中久制黄精多糖的葡聚糖凝胶色谱柱(Sephadex G-200)图;
图4示出了本发明实施例中久制黄精多糖的紫外光谱图;
图5示出了本发明实施例中久制黄精多糖的HPGPC图;
图6示出了本发明实施例中久制黄精多糖的红外光谱图;
图7示出了本发明实施例中久制黄精多糖的单糖组成分析GC-MS图;
图8A示出了本发明实施例中久制黄精多糖的298K氢谱图(
图8B示出了本发明实施例中久制黄精多糖的碳谱图(
图8C示出了本发明实施例中久制黄精多糖的同核化学位移相关谱图(
图8D示出了本发明实施例中久制黄精多糖的异核单量子关系谱图(HSQC图);
图8E示出了本发明实施例中久制黄精多糖的多键碳氢关系谱图(HMBC图);
图8F示出了本发明实施例中久制黄精多糖的异核化学位移相关谱图(NOESY图)。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地说明,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1久制黄精多糖的制备。
久制黄精多糖的制备步骤如图1所示:
1.1制备久制黄精粗多糖:
S1:取干燥后的生多花黄精2500g,用水蒸制12h,水与药材的质量比例为4:1,取出放入干燥箱(50℃)中烘干12h,蒸制和烘干重复9次,每次蒸制和烘干后留出相应蒸制次数的200g药材用于多糖提取,剩余药材进行循环蒸制和烘干。
S2:将经S1得到的“久制”黄精的干燥根茎粉碎成粉末,用水煎煮,“久制”黄精药材粉末与水的体积比是1:4,煎煮温度为100℃,煎煮1h,过滤,得滤液,搅拌下使用80%乙醇沉淀,滤液与80%乙醇体积比为1:4,醇沉温度为室温25-30℃,醇沉时间为1h。5000rpm/min下离心10min,收集沉淀,经冻干即为久制黄精粗多糖,命名为9蒸久制粗多糖。
将S1-S2中的蒸制和烘干步骤重复9次分别替换成1-8次,其余条件不变,产物分别命名为1蒸粗多糖、2蒸粗多糖、3蒸粗多糖、4蒸久制黄精粗多糖、5蒸粗多糖、6蒸粗多糖、7蒸粗多糖、8蒸粗多糖。
将S1中的干燥后的生多花黄精不进行蒸制直接粉碎后进行步骤S2操作,得到的产物命名为0蒸久制黄精粗多糖。
1.2利用MH7A细胞筛选久制黄精粗多糖,具体步骤如下:
1.2.1细胞培养
选用含10%胎牛血清和1%青霉素和链霉素的DMEM细胞培养基,在37℃、5%CO
1.2.2细胞增殖活力测定
使用CCK-8检测试剂盒评估细胞活力。取对数期正常生长的MH7A细胞,消化、离心收集细胞,计数板下计数,制成1×10
久制黄精粗多糖对MH7A细胞增殖的比较结果如图2A所示,与空白组相比,MH7A细胞的存活率随着多糖浓度增加而明显降低,差异有统计学意义(P<0.05)。多糖在50、100、200μg/mL浓度下干预MH7A细胞24h时呈浓度和时间依赖性。可以看出,4蒸久制黄精粗多糖的细胞存活率在50、100μg/mL与0蒸多糖没有太大差异,但都比9蒸久制粗多糖要低,在200μg/mL明显,细胞存活率是4蒸久制黄精粗多糖<0蒸久制黄精粗多糖<9蒸久制粗多糖,说明在细胞活性方面4蒸久制黄精粗多糖>0蒸久制黄精粗多糖>9蒸久制粗多糖。
1.2.3久制黄精粗多糖对MH7A细胞的诱导凋亡作用
1.2.3.1荧光显微镜观察久制黄精粗多糖对MH7A细胞的诱导凋亡作用
用荧光显微镜观察凋亡细胞的死亡情况,MH7A细胞悬液加入到6孔板(1×10
1.2.3.2流式细胞仪检测久制黄精粗多糖对MH7A细胞的诱导凋亡作用
MH7A细胞悬液收集后接种到6孔板(1×10
MH7A细胞(1×10
结果如图2BⅠ所示,2BⅠ为荧光显示的细胞凋亡图,2BⅡ为流式细胞仪显示的图谱,对于正常和TNF-α刺激的MH7A细胞,可以观察到完整的细胞核DAPI的微弱荧光染色。而0蒸久制黄精粗多糖、4蒸久制黄精粗多糖和9蒸久制粗多糖(50、100、200μg/mL)处理的MH7A细胞显示出典型的凋亡细胞核形态学变化,如细胞核凝聚、亮度增加和细胞核皱褶。
久制黄精多糖对MH7A细胞细胞周期的影响如图2C所示,与对照组相比,随着0蒸久制黄精粗多糖、4蒸久制黄精粗多糖和9蒸久制粗多糖浓度的增加,可以观察到凋亡率逐渐增加,上述结果提示0蒸、4蒸和9蒸黄精粗多糖可诱导滑膜成纤维细胞凋亡,并且在200μg/mL高浓度时,细胞凋亡率是4蒸久制黄精粗多糖<0蒸久制黄精粗多糖<9蒸久制粗多糖,说明在活性方面4蒸久制黄精粗多糖>0蒸久制黄精粗多糖>9蒸久制粗多糖,证明0蒸久制黄精粗多糖、4蒸久制黄精粗多糖和9蒸久制粗多糖通过诱导MH7A细胞凋亡,从而抑制炎症细胞的增殖、迁移和侵袭来达到抗炎的作用。0蒸、4蒸和9蒸黄精多糖处理细胞24h后,G1期细胞比例呈递增趋势,G2期细胞比例呈递减趋势,结果表明随着0蒸、4蒸和9蒸久制粗多糖浓度的增加,MH7A细胞G0/G1期细胞数量逐渐增多,G2期细胞数量逐渐减少,细胞周期被阻滞于G1期。因此,推测0蒸、4蒸和9蒸久制粗多糖对MH7A细胞是通过阻断G0/G1期细胞周期实现抗炎活性的。
1.2.4划痕实验测定久制黄精粗多糖对MH7A细胞迁移能力的影响
MH7A细胞(1×10
久制粗黄精多糖对MH7A细胞迁移的影响结果如图2DⅠ所示,与对照组(即正常组和模型组)相比,其中正常组为不经TNF-α刺激和给药的细胞,模型组为经TNF-α刺激而不给药的细胞,0蒸久制黄精粗多糖、4蒸久制粗多糖和9蒸久制粗多糖处理的MH7A细胞划痕间隙变宽,表明MH7A细胞的迁移能力下降,且下降程度与多糖剂量呈正相关。并且,如图2DⅡ所示,在50、100、200μg/mL下,细胞迁移率:4蒸久制黄精粗多糖<0蒸久制黄精粗多糖<9蒸久制粗多糖,表明抑制MH7A细胞的迁移活性:4蒸久制黄精粗多糖>0蒸久制黄精粗多糖>9蒸久制粗多糖。
1.2.5 Transwell法评估久制黄精粗多糖对MH7A细胞侵袭能力的影响
将matrigel胶(0.1%)均匀涂在Transwell上室底部膜上,37℃环境下温育30min使基底膜水化,用PBS洗三次。胰蛋白酶消化吹打收集细胞,用PBS和无血清培养基先后洗涤一次,用无血清培养基悬浮细胞,计数,调整浓度为5×10
1.2.6 IL-10,IL-6,IL-1β含量的影响(ELISA)
将MH7A细胞的对数生长期调整为1×10
结果如图2FⅠ、2FⅡ和2FⅢ所示,其中图2FⅠ、图2FⅡ和图2FⅢ分别为TNF-α诱导的MH7A细胞中IL-6、IL-6和IL-1β的产生水平,可以看出TNF-α模型组IL-6和IL-1β水平较空白对照组明显升高,IL-10明显降低,说明免疫调节细胞模型建立成功。用不同浓度的0蒸、4蒸和9蒸多花黄精多糖(50、100、200μg/mL)作用细胞后显著降低MH7A细胞中IL-6和IL-1β的水平,增加MH7A细胞中IL-10的水平(与对照组相比,p<0.05)。结果表明,0蒸、4蒸和9蒸黄精多糖可通过抑制TNF-α诱导的MH7A细胞中IL-6和IL-1β的上调以及增加IL-10的分泌,有效防止大规模异常炎症反应。并且,在50、100、200μg/mL下,IL-6和IL-1β的上调以及增加IL-10的分泌:4蒸久制黄精粗多糖<0蒸久制黄精粗多糖<9蒸久制黄精粗多糖,表明抗炎免疫活性:4蒸久制黄精粗多糖>0蒸久制黄精粗多糖>9蒸久制黄精粗多糖。以上说明0蒸、4蒸和9蒸久制黄精粗多糖的抗RA作用在一定程度上是通过抑制促炎细胞因子的分泌和增加以及促进抗炎性因子的分泌而达到的。
从以上实验可知,4蒸久制黄精粗多糖在抑制MH7A细胞活性中具有更佳的性能,以下实施例以4蒸久制黄精粗多糖为例进行实验。
实施例2 4蒸久制黄精粗多糖的纯化分离。
2.1取实施例1中制得并经细胞实验筛选的4蒸久制黄精粗多糖配制成浓度为10mg/mL的久制黄精粗多糖溶液,使用DEAE-52阴离子交换柱层析(3.5×30cm),洗脱液采用0、0.05、0.1、0.2、0.3、0.4、0.5、1.0mol/L的NaCl溶液,流速为2.0mL/min,通过苯酚-硫酸比色法检测洗脱液中多糖含量,收集含多糖洗脱液,得久制黄精多糖精提液,得到3个组分,分别是0mol/L NaCl组分、0.05mol/L NaCl组分和0.1mol/L NaCl组分,其余0.2、0.3、0.4、0.5、1.0mol/L的NaCl组分未得到多糖组分。
4蒸久制黄精多糖的DEAE-52阴离子交换柱层析洗脱结果如图3A所示,0、0.05、0.1、0.2、0.3、0.4、0.5、1.0mol/L的NaCl溶液洗脱共接收了560个试管,每个浓度各80个试管,每管25mL,收集吸光度值超过0.2的试管中的含糖洗脱液,0.05mol/LNaCl组分和0.1mol/LNaCl组分收集后经透析除盐。
2.2将2.1中4蒸久制黄精多糖精提液(0.1mol/LNaCl组分)经过葡聚糖凝胶色谱柱(Sephadex G-200,1.6×40cm)纯化,洗脱液为纯水,流速为0.2mL/min,通过苯酚-硫酸比色法检测洗脱液中多糖含量,收集含多糖洗脱液,经真空冷冻干燥,得久制黄精多糖。得到的葡聚糖凝胶色谱如图3B所示,用纯水洗脱了40管,每管10mL,收集吸光度值超过0.2的试管中的含糖洗脱液。
经上述步骤处理,4蒸久制黄精多糖的提取率为0.65%。
实施例3对4蒸久制黄精多糖的理化性质进行分析。
3.1采用蒽酮-硫酸法测定实施例2所得久制黄精多糖的碳水化合物含量,其具体方法如下:
取经干燥至恒重的无水葡萄糖对照品33mg,精密称定,置100mL量瓶中,加水溶解并稀释至刻度,摇匀,即得(每1mL中含无水葡萄糖0.33mg)。精密量取对照品溶液0.2mL、0.4mL、0.6mL、0.8mL、1.0mL,分别置10mL离心管中,各加水至1.0mL,摇匀,在冰水浴中缓缓滴加0.2%蒽酮-硫酸溶液4mL,混匀。放冷后置100℃沸水浴中加热20min。取出,立即置冰水浴中冷却10min,582nm波长处测定吸光度。以吸光度为纵坐标,浓度为横坐标,绘制标准曲线。称取久制黄精多糖冻干粉各5mg,用纯水溶解成0.5mg/mL的多糖溶液,取各溶液0.3mL,分别置于10mL试管中。测定各样品溶液的吸光度,计算多糖含量。
经测定,实施例2所得的4蒸久制黄精多糖中碳水化合物含量为85.94%,所用仪器为SHIMADZU UV-2550紫外可见分光光度仪。
3.2采用间羟基联苯法测定实施例2所得的4蒸久制黄精多糖的糖醛酸含量。
称量0.955g四硼酸钠溶于100mL浓硫酸中。称量0.015g间羟基联苯,溶于0.5%的NaOH溶液中,定容至10mL。精密称取无水半乳糖醛酸5mg,加纯水溶解并用10mL容量瓶定容,得0.5mg/mL半乳糖醛酸标准溶液。精密移取上述葡萄糖标准溶液0、0.2、0.4、0.6、0.8、1.0mL分别置于10mL试管中,各管用双蒸水补充至1.0mL,将试管置于冰浴中逐滴加入冷却的5mL硼酸盐溶液,振荡混匀后将其放入沸水浴中20min,取出后冷却至室温。加入每管100μL间羟基联苯溶液,混匀后放置30min。精密称取久制黄精多糖冻干粉各5mg,用纯水溶解成0.5mg/mL的多糖溶液,取各溶液0.3mL,分别置于10mL试管中。于525nm波长下测定吸光度值。
经测定,实施例2所得的4蒸久制黄精多糖中糖醛酸含量为0.89%,所用仪器为SHIMADZU UV-2550紫外可见分光光度仪。
3.3采用UV扫描测定实施例2所得的4蒸久制黄精多糖的紫外吸收情况,结果如图4所示,经检测,所得到的4蒸久制黄精多糖的UV扫描谱中无色素、蛋白和核酸的吸收峰,所用仪器为SHIMADZU UV-2550型紫外可见分光光度仪,扫描范围为200~800nm。
3.4采用HPGPC法测定实施例2所得的4蒸久制黄精多糖的均一性和相对分子量。
具体步骤如下:
首先测定分子量分别为1、5、12、50、150kDa的Dextran系列葡聚糖标准品在相同条件下的保留时间,利用Agilent GPC数据分析软件制作分子量标准曲线,然后根据标准曲线计算多糖样品的相对分子量Mw。
测试条件:Agilent 1260 Infinity系统;SRT SEC-150(7.8×300mm)色谱柱;流动相双蒸水;进样量10μL;流速0.8mL/min;柱温35℃;示差折光检测器。
经检测,结果如图5所示,实施例2所得到的4蒸久制黄精多糖为均一多糖,其相对分子质量为37.46kDa。
3.5采用红外光谱仪分析实施例2所得的4蒸久制黄精多糖的特征基团。
称取2.0mg左右干燥的多糖样品,用200mgKBr粉末混合压片后在Nicolet 5700FT-IR型傅里叶红外光谱仪上扫描分析,扫描范围为4000cm
经检测结果如图6所示,实施例2所得到的久制黄精多糖具有多糖的特征峰,O-H残基的伸缩振动出现在3450cm
实施例4 4蒸久制黄精多糖的化学结构鉴定。
具体方法如下:
4.1采用GC-MS法测定实施例2所得的久制黄精多糖的单糖组成。
将干燥的4蒸久制黄精多糖样品(20mg)经2mL 2M TFA在100℃反应6h,甲醇旋干,然后溶解在2mL无水DMSO中,超声溶解,加入60mgNaOH,在35℃下搅拌2h,搅拌下缓慢滴加1mL CH
GC条件:采用BR-17色谱柱(0.25μm×250μm×30m);
载气:高纯氦气(纯度99.999%)和高纯氮气(纯度99.999%);
柱流量:1.0mL/min;采用分流式进样,入口温度250℃。温度程序设定为:初始温度为60℃,20℃/min升温至100℃保持2min,然后4℃/min升温至180℃。
MS条件:EI离子源,电子能量70eV,离子源温度为220℃,输电线路温度为280℃,四级杆温40℃。全扫描模式,扫描范围m/z 40~600,质谱标准库:NIST 11.L。
经检测结果如图7所示,图7中1为鼠李糖,2为葡萄糖,3为甘露糖,4为半乳糖,5为半乳糖醛酸,6为正十六烷。实施例2所得到的纯化后的4蒸久制黄精多糖由葡萄糖、甘露糖、半乳糖、鼠李糖和半乳糖醛酸组成,摩尔比为46.67:5.03:19.32:1.25:7.73。
4.2采用甲基化分析实施例2所得的4蒸久制黄精多糖的糖苷键类型。
具体步骤如下:
称取10mg充分干燥后的4蒸久制黄精多糖,加入2mL无水二甲基亚砜(DMSO)充分溶解,随后加入NaOH粉末,搅拌反应2h,再加入1mL无水碘甲烷,35℃密闭避光反应12h,加适量蒸馏水终止反应,得完全甲基化样品。
取完全甲基化样品置于10mL安瓿瓶中,加入2mol/L三氟乙酸2mL,封管,于100℃下水解6h,室温冷却,将水解液转移至旋蒸瓶内蒸干后,多次加入适量甲醇蒸干,以彻底除去残留的三氟乙酸,之后加入1mL 0.05MNaOH溶液、硼氢化钠30mg,室温条件下反应12h,用100μL的乙酸中和至中性,并将反应液置于旋转蒸发仪上蒸干;向反应液中依次加入1mL的乙酸酐与1mL的吡啶,密塞后于90℃下乙酰化反应2h;反应结束后,反应液二氯甲烷萃取乙酰化产物,萃取物用无水硫酸钠去除残余水分,进行GC-MS测定。
GC条件:采用BR-17色谱柱(0.25μm×250μm×30m);
载气:高纯氦气(纯度99.999%)和高纯氮气(纯度99.999%);
柱流量:1.0mL/min;采用分流式进样,入口温度250℃。温度程序设定为:初始温度为50℃,25℃/min升温至100℃保持3min,然后4℃/min升温至180℃。
MS条件:EI离子源,电子能量70eV,离子源温度为220℃,输电线路温度为280℃,四级杆温40℃。全扫描模式,扫描范围m/z 40~600,质谱标准库:NIST 11.L。
经检测,实施例2所得到的4蒸久制黄精多糖甲基化产物,见表1,具体的甲基化结构分析如下:
表1
4.3采用NMR法测定实施例2所得的4蒸久制黄精多糖的化学结构特征。
具体步骤如下:
取4蒸久制黄精多糖20mg完全溶于99.9%的D
检测条件:VNMRS600超导核磁共振波谱仪;One NMR probe(5mm)探头;
经检测结果如图8A-8F所示,实施例2所得到的久制黄精多糖是主链由Glcp(3→,→2)Galp(4→,→1)Glcp(2→,→2,4)Manp(6→,→3)Rhap(4→,支链由Glcp(3→,→2)Glcp(6→,→1)Glcp(2→,→2,3)GalAp(4→,→1)Man p(3→,→2)Glcp(3→所构成,其中图8A为298K氢谱图(
表2
综合上述所述分析可得如下结果:4蒸久制黄精多糖组成均一,相对分子质量为37.46kDa,单糖组成分析及甲基化结果表明本发明中的久制黄精多糖含有吡喃型葡萄糖(Glcp)、吡喃型甘露糖(Manp)、吡喃型半乳糖(Galp)、吡喃型鼠李糖(Rhap)和吡喃型半乳糖醛酸(GalAp),其摩尔比为46.67:25.03:19.32:1.25:7.73;核磁分析结果表明糖残基构型为α和β型,其一级结构单元含有→2)-α-D-GalAp(3,4→,→3)-α-D-Glcp,→3)-α-L-Rhap(4→,→2)-β-D-Galp(4→,→2)-α-D-Glcp(3→,→2)-α-D-Glcp(6→,→1)-β-D-Glcp(2→,→2,4)-α-D-Manp(6→,→1)-β-D-Manp(3→9种糖残基,9种糖残基的连接方式如下:其中,n:m=2:1。
尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的精神和范围。
