冠状病毒的抗体或其抗原结合片段
文献发布时间:2023-06-19 18:35:48
技术领域
本发明涉及一种冠状病毒的抗体或其抗原结合片段,编码该抗体或其抗原结合片段的核酸分子,包含该核酸分子的载体,包含该载体的宿主细胞,以及该抗体或其抗原结合片段制备治疗或预防冠状病毒所导致的疾病的药物方面的应用,以及在检测产品方面的应用,属于生物医药领域。
背景技术
新型冠状病毒肺炎(2019-nCOV),是由SARS-COV-2新型冠状病毒引起的急性呼吸道传染病。该病毒传播能力极强,可经呼吸道、接触等多途径传播给全世界的公共卫生安全带来严峻挑战。
SARS-CoV-2病毒属于冠状病毒科,与2003年暴发的SARS冠状病毒同属β属冠状病毒,氨基酸同源性高达77.2%。SARS-CoV-2病毒的主要包膜蛋白是其刺突蛋白(也称Spike蛋白,简称S蛋白),在病毒感染过程中被细胞内的蛋白酶水解成S1和S2两部分。其中S2是跨膜蛋白,S1具有识别和结合细胞受体血管紧张素转换酶-2(ACE-2)的受体结合区(ReceptorBinding domain,简称RBD)。S1和S2构成的刺突蛋白是SARS-CoV-2病毒特异性识别、结合靶细胞受体,并介导病毒感染的病毒受体,同时也是待开发的中和抗体的识别靶点。
目前为止,全世界尚无有效的药物和疫苗来治疗和预防SARS-CoV-2病毒感染,临床上对新冠肺炎患者只能采取支持性的对症治疗。研究表明,临床上使用病毒特异性的康复人血浆,可有效中和病毒,防止病毒在体内各器官扩散,对病人病程的转归也起了重要作用。但多抗血浆不仅来源有限,同时其临床应用也受到诸如难以质控、供受体血型差异、潜在的传染性因子等条件的限制。从新冠肺炎康复者体内分离可中和SARS-CoV-2病毒的全人源单克隆抗体,可有效克服上述问题,是目前新冠病毒药物开发的主要方向之一。
截止到目前,国内外多个研究团队报道,从新冠肺炎康复者外周血中分离获得可结合SARS-CoV-2病毒S蛋白的全人源单克隆抗体,如BD-368-2,B38等,目前尚处于实验研发阶段。这些研究团队所采用的技术方法是利用重组表达的SARS-CoV-2病毒的S蛋白或S蛋白受体结合区(RBD)为钓饵,从康复者外周血中筛选分离出可结合这些蛋白的B细胞(记忆B细胞),利用细胞测序或单细胞测序的方法获得单个B细胞所表达抗体的重链和轻链配对基因,通过体外重组的方式表达出抗体后,再对其中和病毒的能力进行验证。由于该方法在进行抗体基因测序前,利用标记蛋白(上述被称作钓饵的重组表达的SARS-CoV-2病毒的S蛋白或S蛋白受体结合区)预先对B细胞进行筛选和富集,因此只有特异性结合标记蛋白的抗体才能被筛选出来。
黄竞荷博士(本申请的发明人之一)于2013年首创的人B细胞体外单克隆培养与高通量抗体筛选技术(Huang J et al.Nature Protocols 2013),从新冠肺炎康复者外周血中分离全人源单克隆抗体,其流程为:首先利用SARS-CoV-2和SARS-CoV假病毒中和体系检测新冠肺炎康复者血清的中和抗体,筛选出对SARS-CoV-2和SARS-CoV同时具有较高中和活性的康复者;然后采集康复者的外周血淋巴细胞,利用流式细胞分选出记忆性B淋巴细胞;将单个B细胞接种到384孔板中,并加入细胞因子和饲养细胞培养,培养的B细胞在体外扩增分化后分泌抗体到上清中。然后利用体外高通量中和实验检测上清中的抗体对SARS-CoV-2和SARS-CoV病毒的中和能力,筛选出可同时中和这两种病毒的阳性克隆,利用RT-PCR的方法克隆出抗体的重链和轻链可变区,并构建至抗体重链、轻链表达载体后,转染293T细胞表达纯化出单克隆抗体。
其他团队目前所报道的抗体虽然对测试的SARS-CoV-2病毒毒株有较好的中和能力,但由于SARS-CoV-2病毒是RNA病毒,在传播流行过程中病毒的基因组序列容易产生突变。当这些抗体所识别的非保守区域位点发生突变,产生新的流行毒株时,会导致抗体失去对突变病毒的保护效果。
因此,本领域技术人员仍然希望能够开发出新的对于包括SARS-CoV-2病毒在内的冠状病毒具有结合能力和中和能力的抗体。
发明内容
为解决上述技术问题,本发明一方面提供了一种冠状病毒的抗体,或其抗原结合片段,包含重链可变区和轻链可变区,所述重链可变区包含三个重链互补决定区HCDR1、HCDR2和HCDR3,所述轻链可变区包含三个轻链互补决定区LCDR1、LCDR2和LCDR3;其中:
所述HCDR1的序列通式为:GX
所述HCDR2的序列通式为:X
优选的,所述HCDR3的序列通式为:ARDLIX
所述LCDR1的序列为QGISSY,所述LCDR2的序列为AAS;
所述LCDR3的序列通式为:QQLNSYPPX
在本发明的一个优选实施方案中,所述HCDR1的序列如SEQ ID NO.1所示,所述HCDR2的序列如SEQ ID NO.2所示,所述HCDR3的序列如SEQ ID NO.3所示;并且,所述LCDR1的序列如SEQ ID NO.5所示,所述LCDR2的序列如SEQ ID NO.6所示,所述LCDR3的序列如SEQID NO.7所示;或者,
所述HCDR1的序列如SEQ ID NO.11所示,所述HCDR2的序列如SEQ ID NO.12所示,所述HCDR3的序列如SEQ ID NO.13所示;并且,所述LCDR1的序列如SEQ ID NO.15所示,所述LCDR2的序列如SEQ ID NO.16所示,所述LCDR3的序列如SEQ ID NO.17所示。
在本发明的另一个优选实施方案中,所述重链可变区具有如SEQ ID NO.4所示序列或者与所述SEQ ID NO.4所示序列有80%以上的序列同源性的序列,且所述轻链可变区具有如SEQ ID NO.8所示序列或者与所述SEQ ID NO.8所示序列有80%以上的序列同源性的序列;或者,
所述重链可变区具有如SEQ ID NO.14所示序列或者与所述SEQ ID NO.14所示序列有80%以上的序列同源性的序列,且所述轻链可变区具有如SEQ ID NO.18所示序列或者与所述SEQ ID NO.18所示序列有80%以上的序列同源性的序列。
在本发明的一个优选实施方案中,所述HCDR1的序列如SEQ ID NO.21所示,所述HCDR2的序列如SEQ ID NO.22所示,所述HCDR3的序列如SEQ ID NO.23所示;并且,所述LCDR1的序列如SEQ ID NO.25所示,所述LCDR2的序列如SEQ ID NO.26所示,所述LCDR3的序列如SEQ ID NO.27所示;或者,
所述HCDR1的序列如SEQ ID NO.31所示,所述HCDR2的序列如SEQ ID NO.32所示,所述HCDR3的序列如SEQ ID NO.33所示;并且,所述LCDR1的序列如SEQ ID NO.35所示,所述LCDR2的序列如SEQ ID NO.36所示,所述LCDR3的序列如SEQ ID NO.37所示;或者,
所述HCDR1的序列如SEQ ID NO.41所示,所述HCDR2的序列如SEQ ID NO.42所示,所述HCDR3的序列如SEQ ID NO.43所示;并且,所述LCDR1的序列如SEQ ID NO.45所示,所述LCDR2的序列如SEQ ID NO.46所示,所述LCDR3的序列如SEQ ID NO.47所示;或者,
所述HCDR1的序列如SEQ ID NO.51所示,所述HCDR2的序列如SEQ ID NO.52所示,所述HCDR3的序列如SEQ ID NO.53所示;并且,所述LCDR1的序列如SEQ ID NO.55所示,所述LCDR2的序列如SEQ ID NO.56所示,所述LCDR3的序列如SEQ ID NO.57所示;或者,
所述HCDR1的序列如SEQ ID NO.61所示,所述HCDR2的序列如SEQ ID NO.62所示,所述HCDR3的序列如SEQ ID NO.63所示;并且,所述LCDR1的序列如SEQ ID NO.65所示,所述LCDR2的序列如SEQ ID NO.66所示,所述LCDR3的序列如SEQ ID NO.67所示。
在本发明的另一个优选实施方案中,所述重链可变区具有如SEQ ID NO.24所示序列或者与所述SEQ ID NO.24所示序列有80%以上的序列同源性的序列,且所述轻链可变区具有如SEQ ID NO.28所示序列或者与所述SEQ ID NO.28所示序列有80%以上的序列同源性的序列;或者,
所述重链可变区具有如SEQ ID NO.34所示序列或者与所述SEQ ID NO.34所示序列有80%以上的序列同源性的序列,且所述轻链可变区具有如SEQ ID NO.38所示序列或者与所述SEQ ID NO.38所示序列有80%以上的序列同源性的序列;或者,
所述重链可变区具有如SEQ ID NO.44所示序列或者与所述SEQ ID NO.44所示序列有80%以上的序列同源性的序列,且所述轻链可变区具有如SEQ ID NO.48所示序列或者与所述SEQ ID NO.48所示序列有80%以上的序列同源性的序列;或者,
所述重链可变区具有如SEQ ID NO.54所示序列或者与所述SEQ ID NO.54所示序列有80%以上的序列同源性的序列,且所述轻链可变区具有如SEQ ID NO.58所示序列或者与所述SEQ ID NO.58所示序列有80%以上的序列同源性的序列;或者,
所述重链可变区具有如SEQ ID NO.64所示序列或者与所述SEQ ID NO.64所示序列有80%以上的序列同源性的序列,且所述轻链可变区具有如SEQ ID NO.68所示序列或者与所述SEQ ID NO.68所示序列有80%以上的序列同源性的序列。
关于“序列同源性”的百分比,是通过确定两个序列中存在的氨基酸残基的数目来产生匹配位置的数目,将匹配位置的数目除以比较窗口中位置总数,将结构乘以100从而产生序列的同一性百分比。
在本发明的一个具体实施方案中,上述重链可变区可以在第一氨基酸序列的基础之上进行氨基酸的增减或替代,上述轻链可变区也可以在第二氨基酸序列的基础之上进行氨基酸的增减或替代,例如相似氨基酸的替代或少量氨基酸的增减,特别是在保守序列部分的氨基酸增减或替代,获得的抗体的变体具有较高的同源性(80%以上的同源性),且保留原有的抗体功能,即与冠状病毒特异性结合的功能和性质,这些变体也落入本发明的保护范围之内。
在本发明的一个优选实施方案中,所述抗体或其抗原结合片段的重链氨基酸序列如SEQ ID NO.9所示,轻链氨基酸序列如SEQ ID NO.10所示;或者,
所述抗体或其抗原结合片段的重链氨基酸序列如SEQ ID NO.19所示,轻链氨基酸序列如SEQ ID NO.20所示;或者,
所述抗体或其抗原结合片段的重链氨基酸序列如SEQ ID NO.29所示,轻链氨基酸序列如SEQ ID NO.30所示;或者,
所述抗体或其抗原结合片段的重链氨基酸序列如SEQ ID NO.39所示,轻链氨基酸序列如SEQ ID NO.40所示;或者,
所述抗体或其抗原结合片段的重链氨基酸序列如SEQ ID NO.49所示,轻链氨基酸序列如SEQ ID NO.50所示;或者,
所述抗体或其抗原结合片段的重链氨基酸序列如SEQ ID NO.59所示,轻链氨基酸序列如SEQ ID NO.60所示;或者,
所述抗体或其抗原结合片段的重链氨基酸序列如SEQ ID NO.69所示,轻链氨基酸序列如SEQ ID NO.70所示。
在本发明的一个优选实施方案中,所述抗体或其抗原结合片段为冠状病毒的中和抗体或其抗原结合片段。
术语“中和抗体”是特异性结合病毒受体蛋白的抗体或抗原结合片段,该特异性结合可抑制病毒受体蛋白的生物学功能,如阻止受体蛋白结合其靶细胞受体,可特异性降低病毒感染靶细胞的能力;在本申请中,冠状病毒的中和抗体或其抗原结合片段是指结合冠状病毒的S蛋白的抗体或其抗原结合片段。
术语“抗体”在本文中以最宽的含义使用,涵盖各种结构的天然抗体和人工抗体,包括但不限于单克隆抗体、多克隆抗体、多特异性抗体(例如,双特异性抗体)、单链抗体、完整抗体和呈现期望的抗原结合活性的抗体片段、抗原结合蛋白、融合蛋白等。
在本发明的一个优选实施方案中,所述抗体为单克隆抗体。
在本发明的一个更优选实施方案中,所述抗体为全人源单克隆抗体。
在本发明的一个优选实施方案中,所述抗体的Fc结构域来源于免疫球蛋白的Fc结构域,包括天然序列的Fc结构域或变体Fc结构域。
在本发明的一个优选实施方案中,所述抗体为IgG1、IgG2、IgG3或IgG4中的任意一种或几种的组合。
优选的,所述抗体可以为选自IgG1、IgG2、IgG3或IgG4的完整抗体。
在本发明的一个优选实施方案中,所述抗原结合片段为Fv、Fab、F(ab’)2、Fab’、dsFv、scFv、sc(Fv)2或单链抗体。
在本发明的一个优选实施方案中,所述抗体或其抗原结合片段,可以与其他抗体或其抗原结合片段组合形成具有至少两个抗原结合位点的抗体或其抗原结合片段,即多特异性抗体或其抗原结合片段;所述两个抗原结合位点可以是同一抗原的不同表位,也可以是不同抗原的不同表位。
在本发明的一个优选实施方案中,上述的抗体,或其抗原结合片段可以进一步被化学修饰,例如可以将一个或多个化学基团连接于抗体,以增加抗体的一个或多个功能特性。例如,常见的化学修饰有糖基化修饰和聚乙二醇化修饰等。其中,例如,可以在重链或轻链可变区进行糖基化修饰,增加一个或多个糖基化位点,以改善抗体的部分功能,例如增强抗体的免疫原性或改善抗体的药物动力学等。例如,在合适的条件下,将抗体或其抗原结合片段与活性的聚乙二醇(例如聚乙二醇的活性酯或醛衍生物)进行酰化反应或烷基化反应实现聚乙二醇化修饰,以改善抗体的部分功能,例如增加抗体的生物(如血清)半衰期等。上述的化学修饰不显著改变本发明抗体或其抗原结合片段的基本功能和性质,即与冠状病毒特异性结合的功能和性质;这些经过化学修饰后的变体也落入本发明的保护范围之内。
在本发明的一个优选实施方案中,上述的抗体或其抗原结合片段可以通过化学方法或者基因工程的方法与其他因子缀合;例如这些因子可以提供将抗体靶向所需功能位点的作用或其他性能;例如这些因子可以为一个或多个异源分子,优选的,异源分子为细胞毒性剂。上述的抗体,或其抗原结合片段与其他因子缀合形成的复合物,落入本发明的保护范围之内。
本发明另一方面提供了一种核酸分子,其中,所述核酸分子编码如上述的抗体,或其抗原结合片段。
在本发明的一个优选实施方案中,所述核酸分子中,编码所述重链可变区的核酸序列如SEQ ID NO.71所示,编码所述轻链可变区的核酸序列如SEQ ID NO.72所示;或者,
编码所述重链可变区的核酸序列如SEQ ID NO.75所示,编码所述轻链可变区的核酸序列如SEQ ID NO.76所示;或者,
编码所述重链可变区的核酸序列如SEQ ID NO.79所示,编码所述轻链可变区的核酸序列如SEQ ID NO.80所示;或者,
编码所述重链可变区的核酸序列如SEQ ID NO.83所示,编码所述轻链可变区的核酸序列如SEQ ID NO.84所示;或者,
编码所述重链可变区的核酸序列如SEQ ID NO.87所示,编码所述轻链可变区的核酸序列如SEQ ID NO.88所示;或者,
编码所述重链可变区的核酸序列如SEQ ID NO.91所示,编码所述轻链可变区的核酸序列如SEQ ID NO.92所示;或者,
编码所述重链可变区的核酸序列如SEQ ID NO.95所示,编码所述轻链可变区的核酸序列如SEQ ID NO.96所示。
在本发明的一个更优选实施方案中,所述核酸分子中,
编码重链的核酸序列如SEQ ID NO.73所示,编码轻链的核酸序列如SEQ ID NO.74所示;或者,
编码重链的核酸序列如SEQ ID NO.77所示,编码轻链的核酸序列如SEQ ID NO.78所示;或者,
编码重链的核酸序列如SEQ ID NO.81所示,编码轻链的核酸序列如SEQ ID NO.82所示;或者,
编码重链的核酸序列如SEQ ID NO.85所示,编码轻链的核酸序列如SEQ ID NO.86所示;或者,
编码重链的核酸序列如SEQ ID NO.89所示,编码轻链的核酸序列如SEQ ID NO.90所示;或者,
编码重链的核酸序列如SEQ ID NO.93所示,编码轻链的核酸序列如SEQ ID NO.94所示;或者,
编码重链的核酸序列如SEQ ID NO.97所示,编码轻链的核酸序列如SEQ ID NO.98所示。
本发明还一方面提供了包含上述核酸分子的载体。
在本发明的一个优选实施方案中,所述载体还包括与上述核酸分子连接的表达调控序列。
术语“载体”一词指的是,可将编码某蛋白的多聚核苷酸插入其中并使该蛋白获得表达的一种核酸运载工具。载体可通过转化、转导或转染宿主细胞,使其携带的遗传物质元件在宿主细胞内得以表达。载体可以包含多种控制表达的元件,例如启动子序列、转录起始序列、增强子序列、选择元件及报告基因等。另外,载体还可含有复制起始位点。载体还有可能包括协助其进入细胞的成分,如病毒颗粒、脂质体或蛋白外壳,但不仅仅只有这些物质。在本发明的实施方案中,载体可以选自,但不限于:质粒、噬菌粒、柯斯质粒、人工染色体(如酵母人工染色体YAC、细菌人工染色体BAC或P1来源的人工染色体PAC)、噬菌体(如λ噬菌体或M13噬菌体)以及用作载体的动物病毒,例如,逆转录病毒(包括慢病毒)、腺病毒、腺相关病毒、疱疹病毒(如单纯疱疹病毒)、痘病毒、杆状病毒、乳头瘤病毒、乳头多瘤空泡病毒(如SV40)。
本发明还一方面提供了包含上述载体的宿主细胞。
关于“宿主细胞”,可以选择,但不限于:大肠杆菌或枯草菌等原核细胞,酵母细胞或曲霉菌等真菌细胞,S2果蝇细胞或Sf9等昆虫细胞,或者纤维原细胞、CHO细胞、COS细胞、NSO细胞、HeLa细胞、BHK细胞、HEK293细胞等动物细胞模型。
优选的,所述宿主细胞为HEK293细胞。
本发明还一方面提供了一种生产如上述的抗体,或其抗原结合片段的方法,其中,培养上述的宿主细胞,以生产所述的抗体,或其抗原结合片段。
本发明还一方面提供了一种药物组合物,其中,所述药物组合物包含上述的抗体,或其抗原结合片段。
在本发明的一个优选实施方案中,所述药物组合物包含治疗有效量的中和抗体,或其抗原结合片段,以及药用载体或稀释剂。本领域技术人员可以采用适当的药用载体或者稀释剂,与治疗有效量的所述中和抗体,或其抗原结合片段组合,施用于患者,用于治疗或预防冠状病毒所导致的疾病。
本发明还一方面提供了上述的抗体,或其抗原结合片段,或者上述的药物组合物,在制备治疗或预防冠状病毒所导致的疾病的药物方面的用途。
在本发明的一个优选实施方案中,所述用途是指在制备治疗或预防SARS-CoV-2、SARS-CoV或类SARS冠状病毒所导致的疾病的药物方面的用途。
本发明一方面还提供了治疗或预防治疗或预防冠状病毒所导致的疾病的方法,向患者施用治疗有效量的上述的抗体,或其抗原结合片段;或者向患者施用包含有治疗有效量的上述的抗体,或其抗原结合片段的药物组合物。优选的,冠状病毒所导致的疾病是SARS-CoV-2、SARS-CoV或类SARS冠状病毒所导致的疾病。
本发明还一方面提供了一种检测产品,其中,所述检测产品包含如上述的抗体,或其抗原结合片段。
所述检测产品用于检测冠状病毒在样品中的存在或水平。
在本发明的一个具体实施方案中,所述检测产品包括,但不限于,检测试剂、检测试剂盒、检测芯片或试纸等。
本发明的上述抗体或其抗原结合片段可以通过化学方法或者基因工程的方法进行标记,标记后的抗体或其抗原结合片段可以用于检测;标记后的抗体或其抗原结合片段,落入本发明的保护范围之内。
具体的检测方法,可以采用以下步骤,1)提供样品;2)将所述样品与上述本发明的冠状病毒的抗体或其抗原结合片段进行接触;3)检测样品与抗体或其抗原结合片段之间的免疫反应。
发明人利用B细胞体外单克隆培养和高通量抗体筛选技术获得了一系列冠状病毒的抗体及其抗原结合片段,这些抗体及其抗原结合片段对于SARS-CoV-2病毒具有强效结合能力和中和能力,并且均能够识别并结合SARS-CoV-2病毒的S1蛋白及其RBD,有非常强的亲和力,由此可以推测本发明的一系列冠状病毒的抗体及其抗原结合片段对于其他冠状病毒,以及未来可能出现的冠状病毒也可能具有结合能力和中和能力,未来具有良好的临床应用前景。
附图说明
图1为单抗4L12识别SARS-CoV-2病毒的S1蛋白及其RBD,和S2蛋白的检测结果;
图2为单抗12F5识别SARS-CoV-2病毒的S1蛋白及其RBD,和S2蛋白的检测结果;
图3为单抗3D13识别SARS-CoV-2病毒的S1蛋白及其RBD,和S2蛋白的检测结果;
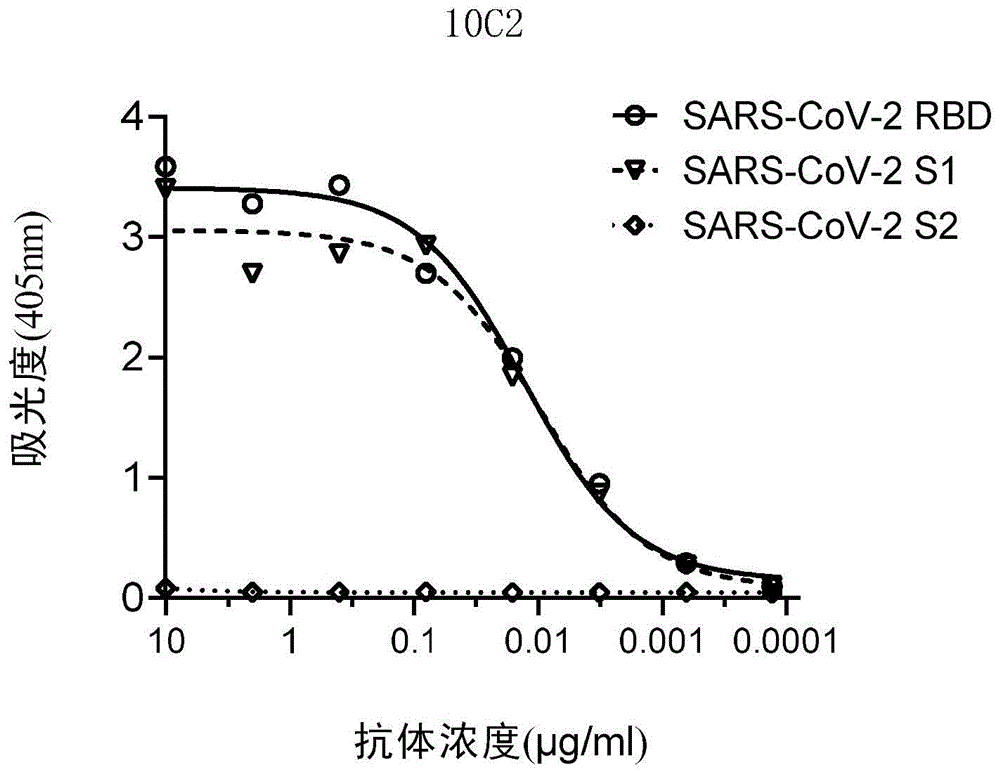
图4为单抗10C2识别SARS-CoV-2病毒的S1蛋白及其RBD,和S2蛋白的检测结果;
图5为单抗16L9识别SARS-CoV-2病毒的S1蛋白及其RBD,和S2蛋白的检测结果;
图6为单抗20E21识别SARS-CoV-2病毒的S1蛋白及其RBD,和S2蛋白的检测结果;
图7为单抗22H22识别SARS-CoV-2病毒的S1蛋白及其RBD,和S2蛋白的检测结果;
图8为单抗4L12结合SARS-CoV-2病毒的S1蛋白的RBD的亲和力检测结果;
图9为单抗12F5结合SARS-CoV-2病毒的S1蛋白的RBD的亲和力检测结果;
图10为单抗3D13结合SARS-CoV-2病毒的S1蛋白的RBD的亲和力检测结果;
图11为单抗10C2结合SARS-CoV-2病毒的S1蛋白的RBD的亲和力检测结果;
图12为单抗16L9结合SARS-CoV-2病毒的S1蛋白的RBD的亲和力检测结果;
图13为单抗20E21结合SARS-CoV-2病毒的S1蛋白的RBD的亲和力检测结果;
图14为单抗22H22结合SARS-CoV-2病毒的S1蛋白的RBD的亲和力检测结果。
具体实施方式
以下将结合附图所示的具体实施方式对本发明进行详细描述。但这些实施方式并不限制本发明,本领域的普通技术人员根据这些实施方式所做出的结构、方法、或功能上的变换均包含在本发明的保护范围内。
现在将参考附图更全面地描述示例实施方式。然而,示例实施方式能够以多种形式实施,且不应被理解为限于在此阐述的实施方式;相反,提供这些实施方式使得本发明将全面和完整,并将示例实施方式的构思全面地传达给本领域的技术人员。
下面实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件(例如参考J.萨姆布鲁克等著,黄培堂等译的《分子克隆实验指南》第三版,科学出版社)或按照产品说明书进行。
实施例1:冠状病毒的抗体的筛选和检测
发明人对2020年1月20日至2020年2月26日收治在发明人所在单位(上海市公共卫生临床中心)的新型冠状病毒肺炎患者(康复出院两周后随访)的血浆进行假病毒中和实验筛选,发现其中三名轻症患者的血清对于SARS-CoV-2假病毒中和活性很强,经发明人所在单位伦理委员会及患者本人书面同意,抽取其外周血进行研究。
1、外周血记忆B细胞的分选
1)分离外周血淋巴细胞:抽取上述患者恢复期的外周血与等量的生理盐水混合后,采用淋巴细胞分离液Lymphoprep(Stemcell Technologies,货号07851)分离外周血淋巴细胞,操作过程参见淋巴细胞分离液说明书。
2)分选外周血记忆B细胞:采用抗体混合物对上述步骤1)分离的外周血淋巴细胞在4℃和暗处染色30min,其中,抗体混合物为抗CD19-PE-Cy7(BD Bioscience)、IgA-APC(Jackson Immunoresearch)、IgD-FITC(BD Bioscience)和IgM-PE(JacksonImmunoresearch)构成的混合物;染色后,用10ml PBS-BSA缓冲液洗涤,并重悬浮在500μlPBS-BSA中;最后用FACSAria III细胞分选仪(Becton Dickinson)分选出CD19+IgA-IgD-IgM-记忆B细胞。
2、外周血记忆B细胞的孵育
将上述分选出的CD19+IgA-IgD-IgM-记忆B细胞重悬浮于含有10%FBS和100U/mlIL-2、50ng/ml IL-21以及辐照过的3T3-msCD40L饲养细胞的培养基中;将记忆B细胞以4个细胞/孔的密度接种在384孔微量滴定板中(终体积为50μl),孵育13天;生长因子IL-2和IL-21刺激记忆B细胞分裂生长,分泌抗体到孵育的培养液中。具体培养方法见参考文献HuangJ et al.Nature Protocols 2013,8(10):1907-15。
3、SARS-CoV-2和SARS-CoV假病毒的生产
SARS-CoV-2和SARS-CoV假病毒是表面分别具有SARS-CoV-2和SARS-CoV刺突膜蛋白(Spike,S),并携带荧光素酶报告基因的非复制缺陷型逆转录病毒颗粒,它们可以分别模拟SARS-CoV-2、SARS-CoV病毒对宿主细胞(如人肝癌细胞系Huh-7、稳定表达人ACE2受体的293T细胞系293T-ACE2)的感染过程,并在感染细胞内表达荧光素酶报告基因。由于假病毒感染无法产生成熟的病毒颗粒,因此可以安全地在生物安全二级实验室内进行相关操作。
SARS-CoV-2和SARS-CoV假病毒分别通过各自的S蛋白表达质粒和带荧光素酶报告基因的HIV Env缺陷的骨架质粒(pNL4-3.Luc.R-E-)共转染293T细胞获得。SARS-CoV-2和SARS-CoV的S基因序列根据NCBI GenBank序列NC_045512和ABD72979.1设计,基因序列经密码子优化后,由南京金斯瑞公司合成,并连接到pcDNA3.1真核表达载体构建成SARS-CoV-2和SARS-CoV S蛋白表达质粒。pNL4-3.Luc.R-E-骨架质粒源自美国NIH AIDSReagentProgram。所有质粒通过转化DH5α感受态细胞扩增,并利用美基生物生产的质粒纯化试剂盒纯化,纯化操作过程参照试剂盒说明书。
293T细胞在含10%胎牛血清(Gibco)的DMEM培养基培养,转染前接种到10cm细胞平皿中。培养24小时后,利用EZ Trans细胞转染试剂(李记生物)将骨架质粒(pNL4-3.Luc.R-E-)与表达SARS-CoV或SARS-CoV-2质粒以3:1的比例共转染293T细胞,详细转染方法参见EZ Trans细胞转染试剂的使用说明书。转染48小时后,收取含有假病毒的上清液,1500转离心10分钟去除细胞碎片后并分装冻存于-80℃冰箱,用于中和抗体的检测。
4、中和筛选
外周血记忆B细胞在体外培养13天后,每孔收集40μl培养上清液用于检测SARS-CoV-2和SARS-CoV的中和抗体。检测方法如下:取20μl培养上清与20μl上述生产获得的假病毒的上清液,在384孔细胞培养板中混合,室温孵育30分钟后,每孔加入50μl 5000个293T-ACE2细胞并继续在细胞培养箱内培养。48小时后,利用荧光素酶检测试剂盒(LuciferaseAssay System,Promega Cat.#E1500)裂解细胞并检测每孔的荧光素酶活性,具体检测方法参照试剂盒说明书。利用多功能酶标仪(Perkin Elmer)检测每孔化学发光RLU值。根据培养上清与病毒对照RLU值的比例计算培养上清对假病毒的中和抑制百分比,筛选出抑制百分比大于90%的孔作为病毒中和阳性孔。
5、RT-PCR扩增重链和轻链基因
病毒中和阳性孔的B细胞,利用RT-PCR扩增免疫球蛋白基因的重链和轻链的可变区。RT-PCR的引物设计和具体操作过程见参考文献Tiller,T.et al.J.Immunol Methods2018,329:112–124.扩增获得的抗体重链和轻链可变区基因经琼脂糖凝胶电泳纯化回收后,利用PMD19-T vector克隆试剂盒(Takara 6013)克隆到PMD19-T载体中,具体操作过程参见试剂盒说明书,并挑选出单克隆进行基因测序。
6、单克隆抗体的表达和纯化
测序正确的抗体重链可变区基因与pCMV/R-10E8重链基因(NIHAIDSReagentProgram Cat 12290)分别经Age I和Sal I酶切后,连接胶纯化回收后的目的片段并转化DH5α感受态细胞构建抗体表达重链质粒;测序正确的抗体Lambda或Kappa轻链可变区基因与pCMV/R-10E8 Lambda轻链基因表达质粒(NIHAIDS Reagent Program Cat 12291)或pCMV/R-N6 Kapp轻链基因表达质粒(NIH AIDS Reagent Program Cat 12966)分别经AgeI和Xho I或Age I和BsiwI酶切后,连接胶纯化回收后的目的片段并转化DH5α感受态细胞构建抗体表达轻链质粒;抗体重链、轻链质粒经质粒纯化试剂盒(美基生物)纯化(参见图1为表达纯化的抗体SDS-PAGE检测结果),并利用EZ Trans细胞转染试剂(李记生物)以1:1的比例共转染293T细胞表达。72小时后,收集细胞转染上清,利用protein-G柱(天地人和生物科技公司,常州)纯化上清中的抗体IgG,纯化方法参照protein-G柱的使用说明。纯化获得的抗体IgG利用Nanodrop 2000(Thermo Fisher)测定280nm吸光值并计算抗体浓度。
通过上述1-6部分,本申请发明人获得了数个IgG抗体,本申请公开其中7个抗体(名称依次为:4L12、12F5、3D13、10C2、16L9、20E21和22H22)。
7个抗体的氨基酸序列编号信息如下表1:
表1
7个抗体的核苷酸序列编号信息如下表2:
表2
7、本申请的7个单抗(4L12、12F5、3D13、10C2、16L9、20E21和22H22)对SARS-CoV-2冠状病毒的中和活性的检测
在96孔细胞板上测试不同浓度的单抗抑制假病毒感染Huh-7细胞来检测单抗对SARS-CoV-2冠状病毒中和能力。
检测方法如下:1)Huh-7细胞接种于96孔细胞板,每孔接种1X10
结果参见下表3。
表3
从表3中可以看出,4L12、12F5、3D13、10C2、16L9、20E21、22H22这7个单抗在ng/ml级别的浓度下就能很好地中和SARS-CoV-2病毒,中和活性非常强。中和活性越强,应用时的抗体用量就越少,成本越低。因此,4L12、12F5、3D13、10C2、16L9、20E21、22H22这7个抗体有较好的临床应用前景。
8、本申请的7个单抗(4L12、12F5、3D13、10C2、16L9、20E21和22H22)识别SARS-CoV-2病毒的S1蛋白及其RBD蛋白的检测
上述纯化获得的7个单抗对SARS-CoV-2病毒的S1和RBD蛋白的识别,依次通过酶联免疫吸附(ELISA)的方法检测。
检测方法如下:将1μg/ml的抗原蛋白(义翘神州)包被于96孔ELISA板中,4℃过夜。用PBS-T溶液(0.2%吐温-20)洗板5次,每孔加入300μl封闭液(PBS,1%FBS,5%milk)室温封闭1小时。PBS-T洗板3次,将单抗用PBS稀释液(PBS,5%FBS,2%BSA,1%Tween-20)进行5倍系列稀释后,取100μl样本加入到ELISA板中,37℃孵育1小时。PBS-T洗板5次,每孔加入100μl用PBS稀释液1:2500稀释的辣根过氧化物酶标记的山羊抗人IgG抗体(JacksonImmunoresearch),室温孵育1小时。PBS-T洗板5次,加入150μlABTS显色底物(ThermoFisher),室温避光显色30分钟后,通过酶标仪读取405nm波长的吸光度值。
参见图1,单抗4L12识别SARS-CoV-2病毒的S1蛋白及其RBD,和S2蛋白的检测结果;
参见图2,单抗12F5识别SARS-CoV-2病毒的S1蛋白及其RBD,和S2蛋白的检测结果;
参见图3,单抗3D13识别SARS-CoV-2病毒的S1蛋白及其RBD,和S2蛋白的检测结果;
参见图4,单抗10C2识别SARS-CoV-2病毒的S1蛋白及其RBD,和S2蛋白的检测结果;
参见图5,单抗16L9识别SARS-CoV-2病毒的S1蛋白及其RBD,和S2蛋白的检测结果;
参见图6,单抗20E21识别SARS-CoV-2病毒的S1蛋白及其RBD,和S2蛋白的检测结果;
参见图7,单抗22H22识别SARS-CoV-2病毒的S1蛋白及其RBD,和S2蛋白的检测结果。
从图1-7可以看出,单抗4L12、12F5、3D13、10C2、16L9、20E21和22H22均能够识别并结合SARS-CoV-2病毒的S1蛋白及其RBD(保守区域);鉴于冠状病毒的S1蛋白的RBD是ACE2受体结合的区域,其具有高度保守性,由此可以推测到,本申请的单抗4L12、12F5、3D13、10C2、16L9、20E21和22H22除了对于SARS-CoV-2病毒有强结合能力与中和能力以外,对于其他冠状病毒,以及未来可能出现的冠状病毒也可能具有结合能力和中和能力。
8.生物膜层干涉技术检测本申请的7个单抗(4L12、12F5、3D13、10C2、16L9、20E21和22H22)与SARS-CoV-2病毒的S1蛋白的RBD的结合能力
为了检测本申请的7个单抗与SARS-CoV-2病毒的S1蛋白的RBD之间的相互作用,采用生物膜层干涉技术对它们之间的结合动力学进行检测,检测过程在OctetRED96(Fortebio)仪器上进行。
检测方法如下:提前将AHC探针在无菌水中浸泡10分钟进行平衡,检测的过程全部在30℃的反应条件下进行,可以分为以下五个步骤,1)调零:将探针浸入在无菌水中作用60秒获得检测基线;2)捕获抗体:将探针浸入10μg/ml的单抗溶液中作用200秒捕获抗体;3)再次调零:将探针浸入缓冲液(加入0.02%Tween20的PBS溶液)中作用120秒去除未结合的抗体;4)结合RBD:将探针浸入起始浓度为100nM、3倍梯度稀释的RBD蛋白溶液中,作用300秒得到单抗与RBD结合的动态曲线;5)结合解离:将探针放入缓冲液中作用300秒。蛋白的结合引起生物膜厚度的变化,导致干涉光波发生相对位移,被光谱仪检测到,形成干涉光谱,以干涉图谱的实时位移(nm)显示出来。以此检测RBD与本申请的单抗结合解离的动态曲线。在数据分析时样本孔的数据减去缓冲液对照孔的数据,扣除缓冲溶液的非特异性干扰,采用1:1结合模型,对不同的RBD稀释浓度下与单抗的结合进行整体曲线拟合,得到平均结合常数K
检测结果参见图8-14,依次为单抗4L12、12F5、3D13、10C2、16L9、20E21和22H22结合SARS-CoV-2病毒的S1蛋白的RBD的亲和力检测结果;每幅图中都有五条曲线,这五条曲线代表该单抗与五种不同浓度RBD的动态结合解离曲线。
从图8-14可以看出,本申请的7个单抗4L12、12F5、3D13、10C2、16L9、20E21和22H22均与SARS-CoV-2病毒的S1蛋白的RBD结合呈浓度梯度依赖;结合后进行解离,解离的RBD非常少;7个单抗4L12、12F5、3D13、10C2、16L9、20E21和22H22的K
应当理解,虽然本说明书按照实施方式加以描述,但并非每个实施方式仅包含一个独立的技术方案,说明书的这种叙述方式仅仅是为清楚起见,本领域技术人员应当将说明书作为一个整体,各实施方式中的技术方案也可以经适当组合,形成本领域技术人员可以理解的其他实施方式。
上文所列出的一系列的详细说明仅仅是针对本发明的可行性实施方式的具体说明,它们并非用以限制本发明的保护范围,凡未脱离本发明技艺精神所作的等效实施方式或变更均应包含在本发明的保护范围之内。
