一种用于治疗原位肝癌的载D-乳酸新型仿生靶向纳米制剂及其制备方法
文献发布时间:2023-06-19 18:37:28
技术领域
本发明涉及药物制备技术领域,具体是一种用于治疗原位肝癌的载D-乳酸新型仿生靶向纳米制剂及其制备方法。
背景技术
近年来,研究表明肠道菌群及其代谢产物的存在干预了肝脏免疫耐受微环境的形成,与肿瘤的发生、发展、转移及耐药性也密切相关。据文献报道,肠道菌群的种类、数量可以预测免疫检查点抑制剂的抗肿瘤疗效,而特定菌群能够调控I CI疗效,利用辅助ICI菌群有助于克服ICI治疗耐药性。另外,肠道菌群产生的代谢产物可进入血液循环并调控宿主的生理机能。
例如,2018年《Science》杂志报道了一项研究,发现梭状芽胞杆菌可控制小鼠肠道胆汁代谢,生成的次级胆酸可加强肝脏趋化因子C-X-Cmot i f l igand16(CXCL16)蛋白的表达,而CXCL16可募集自然杀伤T细胞抑制肝癌的发生和发展。
2020年《Science》杂志报道了小肠内假单胞杆菌可释放代谢产物肌苷磷酸和次黄嘌呤,透过肠道屏障分布于循环系统中,并在其他共刺激佐剂存在的情况下激活T细胞腺苷受体相关信号通路,进一步激活抗肿瘤T细胞反应,抑制了结直肠癌、膀胱癌和黑色素瘤的生长。可见,通过调控肠道菌群及其代谢产物改善肿瘤微环境对提高抗肿瘤免疫治疗功效至关重要。
2020年《Ce l l Host&M icrobe》杂志报道了一项研究,发现肠道菌群代谢产物D-乳酸是一种重要的免疫调节剂,其通过肝门静脉进入肝脏,改变枯否细胞的形态,增加了其表面积和体积;而形态变化后的枯否细胞增强了对病原体的捕获和杀伤能力,提升了对肝脏中病原体的清除功效。
然而,肠道菌群产生的D-乳酸的水平极低,且经肝门静脉进入血液循环导致其非特异性分布广,积累在肝脏部位的D-乳酸不足以激活抗肿瘤免疫反应。因此,靶向递送外源性D-乳酸进入肝脏,增加其在肿瘤部位的蓄积,是发挥其诱导TAM转化、改善免疫抑制性肿瘤微环境的可行方案。近年来,纳米粒显示了改善药物溶解性、降低毒副作用、增加靶向递送性和缓释性等优势。因此,利用纳米载体可实现D-乳酸靶向肝脏肿瘤中TAM的特异性递送。
聚乳酸乙醇酸共聚物是一种可降解的高分子有机化合物,具有良好的生物相容性、较低的免疫原性、良好的成囊和成膜性能,已被广泛应用于药物递送与肿瘤免疫治疗领域。近年来,生物膜对纳米粒的仿生修饰也为纳米粒的应用增加了优势,生物膜的修饰可使纳米粒伪装成内源性物质,减少网状内皮系统的摄取,延长其血液循环时间,增加其组织靶向递送性能。例如,通过肿瘤细胞膜包覆的纳米粒,具有肿瘤细胞同源归巢的天然属性,可提高纳米粒在肿瘤病灶处的蓄积量,同时,肿瘤细胞膜表面携带肿瘤相关抗原,可介导肿瘤疫苗效应。因此,利用仿生纳米粒促进长循环、靶向递送外源性D-乳酸,有望成为实现肠道菌群代谢产物免疫治疗抗肝癌的有效策略。
发明内容
本发明的目的在于提供一种用于治疗原位肝癌的载D-乳酸新型仿生靶向纳米制剂及其制备方法,以解决背景技术中的问题。
为实现上述目的,本发明提供如下技术方案:
一种用于治疗原位肝癌的载D-乳酸新型仿生靶向纳米制剂,包括以下原料:聚乳酸类材料、有机溶剂、D-乳酸、磷酸盐缓冲液和表面活性剂。
在上述技术方案的基础上,本发明还提供以下可选技术方案:
在一种可选方案中:所述聚乳酸类材料的浓度为10%-20%且分子量为20000-100000。
在一种可选方案中:聚乳酸类材料包括聚乳酸、聚乳酸-羟基乙酸共聚物和聚乳酸-聚乙烯醇共聚物。
在一种可选方案中:所述有机溶剂为二氯甲烷、乙酸乙酯和丙酮中任意一种或几种的混合。
在一种可选方案中:所述表面活性剂为聚乙烯醇、胆酸钠和乳化剂T-20中的任意一种;所述表面活性剂的浓度为0.1%-2%。
一种如上述所述的用于治疗原位肝癌的载D-乳酸新型仿生靶向纳米制剂的制备方法,包括以下步骤:步骤一:将聚乳酸类材料溶解于有机溶剂作为油相,D-乳酸溶解于磷酸盐缓冲液中作为内水相,将表面活性剂溶解于超纯水中作为外水相;步骤二:将内水相倒入油相中,在冰浴条件下超声制备油包水型初乳液,将所述初乳液倒入其中一部分含有一定量表面活性剂的外水相中,冰浴条件下超声制备水包油包水型预复乳液,然后将预复乳液倒入另一部分含有一定量表面活性剂的外水相中,得到复乳液;步骤三:将所述复乳液进一步溶剂挥发固化,得到装载D-乳酸的聚乳酸纳米颗粒;步骤四:提取肝癌肿瘤细胞膜,通过脂质体挤出器,反复挤压,将细胞膜包覆于装载D-乳酸的聚乳酸纳米颗粒表面,形成肝癌肿瘤细胞膜包覆的装载D-乳酸的聚乳酸仿生纳米制剂;步骤五:将含有靶向多肽的溶液与包覆细胞膜的仿生纳米制剂垂直混悬,经过后插入法,将靶向多肽插入到细胞膜的脂质双分子层中,形成靶向多肽修饰的装载D-乳酸的聚乳酸仿生靶向纳米制剂。
在一种可选方案中:所述步骤二中内水相和油相的体积比为1:5-1:20;所述初乳超声时间为20-80s,超声强度为50%,且超声方式为脉冲式。
在一种可选方案中:所述复乳超声时间为60-180s,所述复乳超声强度为50%,超声方式为脉冲式。
在一种可选方案中:所述步骤三中溶剂挥发固化的固化方式为溶剂挥发法或溶剂扩散法;步骤四中细胞膜为肝癌细胞膜,聚碳酸酯膜孔径为100nm-1μm。
在一种可选方案中:所述步骤五中所述靶向多肽为肿瘤相关巨噬细胞靶向配体,垂直混悬时间为1-4h。
相较于现有技术,本发明的有益效果如下:
本发明通过调整油相与水相的比例,通过超声制备初乳液的方式,使初乳液在纳米制剂形成过程中能够融合,形成内腔,包埋D-乳酸;并通过细胞膜仿生修饰,利用癌细胞的归巢效应赋予纳米制剂靶向肿瘤部位的能力,进一步采用M2型TAM靶向多肽,使其精确靶向肿瘤相关巨噬细胞。
与未靶向的纳米制剂相比,显著提高了载D-乳酸仿生靶向纳米制剂的靶向M2型巨噬细胞的能力;
并有效逆转M2型巨噬细胞的表型,降低M2型巨噬细胞标志物Arg-1、CD206和I L-10等,增加了M1型巨噬细胞标志物TNF-α、IL-1β和IL-12等。
同时体内抗肿瘤实验中;同时体内抗肿瘤实验中,该纳米制剂能在原位肝癌和自发性肝癌中发挥强有力的药效,逆转M2型肿瘤相关巨噬细胞表型,重塑肿瘤微环境,抑制了原位肝癌和自发性肝癌的发生发展,延长了荷瘤小鼠的生存期,体现了载D-乳酸仿生靶向纳米制剂的良好免疫治疗抗肝癌的功效。
本发明针对D-乳酸的药理作用及其理化性质设计了聚乳酸-羟基乙酸装载D-乳酸的纳米颗粒,采用超声乳化结合溶剂挥发法制备了均一可控、小粒径、分散性好的可包埋装载D-乳酸的聚乳酸纳米颗粒,并在纳米颗粒表面包覆肝癌肿瘤细胞膜,修饰靶向M2型肿瘤相关巨噬细胞(TAM)靶向多肽,形成仿生靶向纳米制剂,提高D-乳酸的靶向递送,增强纳米制剂的免疫原性,实现载D-乳酸纳米制剂激活抗肝癌免疫反应,有效抑制原位肝癌和自发性肝癌的发生发展。
附图说明
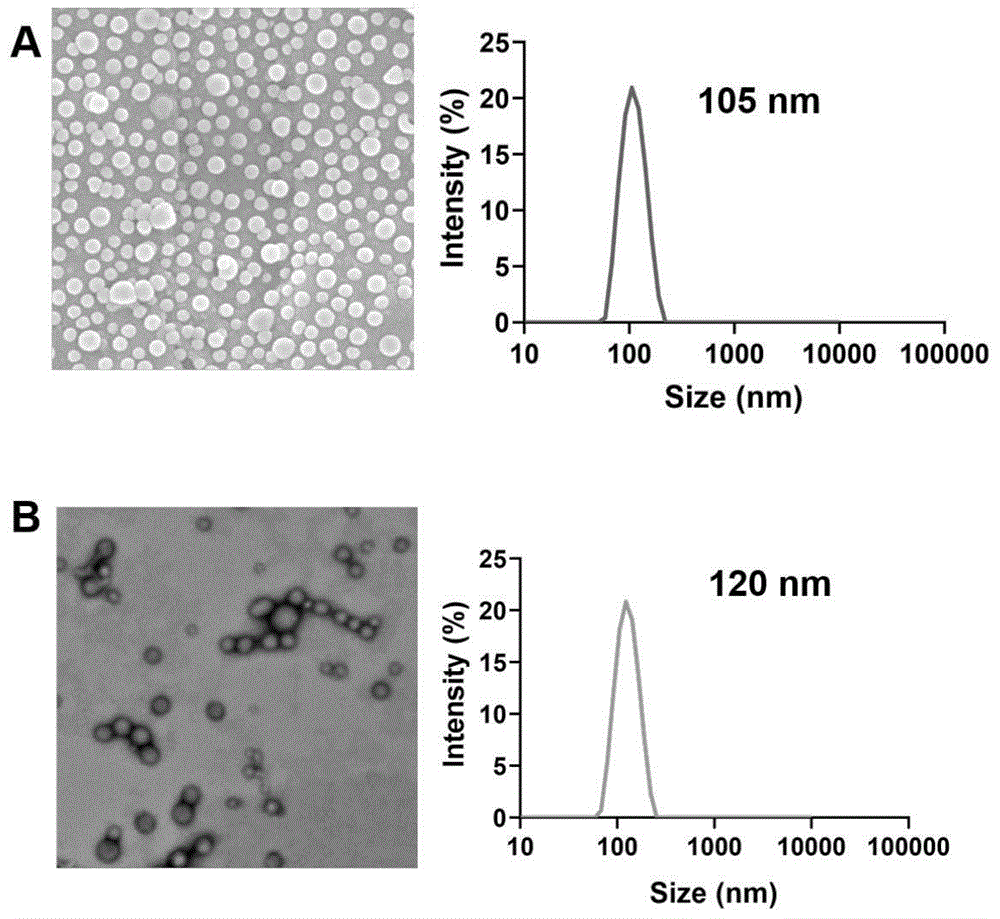
图1是本发明所制备的载D-乳酸仿生靶向纳米制剂的形貌图与粒径分布图,其中A是装载D-乳酸的PLGA纳米制剂扫描电镜图和粒径分布图,B是载D-乳酸仿生靶向纳米制剂的透射电镜图和粒径分布图。
图2是本发明所制备的载D-乳酸仿生靶向纳米制剂在与M2型巨噬细胞共孵育后,靶向修饰的纳米制剂与非靶向修饰的纳米制剂被M2型巨噬细胞摄取的显示图。
图3是本发明所制备的载D-乳酸仿生靶向纳米制剂M2型巨噬细胞共孵育后,M2型巨噬细胞标志物Arg-1、CD206和I L-10等和M1型巨噬细胞标志物TNF-α、I L-1β和I L-12的mRNA表达水平图。
图4是静脉注射载D-乳酸仿生靶向纳米制剂后,免疫荧光定量原位肝癌肿瘤微环境中M2型肿瘤相关巨噬细胞标志物(A)和M1型肿瘤相关巨噬细胞标志物的表达(B)。
图5是静脉注射载D-乳酸仿生靶向纳米制剂后,抑制原位肝癌发展的结果统计图;其中,A是肝癌肿瘤细胞在肝脏部位的生物发光强度,B是肿瘤组织中坏死细胞数量,C是小鼠生存率。
图6静脉注射载D-乳酸仿生靶向纳米制剂后,抑制自发性肝癌发展的结果统计图;其中,A是肝癌肿瘤重量,B是小鼠生存率。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。本发明所列举的各实施例仅用以说明本发明,并非用以限制本发明的范围。对本发明所作的任何显而易知的修饰或变更都不脱离本发明的精神与范围。
采用以下技术方案:
第一方面,本发明提供了一种装载D-乳酸的聚乳酸纳米制剂,所述装载D-乳酸的聚乳酸纳米制具有粒径小且均一、分散性良好的特点;纳米制剂表面包覆肝癌肿瘤细胞膜,且修饰了靶向M2型TAM的靶向多肽,具有靶向肿瘤微环境中M2型TAM的能力和激活免疫抗肝癌的作用。
所述聚乳酸类仿生靶向纳米制剂制备粒径为70-130nm,例如可以是70nm、80nm、85nm、90nm、95nm、100nm、105nm、110nm、115nm、120nm、125nm或130nm。
当所述聚乳酸类纳米制剂粒径越小,越容易被细胞摄取,例如粒径为80-130nm时,纳米制剂被细胞摄取的量会更大,而且粒径越小的纳米粒,还可通过EPR效应更多的进入肿瘤组织,纳米制剂发挥其免疫抗肝癌的可能性越大。
所述载D-乳酸聚乳酸类仿生靶向纳米制剂粒径分散系数范围为0.1-0.3,例如可以是0.1、0.15、0.2、0.25或0.3。
所述载D-乳酸聚乳酸类仿生靶向纳米制剂的仿生修饰为肝癌肿瘤细胞膜,例如可以是Hepa1-6、H22、Huh7或HepG2细胞。
所述载D-乳酸聚乳酸类仿生靶向纳米制剂靶向M2型TAM的靶向修饰配体,包括但不限于半乳糖、甘露糖、M2pep多肽或清道夫受体。
第二方面,还提供了一种载D-乳酸聚乳酸类仿生靶向纳米制剂的制备方法,该方法包括以下步骤:
(1)将聚乳酸类材料溶解于有机溶剂作为油相,D-乳酸溶解于磷酸盐缓冲液(PBS)中作为内水相,将表面活性剂溶解于超纯水中作为外水相;
(2)将内水相倒入油相中,在冰浴条件下超声制备油包水型初乳液,将内水相倒入油相中,在冰浴条件下超声制备油包水型初乳液,将所述初乳液倒入其中一部分含有一定量表面活性剂的外水相中,冰浴条件下超声制备水包油包水型预复乳液,然后将预复乳液倒入另一部分含有一定量表面活性剂的外水相中,得到复乳液;
(3)将所述复乳液进一步溶剂挥发固化,得到装载D-乳酸的聚乳酸纳米颗粒。
(4)提取肝癌肿瘤细胞膜,通过脂质体挤出器,通过不同孔径的聚碳酸酯膜反复挤压,将细胞膜包覆于装载D-乳酸的聚乳酸纳米颗粒表面,形成肝癌肿瘤细胞膜包覆的装载D-乳酸的聚乳酸仿生纳米制剂;
(5)将含有靶向多肽的溶液与包覆细胞膜的仿生纳米制剂垂直混悬,经过后插入法,将靶向多肽插入到细胞膜的脂质双分子层中,形成靶向多肽修饰的装载D-乳酸的聚乳酸仿生靶向纳米制剂。
在步骤(1)中,所述聚乳酸材料包括但不限于聚乳酸(PLA)、聚乳酸-羟基乙酸共聚物(PLGA)、聚乳酸-聚乙烯醇共聚物(PELA)等,优选为聚乳酸-羟基乙酸共聚物(PLGA);所述聚乳酸材料的浓度为10%-20%;所述聚乳酸类材料的分子量为20000-100000。
在步骤(1)中,所述有机溶剂为二氯甲烷、乙酸乙酯、丙酮中任意一种或其组合物,优选为二氯甲烷。
所述表面活性剂为聚乙烯醇(PVA)、胆酸钠或乳化剂T-20任意一种;所述表面活性剂的浓度为0.1%-2%,例如可以是0.1%、0.2%、0.3%、0.4%、0.5%、0.6%、0.7%、0.8%、0.9%、1%、1.5%或2%,优选为0.5%-2%。
在步骤(2)中,所述内水相和油相的体积比为1:5-1:20,例如可以是1:5、1:6、1:7、1:8、1:9、1:10、1:20,优选为1:10。
在的步骤(2)中,所述初乳超声时间为20-80s,例如可以是20s、40s、60s、80s,优选为60s。
所述初乳超声强度为50%,超声方式为脉冲式。
在的步骤(2)中,所述复乳超声时间为60-180s,优选为120s。
所述复乳超声强度为50%,超声方式为脉冲式。
在步骤(3)中,所述固化方式为溶剂挥发法或溶剂扩散法。
在步骤(4)中,所述细胞膜为肝癌细胞膜,例如可以是Hepa1-6、H22、Huh7或HepG2细胞。
在步骤(4)中,所述聚碳酸酯膜孔径为100nm-1μm,优选为100nm-400nm;所述挤压次数为9-15次。
在步骤(5)中,所述靶向多肽为肿瘤相关巨噬细胞靶向配体,例如可以是半乳糖、甘露糖、M2pep多肽或清道夫受体。
在步骤(5)中,所述垂直混悬时间为1-4h。
实施例1
配置一定量的D-乳酸的PBS水溶液作为内水相(W1),0.5%的胆酸钠水相作为外水相(W3),配置一定量的黄芩苷的PBS水溶液作为内水相(W1),称取一定量的聚乳酸-聚乙醇酸共聚物(PLGA)溶于1mL的二氯甲烷中,作为油相(O),把100μL溶解好的含D-乳酸的内水相加入1mL油相中,冰水浴超声乳化制备油包水型初乳液(W1/O),然后将其倒入6mL含胆酸钠水相(W2)中,冰水浴超声60s乳化制备得到预复乳液(W1/O/W2),将预复乳液倒入9mL含0.5%胆酸钠水相(W3)中,冰水浴超声120s,超声强度均为50%,制备粒径小且均一的复乳液(W2/O/W3),随后置于通风橱中搅拌固化过夜。固化的纳米制剂采用超纯水离心洗涤3-5次,即制得装载D-乳酸的聚乳酸-聚乙醇酸共聚物(PLGA)纳米制剂;
如图1A所示,载D-乳酸的PLGA纳米粒分散性好,PDI 0.131,粒径105nm,D-乳酸苷包封率为22%,D-乳酸装载率为6.7μg/mg。
实施例2
将实施例1中装载D-乳酸的PLGA纳米制剂作为内核,肝癌细胞膜作为外壳包覆在其表面。准确称取5mg载D-乳酸的PLGA纳米制剂,取1mg肝癌细胞膜溶液,将两者按1:1混合,之后经过800nm、400nm、200nm、100nm聚碳酸酯膜逐级挤压,将细胞膜包覆在纳米制剂表面,然后将含有10μL靶向多肽的溶液与1mL包覆细胞膜的仿生纳米制剂共混后在4℃条件下垂直混悬4h,将靶向多肽插入到细胞膜的脂质双分子层中,形成靶向多肽修饰的装载D-乳酸的聚乳酸仿生靶向纳米制剂,如图1B所示。
实施例3
共聚焦显微镜(CLSM)定性表征装载D-乳酸的聚乳酸仿生靶向纳米制剂的细胞摄取。在细胞摄取的研究中,将巨噬细胞与5mg/mL纳米制剂共孵育一定时间后,采用共聚焦显微镜观察细胞对仿生纳米颗粒的摄取,以非靶向纳米制剂为对照。首先,将巨噬细胞以5×10
结果如图2所示,与对照组非靶向纳米制剂相比,靶向修饰的纳米制剂被M2型巨噬细胞更多的摄取。
实施例4
装载D-乳酸的聚乳酸仿生靶向纳米制剂诱导M2型巨噬细胞向M1型转化的研究。向收集的M2型巨噬细胞中加入含纳米制剂(DL@NP@M)的培养基,以PBS组和游离的D-乳酸(Free DL)为对照,刺激24小时后,收集细胞,提取样品mRNA;RT-qPCR技术对M2型和M1型巨噬细胞相关的高表达标志物(CD206、I L-10、Arg-1、TNF-α、I L-1β和I L-12)的mRNA表达水平进行检测。
结果如图3所示,装载D-乳酸的聚乳酸仿生靶向纳米制剂(DL@NP@M)显著下调了M2型巨噬细胞高表达标志物CD206、I L-10、Arg-1的mRNA表达水平,同时上调了M1型巨噬细胞高表达标志物TNF-α、IL-1β和IL-12的mRNA表达水平,表明装载D-乳酸的聚乳酸仿生靶向纳米制剂可以有效诱导M2型巨噬细胞向M1型转化。
实施例5
静脉注射载D-乳酸仿生靶向纳米制剂后,免疫荧光定量原位肝癌肿瘤微环境中M2型肿瘤相关巨噬细胞表型转化研究。首先构建原位肝癌荷瘤小鼠,以一定的给药程序静脉注射载D-乳酸仿生靶向纳米制剂(DL@NP@M),在最后一针给药后的7-10天,取小鼠肿瘤组织,免疫荧光法检测肿瘤局部肿瘤相关巨噬细胞表面标志的表达;M2型肿瘤相关巨噬细胞采用F4/80、CD206和Arg-1荧光抗体标记,M1型肿瘤相关巨噬细胞采用F4/80、CD86和iNOS荧光抗体标记,共聚焦显微镜观察相关标志物表达情况。结果显示载D-乳酸仿生靶向纳米制剂(DL@NP@M)显著下调了M2型巨噬细胞高表达标志物CD206和Arg-1的表达水平,同时上调了M1型巨噬细胞高表达标志物CD86和i NOS的表达水平,表明装载D-乳酸的聚乳酸仿生靶向纳米制剂体内也可以有效诱导肿瘤微环境中的M2型肿瘤相关巨噬细胞向M1型转化,如图4所示。
实施例6
载D-乳酸仿生靶向纳米制剂体内抑制原位肝癌发展的研究。
C57BL/6小鼠(6-8周)用于体内实验,细胞株Hepa1-6-LUC构建同种移植原位荷瘤小鼠;通过活体成像仪监控肿瘤的发展情况,当肿瘤的荧光素酶强度值达到-5×10
实施例7
载D-乳酸仿生靶向纳米制剂体内抑制诱导自发性肝癌发展的研究。首先选用C57BL/6乳鼠,出生两周后,腹腔注射二乙基亚硝胺(DEN)10mg/kg,间隔一周后,将小鼠随机分笼,每组16只,继续给予含有DEN的饮用水,小鼠每日饮水喂予含30μg/mL DEN的无菌蒸馏水,正常组小鼠喂予无菌蒸馏水,连续造模5个月后,随机取小鼠安乐死后,取其肝脏观察肝癌形成情况,待肝癌建模成功后,以一定的给药程序静脉注射纳米制剂(D-乳酸含量为100mmo l),给药一周后各组取6只小鼠,进行安乐死,取肝脏组织观察纳米制剂抑瘤效果。结果显示,纳米制剂降低了小鼠肝脏中癌组织的重量,显著抑制了肝脏癌组织的形成和发展,并显著延长了小鼠的生存期;如图6所示。
以上所述,仅为本公开的具体实施方式,但本公开的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本公开揭露的技术范围内,可轻易想到变化或替换,都应涵盖在本公开的保护范围之内。因此,本公开的保护范围应以权利要求的保护范围为准。
