一种孕期肠道菌群代谢紊乱检测物在制备检测NTDs胎儿试剂中的应用
文献发布时间:2023-06-19 18:37:28
技术领域
本发明涉及检测领域,具体涉及一种孕期肠道菌群代谢紊乱检测物在制备检测NTDs胎儿试剂中的应用。
背景技术
妊娠期孕母叶酸缺乏以及代谢紊乱会导致胎儿神经管缺陷(NTDs)。然而,既往研究主要集中在叶酸缺乏引起的胎儿脑基因表达的改变中,而未关注脑代谢物的变化。因此,常规针对NTDs的检测方法包括母血及羊水甲胎蛋白(AFP)检查、AChE酶活性检测等,这些检测方法都存在其优势及劣势,例如:AChE酶活性检测中,其他病证或者血样污染也可能导致假阳性结果。基于现有检测情况,扩展NTDs的检测方法十分有必要。
发明内容
因此,本发明要解决的技术问题在于,如何进一步扩展NTDs的检测方法,从而提供另一种检测思路下的一种孕期肠道菌群代谢紊乱检测物在制备检测NTDs胎儿试剂中的应用。
一种孕期肠道菌群代谢紊乱检测物在制备检测NTDs胎儿试剂中的应用。
所述NTDs胎儿为孕母低叶酸致NTDs胎儿。
所述孕期肠道菌群代谢紊乱检测物用于检测甘油磷脂代谢相关肠道菌群或/和甘油磷脂合成相关代谢物。
所述甘油磷脂代谢相关肠道菌群包括厚壁菌门和/或拟杆菌属。
甘油磷脂合成相关代谢物包括甘油磷脂合成原料,所述甘油磷脂合成原料包括不饱和脂肪酸。
所述不饱和脂肪酸至少包括硬脂酸、油酸、软脂酸和顺-二十碳烯酸中的至少一种。
本发明技术方案,具有如下优点:
1.本发明提供了一种检测NTDs胎儿的新思路,具体的,提供了一种孕期肠道菌群代谢紊乱检测物在制备检测NTDs胎儿试剂中的应用;通过发明人研究首次发现,叶酸缺乏导致孕期母体肠道菌群代谢紊乱与NTDs胎儿脑代谢物之间存在代际间关联的关系,因此可以通过检测孕期母体肠道菌群代谢紊乱情况判断NTDs胎儿脑代谢物的情况,进而判断胎儿是否存在NTDs的情况。本发明可以为NTDs胎儿检测提供另一种检测手段,有效达到了扩展NTDs检测方式的目的。
2.本发明提供的一种孕期肠道菌群代谢紊乱检测物,通过对孕期母体的甘油磷脂代谢相关肠道菌群或/和甘油磷脂合成相关代谢物进行检测,根据相关指标的变化情况,即可用于预期母体内胎儿是否存在NTDs的情况。
附图说明
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
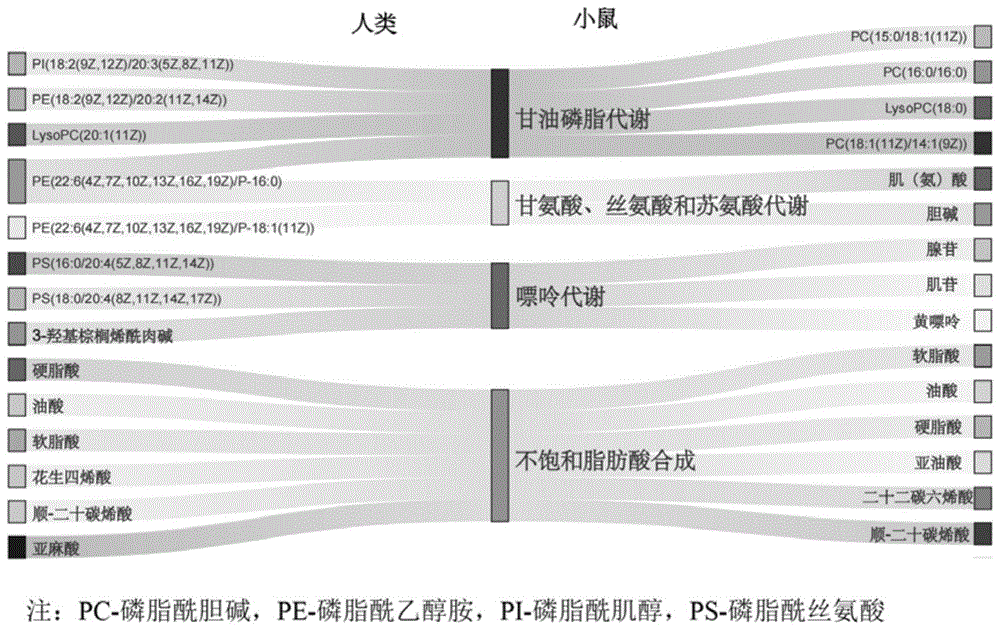
图1是本发明中NTDs胎鼠相较于正常胎鼠脑组织差异代谢物与人NTDs胎儿相较于正常胎儿脑组织差异代谢物的对比图;
图2是本发明中两组孕鼠粪便的差异代谢物代谢谱图;
图3是本发明中两组孕鼠肠道差异菌群及差异代谢物相关性图谱;
图4是本发明中两组孕鼠肠道差异菌群与胎鼠脑甘油磷脂相关代谢物的关联图。
具体实施方式
实施例
获取30名低叶酸致NTDs引产胎儿和30名非病理性引产的健康胎儿脑组织,采用获取的脑组织对脑代谢物进行检测,检测方式为常规液相色谱-质谱联用(LC-MS),具体检测条件如下:
分析仪器为超高效液相色谱(UPLC):ACQUITY UPLC I-Class,沃特世科技有限公司(Waters),
高分辨质谱:VION IMS QTof,沃特世科技有限公司(Waters),
色谱柱:ACQUITY UPLC BEH C18(100mm×2.1mm,1.7um),沃特世科技有限公司(Waters)。
样本前处理过程:
1.精确称取30mg组织样本到1.5ml EP管中,依次加入20μL内标(L-2-氯-苯丙氨酸,0.3mg/mL,甲醇配置),530μL甲醇水溶液(CH3OH:H2Ov:v=4:1);
2.加入两个小钢珠,在-80℃冰箱中放置5min后,放入研磨机中研磨(60Hz,2min);
3.超声提取10min,-20℃静置30min;
4.低温离心10min(13000rpm,4℃),将上清转移到带内衬管的LC-MS进样小瓶中。
5.质控样本(QC)由所有样本的提取液等体积混合制备而成,每个QC的体积与样本相同。
色谱条件如下:
色谱柱:ACQUITY UPLC BEH C18(100mm×2.1mm,1.7um);
柱温:45℃;
流动相:A—水(含0.1%甲酸),B—乙腈(含0.1%甲酸);A与B的洗脱程序为0-2分钟(5-20%B),2-4分钟(20-60%B),4-11分钟(60-100%B),11-13分钟(100% B),13-13.5分钟(100%-5%B),13.5-14.5分钟(5% B)。
流速:0.4mL/min;
进样体积:3μL。
通过对NTDs胎儿和健康胎儿的脑组织代谢物的检测结果对比可知,孕母低叶酸致NTDs引产胎儿与健康胎儿的脑代谢产物中,甘油磷脂代谢及不饱和脂肪酸合成代谢通路相关代谢物在NTDs胎儿脑中明显降低(p<0.05)。
本实施例中通过低叶酸饮食结合MTX诱导建立了NTD小鼠模型,小鼠模型的构建过程如下:
低叶酸饲喂联合甲氨蝶玲注射致胎鼠神经管畸形模型,实验组雌鼠低叶酸饲料喂养4周(对照组正常饲料喂养),雌鼠:雄鼠于按2:1交配,合笼过夜(12小时)后早上8:00见阴道栓定为孕0.5天(E0.5),在孕7.5天(E7.5)给予甲氨蝶呤1.5mg/kg腹腔注射(对照组腹腔注射同等量无菌注射用水),于孕13.5天解剖取NTDs胚胎脑组织。
获取孕鼠低叶酸致NTDs胎鼠与健康胎鼠的脑组织,采用获取的脑组织对脑代谢物进行检测,并由上海鹿明生物科技有限公司提供GC/MS及LC/MS非靶向代谢组分析,对胎鼠脑组织代谢物的检测结果对比可知,孕鼠低叶酸致NTDs胎鼠与健康胎鼠的脑代谢物中,甘油磷脂代谢及不饱和脂肪酸合成代谢通路相关代谢物在NTDs胎鼠脑中明显降低(p<0.05)。
获取NTDs胎鼠与健康胎鼠存在明显差异(p<0.05)的脑代谢物与存在明显差异(p<0.05)胎儿脑组织的差异代谢物进行对比,如图1所示,胎鼠脑组织差异代谢物与胎儿脑组织的差异代谢物对比可知,其中7种为共同差异代谢产物,主要参与甘油磷脂代谢和不饱和脂肪酸生物合成。
肠道菌群及代谢产物是神经系统疾病的潜在治疗靶点,肠道微生物通过肠-脑轴对神经功能有重要的调节作用,因此,可以通过肠道菌群的改变预判神经系统疾病的情况;然而,孕母肠道菌群的改变是否可以调节胎儿脑代谢从而参与胎儿神经管发育,并不清楚。
本发明为了验证孕母肠道菌群的改变与胎儿脑代谢之间的关联关系,进一步获取低叶酸致胎鼠NTDs孕鼠与健康孕鼠的粪便,对粪便进行宏基因组测序及质谱检测,其中,由上海鹿明生物科技有限公司提供GC/MS及LC/MS非靶向代谢组分析,由欧易生物提供宏基因组测序分析,获取粪便的菌群结构及代谢谱,如图2-图4所示。
通过粪便的菌群结构及代谢谱可知,两组孕鼠肠道微生物群组成及代谢物存在差异,具体的,孕鼠粪便代谢谱同样显示甘油磷脂相关代谢物在NTDs组孕鼠粪便中明显降低,与胎鼠脑组织变化趋势相同,如图2所示。大脑中用于甘油磷脂合成的多不饱和脂肪酸是从胃肠道转运至大脑的,胃肠道的代谢物多数由肠道菌群代谢产生,提示肠道菌群代谢可能参与其中,明确了两组孕鼠粪便差异菌群与孕鼠粪便甘油磷脂代谢相关,如图3所示。母体肠道菌群的代谢产物可以通过肠粘膜吸收入血液循环,并通过胎盘、脐带传递给胎儿,显示孕鼠差异菌群与胎鼠脑甘油磷脂相关代谢物之间同样存在相关性,如图4所示;因此,有效证明了母体与胎儿的代际肠脑轴关系链,即母体肠道菌群失调引起肠道甘油磷脂相关代谢物减少,通过母胎循环进入胎儿脑部的甘油磷脂相关代谢物减少,从而影响神经管闭合的进程,参与NTD的发生。
通过上述结果可知,孕期叶酸摄入不足可能通过改变孕母肠道菌群及其代谢产物,进而影响胎儿脑代谢,参与神经管闭合的进程。因此,可以通过对母体的甘油磷脂代谢相关肠道菌群包括厚壁菌门和/或拟杆菌属,或者甘油磷脂合成相关代谢物进行检测,进而用于预测胎儿NTD的发生。
显然,上述实施例仅仅是为清楚地说明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引伸出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
