帕拉米韦注射液杂质C检测方法
文献发布时间:2023-06-19 18:49:33
技术领域
本发明涉及帕拉米韦注射液杂质检测领域,特别涉及帕拉米韦注射液杂质C检测方法。
背景技术
帕拉米韦(Peramivir),是一种新型的抗流感病毒药物,现有临床试验数据证明其对甲型和乙型流感有效。
帕拉米韦原料药合成路线:
具体合成方法是,起始原料在还原剂硼氢化钠作用下发生开环和还原反应生成中间体Ⅰ;中间体Ⅰ和乙酸酐发生酯化反应生成中间体Ⅱ;中间体Ⅱ在氢氧化钠作用下发生水解反应生成中间体Ⅲ;中间体Ⅲ在盐酸作用下脱保护基生成中间体Ⅳ,不分离的中间体Ⅳ直接和起始原料Ⅱ作用生成帕拉米韦粗品,最终经转晶生成帕拉米韦。其重要剂型为静脉注射液。帕拉米韦注射液杂质C主要来源于原料工艺杂质。各国药典均未收载帕拉米韦注射液质量标准,更无帕拉米韦注射液杂质C检测方法;帕拉米韦原料供应商质量标准中的杂质C检测方法采用正相色谱系统,本品为注射液,在正相色谱系统中溶解性差。而仅有国家食品药品监督管理总局收载帕拉米韦氯化钠注射液(100ml:帕拉米韦C
杂质C(对应异构体)的化学名称为(1R,2R,3S,4S)-3-[(1R)-1-(乙酰氨基)-2-乙基丁基]-4-胍-2-羟基环戊烷羧酸三水合物,分子式为C
发明内容
鉴于此,本发明提出帕拉米韦注射液杂质C检测方法,解决上述技术问题。
本发明的技术方案是这样实现的:
帕拉米韦注射液杂质C检测方法,包括以下步骤:采用高效液相色谱法进行检测,测定条件包括:色谱柱:
进一步,磷酸盐缓冲液,每1L磷酸盐缓冲液中含4.75~5.25mmol/L磷酸氢二铵和4.75~5.25mmol/L磷酸二氢铵。
进一步,溶液配制包括:
杂质C定位溶液:取杂质C,精密称定,加溶剂使溶解并稀释至每1ml中含0.015~0.025mg的溶液;
供试品溶液:精密量取帕拉米韦注射液,用溶剂稀释至每1ml中含帕拉米韦0.4~0.6mg的溶液,混匀;
对照溶液:精密量供试品溶液,用溶剂稀释至每1ml中含帕拉米韦0.8~1.2μg的溶液,混匀。
进一步,所述溶剂为水。
进一步,测定法:精密量取供试品溶液、对照溶液及空白溶剂,分别注入液相色谱仪,记录色谱图。
进一步,所述进样体积为:3~5μl。
进一步流动相:5mmol/L磷酸氢二铵和5mmol/L磷酸二氢铵缓冲液。
进一步,所述色谱柱的规格为150mm×4.0mm,5μm。
进一步,检测波长:205nm,柱温:20℃,流速:0.3ml/min,进样体积:4μl。
进一步,杂质C定位溶液:取杂质C,精密称定,加溶剂使溶解并稀释至每1ml中含0.02mg的溶液;
供试品溶液:精密量取帕拉米韦注射液,用溶剂稀释至每1ml中含帕拉米韦0.5mg的溶液,混匀;
对照溶液:精密量供试品溶液,用溶剂稀释至每1ml中含帕拉米韦1μg的溶液,混匀。
与现有技术相比,本发明的有益效果是:
本发明采用反相手性色谱系统,建立帕拉米韦注射液杂质C的检测方法,并对该方法进行了系统的方法学验证,通过了专属性、线性及范围、准确度试验、重复性试验、中间精密度试验、溶液稳定性试验及耐用性试验等考察,能够较好适用于帕拉米韦注射液杂质C检测,有助于提高帕拉米韦注射液质量控制水平。
附图说明
图1本发明方法验证专属性试验中溶剂HPLC图谱;
图2本发明验证专属性试验中空白辅料HPLC图谱;
图3本发明验证专属性试验中杂质O定位溶液HPLC图谱;
图4本发明验证专属性试验中杂质Q定位溶液HPLC图谱;
图5本发明验证专属性试验中杂质S定位溶液HPLC图谱;
图6本发明验证专属性试验中杂质T定位溶液HPLC图谱;
图7本发明验证专属性试验中加标供试品溶液HPLC图谱;
图8本发明验证专属性试验供试品溶液HPLC图谱;
图9本发明验证专属性试验中对照溶液HPLC图谱;
图10本发明验证专属性试验中加标混合溶液HPLC图谱;
图11为本发明线性试验的帕拉米韦线性图;
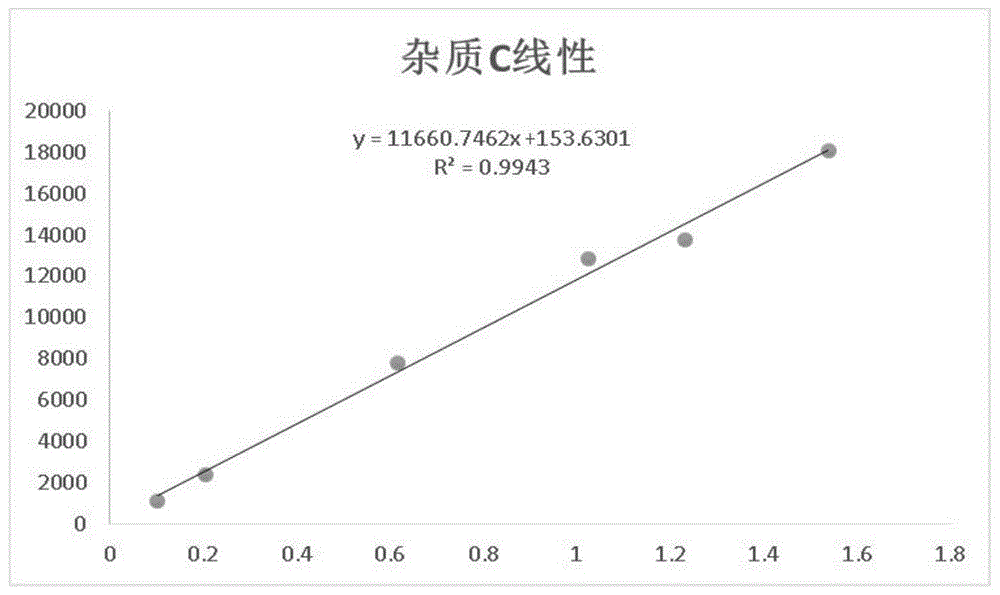
图12为本发明线性试验的杂质C线性图。
具体实施方式
为了更好理解本发明技术内容,下面提供具体实施例,对本发明做进一步的说明。
本发明实施例所用的实验方法如无特殊说明,均为常规方法。
本发明实施例所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例
(一)帕拉米韦注射液杂质C检测方法
采用高效液相色谱法
色谱柱:
检测波长:205nm
柱温:20℃
流速:0.3ml/min
进样体积:4μl
流动相:5mmol/L磷酸氢二铵和5mmol/L磷酸二氢铵缓冲液
溶剂:水
溶液配制:
杂质C定位溶液:取杂质C适量,精密称定,加溶剂使溶解并稀释至每1ml中约含0.02mg的溶液。
供试品溶液:精密量取帕拉米韦注射液1ml,置20ml量瓶中,加溶剂稀释至刻度,摇匀。
对照溶液:精密量供试品溶液1ml,置20ml量瓶中,用溶剂稀释至刻度,摇匀,精密量取1ml,置25ml,用溶剂稀释至刻度,摇匀。
测定法:精密量取供试品溶液、对照溶液及空白溶剂各4μl,分别注入液相色谱仪,记录色谱图。
限度:按不加校正因子的自身对照法计算,杂质C不得过0.2%。
(二)参照中国药典2020年版四部指导原则,对分析方法进行了完整的方法学验证。方法验证内容包括:专属性、线性及范围、准确度试验、重复性试验、中间精密度试验、溶液稳定性试验及耐用性试验。验证使用样品信息见表1。
表1验证使用样品信息
1专属性试验
1.1简述
方法的专属性研究考察峰鉴别和选择性,通过对各杂质进行定位考察,确保杂质C与主峰的分离度符合标准,各杂质均可与主峰及杂质C良好分离,辅料溶液及溶剂不干扰测定。1.2操作方法:
空白辅料溶液:精密量取全辅料溶液1ml,置20ml量瓶中,用溶剂稀释至刻度,摇匀。
杂质O定位溶液:取杂质O约2mg,精密称定,置10ml量瓶中,加溶剂溶解并稀释至刻度,摇匀,作为杂质O的贮备液,精密量取1ml,置20ml量瓶中,用溶剂稀释至刻度,摇匀。
杂质Q定位溶液:取杂质Q约2mg,精密称定,置10ml量瓶中,加溶剂溶解并稀释至刻度,摇匀,作为杂质Q的贮备液,精密量取1ml,置20ml量瓶中,用溶剂稀释至刻度,摇匀。
杂质S定位溶液:取杂质S约2mg,精密称定,置10ml量瓶中,加溶剂溶解并稀释至刻度,摇匀作为杂质S的贮备液,精密量取1ml,置20ml量瓶中,用溶剂稀释至刻度,摇匀。
杂质T定位溶液:取杂质T约2mg,精密称定,置10ml量瓶中,加溶剂溶解并稀释至刻度,摇匀,作为杂质T的贮备液,精密量取1ml,置20ml量瓶中,用溶剂稀释至刻度,摇匀。上述杂质杂质O、杂质Q、杂质S、杂质T的结构式如下表2:
表2
杂质C定位溶液:取杂质C约5mg,精密称定,置50ml量瓶中,加溶剂溶解并稀释至刻度,摇匀,作为杂质C贮备液,精密量取5ml,置25ml量瓶中,加溶剂溶解并稀释至刻度,摇匀。
杂质混合溶液:分别精密量取杂质O、Q、S、T贮备溶液1ml,置10ml量瓶中,加溶剂稀释至刻度,摇匀。
供试品溶液:精密量取帕拉米韦注射液1ml,置20ml量瓶中,加溶剂稀释至刻度,摇匀。
加标供试品溶液:精密量取帕拉米韦注射液和杂质C定位溶液各1ml,置20ml量瓶中,加溶剂稀释至刻度,摇匀。
对照溶液:精密量取加标供试品溶液1ml,置20ml量瓶中,用溶剂稀释至刻度,摇匀,精密量取1ml,置25ml,用溶剂稀释至刻度,摇匀。
加标混合溶液:精密量取帕拉米韦注射液1ml、杂质混合溶液1ml及杂质C定位溶液1ml,置20ml量瓶中,加溶剂稀释至刻度,摇匀,作为加标混合供试品溶液。
精密量取上述空白溶剂、空白辅料溶液、供试品溶液、加标供试品溶液、对照溶液、加标混合溶液及各杂质定位溶液各4μl,分别注入液相色谱仪,记录色谱图。结果见表3及图1-10。
1.3试验结果
表3专属性试验结果
1.4结论
空白溶剂、空白辅料溶液不干扰测定;加标混合溶液中,杂质O、杂质Q不干扰杂质C及主成分的测定,杂质S与杂质C出峰时间重合,严格控制杂质合并计算杂质量,杂质T与杂质S/C的分离度为1.41,小于1.5,但大于1.2,可实现基线分离,该方法的专属性良好。
2线性试验
2.1简述
结合本品合成工艺杂质分析情况,对杂质C进行线性试验。线性试验中,线性相关系数r应大于0.990,Y轴截距与100%理论浓度响应值之比应小于25%。
2.2操作方法
线性贮备溶液:取帕拉米韦三水合物11.5mg,精密称定,置100ml量瓶中,加溶剂溶解并稀释至刻度,摇匀,精密量取1ml和专属试验项下的杂质C贮备液1ml,置50ml量瓶中,用溶剂稀释至刻度,摇匀,作为线性贮备溶液。
分别精密量取线性贮备溶液1ml、3ml、5ml、6ml、7.5ml置不同的10ml量瓶中,用溶剂稀释至刻度,摇匀,分别作为20%、60%、100%、120%、150%的线性溶液。
精密量取上述20%、60%、100%、120%和150%线性溶液各4μl,分别注入液相色谱仪,记录色谱图。以浓度为横坐标,峰面积为纵坐标,用最小二乘法进行线性回归,计算相关系数。结果见表4。
2.3试验结果
表4线性试验结果
2.4结论
帕拉米韦的线性相关系数r为0.99996,大于0.990,Y轴截距与100%理论浓度响应值之比为0.46%,小于25%;杂质C的线性相关系数r为0.99712,大于0.990,Y轴截距与100%理论浓度响应值之比为1.30%,小于25%,杂质C的校正因子为1.05,在0.9~1.1范围内,所以可采用不加校正因子的自身对照法测定。
3定量限及检测限试验
3.1简述
定量限溶液中各峰的信噪比应大于10,各峰保留时间RSD应小于1.0%,峰面积的RSD应小于10%,定量限限度应小于限度的50%或报告限度(取最小值)。定量限溶液中各峰的信噪比应大于3。
3.2操作方法
定量限溶液:精密量取20%线性溶液5ml,置10ml量瓶中,加水稀释至刻度,摇匀。
检测限溶液:精密量取定量限溶液5ml,置10ml量瓶中,加水稀释至刻度,摇匀。
精密量取定量限溶液、检测限溶液各4μl分别注入液相色谱仪中,记录色谱图。结果见表5。
3.3试验结果
表5定量限与检测限试验结果
3.4结论
杂质C的定量限溶液浓度为0.103μg/ml,限度为0.02%,小于0.05%,重复测定6次,信噪比最小为12.71,大于10;保留时间的RSD为0.11%,小于1%;峰面积的RSD为5.59%,小于10%,符合要求。帕拉米韦的定量限溶液浓度为0.115μg/ml,限度为0.02%,小于0.05%,重复测定6次,信噪比最小为13.20,大于10;保留时间的RSD为0.08%,小于1%;峰面积的RSD为4.75%,小于10%,符合要求。检测限溶液中,杂质C和帕拉米韦的信噪比分别为5.96、6.63,大于3,符合要求。
4准确度试验
4.1简述
结合本品合成工艺杂质分析,我们对杂质C进行准确度研究,采用50%、100%、150%浓度对其准确度进行考察,以确保其检测结果的准确性。
4.2操作方法
对照品溶液:精密量取专属试验项下的杂质C定位溶液1ml,置20ml量瓶中,加溶剂定量稀释至刻度,摇匀。平行配制两份。
空白供试品溶液:精密量取帕拉米韦注射液1ml,置20ml量瓶中,加溶剂稀释至刻度,摇匀。
50%回收溶液:精密量取帕拉米韦注射液1ml,置20ml量瓶中,再精密加入专属试验项下的杂质C定位溶液0.5ml,加溶剂稀释至刻度,摇匀加溶剂稀释至刻度,摇匀。(平行配制3份)
100%回收溶液:精密量取帕拉米韦注射液1ml,置20ml量瓶中,再精密加入专属试验项下的杂质C定位溶液1ml,加溶剂稀释至刻度,摇匀加溶剂稀释至刻度,摇匀。(平行配制3份)
150%回收溶液:精密量取帕拉米韦注射液1ml,置20ml量瓶中,再精密加入专属试验项下的杂质C定位溶液1.5ml,加溶剂稀释至刻度,摇匀加溶剂稀释至刻度,摇匀。(平行配制3份)
精密量取上述溶液各4μl,分别注入液相色谱仪,记录色谱图。结果见表6。
4.3试验结果
表6准确度试验结果
4.4结论:
50%-150%回收溶液的回收率平均值为94.0%,在80%-120%范围内,RSD为2.77%。小于10%,准确度良好。
5耐用性试验
5.1简述
考察色谱参数的微小变动及仪器色谱行为的变化对检测结果的影响。将通过流速变化±0.1ml/min、柱温变化±2℃、检测波长变化±2nm,测定结果不受影响的承受程度。
5.2操作方法
空白辅料溶液:精密量取全辅料溶液1ml,置20ml量瓶中,用溶剂稀释至刻度,摇匀。
加标混合溶液:精密量取帕拉米韦注射液1ml、专属试验项下杂质混合溶液1ml及专属试验项下杂质C定位溶液1ml,置20ml量瓶中,加溶剂稀释至刻度,摇匀,作为加标混合溶液。
对照溶液:精密量取加标混合溶液1ml,置20ml量瓶中,用溶剂稀释至刻度,摇匀,精密量取1ml,置25ml,用溶剂稀释至刻度,摇匀。
精密量取上述加标混合溶液、对照溶液、空白辅料溶液及空白溶剂各4μl,于流速变化±0.1ml/min、柱温变化±2℃、检测波长变化±2nm的条件下,分别注入液相色谱仪,记录色谱图。结果见表7。
5.3试验结果
表7耐用性试验加标混合溶液结果
5.4结论
耐用性试验中,在流速变化±0.1ml/min、柱温变化±2℃、检测波长变化±2nm各个条件下,加标混合溶液中,杂质C与主峰的分离度最小为1.97,大于1.5;杂质C的检出量变化率最大为14.51%,小于20%,耐用性良好。
6重复性试验
6.1简述
重复性是通过配制6份供试品溶液来验证该方法具有良好的精密度。
6.2操作方法
杂质C定位溶液配制同专属性试验。
加标供试品溶液:精密量取帕拉米韦注射液1ml,置20ml量瓶中,再精密加入杂质C定位溶液1ml,加溶剂稀释至刻度,摇匀,作为加标供试品溶液。平行配制6份
对照溶液:精密量取加标供试品溶液1ml,置20ml量瓶中,用溶剂稀释至刻度,摇匀,精密量取1ml,置25ml,用溶剂稀释至刻度,摇匀。
精密量取上述空白溶剂、加标供试品溶液及对照溶液各4μl,分别注入液相色谱仪,记录色谱图。结果见表8。
6.3试验结果
表8重复性试验结果
6.4结论
重复性试验中,连续5针对照溶液-1的主峰峰面积RSD为1.43%,小于2.0%,6份加标供试品溶液中杂质C的检出量RSD为1.09%,小于20%,重复性良好。
7中间精密度试验
7.1简述
为考察随机变动因素对精密度的影响,另一名分析人员独立建立系统,考察测定方法的精密度。
7.2操作方法
照上述重复性试验方法于不同日期、不同仪器,由不同操作人员,对同一批样品进行含量测定,重复操作6次。
精密量取上述空白溶剂、加标供试品溶液及对照溶液各4μl,分别注入液相色谱仪,记录色谱图。结果见表9。
7.3试验结果
表9中间精密度试验结果
7.4结论
中间精密度试验中,连续5针对照溶液-1的主峰峰面积RSD为1.65%,小于2%,6份加标供试品溶液中杂质C的检出量RSD为1.96%,小于20%,中间精密度良好。12针加标供试品溶液中杂质C检出量的RSD为4.06%,小于30%,精密度良好。
8溶液稳定性试验
8.1简述
考察在室温条件下放置,溶液随时间的变化规律,为以后检测时测试溶液放置时间的期限提供依据。
8.2操作方法
杂质C定位溶液配制同专属性试验。
加标供试品溶液:精密量取帕拉米韦注射液1ml,置20ml量瓶中,再精密加入杂质C定位溶液1ml,加溶剂稀释至刻度,摇匀。加溶剂稀释至刻度,摇匀,作为加标供试品溶液。
对照溶液:精密量取加标供试品溶液1ml,置20ml量瓶中,用溶剂稀释至刻度,摇匀,精密量取1ml,置25ml,用溶剂稀释至刻度,摇匀。
室温条件下,精密量取上述空白溶剂、加标供试品溶液及对照溶液各4μl,分别注入液相色谱仪,记录色谱图。结果见表10。
计算公式:
式中A
8.3试验结果
表10溶液稳定性试验结果
8.4结论
24h内,对照溶液中主峰峰面积的变化率为最大为2.49%,小于20%,可认为对照溶液在24h内稳定。24h内,加标供试品溶液中杂质C的峰面积的变化率最大为2.17%,小于20%,可认为加标供试品溶液在24h内稳定。
9耐用性
9.1试验方法
在流速变化±0.1ml/min、柱温变化±2℃、检测波长变化±2nm各个条件下,加标混合溶液中,主峰与杂质C峰之间分离度应符合要求。加标混合溶液中,杂质C检出量的变化率应小于20%。
9.2试验结果
在流速变化±0.1ml/min、柱温变化±2℃、检测波长变化±2nm各个条件下,加标混合溶液中,杂质C与主峰的分离度最小为1.97,大于1.5;杂质C的检出量变化率最大为14.51%,小于20%,耐用性良好。
(三)验证结果汇总见表11
表11验证结果汇总
综上,本发明帕拉米韦注射液杂质C检测方法,通过了专属性、线性及范围、准确度试验、重复性试验、中间精密度试验、溶液稳定性试验及耐用性试验等考察,较好适应帕拉米韦注射液杂质C检测,有助于提高帕拉米韦注射液质量控制水平。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 一种帕拉米韦非对映异构体杂质的检测方法
- 帕拉米韦杂质A与杂质C及其制备方法和应用
