一种IFN-α/βR-/-小鼠抗体依赖性增强感染的注射液及其制备方法
文献发布时间:2023-06-19 18:53:06
技术领域
本发明涉及一种IFN-α/βR
背景技术
登革热(DF)是一种由登革热病毒(DENV)感染引起的急性传染病,是最广泛的蚊媒传染病之一。登革热感染模型,特别是抗体依赖增强(ADE)感染模型,对抗病毒药物和疫苗的开发具有临床价值。
登革热病毒属于黄病毒科黄病毒。它的基因组是一条单链正链RNA,约11kb,编码三种结构蛋白和七种非结构蛋白。根据包膜蛋白的抗原性,可将其分为DENV-1、DENV-2、DENV-3和DENV-4四种血清型。登革热病毒主要通过白纹伊蚊和埃及伊蚊的叮咬传播。
登革热病毒感染可表现为不同的临床类型:登革热(DF)、登革热出血热(DHF)和登革热出血综合征(DSS)。四种血清型中任何一种的原发性感染主要导致轻度DF的发展,并提供针对感染毒株的免疫保护。感染患者的临床表现主要是高烧、头痛、肌肉和关节疼痛,并可能伴有皮疹和淋巴结肿大。极少数病例可能具有严重的临床表现,严重感染患者可能表现为血小板减少、血管渗漏、毛细血管通透性增加,甚至死亡。其流行趋势已蔓延至100多个国家,威胁着25亿人,成为一个重大的公共卫生挑战。
目前,登革热病毒感染已成为世界上分布最广泛的虫媒疾病之一,其中重症患者多见于二次感染或多重感染。主流观点认为它可能与ADE有关,但目前对ADE发病机制的了解有限。大量研究表明,ADE感染的发病机制与Fcγ受体密切相关。登革热病毒感染模型和抗体依赖性增强感染模型的建立有利于未来更好地了解其发病机制,并为药物和疫苗安全性评估提供更多的动物模型选择。
最近,Zheng等人通过从临床分离物中纯化DENV-2,并在C6/36细胞中传代3次后皮下感染AG6小鼠,成功建立了致死性感染。Tan GK等人通过腹腔注射非小鼠适应的DENV-2(D2Y98P)菌株建立了AG129的致死模型。在现有的技术中,ADE小鼠模型的建立主要见于A129和AG6小鼠,感染后的症状不能与临床症状(如瘫痪、神经系统损伤)完全一致。然而,在IFN-α/βR
发明内容
为解决上述问题,本发明提供一种IFN-α/βR
本发明通过下列技术方案实现:一种IFN-α/βR
前膜抗体 1份、
磷酸缓冲液 1023份、
浓度为5.6×10
所述前膜抗体为市购的DENV-2抗prM,如Abcom公司AB214333。
进一步地,一种IFN-α/βR
(1)按下列体积份的组分备料:
前膜抗体 1份、
磷酸缓冲液 1023份、
浓度为5.6×10
(2)将前膜抗体与磷酸缓冲液混合,混合后的混合液与浓度为5.6×10
本发明的另一目的在于提供一种IFN-α/βR
使用DENV-2抗prM与DENV-3共孵育30min,然后感染IFN-α/βR
附图说明
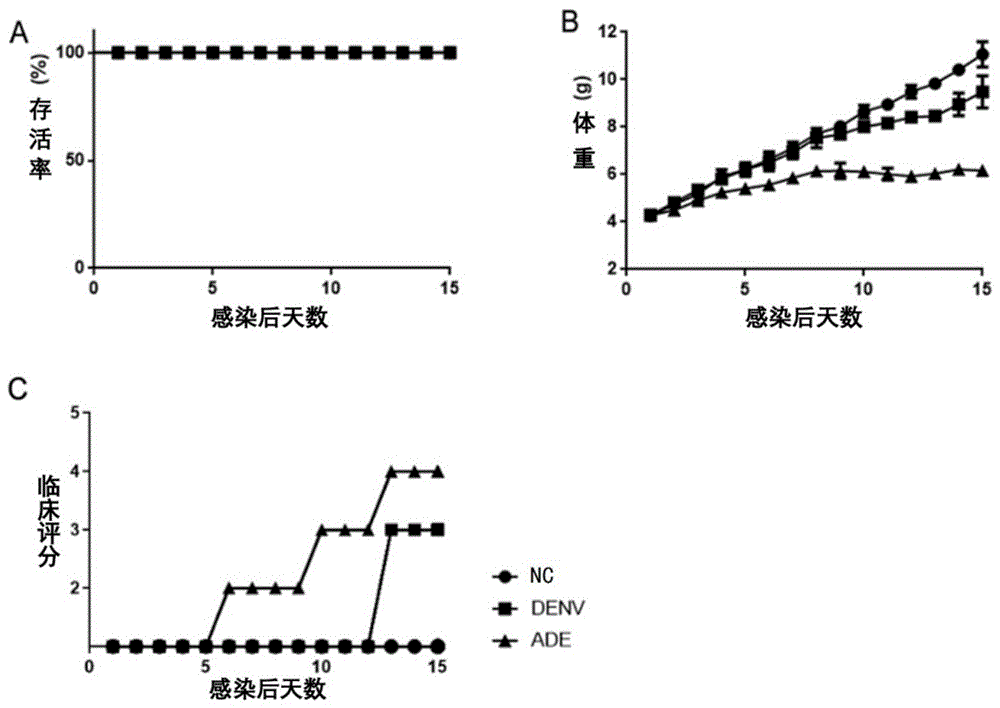
图1为感染后IFN-α/βR
图2为DENV-3感染IFN-α/βR
图3为DENV-3感染A129小鼠介导的多个组织脏器病理学改变。在光学显微镜下以200倍(肝、肠、肺)放大倍数观察切片。箭头指向阳性细胞,比例尺为50μm。每组每个时间点使用三只小鼠(n=3)。
图4为DENV-3感染A129小鼠后多个组织脏器中IL-10,TGF-β,TNF-α表达检测。(A)肝脏组织的免疫组化结果(B)肺部组织的免疫组化结果(C)肠道组织的免疫组化结果。DAPI染色为蓝色,IL-10染色为绿色,TGF-β染色为粉色,TNF-α染色为红色。图片比例尺为30μm。每组每个时间点使用三只小鼠。
图5为抗体依赖性增强感染A129小鼠导致血小板和白细胞计数显著减少。在感染后的2天收集血液测定血小板(A)、血小板积压(B)、单核细胞(C)、白细胞(D)、淋巴细胞(E)、淋巴细胞百分比(F)、血红蛋白(G)、中性粒细胞数量(H)、中性粒细胞百分比(I)。每组每个时间点评估五只小鼠。* P≤0.05,** P≤0.01,*** P≤0.001。
图6为抗体依赖性增强感染A129小鼠介导CD4+淋巴细胞和CD14+中性粒细胞活化。从外周血细胞的T淋巴细胞(A)和中性粒细胞(B)中分选出CD8+T细胞、CD4+T细胞、CD14+中性粒细胞和CD64+中性粒细胞;(C)T淋巴细胞表达CD4+的百分比;(D)T淋巴细胞表达CD8+的百分比;(E)中性粒细胞表达CD14+的百分比;(F)中性粒细胞表达CD64+的百分比。每组每个时间点使用三只小鼠(n=3)。
实施方式
下面结合实施例对本发明做进一步说明。
DENV-3病毒原液(GenBank 编号:MW426463)来源于中国医学科学院北京协和医学院医学生物学研究所。
体内感染模型的建立:
使用DENV-3和DENV-2抗prM(Abcam)构建登革热病毒感染模型(DENV)和抗体依赖性增强感染模型(ADE)。
将7天龄IFN-α/βR
阴性对照组(NC组):10uL PBS。
DENV组:5uL DENV-3病毒原液与5uL PBS的混合物,共计10uL。
ADE组:将1uL DENV-2抗prM(Abcom,AB214333)与1023uL磷酸缓冲液混合,混合后取100uL混合液与100uL浓度为5.6×10
感染方式:颈部皮下注射。
感染后,对每组9只小鼠每天称重进行监测,连续15天评估其生存状态。在感染后1、4和7天处死小鼠,并测定病毒在小鼠中的复制和各种器官的病理损伤。所有小鼠用异氟烷气体麻醉,麻醉后安乐死。
RT-qPCR法测定血清和组织中的病毒核酸载量:
通过RT-qPCR测定各组小鼠血清和组织中病毒核酸的拷贝数(n=5/组)。感染后第1、4和7天,从NC组、DENV组和ADE组采集血清、肝、肠、脾和肺组织样本。根据制造商的说明,使用病毒RNA提取试剂盒(QIAGEN)提取血清中的病毒RNA。组织磨碎后,用Trizol(Takara)提取组织RNA。总RNA(1μg)逆转录为cDNA。使用荧光定量PCR试剂(TaKaRa)扩增逆转录cDNA。PCR扩增循环数为40次,引物退火温度为52℃。根据y=0.316x+10.93标准曲线计算血清中病毒核酸的拷贝数,组织中病毒RNA的相对表达水平通过2
免疫组织化学:
将小鼠安乐死后(n=3/组),依次固定肝脏、肠和肺,脱水,包埋以制备病理切片,然后进行抗原修复。然后滴加BSA并孵育30分钟,轻轻摇晃封闭溶液,将切片与来自兔一级抗体(servicebio GB11179,1:200)的TGF-β混合,在室温下与CY3山羊抗兔二级抗体(servicebio GB21303,1:500)孵育50分钟,然后在4°C下过夜。将切片与兔源性IL-10(servicebioGB11188,1:200)在4℃和FITC山羊抗兔二级抗体(servicebioGB22303,1:150)在室温下孵育50分钟。将兔源TNF-α切片(servicebio GB11534,1:200)在4°C下过夜,在室温下与CY5山羊抗兔二级抗体(servicebioGB27303,1:600)孵育50分钟。切片稍微干燥后,加入自发荧光猝灭剂5分钟,并用流动水冲洗10分钟。切片稍微干燥后,加入DAPI染料滴,并在室温下在黑暗中孵育10分钟。将载玻片置于PBS(PH7.4)中,在脱色摇床上振荡洗涤3次,每次5min。稍微干燥切片,然后用抗荧光猝灭密封剂密封。在荧光显微镜(OLYMPUS BX51)下观察切片并收集图像(DAPI紫外激发波长330-380nm,发射波长420nm,蓝光。FITC激发波长465-495nm,发射频率515-555nm,绿光。CY3激发波长510-560nm,发光波长590nm,红光)。
全血细胞计数:
感染2天后,将NC组、DENV组和ADE组小鼠(n=5/组)的血液样本收集在EDTA抗凝管中,并用自动血液分析仪(迈瑞BC2800Vet)分析样本的血细胞计数。在感染期间,监测了三组患者的血小板总数、血小板红细胞压积、单核细胞、白细胞、淋巴细胞、淋巴细胞百分比、血红蛋白、中性粒细胞和中性粒细胞百分比。
病理切片:
将小鼠安乐死后,收集肝、肠和肺组织,并在感染后1、4和7天立即固定在4%的组织固定剂中。72小时后,将固定组织包埋在石蜡中,切片并用苏木精和伊红(H&E)染色。比较NC组、DENV组和ADE组的病理组织(n=3/组)。
流式细胞术测定淋巴细胞和中性粒细胞:
采用直接免疫荧光法通过多色流式细胞术分析小鼠外周血单个核细胞(PBMC)(n=3/组)。100μL肝素化全血在室温下用红细胞裂解缓冲液(BD)裂解10分钟,然后与抗体混合并孵育45分钟,用PBS洗涤细胞两次并用4%多聚甲醛固定,然后在流式细胞仪(BeckmanCouLter,Brea,CA,USA)中分析。使用Flowjo V10软件收集和分析样品。本申请中使用的抗体为:CD3-APC(Invitrogen 17-0032-80)、CD4-FITC(Invitrigen 11-0041-82)、CD8-PE(Invitroden 12-0081-82),CD45-PC(Invit rogen 17-0451-82)和CD14-FITC(Invitroben11-0141-82)以及CD64-PE(Invitropen 12-0061-82)。
统计分析:
使用GraphPad Prism 6软件分析数据。两组之间的比较采用t检验,三组数据采用二元方差分析和Tukey多重比较检验进行比较。P<0.05被认为具有统计学意义。
结果:
为了确定DENV组和ADE组的病程,在感染后15天连续评估不同组的生存曲线(图1A)、体重(图1B)和临床评分(图1C)。ADE组的小鼠迅速出现临床症状:第6天观察到皱巴巴的外观(9/9)、驼背的姿势(4/9)、第10天体重减轻(9/9)。ADE组出现不同程度的瘫痪(9/9)。与ADE组相比,DENV组小鼠的体重继续稳步增加,没有其他疾病迹象,第13天出现神经麻痹的小鼠更少(2/9)。可见,尽管DENV组和ADE组的小鼠与NC组相比体重减轻了不同程度,但没有一只小鼠死亡,而在ADE组,可观察到更严重的临床症状。其中,(9/9)、(4/9)、(2/9)这些符号表示出现相应症状的小鼠占每组总实验鼠的数量。
(1)DENV-3感染小鼠的病毒复制动力学和组织嗜性:
通过RT-qPCR检测NC组、DENV组和ADE组血清、肝、肠、肺和脾脏中的病毒载量(图2)。感染后第4天,ADE组血清中的病毒RNA水平显著高于DENV组(图2a)。在肝脏组织中(图2b),感染后4天,ADE组肝脏中的病毒RNA水平比DENV组高2.7倍。在ADE组(图2c)中,感染后4天,肠道组织中的病毒RNA水平比DENV组高1.9倍。在脾脏组织中(图2d),感染后4天,ADE组脾脏中的病毒RNA水平比DENV组高15倍。在肺组织中(图2e),感染后4天,ADE组肺组织中的病毒RNA水平比DENV组高13倍。总体而言,每个组织和器官中的病毒核酸拷贝数在感染后第4天达到峰值。与DENV组相比,ADE组的病毒核酸增加更明显,尤其是感染后第4天的肺和脾脏(图2d,图2e)。因此,ADE组血清和多器官中的病毒核酸拷贝数显著高于DENV组。
(2)干扰素-α/βR
将来自未感染组、普通感染组和抗体依赖性增强感染组的肠道病理组织进行比较分析,观察病毒对脏器的损伤情况(图3)。感染后第一天DENV-3组肠道组织与普通感染组相比较都表现出黏膜上皮细胞胞质疏松淡染(箭头),其他未见明显差异,ADE组大肠组织与未感染组和普通感染组比较黏膜上皮疏松程度加重。感染后4天DENV-3组大肠组织少量黏膜上皮细胞胞质疏松淡染,其余位置与未感染组比较无明显差异。ADE组大肠组织多量黏膜上皮细胞胞质疏松淡染,与未感染组和DENV-3组比较可见肠绒毛黏膜上皮与固有层分离。感染后7天,DENV-3组大肠组织才出现较多量的肠绒毛黏膜上皮细胞变性,胞质内可见大小不一的圆形空泡。ADE组大肠除可见多量的肠绒毛黏膜上皮细胞变性,胞质内可见大小不一的圆形空泡外,肠绒毛顶端黏膜上皮与固有层也发生了分离。总之,ADE组肠道病理损伤显著严重,这与病毒核酸拷贝数的结果一致(图2)。
(3)IFN-α/βR
为了比较DENV组和ADE组IFN-α/βR
(4)ADE组全血细胞计数显示血小板和白细胞数量显著减少:
感染后第2天,从NC、DENV和ADE组采集全血样本,以检测血小板(图5A)、血小板红细胞比容(图5B)、单核细胞(图5C)、白细胞(图5D)、淋巴细胞(图5E)、淋巴细胞百分比(LY%,图5F)、血红蛋白(图5G)、中性粒细胞(图5H)和中性粒细胞百分比(NEUT%,图5I)。与NC组和DENV组相比,ADE组的血小板、血小板红细胞压积、单核细胞、白细胞和血红蛋白水平较低。然而,ADE中淋巴细胞和中性粒细胞增加。血小板减少(图5A)和血小板红细胞压积(图5B)与危重患者的症状相似。
(5)IFN-α/βR
通过流式细胞术测定病毒感染后不同时间点外周血细胞中CD4+T细胞、CD8+T细胞,CD14+中性粒细胞和CD64+中性粒细胞的表达水平(图6A和6B)。ADE组中CD4+T细胞和CD8+T细胞的表达水平在感染后3天和5天显著不同,CD4+T淋巴细胞增加(图6C),CD8+T淋巴细胞减少(图6D)。与NC组和DENV组相比,CD14+中性粒细胞在感染后3天和5天显著升高,尤其是在感染后第3天(图6E),而CD64+中性粒细胞减少(图6F),尤其是感染后第5天。
近几十年来,由于全球登革热感染人数不断增加,以及对药物和疫苗的迫切需求。由于ADE的存在和缺乏合适的动物模型,已成为数十年来登革热疫苗和特效药物研发的主要障碍。本发明建立了非致死性IFN-α/βR
在本研究的DENV和ADE感染模型中观察到的疾病过程显示出与AG129小鼠相似的特征。例如,在感染小鼠的肝、肠、脾、肺和血清中观察到高病毒载量,并且随着感染过程,病理损伤的程度逐渐增加。感染后第1天和第4天,组织间病毒载量呈上升趋势,第7天,组织内病毒载量显著下降。ADE组的肝、肠和肺组织中发现更广泛和严重的器官损伤和高病毒载量。血常规分析结果显示,感染DENV-3的IFN-α/βR
IL-10是一种免疫调节因子。DENV感染可诱导IL-10的产生。IL-10也被用作严重登革热感染疾病进展的标志。ADE感染还可能触发Fc-γ受体介导的信号转导,通过激活某些信号通路调节IL-10的表达水平。TNF-α参与全身炎症,是刺激急性期反应的细胞因子之一。据报道,TNF-α在DENV感染中起重要作用。TGF-β调节炎症过程并参与细胞分化,尤其是在肠道。通过免疫组化观察,在感染后1、4和7天,与NC组和DENV组相比,ADE组肝脏中TGF-β和TNF-α显著升高,TGF-α和TNF-β呈持续上升趋势,IL-10在ADE感染后4天达到最高水平。感染后4天,与ADE组相比,肠组织中DENV的IL-10和TGF-β显著升高。与NC组和DENV组相比,ADE感染后7天,肺组织中IL-10的表达水平显著升高。
本发明建立了一种非致死性ADE小鼠模型,其多个体征与临床重症患者一致。该模型将在研究ADE的发病机制中发挥重要作用,并有助于评估候选疫苗和抗病毒药物。
- 治疗免疫介导的登革热感染和登革热感染(包括登革出血热和登革休克综合征)的抗体依赖性增强作用的方法
- 治疗免疫介导的登革热感染和登革热感染(包括登革出血热和登革休克综合征)的抗体依赖性增强作用的方法
