具有激活AMPK磷酸化的酚性杂萜化合物、药物组合物、制备方法以及应用
文献发布时间:2023-06-19 19:00:17
技术领域
本发明涉及化学药物技术领域,尤其涉及具有激活AMPK磷酸化的酚性杂萜化合物、药物组合物、制备方法以及应用。
背景技术
灵芝是传统名贵中药,具有悠久的药用历史。现代药理学对灵芝的进行研究发现,灵芝提取物具有多种活性,如神经保护、调节血糖、改善脂质代谢紊乱和肠道菌群失调、调节免疫、促进睡眠、抗肿瘤、抗氧化、抗炎、美白等。国内外学者通过对灵芝药效物质的不断研究,发现灵芝中除多糖和三萜外,另有一类杂萜成分也具有广泛的药理活性,如神经保护、抗肿瘤、抗肾纤维化、抗炎等。
AMPK(Adenosine 5’-monophosphate(AMP)-activated protein kinase,AMP依赖的蛋白激酶)是能量代谢变化的感受器,在肌肉和肝脏中,AMPK的活化能够增强葡萄糖的摄取、脂肪酸氧化作用和胰岛素敏感性,并且能够减少葡萄糖、胆固醇和甘油三酯的产生,直接改善胰岛素抵抗。
而灵芝中的杂萜成分是否具有激活AMPK改善胰岛素抵抗活性的相关研究未见文献报道。
发明内容
本发明所要解决的技术问题是提供具有激活AMPK磷酸化改善胰岛素抵抗活性的灵芝杂萜类化合物及其在制药和食品中应用,以解决现有技术中存在的不足。
为了解决上述问题,本发明提出以下技术方案:
第一方面,本发明提供一种具有激活AMPK磷酸化的酚性杂萜化合物,所述化合物命名为Ganodercin D,所述化合物的结构式为:
所述化合物为Ganomycin C,所述化合物的结构式为:
进一步地,所述的化合物Ganodercin D和/或Ganomycin C,是通过从反柄紫芝或赤芝中提取获得,或通过人工合成获得。
第二方面,本发明提供一种含有酚性杂萜化合物的药物组合物,包括第一方面所述的化合物Ganodercin D和/或Ganomycin C,或其在药学上可接受的衍生物及其盐类。
进一步地,所述药物组合物为药物制剂,由Ganodercin D和/或Ganomycin C,或其药学上可接受的衍生物及其盐类作为活性成分和药学上可接受的赋形剂组成。
药物制剂包括固体制剂、半固体制剂、液体制剂、眼用制剂等。其中固体制剂包括:片剂、胶囊剂、丸剂、颗粒剂等;半固体制剂包括软膏剂、栓剂等;液体制剂包括:溶液剂、注射剂、喷雾剂等;眼用制剂包括:滴眼剂、眼用凝胶剂等。
第三方面,本发明还提供如第一方面所述的具有激活AMPK磷酸化的酚性杂萜化合物的制备方法,所述的化合物Ganodercin D制备方法包括以下步骤:
取反柄紫芝200kg,粉碎,用2-5倍体积分数80%的乙醇回流提取,减压回收乙醇,得到浸膏16.8kg,取出8kg浸膏混悬于温水,用乙酸乙酯等体积萃取3次,得到乙酸乙酯部分4.0kg;
乙酸酯部分(4.0kg)经硅胶柱层析,石油醚/丙酮(91:9,120L,88:12,120L,85:15,150L,80:20,150L,70:30,150L,60:40,150L,50:50,150L,0;100,100L)梯度洗脱,薄层色谱(TLC)检测,合并相同流分,得Fractions A-D共4个流分段。Fr.B(860.0g)经MCI gel CHP20P柱层析,甲醇/水(60:40,5L,65:35,10L,70:30,8L,75:25,10L,80:20,28L,85:15,18L,90:10,18L,95:5,10L,100:0,10L)梯度洗脱,得到6个部分,B1-B6。Fr.B2(120.0g)经RP-18柱层析,甲醇/水(40:60,0.5L,45:55,1.3L,50:50,2.4L,55:45,3.6L,60:40,4.2L,65:35,4.2L,70:30,3.6L,75:25,3.0L,80:20,5.4L,85:15,3.0L,95:5,3.0L,100:0,3.0L)梯度洗脱,得到5个部分,B21-B25。Fr.B23(21.0g)经MCI gel CHP 20P柱层析,甲醇/水(40-100%)梯度洗脱,得到5个部分,B231-B235。Fr.B234(3.9g)经Sephadex LH-20柱层析分离,甲醇洗脱,然后经制备薄层色谱(PTLC)层析,氯仿/丙酮(7:1)洗脱,得到5个组分,B2341-B2345。Fr.B2345(2.3g)也经Sephadex LH-20柱层析分离,甲醇洗脱,然后经PTLC层析,氯仿/丙酮(7:1)洗脱,得到8个组分,B23451-B23458。Fr.B23451(12.0mg)(R
进一步地,所述的化合物Ganomycin C制备方法包括以下步骤:
取赤芝子实体30kg,粉碎,用8-10倍体积分数95%乙醇渗漉提取,流速140ml/min,减压回收乙醇,得浸膏2.1kg,将浸膏用乙酸乙酯和水等体积萃取3次,得到乙酸乙酯部分1.1kg;
乙酸乙酯部分(1.1kg)用MCI gel CHP 20P柱层析,甲醇/水(40:60,约110L,45:55,约110L,50:50,约52L,55:45,约74L,60:40,约74L,70:30,约89L,75:25,约89L,80:20,约74L,85:15,约80L,90:10,约89L,95:5,约148L,100:0,约110L)梯度洗脱,得FractionsA-M共13个流分段。Fr.K(123.0g)经硅胶柱层析,石油醚/丙酮(10:1,9:1,8:1,5:1,3:1)梯度洗脱,得到K1-K4。Fr.K4(99.0g)行Sephadex LH-20柱层析,甲醇洗脱,得K41-K43。Fr.K43(1.7g)行真空液相色谱(VLC)柱层析,石油醚/丙酮(15:1,10:1,5:1)梯度洗脱,得K431-K435。Fr.K435(1.3g)经PTLC层析,石油醚/丙酮(3:2)洗脱,得到3个组分,K4351-K4353。Fr.K4353(374.0mg)(R
第四方面,本发明提供如第一方面所述的具有激活AMPK磷酸化的酚性杂萜化合物在制备具有激活AMPK磷酸化药物和/或治疗胰岛素抵抗相关疾病药物、及相应食品中的应用。
第五方面,本发明提供如第二方面所述的含有酚性杂萜化合物的药物组合物在制备具有激活AMPK磷酸化药物和/或治疗胰岛素抵抗相关疾病药物、及相应食品中的应用。
与现有技术相比,本发明所能达到的技术效果包括:
1.本发明首次公开了从反柄紫芝中提取分离所述的新化合物Ganodercin D,和从赤芝中提取分离所述的化合物Ganomycin C的方法。
2.本发明所述的化合物Ganodercin D是首次从反柄紫芝分离鉴定得到的新化合物。
3.本发明所述的化合物Ganodercin D和/或Ganomycin C能够显著激活AMPK磷酸化,并能够剂量依赖地促进葡萄糖摄取,在改善胰岛素抵抗相关疾病方面显示一定作用,是AMPK磷酸化的激活剂,可应用在制备具有激活AMPK磷酸化药物和/或治疗胰岛素抵抗相关疾病药物、及相应食品中。
附图说明
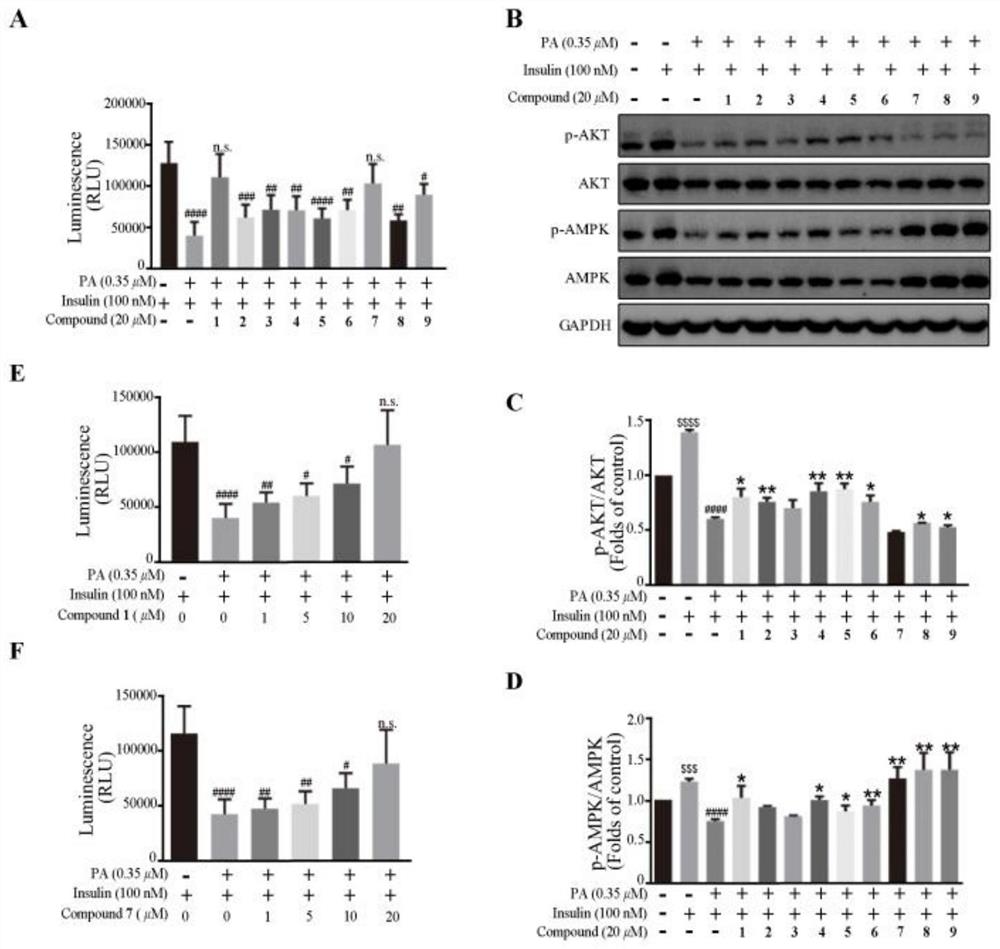
图1为本发明实施例6胰岛素抵抗活性研究的实验结果。
具体实施方式
下面将结合本发明实施例中的附图,对实施例中的技术方案进行清楚、完整地描述。显然,以下将描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
应当理解,在此本发明实施例说明书中所使用的术语仅仅是出于描述特定实施例的目的而并不意在限制本发明实施例。如在本发明实施例说明书和所附权利要求书中所使用的那样,除非上下文清楚地指明其它情况,否则单数形式的“一”、“一个”及“该”意在包括复数形式。
实施例1
化合物Ganodercin D、Ganomycin C的提取分离及结构鉴定
反柄紫芝(Ganoderma cochlear)200kg,粉碎,用体积分数80%的乙醇回流提取(3×120L,4,3,3h),减压回收乙醇,得到浸膏16.88kg,取出8kg浸膏混悬于温水,用乙酸乙酯等体积萃取3次,得到乙酸乙酯部分4.0kg。
乙酸酯部分(4.0kg)经硅胶柱层析,石油醚/丙酮(91:9,120L,88:12,120L,85:15,150L,80:20,150L,70:30,150L,60:40,150L,50:50,150L,0;100,100L)梯度洗脱,薄层色谱(TLC)检测,合并相同流分,得Fractions A-D共4个流分段。Fr.B(860.0g)经MCI gel CHP20P柱层析,甲醇/水(60:40,5L,65:35,10L,70:30,8L,75:25,10L,80:20,28L,85:15,18L,90:10,18L,95:5,10L,100:0,10L)梯度洗脱,得到6个部分,B1-B6。Fr.B2(120.0g)经RP-18柱层析,甲醇/水(40:60,0.5L,45:55,1.3L,50:50,2.4L,55:45,3.6L,60:40,4.2L,65:35,4.2L,70:30,3.6L,75:25,3.0L,80:20,5.4L,85:15,3.0L,95:5,3.0L,100:0,3.0L)梯度洗脱,得到5个部分,B21-B25。Fr.B23(21.0g)经MCI gel CHP 20P柱层析,甲醇/水(40-100%)梯度洗脱,得到5个部分,B231-B235。Fr.B234(3.9g)经Sephadex LH-20柱层析分离,甲醇洗脱,然后经制备薄层色谱(PTLC)层析,氯仿/丙酮(7:1)洗脱,得到5个组分,B2341-B2345。Fr.B2345(2.3g)也经Sephadex LH-20柱层析分离,甲醇洗脱,然后经PTLC层析,氯仿/丙酮(7:1)洗脱,得到8个组分,B23451-B23458。Fr.B23451(12.0mg)(R
赤芝子实体30kg,粉碎,用95%乙醇渗漉提取(240L),流速140ml/min,得浸膏2.1kg,用乙酸乙酯和水等体积萃取3次,得到乙酸乙酯部分1.1kg。
乙酸乙酯部分(1.1kg)用MCI gel CHP 20P柱层析,甲醇/水(40:60,约110L,45:55,约110L,50:50,约52L,55:45,约74L,60:40,约74L,70:30,约89L,75:25,约89L,80:20,约74L,85:15,约80L,90:10,约89L,95:5,约148L,100:0,约110L)梯度洗脱,得FractionsA-M共13个流分段。Fr.K(123.0g)经硅胶柱层析,石油醚/丙酮(10:1,9:1,8:1,5:1,3:1)梯度洗脱,得到K1-K4。Fr.K4(99.0g)行Sephadex LH-20柱层析,甲醇洗脱,得K41-K43。Fr.K43(1.7g)行真空液相色谱(VLC)柱层析,石油醚/丙酮(15:1,10:1,5:1)梯度洗脱,得K431-K435。Fr.K435(1.3g)经PTLC层析,石油醚/丙酮(3:2)洗脱,得到3个组分,K4351-K4353。Fr.K4353(374.0mg)(R
对得到的化合物鉴定结果如下:
化合物Ganodercin D(结构式1),黄色固体,UV(MeOH)λ
化合物Ganomycin C(结构式2),黄色固体,UV(MeOH)λ
表1化合物Ganodercin D和Ganomycin C的
实施例2:
实施例1中化合物Ganodercin D按常规法加注射用溶媒,精滤,灌封灭菌后可制成注射液。
或者,实施例1中化合物Ganomycin C按常规法加注射用溶媒,精滤,灌封灭菌后可制成注射液。
或者,实施例1中化合物Ganodercin D和Ganomycin C按任意比例混合,按常规法加注射用溶媒,精滤,灌封灭菌后可制成注射液。
实施例3:
实施例1中化合物Ganodercin D按常规法配以各种药用辅料可制成片剂。
或者,实施例1中化合物Ganomycin C按常规法配以各种药用辅料可制成片剂。
或者,实施例1中化合物Ganodercin D和Ganomycin C按任意比例混合,按常规法配以各种药用辅料可制成片剂。
具体地,含有实施例1中化合物Ganodercin D和/或Ganomycin C作为有效成分的药物组合物片剂的制备:使用实施例1中化合物Ganodercin D和/或Ganomycin C作为药物活性成分,使用几种赋形剂作为制备组合药物片剂的辅料成分,按照一定比例配比制成每片含有药物成分1-100mg的片剂样品。
实施例4:
实施例1中化合物Ganodercin D按常规法配以各种药用辅料可制成胶囊剂。
或者,实施例1中化合物Ganomycin C按常规法配以各种药用辅料可制成胶囊剂。
或者,实施例1中化合物Ganodercin D和Ganomycin C按任意比例混合,按常规法配以各种药用辅料可制成胶囊剂。
具体地,含有实施例1中化合物Ganodercin D和/或Ganomycin C作为有效成分的药物组合物胶囊制剂的制备:使用实施例1中化合物Ganodercin D和/或Ganomycin C作为药物活性成分、使用几种赋形剂作为制备组合药物胶囊剂的辅料成分,按照一定比例配比制成每粒胶囊中含有化合物成分1-100mg的胶囊制剂。
实施例5:
取实施例1的方法制得的化合物Ganodercin D 1份,10份植脂末,混匀,按照常规方法制成固体饮料。
或者,取实施例1的方法制得的化合物Ganomycin C 1份,10份植脂末,混匀,按照常规方法制成固体饮料。
或者,取实施例1的方法制得的化合物Ganodercin D和Ganomycin C按任意比例混合1份,10份植脂末,混匀,按照常规方法制成固体饮料。
实施例6:
胰岛素抵抗活性研究
本实验用Cell Count Kit-8、ECL kit和Glucose Colorimetric/FluorometricAssay Kit来检测AKT和AMPK磷酸化,和葡萄糖摄取的活性。具体步骤如下:
AKT和AMPK磷酸化:
1.取不同化合物,包括Ganodercin D和Ganomycin C,分别用DMSO溶解成20mM储存液。
2.C2C12细胞株在含有10%FBS(fetal bovine serum)的DMEM中生长至接触抑制,将细胞培养基更换成含有2%马血清(horse serum)、100U/mL的penicillin和100μg/mL的streptomycin的新鲜DMEM中,37℃孵育4天。
3.在细胞分化的同时在诱导培养基中添加350μM棕榈酸钠(PA)处理24h,模拟胰岛素抵抗。经化合物处理24h后,从细胞系中提取总蛋白,并使用定量蛋白样本。
4.等量的蛋白提取物用8%的SDS-PAGE分离,转移到PVDF膜上。用5%牛血清蛋白阻断膜,然后在4℃下用指定抗体过夜,然后用辣根过氧化物酶(HRP)偶联的二抗在室温下孵育。
5.通过ECL试剂盒可视化和测量条带,使用ImageJ软件对免疫印迹结果进行密度测量分析。
葡萄糖摄取:
1.C2C12细胞在DMEM(低糖)中孵育6h。
2.在高糖DMEM中加入化合物,经化合物处理30min后,加入胰岛素(100nmol/L)培养4h。
3.采用葡萄糖比色/荧光测定试剂盒测定培养上清液中的葡萄糖含量。
结果如图1所示,图中Compound 7为化合物Ganodercin D,Compound 1为化合物Ganomycin C。图1中A表明化合物Compound 7和Compound 1可改善肌管中胰岛素刺激的葡萄糖摄取;图1中B-D表明化合物Compound 7和Compound 1可减弱胰岛素信号通路的破坏;图1中E、F分别为化合物Ganomycin C和Ganodercin D改善了胰岛素刺激的肌管中葡萄糖的摄取。
图中
图1结果表明:化合物Ganodercin D和Ganomycin C在20μM浓度下均能够显著激活AMPK磷酸化,以及促进葡萄糖摄取,并且对葡萄糖摄取的调控呈现剂量依赖性,说明化合物Ganodercin D和Ganomycin C是AMPK磷酸化的激活剂,具有一定的改善胰岛素抵抗的活性。
在上述实施例中,对各个实施例的描述都各有侧重,某个实施例中没有详细描述的部分,可以参见其他实施例的相关描述。
以上所述,为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到各种等效的修改或替换,这些修改或替换都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应以权利要求的保护范围为准。
- 五环三萜类化合物及其制备方法、药物组合物和用途
- 一种三萜类化合物及其制备方法和在制备抗癌药物中的应用
- 一种具有抗菌功能的三萜类化合物及其制备方法与在电子烟中的应用
- 一种具有COX-2抑制活性的系列酚性化合物及制备方法
- 4’-硫代核苷的新型化合物及其制备方法、药物组合物和应用
- 一种间苯三酚杂萜类化合物及其制备方法和应用,以及药物组合物
- 一种间苯三酚杂萜类化合物及其制备方法和应用,以及药物组合物
