猪瘟病毒可溶性Erns重组蛋白、其制造方法及其用于鉴别猪瘟病毒感染的套组及方法
文献发布时间:2023-06-19 19:00:17
技术领域
本发明涉及一种动物病毒的重组蛋白及其应用,特别涉及一种猪瘟病毒可溶性Erns重组蛋白、其制造方法暨其用于鉴别猪瘟病毒感染的套组及方法。
背景技术
猪瘟(Classical swine fever)是由经典猪瘟病毒(classical swine fevervirus,CSFV)所引起的高传染性与高致死性疾病。于1903年首次被发现后,一直在亚洲、非洲、欧洲、中南美洲地区流行着,造成全球养猪业的经济严重的损失,更对于无猪瘟的国家的农业安全产生极大威胁。例如:美国的猪瘟是一种有强传染性病毒的猪病,这种病就是由经典猪瘟病毒所引起的。此病毒流行的国家必须使用常规疫苗接种来预防和控制猪瘟的传播。如果使用得当,疫苗接种可以成为限制猪瘟传播、预防疾病爆发并在未感染猪群中建立保护性免疫的有效方法。
猪瘟病毒属于黄病毒科(Flaviviridae)中的瘟疫病毒属(Pestivius),其基因组单股正向的RNA,全长约12.3kb,可转译出具有3898个氨基酸的多聚蛋白(polyprotein)。经蛋白酶加工后可形成四种结构蛋白(C、Erns、E1和E2)及八种非结构病毒蛋白(Npro、p7、NS2、NS3、NS4A、NS4B、NS5A和NS5B),其中E2蛋白、Erns重组蛋白及NS3蛋白可诱发宿主产生抗体反应。
目前普遍使用的商品化猪瘟疫苗有猪瘟活毒减毒疫苗(Modified Live Vaccine;MLV),以及猪瘟病毒套膜蛋白E2次单位疫苗。虽然猪瘟MLV疫苗价格低廉且有效,然而在血清抗体检测上,抗体呈现的阳性免疫反应仅能检测出受试猪只具有抗猪瘟病毒的内生性抗体,但无法鉴别此内生性抗体究竟是因为接种MLV疫苗而产生,或是受到猪瘟病毒感染而产生。
其次,动物接种猪瘟MLV疫苗后,存在于环境中的病毒仍可能持续感染动物,而动物体内仍具有一定程度的低病毒量,难以消除存在于环境及动物体内的病毒。为完全扑灭猪瘟病毒的感染源,亟需提供一种鉴别试剂,以在动物养殖场中,区别猪只是已接受疫苗免疫或受到猪瘟病毒感染,以利后续进行扑灭计划。
发明内容
因此,本发明的一态样是提供一种猪瘟病毒可溶性Erns重组蛋白的制造方法,其是利用原核转形细胞表现猪瘟病毒(CSFV)Erns重组蛋白后,经均质化处理及利用萃取缓冲溶液进行可溶化处理后,可获得猪瘟病毒Erns可溶性重组蛋白。
其次,本发明的另一态样是提供一种猪瘟病毒可溶性Erns重组蛋白,其是由上述方法制得。
再者,本发明的又一态样是提供一种鉴别猪瘟病毒感染的套组,其是将上述猪瘟病毒可溶性Erns重组蛋白固定于反应区域的表面,并利用二级抗体专一性辨识抗Erns重组蛋白的第一抗体,但二级抗体不与由猪瘟病毒E2次单位疫苗免疫产生的第二抗体产生交互作用,有利于鉴别猪瘟病毒感染或已接受猪瘟病毒E2次单位疫苗免疫。
另外,本发明的再一态样是提供一种鉴别猪瘟病毒感染的方法,其包含利用上述套组鉴别猪瘟病毒感染或已接受猪瘟病毒E2次单位疫苗免疫。
根据本发明的上述态样,提出一种猪瘟病毒可溶性Erns重组蛋白的制造方法。首先,对原核转形细胞进行蛋白表现步骤,其中原核转形细胞可包含重组质体,以表现如序列辨识编号(SEQ ID NO):1所示的氨基酸序列的猪瘟病毒(CSFV)Erns重组蛋白。接着,对前述原核转形细胞进行均质化处理,以获得细胞沉淀物,其中此细胞沉淀物包含猪瘟病毒Erns重组蛋白的包涵体。然后,利用萃取缓冲溶液对前述细胞沉淀物进行可溶化处理,以获得猪瘟病毒Erns可溶性重组蛋白,其中前述的萃取缓冲溶液可由20mM至30mM的三羟甲基氨基甲烷(Tris)盐、450mM至550mM的氯化钠(NaCl)及7M至9M的尿素(Urea)所组成,且其酸碱值为pH 7.0至pH 8.0。
在上述实施例中,前述原核转形细胞的宿主细胞可例如为大肠杆菌BL21(DE3)株。
在上述实施例中,前述重组质体可包含如SEQ ID NO:2所示的核酸序列,以编码猪瘟病毒Erns重组蛋白。
在上述实施例中,前述萃取缓冲溶液是由例如25mM的Tris盐、500mM的氯化钠(NaCl)及8M的尿素(Urea)所组成,且萃取缓冲溶液的酸碱值为pH7.5。
在上述实施例中,前述可溶化处理可例如于0℃至4℃进行20分钟至40分钟。
在上述实施例中,于前述可溶化处理之后,可选择性对猪瘟病毒Erns可溶性重组蛋白进行管柱纯化步骤,以获得纯化的猪瘟病毒Erns可溶性重组蛋白。
根据本发明的另一态样,提出一种猪瘟病毒可溶性Erns重组蛋白,其是由上述的方法制得。
根据本发明的再一态样,提出一种鉴别猪瘟病毒感染的套组。在一实施例中,前述套组可包括猪瘟病毒可溶性Erns重组蛋白固定于反应区域的表面,以及二级抗体,且二级抗体与反应区域连通。在上述实施例中,猪瘟病毒可溶性Erns重组蛋白可例如为如SEQ IDNO:1所示的氨基酸序列。前述二级抗体只专一性辨识抗Erns重组蛋白的第一抗体,但不与由猪瘟病毒E2次单位疫苗免疫产生的第二抗体产生交互作用。
在上述实施例中,前述套组可选择性包含显示区域,以呈现前述鉴别反应的结果。
根据本发明的另一态样,提出一种鉴别猪瘟病毒感染的方法。在一实施例中,首先,将如SEQ ID NO:1所示的氨基酸序列的猪瘟病毒可溶性Erns重组蛋白固定于反应区域的表面。接着,加入生物样本于反应区域中,使生物样本与猪瘟病毒可溶性Erns重组蛋白进行键结反应。然后,移除未反应的生物样本。之后,将二级抗体导入反应区域中,使二级抗体与猪瘟病毒可溶性Erns重组蛋白键结的生物样本进行鉴别反应,其中二级抗体只专一性辨识生物样本中抗Erns重组蛋白的第一抗体,但不与生物样本中经猪瘟病毒E2次单位疫苗免疫产生的第二抗体反应。而后,判断鉴别反应的结果,当鉴别反应为阳性时,则判断生物样本来源的猪只对象为受到猪瘟病毒感染;或者当鉴别反应为阴性时,判断生物样本来源的猪只对象为已接受该猪瘟病毒E2次单位疫苗免疫。
在上述实施例中,前述生物样本可包括离体的脏器、组织、细胞、体液、淋巴液、尿液、全血、血浆、血清及/或细胞培养上清液。
应用本发明猪瘟病毒可溶性Erns重组蛋白及其制造方法,其可利用原核转形细胞表现出猪瘟病毒Erns重组蛋白后,将原核转形细胞的细胞沉淀物利用萃取缓冲溶液进行可溶化处理,可获得猪瘟病毒Erns可溶性重组蛋白。当猪瘟病毒Erns可溶性重组蛋白应用于鉴别套组及/或方法时,可有效区分生物样本来源的猪只对象是否受到猪瘟病毒感染,或已接受猪瘟病毒E2次单位疫苗免疫。
可以理解的是,前述的概括说明及下述的详细说明仅为例示,旨在对要求保护的发明提供进一步的解释。
附图说明
为让本发明的上述和其他目的、特征、优点与实施例能更明显易懂,所附图式的详细说明如下:
图1A是显示根据本发明一实施例的猪瘟病毒可溶性Erns重组蛋白于可溶化处理后的十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamidegel electrophoresis,SDS-PAGE)的胶体影像。
图1B是显示图1A的西方转印法的影像结果。
图2A是显示根据本发明一实施例的猪瘟病毒可溶性Erns重组蛋白于管柱纯化步骤后的SDS-PAGE的胶体影像。
图2B是显示图2A的西方转印法的影像结果。
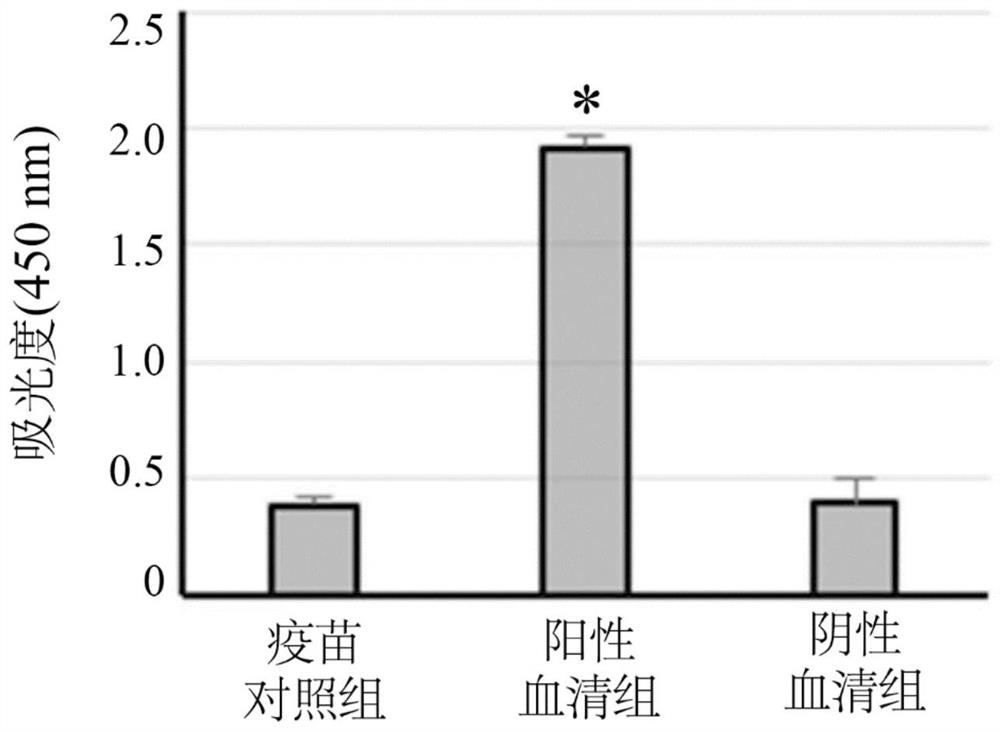
图3是绘示根据本发明一实施例利用猪瘟病毒Erns可溶性重组蛋白鉴别不同生物样本的柱形图。
其中,附图标记:
101:步骤1
103:步骤2
105:不可溶蛋白
107:可溶性蛋白
具体实施方式
倘若引用文献对一术语的定义或用法,与此处对该术语的定义不一致或相反,则适用此处对该术语的定义,而不适用该引用文献对该术语的定义。其次,除非上下文另有定义,单数术语可包括复数,而复数术语亦可包括单数。
如前所述,本发明是提供一种猪瘟病毒可溶性Erns重组蛋白及其制造方法暨其用于鉴别猪瘟病毒感染的套组及方法。前述猪瘟病毒Erns重组蛋白利用原核转形细胞表现后,经由均质化处理并利用萃取缓冲溶液进行可溶化处理,以获得猪瘟病毒Erns可溶性重组蛋白,其可应用于鉴别猪瘟病毒感染的套组及/或方法。
本文所称的「重组蛋白」、「嵌合蛋白」、「重组抗原」、「蛋白质」、「胜肽」及「多肽」是可互换的,指的是氨基酸的聚合物,通常藉由肽键或二硫键连接在一起。「胜肽」亦可用于其中一个或多个氨基酸残基是天然存在的氨基酸及其聚合物、或者对应于天然存在的氨基酸的类似物或模拟物的氨基酸聚合物。「胜肽」还包括经修饰的氨基酸聚合物,例如,具有碳水化合物残基的糖蛋白,或被磷酸化的胜肽。胜肽、多肽及蛋白质可利用液相合成、固相合成或利用基因工程、重组细胞、原核表现系统、真核表现系统产生。在一实施例中,本文所称的重组蛋白是指猪瘟病毒Erns重组蛋白。
此处所称的「氨基酸」与「残基」是可互换的,当与胜肽并用时,指的是天然存在及合成的氨基酸、氨基酸类似物、氨基酸仿真物及化学上与天然存在的氨基酸相似的非天然存在的氨基酸。
此处所称的「猪瘟病毒」,其病毒株种类并无特别限制,可例如猪瘟病毒TW株(基因型2.1,NP_777496.1),然而在其他实施例中,亦可使用其他病毒株,端视实际需求而定。
此处所称的「Erns重组蛋白」可例如为全长的Erns重组蛋白,如序列辨识编号(SEQID NO):1所示的氨基酸序列,或者由如SEQ ID NO:2所示的核酸序列所编码的氨基酸序列。另外,为了方便后续纯化蛋白,Erns重组蛋白的N端可选择性添加组氨酸(His)标签[Histag;或称聚组氨酸(polyhistidine)],其中His标签可包含但不限于6至10个组氨酸残基。
在一些实施例中,上述猪瘟病毒可溶性Erns重组蛋白可利用习知方法或下述方法制造。首先,对原核转形细胞进行蛋白表现步骤,其中原核转形细胞可包含重组质体,其含有如SEQ ID NO:2所示核酸序列的重组基因,以表现如序列辨识编号(SEQ ID NO):1所示的氨基酸序列的猪瘟病毒(CSFV)Erns重组蛋白。为了后续纯化重组蛋白,上述重组基因的5’端可选择性添加编译His标签的核酸序列。在一些例子中,前述编译His标签的核酸序列可例如由市售质体提供,并设计成与上述重组基因的5’端连接。有关His标签的核酸序列乃本发明所属技术领域的公知常识,在此不另赘述。
接着,对前述原核转形细胞进行均质化处理,以获得细胞沉淀物(亦称为细胞碎片),其中此细胞沉淀物包含猪瘟病毒Erns重组蛋白的包涵体。
由于猪瘟病毒Erns重组蛋白的包涵体是由不可溶蛋白堆积而成,会影响甚至无法发挥Erns重组蛋白原有的生物功能。因此,本发明利用萃取缓冲溶液对前述细胞沉淀物进行可溶化处理,以获得猪瘟病毒Erns可溶性重组蛋白。在上述实施例中,前述的萃取缓冲溶液可由20mM至30mM的Tris盐、450mM至550mM的氯化钠(NaCl)及7M至9M的尿素(Urea)所组成,且萃取缓冲溶液的酸碱值为pH 7.0至pH 8.0。在一例示中,前述萃取缓冲溶液可由例如25mM的Tris盐、500mM的氯化钠(NaCl)及8M的尿素(Urea)所组成且萃取缓冲溶液的酸碱值可为pH 7.5。在另一例示中,可溶化处理可例如于0℃至4℃进行20分钟至40分钟。在其他例示中,可溶化处理可例如于0℃进行30分钟,且可溶化处理的过程中可并用搅拌处理。
在上述实施例中,于前述可溶化处理之后,可选择性对猪瘟病毒Erns可溶性重组蛋白进行习知的管柱纯化步骤,以获得纯化的猪瘟病毒Erns可溶性重组蛋白。补充说明的是,相较于习知管柱纯化步骤中必须另外添加β-巯基乙醇(β-mercaptoethanol,b-ME或BME)以避免N端His标签折迭,前述所得的猪瘟病毒Erns可溶性重组蛋白在进行管柱纯化步骤时,无须另外添加b-ME,即可获得较佳的纯化效果。
大体而言,上述Erns重组蛋白的生产量在每公升菌液中可得到至少21.8毫克(mg)的可溶性Erns重组蛋白,后续可应用于鉴别套组及/或方法,区分生物样本来源的猪只对象是否受到猪瘟病毒感染,或已接受猪瘟病毒E2次单位疫苗免疫。上述鉴别套组及/或方法可包含免疫分析套组及/或方法,例如酵素结合免疫吸附分析(enzyme-linkedimmunosorbent assay,ELISA)套组及/或方法(如间接式ELISA),以检测生物样本所含的抗体。
此处所称的「生物样本」并无特别限制,可例如离体的脏器、组织、细胞、体液、淋巴液、尿液、全血、血浆、血清及/或细胞培养上清液等,然而本发明并不限于此处所举。
在一些例子中,上述鉴别方法可使用习知ELISA套组(及/或生物芯片)进行。一般而言,适合的ELISA套组及/或生物芯片的种类并无特别限制,在一些例子中,上述套组可包括如SEQ ID NO:1所示的氨基酸序列的猪瘟病毒可溶性Erns重组蛋白以及二级抗体。上述猪瘟病毒可溶性Erns重组蛋白可固定于套组的反应区域的表面。上述二级抗体可为溶液态储存于试剂区并以微流道与反应区域连通,其中此二级抗体只专一性辨识抗Erns重组蛋白的第一抗体,但不与由猪瘟病毒E2次单位疫苗免疫产生的第二抗体产生交互作用,也不与无特定病原(SPF)猪只血清有任何抗体-抗原的结合反应。在其他实施例中,上述套组可选择性包含显示区域,以呈现鉴别反应的结果。上述套组的种类并无特别限制,举例而言,当上述套组为快筛试剂时,显示区域可例如观测窗,以利用肉眼观测鉴别反应后色条(strip)的检测线及控制线的结果。当上述套组为生物芯片时,显示区域可例如显示器,以显示利用光学式或电化学检测反应产物的影像或讯号。
在此厘清的是,上述所得的Erns重组蛋白是做为免疫分析用,而非做为疫苗用,因此必须要使用全长Erns重组蛋白才能有效区分生物样本来源的猪只对象是否受到猪瘟病毒感染,或已接受猪瘟病毒E2次单位疫苗免疫。倘若利用SEQ ID NO:1以外的氨基酸序列所得的重组蛋白,例如改变长度或改变选用的序列范围,则将无法发挥上述效果,即区分生物样本来源的猪只对象是否受到猪瘟病毒感染,或已接受猪瘟病毒E2次单位疫苗免疫。
在一些实施例中,上述区分生物样本来源的猪只对象是否受到猪瘟病毒感染的具体方式,指的是上述Erns重组蛋白只专一性辨识生物样本中抗Erns重组蛋白的抗体(亦称第一抗体),但不与生物样本中经猪瘟病毒E2次单位疫苗免疫产生的抗体(亦称第二抗体)反应。倘若利用SEQ ID NO:1以外的氨基酸序列所得的重组蛋白,例如改变长度或改变选用的序列范围,则修饰后的Erns重组蛋白有可能同时与第一抗体及第二抗体反应,而无法区分生物样本来源的猪只对象是否受到猪瘟病毒感染,或已接受猪瘟病毒E2次单位疫苗免疫。
可以理解的是,下述特定的重组蛋白序列、特定的配方、特定的使用剂量、特定的检测方式、观点、例示及实施例仅供举例说明,并非作为本发明的限制条件。在不脱离本发明的精神和范围内,本发明的主要特征可用于各种实施例。因此本发明所属技术领域中具有公知常识者,在不脱离本发明的精神和范围内,当可轻易确定本案的必要技术特征,对本发明作各种更动及润饰,以适用不同的用途及条件。
实施例1:制备猪瘟病毒可溶性Erns重组蛋白
1.1构筑猪瘟病毒Erns重组蛋白的重组质体
来自于典型猪瘟病毒(Classical swine fever virus)(CSFV Egystrup strain,Genotype1.1)的Erns全基因片段,利用全基因合成(生工有限公司)合成该基因片段。经由聚合酶链反应[polymerase chain reaction(PCR),ThermoFisher scientific;Phusion高保真DNA聚合酶,PhusionHigh-Fidelity DNA polymerase,进阶生物科技股份有限公司]扩增Erns全基因片段(如SEQ ID NO:2所示序列)。然后,根据市售In-fusion构筑套组(TaKaRaBio,美国)提供的方法,取1μL的Erns基因片段(10ng/μL,如SEQ ID NO:2所示序列)、1μL的pET21质体(10ng/μL)(Invitrogen)以及0.5μL的接合酶(TaKaRa Bio,美国),在50℃反应20分钟。之后,将上述反应产物加入25μL的ECOSTM X胜任细胞[DH5a](益生生技开发股份有限公司),42℃50秒进行转形反应。然后,将转形细胞的菌液涂在含安比西林(Ampicillin,Biobasic)的LB培养基(DifcoTM LB Broth,Miller,BD)的表面。放置37℃约16至18小时,等待菌落形成。之后,挑出单一菌落进行基因定序。
1.2表现猪瘟病毒Erns重组蛋白
取1μL基因定序确认的pET-21-Erns质体(即含有如SEQ ID NO:2所示核酸序列的重组质体)加上25μL的ECOSTM 21胜任细胞[BL21(DE3)](益生生技开发股份有限公司)],以42℃、50秒进行转殖。然后,将菌液涂在含100μg/μL的安比西林(Biobasic)的LB培养基(DifcoTM LB Broth,Miller,BD)上。放置37℃约16至18小时等待菌落形成。挑单一菌落到500μL含有100μg/μL的安比西林的LB培养液中,培养在37℃达6至8小时,取50μL菌液到50mL含有100μg/μL的安比西林的LB培养液中,培养在37℃达16至18小时,取10mL的菌液到1L含有100μg/μL的安比西林的LB培养液中,培养在37℃约3小时后,加入500μL、1M的异丙基-β-D-硫代半乳糖苷(Isopropylβ-d-1-thiogalactopyranoside,IPTG;友和贸易股份有限公司)进行蛋白诱导表现,培养在22℃约16至18小时。
1.3猪瘟病毒Erns重组蛋白的均质化处理、可溶化处理及管柱纯化步骤
在此实施例中,猪瘟病毒Erns重组蛋白依序经由均质化处理(以下亦称为步骤1)及可溶化处理(以下亦称为步骤2),析述如下。
步骤1:取大肠杆菌的细胞加入100mL的细胞溶解缓冲溶液(含有25mM Tris盐及500mM的NaCl,pH 7.5),利用市售均质机(IKA翰新国际有限公司)进行均质化处理。然后,于上述反应产物中加入0.5g的溶菌酶(lysozyme,Cyrusbioscience塞鲁士生技有限公司)并混合均匀后,静置于冰上30分钟。接着,于上述反应产物中加入0.05g DNase I(Cyrusbioscience塞鲁士生技有限公司),利用市售超音波细胞破碎仪(尚伟股份有限公司)进行震荡,每震荡3秒停5秒,全程共20分钟,以获得均质化产物。之后,将均质化产物以12000×g的转速离心40分钟,以获得第一上清液(1S,图号101的S道)及第一沉淀物(1P,图号101的P道),其中第一沉淀物(1P)包含猪瘟病毒Erns重组蛋白的包涵体。
步骤2:于第一沉淀物(1P)中加入萃取缓冲溶液(由25mM的Tris盐、500mM的氯化钠及8M的尿素所组成)并混合均匀后,置于冰上(0℃)搅拌30分钟进行可溶化处理。之后,将可溶化产物以12000×g的转速离心40分钟,藉此获得第二上清液(简称2S,图号103的S道)与第二沉淀物(简称为2P,图号103的P道)。
请参阅图1A,其是显示根据本发明一实施例的猪瘟病毒可溶性Erns重组蛋白的制造方法的步骤1(图号101)与步骤2(图号103)的十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)的胶体影像结果。由图1A的结果显示,原核表现系统产生的Erns重组蛋白为不可溶蛋白105,其蛋白质出现在第一沉淀物(1P)(如图1A的图号101的P道的箭头所示的不可溶蛋白105),且其分子量为28kDa。
然而,利用Erns萃取缓冲溶液(由25mM的Tris盐、500mM的氯化钠、8M的尿素所组成,且酸碱值为pH 7.5),可将第一沉淀物(1P)中不可溶蛋白105进行可溶化处理,以于第二上清液(简称2S)获得可溶性蛋白107。
具体而言,于第一沉淀物(1P)中加入100mL的萃取缓冲溶液,放置冰上搅拌30分钟,以12000×g的转速离心40分钟后,可获得第二上清液(2S)及第二沉淀物(2P),并以SDS-PAGE电泳分析。请参阅图1A,第一沉淀物(1P)中不可溶蛋白105,在第二上清液(2S)中已转为可溶性蛋白107(如图1A的图号103的S道的箭头所示的可溶性蛋白107)。
请参阅图1B,其是显示图1A的西方转印法的影像结果,其西方转印法的流程如下所述。将含有Erns重组蛋白的SDS-PAGE胶片转印到聚偏二氟乙烯(polyvinylidenedifluoride,PVDF)膜(GE healthcare,进阶生物科技股份有限公司)上,与20mL的阻隔缓冲溶液[blocking buffer,包含添加聚山梨醇酯20(Tween20)的Tris缓冲盐溶液(TrisBufferedSaline withTween20,TBST)及5%的牛血清白蛋白(Bovine serum albumin,BSA)]在室温(约25℃)反应2小时。然后,移除阻隔缓冲溶液,将PVDF膜与10mL的抗His标签的抗体溶液[稀释倍数1:1000的抗体与TBST缓冲溶液(添加0.1%Tween-20的1x PBS)]在4℃反应16至18小时。之后,移除抗His标签的抗体溶液,以10mL的TBST缓冲溶液润洗PVDF膜三次,每次润洗20分钟。然后,将PVDF膜与抗-小鼠抗体(anti-mouse antibody,稀释倍数1:10000的)的TBST缓冲溶液,在室温反应1小时。之后,移除含抗体的TBST缓冲溶液,加入10mL的TBST缓冲溶液清洗PVDF膜三次后,每次20分钟,加入呈色剂(ECL stain kit,进阶生物科技股份有限公司)进行呈色,其结果如图1B所示。
图1B的结果显示,以抗His卷标的抗体与Erns重组蛋白的N端聚组氨酸(polyhistidine)作用,确认第一沉淀物(1P,图号101的P道)中不可溶蛋白105经过可溶化处理后,在第二上清液(2S)中已转为可溶性蛋白107,如图1B的图号103的S道的箭头所示的可溶性蛋白107,其分子量为28kDa,且含有N端His标签。
另外,利用市售分光仪(例如BioSpectrometer仪器,Eppendorf)测量可溶性蛋白107于280nm的吸光值(OD
(A280吸光值×蛋白消光系数)×样品体积=蛋白浓度(I)。
经计算出可溶性Erns重组蛋白的浓度为(1.2/2.2)×40mL=21.8mg,代表每公升菌液可获得21.8毫克(mg)的可溶性Erns重组蛋白。
含可溶性Erns重组蛋白的第二上清液(图号2S)可选择性通过镍-氮[基]三醋酸琼脂糖管柱(Ni-nitrilotriacetic acid agarose column,Ni-NTA agarose column,Cytiva,进阶生物科技股份有限公司),进行管柱纯化步骤,并以流洗液[图号FT,含有100mM的咪唑(imidazole)]予以流洗。由此所得的蛋白即为纯化的可溶性Erns重组蛋白,如图2A的图号Erns道的箭头所示的可溶性蛋白107,其分子量为28kDa。
请参阅图2B,其是显示图2A的西方转印法的影像结果,其中纯化的可溶性Erns重组蛋白如图2B的图号Erns道的箭头所示的可溶性蛋白107,其分子量为28kDa,且含有N端His标签。
实施例2:猪瘟病毒的Erns重组蛋白的专一性鉴别结合反应
此实施例建立抗原与抗体的免疫结合功能验证,以酵素结合免疫吸附分析法(ELISA)进行猪瘟病毒Erns重组蛋白的专一性鉴别结合反应。
1.4.1生物样本
此实施例将血清来源分别为以下三组:(1)阳性血清组:中国台湾南部某牧场,施打活毒减毒猪瘟病毒疫苗(来源为高市农干燥兔化猪瘟疫苗,中国台湾高雄市农会生物制药厂,仿真猪瘟病毒感染)的六周龄仔猪血清,于施打疫苗二周后采血。(2)阴性血清组:无特定病原的八周龄仔猪(来源为中国台湾动物科技研究所)血清。(3)疫苗组:无特定病原(SPF)的四周龄仔猪(来源为中国台湾动物科技研究所),于施打市售
1.4.2实验步骤
纯化后的Erns重组蛋白利用碳酸盐-碳酸氢盐缓冲溶液(carbonate-bicarbonate buffer,Sigma,友和贸易股份有限公司),把蛋白浓度调整为1μg/μL。接着,将60ng/μLErns重组蛋白涂布在96孔(well)平底微量盘的底部(Corning)。置于4℃达16至18小时。然后,于每孔中加入250μL的PBST(1x PBS及0.5%Tween-20)润洗,于室温进行10分钟,期间以125rpm的转速震荡,并重复此步骤5次。之后,于每孔加入250μL的阻隔缓冲溶液[PBST及5%BSA(Sigma,友和贸易股份有限公司)],37℃达2小时。移除阻隔缓冲溶液后,于每孔加入100μL(稀释比例为1:1500)的各种血清,于37℃反应1小时后,移除各种血清。接着,于每孔加入250μL的PBST(1x PBS及0.5%Tween-20),在室温反应10分钟,以125rpm转速震荡,并重复此步骤5次。然后,于每孔加入100μL的二级抗体[山羊抗猪的辣根过氧化物酶标记的抗体,Goat-anti pig horseradish peroxidase(HRP)Ab,稀释比例为1:10000,abcam(ab18184)],37℃反应1小时后,移除二级抗体。接着,于每孔加入250μL的PBST(1x PBS及0.5%Tween-20),在室温反应10分钟,以125rpm转速震荡,并重复此步骤5次。而后,于每孔加入100μL的呈色受质(例如四甲基联苯胺二盐酸盐,3,3',5,5'-tetramethylbenzidinedihydrochloride,TMB),于室温反应15至20分钟后,加入100μL的终止(STOP)溶液(ScyTek,友和贸易股份有限公司),检测每孔于450nm的吸光值(OD
请参阅图3,其是绘示根据本发明一实施例利用猪瘟病毒Erns可溶性重组蛋白鉴别不同生物样本的柱形图。如图3结果显示,利用上述实施例纯化的猪瘟病毒Erns可溶性重组蛋白,经由ELISA方式测试后,Erns可溶性重组蛋白会和阳性血清组的血清抗体(施打活毒减毒疫苗的仔猪血清)有结合反应,且具有统计上显著差异(如图号*所示,*p<0.05)。然而,上述纯化的猪瘟病毒Erns可溶性重组蛋白与阴性血清组(即SPF仔猪的仔猪血清)以及疫苗组(即施打市售E2次单位疫苗(Bayer)的仔猪血清)皆无免疫结合反应。
上述实施例纯化的猪瘟病毒Erns可溶性重组蛋白确实可与全病毒产生的血清抗体产生专一性结合反应,但与E2次单位疫苗接种的免疫反应产生的抗体则无结合反应,代表上述实施例纯化的猪瘟病毒Erns可溶性重组蛋白确实能有效区分生物样本来源的猪只对象是否受到猪瘟病毒感染,或已接受猪瘟病毒E2次单位疫苗免疫,未来可望应用于猪瘟病毒鉴别型诊断试剂,进而达到清除猪瘟病毒的目标。
综言之,本发明以特定的氨基酸序列、特定的制造方法、特定的组成、特定的分析模式或特定的评估方法仅用于例示说明猪瘟病毒可溶性Erns重组蛋白及其制造方法暨其用于鉴别猪瘟病毒感染的套组及方法。然而,本发明所属技术领域中具有公知常识者应可理解,在不脱离本发明的精神及范围内,其他的氨基酸序列、其他的制造方法、其他的组成、其他的分析模式或其他的评估方法亦可用于猪瘟病毒可溶性Erns重组蛋白及其制造方法暨其用于鉴别猪瘟病毒感染的套组及方法,并不限于上述。
举例而言,猪瘟病毒可溶性Erns重组蛋白可使用其他表现系统(例如真核表现系统)制得,以优化制程及量产。所得的猪瘟病毒可溶性Erns重组蛋白可视实际需求,应用于快筛试剂或生物芯片或其他市售的检验产品。另外,用于鉴别猪瘟病毒感染的生物样本除了血清之外,亦可使用例如离体的脏器、组织、细胞、体液、淋巴液、尿液、全血、血浆及/或细胞培养上清液等。
根据上述实施例,本发明的猪瘟病毒可溶性Erns重组蛋白及其制造方法,其优点在于利用原核转形细胞表现出猪瘟病毒Erns重组蛋白后,将原核转形细胞的细胞沉淀物利用萃取缓冲溶液进行可溶化处理,可获得猪瘟病毒Erns可溶性重组蛋白。当猪瘟病毒Erns可溶性重组蛋白未来可应用于鉴别套组及/或方法,能有效区分生物样本来源的猪只对象是否受到猪瘟病毒感染,或已接受猪瘟病毒E2次单位疫苗免疫。
虽然本发明已以数个特定实施例揭露如上,但其他实施例亦有可能。因此,本发明所附的权利要求书的精神及范围不应限于这里包含的实施例所述。
序列表
<110> 台湾屏东科技大学
<120> 猪瘟病毒可溶性Erns重组蛋白、其制造方法及其用于鉴别猪瘟病毒感染的套组及方法
<130> 无
<160> 2
<210> 1
<211> 228
<212> PRT
<213> 人工序列
<220>
<223> CSFV的Erns重组蛋白
<400> 1
Met Glu Asn Ile Thr Gln Trp Asn Leu Ser Asp Asn Gly Thr Asn Gly
5 10 15
Ile Gln His Ala Met Tyr Leu Arg Gly Val Ser Arg Ser Leu His Gly
20 25 30
Ile Trp Pro Glu Lys Ile Cys Lys Gly Val Pro Thr Tyr Leu Ala Thr
35 40 45
Asp Thr Glu Leu Lys Glu Ile Gln Gly Met Met Asp Ala Ser Glu Gly
50 55 60
Thr Asn Tyr Thr Cys Cys Lys Leu Gln Arg His Glu Trp Asn Lys His
65 70 75 80
Gly Trp Cys Asn Trp Tyr Asn Ile Asp Pro Trp Ile Gln Leu Met Asn
85 90 95
Arg Thr Gln Ala Asn Leu Ala Glu Gly Pro Pro Ala Lys Glu Cys Ala
100 105 110
Val Thr Cys Arg Tyr Asp Lys Asp Ala Asp Ile Asn Val Val Thr Gln
115 120 125
Ala Arg Asn Arg Pro Thr Thr Leu Thr Gly Cys Lys Lys Gly Lys Asn
130 135 140
Phe Ser Phe Ala Gly Thr Val Ile Glu Gly Pro Cys Asn Phe Asn Val
145 150 155 160
Ser Val Glu Asp Ile Leu Tyr Gly Asp His Glu Cys Gly Ser Leu Leu
165 170 175
Gln Asp Thr Ala Leu Tyr Leu Val Asp Gly Met Thr Asn Thr Ile Glu
180 185 190
Asn Ala Arg Gln Gly Ala Ala Arg Val Thr Ser Trp Leu Gly Arg Gln
195 200 205
Leu Ser Thr Ala Gly Lys Arg Leu Glu Gly Arg Ser Lys Thr Trp Phe
210 215 220
Gly Ala Tyr Ala
225
<210> 2
<211> 684
<212> DNA
<213> 人工序列
<220>
<223> CSFV的Erns重组蛋白
<400> 2
ATGGAAAATA TAACTCAATG GAACCTGAGT GACAACGGCA CTAATGGTAT CCAGCATGCT 60
ATGTACCTTA GAGGGGTTAG CAGGAGCTTG CATGGGATCT GGCCGGAAAA AATATGCAAA 120
GGAGTCCCCA CCTACCTGGC CACAGACACG GAACTGAAAG AAATACAGGG AATGATGGAT 180
GCCAGCGAGG GGACAAACTA TACGTGCTGT AAGTTACAGA GACATGAATG GAACAAACAT 240
GGATGGTGTA ACTGGTACAA TATAGACCCC TGGATACAGT TGATGAATAG AACCCAAGCA 300
AACTTGGCAG AAGGCCCTCC GGCCAAGGAG TGCGCTGTGA CTTGCAGGTA CGATAAAGAT 360
GCTGACATCA ACGTGGTCAC CCAGGCCAGA AACAGGCCAA CAACCCTGAC CGGTTGCAAG 420
AAAGGAAAAA ATTTTTCTTT TGCGGGTACA GTTATAGAGG GCCCATGTAA TTTCAATGTT 480
TCCGTGGAGG ATATCTTGTA TGGGGATCAT GAGTGCGGCA GTTTGCTTCA GGACACGGCT 540
CTGTACCTAG TGGATGGAAT GACCAACACT ATAGAGAATG CCAGACAGGG AGCAGCGAGG 600
GTAACATCTT GGCTCGGGAG GCAACTCAGC ACTGCCGGGA AGAGGTTGGA GGGTAGAAGC 660
AAAACCTGGT TTGGTGCCTA TGCC 684
- 一种非典型猪瘟病毒E2蛋白重组杆状病毒及其制备方法和应用
- 特异干扰猪瘟病毒基因组序列及高效治疗猪瘟病毒感染的方法
- 稳定表达猪瘟病毒E2蛋白的重组细胞系、制备方法、应用、及猪瘟病毒亚单位疫苗
