利用激流式生物反应器培养动物细胞的方法
文献发布时间:2023-06-19 19:16:40
技术领域
本发明涉及生物技术领域,特别是涉及利用激流式生物反应器培养动物细胞的方法。
背景技术
动物细胞高密度大规模的培养,有助于提高疫苗、抗体类蛋白质药物的产量,在生物制药领域发挥着重要的作用。目前,用于动物细胞培养的传统生物反应器主要为搅拌式反应器和波浪式反应器。其中,搅拌式反应器的工作原理是通过搅拌桨的转动带动液体形成涡流实现混合过程,通过底部发泡器通入气体进行鼓泡通气实现氧气和二氧化碳与培养基的气液交换。但是,在实际使用过程中,该搅拌式反应器存在搅拌桨和底部通气方式带来的高剪切力、高能量耗散、易泡沫堆积等问题,这种现象在哺乳动物细胞和昆虫细胞高密度培养时尤其显著。而波浪式反应器的工作原理是通过摇动平台摆动产生的波浪来实现袋内的混合过程。该波浪式反应器虽然可有效避免氧传质过程中出现的强剪切力,实现了对剪切敏感细胞有利的无泡气液交换过程,避免了消泡剂的使用,但其主要用于种子扩大培养阶段,且因其反应袋制造工艺的限制而难以支持大体积培养,从而不适合细胞的大规模培养。
同时,在动物细胞大规模培养中,动物细胞培养时的密度均比较高,对氧气的需求量非常大,从而需要很高的氧传质效率。然而不论是波浪式反应器还是搅拌式反应器,提高氧传质效率的方式,均为提高转速或者提高深层氧气的通气量。但是,这两种方式均会带来大量的泡沫以及更高的剪切力,从而产生更高的细胞杀伤效率,降低细胞液中的二氧化碳逸散效率,使得细胞难以维持正常的细胞增殖而导致细胞存活率下降,继而难以实现动物细胞的高密度大规模培养,尤其是对剪切力较为敏感的动物细胞。
由此可知,利用传统的生物反应器培养动物细胞的方法,仍存在难以实现动物细胞的高密度大规模培养以及细胞存活率低的问题。
发明内容
基于此,有必要针对上述问题,提供一种利用激流式生物反应器培养动物细胞的方法,该方法可实现动物细胞的高密度大规模培养,且细胞存活率高。
一种利用激流式生物反应器培养动物细胞的方法,包括以下步骤:
提供激流式生物反应器;
向所述激流式生物反应器中加入细胞基础培养基,并控制预培养条件进行预培养,得到预培养体系;
将动物细胞接种于所述预培养体系中,并控制批培养条件进行批培养,得到目标密度范围的动物细胞;
其中,在所述批培养过程中,通过所述激流式生物反应器的控制系统在线实时监测并控制温度为27.0℃-37.2℃,pH值为6.20-7.35,DO为40%以上,转速为35rpm-60rpm,以及通过定期取样监测和控制葡萄糖的浓度为1.5g/L以上。
在其中一个实施例中,将动物细胞接种于所述预培养体系的步骤中,所述动物细胞接种密度为(0.5-1.2)×10
在其中一个实施例中,所述动物细胞选自悬浮细胞,所述悬浮细胞选自CHO、HEK293或者SF9。
在其中一个实施例中,当所述悬浮细胞选自CHO或者HEK293时,在所述批培养过程中,还包括通过定期取样监测和控制谷氨酰胺的浓度为2mM以上。
在其中一个实施例中,当所述悬浮细胞选自CHO时,在所述批培养过程中,控制所述温度为36.8℃-37.2℃,控制所述pH值为6.95-7.20,控制所述DO值为50%以上,控制所述转速为55rpm-60rpm,控制所述葡萄糖的浓度为3g/L-6g/L,控制所述谷氨酰胺的浓度为2mM-4mM。
在其中一个实施例中,当所述悬浮细胞选自HEK293时,在所述批培养过程中,控制所述温度为36.8℃-37.2℃,控制所述pH值为6.95-7.35,控制所述DO值为50%以上,控制所述转速为35rpm-60rpm,控制所述葡萄糖的浓度为1.5g/L-6.0g/L,控制所述谷氨酰胺的浓度为2mM-4mM。
在其中一个实施例中,当所述悬浮细胞选自SF9时,在所述批培养过程中,控制所述温度为26.8℃-27.2℃,控制所述pH值为6.20-6.40,控制所述DO值为40%以上,控制所述转速为35rpm-60rpm,控制所述葡萄糖的浓度为1.5g/L-5.0g/L。
在其中一个实施例中,所述pH值的控制通过向所述激流式生物反应器中补加碱液或者通入二氧化碳的方式实现;
及/或,所述DO值的控制通过调节激流式生物反应器的表通气量或者转速的方式实现;
及/或,所述葡萄糖的浓度的控制通过补加料液的方式实现。
在其中一个实施例中,预培养的时间为18h-24h。
在其中一个实施例中,在所述批培养的过程中,还包括通过定期取样监测和控制动物细胞密度、细胞活率、乳酸含量、铵根浓度或渗透压。
本发明中,采用激流式生物反应器进行动物细胞的接种培养,一方面,由于激流式生物反应器不含搅拌和发泡器装置,因而,在进行高密度动物细胞培养时,对细胞剪切力很低,气液传质效率高,从而能够满足高密度动物细胞的溶氧需求,提高细胞的存活率;另一方面,通过所述激流式生物反应器的控制系统在线实时监测并控制批培养条件以及通过定期取样监测和控制葡萄糖的浓度,能够为高密度动物细胞培养提供一个长期稳定健康的生长环境,从而提高动物细胞的高密度大规模培养以及存活率。
由此可见,本发明的利用激流式生物反应器培养动物细胞的方法,可实现动物细胞的高密度大规模培养,且细胞存活率高。
附图说明
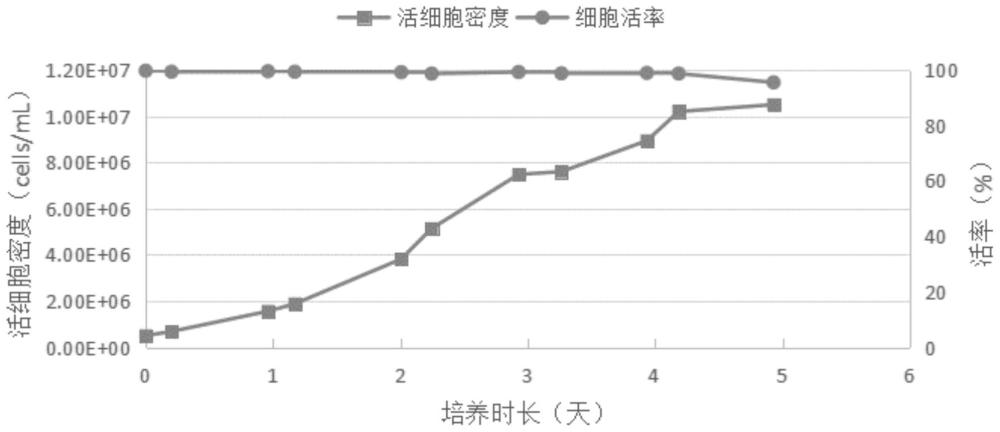
图1为本发明提供的实施例2中CHO细胞在批培养过程中不同时间点的活细胞密度与细胞活率的变化曲线图;
图2为本发明提供的实施例5中HEK-293细胞与对比例8中HEK-293细胞在批培养过程中不同时间点的活细胞密度与细胞活率的变化曲线图;
图3为本发明提供的实施例9中SF9细胞在批培养过程中不同时间点的活细胞密度、细胞活率以及结团率的变化曲线图;
图4为本发明提供的对比例9中SF9细胞在批培养过程中不同时间点的活细胞密度与细胞活率以及结团率的变化曲线图;
图5为本发明提供的实施例9中SF9细胞与对比例9中SF9细胞在批培养过程中的生长曲线图;
图6为本发明提供的实施例9中SF9细胞在批培养时间为4.5h、101h以及214h的细胞形态图;
图7为本发明提供的对比例9中SF9细胞在批培养时间为4.5h、101h以及214h的细胞形态图;
图8为本发明提供的实施例10中SF9细胞在批培养过程中不同时间点的活细胞密度、细胞活率以及结团率的变化曲线图;
图9为本发明提供的对比例11中SF9细胞在批培养过程中不同时间点的活细胞密度与细胞活率以及结团率的变化曲线图;
图10为本发明提供的实施例10中SF9细胞与对比例12中SF9细胞在批培养过程中的生长曲线图;
图11为本发明提供的实施例10中SF9细胞在批培养时间为4.5h、101h以及214h的细胞形态图;
图12为本发明提供的对比例12中SF9细胞在批培养时间为4.5h、101h以及214h的细胞形态图。
具体实施方式
以下将对本发明提供的利用激流式生物反应器培养动物细胞的方法作进一步说明。
本发明的方法主要用于动物细胞的高密度大规模培养,使得接种密度为(0.5-1.2)×10
在采用生物反应器进行动物细胞培养的方法中,本申请人经过长期而深入的研究发现,动物细胞由于没有细胞壁,导致其对于剪切力敏感,细胞娇弱,导致其存活率低,且在高密度大规模培养时,对溶氧量的需求增加。然而,传统的生物反应器(如:波浪式反应器、搅拌式反应器),在进行动物细胞高密度大规模培养时,通过提高氧传质效率而提高溶氧量,而提高氧传质效率的方式则为提高转速或者提高深层氧气的通气量。但是,这两种方式均会带来大量的泡沫以及更高的剪切力,从而产生更高的细胞杀伤效率,降低细胞液中的二氧化碳逸散效率,使得细胞难以维持正常的细胞增殖而导致细胞存活率下降,继而难以实现动物细胞的高密度大规模培养,尤其是对剪切力较为敏感的动物细胞。
而激流式生物反应器是一种非鼓泡式生物反应器,原理是反应器围绕中轴以固定速率旋转,液体随惯性在反应器壁上形成气液传质效率很高的薄膜,随即薄膜被顶部空间氧气饱和后与液体主体相结合,这个过程周而复始不停地提供较强的氧传质效率。激流式生物反应器由于不含搅拌和发泡器装置,对细胞剪切力很低,气液传质效率高,参数控制精准、实验操作简单、同时也具有很好的可放大性,可巧妙的避开波浪式反应器和搅拌式反应器的缺点,是动物细胞(如:哺乳动物、昆虫细胞)培养更佳的反应器。
因而,本发明以激流式生物反应器作为生物反应器,提供了一种利用激流式生物反应器培养动物细胞的方法,包括以下步骤:
S1、提供激流式生物反应器;
S2、向所述激流式生物反应器中加入细胞基础培养基,并控制预培养条件进行预培养,得到预培养体系;
S3、将动物细胞接种于所述预培养体系中,并控制批培养条件进行批培养,得到目标密度范围的动物细胞;其中,在所述批培养过程中,通过所述激流式生物反应器的控制系统在线实时监测并控制温度为27.0℃-37.2℃,pH值为6.20-7.35,DO为40%以上,转速为35rpm-60rpm,以及通过定期取样监测和控制葡萄糖的浓度为1.5g/L以上。
本发明中,通过采用激流式生物反应器进行动物细胞的接种培养,一方面,由于激流式生物反应器不含搅拌和发泡器装置,因而,在进行高密度动物细胞培养时,对细胞剪切力很低,气液传质效率高,从而能够满足高密度动物细胞的溶氧需求,提高细胞的存活率;另一方面,通过所述激流式生物反应器的控制系统在线实时监测并控制批培养条件以及通过定期取样监测和控制葡萄糖的浓度,能够为高密度动物细胞培养提供一个长期稳定健康的生长环境,从而提高动物细胞的高密度大规模培养以及存活率。
由此可见,本发明的利用激流式生物反应器培养动物细胞的方法,可实现动物细胞的高密度大规模培养,且细胞存活率高。
应予说明的是,本发明中批培养是指在培养过程中仅添加葡萄糖、谷氨酰胺等单一成分溶液,而不添加基础培养基、补料培养基等复合培养基溶液的培养方式。
在一实施方式中,所述动物细胞选自悬浮细胞,所述悬浮细胞选自CHO(中国仓鼠卵巢细胞)、HEK293(人类胚胎肾细胞)或者SF9(草地夜蛾卵巢细胞)。进一步优选的,所述CHO选自CHO-K1。
应予说明的是,本发明中细胞基础培养基的种类可根据接种动物细胞的种类进行选择,以满足不同种类细胞的生长需求。如CHO的细胞基础培养基为CHO-WM1基础培养基;HEK293细胞的细胞基础培养基为Celer-S001S基础培养基;SF9细胞的细胞基础培养基为SF-SFM培养基。
在生物制药领域中,对于不同种类的动物细胞的密度需求并不相同,且每种动物细胞所能培养的最大细胞密度均不同,对应的初始培养细胞密度(动物细胞接种密度)也有要求,而初始培养细胞密度的不同,会影响到动物细胞最终的生长密度以及细胞活性。本发明中,优选的,步骤S3中,所述动物细胞接种密度为(0.5-1.2)×10
为了保证激流式生物反应器中培养袋的无菌性以及保证细胞初始培养环境的稳定性,步骤S2中,向激流式生物反应器中的培养袋中加入细胞基础培养基,并设定所述激流式生物反应器的物理反应参数以及控制预培养条件进行预培养18h-24h,得到预培养体系。
在一实施方式中,步骤S2中,所述预培养条件包括温度、pH、DO(溶解氧)和转速,在所述预培养过程中,所述温度和转速可通过所述激流式生物反应器的控制系统自动控制,所述pH值的控制通过向所述激流式生物反应器中补加碱液或者通入二氧化碳的方式实现,优选的,碱液质量分数为8%的碳酸氢钠溶液,用以提高pH值,通入二氧化碳用于降低pH值。
在一实施方式中,步骤S2中,在所述预培养过程中,所述DO值的控制通过调节激流式生物反应器的表通气量或者转速的方式实现。优选的,表通气量的气体选自氧气或者空气中的至少一种,以此来增加培养过程中的溶氧量;通过适当的提高转速可以提高氧传质效率,以此来提高溶氧量,从而满足细胞生长对于氧量的需求。
另外,步骤S3中,在进行批培养之前,还包括设定所述激流式生物反应器的物理反应参数,以便于控制批培养条件,从而保证动物细胞的正常生长以及代谢。
在一实施方式中,步骤S3中,所述批培养条件包括温度、pH、DO(溶解氧)和转速,优选的,所述pH值的控制通过向所述激流式生物反应器中补加碱液或者通入二氧化碳的方式实现,进一步优选的,碱液质量分数为8%的碳酸氢钠溶液,用以提高pH值,通入二氧化碳用于降低pH值。
在一实施方式中,所述DO值的控制通过调节激流式生物反应器的表通气量或者转速的方式实现。优选的,表通气量的气体选自氧气或者空气中的至少一种,以此来增加培养过程中的溶氧量;通过适当的提高转速可以提高氧传质效率,以此来提高溶氧量,从而满足细胞生长对于氧量的需求。
在一实施方式中,葡萄糖的浓度或者谷氨酰胺的浓度的控制可通过补加料液的方式实现。优选的,所述料液为细胞基础培养基。
本发明中,所述激流式生物反应器的容积以及物理反应参数的设定会根据不同种类动物细胞生长所需的培养条件、培养密度以及培养规模做相应调整,使其能够更好的控制培养条件,进而控制细胞的密度以及细胞活性。
在一实施方式中,所述动物细胞选自悬浮细胞,当悬浮细胞为CHO细胞,在容积为5L的激流式生物反应器中进行培养时,预培养阶段:所述激流式生物反应器的物理反应参数设定:Temp:36.8℃-37.2℃,pH:7.05±0.15,DO:≥50%,Motor:48rpm-52rpm,表通:198mL/min-202mL/min空气;批培养阶段:激流式生物反应器的物理反应参数设定:Temp:36.8℃-37.2℃,pH:7.05±0.15,DO:≥50%,Motor:55rpm-60rpm,表通:198mL/min-202mL/min空气。如此设置,可为CHO动物细胞提供一个稳定的生长环境,进一步提高细胞的生长密度以及活性率。
在一实施方式中,所述动物细胞选自悬浮细胞,当悬浮细胞为HEK293,在容积为5L的激流式生物反应器中进行培养时,预培养阶段:所述激流式生物反应器的物理反应参数设定:Temp:36.8℃-37.2℃,pH:7.15±0.20,DO:≥50%,Motor:48rpm-52rpm,表通:98mL/min-102mL/min空气;批培养阶段:所述激流式生物反应器的物理反应参数设定:Temp:36.8℃-37.2℃,pH:7.15±0.20,DO:≥50%,Motor:45rpm-60rpm,表通:98mL/min-102mL/min空气。如此设置,可为HEK293细胞提供一个稳定的生长环境,进一步提高细胞的生长密度以及活性率。
在一实施方式中,所述动物细胞选自悬浮细胞,当悬浮细胞为SF9,在容积为50L的激流式生物反应器中进行培养时,预培养阶段:所述激流式生物反应器的物理反应参数设定:Temp:26.8℃-27.2℃,pH:6.30±0.1,DO:≥40%,Motor:35rpm-45rpm,表通:0.3L/min-0.5L/min空气;批培养阶段:所述激流式生物反应器的物理反应参数设定:Temp:26.8℃-27.2℃,pH:6.30±0.1,DO:≥40%,Motor:35rpm-45rpm,表通:0.3L/min-0.5L/min空气。此设置,可为SF9细胞提供一个稳定的生长环境,进一步提高细胞的生长密度以及活性率。
考虑到不同种类动物细胞所需的营养成分不同,且需要的营养成分很多,如CHO和HEK293生长所需的营养成分除了葡萄糖之外,还包括谷氨酰胺,为了能够及时监测批培养过程中细胞营养成分的变化,并根据变化做相应的调整,为动物细胞提供一个稳态的生长环境。优选的,当所述悬浮细胞选自CHO或者HEK293时,在所述批培养过程中,还包括通过定期取样监测和控制谷氨酰胺的浓度为2mM以上。
在批培养过程中,批培养条件对于提高动物细胞的生长密度、细胞活性以及代谢情况至关重要。
在一实施方式中,所述悬浮细胞选自CHO时,在所述批培养过程中,控制所述温度为36.8℃-37.2℃,控制所述pH值为6.90-7.20,控制所述DO值为50%以上,控制所述转速为55rpm-60rpm,控制所述葡萄糖的浓度为3g/L-6g/L,控制所述谷氨酰胺的浓度为2mM-4mM。
在一实施方式中,所述悬浮细胞选自HEK293时,在所述批培养过程中,控制所述温度为36.8℃-37.2℃,控制所述pH值为6.95-7.35,控制所述DO值为50%以上,控制所述转速为35rpm-60rpm,控制所述葡萄糖的浓度为1.5g/L-6.0g/L,控制所述谷氨酰胺的浓度为2mM-4mM。
在一实施方式中,所述悬浮细胞选自SF9时,在所述批培养过程中,控制所述温度为26.8℃-27.2℃,控制所述pH值为6.20-6.40,控制所述DO值为40%以上,控制所述转速为35rpm-60rpm,控制所述葡萄糖的浓度为1.5g/L-5.0g/L。
如此设置,可为CHO、HEK293或者SF9细胞提供一个健康稳定的生长环境,有利于进一步提高细胞的生长密度以及细胞存活率。
为了能够及时的了解批培养过程中细胞的生长情况以及代谢情况,在一实施方式中,在所述批培养的过程中,还包括通过定期取样监测和控制动物细胞密度、细胞活率、乳酸含量、铵根浓度或渗透压。优选的,每隔8h-12h进行一次取样,并监测和控制所述动物细胞密度、所述细胞活率、所述葡萄糖的浓度、所述谷氨酰胺的浓度、所述乳酸浓度、所述铵根浓度或者所述渗透压。
应予说明的是,本发明中预培养条件基本上与预培养阶段激流式生物反应器的物理反应参数设定一致,批培养条件基本上与批培养阶段激流式生物反应器的物理反应参数设定一致。
以下,将通过以下具体实施例对所述利用激流式生物反应器培养动物细胞的方法做进一步的说明。
应予说明的是,本发明中动物细胞种类、细胞基础培养基以及其他试剂均可通过市场购买得到,同时,本发明中采用Countstar IC100细胞计数仪检测样品的细胞密度、细胞活率、使用西尔曼科技M900生化检测仪检测溶液生化数值以及使用杭州乐乾6003渗透压仪检测溶液渗透压。
实施例1
向容积为5L的激流式生物反应器的培养袋中加入2L的CHO-WM1基础培养基进行预培养24h,并控制预培养条件,得到预培养体系;其中,所述激流式生物反应器的物理反应参数设定:Temp:37℃,pH:7.05,DO:50%,Motor:50rpm,表通:200mL/min空气。然后,将CHO-K1细胞接种于所述预培养体系中,并补加1L的CHO-WM1基础培养基进行批培养,其中,CHO-K1细胞接种密度为0.558×10
实施例2
向容积为5L的激流式生物反应器的培养袋中加入2L的CHO-WM1基础培养基进行预培养24h,并控制预培养条件,得到预培养体系;其中,所述激流式生物反应器的物理反应参数设定:Temp:37℃,pH:7.05,DO:50%,Motor:50rpm,表通:200mL/min空气。然后,将CHO-K1细胞接种于所述预培养体系中,并补加1L的CHO-WM1基础培养基进行批培养,其中,CHO-K1细胞接种密度为0.505×10
实施例3
与实施例2相比,区别仅在于,实施例3中,在批培养过程中,通过所述激流式生物反应器的控制系统在线实时监测并控制批培养条件以及葡萄糖含量的变化,控制温度为37℃,控制pH值为6.9,控制DO为60%,控制转速为55rpm,控制葡萄糖的浓度为6g/L,控制谷氨酰胺浓度为4mM。该实施例培养得到的CHO-K1细胞,其最大细胞密度为1.03×10
实施例4
与实施例2相比,区别仅在于,实施例4中,在批培养过程中,通过所述激流式生物反应器的控制系统在线实时监测并控制批培养条件以及葡萄糖含量的变化,控制温度为37℃,控制pH值为7.05,控制DO为50%,控制转速为45rpm,控制葡萄糖的浓度为5g/L,控制谷氨酰胺浓度为3mM。该实施例培养得到的CHO-K1细胞,其最大细胞密度为1.08×10
实施例5
向容积为5L的激流式生物反应器的培养袋中加入2L的Celer-S001S基础培养基进行预培养24h,并控制预培养条件,得到预培养体系;其中,所述激流式生物反应器的物理反应参数设定:Temp:37℃,pH:7.15,DO:50%,Motor:50rpm,表通:100mL/min空气。然后,将HEK293细胞接种于所述预培养体系中,并补加1L的Celer-S001S基础培养基进行批培养,其中,HEK293细胞接种密度为0.787×10
实施例6
向容积为50L的激流式生物反应器的培养袋中加入15L的Celer-S001S基础培养基进行预培养24h,并控制预培养条件,得到预培养体系;其中,所述激流式生物反应器的物理反应参数设定:Temp:37℃,pH:7.15,DO:50%,Motor:35rpm,表通:800mL/min空气。然后,将HEK293细胞接种于所述预培养体系中,并补加3L的Celer-S001S基础培养基进行批培养,其中,HEK293细胞接种密度为0.802×10
实施例7
与实施例5相比,区别仅在于,实施例7中,在批培养过程中,通过所述激流式生物反应器的控制系统在线实时监测并控制批培养条件以及葡萄糖含量的变化,控制温度为37℃,控制pH值为7.20,控制DO为50%,控制转速为45rpm,控制葡萄糖的浓度为3g/L,控制谷氨酰胺浓度为3mM。该实施例培养得到的HEK293细胞,其最大细胞密度为0.714×10
实施例8
与实施例5相比,区别仅在于,实施例8中,在批培养过程中,通过所述激流式生物反应器的控制系统在线实时监测并控制批培养条件以及葡萄糖含量的变化,控制温度为37℃,控制pH值为7.0,控制DO为50%,控制转速为50rpm,控制葡萄糖的浓度为4g/L,控制谷氨酰胺浓度为2mM。该实施例培养得到的HEK293细胞,其最大细胞密度为0.729×10
实施例9
向容积为50L的激流式生物反应器的培养袋中加入12L的SF-SFM培养基进行预培养24h,并控制预培养条件,得到预培养体系;其中,所述激流式生物反应器的物理反应参数设定:Temp:27℃,pH:6.20,DO:50%,Motor:35rpm,表通:0.4L/min空气。然后,将复苏后的SF9细胞接种于所述预培养体系中,并补加3L的SF-SFM培养基使最终培养体积为15L进行批培养,其中,SF9细胞接种密度为0.794×10
实施例10
与实施例9相比,区别仅在于,实施例10中,在批培养过程中,通过所述激流式生物反应器的控制系统在线实时监测并控制批培养条件以及葡萄糖含量的变化,控制温度为27℃,控制pH值为6.30,控制DO为50%,控制转速为36rpm,控制葡萄糖的浓度为5g/L。该实施例培养得到的SF9细胞,其最大细胞密度为1.11×10
实施例11
与实施例9相比,区别仅在于,实施例11中,在批培养过程中,通过所述激流式生物反应器的控制系统在线实时监测并控制批培养条件以及葡萄糖含量的变化,控制温度为27.0℃,控制pH值为6.4,控制DO为50%,控制转速为35rpm,控制葡萄糖的浓度为3g/L。该实施例培养得到的SF9细胞,其最大细胞密度为1.18×10
实施例12
与实施例9相比,区别仅在于,实施例12中,在批培养过程中,通过所述激流式生物反应器的控制系统在线实时监测并控制批培养条件以及葡萄糖含量的变化,控制温度为27.0℃,控制pH值为6.30,控制DO为50%,控制转速为38rpm,控制葡萄糖的浓度为4g/L。该实施例培养得到的SF9细胞,其最大细胞密度为1.01×10
对比例1
与实施例2相比,区别仅在于,对比例1中,在批培养过程中,通过所述激流式生物反应器的控制系统在线实时监测并控制批培养条件以及葡萄糖含量的变化,控制温度为37℃,控制pH值为7.4,控制DO为30%,控制转速为60rpm,控制葡萄糖的浓度为4g/L,控制谷氨酰胺浓度为2mM。该对比例培养得到的CHO-K1细胞,其最大细胞密度为0.77×10
对比例2
与实施例2相比,区别仅在于,对比例2中,在批培养过程中,通过所述激流式生物反应器的控制系统在线实时监测并控制批培养条件以及葡萄糖含量的变化,控制温度为37℃,控制pH值为7.05,控制DO为50%,控制转速为70rpm,控制葡萄糖的浓度为1.4g/L,控制谷氨酰胺浓度为5mM。该对比例培养得到的CHO-K1细胞,其最大细胞密度为0.35×10
对比例3
与实施例2相比,区别仅在于,对比例3中,采用波浪式生物反应器替换激流式生物反应器进行CHO-K1细胞的培养,摇摆频率12rpm、摇摆角度6°,其余条件相同。该对比例培养得到的CHO-K1细胞,其最大细胞密度为0.75×10
对比例4
与实施例2相比,区别仅在于,对比例4中,采用搅拌式生物反应器替换激流式生物反应器进行CHO-K1细胞的培养,搅拌速度75rpm,表通空气0.8L/min,其余条件相同。该对比例培养得到的CHO-K1细胞,其最大细胞密度为0.84×10
对比例5
与实施例5相比,区别仅在于,对比例5中,在批培养过程中,通过所述激流式生物反应器的控制系统在线实时监测并控制批培养条件以及葡萄糖含量的变化,控制温度为36.8℃,控制pH值为6.8,控制DO为35%,控制转速为55rpm,控制葡萄糖的浓度为1.2g/L,控制谷氨酰胺浓度为1.5mM。该对比例培养得到的HEK293细胞,其最大细胞密度为0.46×10
对比例6
与实施例5相比,区别仅在于,对比例6中,采用波浪式生物反应器替换激流式生物反应器进行HEK293细胞的培养,摇摆频率12rpm、摇摆角度6°,其余条件相同。该对比例培养得到的HEK293细胞,其最大细胞密度为0.43×10
对比例7
与实施例5相比,区别仅在于,对比例7中,采用搅拌式生物反应器替换激流式生物反应器进行HEK293细胞的培养,搅拌速度75rpm,表通空气0.8L/min,其余条件相同。该对比例培养得到的HEK293细胞,其最大细胞密度为0.62×10
对比例8
与实施例5相比,区别仅在于,对比例8中,将HEK293细胞接种于摇瓶中进行培养,培养体积为30mL,温度设定37℃,5%的CO2浓度,其余条件相同。该对比例培养得到的HEK293细胞,其最大细胞密度为0.7×10
对比例9
与实施例9相比,区别仅在于,对比例9中,在批培养过程中,通过所述激流式生物反应器的控制系统在线实时监测并控制批培养条件以及葡萄糖含量的变化,控制温度为27℃,控制pH值为6.5,控制DO为30%,控制转速为33rpm,控制葡萄糖的浓度为4g/L。该对比例培养得到的SF9细胞,其最大细胞密度为0.75×10
对比例10
与实施例9相比,区别仅在于,对比例10中,采用波浪式生物反应器替换激流式生物反应器进行SF9细胞的培养,设定摇摆频率12rpm、摇摆角度6°,其余条件相同。该对比例培养得到的SF9细胞,其最大细胞密度为0.82×10
对比例11
与实施例9相比,对比例11中,将复苏后的SF9细胞接种于含有30mL SF-SFM培养基的摇瓶中,温度设定27℃,0%的CO
对比例12
与实施例10相比,对比例12中,将复苏后的SF9细胞接种于含有30mL SF-SFM培养基的摇瓶中,温度设定27℃,0%的CO
参见图1可清晰得出,本实施例2中培养的细胞生长状态良好,全程维持在高活率,从接种开始至第4天细胞处于对数生长期,倍增时间小于24h;当细胞培养至第5天时细胞达到平台期,峰值密度在1.05×10
参见图2,由图2可知,本实施例5中HEK293细胞生长状态良好,活率从刚开始培养一直高于对比例8中摇瓶并且全程一直处于高活率状态,对比例8中摇瓶密度增长缓慢,且活率逐渐下降。从接种开始至第3天细胞处于对数生长期,倍增时间在48小时左右,细胞峰值密度在0.733×10
同时,本实施例5中HEK-293细胞整个培养周期中,温度十分稳定,并无明显波动,且pH曲线保持稳定,整体由于乳酸积累导致pH呈下降趋势,但波动较小,均在允许范围内。同时,实施例5中激流式生物反应器转速初始为50rpm,由于细胞密度增长导致耗氧量逐渐增加,溶氧曲线下滑较快,第二天提高转速至55rpm,在55rpm条件下后面仅通空气调控,就可以在不通纯氧的情况下维持HEK293细胞的正常培养,这说明激流式反应器气液传质效率极高,表通空气就能维持较高密度的细胞溶氧需求,可以大幅降低培养过程中的氧气通气量。因此,激流式反应器由于仅通过表通空气和氧气进行溶氧传递,所以不存在传统搅拌式反应器液面以下鼓泡通气导致产生的大量泡沫,也不存在鼓泡通气时能量耗散导致的细胞损伤,同时也大幅降低了泡沫破裂时对细胞产生的杀伤力。
参见图3-12可知,本发明实施例9和实施例10在激流式生物反应器上培养SF9细胞至第7天时最大密度可达1.11×10
由此可见,本发明中采用激流式生物反应器培养CHO、HEK293以及SF9细胞的可行性和优越性。
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 一种利用激流式生物反应器悬浮培养动物细胞的工艺过程及控制方法
- 一种利用激流式生物反应器悬浮培养动物细胞的工艺过程及控制方法
