间充质干细胞在制备治疗系统性红斑狼疮的药物中的用途
文献发布时间:2023-06-19 19:27:02
技术领域
本发明涉及生物技术领域,具体涉及间充质干细胞在制备治疗系统性红斑狼疮的药物中的用途。
背景技术
系统性红斑狼疮(Systemic lupus erythematosus,SLE)是一种自身免疫性炎症疾病。数据显示,亚洲人的患病率和发病率比欧洲人群高出2至3倍,其中我国患病人群主要集中在育龄女性,目前有超过百万的系统性红斑狼疮患者,给患者和家庭带来沉重的负担。SLE的病因至今尚未肯定,大量研究显示其发病原因与遗传、内分泌、感染、免疫异常和一些环境因素有关。目前关于红斑狼疮的常规治疗方法有糖皮质激素、免疫抑制剂等药物,然而这些治疗药物都有明显的副作用并且治疗效果参差不齐。近年来研究发现,来源于脐带胎盘等组织类型的传统间充质干细胞(Mesenchymal Stem Cells,MSCs)具有免疫调节能力而被应用于SLE治疗,然而传统组织来源的MSCs细胞的免疫抑制能力有限,细胞功能异质性较高,且含量较低,体外扩增能力有限,且收获的细胞数量难以满足临床移植需求。
发明内容
根据第一方面,在一实施例中,提供诱导性间充质干细胞或胚胎干细胞在制备治疗系统性红斑狼疮的药物中的用途。
根据第二方面,在一实施例中,提供一种诱导性间充质干细胞的制备方法,包括:
一次分化步骤,包括提供诱导性多能干细胞,使用第一诱导性间充质干细胞培养基培养,得到一次分化细胞;
二次分化步骤,使用第二诱导性间充质干细胞培养基培养所述一次分化细胞,得到诱导性间充质干细胞。
根据第三方面,在一实施例中,提供第二方面所述的制备方法制得的诱导性间充质干细胞。
根据第四方面,在一实施例中,提供一种药物组合物,包含第三方面的诱导性间充质干细胞。该组合物还可以包含其他常用的药物制剂或载体。
依据上述实施例的诱导性间充质干细胞在制备治疗系统性红斑狼疮的药物中的用途,通过质控分析显示,本发明提供的多能干细胞来源iMSCs相比较于传统组织来源MSCs具有显著的免疫抑制作用,具有较好的应用价值。
在一实施例中,本发明首次针对治疗系统性红斑狼疮建立了多能干细胞来源的间充质干细胞(iMSCs)制剂制备及质控方法,本发明具有操作步骤简单、工艺体系安全稳定,且体外可以无限制扩增制备等优势;
附图说明
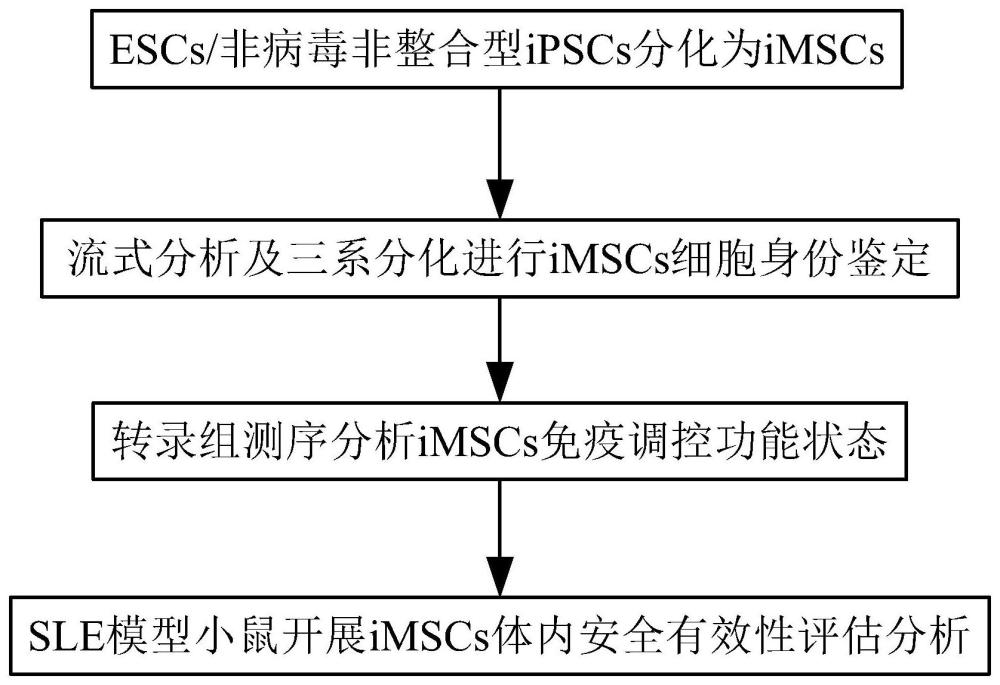
图1为一种实施例的iMSCs制剂制备及质控流程示意图;
图2为实施例1的iMSCs形态图;
图3.1为实施例2的阳性细胞比例结果图;
图3.2为实施例2的细胞分化能力评价结果图;
图4.1为实施例3中的免疫抑制能力整体评估结果图;
图4.2为实施例3中的免疫抑制相关特定基因分析结果图;
图5为实施例4中的iMSCs体内安全有效性评估分析结果图。
具体实施方式
下面通过具体实施方式结合附图对本发明作进一步详细说明。在以下的实施方式中,很多细节描述是为了使得本申请能被更好的理解。然而,本领域技术人员可以毫不费力的认识到,其中部分特征在不同情况下是可以省略的,或者可以由其他材料、方法所替代。在某些情况下,本申请相关的一些操作并没有在说明书中显示或者描述,这是为了避免本申请的核心部分被过多的描述所淹没,而对于本领域技术人员而言,详细描述这些相关操作并不是必要的,他们根据说明书中的描述以及本领域的一般技术知识即可完整了解相关操作。
另外,说明书中所描述的特点、操作或者特征可以以任意适当的方式结合形成各种实施方式。同时,方法描述中的各步骤或者动作也可以按照本领域技术人员所能显而易见的方式进行顺序调换或调整。因此,说明书和附图中的各种顺序只是为了清楚描述某一个实施例,并不意味着是必须的顺序,除非另有说明其中某个顺序是必须遵循的。
本文中为部件所编序号本身,例如“第一”、“第二”等,仅用于区分所描述的对象,不具有任何顺序或技术含义。
现有的MSCs除了免疫抑制能力有限之外,存在的缺陷还包括:非组织来源MSCs制备依然是技术挑战,尽管目前有研究利用胚胎干细胞(Embryonic Stem Cells,ESCs)或诱导性多能干细胞(Induced Pluripotent Stem Cells,iPSCs)等多能干细胞进行诱导性间充质干细胞(Induced Pluripotent Stem Cells derived Mesenchymal Stem Cells,iMSCs)的制备,然而iMSCs主要依赖于使用动物血清及多重生物小分子的处理,且程序复杂,出现高度异质性等难题。此外,针对iMSCs的免疫调控功能状态评估分析方法相对缺乏。前述缺陷限制了iMSCs针对SLE疾病的干预应用。
根据第一方面,在一实施例中,提供诱导性间充质干细胞或胚胎干细胞在制备治疗系统性红斑狼疮的药物中的用途。本发明提供的多能干细胞来源iMSCs相比较于传统组织来源M SCs具有显著的免疫抑制作用,具有较好的应用价值。
在一实施例中,所述诱导性间充质干细胞是由诱导性多能干细胞分化得到。
在一实施例中,所述诱导性间充质干细胞的制备方法包括:
一次分化步骤,包括提供诱导性多能干细胞,使用第一诱导性间充质干细胞培养基培养,得到一次分化细胞;
二次分化步骤,使用第二诱导性间充质干细胞培养基培养所述一次分化细胞,得到诱导性间充质干细胞。
在一实施例中,一次分化步骤中,所述诱导性多能干细胞包括非整合非病毒诱导性多能干细胞。
在一实施例中,一次分化步骤中,所述第一诱导性间充质干细胞培养基中含有抑制剂。
在一实施例中,所述抑制剂包括但不限于PORCN抑制剂。
在一实施例中,所述PORCN抑制剂包括但不限于Wnt-C59。Wnt-C59通过与Wnt家族信号通路作用来促进上皮间质转换而达到分化iMSCs的作用。
在一实施例中,所述第一诱导性间充质干细胞培养基中细胞生长因子的浓度为0.1μmol/L~0.5μmol/L
在一实施例中,二次分化步骤中,所述第二诱导性间充质干细胞培养基中含有细胞生长因子。
在一实施例中,所述细胞生长因子包括但不限于碱性成纤维细胞生长因子(bFGF)。
在一实施例中,所述第二诱导性间充质干细胞培养基中细胞生长因子的浓度为3~7ng/mL,优选为5ng/mL。
在一实施例中,还包括分化能力鉴定步骤,包括将二次分化步骤得到的P1代细胞培养至P5代,对所得的P5代诱导性间充质干细胞进行CD73、CD90、CD105阳性细胞比例以及CD34、CD45阳性细胞比例进行鉴定。
在一实施例中,如果CD73、CD90、CD105阳性细胞比例均大于95%,以及CD34、CD45阳性细胞比例均小于2%,则判定该细胞为诱导性间充质干细胞。
在一实施例中,分化能力鉴定步骤中,包括将二次分化步骤得到的P1代细胞培养至P5代,对所得的P5代诱导性间充质干细胞进行成骨(Osteogenic)、软骨(Chondrogenic)、成脂(Adipogenic)分化能力鉴定。
在一实施例中,还包括免疫调控功能评价步骤,包括将二次分化步骤得到的P1代细胞培养至P5代,对所得的P5代诱导性间充质干细胞进行表达基因检测,根据检测结果评价诱导性间充质干细胞的免疫抑制能力。
在一实施例中,免疫调控功能评价步骤中,检测P5代诱导性间充质干细胞与脐带来源间充质干细胞的差异表达基因。
在一实施例中,如果促炎因子在P5代诱导性间充质干细胞中的表达显著降低,表明诱导性间充质干细胞具有较高的免疫抑制能力。
在一实施例中,所述促炎因子包括但不限于IL6、IL1B中的至少一种。
在一实施例中,还包括安全有效性评估步骤,包括评估二次分化步骤所得的诱导性间充质干细胞在动物体内的免疫抑制有效性。
在一实施例中,如果注射所述诱导性间充质干细胞的动物体的尿液中尿蛋白显著降低,则表明诱导性间充质干细胞在动物体内具有显著的免疫抑制有效性。
在一实施例中,所述动物包括但不限于小鼠。
根据第二方面,在一实施例中,提供一种诱导性间充质干细胞的制备方法,包括:
一次分化步骤,包括提供诱导性多能干细胞,使用第一诱导性间充质干细胞培养基培养,得到一次分化细胞;
二次分化步骤,使用第二诱导性间充质干细胞培养基培养所述一次分化细胞,得到诱导性间充质干细胞。
在一实施例中,一次分化步骤中,所述诱导性多能干细胞包括非整合非病毒诱导性多能干细胞。
在一实施例中,一次分化步骤中,所述第一诱导性间充质干细胞培养基中含有抑制剂。
在一实施例中,所述抑制剂包括但不限于PORCN抑制剂。
在一实施例中,所述PORCN抑制剂包括但不限于Wnt-C59。Wnt-C59通过与Wnt家族信号通路作用来促进上皮间质转换而达到分化iMSCs的作用。
在一实施例中,所述第一诱导性间充质干细胞培养基中细胞生长因子的浓度为0.1μmol/L~0.5μmol/L
在一实施例中,二次分化步骤中,所述第二诱导性间充质干细胞培养基中含有细胞生长因子。
在一实施例中,所述细胞生长因子包括但不限于碱性成纤维细胞生长因子(bFGF)。
在一实施例中,所述第二诱导性间充质干细胞培养基中细胞生长因子的浓度为3~7ng/mL,优选为5ng/mL。
在一实施例中,还包括分化能力鉴定步骤,包括将二次分化步骤得到的P1代细胞培养至P5代,对所得的P5代诱导性间充质干细胞进行CD73、CD90、CD105阳性细胞比例以及CD34、CD45阳性细胞比例进行鉴定。
在一实施例中,如果CD73、CD90、CD105阳性细胞比例均大于95%,以及CD34、CD45阳性细胞比例均小于2%,则判定该细胞为诱导性间充质干细胞。
在一实施例中,分化能力鉴定步骤中,包括将二次分化步骤得到的P1代细胞培养至P5代,对所得的P5代诱导性间充质干细胞进行成骨(Osteogenic)、软骨(Chondrogenic)、成脂(Adipogenic)分化能力鉴定。
在一实施例中,还包括免疫调控功能评价步骤,包括将二次分化步骤得到的P1代细胞培养至P5代,对所得的P5代诱导性间充质干细胞进行表达基因检测,根据检测结果评价诱导性间充质干细胞的免疫抑制能力。
在一实施例中,免疫调控功能评价步骤中,检测P5代诱导性间充质干细胞与脐带来源间充质干细胞的差异表达基因。
在一实施例中,如果促炎因子在P5代诱导性间充质干细胞中的表达显著降低,表明诱导性间充质干细胞具有较高的免疫抑制能力。
在一实施例中,所述促炎因子包括但不限于IL6、IL1B中的至少一种。
在一实施例中,还包括安全有效性评估步骤,包括评估二次分化步骤所得的诱导性间充质干细胞在动物体内的免疫抑制有效性。
在一实施例中,如果注射所述诱导性间充质干细胞的动物体的尿液中尿蛋白显著降低,则表明诱导性间充质干细胞在动物体内具有显著的免疫抑制有效性。
在一实施例中,所述动物包括但不限于小鼠。
根据第三方面,在一实施例中,提供第二方面所述的制备方法制得的诱导性间充质干细胞。
根据第四方面,在一实施例中,提供一种药物组合物,包含第三方面的诱导性间充质干细胞。该组合物还可以包含其他常用的药物制剂或载体。
在一实施例中,本发明的目的在于建立一种治疗系统性红斑狼疮的干细胞制剂的方法,本发明首先利用ESCs或非病毒非整合型iPSCs作为细胞模型,利用无血清、无外源动物成分iMSCs分化体系,获得ESCs或iPSCs分化来源的iMSCs;其次针对上述获得的iMSCs,利用流式分析及三系分化进行细胞身份鉴定,高表达CD73、CD90、CD105及低表达CD34、CD45。其次利用转录组测序完成iMSCs的免疫调控功能状态的评估分析,相比较于传统组织来源MSCs,具有较高的免疫抑制特点。最后利用SLE模型小鼠开展安全有效性评估分析。为最终获得治疗系统性红斑狼疮的临床应用级别的人类iMSCs干细胞制剂奠定了良好的技术基础。
在一实施例中,针对现有治疗系统性红斑狼疮干细胞药物的技术瓶颈,本发明建立了一套操作简单、稳定性好、无限扩增能力且高质量的iMSCs制剂制备及质控体系。整体过程包括:(1)ESCs/非病毒非整合型iPSCs分化为iMSCs。(2)流式分析及三系分化进行iMSCs细胞身份鉴定。(3)转录组测序分析iMSCs免疫调控功能状态。(4)SLE模型小鼠开展iMS Cs体内安全有效性评估分析。图1为流程示意图,具体包括如下步骤:
(1)ESCs/非病毒非整合型iPSCs分化为iMSCs。
1)复苏ESCs/非整合非病毒iPSCs至预先包被5μg玻连蛋白的6孔板中,置于37℃培养箱培养3~5天后细胞达到70%左右的汇合度。
2)吸弃TeSR-E8培养基(STEMCELL technologies),加入1mL D-PBS(不含Ca
3)吸弃6孔板中iMSCs分化培养基1,加入1mL D-PBS(不含Ca
(2)流式分析及三系分化进行iMSCs细胞身份鉴定。
1)在显微镜下观察细胞在80%左右汇合度的P5代iMSCs细胞,使用0.05%TrypLE
2)在80%左右汇合度的P5代iMSCs细胞,使用0.05% TrypLE
(3)转录组测序分析iMSCs免疫调控功能状态。
在80%左右汇合度的P5代iMSCs细胞与P5代UMSCs细胞(脐带来源间充质干细胞,本实验室构建的细胞株,经过系统生物学鉴定),使用0.05% TrypLE
UMSCs来源广泛,可以是实验室自行制备,也可以是商业化购买,无明确限制。本实施例是采用本实验室自行构建的UMSCs,为P5代次。P5代是临床试验最常用类型。
(4)SLE模型小鼠开展iMSCs体内安全有效性评估分析。
14周龄的MRL/lpr小鼠具有典型SLE疾病表型后分为3组,包括iMSCs组、UMSCs组和PBS组,每组不少于6只小鼠。其中iMSCs组和UMSCs组每周分别尾静脉回输5×10
在一实施例中,本发明首次针对治疗系统性红斑狼疮建立了多能干细胞来源的间充质干细胞(iMSCs)制剂制备及质控方法,首先利用ESCs/非病毒非整合型iPSCs分化为iMSCs;ESCs和iPSCs具有无限扩增的特点,解决了组织来源MSCs扩增能力有限的技术难题,亦避免了不用组织来源引入的MSCs异质性,成为干细胞制剂批次均一性生产和有效质控的有力保障。
在一实施例中,本发明不需要饲养层细胞和胎牛血清,培养基成分明确,操作简单,且利用无外源基因组整合风险的iPSCs细胞系,能够高效稳定地制备出人类iMSCs细胞。
在一实施例中,根据国际及行业相关鉴定及质控标准,本发明利用流式分析及三系分化进行iMSCs细胞身份鉴定;包括CD73、CD90、CD105阳性细胞比例均大于95%;CD34、CD45阳性细胞比例均小于2%;且具备软骨、成脂和成骨分化能力。最后利用3D微载片体系完成iMSCs的规模化扩增,细胞均一性较好。进一步通过转录组测序分析iMSCs免疫调控功能状态;利用iMSCs和UMSCs差异表达基因作为输入文件进行GO分类功能注释,基于Pvalue显著性进行筛选分析iMSCs免疫调控能力体外评价。最后利用SLE模型小鼠开展iMSCs体内安全有效性评估分析;SLE小鼠阶段性细胞回输干预后,24h尿液进行尿蛋白检测;采集眼球全血进行免疫调节分子包括IL6、IL10、IL17和TGFβ1检测分析以及anti-dsDNA、anti-ANA检测分析;根据蛋白尿等以上指标来综合判断iMSCs免疫抑制功能状态。
在一实施例中,本发明针对治疗系统性红斑狼疮建立了多能干细胞来源的间充质干细胞(iMSCs)制剂制备及质控方法,为自体免疫性疾病的细胞治疗打下良好的技术基础。
实施例1:ESCs/非病毒非整合型iPSCs分化为iMSCs。
1)在GMP实验室条件下,利用TeSR-E8培养基(STEMCELL technologies)复苏非整合非病毒iPSCs至预先包被5μg玻连蛋白的6孔板中,置于37℃培养箱培养3~5天后,iPSCs细胞达到70%左右的汇合度。IPSCs来源广泛,可以是实验室自行制备,也可以是商业化购买,无明确限制。本实施例是采用本实验室自行构建的非整合非病毒iPSCs。
2)吸弃TeSR-E8培养基(STEMCELL technologies),加入1mL D-PBS(杜氏磷酸缓冲盐溶液,Dulbecco's Phosphate-Buffered Saline,不含Ca
干细胞应用的原则是尽量减少小分子使用数量以及尽量使用临床级别培养体系;例如,现有的CHIR99021与细胞免疫功能活性相关,与IL6、IL1B关系较为复杂,因此本发明未使用该分子。
3)吸弃6孔板中iMSCs分化培养基1,加入1mL D-PBS(不含Ca
先前测试实验显示友康NC0103培养获得的细胞具有较好的细胞免疫活性,且友康NC0103培养基更趋近于临床级别,具有更好的应用前景。
实施例2:流式分析及三系分化进行iMSCs细胞身份鉴定。
1)在显微镜下观察细胞在80%左右汇合度的P5代iMSCs细胞,使用0.05%TrypLE
2)在80%左右汇合度的P5代iMSCs细胞,使用0.05% TrypLE
实施例3:转录组测序分析iMSCs免疫调控功能状态。
在80%左右汇合度的P5代iMSCs细胞与UMSCs细胞(脐带来源间充质干细胞),使用0.05% TrypLE
实施例4:SLE模型小鼠开展iMSCs体内安全有效性评估分析。
14周龄的MRL/lpr小鼠具有典型SLE疾病表型后分为3组,每组8只,包括P5代iMSCs组、P5代UMSCs组和PBS组,其中iMSCs组和UMSCs组每周分别尾静脉回输5×10
现有技术中通过脐带组织分离获取间充质干细胞,组织内目标细胞含量有限,且体外扩增能力有限,对应获得细胞数量难以满足临床上对细胞量的需求;另外消化所使用的胰蛋白酶不利于临床上对细胞的质量控制需求。在一实施例中,本发明的iPSCs细胞(诱导性多能干细胞)可以无限增殖,通过分化可以获得无限数量的诱导性间充质干细胞,操作易于规模化,且使用无血清体系,具有较好的临床应用优势。本发明的iMSCs相对于UMSCs具有优异的免疫抑制能力。
并且,现有技术中通过脐带组织分离获取间充质干细胞,细胞数量局限,且需要通过H LA-G进行分选等,操作繁琐、细胞得率低,使用血清及抗生素等培养体系,且组织来源间充质干细胞扩增能力有限。
有的现有技术通过脐带组织分离间充质干细胞后,经过体细胞重编程获得诱导性多能干细胞,进一步结合小分子等分化为iMSCs。在一实施例中,本发明直接使用诱导性多能干细胞或胚胎干细胞,原始材料上相对广泛拓宽,且分化和扩增步骤(扩增阶段使用商业化临床级规模化培养基,没有额外增加生长因子)有减少相应小分子,步骤得以优化,并且结合转录组测序剖析出具有免疫抑制特征,更利于定向适用于自体免疫疾病,例如SLE疾病的应用。
在一实施例中,本发明首次针对治疗系统性红斑狼疮建立了多能干细胞来源的间充质干细胞(iMSCs)制剂制备及质控方法,本发明具有操作步骤简单、工艺体系安全稳定,且体外可以无限制扩增制备等优势;通过质控分析显示,多能干细胞来源iMSCs相比较于传统组织来源MSCs具有显著的免疫抑制作用,具有较好的应用价值。本发明针对治疗系统性红斑狼疮首次建立了多能干细胞来源的间充质干细胞(iMSCs)制剂制备及质控方法,为自体免疫性疾病的细胞治疗打下良好的技术基础。
在一实施例中,不限于诱导性多能干细胞,胚胎干细胞也可用于制备治疗系统性红斑狼疮的药物。
以上应用了具体个例对本发明进行阐述,只是用于帮助理解本发明,并不用以限制本发明。对于本发明所属技术领域的技术人员,依据本发明的思想,还可以做出若干简单推演、变形或替换。
- 人脐带间充质干细胞在制备脑瘫药物中的应用及培养方法
- Salubrinal在制备治疗骨髓间充质干细胞衰老的药物中的新用途
- 脂肪间充质干细胞在制备治疗薄型子宫内膜药物中的用途
