一种冠状病毒病原体核酸检测试剂及其检测方法和应用
文献发布时间:2023-06-19 19:27:02
技术领域
本发明涉及生物检测技术领域,具体而言,涉及一种冠状病毒病原体核酸检测试剂及其检测方法和应用。
背景技术
冠状病毒呈球形且具有多形型,直径约80~160nm,有囊膜,并包含一段不分段的、线性单股正链RNA基因组,其基因组是已知RNA病毒中最长的,约27~32kb,该RNA含有5'帽子结构和3'聚腺苷酸,还包含多个开放阅读框。目前,冠状病毒被分为α、β、γ和δ四大类,人冠状病毒主要分布在α类和β类,而感染人类的冠状病毒共有七种,致病性较弱的有α冠状病毒属中的HCoV-229E和HCoV-NL63,和β冠状病毒属中的HCoV-OC43、HCoV-HKU1;致病性较强的有β冠状病毒属中的SARS-CoV、MERS-CoV以及SARS-CoV-2。
冠状病毒是一种传染性比较强的病毒,会通过直接、间接接触或气溶胶进行传播,其致病过程大致分为3个阶段,即病毒侵入、复制阶段、过度免疫应答和急性肺损伤阶段,它们首先经由飞沫传播、气溶胶传播和接触传播等途径到达机体,靠静电作用吸附在细胞外表面,随后病毒表面的刺突蛋白(S)或血凝素酯酶蛋白(HE)与敏感细胞膜表面特异性的细胞受体识别并结合,并利用多种方式成功逃逸宿主天然免疫反应,启动病毒的生命周期。与此同时,在机体与病毒的这场博弈中会诱发大量的促炎性细胞因子和趋化因子产生,启动“细胞因子风暴”效应,使靶细胞受损或死亡,进而造成局部组织、器官病变或坏死,最后释放出的子代病毒再不断地去感染其他未受感染的细胞,并随着病毒的不断复制,使机体病情不断恶化,病程加剧。冠状病毒感染的主要致病特征是呼吸道感染与宿主免疫系统的过激反应。
从感染冠状病毒到疾病发作需要经历一个两周左右的潜伏期,早期症状与感冒类似,还有研究表明SARS-CoV-2感染的患者或无症状感染者在潜伏期就具有传染性,所以及时准确的对疑似病例进行确诊、研发有效的治疗药物和抗体以及开发安全有效的疫苗是防止疫情进一步扩大的重要手段。
目前,有血清学检测、核酸检测、电镜技术、病毒的分离培养等检测冠状病毒的方式,其中,血清学检测和核酸检测是检测冠状病毒的主要方式。电镜技术可以用于冠状病毒形态学鉴定和观察,但依赖于科技含量高的电镜设备,合适在实验室里进行形态研究。病毒分离培养是病毒检测的金标准,但病毒的分离对技术的依赖性较高,并且与样本质量、病毒的细胞嗜性以及分离体系有关。血清学检测包括IgM抗体检测法、IgG抗体检测法、IgM/IgG双抗体检测法,其具有可操作性强,适用范围广等优点;但检测样品容易污染或溶血,可能存在假阳性或假阴性的检测结果。
目前,冠状病毒检测多用核酸检测的方式,核酸检测包括全基因组高通量测序、实时荧光定量PCR、多重PCR技术、逆转录环介导等温扩增等方式,其中,全基因组高通量测序能够检测到冠状病毒的整个基因组,但是成本高昂,对设备的依赖性较高;实时荧光定量PCR是目前核酸检测最常用的检测方式,但同样需要价格昂贵的设备进行辅助;多重PCR技术的检测效率较高,可以同时检测多种病毒;逆转录环介导等温扩增具有方便省时、不依赖设备等优点,适合于现场检测,但检测的准确度和重复性有待提高,可能会出现假阴性的风险。
鉴于此,特提出本发明。
发明内容
本发明的目的在于提供一种冠状病毒病原体核酸检测试剂及其检测方法和应用。
本发明是这样实现的:
第一方面,本发明实施例提供了一种冠状病毒病原体核酸检测试剂,其包括用于检测β冠状病毒OC43靶标区域和HKU1靶标区域的核酸组合物;其中,所述OC43靶标区域的序列如SEQ ID No:1所示,所述HKU1靶标区域的序列如SEQ ID No:2所示。
第二方面,本发明实施例提供了如前述实施例所述的冠状病毒病原体核酸检测试剂在制备用于检测冠状病毒病原体核酸的试剂盒中的应用。
第三方面,本发明实施例提供了一种用于检测冠状病毒病原体核酸的试剂盒,其包括如前述实施例所述的冠状病毒病原体核酸检测试剂。
第四方面,本发明实施例提供了一种冠状病毒病原体核酸的检测方法,其包括采用如前述实施例所述的冠状病毒病原体核酸检测试剂或如前述实施例所述的用于检测冠状病毒病原体核酸的试剂盒对待测样本进行PCR检测;所述检测方法不以疾病的诊断或治疗为直接目的。
本发明具有以下有益效果:
本发明针对β冠状病毒属中的OC43、HKU1设计了特异性引物探针,这两组引物探针组合都适配于实时荧光定量PCR分析仪,可以在保证检测的特异性和灵敏度的基础上实现快速检测出结果。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
图1为引物探针用量和体系优化的扩增曲线图数据;
图2为检出限检测实验扩增曲线数据;
图3为特异性检测实验扩增曲线数据;
图4为实时荧光定量PCR分析仪(型号:P810)适配扩增曲线数据;
图5为P810检出限检测实验扩增曲线数据。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
本发明提供的技术方案具体如下。
本发明实施例提供了一种冠状病毒病原体核酸检测试剂,其包括用于检测β冠状病毒OC43(Human coronavirus OC43,MW532109.1)靶标区域和HKU1(Human coronavirusHKU1,MH940245.1)靶标区域的核酸组合物;其中,所述OC43靶标区域的序列如SEQ ID No:1所示,所述HKU1靶标区域的序列如SEQ ID No:2所示。
在一些实施例中,所述冠状病毒病原体核酸检测试剂是检测β冠状病毒属中的HCoV-OC43和/或HCoV-HKU1亚型。
在一些实施例中,所述核酸组合物包括:序列如SEQ ID No:6所示的上游引物(正向引物)和序列如SEQ ID No:7~8所示的下游引物(反向引物)。相对于其他引物探针组合而言,该引物对具有更优的检测效果。
在一些实施例中,所述上游引物和所述下游引物的摩尔比为(0.1~0.5):(0.1~0.5);该摩尔比具体可以为0.1:0.2、0.1:0.3、0.1:0.4、0.1:0.5、0.2:0.1、0.2:0.3、0.2:0.5、0.3:0.1、0.3:0.2、0.3:0.4、0.3:0.5、0.4:0.1、0.4:0.3、0.4:0.5、0.5:0.1、0.5:0.2、0.5:0.3、0.5:0.4中的任意一种或任意两种之间的范围。优选地,所述上游引物和所述下游引物的摩尔比为(0.4~0.5):(0.4~0.5)。
需要说明的是,所述上游引物和所述下游引物的摩尔比应该理解为上游引物与每条/每种下游引物的摩尔比,即,SEQ ID No:6所示上游引物与SEQ ID No:7或8所示下游引物的摩尔比。
在一些实施例中,所述核酸组合物还包括探针。
在一些实施例中,所述上游引物与所述探针的摩尔比为(0.1~0.5):(0.1~0.5);该摩尔比具体为(0.1~0.5):(0.1~0.5);具体可以为0.1:0.2、0.1:0.3、0.1:0.4、0.1:0.5、0.2:0.1、0.2:0.3、0.2:0.5、0.3:0.1、0.3:0.2、0.3:0.4、0.3:0.5、0.4:0.1、0.4:0.3、0.4:0.5、0.5:0.1、0.5:0.2、0.5:0.3、0.5:0.4中的任意一种或任意两种之间的范围。
优选地,所述上游引物与所述探针的摩尔比为(0.4~0.5):(0.2~0.3)。
在一些实施例中,所述探针的序列如SEQ ID No:9所示。
在一些实施例中,所述探针的5’端连接有荧光报告基团,3’端连接有荧光淬灭基团和/或MGB。
在一些实施例中,所述荧光报告基团选自:FAM、VIC、HEX和TET中的任意一种。
在一些实施例中,所述荧光淬灭基团选自:BHQ2、TAMRA中的任意一种。
在一些实施例中,所述检测试剂还包括用于检测内参基因靶标区域的核酸组合物。
在一些实施例中,所述内参基因包括ATCB基因;
在一些实施例中,所述检测内参基因靶标区域的核酸组合物也可以包括引物对和/或探针。
本发明实施例还提供了如前述任意实施例所述的冠状病毒病原体核酸检测试剂在制备用于检测冠状病毒病原体核酸的试剂盒中的应用。
本发明实施例还提供了一种用于检测冠状病毒病原体核酸的试剂盒,其包括如前述任意实施例所述的冠状病毒病原体核酸检测试剂。
在一些实施例中,所述试剂盒还包括:PCR反应液、阳性质控品、阴性质控品和酶混合液中的至少一种。
在一些实施例中,所述阳性质控品包括:分别含β冠状病毒OC43的特异性保守序列和β冠状病毒HKU1的特异性保守序列的盔甲RNA;OC43的特异性保守序列如SEQ ID No:1所示,HKU1的特异性保守序列如SEQ ID No:2所示。
在一些实施例中,所述阳性质控品还包括:含人源ACTB基因的盔甲RNA。
在一些实施例中,所述PCR反应液包括:dNTPs、10×BSA和含有镁离子的缓冲液中的至少一种。其中,dNTPs具体包括dATPs、dUTPs、dGTPs、dCTPs、dTTPs等五种核苷酸,镁离子具体可以为MgCl
在一些实施例中,检测试剂中的引物和探针包含于PCR反应液中。
在一些实施例中,所述酶混合液包括:Taq酶、逆转录酶、RNA酶抑制剂中的至少一种。
在一些实施例中,所述阴性质控品为无菌TE缓冲液,该缓冲液采用分子级水配制。
本发明实施例还提供了一种冠状病毒病原体核酸的检测方法,其包括采用如前述任意实施例所述的冠状病毒病原体核酸检测试剂或如前述任意实施例所述的用于检测冠状病毒病原体核酸的试剂盒对待测样本进行PCR检测。
在一些实施例中,所述待测样本可以为血液样品、组织样本、环境样本或人工配制的阳性样品。
所述检测方法不以疾病的诊断或治疗为直接目的,例如,当样本为环境样本时,所述检测的直接目的在于检测其中是否存在冠状病毒病原体,而并非疾病的诊断与治疗。
在一些实施例中,进行所述PCR检测时,核酸组合物中的每条引物的作用浓度独立地为0.1~0.5μM,具体可以为0.1μM、0.15μM、0.2μM、0.25μM、0.3μM、0.35μM、0.4μM、0.45μM、0.5μM中的任意一种或任意两种之间的范围。
优选地,在所述核酸组合物中,上游引物的作用浓度为0.48μM,每条下游引物的作用浓度为0.48μM。
在一些实施例中,进行所述PCR检测时,核酸组合物中的探针的作用浓度为0.1~0.5μM,具体可以为0.1μM、0.15μM、0.2μM、0.25μM、0.3μM、0.35μM、0.4μM、0.45μM、0.5μM中的任意一种或任意两种之间的范围。
优选地,进行所述PCR检测时,核酸组合物中的探针的作用浓度为0.24μM。
在一些实施例中,进行所述PCR检测时,MgCl
在一些实施例中,进行所述PCR检测时,Taq酶的作用浓度为0.01~1U/μL,具体可以为0.01U/μL、0.05U/μL、0.1U/μL、0.15U/μL、0.2U/μL、0.3U/μL、0.4U/μL、0.5U/μL、0.6U/μL、0.7U/μL、0.8U/μL、0.9U/μL、1U/μL中的任意一种或任意两种之间的范围。
在一些实施例中,进行所述PCR检测时,逆转录酶的作用浓度为1~10U/μL,具体可以为1U/μL、1.5U/μL、2U/μL、2.5U/μL、3U/μL、3.5U/μL、4U/μL、4.5U/μL、5U/μL、5.5U/μL、6U/μL、6.5U/μL、7U/μL、7.5U/μL、8U/μL、8.5U/μL、9U/μL、9.5U/μL、10U/μL中的任意一种或任意两种之间的范围。
在一些实施例中,进行所述PCR检测时,RNA酶抑制剂的作用浓度为0.1~1U/μL,具体可以为0.1U/μL、0.2U/μL、0.3U/μL、0.4U/μL、0.5U/μL、0.6U/μL、0.7U/μL、0.8U/μL、0.9U/μL、1U/μL中的任意或任意两种之间的范围。
在一些实施例中,进行PCR检测时,若采用的PCR仪为常规的qPCR仪(qPCR仪ABI7500),则所述PCR的反应条件如下:48~52℃逆转录13~17min;94~96℃预变性1~5min;94~96℃变性10~20s,49~51℃退火延伸25~35s,收集荧光信号,变性~退火延伸44~46个循环。
在一些实施例中,进行PCR检测时,若采用的实时荧光定量PCR分析仪P810时,则PCR的反应条件如下:48~52℃逆转录0.5~2min;94~96℃0s;58~62℃退火延伸5~15s,收集荧光信号,变性~退火延伸38~42个循环。
具体地,所述检测方法包括以下操作步骤:
(1)核酸提取:采用核酸提取产品即病毒DNA/RNA快速提取试剂(磁珠法)(货号:RK1002)提取样本核酸,提取产物将用于后续的核酸检测。
(2)体系配制:将前述实施例配置的PCR反应液和酶混合液试剂取出-20℃冰箱,室温融化,涡旋震荡10s,低速离心10s。按比例(8μLPCR反应液/人份+2μL酶混合液/人份)取相应量的PCR反应液和酶混合液,充分混匀,低速离心10s备用。
(3)然后按照10μL每反应进行分装,然后加入5μL上述提取产物,混匀,并按照下列程序进行扩增检测。
实时荧光定量PCR分析仪P810上扩增程序设置:
采用该程序9分钟内可以完成全部扩增。
常规qPCR仪ABI7500上扩增程序设置:
采用该程序90分钟内可以完成全部扩增。
(4)结果分析:
4.1实验结束后保存检测数据文件。
4.2分析条件设置:根据分析后图像调节基线(Baseline)的Start值、End值以及阈值(Threshold)的Value值(用户可根据实际情况自行调整,Start值可以在3-15、End值可以在5-20,调整阴性对照的扩增曲线平直或低于阈值线),使仪器给出正确的结果。
(5)质量控制
5.1阴性对照:FAM通道和ROX通道,Ct值显示为0,且无明显S型扩增曲线;CY5通道,Ct值显示为0,且无明显S型扩增曲线;
5.2阳性对照:FAM通道和ROX通道都有Ct值且Ct≤35,有明显S型扩增曲线;CY5通道,有Ct值且Ct≤35,有明显S型扩增曲线;
以上两个要求需在同一次实验中同时满足,否则,本次实验无效,需要重新进行实验。
(6)结果判读
6.1当FAM通道或ROX通道有扩增曲线,且Ct值均≤35时可判定冠状病毒病原体核酸阳性;
6.2当FAM通道和ROX通道都无扩增曲线,且Ct值显示为0,CY5通道有扩增曲线且Ct值均≤35时可判定冠状病毒病原体核酸阴性;
6.3当FAM通道或ROX通道有扩增曲线,35<Ct值≤40,CY5通道有扩增曲线,且Ct值均≤35时建议重复一次实验,如果结果同上,可判定为冠状病毒病原体阳性,如果无扩增,可判定为冠状病毒病原体阴性;
6.4当FAM通道、ROX通道和CY5通道均无扩增曲线,且Ct值显示为0,实验无效、建议更换一批试剂重新实验。
Ct值(cycle threshold,Ct)的定义为:每个反应管内荧光信号达到设定阈值时所经历的循环数。阈值的设定一般是将其设定为恰好可以覆盖住阴性对照和空白对照的荧光值处,因此可以很好的去除反应管荧光值即背景对测试结果的影响。
下面结合具体实施例,进一步详细陈述本发明,应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明详细条件的实验方法,通常按照常规条件如美国Sambrook.J等著《分子克隆实验室指南》(黄培堂等译,北京:科学出版社,2002年)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。
以下结合实施例对本发明的特征和性能作进一步的详细描述。
实施例1引物探针的设计
分析β冠状病毒属中的OC43、HKU1最终确定在ORF1ab基因的保守区域设计多组特异性引物和探针序列。
表1冠状病毒特异性引物和探针序列
备注:F为上游引物,R为下游引物,P为探针;序列中的Y为简并碱基,代表C/T;探针的5’端标记有ROX通道的荧光报告基团,3’端标记有MGB荧光淬灭基团。
在上述引物和探针的设计过程中,尽量选取发卡结构、引物内部二聚体、引物间二聚体以及错配的形成等情况较少的引物探针片段。然后将所设计的引物探针序列在NCBIBlast在线数据库(https://blast.ncbi.nlm.nih.gov/Blast.cgi)上进行比对分析,避免与其他致病菌或人类基因发生非特异结合和扩增。
在常规实时荧光定量PCR仪上进行多轮筛选和优化后,再通过实时荧光定量PCR分析仪进行性能对比确认,最终确定一套灵敏度和特异性最优的引物和探针组合。
为了筛选扩增效率最佳的靶标引物探针组合,本申请合成了以下冠状病毒靶基因的靶标片段,见下表,并将这些序列插入克隆载体,通过单克隆筛选出纯化的含有阳性片段的质粒。再采用盔甲RNA制备技术制作出相应项目的盔甲RNA,使样本更接近真实样本的状态。
/>
备注:序列(SEQ ID No:)1和2对应第2组引物探针,序列10和11对应第1组引物探针。
采用下列扩增体系配制引物探针组合,对比冠状病毒OC43、HKU1的引物探针组合的扩增效率,其中配置表中的5×PCR buffer(货号:MD013)、逆转录酶(货号:MD301)、Taq酶(货号:MD099)为菲鹏生物研发的原料,配制表中的引物探针皆是生工生物进行合成。
表2不同组合引物探针组合单重扩增体系表
/>
模板采用上述构建的冠状病毒的盔甲RNA的提取产物,阳性质控品提取后产物的浓度约为1.0×10
扩增程序采用下表3所示。
表3常规荧光定量PCR仪-ABI7500扩增程序
扩增结果如下表所示:
表4冠状病毒OC43/HKU1第1组引物探针组合在ABI7500上扩增数据
表5冠状病毒OC43/HKU1第2组引物探针组合在ABI7500上扩增数据
根据以上数据,冠状病毒OC43、HKU1的第2组靶标引物探针扩增效果最佳。
实施例2检验方法以及检测体系优化
为了确定引物探针的检测体系,分别尝试了不同浓度的引物探针对荧光PCR反应的影响。将合成的引物探针干粉按说明稀释成浓度为10μM的工作液,在15μL体系中,引物和探针梯度添加量如表6,将引物梯度用量与探针梯度用量作正交实验,如表7、表8,以冠状病毒OC43/HKU1靶标引物探针组合采用冠状病毒OC43的盔甲RNA提取物作为模板,然后将以上体系都用纯化水补足15μL进行扩增。扩增体系配制如下:
表6用量调试通用扩增体系表
表7引物探针的用量变化范围
表8冠状病毒OC43/HKU1靶标引物探针组合用量调试扩增体系表及用量编号
扩增程序如下:
常规qPCR仪ABI7500上扩增程序设置:
扩增结果如下表:
表9冠状病毒OC43/HKU1引物探针用量调试扩增数据
扩增曲线如图1所示,根据扩增曲线和扩增数据结果显示,在冠状病毒OC43/HKU1的靶标引物探针组合中,用量编号9的引物探针组合扩增效果最优,所以F2终浓度为480nM,R2终浓度为480nM,R3终浓度为480nM,P2终浓度为240nM时,扩增效率最好。
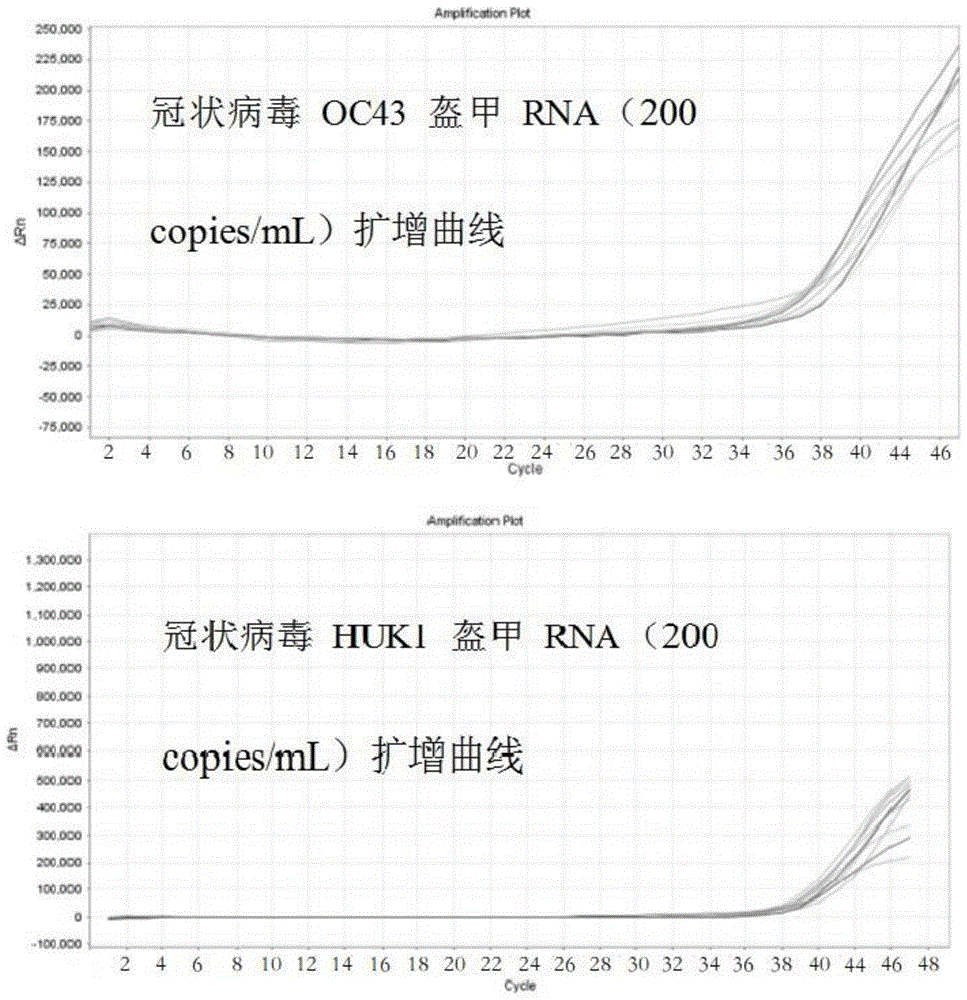
实施例3检出限检测
采用盔甲RNA制备技术制作出相应项目的盔甲RNA,然后使用病毒DNA/RNA快速提取试剂(磁珠法)(货号:RK1002)进行提取,提取产物使用Digital PCR技术(即数字PCR)进行定量,得到相应项目提取产物的浓度。根据已知的浓度将相应的提取产物稀释到合适的浓度后再进行2倍倍比稀释,浓度分别为400 copies/mL、200 copies/mL、100 copies/mL。采用上述确定的检测体系(扩增体系如下表10)、产品形式以及循环参数对上述提取产物进行检测,扩增结果如表11,分别针对4个浓度为200 copies/mL盔甲RNA提取产物进行确认,扩增数据结果如表12,扩增曲线图如图2。结果表明,本发明的检测方法具有较高灵敏度,灵敏度能够达到200 copies/mL。
表10α冠状病毒OC43/HKU1的双重扩增体系表
/>
表11检测体系测试梯度浓度盔甲RNA的扩增数据表
表12检测体系测试最低检出限浓度盔甲RNA的扩增数据表
/>
实施例4特异性检测
本实施例采用将呼吸道合胞病毒株(B型)、流感嗜血杆菌、金黄色葡萄球菌、肺炎链球菌、甲型流感病毒株(型别:H1N1)、甲型流感病毒株(型别:H3N2)、甲型流感病毒株(型别:H7N9)、呼吸道腺病毒(3型)、呼吸道腺病毒(7型)与健康人的唾液混合后的样本等作为特异性样本进行检测。
检测结果显示,呼吸道合胞病毒株(B型)、流感嗜血杆菌、金黄色葡萄球菌、肺炎链球菌、甲型流感病毒株(型别:H1N1)、甲型流感病毒株(型别:H3N2)、甲型流感病毒株(型别:H7N9)、呼吸道腺病毒(3型)、呼吸道腺病毒(7型)等检测特异性质控品的检测结果均为阴性,如图3,同时其内标检测结果为阳性,表明本发明的引物探针组合(第2组)能够扩增,且特异性良好。
实施例5重复性检测
本实施例选取浓度为1×10
检测结果如下表13所示,经过统计分析,CV值%都小于5%,结果表明本发明的试剂盒和检测方法重复性较好。
表13检测体系测试盔甲RNA重复性的扩增数据表
/>
实施例6实时荧光定量PCR分析仪(型号:P810)的适配工作
本实施例选取浓度为800copies/mL、400copies/mL、200copies/mL、100copies/mL的冠状病毒OC43、HKU1的盔甲RNA提取物进行检测,采用上述实施例确定的检测体系,同时使用公司开发的实时荧光定量PCR分析仪(型号:P810)验证试剂的检测性能。
实时荧光定量PCR分析仪P810上扩增程序设置:
/>
扩增结果如表14,扩增曲线如图4,线性关系良好,最低检出限达到200copies/mL,分别针对4个浓度为200copies/mL盔甲RNA提取产物进行确认,扩增数据结果如表15,扩增曲线图如图5,P810平台的最低检出限与ABI7500一致。
表14 P810仪器测试梯度浓度盔甲RNA的扩增数据表
表15 P810测试最低检出限浓度盔甲RNA的扩增数据表
/>
实施例7真实样本检测
本实施例采用冠状病毒OC43、HKU1的病毒株和26例临床样本作为样本,都使用病毒DNA/RNA快速提取试剂(磁珠法)进行提取,其中将病毒株的提取产物用健康人的唾液提取产物稀释100倍。将本发明的第2组检测试剂分别在实时荧光定量PCR分析仪P810和常规qPCR仪ABI7500进行测试,对比本发明试剂在两台仪器的扩增效果,扩增程序如下表,扩增结果如下表16所示。数据表明,本发明试剂在实时荧光定量PCR分析仪P810和常规qPCR仪ABI7500的扩增结果符合率100%,且本发明在荧光定量PCR仪P810的扩增效果比在常规qPCR仪ABI7500的扩增效果更好,说明本发明试剂更适配于荧光定量PCR仪P810,本发明提供的冠状病毒检测试剂盒灵敏、特异、快速,可用于临床样品的检测。
实时荧光定量PCR分析仪P810上扩增程序设置:
常规qPCR仪ABI7500上扩增程序设置:
表16两台PCR仪测试真实样本的扩增数据表
/>
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 用于靶向病原体基因RNA的gRNA及基于C2c2的病原体基因的检测方法、检测试剂盒
- 一种用于检测副猪嗜血杆菌的RPA引物、RPA探针、试剂盒及核酸检测方法
- 一种冠状病毒病原体核酸检测试剂及其检测方法和应用
- 检测新型冠状病毒病原体核酸的检测试剂盒及其使用方法
