一种N-(二氧杂戊环酮基)吲哚类化合物及其制备方法
文献发布时间:2023-06-19 19:28:50
技术领域
本发明涉及医药化工中间体及相关化学技术领域,涉及到一种N-(二氧杂戊环酮基)吲哚类化合物、以吲哚类化合物与碳酸亚乙烯酯类化合物为原料的N-(二氧杂戊环酮基)吲哚类化合物的制备方法。
背景技术
N-官能化吲哚类化合物是一类重要的合成天然产物、药物或功能分子中间体,在有机合成领域有着非常广泛的应用。自吲哚被发现以来,有机化学家们围绕其合成及其官能化反应开展了多种多样的研究;N-官能化吲哚类化合物,尤其在医药和农药等合成方面表现出巨大的用途,因而N-官能化吲哚类化合物的合成是当前的研究热点之一。随着人们对可持续性发展及人类健康的日益关注,具有高效率,低污染,原子经济等特征,绿色化学日益受人关注;N-(二氧杂戊环酮基)吲哚类化合物是一种新型的N-官能化吲哚。但在目前报道的吲哚N-官能化反应中,未见碳酸亚乙烯酯作为吲哚N-官能化试剂的相关报道。
发明内容
为解决现有技术中存在的问题,本发明利用吲哚与碳酸亚乙烯酯反应,提供一种选择性和收率高、反应条件温和、原子经济性高、催化效果好的N-(二氧杂戊环酮基)吲哚类化合物的合成方法,具有重要意义。该方法使用吲哚和碳酸亚乙烯酯为原料,实现了铜-碱协同催化的吲哚和碳酸亚乙烯酯的加成反应,合成N-(二氧杂戊环酮基)吲哚类化合物。该方法具有催化体系简单、选择性好、条件温和、原子经济性好、环境友好、易实现工业化等优点。本发明具有较大的应用价值和社会经济效益。
本发明采用的技术方案为:一种N-(二氧杂戊环酮基)吲哚类化合物,其特征在于,该化合物的结构通式如下:
其中:吲哚环上的带有取代基R=氢、C
合成路线如下:
/>
其中:R=氢、C
(1)将吲哚类化合物、铜-碱协同催化剂、碳酸亚乙烯酯和有机溶剂依次加入到反应器中,25~150℃反应4~36h;所述吲哚类化合物与碳酸亚乙烯酯的摩尔比为1:1~1:5,吲哚类化合物与铜催化剂的摩尔比为1:0.01~1:0.2,吲哚类化合物与碱催化剂的摩尔比为1:0.01~1:0.7;
(2)反应结束后,减压蒸馏除去溶剂,用洗脱剂进行硅胶柱分离,得到N-(二氧杂戊环酮基)吲哚类化合物。
吲哚类化合物包括含有氢、含有C
反应温度范围为25~150℃,优选70~100℃。
反应时间范围为4~36h,优选10~18h。
所述铜催化剂选自氯化亚铜、溴化亚铜、碘化亚铜、氧化亚铜、氰化亚铜、二(三苯基膦)硼氢化亚铜、氟化铜、氯化铜、溴化铜、一水合乙酸铜、硝酸铜、硫酸铜、三氟甲磺酸铜、三氟乙酸铜、酒石酸铜、碱式碳酸铜、三水合硝酸铜、二(乙酰丙酮)铜、氧化铜。
所用碱是无机碱或有机碱,碱催化剂选自叔丁醇钾、甲醇钠、甲醇钾、乙醇钠、乙醇钾、氢氧化钾、氢氧化钠、碳酸锂、碳酸钾、碳酸钠、碳酸铯、碳酸铵、碳酸氢钾、碳酸氢钠、碳酸氢铵、二水合甲酸钠、甲酸钾、乙酸钠、乙酸钾、丙酸钠、丙酸钾、特戊酸钠、特戊酸钾、三氟乙酸钠、三氟乙酸钾、甲酸铵、乙酸铵、吡啶、哌啶、哌嗪、四氢吡咯、三乙胺、二异丙基乙基胺、六甲基二硅基氨基锂、六甲基二硅基氨基钾;
有机溶剂的量为1~500mL,所述有机溶剂选自甲醇、乙醇、正丙醇、异丙醇、正丁醇、叔丁醇、三氟乙醇、二氯甲烷、三氯甲烷、苯、甲苯、环己烷、正戊烷、正己烷、正庚烷、乙醚、异丙基醚、正丁醚、甲基叔丁基醚、乙酸乙酯、石油醚、氟代苯、三氟甲苯、硝基甲烷、1,4-二氧六环、二甲基亚砜、四氢呋喃、N,N-二甲基甲酰胺、乙腈、碳酸二甲酯、碳酸二乙酯、碳酸甲乙酯、水中的一种或几种。
吲哚化合物与铜催化剂的摩尔比为1:0.01~1:0.2。
吲哚化合物与碱催化剂的摩尔比为1:0.01~1:0.7。
吲哚化合物与碳酸亚乙烯酯的摩尔比为1:1~1:5。
/>
/>
本发明的有益效果:本发明的N-(二氧杂戊环酮基)吲哚类化合物及其制备方法,具有选择性高、反应条件温和、底物适用范围广、环境友好等优点,具体为:
(1)该方法中所制备的N-(二氧杂戊环酮基)吲哚类化合物是一类新型的N-官能化吲哚类化合物。
(2)该方法是针对吲哚与碳酸亚乙烯酯的加成反应,现有技术中因吲哚对碳碳双键的加成反应,一般需要贵重金属催化才能顺利进行,催化剂成本较高。本申请中,因碳酸亚乙烯酯作为N-官能化试剂的使用,能采用温和、简单条件,实现吲哚进行的加成反应。
(3)该方法中使用铜和碱组成协同催化体系,降低了催化体系的成本;反应后处理简单。
(4)催化效果好,选择性和收率高,收率均在70%以上。该方法为选择性好、反应条件温和、原子经济性高、催化效果好、收率高的N-(二氧杂戊环酮基)吲哚类化合物的合成方法。由于N-官能化吲哚类化合物是一种重要的有机合成中间体,在医药、农药、材料领域有着非常广泛的应用,因此,本发明具有较大的应用价值和社会经济效益。
附图说明
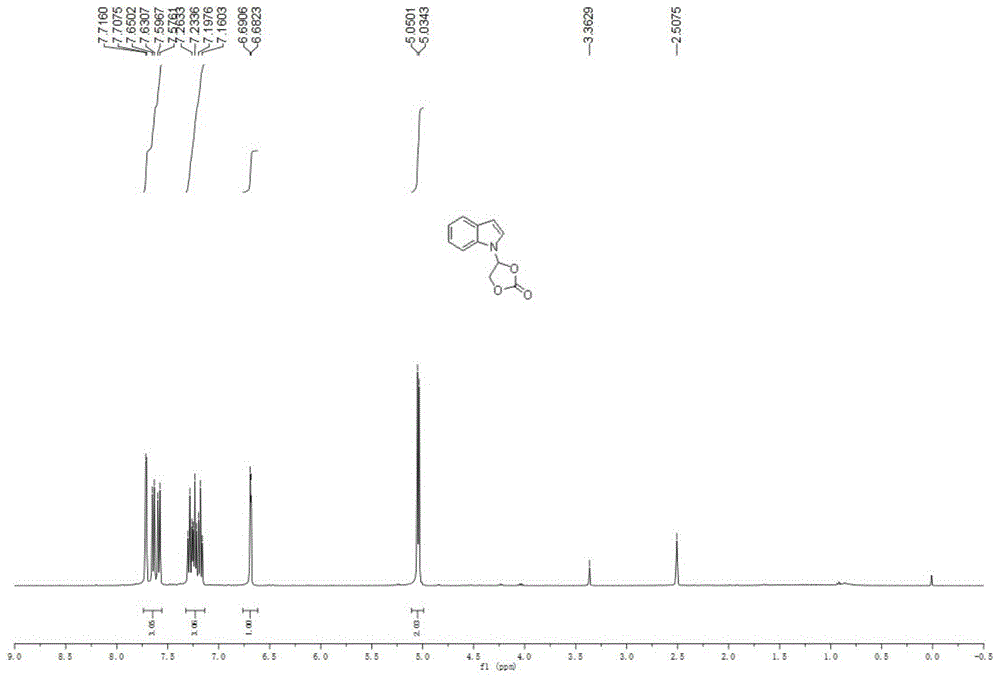
图1为化合物3a的
图2为化合物3a的
图3为化合物3b的
图4为化合物3b的
图5为化合物3c的
图6为化合物3c的
图7为化合物3d的
图8为化合物3d的
图9为化合物3e的
图10为化合物3e的
图11为化合物3f的
图12为化合物3f的
图13为化合物3g的
图14为化合物3g的
图15为化合物3h的
图16为化合物3h的
图17为化合物3i的
图18为化合物3i的
图19为化合物3j的
图20为化合物3j的
图21为化合物3k的
图22为化合物3k的
图23为化合物3l的
图24为化合物3l的
图25为化合物3m的
图26为化合物3m的
图27为化合物3n的
图28为化合物3n的
图29为化合物3o的
图30为化合物3o的
图31为化合物3p的
图32为化合物3p的
图33为化合物3q的
图34为化合物3q的
图35为化合物3r的
图36为化合物3r的
图37为化合物3s的
图38为化合物3s的
图39为化合物3t的
图40为化合物3t的
图41为化合物3u的
图42为化合物3u的
图43为化合物3v的
图44为化合物3v的
图45为化合物3w的
图46为化合物3w的
图47为化合物3x的
图48为化合物3x的
具体实施方式
本发明所述的N-(二氧杂戊环酮基)吲哚类化合物的制备方法,具有原料价廉易得、反应选择性好、反应条件温和、环境友好、原子经济性高等优点,展现出良好的应用前景。
下面结合具体实施例,进一步阐述本发明。这些实施例仅用于说明本发明而不用于限制本发明的范围。在本领域内的技术人员对本发明所做的简单替换或改进均属于本发明所保护的技术方案之内。
以碳酸亚乙烯酯和吲哚类化合物为原料,通过铜-碱协同催化加成反应,合成一系列N-(二氧杂戊环酮基)吲哚类化合物,该方法包括以下步骤:
合成路线如下:
其中:R=氢、C
(1)将吲哚类化合物、铜-碱协同催化剂、碳酸亚乙烯酯和有机溶剂依次加入到反应器中,25~150℃反应4~36h;所述吲哚类化合物与碳酸亚乙烯酯的摩尔比为1:1~1:5,吲哚类化合物与铜催化剂的摩尔比为1:0.01~1:0.2,吲哚类化合物与碱催化剂的摩尔比为1:0.01~1:0.7;
(2)反应结束后,减压蒸馏除去溶剂,用洗脱剂进行硅胶柱分离,得到N-(二氧杂戊环酮基)吲哚类化合物。
实施例1:4-(1H-indol-1-yl)-1,3-dioxolan-2-one(3a)的合成
准确称取吲哚(0.12g,1.0mmol)、碳酸亚乙烯酯(0.26g,3.0mmol)、氯化亚铜(5.0mg,0.05mmol)、碳酸钠(10.6mg,0.1mmol),并依次加入到50mL的Schlenk瓶中,加入四氢呋喃(5.0mL),置于90℃油浴中反应18h。反应结束后,减压蒸馏除去溶剂,使用石油醚/乙酸乙酯(v/v 4:1)作为洗脱剂,硅胶柱层析分离,产物4-(1H-indol-1-yl)-1,3-dioxolan-2-one收率为82%。
实施例2:methyl 1-(2-oxo-1,3-dioxolan-4-yl)-1H-indole-3-carboxylate(3b)的合成
准确称取吲哚-3-甲酸甲酯(0.35g,2.0mmol)、碳酸亚乙烯酯(0.34g,4.0mmol)、一水合乙酸铜(20.0mg,0.10mmol)、三乙胺(50.6mg,0.5mmol),并依次加入到50mL的Schlenk瓶中,加入二氯甲烷(6.0mL),置于40℃油浴中反应10h。反应结束后,减压蒸馏除去溶剂,使用石油醚/乙酸乙酯(v/v 1:1)作为洗脱剂,硅胶柱层析分离,产物methyl 1-(2-oxo-1,3-dioxolan-4-yl)-1H-indole-3-carboxylate收率为92%。
实施例3:4-(4-methyl-1H-indol-1-yl)-1,3-dioxolan-2-one(3c)的合成
准确称取4-甲基吲哚(0.39g,3.0mmol)、碳酸亚乙烯酯(0.60g,7.0mmol)、碘化亚铜(19.1mg,0.10mmol)、碳酸氢钠(40.0mg,0.5mmol),并依次加入到50mL的Schlenk瓶中,加入N,N-二甲基甲酰胺(9.0mL),置于65℃油浴中反应30h。反应结束后,减压蒸馏除去溶剂,使用石油醚/乙酸乙酯(v/v 3:1)作为洗脱剂,硅胶柱层析分离,产物4-(4-methyl-1H-indol-1-yl)-1,3-dioxolan-2-one收率为75%。
实施例4:4-(4-methoxy-1H-indol-1-yl)-1,3-dioxolan-2-one(3d)的合成
准确称取4-甲氧基吲哚(1.47g,10.0mmol)、碳酸亚乙烯酯(1.72g,20.0mmol)、溴化铜(223.4mg,1.0mmol)、碳酸氢钾(100.1mg,1.0mmol),并依次加入到100mL的Schlenk瓶中,加入二甲基亚砜(40.0mL),置于75℃油浴中反应20h。反应结束后,减压蒸馏除去溶剂,使用石油醚/乙酸乙酯(v/v 4:1)作为洗脱剂,硅胶柱层析分离,产物4-(4-methoxy-1H-indol-1-yl)-1,3-dioxolan-2-one收率为70%。
实施例5:4-(4-(benzyloxy)-1H-indol-1-yl)-1,3-dioxolan-2-one(3e)的合成
准确称取4-苄氧基吲哚(0.11g,0.5mmol)、碳酸亚乙烯酯(0.26g,3.0mmol)、溴化亚铜(14.4mg,0.10mmol)、吡啶(15.8mg,0.2mmol),并依次加入到50mL的Schlenk瓶中,加入苯(3.0mL),置于80℃油浴中反应18h。反应结束后,减压蒸馏除去溶剂,使用石油醚/乙酸乙酯(v/v 4:1)作为洗脱剂,硅胶柱层析分离,产物4-(4-(benzyloxy)-1H-indol-1-yl)-1,3-dioxolan-2-one收率为78%。
实施例6:4-(4-chloro-1H-indol-1-yl)-1,3-dioxolan-2-one(3f)的合成
准确称取4-氯吲哚(0.30g,2.0mmol)、碳酸亚乙烯酯(0.69g,8.0mmol)、氟化铜(5.1mg,0.05mmol)、氢氧化钾(11.2mg,0.2mmol),并依次加入到50mL的Schlenk瓶中,加入甲醇(6.0mL),置于45℃油浴中反应36h。反应结束后,减压蒸馏除去溶剂,使用石油醚/乙酸乙酯(v/v 3:1)作为洗脱剂,硅胶柱层析分离,产物4-(4-chloro-1H-indol-1-yl)-1,3-dioxolan-2-one收率为91%。
实施例7:4-(4-bromo-1H-indol-1-yl)-1,3-dioxolan-2-one(3g)的合成
准确称取4-溴吲哚(0.98g,5.0mmol)、碳酸亚乙烯酯(0.86g,10.0mmol)、氧化亚铜(71.5mg,0.50mmol)、氢氧化钠(40.0mg,1.0mmol),并依次加入到50mL的Schlenk瓶中,加入乙醇(15.0mL),置于85℃油浴中反应20h。反应结束后,减压蒸馏除去溶剂,使用石油醚/乙酸乙酯(v/v 4:1)作为洗脱剂,硅胶柱层析分离,产物4-(4-bromo-1H-indol-1-yl)-1,3-dioxolan-2-one收率为89%。
实施例8:methyl 1-(2-oxo-1,3-dioxolan-4-yl)-1H-indole-4-carboxylate(3h)的合成
准确称取吲哚-4-甲酸甲酯(0.18g,1.0mmol)、碳酸亚乙烯酯(0.26g,3.0mmol)、三水合硝酸铜(24.2mg,0.10mmol)、二水合甲酸钠(10.4mg,0.1mmol),并依次加入到50mL的Schlenk瓶中,加入甲苯(4.0mL),置于75℃油浴中反应30h。反应结束后,减压蒸馏除去溶剂,使用石油醚/乙酸乙酯(v/v 2:1)作为洗脱剂,硅胶柱层析分离,产物methyl 1-(2-oxo-1,3-dioxolan-4-yl)-1H-indole-4-carboxylate收率为86%。
实施例9:4-(4-nitro-1H-indol-1-yl)-1,3-dioxolan-2-one(3i)的合成
准确称取4-硝基吲哚(0.47g,3.0mmol)、碳酸亚乙烯酯(0.86g,10.0mmol)、二(三苯基膦)硼氢化亚铜(30.1mg,0.05mmol)、碳酸钾(13.8mg,0.1mmol),并依次加入到50mL的Schlenk瓶中,加入甲苯(10.0mL),置于50℃油浴中反应24h。反应结束后,减压蒸馏除去溶剂,使用石油醚/乙酸乙酯(v/v1:2)作为洗脱剂,硅胶柱层析分离,产物4-(4-nitro-1H-indol-1-yl)-1,3-dioxolan-2-one收率为94%。
实施例10:1-(2-oxo-1,3-dioxolan-4-yl)-1H-indole-4-carbonitrile(3j)的合成
准确称取4-氰基吲哚(0.28g,2.0mmol)、碳酸亚乙烯酯(0.43g,5.0mmol)、三氟甲磺酸铜(18.1mg,0.05mmol)、碳酸钠(21.2mg,0.2mmol),并依次加入到50mL的Schlenk瓶中,加入四氢呋喃(5.0mL),置于40℃油浴中反应30h。反应结束后,减压蒸馏除去溶剂,使用石油醚/乙酸乙酯(v/v 1:1)作为洗脱剂,硅胶柱层析分离,产物1-(2-oxo-1,3-dioxolan-4-yl)-1H-indole-4-carbonitrile收率为88%。
实施例11:4-(5-methyl-1H-indol-1-yl)-1,3-dioxolan-2-one(3k)的合成
准确称取5-甲基吲哚(0.13g,1.0mmol)、碳酸亚乙烯酯(0.10g,1.2mmol)、氧化铜(8.0mg,0.10mmol)、碳酸铯(16.3mg,0.05mmol),并依次加入到50mL的Schlenk瓶中,加入三氯甲烷(3.0mL),置于55℃油浴中反应16h。反应结束后,减压蒸馏除去溶剂,使用石油醚/乙酸乙酯(v/v 3:1)作为洗脱剂,硅胶柱层析分离,产物4-(5-methyl-1H-indol-1-yl)-1,3-dioxolan-2-one收率为79%。
实施例12:4-(5-methoxy-1H-indol-1-yl)-1,3-dioxolan-2-one(3l)的合成
准确称取5-甲氧基吲哚(0.59g,4.0mmol)、碳酸亚乙烯酯(0.60g,7.0mmol)、碘化亚铜(9.5mg,0.05mmol)、乙酸钠(24.6mg,0.3mmol),并依次加入到50mL的Schlenk瓶中,加入甲苯(9.0mL),置于90℃油浴中反应12h。反应结束后,减压蒸馏除去溶剂,使用石油醚/乙酸乙酯(v/v 3:1)作为洗脱剂,硅胶柱层析分离,产物4-(5-methoxy-1H-indol-1-yl)-1,3-dioxolan-2-one收率为72%。
实施例13:4-(5-(benzyloxy)-1H-indol-1-yl)-1,3-dioxolan-2-one(3m)的合成
准确称取5-苄氧基吲哚(0.45g,2.0mmol)、碳酸亚乙烯酯(0.43g,5.0mmol)、氯化亚铜(9.9mg,0.10mmol)、乙酸钾(29.4mg,0.3mmol),并依次加入到50mL的Schlenk瓶中,加入乙酸乙酯(3.0mL),置于70℃油浴中反应15h。反应结束后,减压蒸馏除去溶剂,使用石油醚/乙酸乙酯(v/v 3:1)作为洗脱剂,硅胶柱层析分离,产物4-(5-(benzyloxy)-1H-indol-1-yl)-1,3-dioxolan-2-one收率为80%。
实施例14:4-(5-chloro-1H-indol-1-yl)-1,3-dioxolan-2-one(3n)的合成
准确称取5-氯吲哚(0.15g,1.0mmol)、碳酸亚乙烯酯(0.26g,3.0mmol)、氯化铜(6.7mg,0.05mmol)、甲酸钾(16.8mg,0.2mmol),并依次加入到50mL的Schlenk瓶中,加入甲基叔丁基醚(6.0mL),置于65℃油浴中反应28h。反应结束后,减压蒸馏除去溶剂,使用石油醚/乙酸乙酯(v/v 3:1)作为洗脱剂,硅胶柱层析分离,产物4-(5-chloro-1H-indol-1-yl)-1,3-dioxolan-2-one收率为86%。
实施例15:4-(5-bromo-1H-indol-1-yl)-1,3-dioxolan-2-one(3o)的合成
准确称取5-溴吲哚(0.39g,2.0mmol)、碳酸亚乙烯酯(0.22g,2.5mmol)、一水合乙酸铜(10.0mg,0.05mmol)、三乙胺(50.6mg,0.5mmol),并依次加入到50mL的Schlenk瓶中,加入1,4-二氧六环(4.0mL),置于105℃油浴中反应12h。反应结束后,减压蒸馏除去溶剂,使用石油醚/乙酸乙酯(v/v 2:1)作为洗脱剂,硅胶柱层析分离,产物4-(5-bromo-1H-indol-1-yl)-1,3-dioxolan-2-one收率为84%。
实施例16:4-(5-iodo-1H-indol-1-yl)-1,3-dioxolan-2-one(3p)的合成
准确称取5-碘吲哚(0.24g,1.0mmol)、碳酸亚乙烯酯(0.17g,2.0mmol)、溴化亚铜(7.2mg,0.05mmol)、碳酸钠(10.6mg,0.1mmol),并依次加入到50mL的Schlenk瓶中,加入正庚烷(2.0mL),置于75℃油浴中反应30h。反应结束后,减压蒸馏除去溶剂,使用石油醚/乙酸乙酯(v/v 4:1)作为洗脱剂,硅胶柱层析分离,产物4-(5-iodo-1H-indol-1-yl)-1,3-dioxolan-2-one收率为78%。
实施例17:methyl 1-(2-oxo-1,3-dioxolan-4-yl)-1H-indole-5-carboxylate(3q)的合成
准确称取吲哚-5-甲酸甲酯(0.88g,5.0mmol)、碳酸亚乙烯酯(0.69g,8.0mmol)、氟化铜(5.1mg,0.05mmol)、叔丁醇钾(56.1mg,0.5mmol),并依次加入到50mL的Schlenk瓶中,加入二甲基亚砜(15.0mL),置于60℃油浴中反应16h。反应结束后,减压蒸馏除去溶剂,使用石油醚/乙酸乙酯(v/v 1:1)作为洗脱剂,硅胶柱层析分离,产物methyl 1-(2-oxo-1,3-dioxolan-4-yl)-1H-indole-5-carboxylate收率为90%。
实施例18:4-(5-nitro-1H-indol-1-yl)-1,3-dioxolan-2-one(3r)的合成
准确称取5-硝基吲哚(0.32g,2.0mmol)、碳酸亚乙烯酯(0.52g,6.0mmol)、氯化亚铜(9.9mg,0.10mmol)、碳酸钠(42.4mg,0.4mmol),并依次加入到50mL的Schlenk瓶中,加入四氢呋喃(6.0mL),置于60℃油浴中反应20h。反应结束后,减压蒸馏除去溶剂,使用石油醚/乙酸乙酯(v/v 1:1)作为洗脱剂,硅胶柱层析分离,产物4-(5-nitro-1H-indol-1-yl)-1,3-dioxolan-2-one收率为87%。
实施例19:1-(2-oxo-1,3-dioxolan-4-yl)-1H-indole-5-carbonitrile(3s)的合成
准确称取5-氰基吲哚(0.85g,6.0mmol)、碳酸亚乙烯酯(1.03g,12.0mmol)、碘化亚铜(38.2mg,0.20mmol)、碳酸钾(110.6mg,0.8mmol),并依次加入到100mL的Schlenk瓶中,加入乙醇(20.0mL),置于45℃油浴中反应30h。反应结束后,减压蒸馏除去溶剂,使用石油醚/乙酸乙酯(v/v 1:2)作为洗脱剂,硅胶柱层析分离,产物1-(2-oxo-1,3-dioxolan-4-yl)-1H-indole-5-carbonitrile收率为84%。
实施例20:4-(6-methyl-1H-indol-1-yl)-1,3-dioxolan-2-one(3t)的合成
准确称取6-甲基吲哚(0.13g,1.0mmol)、碳酸亚乙烯酯(0.13g,1.5mmol)、氯化铜(13.4mg,0.10mmol)、碳酸钠(26.5mg,0.25mmol),并依次加入到50mL的Schlenk瓶中,加入苯(4.0mL),置于65℃油浴中反应36h。反应结束后,减压蒸馏除去溶剂,使用石油醚/乙酸乙酯(v/v 3:1)作为洗脱剂,硅胶柱层析分离,产物4-(6-methyl-1H-indol-1-yl)-1,3-dioxolan-2-one收率为72%。
实施例21:4-(6-methoxy-1H-indol-1-yl)-1,3-dioxolan-2-one(3u)的合成
准确称取6-甲氧基吲哚(0.93g,4.0mmol)、碳酸亚乙烯酯(0.52g,6.0mmol)、氯化亚铜(5.0mg,0.05mmol)、乙酸钠(16.4mg,0.2mmol),并依次加入到50mL的Schlenk瓶中,加入石油醚(10.0mL),置于50℃油浴中反应30h。反应结束后,减压蒸馏除去溶剂,使用石油醚/乙酸乙酯(v/v 3:1)作为洗脱剂,硅胶柱层析分离,产物4-(6-methoxy-1H-indol-1-yl)-1,3-dioxolan-2-one收率为80%。
实施例22:4-(6-(benzyloxy)-1H-indol-1-yl)-1,3-dioxolan-2-one(3v)的合成
准确称取6-苄氧基吲哚(2.23g,10.0mmol)、碳酸亚乙烯酯(1.30g,15.0mmol)、一水合乙酸铜(100.0mg,0.5mmol)、氢氧化钠(80.0mg,2.0mmol),并依次加入到250mL的Schlenk瓶中,加入甲基叔丁基醚(50.0mL),置于55℃油浴中反应32h。反应结束后,减压蒸馏除去溶剂,使用石油醚/乙酸乙酯(v/v 3:1)作为洗脱剂,硅胶柱层析分离,产物4-(6-(benzyloxy)-1H-indol-1-yl)-1,3-dioxolan-2-one收率为76%。
实施例23:methyl 1-(2-oxo-1,3-dioxolan-4-yl)-1H-indole-6-carboxylate(3w)的合成
准确称取吲哚-6-甲酸甲酯(0.35g,2.0mmol)、碳酸亚乙烯酯(0.43g,5.0mmol)、氯化铜(13.5mg,0.1mmol)、碳酸钾(13.8mg,0.10mmol),并依次加入到50mL的Schlenk瓶中,加入碳酸二甲酯(5.0mL),置于70℃油浴中反应18h。反应结束后,减压蒸馏除去溶剂,使用石油醚/乙酸乙酯(v/v 2:1)作为洗脱剂,硅胶柱层析分离,产物methyl 1-(2-oxo-1,3-dioxolan-4-yl)-1H-indole-6-carboxylate收率为85%。
实施例24:4-(6-chloro-1H-indol-1-yl)-1,3-dioxolan-2-one(3x)的合成
准确称取6-氯吲哚(1.21g,8.0mmol)、碳酸亚乙烯酯(0.86g,10.0mmol)、碘化亚铜(95.3mg,0.5mmol)、三乙胺(101.2mg,1.0mmol),并依次加入到250mL的Schlenk瓶中,加入三氟乙醇(25.0mL),置于65℃油浴中反应24h。反应结束后,减压蒸馏除去溶剂,使用石油醚/乙酸乙酯(v/v 3:1)作为洗脱剂,硅胶柱层析分离,产物4-(6-chloro-1H-indol-1-yl)-1,3-dioxolan-2-one收率为90%。
从实施例可以得出:当R基团是具有吸电子性质的取代基时,反应收率高于R基团是具有给电子性质取代基的情况。该方法为选择性好、反应条件温和、原子经济性高、催化效果好、收率高的N-(二氧杂戊环酮基)吲哚类化合物的合成方法。由于N-官能化吲哚类化合物是一种重要的有机合成中间体,在医药、农药、材料领域有着非常广泛的应用,因此,本发明具有较大的应用价值和社会经济效益。
- 一种乙酰化二苯并-1,3-二氧杂环辛类化合物的制备方法与作为抗菌药物的应用
- 一种氮-烷基(氘代烷基)芳杂环和烷基(氘代烷基)芳基醚类化合物的制备方法
- 一种制备卤代2,2-二(全氟取代基)-1,3-二氧杂戊环类化合物的方法
- 一种制备卤代2,2-二(全氟取代基)-1,3-二氧杂戊环类化合物的方法
