一种柯萨奇病毒B1型的核酸定量检测方法
文献发布时间:2023-06-19 19:28:50
技术领域
本发明涉及病毒检测领域,具体地,本发明涉及用于检测柯萨奇病毒B1型(CVB1)的引物及探针,以及使用所述引物及探针检测CVB1的方法。
此外,本发明还涉及用于CVB1核酸提取的稳定剂以及使用所述稳定剂提取CVB1核酸的方法。
背景技术
柯萨奇病毒B1型(Coxsackievirus B1,CVB1)是一类常见的人类病原体,隶属于小RNA病毒科(Picornaradae)肠道病毒属(Enterovirus),是一种无包膜的单股正义链RNA病毒,基因组长约7500nt。CVB1主要感染婴幼儿,临床症状表现为发热、感冒、轻度上呼吸道症状、腹泻以及胃肠道疾病等,也可引起无菌性脑膜炎、病毒性心肌炎、扩张性心肌病、肝炎和胰腺炎在内的严重病症,有时可致死亡。目前市场上尚无有效的预防性或治疗性药物可用。
目前最常用的病毒定量检测方法主要有以下三大类:(1)基于病毒感染力的检测技术,如病毒空斑形成试验、半数组织培养感染剂量TCID
目前关于肠道病毒核酸检测方法报道,主要为基于5’UTR非编码区保守区域设计的通用型检测方法,侧重于样品定性检出,而未对定量体系进行系统优化。商品化分型检测试剂盒及文献报道分型检测主要围绕EV71、CVA16和CVA6等手足口病相关病原体的检测,对于柯萨奇病毒B组1型(CVB1)的核酸定量检测方法报道较少。目前已报道的CVB1病毒核酸定量方法中,主要是对扩增体系和扩增程序的优化和方法性能的考察,而缺乏对于样本预处理、标准品的准确定量等方面的研究。不同的样品基质对病毒核酸的提取效率有较大的影响,另外,由于CVB1病毒的基因组为RNA,在核酸提取环节,病毒核酸容易被污染的RNA酶降解,进而影响病毒核酸的回收率和扩增模板质量,最终影响病毒核酸的准确定量。另外,核酸定量检测方法的检测准确性,还依赖于对标准品/质控品的准确定量赋值。目前常用的标准赋值方法有以下几种:(1)使用紫外分光光度计方法进行定量赋值。紫外分光光度计对于核酸的定量赋值可能受到杂质、DNA含量等影响,灵敏度和赋值准确度有限,无法进行绝对定量赋值;(2)使用病毒感染滴度检测方法作为质控品/标准品赋值方法。因病毒感染滴度代表在一定条件下有感染能力的病毒含量,可能受到滴度检测条件的影响,包括细胞类型、培养条件及毒株感染性强弱等,而病毒核酸拷贝数是一个物理含量,包括病毒颗粒内部的核酸以及游离的病毒核酸,因此感染滴度与病毒核酸二者不存在一个固定的对应关系。
综上,开发CVB1特异性定量检测方法对于CVB1相关疾病的早期诊断和及时介入、以及对于相关疫苗或治疗性药物的开发,具有重要意义。
发明内容
本申请发明人经过大量的研究,开发了一种用于检测CVB1的引物及探针组,并基于所述引物及探针组建立了CVB1的核酸定量检测方法,所述方法准确性和灵敏度高,特异性好,能够在柯萨奇病毒的诸多血清型中特异性定量检出CVB1。
此外,本申请发明人还优化了病毒核酸提取处理过程,可显著提高病毒核酸的回收率及稳定性、排除游离核酸对检测结果的干扰。
引物及探针组
因此,在一方面,本申请提供了用于检测CVB1的引物及探针组,其包含序列如SEQID NO.1所示的第一引物,序列如SEQ ID NO.2所示的第二引物,以及,序列如SEQ ID NO.3所示的探针。
在某些实施方案中,所述探针标记有报告基团(例如,荧光基团)和猝灭基团(例如,荧光猝灭基团)。
本领域技术人员易于理解,为便于利用所述探针检测靶标序列(例如,CVB1核酸序列)的存在或其含量,所述探针在与其所靶向的序列杂交的情况下发出的信号不同于在未与其所靶向的序列杂交的情况下发出的信号。在某些实施方案中,当探针未与其所靶向的序列杂交时,淬灭基团位于能够吸收或淬灭报告基团的信号的位置(例如,淬灭基团位于报告基团的邻近),从而吸收或淬灭报告基团发出的信号。在这种情况下,所述探针不发出信号。进一步,当所述探针与其所靶向的序列杂交时,淬灭基团位于不能吸收或淬灭报告基团的信号的位置(例如,淬灭基团位于远离报告基团的位置),从而无法吸收或淬灭报告基团发出的信号。在这种情况下,所述探针发出信号。
在某些实施方案中,所述探针的5’端连接有报告基团(例如,荧光基团),3’端连接有猝灭基团(例如,荧光猝灭基团)。
在某些实施方案中,所述探针的5’端连接有FAM荧光基团,和/或,所述探针的3’端连接有BHQ1荧光猝灭基团。
在另一方面,本申请提供了一种检测CVB1的方法,其包括使用如上所述的引物及探针组。
在某些实施方案中,所述方法包括以下步骤:
(1)提供如上所述的引物及探针组,以及,待测样品;
(2)将所述引物及探针组与待测样品接触,并进行RT-qPCR反应;和,
(3)结果判读。
易于理解,所述待测样品的来源不受限制,其可来源但不限于血液样品、尿液样品、呼吸道分泌物样品(例如,鼻腔分泌物)、粪便样品等。
在某些实施方案中,步骤(1)中所述待测样品经过预处理,所述预处理包括RNA提取和/或纯化的步骤。
在某些实施方案中,所述待测样品经病毒样品预处理获得,并且,所述预处理包括步骤:
(i)使病毒裂解;和,
(ii)纯化病毒裂解释放的RNA。
在某些实施方案中,步骤(i)中,所述方法在病毒稳定剂的存在下使病毒裂解,其中,所述病毒稳定剂为含有Tween-80的His缓冲液。
在某些实施方案中,所述Tween-80的浓度为
在某些实施方案中,所述His缓冲液进一步含有NaCl。
在某些实施方案中,所述NaCl的浓度为0.3~0.8M(例如,0.3~0.5M,0.5M)。
在某些实施方案中,所述His缓冲液的pH值为6.0-6.5(例如,6.2-6.5,6.25-6.5,6.0-6.4,6.0-6.25或6.25)。
在某些实施方案中,所述His缓冲液中His的浓度为10-50mM(例如,10-30mM,10-20mM,20-50mM,20-30mM,20mM)。
在某些实施方案中,步骤(i)之前,所述预处理还包括去除病毒样品中游离核酸的步骤。
在某些实施方案中,所述预处理通过酶解去除病毒样品中游离核酸。
在某些实施方案中,所述预处理通过使用核酸酶(例如,DNase和/或RNase)去除病毒样品中游离核酸。
在某些实施方案中,步骤(3)中,所述方法通过RT-qPCR反应的结果判断:所述待测样品中是否含有来源于CVB1的核酸,或者,所述待测样品所源自的样品中是否含有CVB1。
在某些实施方案中,步骤(3)中,所述方法还包括通过RT-qPCR反应的结果判断所述待测样品中来源于CVB1的核酸的含量;或者,所述待测样品所源自的样品中CVB1的含量。
在某些实施方案中,步骤(3)中,所述方法通过将待测样品的Ct值与系列已定量标准品的Ct值进行比对,从而确定所述待测样品中来源于CVB1的核酸的含量或所述待测样品所源自的样品中CVB1的含量。
在某些实施方案中,所述标准品为经纯化的CVB1的RNA或者经纯化的CVB1。
在某些实施方案中,所述标准品为经纯化的CVB1。本领域技术人员易于理解,在此类实施方案中,所述标准品经过包括RNA提取和/或纯化步骤的预处理以释放RNA,从而用于Ct值的检测;其中,当所述待测样品经病毒样品预处理获得,所述标准品的预处理与所述病毒样品的预处理相同。
在某些实施方案中,所述方法中,所述待测样品和所述标准品的Ct值在相同条件下检测获得。
在某些实施方案中,所述标准品通过ddPCR进行定量。
另一方面,本申请还提供了试剂盒,其包含如上所述的引物及探针组。
在某些实施方案中,所述试剂盒进一步包含以下的一项或多项:
(a)病毒稳定剂,其中,所述病毒稳定剂为含有Tween-80的His缓冲液;
(b)核酸酶(例如,DNase和/或RNase);
(c)RT-qPCR所需试剂。
在某些实施方案中,所述Tween-80的浓度为
在某些实施方案中,所述His缓冲液进一步含有NaCl。
在某些实施方案中,所述NaCl的浓度为0.3~0.8M(例如,0.3~0.5M,0.5M)。
在某些实施方案中,所述His缓冲液的pH值为6.0-6.5(例如,6.2-6.5,6.25-6.5,6.0-6.4,6.0-6.25或6.25)。
在某些实施方案中,所述His缓冲液中His的浓度为10-50mM(例如,10-30mM,10-20mM,20-50mM,20-30mM,20mM)。
另一方面,本申请还提供了如上所述的引物及探针组或试剂盒在制备用于检测CVB1的检测试剂中的用途。
病毒稳定剂
另一方面,本申请还提供了一种病毒稳定剂,其为含有Tween-80的His缓冲液。
在某些实施方案中,所述Tween-80的浓度为
在某些实施方案中,所述His缓冲液进一步含有NaCl。
在某些实施方案中,所述NaCl的浓度为0.3~0.8M(例如,0.3~0.5M,0.5M)。
在某些实施方案中,所述His缓冲液的pH值为6.0-6.5(例如,6.2-6.5,6.25-6.5,6.0-6.4,6.0-6.25或6.25)。
在某些实施方案中,所述His缓冲液中His的浓度为10-50mM(例如,10-30mM,10-20mM,20-50mM,20-30mM,20mM)。
另一方面,本申请还提供了一种CVB1病毒核酸提取方法,其包括使用如上所述的病毒稳定剂。
在某些实施方案中,所述方法包括步骤:
(i)在所述病毒稳定剂的存在下使病毒裂解;和,
(ii)纯化病毒裂解释放的RNA。
另一方面,本申请还提供了如上所述的病毒稳定剂在制备用于提取CVB1核酸的试剂中的用途。
在本发明中,除非另有说明,否则本文中使用的科学和技术名词具有本领域技术人员所通常理解的含义。并且,本文中所用的病毒学、生物化学、免疫学实验室操作步骤均为相应领域内广泛使用的常规步骤。同时,为了更好地理解本发明,下面提供相关术语的定义和解释。
当本文使用术语“例如”、“如”、“诸如”、“包括”、“包含”或其变体时,这些术语将不被认为是限制性术语,而将被解释为表示“但不限于”或“不限于”。
除非本文另外指明或根据上下文明显矛盾,否则术语“一个”和“一种”以及“该”和类似指称物在描述本发明的上下文中(尤其在以下权利要求的上下文中)应被解释成覆盖单数和复数。
发明的有益效果
本申请提供的引物及探针组可有效用于CVB1检测,基于所述引物及探针组的检测CVB1的方法的准确性和灵敏度高,特异性好,能够在柯萨奇病毒的诸多血清型中特异性定量检出CVB1。此外,所述方法还能进一步对样品中的CVB1进行定量,其定量范围广(例如,9.87×10
此外,本申请发明人还优化了病毒核酸提取处理过程,可显著提高病毒核酸的回收率及稳定性、排除游离核酸对检测结果的干扰。
下面将结合附图和实施例对本发明的实施方案进行详细描述,但是本领域技术人员将理解,下列附图和实施例仅用于说明本发明,而不是对本发明的范围的限定。根据附图和优选实施方案的下列详细描述,本发明的各种目的和有利方面对于本领域技术人员来说将变得显然。
附图说明
图1:实施例4中标准品定量拟合曲线。
图2:实施例6中核酸酶预处理对病毒定量效果的影响。
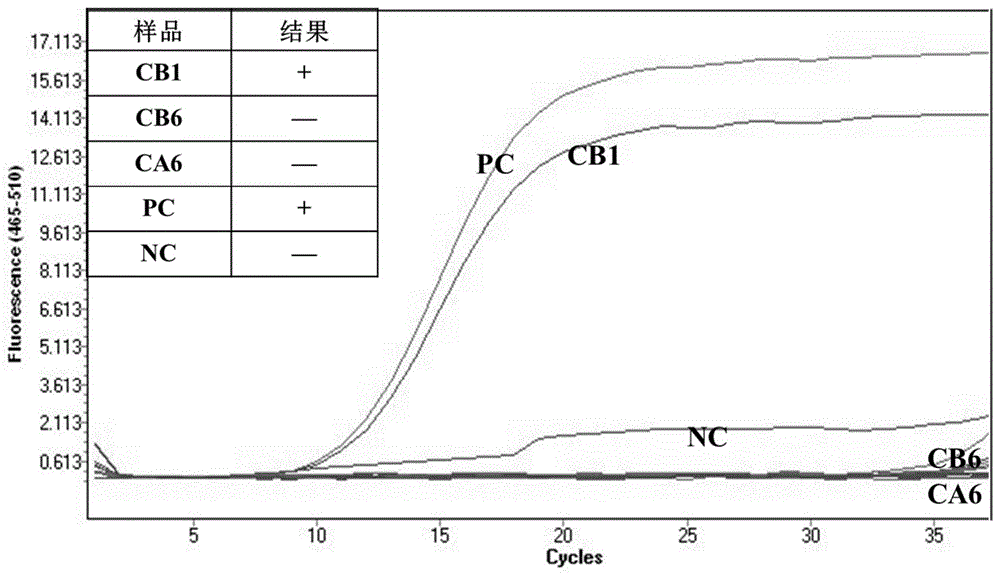
图3:实施例7中方法特异性考察,其中,“PC”表示阳性对照,“NC”表示阴性对照。
具体实施方式
现参照下列意在举例说明本发明(而非限定本发明)的实施例来描述本发明。
实施例1:引物及探针的设计和合成
通过比对GenBank数据库中的CVB1毒株序列,选择VP1编码区相对保守且CVB1毒株特异性的区域,设计引物与探针,正向引物的核苷酸序列SEQ.ID NO.1,反向引物的核苷酸序列SEQ.ID NO.2,探针的核苷酸序列SEQ.ID NO.3(具体序列见表1),探针5’端标记报告荧光染料FAM,3’端标记淬灭荧光染料TAMRA,引物与探针均委托上海百力格公司合成。
表1引物及探针序列
实施例2:核酸提取与RT-qPCR扩增方法
1)核酸提取:使用病毒稳定剂(20mM His缓冲液,pH=6.25,含
2)RT-qPCR扩增
使用Hycells Fast-RT一步法反应体系(和心医疗,货号:HX106-100),按照说明书进行一步法RT-qPCR反应。按照表2所示配制荧光定量RT-qPCR反应体系(25μL/孔)。使用罗氏LightCycler 480II实时荧光定量PCR仪进行核酸扩增与定量检测,扩增程序参数为:50~55℃逆转录15min,95℃反应15min;94℃变性15s,50~55℃退火/延伸45s,40~45个循环(每循环结束采集FAM荧光信号)。
表2RT-qPCR反应体系配制
3)数据的处理
使用LightCycler 480II设备自带软件进行数据处理。对样品类型进行命名(Unknow、Standard、Negative control等),对标准品进行赋值。选择分析方法为AbsQuant/2nd Derivative Max分析及High Confidence,选择Filter Comb为485-533(FAM通道)。仪器自动计算,获得绘制的扩增曲线、标准品拟合曲线、样品定量结果等。
实施例3:标准品的制备与定量赋值
标准品的制备:使用HEK293 CD培养基(QuaCell)培养HEK293悬浮细胞(QuaCell),按照MOI=0.01接种CVB1病毒,接毒后48h收获病毒培养物。反复冻融3次病毒培养物以破碎细胞释放病毒。使用Benzonase核酸酶(Merck)消化宿主核酸,澄清过滤后使用100KD的膜包(PALL)进行超滤浓缩,再通过Capto Core 400和Capto Q ImpRes两步层析进行精纯,最终置换至20mM His缓冲液(含0.5M NaCl,pH=6.25)中。对纯化的CVB1样品进行分装(0.5mL/支),分装的标准品置于-80℃冷冻储存。
标准品的定量赋值:以实施例2所述方法提取CVB1标准品的核酸,使用实施例1的引物及探针,委托达微生物公司利用ddPCR(微滴式数字PCR)方法对标准品进行核酸定量。定量结果为9.87×10
实施例4:本申请方法的线性
选择9.87×10
表3定量标准曲线与线性分析
实施例5:病毒稳定剂的筛选
分别使用不同的病毒稀释液对标准品进行梯度稀释,以实施例2所述方法进行核酸提取和扩增检测。使用不同的病毒稀释液稀释标准品,考察其对扩增效率的影响,如表4所示,结果表明当使用含有Tween80和NaCl的His缓冲液(以下统称为病毒稳定剂)作为稀释液时,可降低病毒在预处理与核酸提取中的吸附损失,有效提高病毒核酸的回收率,从而提高扩增效率。
表4不同病毒稀释液对扩增效率影响
注:组3-6中,NaCl的浓度为0.5M;His缓冲液的浓度为20mM,pH为6.25;Tween 80的浓度以v/v进行计算。
为考察病毒稳定剂在不同类型样本中的适用性,分别选择了食蟹猴的血液、鼻腔分泌物和尿液标本进行考察。
1)优化组:使用病毒稳定剂(20mM His缓冲液,pH=6.25,含
2)对照组:使用1×PBS稀释病毒标准品至4.94×10
以实施例2所述方法进行核酸提取、RT-qPCR扩增。结果如表5所示,添加病毒稳定剂后,不同类型样本的提取回收率均显著提高。
表5不同类型空白样本的提取回收率
实施例6:核酸酶预处理对病毒定量效果的影响
含有基因组核酸的完整病毒颗粒是CVB1相关疫苗或治疗性药物的关键有效成分,因此对样品中完整病毒颗粒中基因组核酸的准确定量是非常重要的。而在各类型的CVB1病毒样品中,可能存在游离的病毒核酸,或一些工艺处理会使病毒核酸从病毒衣壳内释放出来,游离的病毒核酸可能会对完整病毒颗粒的核酸定量造成干扰。向样品中添加核酸酶,可以酶切去除游离的病毒核酸,而完整病毒颗粒中的病毒核酸由于受到病毒衣壳的保护,无法被酶切去除。
为了验证游离核酸的潜在干扰,本实施例使用Benzonase核酸酶(Merck)对不同类型的CVB1样品进行预处理。
1)消化组:在待检细胞培养物、冻干及冷冻制剂样品中,加入Benzonase核酸酶(终浓度100IU/mL)和MgCl
2)不消化组:在待检细胞培养物、冻干及冷冻制剂样品中,仅加入MgCl
参照实施例2、4的方法进行核酸提取及定量检测。结果如图2所示,使用核酸酶对CVB1样品进行预处理后,检测值有一定比例地下降,提示样品中有一定比例的游离核酸。特别是对于经冻干处理的CVB1病毒样品,加入核酸酶后,核酸定量结果出现大幅度下降,提示冻干过程会破坏病毒颗粒的完整性导致病毒核酸释放出来,并被核酸酶消化去除。因此,核酸酶预处理能够有效去除样品中游离病毒核酸的干扰,使检测结果更加准确地反映完整病毒颗粒中基因组核酸的含量。
实施例7:本申请方法的特异性
选取CVA6、CVB6及CVB1病毒培养物样品,以实施例2所述方法进行核酸提取及核酸扩增。结果如图3所示,显示CVA6、CVB6病毒样品无典型S性扩增曲线,CVB1病毒样品的扩增曲线为典型的S型扩增曲线。结果表明,本申请所提供的引物、探针能够特异性检测CVB1病毒。
实施例8:本申请方法的检测限
使用病毒稳定剂(20mM His缓冲液,pH=6.25,含
实施例9:本申请方法的重复性考察
对7个稀释梯度的病毒标准品进行定量检测,共重复检测6次,以实施例2和实施例4中的方法进行核酸提取及定量检测。结果如表6所示,标准品Ct的CV<5%,定量值CV<10%,表明本申请方法的重复性良好。
表6本申请方法的重复性考察
尽管本发明的具体实施方式已经得到详细的描述,但本领域技术人员将理解:根据已经公布的所有教导,可以对细节进行各种修改和变动,并且这些改变均在本发明的保护范围之内。本发明的全部分为由所附权利要求及其任何等同物给出。
- 一种柯萨奇病毒A6型核酸的检测试剂盒及检测方法
- 一种16型、18型HPV病毒核酸荧光定量PCR检测方法及其试剂盒
